A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פלטפורמת ביטוי נוח כללי לייצור חלבונים המופרשים מ תאים אנושיים
* These authors contributed equally
In This Article
Summary
בעידן שאחרי האדם הגנומיקה, הזמינות של חלבונים רקומביננטיים של תצורות המקומיים הוא חיוני למחקר מבנית, תפקודית טיפולית ופיתוח. כאן אנו מתארים מבחן רחב היקף של ביטוי חלבונים מערכת עובריים אנושיים לתאי כליה 293T, שניתן להשתמש בהם כדי לייצר מגוון של חלבונים רקומביננטיים.
Abstract
רקומביננטי ביטוי החלבון חיידקים, בדרך כלל א ' coli, הייתה האסטרטגיה המוצלחת ביותר עבור ביטוי בכמות מיליגרם של חלבונים. עם זאת, המארחים פרוקריוטים הם לעתים קרובות לא בהתאם ביטוי של חלבונים אנושיים, ויראלי או האיקריוטים בשל הרעילות של מקרומולקולה החוץ, ההבדלים מכונות קיפול חלבונים, או בשל חוסר שיתוף שינויים או שלאחר translational מסוימים של חיידקים. מערכות ההבעה על בסיס שמרים (pastoris פ או cerevisiae ס) 1,2, baculovirus-נגוע חרק (ס 'frugiperda או ט' ני) 3 תאים, תא ללא במבחנה תרגום מערכות 2,4 שימשו בהצלחה לייצר חלבונים יונקים. באופן אינטואיטיבי, את ההתאמה הטובה ביותר היא להשתמש המארח יונקים על מנת להבטיח את הייצור של חלבונים רקומביננטיים המכילים הנכון לאחר שינויים של תרגום. מספר שורות תאים יונקים (קיד עובריים אנושייםניי (HEK) 293, C-V-1 התאים O rigin הנושאים V40 S larget T-antigen (COS), השחלות אוגר סיני (CHO), ועוד) כבר נוצלו בהצלחה overexpress כמויות מיליגרם של מספר חלבונים אנושיים 5-9. עם זאת, היתרונות של שימוש בתאי יונקים הם לעתים קרובות הגיב עלויות גבוהות יותר, הדרישה של ציוד מעבדה מיוחד, תשואות נמוכות יותר חלבון, ושעות ארוכות לפתח יציבות התא קמטי הבעה. הגדלת התשואה חלבונים לייצר מהר יותר, תוך שמירה על עלויות נמוכות, הם הגורמים העיקריים למעבדות אקדמיים ומסחריים רבים.
כאן אנו מתארים זמן ועלות יעיל, חלק 2, הליך לביטוי של חלבונים המופרשים אדם חסיד תאים HEK 293T. מערכת זו הוא מסוגל לייצר מיקרוגרם כמויות מיליגרם של חלבון פונקציונלי ללימודי מבניים, biophysical ו ביוכימי. החלק הראשון, בונה רבות של הגן של עניין הם מייצרים ד במקביל transfected זמני אל חסיד תאים HEK 293T בקנה מידה קטן. זיהוי וניתוח של חלבון רקומביננטי מופרש לתוך המדיום תרבית תאים מבוצע על ידי ניתוח כתם המערבי באמצעות נוגדנים זמינים מסחרית המכוונים נגד תג וקטור המקודד טיהור חלבונים. לאחר מכן, בונה מתאים לייצור בקנה מידה גדול חלבון transfected זמני באמצעות polyethyleneimine (PEI) ב -10 מפעלים שכבת תאים. חלבונים המופרשים לתוך ליטר למוצרי כרכים של המדיום אוויר מרוכזים לתוך כמויות לניהול באמצעות סינון זרימת משיק, ואחריו טיהור ידי כרומטוגרפיה נגד HA זיקה. השירות של פלטפורמה זו היא הוכחה על ידי היכולת שלו לבטא את כמויות מיליגרם של ציטוקינים, קולטנים ציטוקינים, קולטנים בתא השטח, גורמים פנימיים, וכן הגבלה גליקופרוטאינים ויראליים. בשיטה זו השתמשו בהצלחה גם בקביעת המבנה של 5,10 גליקופרוטאין trimeric ebolavirus.
ילדה = "jove_content"> לסיכום, פלטפורמה זו מציעה מהירות וקלות שימוש, ויכולת הרחבה תוך מיקסום איכות החלבון ופונקציונליות. יתר על כן, הציוד ללא תוספת, למעט תקן humidified CO 2 באינקובטור, נדרשת. הליך זה עשוי להתרחב במהירות למערכות מורכבות יותר, כמו ביטוי משותף של קומפלקסים חלבונים, אנטיגנים ונוגדנים, ייצור של וירוסים כמו חלקיקים עבור חיסונים, או לייצור של adenoviruses או lentiviruses עבור התמרה של שורות תאים קשים.
Protocol
1. עבודת ההכנה - בונה בתרביות תאים
לפני תחילת הטקס, את הגן של עניין צריך להיות קודון, מותאם במיוחד לידי ביטוי בתאי יונקים, והוא משובטים לתוך וקטור ביטוי הולם באמצעות טכניקות סטנדרטיות ביולוגיה מולקולרית. על מנת להבטיח את הסיכוי הגבוה ביותר לביטוי מוצלח, גרסאות שונות של הגן של עניין צריך להיות שנוצר. רבים וקטורים ביטוי יונקים הם זמינים מסחרית ויש להם תגים טיהור שונים (polyhistidine, hemagglutinin, streptavidin, HALO-Tag, גלוטתיון S-transferase, בין היתר). אנחנו מעדיפים להשתמש וקטור pDISPLAY, אשר מקודד עבור היזם ציטומגלווירוס חזקה האדם, האות κ איג הפרשה, hemagglutinin תג טיהור, ויש לו עוגן בטרמינל C-הטרנסממברני למקד את החלבון דרך מסלול הפרשה לתצוגה על קרום הפלזמה. אנחנו בדרך כלל להוסיף קודון עצירה מול וקטור המקודד הטרנסממברני אנצ'וR כדי לאפשר את החלבון כדי להיות מופרשים לתוך המדיום מותנה.
אדם עובריים (HEK) כליות תאים 293T זמינים באופן נרחב, ותרבותי בקלות transfected. 293T HEK משמשים באופן שגרתי לביטוי של חלבונים יונקים, אך נחשבים ביולוגית מסוכנת וצריך להיות מטופל ברמת בטיחות ביולוגית 2. יש ללבוש ביגוד נאות מגן אישי; עבודה יש לבצע בארון בטיחות ביולוגית שאושרה באמצעות טכניקה מזוהם. בזבוז כל ומשטחים יש לחטא לפי ההנחיות מוסדיים וממשלתיים. מומלץ להיבדק על תאים זיהום Mycoplasma לפני השימוש. התאים עשויים להיות מטופלים עם ציפרופלוקסאצין (10 מיקרוגרם / מ"ל) למשך עשרה ימים כדי למגר כל מקור של Mycoplasma spp. זיהום. פרוטוקולים כללי כדי להפיץ HEK תאים 293T מוצגות בנפרד (תיבה 1).
שיקולים נוספים עבור מבחן וביטוי בקנה מידה גדול חלבונים הם revieweד ב 11-15.
2. בקנה מידה קטן מבחן הביטוי
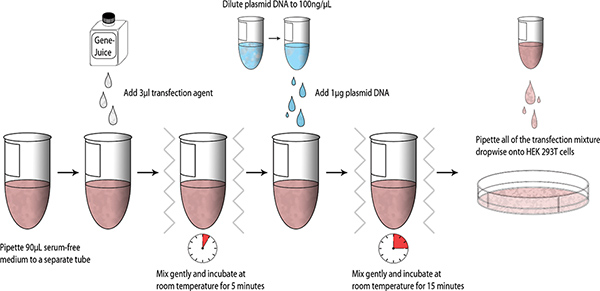
לאחר מבנים עוצבו שנוצר, בקנה מידה קטן transfections הבדיקה ניתן לבצע באמצעות HEK 293T תאים; סכמטי המסכם את תהליך מוצגת להלן (איור 1).
- השתמש T75 2 ס"מ או 2 ס"מ T225 סלולריים תרבות צלוחיות (תלוי במספר ביטויים הבדיקה להתבצע) לגדל את התאים HEK 293T ולפצל את התאים כל 2-3 ימים, כאשר התאים הם confluent 100% (תיבה 1).
- זרע 2.5 x 10 5 HEK 293T תאים לכל גם בצלחת 6-היטב ומוסיפים 2 מ"ל DMEM 1X עם עט / דלקת ו 10% (V / V) FBS, לערבל את הצלחת בעדינות על מנת להבטיח פיזור אפילו תא אחד טוב, דגירה בין לילה ב 37 מעלות צלזיוס תא 5% CO 2 humidified.
- כאשר תאים HEK 293T להגיע 40% confluency, למחוק את התקשורת ולהוסיף טרי 2 מ"ל DMEM בעט 1X / דלקת ו 10% (V / V) FBS כדי וולס. לבצעtransfection מבחני.
- Aliquot 90 μl סרום ללא DMEM לתוך צינור microcentrifuge סטרילי 1.5 מ"ל. פיפטה 3 GeneJuice μl לתוך סרום ללא DMEM בעדינות מערבבים את הצינור (מערבולת אצבע). דגירה במשך 5 דקות בטמפרטורת החדר.
- הוסף 1 מיקרוגרם של MiniPrep מטוהרים DNA פלסמיד (DNA המניות = 100 ng / μl) לתערובת DMEM-GeneJuice, מערבולת אצבע, דגירה במשך 15 דקות בטמפרטורת החדר.
- פיפטה את התערובת transfection dropwise על HEK 293T תאים, ו מערבולת צלחת 6-היטב בעדינות, כדי לאפשר גם חלוקת תערובת transfection. דגירה צלחת 6 גם ב 37 מעלות צלזיוס קאמרית 5% CO 2 humidified.
- הוסף 1 מ"ל DMEM טרי עם 1X עט / דלקת ו 10% (V / V) FBS זה לזה במשך 24 שעות גם לאחר transfection ו דגירה למשך 48 שעות (סה"כ 72 שעות).
- קציר 1 מ"ל של supernatant מבאר כל שלושה ימים לאחר transfection ו microcentrifuge דגימות ב g 16,000 ל -10 דקות בטמפרטורת החדר. ביצוע ווסהסטאז'ר ניתוח כתם כמפורט תיבה 2. דוגמאות ניתן לאחסן 4 ° C. משך האחסון על 4 מעלות צלזיוס הוא החלבון תלויה.
3. בקנה מידה גדול מבחן ביטוי וטיהור
ברגע מבנה זוהה ביטוי בכמות מיליגרם של חלבון רקומביננטי מושגת על ידי transfection PEI של חסיד תאים HEK 293T באמצעות 10-שכבת מפעלים סלולריים (איור 2: 6360 2 ס"מ שטח הפנים). ללימודי יותר גישוש, מפעלים קטנים יותר תאים או T-צלוחיות (טבלה 1) ניתן להשתמש בו.
- לטהר 1 מ"ג של ה-DNA של transfection באמצעות ערכת טיהור פלסמיד MaxiPrep. תרבות הלילה 500 מ"ל של XL-1 כחול התאים צריכים לייצר לפחות 1 מ"ג של ה-DNA טהור. בדיקת טוהר ה-DNA על ידי מדידת 260/280 יחס: צריך להיות מעל 1.8.
- בהיקף של עד HEK 293T תאים 2.0 x 10 8 תאים. כל בקבוק T225 2 ס"מ גדל שיתוף confluency 100%ntains ו הממוצע של ~ 2.25 x 10 -7 תאים.
- הוסף 1.2 ליטר DMEM עם 5% (V / V) FBS למפעל שכבה של 10 תאים. הוסף 2.0 x 10 8 HEK 293T התאים למפעל תא ולהפיץ התאים באופן שווה לכל שכבות של כלי השיט. קשה מאוד לדמיין את confluency של תאים במפעל התא. כחלופה, להגדיר T75 2 בקבוק ס"מ עם מספר מתאים של תאים, תוך שימוש במספר התא באותו יחס שטח פנים כמו ביצע עם כלי 10-השכבה. צג זה הבקבוק על שיעורי צמיחה. ראה וידאו הקשורים להוראה על טיפול מפעל התא. דגירה בין לילה ב 37 מעלות צלזיוס עם CO 5% 2, כדי לאפשר מצורף התא וצמיחה.
- ביצוע בקנה מידה גדול transfection כאשר חסיד HEK תאים 293T הם 70% confluent. מכינים את תערובת PEI-DNA transfection (03:01 w / w PEI יחס ה-DNA) בארון בטיחות ביולוגית באמצעות בקבוק סטרילי T75 2 ס"מ. מערבבים 0.84 מ"ג של ה-DNA עם 84 מ"ל של סטרילית 1X PBS, ולאחר מכן להוסיף 2.5 מ"ל של PEI (2.5 מ"ג סך PEI). דגירה בטמפרטורת החדר למשך 15 דקות. הפתרון צריך להיות מעונן.
- יוצקים את התערובת PEI-DNA transfection לאט לתוך המפעל התא ביסודיות להפיץ מעל כל השכבות של כלי השיט. אופציונלי: על התשואות ביטוי מוגבר, להוסיף חומצה ולפרואית (4 בריכוז mM הסופי). דגירה על 37 מעלות צלזיוס עם CO 5% 2 במשך ארבעה ימים.
- Supernatant קציר ארבעה ימים לאחר transfection. בצנטריפוגה התקשורת מיזוג ב 6000 x g למשך 30 דקות 4 ° C. יתר על כן לסנן supernatant באמצעות 0.22 מיקרומטר Stericup ואקום מנגנון הסינון. המפעל 10-שכבת תאים ניתן לעשות שימוש חוזר, ראו תיבה 3 לניקוי ההוראות. זה המפתח ניקוי הוא יזם מיד לאחר הקציר supernatant, לא נותנים התאים על גבי משטח יבש כלי.
- לרכז את supernatant ל 75 מ"ל באמצעות סינון Centramate משיק מערכת הזרימה.
- הוסף 500 מ"ל של PBS מחדש כדי להתרכז מ"ל 75. חזור על 3 additפעמים לאומיים לחלוטין שסופגת להחליף את המדגם.
- לאזן 1 מ"ל אנטי HA בעמודה זיקה 1X PBS וליישם מדגם מרוכזת על ידי זרימת כוח המשיכה בקצב <1 מ"ל / דקה.
- לשטוף את הטור עם 30 מ"ל של 1X-PBS Tween20.
- ממיסים HA פפטיד ב 1X PBS (1.0 מ"ג / מ"ל) ו - דגירה על 37 ° C.
- החל 1 מ"ל של הפפטיד HA לעמודה נגד HA ולאפשר פפטיד לזרום לתוך שרף. איסוף לזרום דרך. לעצור את הזרימה כאשר הפתרון הפפטיד מגיע לגובה המיטה.
- דגירה עמודה שלמה נגד HA על 37 מעלות צלזיוס במשך 15 דקות.
- חזור על שלב 12 פעמיים נוספות.
- החל 1 מ"ל של 1X PBS לעמודה נגד HA וזרימה לתוך שרף עד שהוא מגיע לגובה המיטה. איסוף לזרום דרך.
- לחדש את הטור אנטי HA עם 10 מ"ל pH 0.1 גליצין 2.2 מ '. לשטוף עם 10 מ"ל PBS ועמודה חנות זיקה על 4 מעלות צלזיוס PBS עם 0.02% (w / v) NaN 3.
- בצע SDS-PAGE ניתוח בריכה Fractions בהתאם. הערה: פפטיד HA יפריע מדידות ריכוז חלבון של 280 או ברדפורד. כדי להעריך את כמות החלבון הנוכחי, עומס 5, 10, 15, 25 מיקרוגרם של ה-BSA על ג'ל SDS-PAGE כסטנדרט ולהשוות את עוצמות הלהקה.
שלבים 9-17 ניתן לחזור ללכוד חלבון נוסף ממדיום מותנה.
4. נציג תוצאות
במאמר זה נתאר ולהפגין פלטפורמת ביטוי נוח לייצור מיליגרם, כמות חלבונים אנושיים שיכולים לאחר מכן לשמש מחקרים מבניים ותפקודיים. הקרנה של החלבון האנושי בונה באמצעות תאים HEK 293T ב 6 צלחות גם הוא יעיל ואפקטיבי בזיהוי מבנים מקובל ייצור בקנה מידה גדול יותר. דרכי ביטוי מסחרי ניתן transfected ביעילות בתאים HEK 293T באמצעות מגוון של חומרים כימיים, כגון transfection GeneJuice, FuGene HD או PE א אנו ממליצים להשתמש מגיב transfection מסחרי, כגון GeneJuice או FuGene HD, עבור ביטויים הבדיקה, כמו חומרים כימיים אלה יעילים יותר חלבונים המבטאים עניות (איור 3). המבנים שנבחרו ביטוי בקנה מידה גדול יותר צריך להיות מאופיין על ידי הלהקה, אחת בעוצמה חזקה, המתאים למשקל המולקולרי הנכון על כתם המערבי (איור 3). גליקופרוטאינים עשויים לנדוד כלהקה רחבה יותר בשל ההטרוגניות של glycosylation. הראינו כי מגוון של מקרומולקולות, החל גליקופרוטאינים ויראליים, ציטוקינים, קולטנים ציטוקינים וחלבונים פני אחרים, יכול לבוא לידי ביטוי מטוהרים להניב כמויות millgram של חלבון באמצעות פלטפורמה זו ביטוי כללי (איור 4).
באיור 1. סכמטי של זרימת עבודה בקנה מידה קטן transfections.tp_upload/4041/4041fig1large.jpg "target =" _blank "> לחץ כאן כדי להציג דמות גדולה.

איור 2. קורנינג 10-שכבת CellSTACK לביטוי חלבונים בקנה מידה גדול יותר. כל שכבה מכילה 636 2 ס"מ שטח הפנים של התא המצורף. תקן מעבדה CO 2 באינקובטור (6.0 מ"ק. מטר) יהיה נוח להחזיק ארבעה 10-שכבת מפעלים סלולריים.
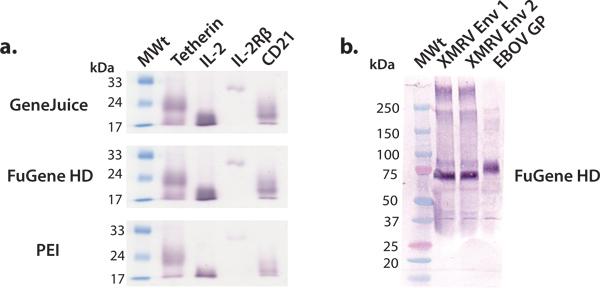
.. איור 3 בקנה מידה קטן ביטוי של חלבונים המופרשים שונים ביצענו סדרה של בקנה מידה קטן ביטויים הבדיקה באמצעות ריאגנטים transfection נפוצות:. GeneJuice, FuGene HD ו PEI (א) ההקרנה כתם המערבי של נבחרות חלבונים תאיים אדם (tetherin), רצפטורים (IL-2R למקטע β) ו ציטוקינים (IL-2). Tetherin היא גליקופרוטאין קרום האנושית המגבילה את שחרורם שלהמתהווה HIV-1 virions 16. תחום תאי של tetherin קיים כמו דימר glycosylated דיסולפיד צמוד, של ~ 36 kDa. תחת צמצום התנאים, כפי שמוצג כאן, tetherin נודד כמו מונומר עם משקל מולקולרי לכאורה של ~ 22 kDa. אינטרלויקין -2 (IL-2) הוא ציטוקין (~~~HEAD=NNS 17 KDA) מעורבים התפשטות לימפוציטים 17. הוא מקיים אינטראקציה עם מורכבות IL-2 receptor, מתוכם IL-2R βsubunit (~~~HEAD=NNS 26 KDA) הוא רכיב 18. CD21 הוא חלבון קרום מעורב ההפעלה והתבגרות B-תאים של המערכת השלמה, והוא גם קולטן לנגיף Epstein-Barr. תחום תאי glycosylated של CD21 נודד כמו מונומר עם משקל מולקולרי לכאורה של ~ 20 kDa. (ב) ההקרנה המערבי כתם של גליקופרוטאינים על פני השטח שנבחרו נגיפיים (XMRV Env ו ebolavirus GP). XMRV ו גליקופרוטאינים ebolavirus (עוגן הטרנסממברני נמחק) קיים קרום ויראלי כמו קוצים trimeric ומעורבים מצורף התא המאכסןואיחוי. Ectodomain של XMRV Env ו EBOV GP מעוטרים בכבדות עם N צמודות glycans ולהעביר את משקל מולקולרי לכאורה של 70 ו -75 kDa KDA, בהתאמה.

באיור 4. מטוהרים חלבונים תאיים אדם מן בקנה מידה גדול תרבויות HEK 293T. כל החלבונים באו לידי ביטוי באמצעות מפעל 10-שכבת תאים, והתרכז מטוהרים על ידי כרומטוגרפיה נגד HA. כפי שמוצג על ידי ניתוח SDS-PAGE Coomassie מוכתם, התחומים תאיים של הקולטן interleukin-2 (IL-2R) α ו - γ יחידות משנה להעביר את משקל מולקולרי של 40 ו -46 kDa KDA, בהתאמה. תחום תאי של tetherin נודד כמו דימר, תחת אי - הפחתת תנאים, עם משקל מולקולרי לכאורה של 36 kDa. שים לב כי יש זיהום BSA המופיע במשקל מולקולרי לכאורה של 60 kDa. בנוסף, ההטרוגניות של N צמודות glycans להציג על tetherin,IL-2R α ו - IL-2R γ הלהקה גורם להרחבת על ג'ל SDS-PAGE. מורכבות מסוג אלה N צמודות glycans ניתן להסיר באמצעות פפטיד: N-glycosidase פ
| כלי שיט | פני השטח |
| 6 גם צלחת | 9.5 ס"מ 2 (כל טוב) |
| 100 מנות מ"מ | 55 ס"מ 2 |
| 245 מנות מ"מ | 500 ס"מ 2 |
| T75 2 ס"מ הבקבוק | 75 ס"מ 2 |
| T175 2 ס"מ הבקבוק | 175 ס"מ 2 |
| T225 2 ס"מ הבקבוק | 225 ס"מ 2 |
| רולר מבקבוק רגיל | 850 ס"מ 2 |
| בקבוק מורחבת רולר השטח | 1700 ס"מ 2 |
| 1-שכבת CellSTACK | 636 ס"מ 2 |
| 2 שכבת CellSTACK | 1272 ס"מ 2 |
| 5-שכבת CellSTACK | 3180 ס"מ 2 |
| 10-שכבת CellSTACK | 6360 ס"מ 2 |
| 40-שכבת CellSTACK | 25440 2 ס"מ |
טבלה 1. השוואה של תרבות כלי תאים המשמשים ביטוי החלבון.
רשימת מתכונים מגיב
100x Ciprofloxacine לפתרון 10 מ"ל, מוסיפים 10 מ"ל מים deionized כדי ciprofloxacine 10 מ"ג. הוסף 10 μl HCl 6N לחלוטין לפרק את ciprofloxacine.
PEI (1 מ"ג / מ"ל) לפתרון 100 מ"ל, לפזר 100 מ"ג של 25 kDa ליניארי פיי מים בחום deionized ו עד 80 ° C. פתרון מצננים לטמפרטורת החדר, כדי להתאים את ה-pH 7.2 aliquot, 0.22 מיקרומטר מסנן מחטאים ההקפאה ב -20 מעלות צלזיוס במשך לוןg לטווח האחסון.
1X PBS לפתרון 1 L מימית: 8.0 גר 'NaCl, 0.2 גרם KCl, 1.4 גרם Na 2 HPO 4 (נטול מים), 0.24 גרם KH 2 PO 4. התאם את ה-pH של פתרון 7.4 ו 1.0 ל 'מילוי
1X PBS-Tween-20 עבור פתרון 1 L מימית: 8.0 גר 'NaCl, 0.2 גרם KCl, 1.4 גרם Na 2 HPO 4 (נטול מים), 0.24 גרם KH 2 PO 4, 1 מ"ל Tween-20. התאם את ה-pH של פתרון 7.4 ו 1.0 ל 'מילוי
1X העברת מאגר לפתרון 1 L מימית: 3.0 גר 'טריס הבסיס, 14.4 גרם גליצין, 150 מ"ל מתנול.
1X SDS-PAGE מפעיל מאגר לפתרון 1 L מימית: 3.0 גר 'טריס הבסיס, 14.4 גרם גליצין, 1.0 גרם SDS.
SDS-PAGE צמצום מאגר מדגם לפתרון 10 מ"ל: 0.6 גרם SDS, 3 גליצרול מ"ל, 1.8 מ"ל 1.0 טריס-HCl pH 6.8, 1 מ"ג bromophenol כחולים, 5% (V / V) 2 mercaptoethanol.
תיבה 1. פרוטוקולים כלליות התפשטות תאים- לגדל תאים HEK 293T ב בינוני שינוי Dulbecco של הנשרים (DMEM) השלימו עם 10% (V / V) בסרום שור עוברית (FBS), עט 1X / דלקת על 37 מעלות צלזיוס ב CO 5% 2-humidified האווירה.
- שימו לב תאים תחת מיקרוסקופ הפוכה. כאשר תאים נמצאים confluency 100%, להסיר ולסלק בינוני התרבות.
- יש לשטוף את התאים עם 5 מ"ל של סטרילית 1X PBS להסיר עקבות של סרום. להשליך את הכביסה PBS.
- הוסף 2 מ"ל של 0.05% (w / v) טריפסין-EDTA פתרון בקבוק T225 ס"מ 2 (או 1 מ"ל של 0.05% (w / v) טריפסין-EDTA עבור בקבוק T75 ס"מ 2) ו דגירה בטמפרטורת החדר עד תאים לנתק מפני השטח. כמו כן ניתן להשתמש 1X סטרילית PBS-EDTA לנתק תאים HEK 293T.
- הוסף 13 מ"ל של DMEM עם 10% (V / V) FBS אל הבקבוק T225 ס"מ 2 (או 9 מ"ל של DMEM עם 10% (V / V) FBS של 2 ס"מ T75 הבקבוק) לעכב את התגובה טריפסין.
- פיצול גאמות 01:05. עבור בקבוק T225 2 ס"מ, להוסיף 3 מ"ל של תרחיף תאים ל 27 מ"ל של DMEM טרי עם FBS 1X עט / דלקת ו 10% (V / V) בכלי תרבות חדשה. עבור בקבוק T75 2 ס"מ, להוסיף 2 מ"ל של תרחיף תאים ל 8 מ"ל של התקשורת צמיחה חדשים. דגירה תרבויות על 37 מעלות צלזיוס ב CO 5% 2-humidified האווירה. תאים צריכים לגדול עד 100% confluency בתוך יומיים.
תיבה 2. ניתוח כתם המערבי
- הוסף 10 μl חיץ SDS-דף דוגמה לתרבות הפחתת 30 תא μl supernatant. דגימות טען ו prestained סמני משקל מולקולרי על גבי ג'לים polyacrylamide ו electrophorese באמצעות 1X SDS-PAGE המאגר פועל ב V 175 במשך שעה או עד 1 סמני משקל מולקולרי נפתרו היטב.
- משרים את קרום Immobilon-P PVDF ב 100% מתנול דקה 1 להפעיל.
- להרכיב מכשיר כתם המערבי. להבטיח את קרום PVDF פונה אלקטרודה חיובית לשמור את כל המרכיבים הרטובים עם חיץ 1X ההעברה. AVOאיד בין בועות ג'ל polyacrylamide ואת הקרום.
- למלא לגמרי את תא אלקטרופורזה עם חיץ 1X העברה והעברה שעה 1 ב 100 ו '
- לחסום את הקרום עם חלב רזה 5% (w / v) ב-PBS 1X Tween20 שעה 1 בטמפרטורת החדר, או לילה ב 4 ° C.
- דגירה עם נוגדן חד שבטי העיקרי (כלומר 1:1000 נגד HA דילול מאב או אחר הנוגדן המתאים) מומס 5% (w / v) חלב רזה ב-1X PBS Tween20 1 שעה בטמפרטורת החדר או לילה ב 4 ° C.
- לשטוף את הקרומים ב 1X-PBS Tween20 במשך 10 דקות. חזור פעמיים נוספות.
- דגירה עם נוגדן חד שבטי משני מצומדות עם phosphatase אלקליין (1:1000 דילול של 5% (w / v) חלב רזה ב-1X PBS Tween20) במשך שעה 1 בטמפרטורת החדר, או לילה ב 4 ° C.
- לשטוף את הקרומים ב 1X-PBS Tween20 במשך 10 דקות. חזור פעמיים נוספות.
- מניחים את הממברנה לתוך מיכל קטן, מוסיפים 5 מ"ל אלקליין phosphatase substraטה (BCIP / NBT) פתרון. פיתוח צבע צריך להתרחש בתוך 1-5 דקות. עוצמת הלהקה הרצוי פעם הוא הגיע, לשטוף עם מים deionized ואוויר יבש. צבע יכול לדהות עם הזמן, באופן אלקטרוני לסרוק את קרום יבש פעם אחת.
תיבה 3. ניקוי ומיחזור של תרבות כלי סלולריים
בעוד מפעלים סלולריים נועדו להיות שימוש אחד, הכלים האלה יכולים להיות ממוחזרים עבור בקנה מידה גדול transfections נוספים באמצעות פרוטוקול ניקוי הבאה:
- מיד לאחר decanting supernatant מהמפעל 10-שכבת תאים, להוסיף 20% (V / V) אקונומיקה ולנער במרץ לנתק את התאים. דגירה בטמפרטורת החדר במשך שלוש שעות.
- לרוקן את כלי השיט ולהוסיף טרי 20% (V / V) אקונומיקה דגירה בטמפרטורת החדר למשך הלילה.
- לרוקן את כלי ולשטוף עם 1.5 ליטר מים deionized. לחזור שלוש פעמים.
- לרוקן את המפעל שכבת 10 תאים ולהוסיף 0.5 ליטר של סטרילית 1X PBS השלימו עם 10X אנטיביוטי / Antimycotic פתרון. אחסן את כלי בטמפרטורת החדר ולהחליף כמוסות אוורור למילוי יציאות סטנדרטיות (33 כמוסות מ"מ הברגה) לפני השימוש הבא. הערה: כל השכבות צריך להיות ברור לחלוטין לאחר הניקוי, אם לא, אל תשתמש ועושה את המפעל התא בהתאם להנחיות מוסדיים.
Discussion
את 10-שכבת מפעלים סלולריים הם כלי יעיל לייצור כמויות מיליגרם של חלבון. היתרון הגדול של שימוש מפעל התא על כלי מסורתיים אחרים, כגון בקבוקים, צלוחיות הרים לוחצים או צלוחיות תיבת הטווח, היא שהם אינם דורשים רכישת ציוד מעבדה נוספת. תקן ה-CO 2 באינקובטור (~~~HEAD=NNS 6.0 מ"ק. מט...
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
עבודה זו נתמכה על ידי HIV רשת אונטריו טיפול מחקר הפעלה גרנט (ROG-G645) וקנדה מכון פרס מחקר לחוקר הבריאות החדש (MSH-113554) כדי JEL, ואוניברסיטת טורונטו מלגות חה, FCA, וג'וינט. המחברים מבקשים להודות מארני Fusco, דפנה אבלסון וד"ר אריקה Ollmann Saphire במכון המחקר סקריפס (La Jolla, CA) עבור תאים המספקים, ebolavirus וקטור GP ביטוי וייעוץ כללי.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| אלקליין phosphatase (BCIP / NBT) מצע נוזלי פתרון | סיגמא | B6404 | |
| אנטיביוטיקה / Antimycotic, 100x | Invitrogen | 15240062 | |
| Anti-HA זיקה מטריקס, שיבוט 3F10 | רוש | 1815016 | |
| Anti-HA Murine MAB, שיבוט 16B12 | Covance | MMS-101P | |
| תרבות בקבוק נייד, T75 2 ס"מ תרבות רקמות טיפול | קורנינג | 430641 | |
| תרבות בקבוק נייד, T225 2 ס"מ תרבות רקמות טיפול | קורנינג | 431082 | |
| תרבות צלחות סלולריים ,6-גם תרביות רקמה טיפול | קורנינג | 3516 | |
| מפעל נייד, 10-שכבת CellSTACK | קורנינג | 3312 | |
| Centramate אומגה 5K קלטת | אריג אבל | OS005C12 | |
| Centramate אומגה 30K קלטת | אריג אבל | OS030C12 | |
| עמודות כרומטוגרפיה זכוכית, 1.0x10 ס"מ | Kontes | 4204001010 | |
| ציפרופלוקסאצין | סיגמא | 17850 | |
| CO 2 | |||
| שונה Dulbecco של הנשר של התקשורת (DMEM) | סיגמא | D5796 | |
| בסרום שור עוברית (FBS), חום מומת | Invitrogen | 12484-028 | |
| FuGENE HD מגיב transfection | Promega | 4709691001 | |
| GeneJuice מגיב transfection | EMD / מרק | 70967-6 | |
| גליצין | סיגמא | G8898 | |
| נגד העכבר עיזים IgG ו '("א.ב.) 2 אלקליין | Thermo Scientific | 31324 | |
| phosphatase-מצומדות נוגדן | |||
| Hemagglutinin (HA) פפטיד, 100 מ"ג | Genscript | אישית סינתזה | |
| (רצף: YPYDVPDYA, טוהר 95%) | |||
| HEK 293T תאים | ATCC | CRL-11268 | |
| Householד אקונומיקה (4% w / v hypochlorite נתרן) | מותגים שונים זמינים | ||
| Immobilon-P PVDF הממברנה | Millipore | IPVH07850 | |
| MiniPrep ערכת טיהור פלסמיד, PureLink מהירה | Invitrogen | K2100-11 | |
| MaxiPrep ערכת טיהור פלסמיד, PureLink HiPure | Invitrogen | K2100-07 | |
| 3 NaN | סיגמא | S8032 | |
| הביטוי pDISPLAY וקטור | Invitrogen | V660-20 | |
| פניצילין / סטרפטומיצין (עט / דלקת), 100x | Invitrogen | 15140-122 | |
| פוספט בופר סליין (PBS), סטרילית 1X | סיגמא | D8537 | |
| Polyethyleneimine (PEI), ליניארי 25 kDa | Polyscience | 23966 | |
| אבקת חלב רזה יבש | צפורן | ||
| Stericup-GP ואקום PES סינון יחידה, | Millipore | SCGPU05RE | |
| 0.22 מיקרומטר, 500 מ"ל קיבולת | |||
| Trypan כחול | Invitrogen | 15250061 | |
| טריפסין, EDTA, 0.05% (w / v) | Invitrogen | 25300-054 | |
| Tween-20 | סיגמא | P7949 | |
| חומצה ולפרואית | סיגמא | P4543 | |
| Centramate מערכת זרימת משיק | אריג אבל | ||
| CO 2 באינקובטור humidified, תקן 6.0 מ"ק. מטר | מותגים שונים זמינים | ||
| אלקטרופורזה והעברת היחידה | מותגים שונים זמינים | ||
| החממה, 37 ° C | מותגים שונים זמינים |
References
- Celik, E., Calik, P. Production of recombinant proteins by yeast cells. Biotechnol. Adv. , (2011).
- Yokoyama, S. Protein expression systems for structural genomics and proteomics. Curr. Opin. Chem. Biol. 7, 39-43 (2003).
- Nettleship, J. E., Assenberg, R., Diprose, J. M., Rahman-Huq, N., Owens, R. J. Recent advances in the production of proteins in insect and mammalian cells for structural biology. J. Struct. Biol. 172, 55-65 (2010).
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: Applications come of age. Biotechnol. Adv. , (2011).
- Lee, J. E. Structure of the Ebola virus glycoprotein bound to an antibody from a human survivor. Nature. 454, 177-182 (2008).
- Bowden, T. A. Structural basis of Nipah and Hendra virus attachment to their cell-surface receptor ephrin-B2. Nat. Struct. Mol. Biol. 15, 567-572 (2008).
- Evans, M. J., Hartman, S. L., Wolff, D. W., Rollins, S. A., Squinto, S. P. Rapid expression of an anti-human C5 chimeric Fab utilizing a vector that replicates in COS and 293 cells. J. Immunol. Methods. 184, 123-138 (1995).
- Ye, J. High-level protein expression in scalable CHO transient transfection. Biotechnol. Bioeng. 103, 542-551 (2009).
- Wurm, F. M. Production of recombinant protein therapeutics in cultivated mammalian cells. Nat Biotechnol. 22, 1393-1398 (2004).
- Lee, J. E., Fusco, M. H., Hessell, A. J., Burton, D. R., Saphire, E. O. Techniques and tactics used in determining the structure of trimeric, prefusion Ebola virus GP. Acta Cryst. 65, 1162-1180 (2009).
- Aricescu, A. R. Eukaryotic expression: developments for structural proteomics. Acta. Crystallogr. D Biol. Crystallogr. 62, 1114-1124 (2006).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta. Crystallogr. D Biol. Crystallogr. D62, 1243-1250 (2006).
- Chang, V. T. Glycoprotein structural genomics: solving the glycosylation problem. Structure. 15, 267-273 (2007).
- Lee, J. E., Fusco, M. H., Saphire, E. O. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nature Protocols. 4, 592-604 (2009).
- Nettleship, J. E., Rahman-Huq, N., Owens, R. J. The production of glycoproteins by transient expression in Mammalian cells. Methods Mol. Biol. 498, 245-263 (2009).
- Neil, S. J., Zang, T., Bieniasz, P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. Nature. 451, 425-430 (2008).
- Nakamura, Y. Heterodimerization of the IL-2 receptor beta- and gamma-chain cytoplasmic domains is required for signalling. Nature. 369, 330-333 (1994).
- Wang, X., Rickert, M., Garcia, K. C. Structure of the quaternary complex of interleukin-2 with its alpha, beta, and gammac receptors. Science. 310, 1159-1163 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved