É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A Plataforma de expressão adequada e geral para a produção de proteínas secretadas a partir de células humanas
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Na era pós-genômica humana, a disponibilidade de proteínas recombinantes em conformações nativas é crucial para a investigação estrutural, funcional e terapêutico e desenvolvimento. Aqui, nós descrevemos um-teste e em grande escala sistema de expressão de proteínas em células humanas embrionárias de rim 293T que podem ser utilizados para produzir uma variedade de proteínas recombinantes.
Resumo
A expressão da proteína recombinante em bactérias, tipicamente E. coli, tem sido a estratégia mais bem sucedido para a expressão quantidade miligrama de proteínas. No entanto, hospedeiros procarióticos não são frequentemente como apropriado para a expressão de humanos, as proteínas virais ou eucarióticos, devido à toxicidade da macromolécula externa, as diferenças de a máquina de dobragem de proteína, ou devido à falta de modificações específicas co ou pós-translacional em bactérias. Os sistemas de expressão baseados em levedura (P. pastoris ou S. cerevisiae) 1,2, baculovírus-infectada de insectos (S. frugiperda ou T. ni), as células 3, e livre de células in vitro tradução sistemas 2,4 foram utilizados com sucesso para produzir proteínas de mamíferos. Intuitivamente, a melhor correspondência é usar um hospedeiro mamífero para assegurar a produção de proteínas recombinantes que contêm as adequadas modificações pós-translacionais. Um certo número de linhas de células de mamíferos (Kid embrionário humanoNey (HEK) 293, C V-1 em células que transportam o O RIGEM S V40 larget antigénio T-(COS), de Ovário de Hamster Chinês (CHO), e outros) têm sido utilizados com sucesso para superexpressar quantidades de miligramas de um número de proteínas humanas 5-9. No entanto, as vantagens da utilização de células de mamíferos são frequentemente contrariada pela custos mais elevados, a exigência de equipamento de laboratório especializado, rendimentos mais baixos de proteína, e os tempos longos para desenvolver linhagens de células estáveis de expressão. Aumento de produtividade e produção de proteínas mais rápido, mantendo os custos baixos, são fatores importantes para muitos laboratórios acadêmicos e comerciais.
Aqui, nós descrevemos um tempo e custo-eficácia, o procedimento de duas partes para a expressão de proteínas secretadas humanos a partir de células aderentes HEK 293T. Este sistema é capaz de produzir quantidades de micrograma miligrama de proteína funcional para estudos estruturais, biofísicas e bioquímicas. A primeira parte, as construções de múltiplas do gene de interesse são produzird em paralelo e transientemente transfectados para células aderentes HEK 293T em pequena escala. A detecção e análise de proteína recombinante segregada no meio de cultura de células é realizada por análise de Western blot utilizando anticorpos comercialmente disponíveis dirigidos contra uma etiqueta de purificação do vector proteína codificada. Subsequentemente, as construções adequadas para produção em larga escala de proteínas são transitoriamente transfectadas utilizando polietilenoimina (PEI) em fábricas 10 da camada de células. As proteínas segregadas no litros de volumes de meio condicionado são concentrados em quantidades administráveis usando filtração de fluxo tangencial, seguido de purificação por anti-HA cromatografia de afinidade. A utilidade desta plataforma é comprovada pela sua capacidade de expressar quantidades de miligramas de citocinas, receptores de citocinas, receptores da superfície celular, os factores de restrição intrínsecas, e glicoproteínas virais. Este método foi também utilizada com sucesso na determinação estrutural das 5,10 da glicoproteína triméricos Ebolavirus.
2, é necessário. Este procedimento pode ser rapidamente expandido para sistemas de maior complexidade, tais como co-expressão de complexos de proteína, antigénios e anticorpos, produção de partículas semelhantes a vírus para as vacinas, ou a produção de adenovírus ou lentivírus para transdução de linhas de células difíceis.
Protocolo
1. Trabalho de preparação - Construções e culturas de células
Antes de iniciar o protocolo, o gene de interesse deve ser codão optimizados para a expressão em células de mamíferos, e clonado num vector de expressão apropriado utilizando técnicas padrão de biologia molecular. A fim de assegurar a maior oportunidade para a expressão bem sucedida, múltiplas variantes do gene de interesse deverá ser gerado. Muitos vectores de expressão de mamífero estão disponíveis comercialmente e ter marcas de purificação diferentes (poli-histidina, a hemaglutinina, estreptavidina, halo-Tag, glutationa S-transferase, entre outros). Nós preferimos usar o vector pDISPLAY, que codifica para um promotor de citomegalovírus humano forte, um sinal de secreção de Ig κ, hemaglutinina tag purificação, e tem uma âncora transmembranar C-terminal para alvejar a proteína através da via secretora para exibição sobre a membrana plasmática. Nós geralmente inserir um codão de paragem na frente do vector-encoded transmembranar anchor para permitir que a proteína a ser segregado para o meio condicionado.
De rim embrionário humano (HEK) células 293T estão amplamente disponíveis, e facilmente cultivado e transfectado. HEK 293T são usados rotineiramente para a expressão das proteínas de mamíferos, mas são considerados de risco biológico e deve ser tratado em nível de biossegurança 2. Por favor, use roupas de proteção individual; trabalho deve ser realizado em uma cabine de segurança biológica aprovado utilizando uma técnica asséptica. Todos os resíduos e as superfícies devem ser desinfetados de acordo com as diretrizes institucionais e governamentais. Recomenda-se que as células sejam testados para a contaminação por micoplasma antes de usar. As células podem ser tratadas com ciprofloxacina (10 ug / ml) durante dez dias para erradicar qualquer fonte de Mycoplasma spp. contaminação. Protocolos gerais para propagar células HEK 293T são apresentados separadamente (Quadro 1).
Considerações adicionais para a expressão de proteína-teste e em grande escala são reviewed em 11-15.
2. Pequena escala expressão de teste
Uma vez que as construções foram concebidos e gerados, transfecções em pequena escala de ensaio pode ser realizada utilizando HEK 293T; um diagrama esquemático resumindo o processo é apresentado abaixo (Fig. 1).
- Use T75 cm 2 ou T225 cm 2 frascos de cultura de células (dependendo do número de expressões de teste a ser realizado) para cultivar as células HEK 293T e dividir as células a cada 2-3 dias, quando as células são confluentes 100% (Quadro 1).
- Semente 2,5 x 10 5 HEK 293T células por poço numa placa de 6 poços e adicionar 2 ml de DMEM com 1X pen / strep e 10% (v / v) de FBS redemoinho, a placa suavemente para assegurar mesmo dispersão de células em cada poço, e incubar durante a noite a 37 ° C em uma câmara de 5% de CO 2 humidificado.
- Quando as células HEK 293T alcançar 40% de confluência, descartar os meios de comunicação e adicionar 2 ml de DMEM fresco com 1X pen / strep e 10% (v / v) de FBS aos poços. Realizarensaios de transfecção.
- Alíquota 90 uL DMEM isento de soro para um tubo de microcentrífuga esterilizado de 1,5 ml. Pipetar GeneJuice 3 ul para a DMEM isento de soro e misturar suavemente o tubo (vórtice dedo). Incubar durante 5 minutos à temperatura ambiente.
- Adicionar 1 ug de DNA do plasmídeo purificado miniprep (ADN estoque = 100 ng / ul) em DMEM-GeneJuice mistura, vórtice dedo, e incubar durante 15 minutos à temperatura ambiente.
- Pipetar a gota a gota da mistura de transfecção para células HEK 293T, e agite a placa de 6 poços suavemente para permitir uma distribuição uniforme da mistura de transfecção. Incubar a placa de 6 poços, a 37 ° C em uma câmara de 5% de CO 2 humidificado.
- Adicionar 1 ml de DMEM fresco com 1X pen / strep e 10% (v / v) de FBS a cada poço 24 horas pós-transfecção e incubar durante mais 48 horas (total de 72 horas).
- Ml colheita 1 de sobrenadante de cada poço a três dias após a transfecção e microcentrífuga as amostras a 16.000 g durante 10 minutos à temperatura ambiente. Realizar western blot, conforme detalhado no Quadro 2. As amostras podem ser armazenadas a 4 ° C. O comprimento do armazenamento a 4 ° C é a proteína dependente.
3. Em larga escala expressão de teste e Purificação
Uma vez que uma construção foi identificado expressão quantidade miligrama de proteína recombinante é conseguido através da PEI a transfecção de células aderentes HEK 293T usando fábricas 10 da camada de células (Fig. 2; 6360 centímetros área de superfície 2). Para estudos mais exploratória, pequenas fábricas celulares ou frascos-T (Tabela 1) pode ser usado.
- Purifica-se 1 mg de DNA para a transfecção utilizando um kit de purificação MaxiPrep plasmídeo. Uma cultura de 500 ml durante a noite de XL-1 Blue células devem produzir pelo menos 1 mg de DNA puro. Verificar a pureza de DNA medindo A 260 / A razão de 280; deve estar acima de 1,8.
- Aumentar os HEK 293T para 2,0 x 10 8 células. Cada T225 cm 2 balão crescido para 100% de co confluênciantains e média de aproximadamente 2,25 x 10 7 células.
- Adicionar 1,2 L DMEM com 5% (v / v) de FBS a uma fábrica celular camada-10. Adicionar 2,0 x 10 8 HEK 293T células para a fábrica de células e distribuir uniformemente as células de todas as camadas do vaso. É muito difícil para visualizar a confluência de células na fábrica celular. Como uma alternativa, configurar um T75 cm 2 balão com um número adequado de células, utilizando o número mesma célula a razão de área de superfície como foi executado com o navio 10-camada. Monitorar este frasco para taxas de crescimento. Veja o vídeo associado para instruções sobre como lidar com a fábrica da célula. Incubar durante a noite a 37 ° C com 5% de CO 2 para permitir a ligação de células e do crescimento.
- Execute grande escala transfecção quando aderentes células HEK 293T são 70% confluentes. Preparar a mistura de transfecção PEI-DNA (3:1 w / w de PEI a proporção de ADN) num armário de segurança biológica utilizando uma agulha estéril T75 cm 2 balão. Misturar 0,84 mg de ADN com 84 ml de PBS 1X estéril, em seguida, adicionar 2,5 ml de PEI (2.5 mg Total PEI). Incubar a temperatura ambiente durante 15 minutos. Solução deve ficar nublado.
- Verter a mistura de transfecção PEI-DNA lentamente na fábrica celular e completamente distribuir ao longo de todas as camadas da embarcação. Opcional: para os rendimentos de expressão aumentada, adicionar o ácido valpróico (4 mM concentração final). Incubar a 37 ° C com 5% de CO 2 durante quatro dias.
- Colheita sobrenadante quatro dias após a transfecção. Centrifugar os meios condicionados a 6000 x g durante 30 minutos a 4 ° C. Além disso filtrar o sobrenadante utilizando um aparelho de 0,22 uM vácuo Stericup filtro. A fábrica de células 10-camada pode ser reutilizado, ver Caixa 3 para limpeza do aparelho. É fundamental que a limpeza é iniciado imediatamente após a colheita sobrenadante, não deixe que as células seco sobre a superfície do vaso.
- Concentrar o sobrenadante a 75 ml, utilizando o sistema de filtração de fluxo tangencial Centramate.
- Adicionar 500 ml de PBS e re-concentrado para 75 ml. Repita três additvezes ional completamente buferiza trocar a amostra.
- Equilibre um 1 ml coluna de afinidade anti-HA com PBS 1X e aplicar amostra concentrada por fluxo de gravidade, a uma taxa <1 ml / min.
- Lavar a coluna com 30 ml de PBS 1X-Tween20.
- Dissolver HA péptido em PBS 1X (1,0 mg / ml) e incubar a 37 ° C.
- Aplicar 1 ml do péptido HA para a coluna de anti-HA e permitir que o péptido a fluir para a resina. Recolher o fluxo através. Parar o fluxo quando a solução peptídica atinge a altura do leito.
- Incubar a coluna anti-HA toda a 37 ° C durante 15 minutos.
- Repita o passo 12 duas vezes.
- Aplicar 1 ml de PBS 1X para a coluna de anti-HA e fluir para a resina até atingir a altura do leito. Recolher o fluxo através.
- Regenerar a coluna anti-HA com 10 ml 0,1 M pH 2,2 glicina. Lava-se com 10 ml de PBS e coluna de afinidade de armazenamento a 4 ° C em PBS com 0,02% (w / v) de NaN3.
- Realizar Análise SDS-PAGE e reunir a fractions acordo. Nota: O péptido de HA irá interferir com as medições da concentração de proteína por A 280 ou Bradford. Para estimar a quantidade de proteína presente, a carga 5, 10, 15, 25 ug de BSA sobre o gel de SDS-PAGE como um padrão e comparar as intensidades da banda.
Passos 9-17 pode ser repetido para capturar proteína adicional a partir do meio condicionado.
4. Os resultados representativos
Neste artigo, vamos descrever e demonstrar uma plataforma de expressão conveniente para miligramas quantidade de produção de proteínas humanas que podem ser posteriormente utilizados para estudos estruturais e funcionais. O rastreio da proteína humana construções utilizando células HEK 293T em 6-poços é eficiente e eficaz na identificação de construções passíveis de produção em maior escala. Vectores de expressão comerciais podem ser transfectadas de forma eficiente em células HEK 293T usando uma variedade de reagentes de transfecção, tais como GeneJuice, HD FuGene ou PE I. É recomendável o uso de um reagente de transfecção comercial, tais como GeneJuice ou HD FuGene, para expressões de ensaio, como estes reagentes são mais eficazes para mais pobres proteínas expressando (Fig. 3). Constructos seleccionados para a expressão escala maior deve ser caracterizada por uma única banda, intensidade, forte, correspondente ao peso molecular adequado sobre a técnica de Western blot (Fig. 3). Glicoproteínas podem migrar como uma ampla faixa devido à heterogeneidade na glicosilação. Mostrámos que uma variedade de macromoléculas, que vão desde glicoproteínas virais, citocinas, receptores de citocinas, proteínas e outra superfície, pode ser expresso e purificado para produzir quantidades de proteína millgram usando esta plataforma expressão geral (Fig. 4).
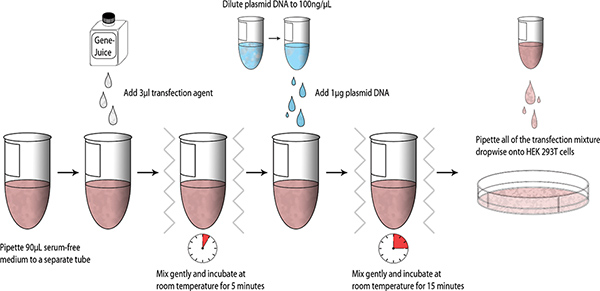
Figura 1. Esquema de fluxo de trabalho de pequena escala transfecções.tp_upload/4041/4041fig1large.jpg "target =" _blank "> Clique aqui para ver maior figura.

Figura 2. Corning CellSTACK 10-camada para a expressão proteína maior escala. Cada camada contém 636 centímetros área de superfície 2 de ligação de células. Um padrão de laboratório incubadora de CO 2 (6.0 cu. Ft) irá segurar confortavelmente quatro fábricas de 10 camadas de células.
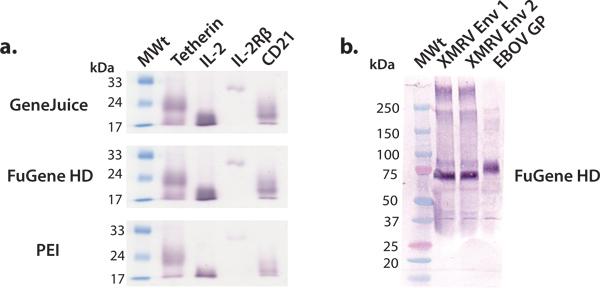
.. Figura 3 em pequena escala expressão de várias proteínas secretadas Foi realizada uma série de expressões de pequena escala de ensaio, utilizando reagentes de transfecção comuns:. GeneJuice, FuGene HD e PEI (a) rastreio de Western blot de proteínas celulares seleccionadas humanos (tetherin), de receptores (IL-2R subunidade β) e citocinas (IL-2). Tetherin é uma glicoproteína de membrana humano que restringe a libertação denascentes viriões de HIV-1 16. O domínio extracelular de tetherin existe como um glicosilada, dímero de dissulfureto-linked de ~ 36 kDa. Sob condições redutoras, como mostrado aqui, tetherin migra como um monómero com um peso molecular aparente de ~ 22 kDa. A interleucina-2 (IL-2) é uma citocina (~ 17 kDa) envolvida na proliferação de linfócitos 17. Ele interage com o IL-2 complexo receptor, dos quais a IL-2R βsubunit (~ 26 kDa) é um componente 18. CD21 é uma proteína de membrana envolvidas na activação e na maturação de células B por o sistema do complemento, e é também um receptor para o vírus de Epstein-Barr. O domínio extracelular de CD21 glicosilada migra como um monómero com um peso molecular aparente de aproximadamente 20 kDa. (B) rastreio de Western blot de glicoproteínas de superfície seleccionados virais (XMRV Env e Ebolavirus GP). XMRV e glicoproteínas Ebolavirus (âncora transmembranar suprimido) existe na membrana virai como picos triméricos e estão envolvidos na ligação de células de acolhimentoe fusão. O ectodomínio de XMRV Env e GP EBOV são fortemente decorado com glicanos N-ligados e migrar em pesos moleculares aparentes de 70 kDa e 75 kDa, respectivamente.

Figura 4. Humana purificada proteínas celulares a partir de culturas em larga escala HEK 293T. Todas as proteínas foram expressas utilizando uma fábrica celular 10-camada, e concentrada e purificada por cromatografia de anti-HA. Como demonstrado por Coomassie manchado de análise de SDS-PAGE, os domínios extracelulares do receptor de interleucina-2 (IL-2R) α e γ subunidades migrar em pesos moleculares de 40 kDa e 46 kDa, respectivamente. O domínio extracelular de tetherin migra como um dímero, sob condições não redutoras, com um peso molecular aparente de 36 kDa. Note-se que há alguma contaminação BSA que aparece em um peso molecular aparente de 60 kDa. Além disso, a heterogeneidade dos glicanos N-ligados presentes no tetherin,IL-2R α e IL-2R γ banda causas ampliação no gel de SDS-PAGE. Estes complexos de tipo N-glicanos ligados pode ser removida utilizando péptido: N-glicosidase F.
| Navio | Superfície |
| 6-bem placa | 9,5 centímetros 2 (cada poço) |
| Placas de 100 mm | 55 centímetros 2 |
| 245 pratos mm | 500 cm 2 |
| T75 cm 2 balão | 75 centímetros 2 |
| T175 cm 2 balão | 175 centímetros 2 |
| T225 cm 2 balão | 225 centímetros 2 |
| Rolo garrafa-regular | 850 centímetros 2 |
| Superfície do rolo garrafa expandida | 1700 centímetros 2 |
| 1 camada-CellSTACK | 636 centímetros 2 |
| 2 camadas CellSTACK | 1272 centímetros 2 |
| 5-camada CellSTACK | 3180 centímetros 2 |
| 10-camada CellSTACK | 6360 centímetros 2 |
| 40-camada CellSTACK | 25.440 centímetros 2 |
Tabela 1. Comparação dos vasos de células de cultura utilizados para a expressão da proteína.
Lista de Receitas de reagente
100X Ciprofloxacine Para 10 ml de solução, adicionam-se 10 ml de água desionizada a 10 mg ciprofloxacina. Adicionar 10 ul HCl 6N para dissolver completamente o ciprofloxacina.
PEI (1 mg / mL) para uma solução de 100 ml, dissolver 100 mg de 25 kDa linear PEI em água desionizada e calor a 80 ° C. Solução arrefecer até à temperatura ambiente, ajustar o pH a 7,2, 0,22 filtro esterilizar alíquota, e congelamento a -20 ° C durante long prazo de armazenamento.
1X PBS durante 1 solução de L aquosa: 8,0 g de NaCl, 0,2 g de KCl, 1,4 g de Na 2 HPO 4 (anidro), 0,24 g KH PO 2 4. Ajustar o pH da solução para 7,4 e encha até 1,0 L.
1X PBS-Tween-20 para uma solução de L aquosa: 8,0 g de NaCl, 0,2 g de KCl, 1,4 g de Na 2 HPO 4 (anidro), 0,24 g KH 2 PO 4, 1 ml de Tween-20. Ajustar o pH da solução para 7,4 e encha até 1,0 L.
1X tampão de transferência para uma solução de L aquosa: 3,0 g de base Tris, 14,4 g de glicina, 150 ml de metanol.
SDS-PAGE 1X tampão de corrida Para uma solução de L aquosa: 3,0 g de base Tris, 14,4 g de glicina, 1,0 g de SDS.
SDS-PAGE de redução de tampão de amostra para 10 ml de solução: 0,6 g de SDS, 3 ml de glicerol, 1,8 ml 1,0 Tris-HCl pH 6,8, 1 mg de azul de bromofenol, 5% (v / v) 2-mercaptoetanol.
Quadro 1. Protocolos gerais para a propagação das células- Cultivar células HEK 293T em meio Dulbecco modificado por Eagle (DMEM) suplementado com 10% (v / v) de soro fetal bovino (FBS), caneta 1X / strep a 37 ° C em um 5% de CO 2-humidificada atmosfera.
- Observar as células em um microscópio invertido. Quando as células estão em confluência de 100%, remover e descartar o meio de cultura.
- Lavar as células com 5 ml de PBS estéril 1X para remover vestígios de soro. Descartar o de lavagem PBS.
- Adicionar 2 ml de 0,05% (w / v) de tripsina-EDTA solução para um balão T225 cm 2 (ou 1 ml de 0,05% (w / v) de tripsina-EDTA para T75 balão cm 2) e incubar à temperatura ambiente até que as células separar a partir da superfície. É também possível usar 1X PBS estéril-EDTA para separar as células HEK 293T.
- Adicionar 13 ml de DMEM com 10% (v / v) de FBS a um balão T225 cm 2 (ou 9 ml de DMEM com 10% (v / v) de FBS para T75 cm 2 balão) para inibir a reacção de tripsina.
- Divida cells 1:5. Para um balão T225 cm 2, adicionar 3 ml de suspensão de células para 27 ml de DMEM fresco com 1X pen / strep e 10% (v / v) de FBS em um vaso de cultura novo. Para um balão T75 cm 2, adicionar 2 ml de suspensão de células a 8 ml de meio de crescimento fresco. Incubar as culturas a 37 ° C em um 5% de CO 2-humidificada atmosfera. As células devem aumentar para 100% de confluência em dois dias.
Caixa 2. Análise de mancha de western
- Adicionar 10 ul de SDS-PAGE tampão de amostra de redução para 30 uL sobrenadante de cultura de células. As amostras de carga e prestained marcadores de peso molecular em géis de poliacrilamida, e electroforese usando SDS-PAGE 1X tampão de corrida a 175 V durante 1 hora ou até que os marcadores de peso molecular são bem resolvidos.
- Embeber o PVDF membrana Immobilon-P em metanol a 100% durante 1 minuto para activar.
- Montar aparelho western blot. Assegurar a membrana de PVDF enfrenta o eletrodo positivo e manter todos os componentes molhados com 1X tampão de transferência. Avobolhas ID entre o gel de poliacrilamida ea membrana.
- Preencher completamente a câmara de electroforese com 1X tampão de transferência e de transferência durante 1 hora a 100 V.
- Bloquear a membrana com 5% (w / v) de leite desnatado em PBS 1X-Tween20 durante 1 hora à temperatura ambiente, ou durante a noite a 4 ° C.
- Incubar com o anticorpo monoclonal primário (isto é, diluição 1:1000 mAb anti-HA ou outro anticorpo apropriado) dissolvido em 5% (w / v) de leite desnatado em PBS 1X-Tween20 durante 1 hora à temperatura ambiente ou durante a noite a 4 ° C.
- Lave as membranas em 1X PBS-Tween 20 por 10 minutos. Repita duas vezes extra.
- Incubar com um anticorpo monoclonal secundário conjugado com fosfatase alcalina (diluição 1:1000 em 5% (w / v) de leite desnatado em PBS 1X-Tween20) durante 1 hora à temperatura ambiente, ou durante a noite a 4 ° C.
- Lave as membranas em 1X PBS-Tween 20 por 10 minutos. Repita duas vezes extra.
- Coloque a membrana para um recipiente de pequenas dimensões, adicionar 5 ml de fosfatase alcalina substrate solução (BCIP / NBT). O desenvolvimento da coloração deve ocorrer dentro de 1-5 minutos. Uma vez que a intensidade banda desejada é alcançada, lavar com água desionizada e ar seco. Cor pode desaparecer com o tempo; eletronicamente analisar as membranas, uma vez secos.
Box 3. Limpeza e reciclagem de recipientes de cultura de células
Enquanto fábricas celulares são concebidos para serem de uso único, estes vasos podem ser reciclados para adicionais em grande escala transfecções usando o protocolo de limpeza seguinte:
- Imediatamente após decantação do sobrenadante a partir da fábrica de células 10-camada, adicionar 20% (v / v) de lixívia e agitar vigorosamente para separar células. Incubar a temperatura ambiente durante três horas.
- Esvaziar o recipiente e adiciona fresco de 20% de lixívia (v / v) e incuba-se à temperatura ambiente durante a noite.
- Esvaziar o recipiente e lava-se com 1,5 L de água desionizada. Repetir três vezes.
- Esvaziar a fábrica celular camada-10 e adicionar 0,5 L de estéril 1X PBS suplementado com 10X solução de antibiótico / antimicótico. Armazenar o vaso, à temperatura ambiente e substituir as tampas de ventilação para o enchimento portas (padrão 33 mm tampas roscadas) antes da utilização seguinte. Nota: todas as camadas deve estar completamente livre após a limpeza, se não, não usar e descartar a fábrica de células de acordo com as diretrizes institucionais.
Discussão
As fábricas 10-camada de células são um vaso eficaz para a produção de quantidades de miligramas de proteína. Uma grande vantagem de utilizar a fábrica celular sobre outros vasos tradicionais, tais como garrafas cilíndricas, frascos de agitação ou frascos giratórios, é que eles não requerem a aquisição de qualquer equipamento de laboratório adicional. Um padrão incubadora de CO 2 (aproximadamente 6,0 Cu. Ft) irá facilmente acomodar quatro fábricas 10 da camada de células (Fig. 2).<...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado por um Tratamento HIV Ontario Rede de Pesquisa Operacional Grant (ROG-G645) e Canadian Institutes of Health Research New Investigator Award (MSH-113554) para JEL, e da Universidade de Bolsas de Toronto para HA, FCA, e JDC. Os autores gostariam de agradecer Marnie Fusco, Dafna Abelson e Dr. Erica Ollmann Saphire no The Scripps Research Institute (La Jolla, CA) para as células que fornecem, vetor de expressão Ebolavirus GP e conselhos gerais.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Fosfatase alcalina (BCIP / NBT) de solução de substrato líquido | Sigma | B6404 | |
| Antibiótico / antimicótico, 100X | Invitrogen | 15240062 | |
| Anti-HA matriz de afinidade, o clone 3F10 | Roche | 1815016 | |
| Anti-HA de murino mAb, clone 16B12 | Covance | MMS-101P | |
| Balão de cultura de células, cultura de tecidos T75 centímetros 2 tratada | Corning | 430641 | |
| Balão de cultura de células, T225 centímetros de cultura de tecidos 2 tratada | Corning | 431082 | |
| As placas de cultura de células bem ,6-cultura de tecidos tratados | Corning | 3516 | |
| Fábrica de células, CellSTACK 10 camadas | Corning | 3312 | |
| Centramate Omega Cassete 5K | Mortalha | OS005C12 | |
| Centramate Omega 30K Cassete | Mortalha | OS030C12 | |
| Cromatografia em coluna de vidro, cm 1.0x10 | Kontes | 4204001010 | |
| Ciprofloxacina | Sigma | 17850 | |
| CO 2 | |||
| Meios Dulbecco modificado por Eagle (DMEM) | Sigma | D5796 | |
| Soro fetal de bovino (FBS), inactivado pelo calor | Invitrogen | 12484-028 | |
| FuGENE reagente transfecção HD | Promega | 4709691001 | |
| GeneJuice reagente transfecção | EMD / Merck | 70967-6 | |
| Glycine | Sigma | G8898 | |
| Cabra anti-rato IgG F (ab ') 2 alcalina | Thermo Scientific | 31324 | |
| fosfatase anticorpo conjugado | |||
| Hemaglutinina (HA) péptido, 100 mg | GenScript | síntese feita sob encomenda | |
| (Seqüência: YPYDVPDYA; grau de pureza 95%) | |||
| As células HEK 293T | ATCC | CRL-11268 | |
| Household lixívia (4% w / v de hipoclorito de sódio) | várias marcas estão disponíveis | ||
| Immobilon-P PVDF membrana | Millipore | IPVH07850 | |
| Miniprep kit de purificação de plasmídeo, PureLink rápida | Invitrogen | K2100-11 | |
| MaxiPrep kit de purificação de plasmídeo, PureLink HiPure | Invitrogen | K2100-07 | |
| NaN 3 | Sigma | S8032 | |
| vetor de expressão pDISPLAY | Invitrogen | V660-20 | |
| Penicilina / estreptomicina (pen / strep), 100X | Invitrogen | 15140-122 | |
| Salino tamponado com fosfato (PBS) estéril, 1X | Sigma | D8537 | |
| Polietilenoimina (PEI), lineares 25 kDa | Polyscience | 23966 | |
| Leite desnatado em pó seco | Cravo | ||
| Stericup-GP unidade de filtração PES vácuo, | Millipore | SCGPU05RE | |
| 0,22, 500 ml de capacidade | |||
| Trypan azul | Invitrogen | 15250061 | |
| Tripsina-EDTA, 0,05% (w / v) | Invitrogen | 25300-054 | |
| Tween-20 | Sigma | P7949 | |
| O ácido valpróico | Sigma | P4543 | |
| Centramate sistema de fluxo tangencial | Mortalha | ||
| Incubadora de CO 2 umidificado, padrão 6.0 cu. pé | várias marcas estão disponíveis | ||
| Eletroforese e transferência | várias marcas estão disponíveis | ||
| Incubadora, a 37 ° C | várias marcas estão disponíveis |
Referências
- Celik, E., Calik, P. Production of recombinant proteins by yeast cells. Biotechnol. Adv. , (2011).
- Yokoyama, S. Protein expression systems for structural genomics and proteomics. Curr. Opin. Chem. Biol. 7, 39-43 (2003).
- Nettleship, J. E., Assenberg, R., Diprose, J. M., Rahman-Huq, N., Owens, R. J. Recent advances in the production of proteins in insect and mammalian cells for structural biology. J. Struct. Biol. 172, 55-65 (2010).
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: Applications come of age. Biotechnol. Adv. , (2011).
- Lee, J. E. Structure of the Ebola virus glycoprotein bound to an antibody from a human survivor. Nature. 454, 177-182 (2008).
- Bowden, T. A. Structural basis of Nipah and Hendra virus attachment to their cell-surface receptor ephrin-B2. Nat. Struct. Mol. Biol. 15, 567-572 (2008).
- Evans, M. J., Hartman, S. L., Wolff, D. W., Rollins, S. A., Squinto, S. P. Rapid expression of an anti-human C5 chimeric Fab utilizing a vector that replicates in COS and 293 cells. J. Immunol. Methods. 184, 123-138 (1995).
- Ye, J. High-level protein expression in scalable CHO transient transfection. Biotechnol. Bioeng. 103, 542-551 (2009).
- Wurm, F. M. Production of recombinant protein therapeutics in cultivated mammalian cells. Nat Biotechnol. 22, 1393-1398 (2004).
- Lee, J. E., Fusco, M. H., Hessell, A. J., Burton, D. R., Saphire, E. O. Techniques and tactics used in determining the structure of trimeric, prefusion Ebola virus GP. Acta Cryst. 65, 1162-1180 (2009).
- Aricescu, A. R. Eukaryotic expression: developments for structural proteomics. Acta. Crystallogr. D Biol. Crystallogr. 62, 1114-1124 (2006).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta. Crystallogr. D Biol. Crystallogr. D62, 1243-1250 (2006).
- Chang, V. T. Glycoprotein structural genomics: solving the glycosylation problem. Structure. 15, 267-273 (2007).
- Lee, J. E., Fusco, M. H., Saphire, E. O. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nature Protocols. 4, 592-604 (2009).
- Nettleship, J. E., Rahman-Huq, N., Owens, R. J. The production of glycoproteins by transient expression in Mammalian cells. Methods Mol. Biol. 498, 245-263 (2009).
- Neil, S. J., Zang, T., Bieniasz, P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. Nature. 451, 425-430 (2008).
- Nakamura, Y. Heterodimerization of the IL-2 receptor beta- and gamma-chain cytoplasmic domains is required for signalling. Nature. 369, 330-333 (1994).
- Wang, X., Rickert, M., Garcia, K. C. Structure of the quaternary complex of interleukin-2 with its alpha, beta, and gammac receptors. Science. 310, 1159-1163 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados