Method Article
4D التصوير التجميع البروتين في الخلايا الحية
In This Article
Summary
الجدوى الخلوية تعتمد على إدارة الوقت المناسب والفعال للmisfolding البروتين. نحن هنا وصف طريقة لتصور مصائر مختلفة المحتملة للبروتين تتجمع: طوي ثانية، وتدهور، أو عزل في الادراج. نحن لشرح استخدام جهاز استشعار للطي، Ubc9 TS، لرصد وتجميع proteostasis مراقبة الجودة في الخلايا الحية باستخدام المجهر 4D.
Abstract
One of the key tasks of any living cell is maintaining the proper folding of newly synthesized proteins in the face of ever-changing environmental conditions and an intracellular environment that is tightly packed, sticky, and hazardous to protein stability1. The ability to dynamically balance protein production, folding and degradation demands highly-specialized quality control machinery, whose absolute necessity is observed best when it malfunctions. Diseases such as ALS, Alzheimer's, Parkinson's, and certain forms of Cystic Fibrosis have a direct link to protein folding quality control components2, and therefore future therapeutic development requires a basic understanding of underlying processes. Our experimental challenge is to understand how cells integrate damage signals and mount responses that are tailored to diverse circumstances.
The primary reason why protein misfolding represents an existential threat to the cell is the propensity of incorrectly folded proteins to aggregate, thus causing a global perturbation of the crowded and delicate intracellular folding environment1. The folding health, or "proteostasis," of the cellular proteome is maintained, even under the duress of aging, stress and oxidative damage, by the coordinated action of different mechanistic units in an elaborate quality control system3,4. A specialized machinery of molecular chaperones can bind non-native polypeptides and promote their folding into the native state1, target them for degradation by the ubiquitin-proteasome system5, or direct them to protective aggregation inclusions6-9.
In eukaryotes, the cytosolic aggregation quality control load is partitioned between two compartments8-10: the juxtanuclear quality control compartment (JUNQ) and the insoluble protein deposit (IPOD) (Figure 1 - model). Proteins that are ubiquitinated by the protein folding quality control machinery are delivered to the JUNQ, where they are processed for degradation by the proteasome. Misfolded proteins that are not ubiquitinated are diverted to the IPOD, where they are actively aggregated in a protective compartment.
Up until this point, the methodological paradigm of live-cell fluorescence microscopy has largely been to label proteins and track their locations in the cell at specific time-points and usually in two dimensions. As new technologies have begun to grant experimenters unprecedented access to the submicron scale in living cells, the dynamic architecture of the cytosol has come into view as a challenging new frontier for experimental characterization. We present a method for rapidly monitoring the 3D spatial distributions of multiple fluorescently labeled proteins in the yeast cytosol over time. 3D timelapse (4D imaging) is not merely a technical challenge; rather, it also facilitates a dramatic shift in the conceptual framework used to analyze cellular structure.
We utilize a cytosolic folding sensor protein in live yeast to visualize distinct fates for misfolded proteins in cellular aggregation quality control, using rapid 4D fluorescent imaging. The temperature sensitive mutant of the Ubc9 protein10-12 (Ubc9ts) is extremely effective both as a sensor of cellular proteostasis, and a physiological model for tracking aggregation quality control. As with most ts proteins, Ubc9ts is fully folded and functional at permissive temperatures due to active cellular chaperones. Above 30 °C, or when the cell faces misfolding stress, Ubc9ts misfolds and follows the fate of a native globular protein that has been misfolded due to mutation, heat denaturation, or oxidative damage. By fusing it to GFP or other fluorophores, it can be tracked in 3D as it forms Stress Foci, or is directed to JUNQ or IPOD.
Protocol
1. الخميرة الاستعدادات
- تحويل سلالات الخميرة مع بلازميد يحمل كاسيت GAL1-GFP-Y68L (UBC9 TS).
- تنمو الخميرة في وسائل الإعلام التي تحتوي على رافينوز الاصطناعية 2٪ لمدة 24 ساعة وتضعف إلى 2٪ سكر اللبن التي تحتوي على وسائل الإعلام لمدة 16 ساعة أو O / N. احتضان خلايا في C ° 30 بينما تهز في 200 دورة في الدقيقة.
- في صباح اليوم التالي، يخفف من الضغط على الاستعلام OD 600 = 0.2. يهز لمدة 4-6 ساعة في 30 ° C (200 دورة في الدقيقة) حتى يصل ثقافة OD 600 = 0،8-1،0.
- لقمع التعبير (وذلك لمراقبة فقط تجمع بالفعل ترجمتها ومطوية من GFP Ubc9-TS)، وسائل الإعلام إلى وسائل الإعلام التغيير الاصطناعية تستكمل مع الجلوكوز 2٪ (SD) 30 دقيقة قبل التصوير.
- العلاج - الصدمة الحرارية الخلايا لمدة 20 دقيقة عند 37 درجة مئوية للحث على misfolding، أو مستمر في الحاضنة المجهر لمتابعة تجميع البروتين في ظروف حرارة الصدمة. ملاحظة - إذا كنت تستخدم المجهر في أي درجة الحرارة فوق RT، قبل الحرارة FOص حوالي 2 ساعة لتتوازن درجة الحرارة على طول الجسم من المجهر وأهداف (انظر أدناه).
2. لوحة \ الاستعدادات الشرائح
- اختيار لوحة مناسبة. الاعتبار الرئيسي هو القدرة على الحفاظ على التركيز خلال اقتناء التصوير. النقاط التالية هي الحاسمة للتصوير 4D وليس لهفوات وقت 2D أو 3D التصوير.
- متعددة الآبار لوحة أسفل الآبار مختلفة قد لا تكون متجانسة (أي الآبار ستكون على ارتفاعات مختلفة بالنسبة إلى الهدف). وهذا سيجعل من الصعب الحفاظ على التركيز عبر نقاط س ص ونقطة الوقت، بغض النظر عن كونه يستخدم هذه التقنية autofocusing.
- المواد الشريحة: الزجاج البلاستيك مقابل. الشرائح الزجاجية القاع أكثر Z-متجانسة بين الآبار، ولكنها أكثر تكلفة.
- سمك أسفل لوحة: نحن عادة استخدام لوحات ساترة القاع مؤشر 1.5، ولكن مؤشر 1 هو أيضا مقبولة اعتمادا على الهدف.
- COVإيه السفلي من لوحة \ الشريحة مع كونا (0.25 ملغ / مل) لمدة 10 دقيقة. يستخدم كونا للانضمام إلى الشريحة الخلايا، والتي تمكن بعد خلية واحدة مع مرور الوقت.
- إزالة كونا واحتضان شريحة في غطاء محرك السيارة الكيميائية بحيث تتبخر كونا الزائدة.
- لوحة من 200 ميكرولتر عينة الخميرة (OD 600 = 0.5) في ConAed أيضا.
- احتضان لمدة 15 دقيقة، وذلك لتمكن خلايا التمسك سطح اللوحة.
- استخراج المتوسط، ويغسل ثلاث مرات مع الوسيلة الجديدة للحصول على طبقة واحدة من الخلايا. ملاحظة: إذا تم التخطيط لمرور وقت طويل، وبذور الخلايا قليلة بحيث براعم الجديدة لن تملأ ويقطع المنطقة من الاهتمام.
3. المجهر الاستعدادات
- نستخدم المجهر متحد البؤر A1Rsi نيكون مع التعديلات غير القياسية قليلة. للتصوير الخميرة نستخدم ما يصل إلى 4 أجهزة الليزر (405 نانومتر و 50 ميغاواط الليزر CUBE؛ 457-514 نانومتر، 65 ميغاواط ليزر الأرجون ايون؛ 561 نانومتر، و 50 ميغاواط ليزر الياقوت؛ و 640 نانومتر، و 40 ميغاواط الليزر CUBE)، وتصل إلى 4 فرق إدارة المشاريع PMT مجهزةالمرشحات. ويتم تصوير معظم لدينا مع مجموعة الاخضر لتصفية EGFP ومجموعة الأحمر لمرشح mCherry وtdTomato. مع GFP وmCherry هناك تقريبا أي bleedthrough، لذلك نحن غالبا ما تستخدم المسح في وقت واحد. ومع ذلك، يمكن أيضا خط المسح أن تستخدم لمنع bleedthrough عندما يحدث. كما تم تزويد لدينا مبائر مع مرحلة بيزو PInano (MCL)، التي يمكن أن تجعل 3 خطوات ميللي ثانية في Z، مما 2-3 Z-المداخن (30-50 أقسام) في الثانية الواحدة. نظم أيضا جهاز كشف الطيفي، التركيز الكمال (ليزر الأوفست)، واثنين من الماسحات الضوئية - ماسح ضوئي GALVANO وماسح ضوئي الرنانة.
- اختيار الهدف المناسب. الرئيسية الاعتبارات:
- المياه / نفط / الهواء الهدف: الاعتبار الرئيسي هو معامل انكسار الوسط التصوير مباراة وسيلة من العينة.
- المزايا النفط الهدف:
- يمكن أن أهداف النفط أعلى فتحات العددية (النفط الخفيف أكثر من فواصل المياه، وبالتالي المزيد من الفوتونات العودة إلى الهدف). يمكن أن يكون ما يصل الأهداف النفطلNA 1.49، مقابل 1.27 للمياه. (ومع ذلك، هذه ليست في الواقع تغيير كبير في القرار).
- معامل انكسار زيت مباريات معامل انكسار الزجاج، ولذلك لا يتم فقدان الفوتونات الانتقال من العينة، من خلال الزجاج، في منطقة الهدف. (ملاحظة - اختار للنفط الغمر الذي يحتوي على معامل الانكسار الذي يتناسب مع الهدف الخاص بك وساترة الخاص بك).
- النفط تمكن خالية من المتاعب طويلة زمنيا الهفوات لأنه لا تتبخر.
- ارتفاع القرار مكنت من أعلى NA الأهداف النفط يتحلل بسرعة إذا كان مصباح يضطر إلى السفر من خلال وسط مائي (مثل خلية).
- صور وعادة ما يكون أكثر الانحرافات كروية و "ممدودة" تأثير في 3D.
- النفط هو لزجة، فوضوي، وخطرا على الأهداف.
- مزايا المياه الهدف
- الخلية نفسها مائي، لذلك هناك عدد أقل من التشوهات في Z، وهوالقرار الثاني لا تزال عميقة عالية في عينة مائي.
- تنظيف وسهلة الاستعمال. عيوب الهدف المياه: يتبخر بسرعة، لذلك لا تصلح لأفلام طويلة دون ترتيبات خاصة تجري على ضخ المياه باستمرار في تحقيق الهدف.
- مزايا الهدف الهواء: 1. يتم فقدان أية مواد / يتبخر خلال اكتساب نقطة أو متعددة فيلم طويل. 2. تنظيف وسهلة الاستعمال. العيب: دقة منخفضة وانخفاض حساسية الإشارة.
- المزايا النفط الهدف:
- الغرفة ودرجة حرارة الحاضنة: درجة الحرارة المتغيرة تؤثر خصائص المسألة، ونظم في الدقيقة يغير التركيز. ينبغي تعديل درجة الحرارة قبل اختيار نقاط لاقتناء. سوف تغير درجة الحرارة خلال اقتناء تعطيل التصوير، وسوف يؤدي إلى فقدان التركيز. تركنا نظامنا المجهر لمدة 2 ساعة تتوازن في درجة الحرارة المطلوبة قبل التصوير.
- الياقات تصحيح: في العديد من الأهداف يأتي مع عصابة التصحيح تمكينإلى تعديل الهدف لسمك الغطاء زلة معينة. نوصي بتعديل طوق التصحيح أثناء استخدام الخرز الفلورسنت لتصور وظيفة انتشار نقطة. وهذا يضمن الإعدادات الصحيحة لكل عينة.
- أصحاب عينة مستقرة: نجد أن معظم أصحاب عينة متاحة تجاريا هي أضعف جزء في المجهر. فهي في كثير من الأحيان ومباشرة متهاد لا. هذا هو كارثة على الدقة العالية، متعدد نقطة 4D التصوير. نحن لدينا تصميم أصحاب عينة الخاصة التي هي على التوالي، وتناسب محكم على خشبة المسرح. يمكن أيضا أن تكون انسحب أسفل عند الحاجة.
- متعدد نقطة الشراء: تم تجهيز نظامنا التصوير مع نيكون "الكمال التركيز" النظام، الذي هو في الأساس الليزر القائمة على آلية التركيز التلقائي. ومع ذلك، ليس من الضروري autofocusing بالضرورة مع التصوير 4D، خاصة إذا كان النظام لا ينجرف الكثير.
- المياه / نفط / الهواء الهدف: الاعتبار الرئيسي هو معامل انكسار الوسط التصوير مباراة وسيلة من العينة.
4. التصوير
- تشغيل النظام: ليزر، المرحلة، تحكم، وكاميرا وكمبيوثالثا البرمجيات.
- لوحة مكان على حامل المرحلة، واستقرت المضمون بشكل صحيح.
- استخدام المنفذ العين لتحديد الموقع والتوجه من الخميرة.
- باستخدام brightfield، وتقييم الجدوى الصحية الخلية وفقا لشكل والملمس.
- بدوره على ضوء epifluorescent وفقا لfluorophore ذات الصلة (على سبيل المثال تصفية FITC GFP)، والتركيز على عرض الخلايا النمط الظاهري الذي يخضع للبحث الخاص بك. قد الخلايا التي هي نيون للغاية في أكثر من طول موجي واحد قد مات وبالتالي autofluorescent. نحن تصور النواة مع fluorophore tdTomato تنصهر إلى إشارة NLS SV40 (NLS-TFP). TFP هو ضعف حجم GFP، وبالتالي فهو فوق الحد نشر النواة، وبالتالي فإنه يعمل بشكل جيد جدا كعلامة النووية. يمكننا أيضا تثير TFP مع ليزر (488 نانومتر) في وقت واحد والأخضر GFP، ولكن جمع انبعاثات الأخضر والأحمر إلى قسمين منفصلة للفرق إدارة المشاريع PMT القرار الطيفية.
- ضبط الإعدادات التالية للحد من الضوضاءوoversaturation:
- الليزر السلطة - ينبغي النظر photobleaching والضيائية مقابل سطوع الصورة.
- كسب: حساسية الكاميرا يؤثر، بالتالي إشارة إلى نسبة الضوضاء.
- ينبغي تعديل وفقا ليزر مع طول موجة أقصر - ثقب الدبوس القطر. قطر الثقب يحدد سمك (ارتفاع) من قسم تصوير الضوئي. وبالتالي، فإن فتح ثقب الدبوس جمع مزيد من الضوء (الفوتونات في السماح لمزيد من)، ولكن القرار سوف تنخفض في Z (أقل confocality).
- نصائح مفيدة:
- إذا fluorophores مختلفة الطول الموجي تنبعث منها متطابقة، استخدام ميزة الكاشف الطيفي الذي يمكن اختيار مرشحات الظاهري. نضع في اعتبارنا أن أجهزة الكشف عن الطيفية هي أقل حساسية من فرق إدارة المشاريع PMT العادية.
- إذا نحن متحمسون fluorophores مختلفة من الليزر نفسه، استخدام ميزة المسح الضوئي الخط.
- والماسحة الضوئية تمكن أكثر حساسية GALVANO، ولكن لديها أعلى خطر للphotobleaching. A الماسح الضوئي الرنين تمكن أسرعcquisition، وبالتالي خفض خطر الإصابة photobleaching، ولكن أقل حساسية.
- في المتوسط بين 2 و 16 صور، لأنه يعزز إشارة إلى نسبة الضوضاء، ولكن يجعل اقتناء أبطأ، وبطبيعة الحال، ينطوي على مزيد من التعرض للعينة إلى الليزر.
- مدة على عملية الاستحواذ يعتمد على مسألة البيولوجية (مثل JUNQ وتشكيل IPOD يأخذ ~ 2 ساعة). وقد التقط نحن الخميرة مع الماسح الضوئي الرنانة لمدة تصل إلى 30 ساعة في الوقت الفاصل بين 3D.
- والفاصل الزمني فترات الصغر فترات عمل فيلم أكثر تماسكا ولكن قد يسبب تبييض الصورة، وبالتالي فقدان الإشارة.
النتائج
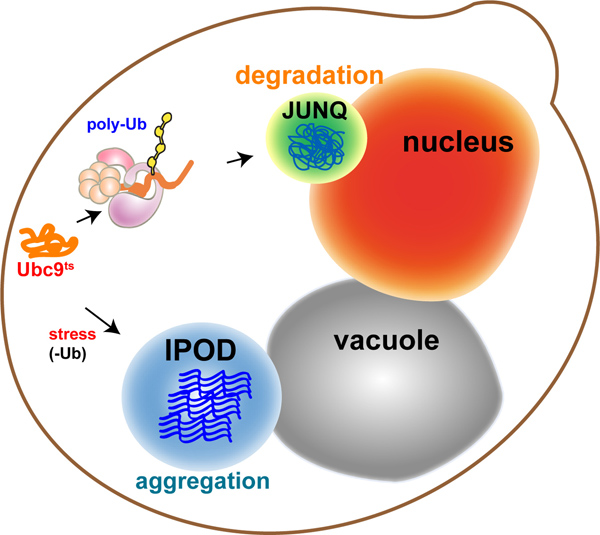
الشكل 1. نموذج: التقسيم الفرعي الخلوية للبروتينات تتجمع الجودة آلات التحكم يوجه البروتينات تتجمع في حجرات مختلفة مع وظائف مختلفة: البروتينات القابلة للذوبان، التي تستهدف تدهور، والخضوع بولي ubiquitination ويتم إرسالها إلى xta-N جو المقصورة Q uclear تحكم uality (JUNQ ). يتم إرسال البروتينات غير قابلة للذوبان التي لا يمكن عزل لحماية ubiquitinated إلى I nsoluble العلاقات العامة eposit D otein (IPOD)، المتاخمة للفجوة، حيث أنها تخضع التجميع بالموقع.
es.jpg "SRC =" / files/ftp_upload/50083/50083fig2.jpg "/>
الشكل 2. النمذجة misfolding البروتين GFP-Ubc9 مع TS. في ظل الظروف العادية، يتم طي أصلا GFP-TS Ubc9 (أخضر)، ويتم ترجمة منتشرة في العصارة الخلوية للنواة و. هو المسمى النواة من TFP-NLS (الحمراء). وأغلق التعبير عن TS Ubc9 قبالة عن طريق إضافة السكر 2٪ قبل التصوير في جميع التجارب. اضغط هنا لمشاهدتها بشكل اكبر شخصية .
- على درجة حرارة التحول إلى 37 ° C وتتجمع، GFP-TS Ubc9 (الأخضر)، وتشكل بؤر التوتر عصاري خلوي. هو المسمى النواة من TFP-NLS (الحمراء).
- بعد شفائهم من الصدمة الحرارية في C ° 23، denaturated حراريا GFP-TS Ubc9 هو المتدهورة، كما يتضح من مستوى مضان انخفضت.
- على درجة حرارة التحول الى 37 وتثبيط C ° مع proteasome 80 مم MG132، GFP-U وتتجمع bc9 TS ومعالجتها في JUNQ والادراج IPOD. هو المسمى النواة من TFP-NLS (الحمراء).
- على التحول إلى درجة حرارة 37 ° C وتثبيط ubiquitination، TS-GFP Ubc9 وتتجمع ومعالجتها في إدراج IPOD. هو المسمى النواة من TFP-NLS (الحمراء). هى overexpressed في البروتياز اليوبيكويتين 4 (Ubp4) لمنع Ubc9 ubiquitination TS.
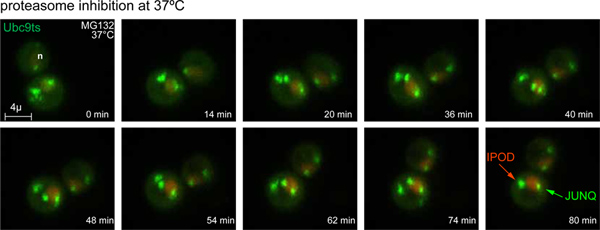
الشكل 3. الفاصل الزمني من JUNQ وتشكيل IPOD. عند درجة حرارة التحول إلى 37 ° C وتثبيط proteasome مع 80 مم MG132، تتم معالجة الإجهاد GFP-TS Ubc9 بؤر إلى JUNQ والادراج IPOD. هو المسمى النواة من TFP-NLS (الحمراء). صور تم الحصول عليها 3D على فترات دقيقة 4. (انظر أيضا الفيلم 1).com/files/ftp_upload/50083/50083fig3large.jpg "الهدف =" _blank "> اضغط هنا لمشاهدتها بشكل اكبر الرقم.
Discussion
حدسنا عن العمليات البيوكيميائية مستمدة من التجارب مقاعد البدلاء في الأعلى الذي يسمح حلا جيدا مختلطة من المواد المتفاعلة والمنتجات للوصول إلى التوازن في كوب. في مثل هذا الوضع، يمكن التعبير عن تركيز على الأنواع الكيميائية على النحو الوارد رقم واحد، الذي هو نسبة كمية من جزيئات المولي إلى وحدة تخزين العيانية. معظم ما نعرفه عن بنية البروتين وظيفة تستمد من استخدام الأساليب التي تعكس الكلاسيكية، صور رد الفعل الأكبر: البقع الغربية، centrifugations، وقياسات طيفية التي أجريت على مقتطفات من الخليط السكان كاملة من الخلايا.
وبما أن التكنولوجيا التي نستخدمها للنظر في الخلايا تحت التكبير يحسن على قدم وساق، يصبح أكثر وضوحا من أي وقت مضى أن الظروف التي معظم ردود الفعل البيوكيميائية في الجسم الحي تحدث فقط تحمل أدنى تشابه لتلك السيناريو مقاعد البدلاء الأعلى الكلاسيكية. ليس فقط هو الجزء الداخلي من سللا المزدحمة بالسكان والبيئة، والآثار التي الزحام تغيير جوهري في أنشطة مختلف المواد المتفاعلة، كما أنها على العكس تماما من مختلط أيضا. وهذا يفسر التفاوت متكررة بين في المختبر والمجراة في الكفاءة من مجموعة واسعة من ردود الفعل الجزيئات المعقدة.
في اي مكان الحدس النابعة من التجارب الكلاسيكية في المختبر الكيمياء الحيوية أكثر عرضة للتضليل كما في المسائل المتعلقة لطي في الجسم الحي، misfolding، وتجميع البروتينات. في حين أن دراسات الكيمياء البروتين في التفاعلات السائبة يمكن أن علاج قضية قابلة للطي لبروتين معين كما بنعم أو لا سؤال، يجب أن أي محاولة لتتبع ديناميات السكان كاملة من الجزيئات في خلية حية حساسة للتوزيع كاملة من الممكن نتائج بتكوين المتاحة لسلسلة ببتيد، وعلى وجه الخصوص لخطر misfolding والتجميع. على سبيل المثال، فإننا قد فحص لاي الخلية الأكبرأشبع من البروتين تجميع من غرب النشاف، وتحديد أن البروتين معظمها غير قابل للذوبان وubiquitinated لا. ومع ذلك، في الخلية الحية وشبه المنفصلة السكان من البروتين، يصعب اكتشافها عندما بلغ متوسطها أكثر من العديد من الخلايا، قد تكون قابلة للذوبان وubiquitinated في مقصورة خاصة حيث تركز المحلية من الأنواع عالية جدا. قد يكون له عواقب السيناريو الأخير أكثر أهمية من أجل بقاء الخلية أكبر من معظم شبه السكان. وعلاوة على ذلك، في حين أن المحرمين عرض مجموعة متنوعة من السلوكيات عديد المظاهر وظائف في المختبر، أصبح واضحا أن في الخلية والمكان والزمان تقتصر مهامهم منفصلة.
في النموذج الناشئ حديثا لفهم الكيمياء الحيوية، وتركيز يصبح خاصية متغير كل محددة النانو البيئة في الخلية، ويجب أن يعاير الأحداث الجزيئية التي تكمن وراء العمليات البيولوجية ليس فقط في الوقت المناسب، ولكن أيضا في SPACه. النهج التصوير 4D المقدمة هنا يمكن النمذجة الحساسة من misfolding البروتين في الخلايا الحية، على الرغم من أنها يمكن أن تستخدم لدراسة أي عدد من العمليات البيولوجية الأخرى وكيف يتم تنظيمها في الفضاء، والوقت، وبعد التغييرات في الظروف البيئية. في هذه الورقة نستخدم الاستشعار TS Ubc9 للطي، والذي يدل على فعالية المراحل والخيارات للتعامل مع بداية تجميع البروتين في العصارة الخلوية. بالإضافة إلى توضيح بيولوجيا الخلية لمراقبة الجودة التجميع، يمكن هذا النهج بمثابة أداة قوية لفك رموز تأثير الاضطرابات محددة أو الطفرات الوراثية على proteostasis (على سبيل المثال يمكن أن تستخدم لقياس Ubc9 TS الإجهاد طي البروتين استجابة للأكسدة، التعبير عن الكلي السامة، أو طفرات نوعية في مسار التحكم).
4D التصوير ضروري أيضا لتحديد بدقة الترجمة البروتين أو البروتين colocalization بين اثنين من مختلفق، وللكشف عن الظواهر التي ربما تكون عابرة ولكنها مهمة. على سبيل المثال، وخاصة في الحي كروية صغيرة مثل الخميرة، فإنه قد يبدو أن القضية التي بنية أو الكلي لديه التعريب juxtanuclear، في حين 4D التصوير قد تكشف عن أن هذا هو مجرد قطعة أثرية من زاوية التفتيش.
في التجربة سبيل المثال نقدم هنا، ونحن لشرح استخدام نموذج تتجمع البروتين، Ubc9 TS، لمتابعة التجميع مراقبة الجودة عبر الزمان والمكان في العصارة الخلوية. في درجة حرارة الإباحية، يتم طي Ubc9 TS والموزعة في النواة والعصارة الخلوية. على الحرارة التي يسببها misfolding، وأنها تشكل في البداية بسرعة نشرها الإجهاد الكلي الصغيرة بؤر التي تتم معالجتها عن تدهور proteasomal. عندما يتم جزئيا proteasome إعاقة، يتم تحويل هذه البؤر إلى الإجهاد JUNQ والادراج IPOD على مدى حوالي 2 ساعة. إذا اليوبيكويتين بوساطة تدهور غير متوفرة كخيار مراقبة الجودة، UBوعلى الفور C9 TS تغيير مسارها إلى إدراج IPOD لتجميع واقية. هذه الأدوات تتيح فرصا لا تصدق لاكتشاف العوامل الوراثية رواية المشاركة في مراقبة الجودة التجميع، واستكشاف تنظيمها المكاني والزماني في الخلية.
Disclosures
الإعلان عن أي تضارب في المصالح.
Materials
| Name | Company | Catalog Number | Comments |
| MG132 | Mercury | mbs474790 | |
| con A | Sigma | C2010 | |
| Glass bottom plates | ibidi | ibd81158 | |
| 4D Fluorescence Imaging of Protein Aggregation Confocal 3D movies were acquired using a Nikon A1R-si microscope equipped with a PInano Piezo stage (MCL), using a 60x water objective NA 1.27, 0.3 micron slices, 0.5% laser power (from 65 mW 488 laser and 50 mW 561 laser). z-stacks were acquired every 5 min for 90 min. Each z-series was acquired with 0.5 micron step size and 30 total steps. Image processing was performed using NIS-Elements software. | |||
References
- Gershenson, A., Gierasch, L. M. Protein folding in the cell: challenges and progress. Current opinion in structural biology. 21, 32-41 (2011).
- Aguzzi, A., Calella, A. M. Prions: protein aggregation and infectious diseases. Physiological reviews. 89, 1105-1152 (2009).
- Morimoto, R. I. Proteotoxic stress and inducible chaperone networks in neurodegenerative disease and aging. Genes & development. 22, 1427-14 (2008).
- Cohen, E., Dillin, A. The insulin paradox: aging, proteotoxicity and neurodegeneration. Nature reviews. Neuroscience. , (2008).
- Hershko, A., Ciechanover, A. The ubiquitin system. Annual review of biochemistry. 67, (1998).
- Tyedmers, J., Mogk, A., Bukau, B. Cellular strategies for controlling protein aggregation. Nature reviews. Molecular cell biology. 11, 777-788 (2010).
- Treusch, S., Cyr, D. M., Lindquist, S. Amyloid deposits: Protection against toxic protein species?. Cell cycle (Georgetown, Tex.). 8, 1668-1674 (2009).
- Spokoini, R., et al. Confinement to Organelle-Associated Inclusion Structures Mediates Asymmetric Inheritance of Aggregated Protein in Budding Yeast. Cell Rep. , (2012).
- Weisberg, S. J., et al. Compartmentalization of superoxide dismutase 1 (SOD1G93A) aggregates determines their toxicity. Proc Natl Acad Sci U S A. 109, 15811-15816 (2012).
- Kaganovich, D., Kopito, R., Frydman, J. Misfolded proteins partition between two distinct quality control compartments. Nature. 454, 1088 (2008).
- Betting, J., Seufert, W. A yeast Ubc9 mutant protein with temperature-sensitive in vivo function is subject to conditional proteolysis by a ubiquitin- and proteasome-dependent pathway. The Journal of biological chemistry. 271, 25790 (1996).
- Tongaonkar, P., Beck, K., Shinde, U. P., Madura, K. Characterization of a temperature-sensitive mutant of a ubiquitin-conjugating enzyme and its use as a heat-inducible degradation signal. Analytical biochemistry. 272, 263 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved