Method Article
4D изображений агрегации белков в живых клетках
В этой статье
Резюме
Сотовый жизнеспособность зависит от своевременного и эффективного управления белка неправильного сворачивания. Здесь мы опишем метод визуализации различных потенциальных судьбы неправильно упакованных белков: рефолдинг, деградации или поглощения в включений. Мы демонстрируем использование складной датчик, Ubc9 TS, Для proteostasis мониторинга и контроля качества агрегации в живых клетках с использованием 4D микроскопа.
Аннотация
One of the key tasks of any living cell is maintaining the proper folding of newly synthesized proteins in the face of ever-changing environmental conditions and an intracellular environment that is tightly packed, sticky, and hazardous to protein stability1. The ability to dynamically balance protein production, folding and degradation demands highly-specialized quality control machinery, whose absolute necessity is observed best when it malfunctions. Diseases such as ALS, Alzheimer's, Parkinson's, and certain forms of Cystic Fibrosis have a direct link to protein folding quality control components2, and therefore future therapeutic development requires a basic understanding of underlying processes. Our experimental challenge is to understand how cells integrate damage signals and mount responses that are tailored to diverse circumstances.
The primary reason why protein misfolding represents an existential threat to the cell is the propensity of incorrectly folded proteins to aggregate, thus causing a global perturbation of the crowded and delicate intracellular folding environment1. The folding health, or "proteostasis," of the cellular proteome is maintained, even under the duress of aging, stress and oxidative damage, by the coordinated action of different mechanistic units in an elaborate quality control system3,4. A specialized machinery of molecular chaperones can bind non-native polypeptides and promote their folding into the native state1, target them for degradation by the ubiquitin-proteasome system5, or direct them to protective aggregation inclusions6-9.
In eukaryotes, the cytosolic aggregation quality control load is partitioned between two compartments8-10: the juxtanuclear quality control compartment (JUNQ) and the insoluble protein deposit (IPOD) (Figure 1 - model). Proteins that are ubiquitinated by the protein folding quality control machinery are delivered to the JUNQ, where they are processed for degradation by the proteasome. Misfolded proteins that are not ubiquitinated are diverted to the IPOD, where they are actively aggregated in a protective compartment.
Up until this point, the methodological paradigm of live-cell fluorescence microscopy has largely been to label proteins and track their locations in the cell at specific time-points and usually in two dimensions. As new technologies have begun to grant experimenters unprecedented access to the submicron scale in living cells, the dynamic architecture of the cytosol has come into view as a challenging new frontier for experimental characterization. We present a method for rapidly monitoring the 3D spatial distributions of multiple fluorescently labeled proteins in the yeast cytosol over time. 3D timelapse (4D imaging) is not merely a technical challenge; rather, it also facilitates a dramatic shift in the conceptual framework used to analyze cellular structure.
We utilize a cytosolic folding sensor protein in live yeast to visualize distinct fates for misfolded proteins in cellular aggregation quality control, using rapid 4D fluorescent imaging. The temperature sensitive mutant of the Ubc9 protein10-12 (Ubc9ts) is extremely effective both as a sensor of cellular proteostasis, and a physiological model for tracking aggregation quality control. As with most ts proteins, Ubc9ts is fully folded and functional at permissive temperatures due to active cellular chaperones. Above 30 °C, or when the cell faces misfolding stress, Ubc9ts misfolds and follows the fate of a native globular protein that has been misfolded due to mutation, heat denaturation, or oxidative damage. By fusing it to GFP or other fluorophores, it can be tracked in 3D as it forms Stress Foci, or is directed to JUNQ or IPOD.
протокол
1. Дрожжевые препараты
- Преобразование штаммов дрожжей с плазмидой, несущей GAL1-GFP-Y68L (Ubc9 TS) кассеты.
- Рост дрожжей на синтетических средах, содержащих 2% раффиноза в течение 24 ч и обратно разбавляют до 2% галактозы содержащий средства массовой информации в течение 16 часов или O / N. Инкубируйте клетки при 30 ° C при встряхивании со скоростью 200 оборотов в минуту.
- На следующее утро, разбавить запросе напрягаться, чтобы OD 600 = 0,2. Встряхните в течение 4-6 часов при температуре 30 ° C (200 мин), пока культура достигает OD 600 = 0,8-1,0.
- Чтобы подавить выражение (так, чтобы следить только за уже переведены и сложить пул GFP-Ubc9 TS), изменение средств массовой информации к синтетической среде с добавлением 2% глюкозы (SD) 30 мин до визуализации.
- Лечение - теплового шока клеток в течение 20 мин при 37 ° C, чтобы вызвать неправильного сворачивания или непрерывно в микроскоп инкубатор следовать агрегации белков в теплового шока условиях. Примечание - если вы используете микроскопом при любой температуре выше комнатной температуры предварительного нагрева лг около 2 часов, чтобы уравновесить температуры вдоль тела микроскопа и целей (см. ниже).
2. Плита \ Презентация подготовка
- Выберите соответствующую пластину. Основным фактором является способность сохранять фокус во время съемки изображений. Следующие пункты являются критическими для 4D визуализации, а не для 2D упущения времени или 3D-изображений.
- Несколько скважин пластинчатые в нижней части разных скважин не могут быть однородными (т.е. скважин будет на разной высоте по отношению к цели). Это позволит сделать его трудно поддерживать внимание на пункты ху и моменты времени, независимо от автофокусировки техника используется.
- Презентация материал: стекло против пластика. Со стеклянным дном слайды более Z-однородной между скважинами, но стоят дороже.
- Толщина нижней плиты: мы обычно используем покровное-днища индексом 1,5, а индекс 1 также приемлемо в зависимости от цели.
- Covэ нижней части пластины \ слайд с ConA (0,25 мг / мл) в течение 10 мин. ConA используется придерживаться клеток на слайд, который позволяет после однократной клетки с течением времени.
- Удалить ConA и инкубировать слайд в химической капот так, что избыток ConA будет испаряться.
- Плита 200 мкл образцов дрожжей (OD 600 = 0,5) в ConAed хорошо.
- Инкубировать в течение 15 мин, чтобы позволить клеткам прилипать к поверхности пластины.
- Извлечение среды, и мыть три раза с новой средой, чтобы получить один слой клеток. Примечание: если долго промежуток времени Планируется, семена клетки редко, так что новые бутоны не будет заполнить и прервать области интереса.
3. Микроскоп подготовка
- Мы используем Nikon A1Rsi конфокальной микроскопии с несколько нестандартной модификации. Для дрожжей изображения мы используем до 4 лазеры (405 нм, 50 мВт CUBE лазер, 457-514 нм, 65 мВт аргоновый ионный лазер, 561 нм, 50 мВт сапфировый лазер и 640 нм, 40 мВт CUBE лазером), и до 4 ФЭУ оснащеныфильтры. Большинство наших изображения осуществляется с зеленым набор фильтров для EGFP и красный набор фильтров для mCherry и tdTomato. С GFP и mCherry почти нет bleedthrough, поэтому мы часто используют одновременное сканирование. Тем не менее, линейного сканирования также может быть использован для предотвращения bleedthrough, когда это произойдет. Наши конфокальной также оснащен этап PInano Piezo (MCL), который может сделать 3 мс шагами по г, что позволит 2-3 г-стеков (30-50 секций) в секунду. Система также имеет спектральный детектор, Perfect Focus (лазерная смещение), и двух сканеров - сканер гальвано и резонансным сканером.
- Выберите соответствующие цели. Основные рекомендации:
- Вода / масло / воздух цели: основная фактором является показатель преломления изображений средних против среднего образца.
- Преимущества масла цели:
- Нефть цели могут иметь более высокие числовые апертуры (нефть перерывов света больше, чем воды, и, следовательно, больше фотонов вернуться к цели). Нефть цели может иметь доН.А. 1,49, по сравнению с 1,27 для воды. (Впрочем, это не на самом деле огромная разница в разрешении).
- Показатель преломления масла соответствует показателю преломления стекла, поэтому нет фотонов теряется переходе от образца, через стекло, к цели. (Примечание - выбрал иммерсионного масла, которое имеет показатель преломления, который подходит для ваших целей и вашей покровное).
- Масло позволяет без проблем долгое время, упущения, поскольку он не испарится.
- Чем выше разрешение включено более высокой NA нефти цели деградирует быстрее, если свет должен проходить через водную среду (например, клетки).
- Изображения обычно имеют больше сферические аберрации и "протянул" эффекта в 3D.
- Нефть является липким, грязным и опасным для целей.
- Преимущества Вода цели
- Сама клетка представляет собой водный раствор, поэтому есть меньше искажений в г,го разрешения остается высоким глубоко в водном образце.
- Очистите и дружественным к пользователю. Вода цели недостатки: быстро испаряется, поэтому не подходит для долгого фильмов без специальных соглашений к тому, чтобы откачивать воду непрерывно в цель.
- Air объективных преимуществ: 1. Нет материала потерянных / испаряется в течение нескольких приобретение точку или длинный фильм. 2. Очистите и дружественным к пользователю. Недостатки: низкое разрешение и низкую чувствительность сигнала.
- Преимущества масла цели:
- Номер и инкубатор температуры: изменение температуры влияет на свойства материи, а в тонких системах меняет фокус. Температура должна быть скорректирована перед выбором пунктов для приобретения. Изменение температуры во время сбора будут нарушать изображений и приведет к потере фокуса. Мы позволяем нашим микроскопом системы равновесия в течение 2 часов в нужной температуры перед изображениями.
- Коррекция воротники: Многие приходят с целями коррекции кольцо позволяетЦелью быть скорректированы для данного покровное стекло толщиной. Мы рекомендуем изменять коррекции воротник при использовании флуоресцентных бусин для визуализации функции точки распространения. Это будет гарантировать правильные настройки для каждого образца.
- Стабильный держатели для образцов: мы обнаружили, что большинство имеющихся в продаже держатели образца являются самым слабым звеном микроскопа. Они часто являются шаткими, а не прямо. Это катастрофа для высокого разрешения, многоточечная 4D визуализации. Мы разрабатываем наши собственные держатели для образцов, которые прямо и плотно на сцену. Они также могут быть болтами вниз, когда это необходимо.
- Multi-точка приобретения: наша система визуализации оснащена Nikon "Perfect фокус" система, которая представляет собой лазерный автофокус механизм. Тем не менее, автофокусировка не обязательно необходимым с 4D визуализации, особенно если система не плыть по течению много.
- Вода / масло / воздух цели: основная фактором является показатель преломления изображений средних против среднего образца.
4. Изображениями
- Включите систему: лазеры, этап, контроллер, камера и COMPUтер программного обеспечения.
- Место пластины на этапе держатель, надежно закреплены и стабилизировалась.
- Используйте глаз порт, чтобы определить местоположение и ориентацию дрожжей.
- Использование светлого, оценки здоровья и жизнеспособности клетки в соответствии с формой и текстурой.
- Включите epifluorescent света в соответствии с соответствующими флуорофора (например, FITC фильтр для GFP), и сосредоточиться на клетки отображения фенотипу, являющемуся предметом вашего исследования. Клетки, которые очень флуоресцентные более чем в одной длины волны может быть мертв и, следовательно, аутофлуоресцентной. Мы представляем ядра с флуорофором tdTomato слит с сигналом SV40 NLS (NLS-TFP). TFP в два раза превышает размер GFP, и, следовательно, выше диффузии предел ядра, поэтому он работает очень хорошо в качестве ядерного маркера. Мы также можем возбуждать TFP с зеленой (488 нм) лазера одновременно как GFP, но собирать зеленые и красные выбросы в два отдельных ФЭУ для спектрального разрешения.
- Настройте следующие параметры для минимизации шумаи перенасыщенность:
- Мощность лазера - фотообесцвечивания и фототоксичности против яркость изображения должны быть рассмотрены.
- Усиление: влияет на чувствительность камеры, таким образом, соотношение сигнал-шум.
- Пинхол диаметр - должны быть скорректированы в соответствии с лазер с более короткой длиной волны. Отверстие диаметром определяет толщину (высоту) оптической части образа. Таким образом, открывая отверстие будет собирать больше света (пусть больше фотонов в), но будет снижаться разрешение в г (менее конфокальности).
- Полезные советы:
- Если разные флуорофоров излучают волны конгруэнтны, используйте функцию спектрального детектора, который дает возможность выбора виртуальных фильтров. Имейте в виду, что спектральные детекторы менее чувствительны, чем обычные ФЭУ.
- Если разные флуорофоров в восторге от того же лазера, использовать функцию строчной развертки.
- Сканер позволяет Galvano большей чувствительностью, но имеет более высокий риск для фотообесцвечивания. Резонансный сканер позволяет быстрееcquisition, тем самым снижая риск фотообесцвечивания, но менее чувствительной.
- Усреднение от 2 до 16 фотографий, он усиливает сигнал-шум, но делает приобретение медленнее и, конечно же, включает в себя более воздействии на образец лазера.
- Срок приобретения, зависит от биологических вопрос (например JUNQ и IPOD образование занимает ~ 2 часа). Мы отображаемого дрожжи с резонансного сканера до 30 часов в 3D замедленной.
- Временной интервал интервалом-меньшие интервалы создаст более согласованную фильм, но может привести к фото отбеливания и, следовательно, потери сигнала.
Результаты
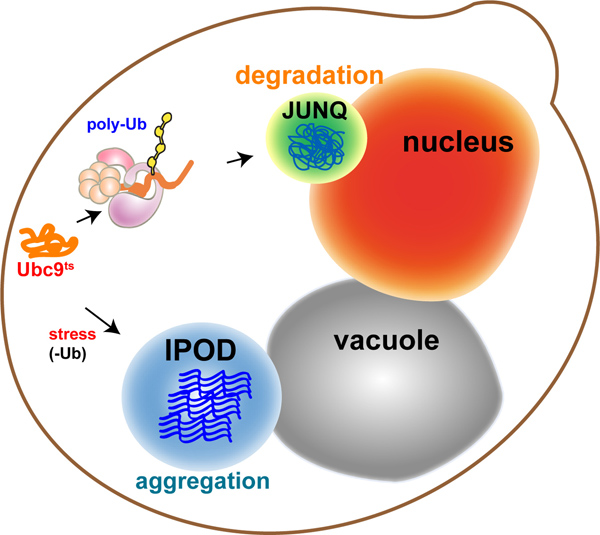
Рисунок 1. Модель:. Субклеточном изолированность неправильно упакованных белков механизмы контроля качества направляет неправильно свернутых белков на отдельные отсеки с различными функциями: растворимых белков, предназначенных для деградации, проходят поли-убиквитинирования и отправляются на Ju XTA-N uclear Q uality отсеке управления (JUNQ ). Нерастворимые белки, которые не могут быть убиквитинированных направляются на защитные поглощения в I nsoluble Pr otein D eposit (IPOD), прилегающие к вакуоль, где они подвергаются активной агрегации.
es.jpg "SRC =" / files/ftp_upload/50083/50083fig2.jpg "/>
Рисунок 2. Моделирование неправильного фолдинга белков с GFP-Ubc9 TS. При нормальных условиях, GFP-Ubc9 TS (зеленый) изначально сложены, и локализован диффузно в ядре и цитозоле. Ядро помечены NLS-TFP (красный). Выражение Ubc9 TS был отключен добавлением 2% глюкозы перед изображениями во всех экспериментах. Нажмите, чтобы увеличить показатель .
- После сдвига температуры до 37 ° C, GFP-Ubc9 TS (зеленый) неправильно свернутых и образует цитозольного Очаги стресса. Ядро помечены NLS-TFP (красный).
- После восстановления от теплового шока при 23 ° C, термической денатурации GFP-Ubc9 TS ухудшается, о чем свидетельствует снизился уровень флуоресценции.
- После сдвига температуры до 37 ° С и торможения протеасома с 80 мм MG132, GFP-U bc9 ТС неправильно свернутых и перерабатывается в JUNQ и IPOD включений. Ядро помечены NLS-TFP (красный).
- После сдвига температуры до 37 ° С и убиквитинирования торможения, GFP-Ubc9 ТС неправильно свернутых и перерабатывается в IPOD включения. Ядро помечены NLS-TFP (красный). Убиквитин протеазы 4 (Ubp4) избыточно экспрессируется, чтобы заблокировать Ubc9 TS убиквитинирования.
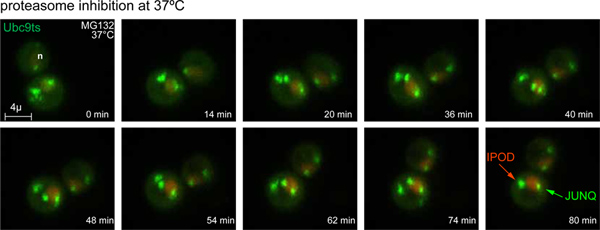
Рисунок 3. Время истечения JUNQ и IPOD образования. После сдвига температуры до 37 ° C и протеасомной торможение с 80 мм MG132, GFP-Ubc9 Очаги TS Стресс перерабатывается в JUNQ и IPOD включений. Ядро помечены NLS-TFP (красный). 3D-изображения были приобретены на 4 интервалов мин. (См. также фильм 1).com/files/ftp_upload/50083/50083fig3large.jpg "целевых =" _blank "> Щелкните здесь для просмотра больших фигура.
Обсуждение
Наша интуиция о биохимических процессах происходят от настольных экспериментах, в которых хорошо смешанный раствор реагентов и продуктов позволило достичь равновесия в стакан. В таких условиях, концентрация данного вида химического вещества могут быть выражена в виде одного числа, которое представляет собой отношение молярной количество молекул в макроскопическом объеме. Многое из того, что мы знаем о структуре и функции белков происходит от использования методов, которые отражают классический, навалочных картина реакции: вестерн-блоттинга, центрифугирования, и спектрофотометрического измерения проводились на выдержки из гомогенатах целых популяций клеток.
Поскольку технологии мы используем, чтобы посмотреть на клетки под увеличением улучшается не по дням, а по часам, она становится все яснее, что условия, в которых большинство биохимических реакций происходят в естественных условиях несут только малейшее сходство с теми классический сценарий верхней скамейке. Не только интерьер челла плотно упакованных среды, в которой вытеснение эффекты существенно изменить деятельность различных реагентов, но и наоборот хорошо смешанные. Этим объясняется частое несоответствие в пробирке и в естественных эффективность широкого спектра сложных реакций макромолекул.
Нигде интуиции, вытекающие из классического в пробирке биохимических экспериментах более склонны вводить в заблуждение, как и в вопросах, касающихся в естественных условиях складывающиеся, неправильного сворачивания и агрегации белков. В то время как исследования белков химии в натуральном реакции могут рассматривать вопрос спинка для данного белка, просто да или нет вопрос, любая попытка проследить динамику всего населения макромолекул в живой клетке должен быть чувствительным к целому распределение возможных конформационные результаты доступны для полипептидной цепи и, в частности, риск неправильного сворачивания и агрегации. Например, мы могли бы рассмотреть объемную ют клеткинасытить агрегирующего белков методом вестерн-блоттинга, и определить, что белок в основном нерастворимы и не убиквитинированных. Тем не менее, в живой клетке дискретных групп населения белка, трудно обнаружить при усреднении по многим клеткам, могут быть растворимыми и убиквитинированных в конкретном отделении, где местная концентрация видов чрезвычайно высока. Последний сценарий может иметь более серьезные последствия для жизнеспособности клеток, чем больше масса групп населения. Кроме того, в то время как сопровождающие отображать различные плейотропным поведение и функции в пробирке, становится очевидным, что в клетках их дискретных функций во времени и пространстве ограничен.
В формирующейся новой парадигмы для понимания биохимии, концентрация становится переменной свойства каждого конкретного нано-среды в клетку, и молекулярных событий, которые лежат в основе биологических процессов должны быть проанализированы не только во времени, но и в SPACе. Подход 4D визуализации, представленные здесь позволяет чувствительной моделирования белков неправильного сворачивания в живых клетках, хотя она может быть использована для изучения любого количества других биологических процессов и как они регулируются в пространстве, времени, и после изменения условий окружающей среды. В данной работе мы используем Ubc9 TS складывающиеся датчик, который эффективно демонстрирует этапы и варианты борьбы с наступлением агрегации белков в цитозоле. В дополнение к иллюстрирующих клеточной биологии контроля качества агрегации, этот подход может служить мощным инструментом для расшифровки эффекта конкретного возмущения или генетических мутаций на proteostasis (например Ubc9 TS может быть использован для измерения сворачивания белков стресса в ответ на окисление, выражение токсичных совокупности, или мутации в пути управления качеством).
4D изображений также имеет важное значение для точного определения локализации белка или колокализации двух разных белковс, а для обнаружения явлений, которые, возможно, быть временными, но важный. Например, особенно в небольших сферических организма, таких как дрожжи, оно может оказаться так, что структура или агрегат имеет juxtanuclear локализации, в то время как 4D изображений может показать, что это просто артефакт от угла осмотра.
В примере эксперимента мы представляем здесь, мы демонстрируем использование модели неправильно свернутых белков, Ubc9 TS, следовать агрегации контроля качества во времени и пространстве в цитозоле. На допустимая температура, Ubc9 TS складывается и распространяется в ядре и цитозоле. По тепло-индуцированной неправильного сворачивания, он изначально формирует быстро диффундирующего небольшой совокупный стресс очаги, которые обрабатываются для протеасомной деградации. Когда протеасома частично подавляется, эти очаги напряжения преобразуются в JUNQ и IPOD включения в течение примерно 2 часов. Если убиквитин-опосредованного деградации не доступна в качестве опции контроля качества, Ubc9 TS сразу же перенаправляются на IPOD включение защитных агрегации. Эти инструменты предлагают невероятные возможности открыть для себя новые генетические факторы, связанные с контролем качества агрегации, а также изучить их пространственных и временных регулирования в клетке.
Раскрытие информации
Нет конфликта интересов объявлены.
Материалы
| Name | Company | Catalog Number | Comments |
| MG132 | Mercury | mbs474790 | |
| con A | Sigma | C2010 | |
| Glass bottom plates | ibidi | ibd81158 | |
| 4D Fluorescence Imaging of Protein Aggregation Confocal 3D movies were acquired using a Nikon A1R-si microscope equipped with a PInano Piezo stage (MCL), using a 60x water objective NA 1.27, 0.3 micron slices, 0.5% laser power (from 65 mW 488 laser and 50 mW 561 laser). z-stacks were acquired every 5 min for 90 min. Each z-series was acquired with 0.5 micron step size and 30 total steps. Image processing was performed using NIS-Elements software. | |||
Ссылки
- Gershenson, A., Gierasch, L. M. Protein folding in the cell: challenges and progress. Current opinion in structural biology. 21, 32-41 (2011).
- Aguzzi, A., Calella, A. M. Prions: protein aggregation and infectious diseases. Physiological reviews. 89, 1105-1152 (2009).
- Morimoto, R. I. Proteotoxic stress and inducible chaperone networks in neurodegenerative disease and aging. Genes & development. 22, 1427-14 (2008).
- Cohen, E., Dillin, A. The insulin paradox: aging, proteotoxicity and neurodegeneration. Nature reviews. Neuroscience. , (2008).
- Hershko, A., Ciechanover, A. The ubiquitin system. Annual review of biochemistry. 67, (1998).
- Tyedmers, J., Mogk, A., Bukau, B. Cellular strategies for controlling protein aggregation. Nature reviews. Molecular cell biology. 11, 777-788 (2010).
- Treusch, S., Cyr, D. M., Lindquist, S. Amyloid deposits: Protection against toxic protein species?. Cell cycle (Georgetown, Tex.). 8, 1668-1674 (2009).
- Spokoini, R., et al. Confinement to Organelle-Associated Inclusion Structures Mediates Asymmetric Inheritance of Aggregated Protein in Budding Yeast. Cell Rep. , (2012).
- Weisberg, S. J., et al. Compartmentalization of superoxide dismutase 1 (SOD1G93A) aggregates determines their toxicity. Proc Natl Acad Sci U S A. 109, 15811-15816 (2012).
- Kaganovich, D., Kopito, R., Frydman, J. Misfolded proteins partition between two distinct quality control compartments. Nature. 454, 1088 (2008).
- Betting, J., Seufert, W. A yeast Ubc9 mutant protein with temperature-sensitive in vivo function is subject to conditional proteolysis by a ubiquitin- and proteasome-dependent pathway. The Journal of biological chemistry. 271, 25790 (1996).
- Tongaonkar, P., Beck, K., Shinde, U. P., Madura, K. Characterization of a temperature-sensitive mutant of a ubiquitin-conjugating enzyme and its use as a heat-inducible degradation signal. Analytical biochemistry. 272, 263 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены