Method Article
عالية الإنتاجية التعبير الكمي فحص وتنقية تطبق على المؤتلف ثاني كبريتيد الغنية البروتينات السم المنتجة في
In This Article
Summary
يوصف بروتوكول للكمية، وارتفاع الإنتاجية التعبير فحص وتنقية التحليلية من البروتينات الانصهار من الثقافات على نطاق صغير القولونية وتطبيقه على التعبير عن أهداف البروتين المركب من السم حيوان ثاني كبريتيد الغنية.
Abstract
الإشريكية القولونية (E. كولاي) هو النظام الأكثر استخداما على نطاق واسع التعبير لإنتاج البروتينات المؤتلف للدراسات الهيكلية والوظيفية. ومع ذلك، وتنقية البروتينات يشكل تحديا في بعض الأحيان منذ يتم التعبير عن العديد من البروتينات في شكل غير قابل للذوبان. عند العمل مع الاهداف الصعبة أو متعددة لذلك ينصح باستخدام إنتاجية عالية (بالمشاركه) فحص البروتين التعبير على نطاق صغير (1-4 مل الثقافات) لتحديد الظروف بسرعة للتعبير قابلة للذوبان. للتعامل مع مختلف برامج الجينوميات الهيكلية للمختبر، والكمية (ضمن مجموعة من ،1-100 ملغم / لتر ثقافة البروتين المؤتلف) ونفذ البروتين بالمشاركه بروتوكول الفحص التعبير والتحقق من صحتها على الآلاف من البروتينات. تم الآلي البروتوكولات مع استخدام الروبوت التعامل مع السائل ولكن يمكن أيضا إجراء يدويا بدون المعدات المتخصصة.
تكتسب البروتينات السم، ثاني كبريتيد الغنيةاعتراف متزايد لإمكاناتهم كما يؤدي العقاقير العلاجية. يمكن أن تكون قوية للغاية وانتقائية، ولكن شبكات السندات ثاني كبريتيد المعقدة التي جعلها صعبة لإنتاج. كعضو في مشروع FP7 Venomics الأوروبية ( www.venomics.eu )، التحدي الذي يواجهنا هو تطوير استراتيجيات الإنتاج الناجحة بهدف إنتاج الآلاف من البروتينات السم الرواية لتوصيف وظيفي. بمساعدة من خصائص الأكسدة من السندات ثاني كبريتيد مصاوغة DsbC، ونحن تكييفها خط الانتاج بالمشاركه دينا للتعبير عن أكسدة، الببتيدات السم وظيفية في E. السيتوبلازم القولونية. البروتوكولات تنطبق على إنتاج البروتينات ثاني كبريتيد الغنية المتنوعة أيضا. نحن هنا لشرح خط أنابيب لدينا تطبيقها على إنتاج البروتينات الحيوانية السم. مع بروتوكولات الموصوفة هنا فمن المرجح التي سيتم الحصول عليها بروتينات قابلة للذوبان في ثاني كبريتيد الغنية اقل من أسبوع. حتى من نطاق صغير، هناك احتمال لاستخدام اله تنقية البروتينات للتحقق من صحة وحالة الأكسدة بواسطة مطياف الكتلة، لتوصيف في الدراسات التجريبية، أو لفحوصات الحساسة الدقيقة.
Introduction
بدافع النهوض الجينوميات وتسارع معدل اكتشاف بروتينات جديدة، تم تطوير خطوط الأنابيب إنتاجية عالية ليوازي الأساليب التقليدية لفحص وتحديد استراتيجيات إنتاج البروتين الأمثل. وتشمل المتغيرات المحتملة ليكون الأمثل، ولكن ليس على سبيل الحصر، سلالات متفاوتة التعبير 1،2، 3،4 درجة الحرارة، ووسائل الإعلام 2،3، الهدف المتغيرات 5، شركاء الانصهار 6-13، وشارك في التعبير مع المحرمين 14،15، هيولي أو محيط بالجبلة التعبير 16-18، والعازلة تنقية مكونات 3. من خلال تنفيذ النهج إنتاجية عالية، العديد من المتغيرات أو العديد من الأهداف يمكن اختبار بالتوازي مع مستوى عال من الكفاءة، مع الحد من التباين دفعة إلى دفعة. في تجربتنا، كما يعطي استراتيجية استنساخ جيدة على نطاق المتابعة باستخدام نفس الثقافة (درجة الحرارة، ووسائل الإعلام، التهوية، الخ) والظروف تنقية (نفس ريسين، ومخازن، وغيرها). وقد استخدمت العديد من منصات إنتاجية عالية في العقد الماضي لتحديد الظروف الملائمة لذوبان البروتين التعبير، أي من خلال المعلمات متفاوتة مثل الشركاء الانصهار، والسلالات التعبير أو درجة حرارة 19-23.
كنا مؤخرا نهجنا فحص إنتاجية عالية للتعبير عن ذوبان في ثاني كبريتيد الغنية البروتينات 11. كانت البروتينات المحددة ليس فقط من مصادر السامة، ولكن شملت أيضا مثبطات انزيم ثاني كبريتيد الغنية من مجموعة واسعة من الأنواع بما في ذلك النباتات والخنازير والأبقار والبشر. مقارنة التجربة آثار 12 شركاء الانصهار مختلفة وثلاث سلالات مختلفة التعبير على الذوبان وقابلة للطي من 28 البروتينات شبكية ثاني كبريتيد. أثبتنا أن استخدام DsbC كشريك الانصهار للإنتاج في BL21 سلالة (DE3) pLysS outproduced إلى حد كبير (في كل من المحصول وعدد من البروتينات القابلة للذوبان التي تم الحصول عليها) أي تركيبة أخرى من سلالة والانصهار اختبار 11. النتائج هذه التجربة شكلت الأساس للتكيف لدينا خط أنابيب الأصلي إنتاجية عالية عموما (والتي تم استخدامها لفحص التعبير عن مجموعة واسعة من البروتينات) 22،24 في واحدة أكثر ملاءمة للتعبير عن أهداف ثاني كبريتيد الغنية. البروتينات ثاني كبريتيد الغنية من السموم الحيوانية ذات أهمية خاصة. السموم هي خليط معقد من الببتيدات النشطة بيولوجيا والبروتينات، مع القيمة المحتملة عقاقيري وعلاجيا. ومع ذلك، التعبير عن ثاني كبريتيد البروتينات المحتوية على السندات ليست تافهة. تحتوي هذه البروتينات عادة ما بين 1-7 السندات ثاني كبريتيد، ويجب أن تتأكسد مع أنماط ثاني كبريتيد-الترابط الصحيح من أجل أن تكون نشطة. حاليا، يتم استخدام منصة لفحص التعبير عن عدد كبير من البروتينات الحيوانية السم ثاني كبريتيد الغنية كجزء من المشروع الأوروبي FP7 VENOMICS (www.venomics.eu) والقياس بروتوكولات الرواية للتعبير إنتاجية عالية الآلاف من الأهداف . هنا، أسلوب مؤتمتوتقدم لإنتاجية عالية الصغيرة الفرز التعبير وتنقية (انظر الشكل 1) تطبق على ثاني كبريتيد الغنية البروتينات الحيوانية السم. استراتيجية ثاني كبريتيد الببتيدات والبروتينات الغنية يستخدم علامة HIS لتنقية والشريك الانصهار الأكسدة الفعالة، DsbC، وخلق شطورة اندماج HIS-DsbC إلى البروتينات المستهدفة (انظر الشكل 2).
في حين أن التركيز من البروتوكولات هو أتمتة هنا باستخدام السائل التعامل مع الروبوت وبالمشاركه الكهربائي، وهذه الأساليب هي أيضا مناسبة عن دليل نهج إنتاجية عالية، وهذا يعني أنه حتى مع مختبرات الإعداد الأساسي يمكن الاستفادة من البروتوكولات دون أي شرط مسبق لمعدات باهظة الثمن . وقد نشرت البروتوكولات دليل للتحول إلى تنقية وتحليل (ليست محددة لبروتينات ثاني كبريتيد الغنية) في أي مكان آخر و24 لن تتكرر هنا. مرت من الإجراء اليدوي (من استنساخ التعبير، التي تنتجها recombiالاستنساخ الوطني 25، لتحليل مستويات البروتين للذوبان) 96 (باستخدام الكشف SDS-PAGE) أو 384 (4 × 96، واستخدام لطخة نقطة وSDS-PAGE 26) الثقافات في الأسبوع (انظر الشكل 1). هذا ويمكن زيادة إذا أجريت بطريقة شبه الآلي (باستخدام الروبوت التعامل مع السائل وصمة عار نقطة أو 26 بالمشاركه الكهربائي، كما هو الحال مع نظام الفرجار GXII LabChip 22 لتحليل النتائج) لتصل إلى 1،152 (12 × 96) الثقافات بالتوازي أكثر من أسبوع واحد، كما هو موضح هنا. يتم إجراء زراعة في بئر عميقة 24 (DW24) شكل بحيث حاضنات تهز العادية يمكن استخدامها على النقيض من الثقافات التي تزرع في بئر عميقة 96 (DW96) شكل، والتي تستلزم استخدام قصيرة المدارية حاضنات عالية السرعة تهتز للتهوية كافية (الهز في 800 دورة في الدقيقة). استخدام وسائل الإعلام لصناعة السيارات في الحث 27 أيضا يبسط التعبير، والقضاء على خطوة الاستقراء دليل. حتى عندما تستخدم بالفعل مختبرات التعبير وبوري محددة مسبقاشروط fication، وهذه يمكن نقلها مباشرة إلى هذا النظام بالمشاركه ببساطة لتحسين الكفاءة. ويرد تخطيطي مفصل للأنابيب فحص إنتاجية عالية للبروتينات ثاني كبريتيد الغنية في الشكل 3. تم تحديد المعلمات في خط أنابيب استنادا إلى تجارب واسعة الفرز 11، 22، الأمر الذي سمح لنا لاختيار الظروف الأكثر فائدة للإنتاج البروتين.
توصيف يمكن أن يؤديها على البروتينات الموسومة تنقية مباشرة من التعبيرات الصغيرة في دراسات تجريبية حيث عشرات ميكروغرام من عينة كافية، أو لفحوصات وظيفية حساسة وفحوصات ملزمة (على سبيل المثال، نظم انخفاض حجم بالمشاركه التصحيح المشبك 28). لا يمكن للنفس حتى يتم تنفيذ أهداف على معلم بعد الانقسام، شريطة أن يتم إزالة علامة والبروتيني (على سبيل المثال، من خلال عكس المرحلة HPLC). ويمكن أيضا لمراقبة الجودة أن يقوم بها مطياف الكتلة (للتأكد من حجم المتوقع والأكسدة الحادي وأكلت) أو طرق الكروماتوغرافي (لتأكيد نقاء أو عدم التجانس) 29. في بعض الأحيان علامة الانقسام غير ضروري أو حتى مرغوب فيه (ولا سيما بالنسبة للبروتينات قابلة للذوبان ضعيفة 30،31)، لذلك في هذا الانقسام بروتوكول اختياري. بغض النظر، في جميع بنيات هناك TEV البروتيني انشقاق موقع (ENLYFQ / [G] 32) التي سبقت مباشرة الجين المستهدف لإنتاج البروتين الأصلي بعد الانقسام (انظر الشكل 2 ومناقشة). إذا كان المطلوب الانقسام العلامة الانصهار، ويمكن اختبار الانقسام (على الكسر أو شطف "على عمود ') في نطاق صغير لتحليل الكفاءة، وتحسين الظروف إذا لزم الأمر والحصول على تقديرات موثوقة للعائدات للتجارب نطاق المتابعة اللاحقة.
هناك خياران لحجم حبات استخدمت خلال تنقية تقارب، تبعا لأهداف وتطلعات التجربة. لتكون قادرة على التقاط أكبر قدر ممكن من البروتين (لتنقية لفحوصات تجريبية أو MS، أو لextrapolيأكلون الغلة النطاق متابعة) وينبغي أن تستخدم الحجم النهائي من 200 ميكرولتر من الراتنج، مما يتيح الكشف عن البروتينات القابلة للذوبان في مجموعة من 1-100 ملغ / لتر الثقافة قبل تشبع النظام (انظر بروتوكول (A) في القسم 8.1) . ومع ذلك، إذا كان الهدف من هذه التجربة هو الكشف عن كميات قليلة من البروتينات القابلة للذوبان ثم الحجم النهائي من 50 ميكرولتر من الراتنج هو مناسب، مما يسمح للكشف عن البروتين للذوبان في حدود 0،1 حتي 25 ملغ / لتر الثقافة (انظر البروتوكول (B ) في القسم 8.2).
يمكن زيادتها إنتاج ما يصل، إذا لزم الأمر، للحصول على كميات مليغرام من الأهداف تنقيته لمزيد من الدراسات البنيوية والوظيفية باستخدام الظروف المحددة للتعبير قابلة للذوبان. وقد نوقشت تفاصيل البروتوكولات المستخدمة على نطاق والمتابعة في أماكن أخرى AFMB 22،24.
مزيد من التفاصيل ذات الصلة الإعداد التجريبية، الخطوات الحاسمة في البروتوكول، وتقدم التعديلات وإصلاح الأعطال والقيود المفروضة على التقنية في القرصussion. يرجى قراءة المناقشة قبل بدء التجارب.
في جميع أنحاء بروتوكولات نتوقع نسبة نجاح 90٪ في كل خطوة (على سبيل المثال، لا يقل عن 90٪ من الثقافات يجب أن تنمو في أي خطوة معينة). إذا كان معدل نجاح أي خطوة في التجربة يسقط أقل من 90٪ يتم تجاهل العينات ويتم تكرار التجربة لمجموعة كاملة من بنيات. ومع ذلك، وهذا معدل نجاح لا ينطبق على عدد من البنى التي تعبر عن البروتينات القابلة للذوبان مثل أو نسبة التركيبات التي يلتصق بكفاءة 100٪، وهذا سوف تعتمد بشكل كبير على البروتينات التي تم اختبارها.
يتم تقديم تفاصيل محددة لمجموعة المتابعة من المنضدة روبوت لكل بروتوكول (أيضا انظر الشكل 4)، إلا أنها يمكن تكييفها على النحو المطلوب لالمنضدة بديل مجموعة عمليات. الأجهزة الروبوت (TECAN) ويتكون من ذراع 96-الأقنية (MCA96)، مناور الروبوتية (الغجر) و8 قنوات الرأس مناولة السائل (يحة). ويمكن أيضا الاستفادة من جميع الخطوات MCA96 أن يؤديها باستخدام يحة إذا كان MCA96 غير متوفرة، إلا أنها ستستغرق وقتا أطول لأن يحة سوف تحتاج إلى أن تغسل بين الخطوات. في حين أن الروبوت هو تقنيا ليس بيئة معقمة، وإدراج المضادات الحيوية عموما يضمن أنه لا توجد مشاكل مع التلوث أو العقم.
Protocol
الجزء ألف: التحول واختبار التعبير
وتناقش الإجراءات اليدوية لاستنساخ 22 والتحول إلى تنقية مكان آخر 24. بروتوكول التحول لا يمكن أن يؤديها بشكل كامل على الروبوت 26 ولكنه عادة ما يكون أكثر كفاءة من الوقت للقيام بذلك يدويا. لذا البروتوكولات تبدأ من هنا التلقيح من precultures التعبير والطلاء لهذا التحول من حرارة التحول صدمت يمزج عمله يدويا. لمزيد من التفاصيل بشأن إجراءات الاستنساخ والتحول دليل راجع المراجع ذات الصلة 22،24.
1. Precultures وتصفيح
- إعداد المنضدة الروبوت (انظر الشكل 4 لمناصب):
- وضع 300 مل تحتوي على الحوض الصغير 150 مل العقيمة مرق LB (تستكمل مع الأمبيسلين (100 ميكروغرام / مل) / كلورامفينيكول (34 ميكروغرام / مل)، أو غيرها من المضادات الحيوية المناسبة) في موقف 8.
- وضع DW العقيمة96 في المركز 11. وضع 4x ومعدة سلفا-24-LB جيدا أجار (أمبير / كاميرا) لوحات زراعة الأنسجة (التي تحتوي على 2 مل أجار في كل بئر) مع الأغطية على مناصب في 14 إلى 17.
- وضع لوحة التحول (التي تحتوي على 96 يمزج التحول بعد heatshock) في موقف 13. سيتم استخدام هذا لتلقيح precultures السائل ولوحات أجار LB. وضع مربع من معقمة 200 ميكرولتر ماصة نصائح في الموقف 18.
- باستخدام ذراع 96-الأقنية (MCA96) و 200 ميكرولتر نصائح، نضح 200 ميكرولتر من مرق LB (موقف 8)، والاستغناء في DW96 في الموقف 11. كرر حتى يكون هناك الحجم النهائي من 1 مل مرق LB في كل بئر من وDW96. وسوف تصبح هذه preculture السائل.
- باستخدام مناور الروبوتية (روما)، وإزالة الغطاء من أول 24 لوحة جيدا LB أجار ووضعه في مكان آخر (على سبيل المثال في الناقل فندق) حتى يتم الانتهاء من الطلاء لهذا اللوحة.
- باستخدام التعامل مع (يحة) رئيس السائل 8 قنوات، ثم نضح مزيج 50 ميكرولتر من رانه العمود الأول من مزيج التحول في الموقف 13. هذا الحجم من مزيج التحول هو فقط ما يكفي لتغطية LB آجار جيدا.
- مع القنوات 4 الأولى، الاستغناء على العمود الأول من أول 24 لوحة جيدا LB أجار في موقف 14 (كما هو موضح في الشكل 5).
- مع القنوات 4 الماضي، الاستغناء على العمود الثاني من أول 24 لوحة جيدا LB أجار.
- يغسل جيدا بعد كل النصائح الاستغناء.
- تستمر هذه العملية حتى تم مطلي جميع التحولات على لوحة للمرة الأولى في الموقف 14، ونقل من 96 - إلى 24 جيدا باستخدام نظام المنصوص عليه في الشكل 5.
- مرة واحدة وقد تم الانتهاء من لوحة الأولى، استخدم روما لاستبدال الغطاء وإزالة الغطاء عن لوحة المقبل في الموقف 15. الاستمرار في استخدام نظام الطلاء لوحات 3 القادم.
- بعد الانتهاء الطلاء، وتعيين تي اهتز إلى 1،200 دورة في الدقيقة ويهز جميع لوحات لمدة 1 دقيقة لتوزيع متجانس من مزيج التحول.
- باستخدام MCA96 ونصائح ماصة الأصلي، ثم نضح مزيج 60 ميكرولتر من مزيج التحول المتبقية (الموقف 13) والاستغناء في DW96 تحتوي على مرق LB في الموقف 11.
- ختم precultures DW96 مع فيلم لاصق تنفس للسماح الثقافة التهوية.
- مكان في الحاضنة 37 درجة مئوية اهتزاز في أقصى سرعة O / N (200/800 دورة في الدقيقة اعتمادا على شاكر المداري).
- يجب وضع لوحات أجار LB في غطاء مع الأغطية قبالة حتى تجف (10 دقيقة). ثم يتم وضعها المقلوب في 37 ° C وحة الحاضنة حتى صباح اليوم التالي.
- في اليوم التالي، يتم استخدام preculture لتطعيم التعبير الاختبار في صناعة السيارات في الحث المتوسطة وإعداد مخزونات الجلسرين. وضع لوحات أجار في الثلاجة، وذلك حتى الظهر. إذا لزم الأمر، بدءا من لوحات أجار أو الأسهم الجلسرين، والتعبير الاختبار يمكن إعادة القيام به، فحقن preculture LB الطازجة مباشرة.
2. إعداد DW24 ZYP-5052 لوحات
ملاحظة: هذا الإجراء يأخذ حوالي 5 دقائق لاستكمال لكل مجموعة من لوحات 4X DW24.
- يشكلون 500 مل ZYP-5052 متوسطة لصناعة السيارات في الحث عن كل تكرار من 96 الثقافات (464 مل ZY المتوسطة، و 250 ميكرولتر 2 M MgSO 4، 10 مل 50X 5052، 25 مل 20x وNPS، في هذا النظام - وصفات لكل مكون و المنصوص عليها في الجدول رقم 1) تستكمل مع المضادات الحيوية المناسبة.
- إعداد المنضدة الروبوت:
- وضع اثنين 300 مل أحواض، كل منها يحتوي على 250 مل ~ المتوسطة في موقف 5 و 6. وضع أربع لوحات DW24 العقيمة في المواقف 14-17. ضع 200 نصائح ميكرولتر في الموقف 18.
- باستخدام MCA96 و 200 نصائح ميكرولتر، نضح 200 ميكرولتر من ZYP-5052 من موقعه 5 والاستغناء في لوحة DW24 الأولى في الموقف 14. هل هذا ما مجموعه 5 مرات (4 نصائح سوف تستغني في بئر واحدة في وقت واحد ليصبح المجموع من 4 مل). تكرار لوحات 3 س DW24 المتبقية في المواقف 15-17، SWITتشينغ إلى 5052 ZYP في موقف ل6 الماضيين DW24 لوحات.
3. التلقيح والنمو من الثقافات اختبار التعبير
ملاحظة: التلقيح يستغرق حوالي 10 دقيقة لإكمال لكل مجموعة من لوحات 4X DW24، ويستمر النمو O / N.
- إعداد المنضدة الروبوت:
- وضع لوحة تحتوي على DW96 precultures (من الخطوة 1.15) في موقف 11. وضع أربعة DW24 لوحات تحتوي المتوسطة ZYP-5052 (من الخطوة 2.3) في المواقف 14-17.
- باستخدام نضح يحة 100 ميكرولتر من preculture من موقف 11 لتطعيم الثقافات اختبار التعبير (1/40 التخفيف) باستخدام نظام المنصوص عليه في الشكل 5. غسل الرأس يحة تماما في محطة غسيل بين كل عمود من precultures 96 جيدا.
- ختم لوحات DW24 مع فيلم تنفس واحتضان عند 37 درجة مئوية مع الهز (200/400 دورة في الدقيقة) لمدة 4 ساعة. هذا هو الوقت المناسب للمرحلة النمو خلالها glucosسوف تفضيلي تستنفد ه من المتوسطة 27.
- خفض درجة الحرارة إلى 17 درجة مئوية. بعد ساعة 4 واستنزاف الجلوكوز، اللاكتوز سوف تبدأ عملية الأيض بالنسبة له، مما يؤدي إلى تحريض التعبير، وتوفير الظروف المثلى لنمو BL21 (DE3) pLysS أو رشيد 2 (DE3) pLysS، في هذا العمل 22. ترك الخلايا للتعبير O / N. استخدام preculture المتبقية لجعل الأسهم الجلسرين.
4. إعداد مخزون الجلسرين
ملاحظة: يجب أن يتم مخزونات الجلسرين في يثلث ليتم تخزينها في مواقع مختلفة في حال فشل الفريزر.
- إعداد المنضدة الروبوت:
- وضع وحات microtiter في موقف 5-7 لإيواء الأسهم الجلسرين. وضع 300 مل حوض مليئة 50 مل من الجلسرين بنسبة 100٪ في موقف 8. وضع DW96 تحتوي على 800 ميكرولتر من preculture (بعد الخطوة 3.2) في كل بئر في الموقف 11. وضع 200 ميكرولتر نصائح في الموقف 18.
- باستخدام سلوفاكيا ث الطموح وصرفها بسرعة، استخدم MCA96 و 200 ميكرولتر نصائح لإضافة الجلسرين في DW96 تحتوي على precultures.
- نضح 200 ميكرولتر من الجلسرين (من موقف 8).
- الاستغناء 150 ميكرولتر (على الموقف 11) أولا، ثم وقفة لمدة 20 ثانية للسماح للالجلسرين المتبقية للوصول إلى الجزء السفلي من غيض. الاستغناء عن 50 ميكرولتر المتبقية.
- باستخدام نفس النصائح، مزيج من الثقافة والجلسرين في DW96 في موقف 11 حتى تختلط جيدا. تركيز النهائي من الجلسرين هو 20٪. نضح 140 ميكرولتر من DW96 والاستغناء في لوحة microtiter الأولى في موقف 5.
- كرر الخطوة 4.3 لتبقى كل وحة microtiter (مواقف 6 و 7).
- ختم كل وحة microtiter مع شريط لاصق من البلاستيك وتخزينها في -80 درجة مئوية. تجاهل ثقافة المتبقية في DW96، تطهير مع وكيل المضادة للجراثيم قبل التخلص منها.
5. تقييم النمو من الثقافات
معشوقة = "jove_content"> ملاحظة: ليس من الضروري عادة لتقييم معدل النمو النهائي كما OD النهائية 600 عادة ما يكون الشيء نفسه بالنسبة لمعظم الثقافات (حوالي 12 في هذه الظروف)، ولكن أي الثقافات التي لا تنمو وتجدر الإشارة.
- تأخذ 50 ميكرولتر من كل ثقافة (من الخطوة 3.4) والاستغناء في ذلك، واضح وحة microtiter مسطحة القاع تحتوي على 150 ميكرولتر من المتوسط.
- قياس OD 600، مع مراعاة التخفيف 4 أضعاف. إذا كان هناك أي التي لا تنمو بشكل جيد جدا، لاحظ هذا لتحليل النهائي.
6. حصاد الخلايا
ملاحظة: يستغرق هذا الإجراء حوالي 45 دقيقة لإكمال.
- أجهزة الطرد المركزي لوحات 4X DW24 (من الخطوة 3.4) في 3000 x ج لمدة 10 دقيقة ثم تجاهل طاف في حاوية النفايات التي تحتوي على عامل مضاد للميكروبات. الاستفادة من لوحات، رأسا على عقب، على ورقة ماصة لإزالة أي وسيط الزائدة.
- في هذه الأثناء، وإعداد 100 مل من تحللالعازلة (50 ملي تريس، 300 ملي مول كلوريد الصوديوم، ودرجة الحموضة 10 ملي إيميدازول 8، أو عازلة المفضل غيرها) التي تحتوي على الليزوزيم (تركيز النهائي 0.25 ملغ / مل).
- إعداد المنضدة الروبوت:
- وضع العازلة تحلل في 300 مل الحوض في موقف 5. وضع DW96 نظيفة في الموقف 11. وضع لوحات 4 × DW24 تحتوي على الكريات خلية (من الخطوة 6.1) في المناصب 14-17. وضع 200 ميكرولتر نصائح في الموقف 18.
- باستخدام MCA96 و 200 نصائح ميكرولتر، نضح 125 ميكرولتر من العازلة تحلل الموقف من 5 والاستغناء في كل لوحة DW24 (المواقف 14-17). تكرار. ملاحظة: وسوف 4 نصائح الاستغناء في بئر واحدة في وقت واحد للحصول على الحجم النهائي من 1 مل في كل بئر من لوحات DW24.
- يهز لوحات في مواقع 14-17 باستخدام تي اهتز (1،000 دورة في الدقيقة) لمدة 15 دقيقة ل resuspend الكريات.
- مرة واحدة ومعلق الكريات، واستخدام القنوات 4 الأولى من يحة لنضح 550 ميكرولتر من عينات 1-4 (في العمود الأول من DW24 الأولى، في موقف 14)، ثم باستخدام لترAST 4 قنوات من نضح يحة 550 ميكرولتر من عينات 5-8 (العمود الثاني من DW24 الأول). الاستغناء في الصف الأول من DW96 في الموقف 11.
- كرر الخطوة 6.6، بحيث يتم نقل كل من تعليق خلية إلى DW96.
- بعد كل مجموعة من العينات غسل نصائح يحة في محطة غسيل.
- كرر الخطوات من 6،6-6،8 لكل عمود في كل لوحة DW24 (المواقف 15-17) باستخدام نظام المنصوص عليه في الشكل 5. ختم مع فيلم البلاستيك.
- لتنقية في نفس اليوم أو تجميد المدى القصير، مخزن في -80 درجة مئوية لمدة لا تقل عن 1 ساعة، تخزين خلاف ذلك في -20 درجة مئوية.
الجزء باء: تنقية وتحليل
7. تحلل الخلية
ملاحظة: هذا الإجراء يستغرق حوالي 60 دقيقة لإكمال.
- ذوبان الجليد في تعليق خلية مجمدة (من الخطوة 6.10) في حمام مائي (في RT أو 37 درجة مئوية) لمدة حوالي 15 دقيقة و resuspend في حاضنة تهتز للضافية 10 دقيقة. ينبغي أن تصبح لزجة الثقافات.
- تأخذ 500 ميكرولتر من الأسهم الدناز ومزجها مع 1 مل من MgSO 4 الأسهم. يدويا مع ماصة 8 قنوات أو مع الروبوت يحة، تستغني 15 ميكرولتر في كل بئر من DW96، لإعطاء تركيز النهائي من 10 ميكروغرام / مل من الدناز و 20 ملي MgSO 4.
- إعادة ختم لوحة مع الشريط البلاستيك ويهز لمدة 15 دقيقة أخرى. عند هذه النقطة يجب أن تكون الثقافات غير لزج. التحقق بعناية (عن طريق الفحص البصري) أن جميع الثقافات لم تعد لزجة. ملاحظة: هذا أمر بالغ الأهمية، وإذا كان بعض الثقافات لا تزال لزجة (على سبيل المثال، إذا كان الدناز تم نسيان قصد أو غير مناسب في الاستغناء عن بعض الآبار)، مرشح سوف تسد، وتوليد ضغط غير متساو على عينات وتجاوز أو انسداد الإجمالية لل لوحة مرشح يمكن أن يحدث خلال تنقية.
- للحصول على عينات SDS-PAGE من المحللة خلية كاملة، نضح 10 ميكرولتر من المحللة والاستغناء في لوحة 96 جيدا PCR يحتوي على10 ميكرولتر من 4X SDS-PAGE العازلة عينة و 20 ميكرولتر من الماء. تفسد لمدة 3 دقائق في 95 درجة مئوية وتجميد حتى التحليل (إجمالي الكسر). إذا كان نظام الكهربائي بالمشاركه هو متاح، ويمكن تحليل عينات على هذا البروتوكول بدلا التالية أوصت الشركة الصانعة لإعداد العينة. لمزيد من التفاصيل بشأن تحليل العينات انظر القسم 10.
8. ني تقارب تنقية
ملاحظة: يجب استخدام بطء سرعة الطموح لpipetting لجميع المعلقات الراتنج، كما الايقاف سميكة جدا. وسوف يؤدي الإفراط في تجفيف الراتنج إلى انخفاض في قدرة ملزمة. لتنقية، وتركيزات إيميدازول المحدد تنطبق على النيكل الراتنج تقارب. إذا تم استخدام أيونات البديلة (مثل الكوبالت)، ثم ينبغي أن تعدل تركيزات فقا لذلك.
- A - ني تقارب تنقية للكشف في مجموعة من 1-100 ملغ / لتر (حجم الراتنج النهائي = 200 ميكرولتر)
ملاحظة: Tيأخذ الإجراء تنقية له حوالي 1.5 ساعة لاستكمال، وهذا يعني أن ما يصل إلى 4 لا يمكن أن يؤديها في يوم واحد.- إعداد المنضدة الروبوت:
- وضع 300 مل تحتوي على أحواض العازلة ملزمة (50 ملي تريس، 300 ملي مول كلوريد الصوديوم، ودرجة الحموضة 10 ملي إيميدازول 8)، غسل العازلة (50 ملي تريس، 300 ملي مول كلوريد الصوديوم، ودرجة الحموضة 50 ملي إيميدازول 8) وشطف العازلة (50 ملي تريس، 300 ملي كلوريد الصوديوم، 250 ملي إيميدازول درجة الحموضة 8) في المناصب 6-8، على التوالي.
- ترك فارغة 300 مل الحوض في موقف ل5 الطين الراتنج. في موقف 9 و 10 لوحة وضعت أصحاب. في موقف 10 وضع DW96 مع كتلة SPE ولوحة مرشح / المتلقي (20 ميكرون) على القمة.
- وضع DW96 تحتوي على المحللة (من الخطوة 7.3) في الموضع 14. وفي موقف 18 و 19 وضع 200 نصائح تتحمل اسعة ميكرولتر وميكرولتر 200 نصائح، على التوالي. وضع اثنين من لوحات DW96 الغيار للغسل وشطف في الفندق. ملاحظة: ويمكن أيضا أن توضع في موقع بديل على المنضدة إذا كان الفندق غير متوفر.
- إعداد 105مل من معايرتها 33٪ راتنج الطين (35 مل + 70 مل الراتنج العازلة ملزمة). إضافة تعليق الراتنج إلى القاع في موقف 5 فورا قبل بدء الإجراء.
- باستخدام MCA96 و 200 نصائح تتحمل اسعة ميكرولتر (الموقف 18)، وخلط الطين الراتنج في الموقف جيدا قبل 5 الشفط والاستغناء 200 ميكرولتر من الراتنج الطين في DW96 تحتوي على المحللة في الموقف 14. كرر مرتين بحيث 600 ميكرولتر من الراتنج الطين وقد أضيفت إلى المحللة، والاختلاط تعليق راتنج قبل كل الطموح.
- إجراء خلط الخطوة 10 دقيقة باستخدام MCA96 في موقف 14 للسماح للربط ومنع من الراتنج التكوير.
- نضح من موقف 14 والاستغناء 800 ميكرولتر (200 ميكرولتر في الكثير) على لوحة تصفية الموقف في 9، والاختلاط قبل كل طموح وإلا سيتم الاحتفاظ الراتنج في الجزء السفلي من DW96.
- بدوره على الفراغ في المركز 10 لحوالي 90 ثانية إلى تحديد المحللة من خلال لوحة فيDW96 لجمع التدفق من خلال، مع الحرص على عدم تجفيف الراتنج. بدوره الفراغ قبالة.
- كرر الخطوات 8.1.5 8.1.6 وحتى يتسنى لجميع من الراتنج ومن ثم في لوحة التصفية.
- باستخدام ذراع روما تحريك كتلة SPE عقد لوحة تصفية من موقف لموقف 10 9 بحيث الخطوة غسل التالي يذهب مباشرة إلى النفايات ونقل DW96 تحتوي على التدفق من خلال الموقف في 10 إلى موقع آخر (على سبيل المثال، إلى فندق الناقل) حتى نهاية الإجراء.
- مع مجموعة جديدة من 200 نصائح ميكرولتر (على الموقف 19)، وغسل الراتنج (في موقف 9) مع ما مجموعه 800 ميكرولتر من العازلة ملزمة (من موقف 6)، وتطبيق فراغ في المنصب 9 حتى اجتاز العازلة من خلال . أكرر مرة أخرى.
- استخدام الذراع روما لوضع DW96 جديدة على موقف 10 لجمع غسل إيميدازول 50 ملي ونقل كتلة SPE ومرشح لوحة مرة أخرى في أعلى (الموقف 10).
- إضافة 800 ميكرولتر من غسل العازلة من موقف على موقف 7 10، وتحويلفراغ حتى مرت على المنطقة العازلة من خلال. تبديل قبالة فراغ.
- مع ROMA، وإزالة كتلة SPE ومرشح لوضع لوحة (9) وDW96 تحتوي على عينة غسل إلى الفندق، ويبقيه جانبا حتى نهاية الإجراء.
- غسل الراتنج مع 800 ميكرولتر آخر من غسل العازلة (من 7 إلى موقف موقف 9)، وتطبيق الفراغ حتى اجتاز العازلة من خلال. أكرر مرة أخرى.
- استخدام روما لوضع DW96 جديدة على موقف 10 ووضع كتلة SPE ومرشح لوحة مرة أخرى في أعلى لجمع شطف.
- إضافة ما مجموعه 500 ميكرولتر من شطف العازلة (8 من موقف على موقف 9)، واحتضان في الموقع لمدة 3 دقائق. بدوره على فراغ حتى اجتاز كل العازلة من خلال.
- اختياري: لغاية معربا عن البروتينات، يمكن إجراء شطف الثاني في DW96 الطازجة كما هو الحال في الخطوات 8.1.14 8.1.15 و.
- أخذ عينات من التدفق من خلال، وغسل وشطف / s للSDS-PAGE أو بالمشاركه الكهربائي.
- للعينات SDS-PAGE من التدفق من خلال، تستغني 10 ميكرولتر في لوحة 96-PCR جيدا تحتوي على 10 ميكرولتر من 4X SDS-PAGE العازلة عينة و 20 ميكرولتر من الماء. للحصول على عينات SDS-PAGE للغسل وشطف / ث 30 ميكرولتر الاستغناء في لوحات PCR تحتوي على 10 ميكرولتر من 4X SDS-PAGE عينة العازلة. تفسد لمدة 3 دقائق في 95 درجة مئوية وتجميد حتى التحليل.
- لعينات بالمشاركه الكهربائي، اتبع إرشادات الشركة المصنعة. لمزيد من التفاصيل بشأن تحليل العينات انظر القسم 10.
- إعداد المنضدة الروبوت:
- ب - ني تقارب تنقية للكشف في حدود 0،1 حتي 25 ملغ / لتر (حجم الراتنج النهائي = 50 ميكرولتر)
ملاحظة: يستغرق هذا الإجراء حوالي 30 دقيقة تنقية لاستكمال، وهذا يعني أن ما يصل إلى 12 لا يمكن أن يؤديها في يوم واحد.- إعداد المنضدة الروبوت:
- وضع 300 مل تحتوي على أحواض العازلة ملزمة (50 ملي تريس، 300 ملي مول كلوريد الصوديوم، ودرجة الحموضة 10 ملي إيميدازول 8)، وغسل العازلة (50 ملي تريس، 300 ملي مول كلوريد الصوديوم، ودرجة الحموضة 50 ملي إيميدازول 8)وشطف العازلة (50 ملي تريس، 300 ملي مول كلوريد الصوديوم، و 250 ملي إيميدازول درجة الحموضة 8) في المناصب 6-8، على التوالي.
- ترك فارغة 300 مل الحوض في موقف ل5 الطين الراتنج. في موقف 9 و 10 لوحة وضعت أصحاب. في موقف 10 وضع DW96 مع كتلة SPE ولوحة مرشح / المتلقي (20 ميكرون) على القمة.
- وضع DW96 تحتوي على المحللة (من الخطوة 7.3) في الموضع 14. وفي موقف 18 و 19 وضع 200 ميكرولتر نصائح تتحمل واسعة و200 نصائح ميكرولتر، على التوالي. وضع الغيار 96 جيدا لوحة microtiter شطف في الفندق. ملاحظة: يمكن أيضا أن توضع هذه في موقع بديل على المنضدة إذا كان الفندق غير متوفر.
- إعداد 50 مل من معايرتها 25٪ راتنج الطين (12.5 مل الراتنج + 37.5 مل العازلة ملزمة). إضافة تعليق الراتنج إلى القاع في موقف 5 فورا قبل بدء الإجراء.
- باستخدام MCA96 و 200 نصائح تتحمل اسعة ميكرولتر (الموقف 18)، وخلط الطين الراتنج في الموقف جيدا قبل 5 الشفط والدهاناتnsing 200 ميكرولتر من الراتنج الطين في DW96 تحتوي على المحللة في الموقف 14.
- احتضان عند RT مع اهتزاز باستخدام تي اهتز الساعة 1400 دورة في الدقيقة لمدة 10 دقيقة للسماح ملزمة.
- نضح من موقف 14 والاستغناء عن 1،200 ميكرولتر كاملة (في 200 ميكرولتر الكثير) باستخدام النصائح تتحمل واسعة (الموقف 18) على لوحة تصفية في موقف 10. ميكس قبل كل طموح وإلا سيتم الاحتفاظ الراتنج في الجزء السفلي من DW96.
- بدوره على الفراغ في المركز 10 لحوالي 30 ثانية إلى تحديد المحللة من خلال لوحة في DW96 لجمع تدفق من خلال، مع الحرص على عدم تجفيف الراتنج. بدوره الفراغ قبالة.
- باستخدام ذراع روما، نقل كتلة SPE عقد لوحة تصفية من موقف لموقف 10 9 بحيث الخطوة غسل التالي يذهب مباشرة إلى النفايات ونقل DW96 تحتوي على التدفق من خلال الموقف في 10 إلى موقع آخر (على سبيل المثال، في الناقل الفندق) حتى نهاية الإجراء.
- مع 200 μنصائح ل (في موقف 19)، وغسل الراتنج (في موقف 9) مع ما مجموعه 800 ميكرولتر من العازلة ملزمة (من موقف 6)، وتطبيق فراغ في المنصب 9 حتى اجتاز العازلة من خلال. تكرار.
- استخدام الذراع روما لوضع DW96 جديدة على موقف 10 لجمع غسل إيميدازول 50 ملي ونقل كتلة SPE ومرشح لوحة مرة أخرى في أعلى (الموقف 10).
- إضافة 150 ميكرولتر من غسل العازلة من موقف على موقف 7 10، وتحويل الفراغ على حتى اجتاز العازلة من خلال. تبديل قبالة فراغ.
- مع ROMA إزالة كتلة SPE ومرشح لوضع لوحة (9) وDW96 تحتوي على عينة غسل إلى الفندق، ويبقيه جانبا حتى نهاية الإجراء.
- غسل الراتنج مع 800 ميكرولتر آخر من غسل العازلة (من 7 إلى موقف موقف 9)، وتطبيق الفراغ حتى اجتاز العازلة من خلال. تكرار.
- استخدام روما لوضع صفيحة ميكروسكوبية في موقف 9 ووضع كتلة SPE ومرشح لوحة مرة أخرى في أعلى لجمع اله شطف.
- إضافة 190 ميكرولتر من شطف العازلة (8 من موقف على موقف 9)، واحتضان في الموقع لمدة 3 دقائق. تطبيق فراغ حتى اجتاز كل العازلة من خلال.
- أخذ عينات من التدفق من خلال، وغسل وشطف للSDS-PAGE أو بالمشاركه الكهربائي.
- للحصول على عينات SDS-PAGE من التدفق من خلال، تستغني 10 ميكرولتر في لوحة 96-PCR جيدا تحتوي على 10 ميكرولتر من 4X SDS-PAGE العازلة عينة و 20 ميكرولتر من الماء. للحصول على عينات SDS-PAGE للغسل وشطف / ث 30 ميكرولتر الاستغناء في لوحات PCR تحتوي على 10 ميكرولتر من 4X SDS-PAGE عينة العازلة. تفسد لمدة 3 دقائق في 95 درجة مئوية وتجميد حتى التحليل.
- لعينات بالمشاركه الكهربائي، اتبع إرشادات الشركة المصنعة. لمزيد من التفاصيل بشأن تحليل العينات انظر القسم 10.
- إعداد المنضدة الروبوت:
9. الشق الوسم (اختياري)
- إضافة البروتيني TEV (2 ملغ / مل) للبروتين مزال (من الخطوة 8.1.15 (و 8.1.16) أو خطوة 8.2.14) في نسبة 1/10 (ت / ت).
- احتضان عند RT (أو 4 درجة مئوية لمدة بروتينات حساسة للحرارة) O / N مع الهز لطيف.
- في نهاية الانقسام الاستغناء 30 ميكرولتر في لوحة PCR تحتوي على 10 ميكرولتر من 4X SDS-PAGE العازلة عينة أو اتباع إرشادات الشركة المصنعة للعينات بالمشاركه الكهربائي.
- تحديد المتبقية خليط الانقسام (من الخطوة 9.2) من خلال 96 لوحة جيدا 0.22 ميكرون التصفية وجمع من خلال تدفق للذوبان في DW96 من خلال تطبيق فراغ. ويمكن أن يتم هذا في واحد من المواقع فراغ (على سبيل المثال، موقف 10) على التعامل مع الروبوت السائل، مثل للخطوات شطف في القسمين 8.1 و 8.2. هذا يزيل أي البروتين الذي عجلت خلال الانقسام.
- بعد الترشيح، والاستغناء عن 30 ميكرولتر في لوحة PCR تحتوي على 10 ميكرولتر من 4X SDS-PAGE العازلة عينة أو إعداد كعينات بالمشاركه الكهربائي. وهذا يسمح للمقارنة بين البروتين قبل الانقسام، الخليط بعد انشقاق وسولالبروتين uble المتبقية بعد انشقاق ويعطي مؤشرات جيدة للنتائج المتوقعة في التجارب على نطاق يصل اللاحقة. لمزيد من التفاصيل بشأن تحليل العينات انظر القسم 10.
10. تحليل النتائج
- تحديد بنيات التعبير عن بروتين قابل للذوبان من خلال تحليل عينات تنقية على SDS-PAGE، وصمة عار نقطة أو نظام الكهربائي بالمشاركه مثل الفرجار LabChip.
- تحليل العينات شطف أولا تحديد بنيات إنتاج البروتين للذوبان. في معظم الحالات يتم تحليل العينات فقط شطف إذا تم تحديد بنيات القابلة للذوبان، لتقليل الوقت الذي يقضيه في التحليل.
- إذا كان البروتين هو ليس في شطف، تشغيل عينات غسل والتدفق من خلال لمعرفة ما إذا كان يعبر عنه ولم ربط بشكل صحيح إلى الراتنج.
- ليبني حيث يمكن الكشف عن أي بروتين قابل للذوبان في المدى المحللة خلية كاملة لمعرفة ما إذا أعرب عن بروتين.
ملاحظة: واحد الحد هنا هو أنه إذا كان عrotein من الفائدة لم يتم تقديم مستويات التعبير الخلفية أعلاه، فإنه قد لا يكون من الممكن رؤية بروتين ويمكن أن تؤدي إلى سلبية كاذبة. وتجدر الإشارة إلى أنه من الممكن دائما للبروتينات لعصا ويعجل على راتنج تقارب وهذا يمكن أن يؤدي إلى سلبية كاذبة أو تحت تقدير العائد باستخدام بروتوكول موصى بها (حدث نادر في هذا العمل). في حال أن البروتين يترسب على شطف (بيليه الأبيض مرئيا بعد بضع دقائق / ساعات شطف) فمن المستحسن لتغيير التركيبة عازلة (على سبيل المثال، تركيز الملح) و / أو إجراء فحص المسح التفاضلي fluorimetry لتحسين مخازن. كما يمكن معلق عينة صغيرة من الراتنج في SDS-PAGE العازلة عينة ويغلى لكشف ما إذا كان يتم الاحتفاظ بروتين على الراتنج. - إذا لم يكن أعرب عن البروتين ولكن الخلايا لم تنمو، اتباع استراتيجية تعبير جديد، أو إذا كان OD 600 يست عالية بما يكفي تنمو وreanalyze الثقافة. >
- إذا عينات الانقسام هي ليتم تحليلها، فإنها ينبغي تحليلها بطريقة جنبا إلى جنب، بحيث يمكن أن تظهر كل بناء قبل الانقسام وبعد الانقسام في الحارات المجاورة، لتبسيط التحليل.
- إلا باستخدام الأسلوب الكمي الذي يعطي مباشرة لتركيز شطف، يجب أن يتم تنفيذ الكمي للعينات الإيجابية من خلال قياس الامتصاصية في 280 نانومتر (A280).
- قياس A280، مع انقراض شارك في كفاءة من البروتين في الاعتبار واستخدام شطف العازلة باعتبارها فارغة، لتقديم تقدير العائد من البروتين من أجل تحديد أعلى معربا عن بنيات القابلة للذوبان.
- للمقارنة الأكثر موثوقية من غلة قابلة للذوبان، فمن المستحسن لتطبيع غلة من كثافة ثقافة (باستخدام قياس OD 600)، الذي اتخذ في القسم 5، وإذا نمت لجميع الثقافات تقريبا نفس الكثافة، وليس التطبيع المطلوبة.
- ويمكن تحليل عينات مباشرة من شطف أو عينة الانقسام من قبل اللوني الشامل السائل قياس الطيف (LC / MS).
- بدلا من ذلك، desalt الأول (لإزالة إيميدازول وأية أملاح العازلة التي قد تكون موجودة) باستخدام ماصة نصائح ZipTip أو أساليب اللوني السائل، ثم تحليل باستخدام مصفوفة بمساعدة الليزر الامتزاز / التأين وقت من الطيران (MALDI-TOF) أو التأين electrospray ( ESI) مطياف الكتلة.
- لا يمكن أن يؤديها الدراسات الفنية الصغيرة لمعرفة ما اذا كان وظيفة البروتين هو كما هو متوقع. إذا كانت هناك حاجة لكميات أكبر وظيفة، ويمكن إجراء ثقافة نطاق المتابعة وتأكدت وظيفة اختبار من ثقافة أكبر حجم مرة واحدة والأكسدة الدولة في نطاق ضيق.
النتائج
وتظهر نتائج ممثلة في الشكل (6) لفحص التعبير من 96 ثاني كبريتيد الغنية البروتينات من خط الأنابيب VENOMICS. يتم ترتيب البروتينات من قبل عدد متزايد من السندات ثاني كبريتيد ثم زيادة عدد المخلفات. وأعرب عن الببتيدات في السيتوبلازم مع صاحب العلامة وDsbC شريك الانصهار. عند استخدام ظروف ثقافة الموصى بها، وOD 600 من 12 ويتحقق عادة. وتنقيته الببتيدات باستخدام بروتوكول 8.2-B مع الحجم النهائي من 50 ميكرولتر من النيكل الراتنج تقارب، لذلك يمكن أن يتم الكشف عن مدة أقصاها 25 ~ البروتين ملغم / لتر الانصهار في هذه التجربة.
ويبين الشكل 6A نتيجة الكهربائي من نظام الفرجار LabChip (تبين الانصهار قبل الانقسام) ونظام التسجيل بناء على استقراء لانتاج الثقافة في ملغم / لتر من البروتين الانصهار (في مستويات 0،1-2 الثقافة ملغم / لتر، 2 ل 10 ملغم / لتر الثقافة، من 10 إلى 25 ملغ / لتر والثقافة لا الكشف عن ر.) لاحظ أن العلامة DsbC المشقوق يعمل عادة في حوالي 32 كيلو دالتون، بدلا من 27 كيلو دالتون كما هو متوقع. وبالمثل، فإن اندماج DsbC أيضا تشغيل حوالي 5 كيلو دالتون أعلى مما كان متوقعا. بالنسبة للكثير من الأهداف التي نراها ليس فقط الانصهار سليمة (الشريط العلوي)، ولكن أيضا الشريك الانصهار وحده (الشريط السفلي). لبعض هذه الأهداف وتحسين الظروف الثقافة يمكن أن تحسن نسبة الانصهار سليمة (الشريط العلوي) مقارنة DsbC وحدها السماح بزيادة العائد النهائي. ويستند التهديف فقط على مستوى الانصهار سليمة. لا يمكن الكشف عن 16 فقط من أصل 96 على مستوى البروتينات الانصهار. وهذا يتوافق مع مستوى النجاح العام من 83٪. من 80 البروتينات التي يمكن أن يتم الكشف عن، تم الكشف عن 45 من هذه عند مستويات تزيد عن 2 ملغم / لتر الثقافة (56٪). اعتمادا على الهدف والانصهار، والمحاصيل البروتين وعادة ما تكون في حدود 2-100 ملغ / لتر الثقافة (رغم أنه في هذا المثال باستخدام بروتوكول 8.2 B كحد أقصى ~ البروتين 25 ملغم / لتر الانصهار يمكن الكشف).
ر "> تحليل للنجاح حسب عدد السندات ثاني كبريتيد الحاضر (كما هو موضح في الشكل 6B) يبين نجاح معقولة لجميع الأرقام من السندات ثاني كبريتيد اختبار (بين 1 و 7)، مع أدنى مستوى النجاح إلى 66٪ للأهداف التي تحتوي على 6 ثاني كبريتيد السندات. تحليل توزيع نجاح التعبير على أساس نقطة تساوي الكهربية وعدد من بقايا (هو مبين في الشكل 6C) لا يظهر أي تحيز معين لهذه التقنية، مع كل الأهداف والغايات التي لم يتم الكشف عن المؤامرة المنتشرة في جميع أنحاء أعرب بنجاح.ويبين الشكل 6D مثال للنتائج التي تم الحصول عليها من قياس الطيف الكتلي electrospray التأين مطياف الكتلة (ESI-MS) لهدف واحد، قبل وبعد التخفيض من العينة مع التلفزيون الرقمي الأرضي. عادة، فإن مثل هذا التحليل الطيفي شاملة لا تحتاج إلى أن يتم تنفيذ (لن تحتاج إلى تخفيض عينة لتحليلها)، ولكن لأغراض demonstratio شاملن أظهرنا كل من النتائج. الهدف هو موضح هو 5.7 كيلو دالتون، ثاني كبريتيد الغنية البروتين المركب من السم مع السندات ثاني كبريتيد 4. الطيف على اليسار يظهر نتائج للبروتين قبل التخفيض مع التلفزيون الرقمي الأرضي، كما كان بعد انشقاق وتحلية دون مزيد من التدخل. الطيف على الجهة اليمنى يظهر البروتين بعد التخفيض مع DTT تليها تحلية لإزالة أي فائض DTT. وتتميز الأيونات المقابلة للجماهير التجريبية مع السهام على طيف وتسمية لكل أيون هو مبين باللون الأخضر. الجماهير الأم التجريبية المحسوبة لهذه الأيونات (للبروتين قبل التخفيض (-DTT) وبعد التخفيض (+ DTT)) وترد في الجدول. الجماهير (5709.6 دا للعينة قبل التخفيض و5717.6 دا لخفض عينة) يحمل فرقا كتلة 8 دا. وهناك فرق الشامل من 2 دا يتوافق مع وجود 1 تتأكسد السندات ثاني كبريتيد، وبالتالي اختلاف كتلة 8 دا يدل على وجود 4 السندات ثاني كبريتيد (كما هو متوقع) فيعدم تخفيض عينة.
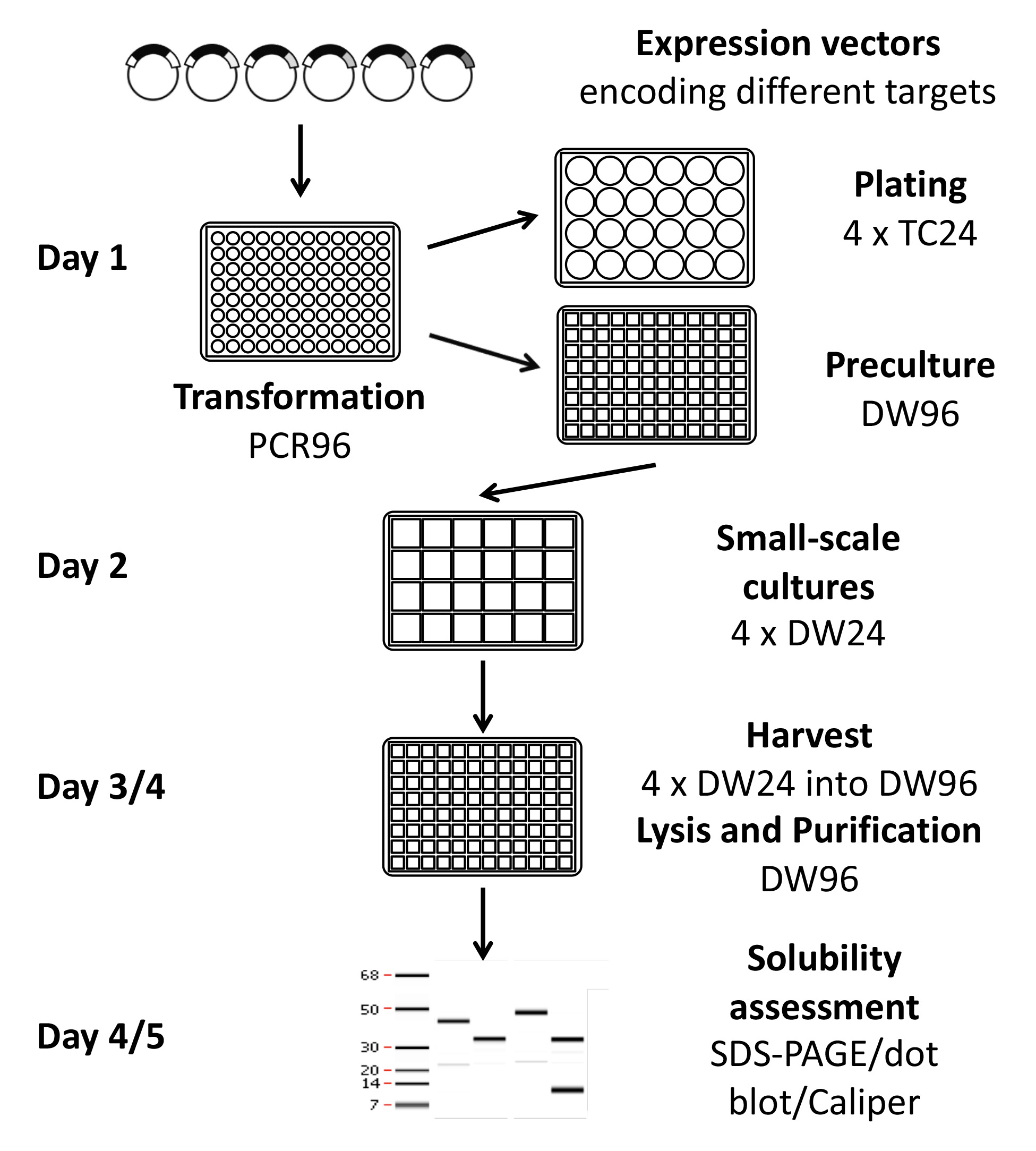
الشكل 1. تمثيل تخطيطي للإنتاجية عالية بروتوكول الفحص التعبير. باستخدام هذا البروتوكول، يمكن اختبار 96-384 الشروط قبل شخص واحد في أسبوع واحد باستخدام الأساليب اليدوية، أو ما يصل إلى 1،152 الظروف مع المعدات شبه الآلي وصفها. هي التي شيدت البلازميدات التعبير باستخدام تكنولوجيا الاستنساخ إعادة التركيب بحيث يمكن أن يكون العديد من الأهداف الفرعية المستنسخة في وقت واحد. وقد تم تحديد الظروف التعبير مرة واحدة قابلة للذوبان والانقسام يؤديها، إذا رغبت في ذلك، يمكن للبروتين المضي قدما لمراقبة الجودة للتأكد من الأكسدة والنقاء، microassays و / أو الإنتاج على نطاق واسع.
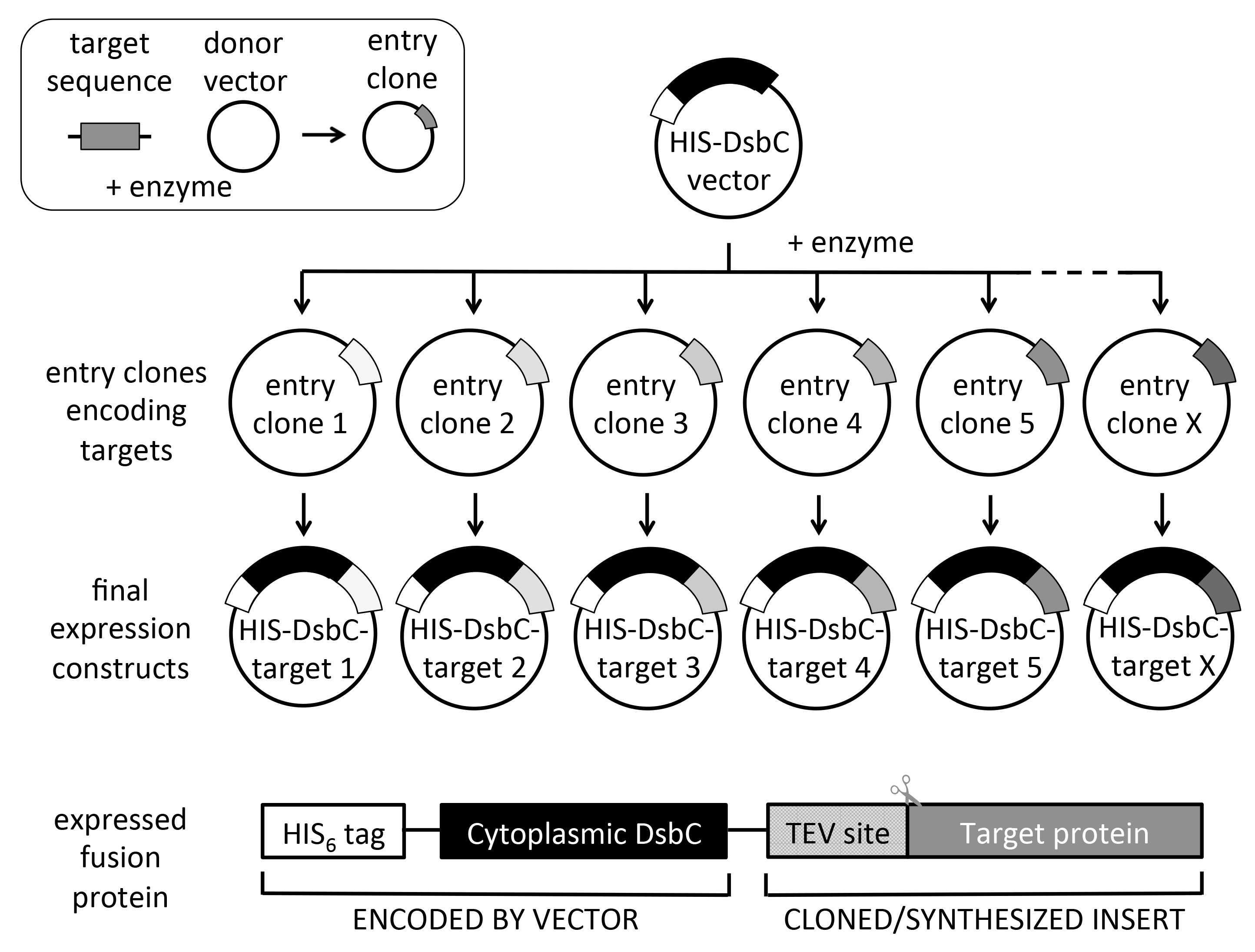
الشكل 2. تخطيطي لاستنساخ تهجيني العالمية وبناء التصميم. من الحيوانات المستنسخة دخول الهدف، وناقلات التعبير متعددة يمكن أن تكون مستنسخة فرعية في تجربة واحدة بطريقة إنتاجية عالية (تصل إلى 6 × 96 استنساخ دخول في الأسبوع). البروتين أعرب بترميز علامة HIS لتنقية النيكل تقارب. يتم استخدام DsbC (التي تفتقر إلى التسلسل في إشارة محيط بالجبلة للتعبير حشوية) شريك الانصهار لزيادة القابلية للذوبان و / أو قابلة للطي المساعدات والأكسدة الصحيح من البروتين الهدف. لاحظ أن تسلسل الترميز الهدف يجب أن يحتوي موقع TEV البروتيني-N محطة (ENLYFQ) إذا كان المطلوب علامة الانقسام. أقحم في الجزء العلوي الأيسر يبين إنتاج الحيوانات المستنسخة الدخول باستخدام ناقلات المانحة وتسلسل الهدف، والتي يمكن الحصول عليها عن طريق PCR أو التوليف الجيني. كما يمكن الحصول على الحيوانات المستنسخة من دخول دخول مجموعات استنساخ التجارية. هي أنظمة الاستنساخ تهجيني متعددة متاحة، لكننا الاستفادة من بوابة التنفسيم، كما هو مبين في التخطيطي.
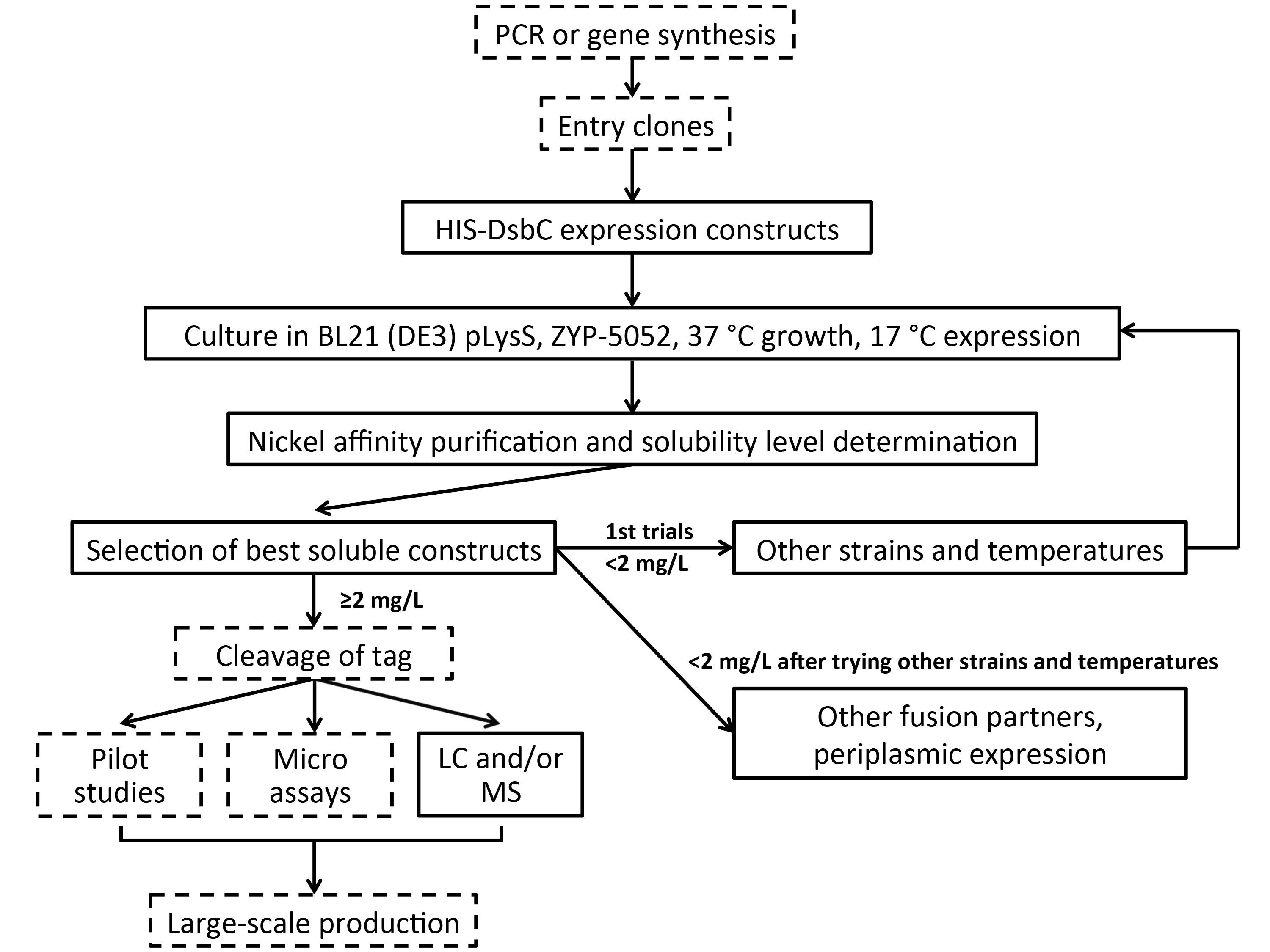
الرقم 3. خط أنابيب الفحص عالية الإنتاجية لأهداف ثاني كبريتيد غنية متعددة. يتم التعبير عن الأهداف في البداية لاندماج HIS-DsbC في السيتوبلازم من BL21 (DE3) pLysS E. القولونية في 37/17 درجة مئوية باستخدام لصناعة السيارات في الحث المتوسطة (ZYP-5052). يتم تنفيذ تنقية على الراتنج النيكل تليها الكشف عن بنيات القابلة للذوبان التي كتبها الكهربائي بالمشاركه (أو مع وصمة عار نقطة / SDS-PAGE). إذا كانت الجولة الأولى من الفرز التعبير غير ناجحة، وحاول ظروف ثقافة بديلة. إذا بنيات إنتاج بروتينات قابلة للذوبان في عوائد عالية بما فيه الكفاية، microassays ومراقبة الجودة لا يمكن أن يؤديها، وإذا لزم الأمر، يمكن متابعتها الإنتاج على نطاق واسع. للأهداف حيث غلة قابلة للذوبان ليست عالية بما فيه الكفاية، يمكن فحص التعبير تواصل مع سترا البديلةخصوصيات ودرجات الحرارة ثم الانصهار الشركاء الآخرين والتعبير محيط بالجبلة. يشار إلى الخطوات الاختيارية من قبل صناديق متقطع.
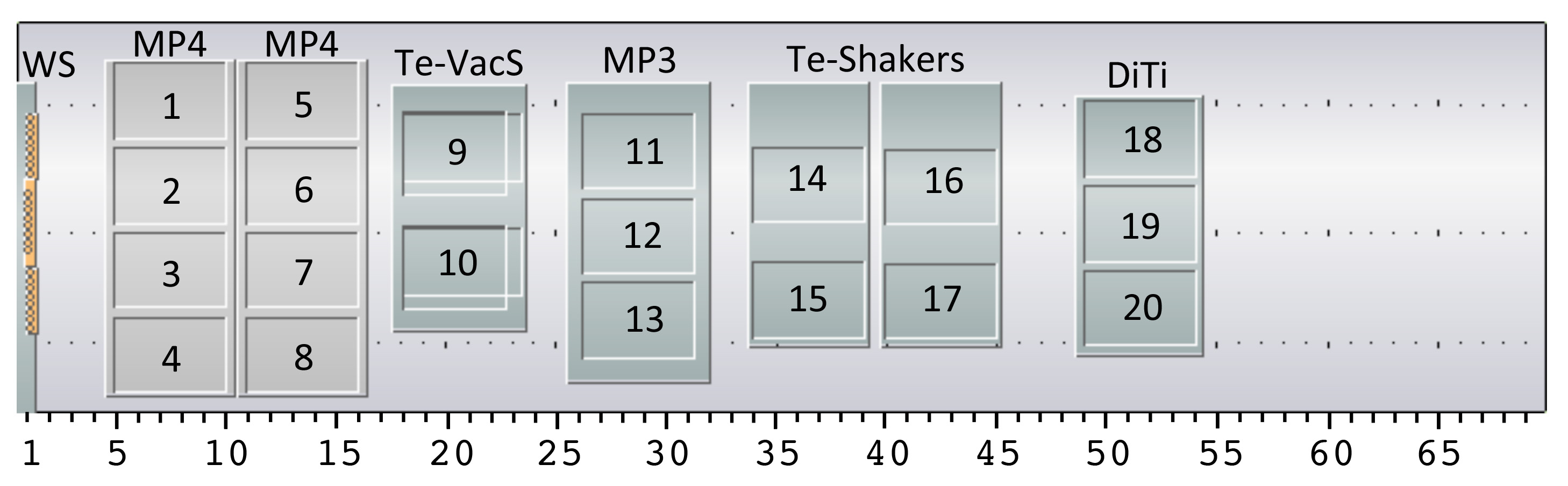
قدمت الرقم 4. الإعداد روبوت المنضدة لمنصة بالمشاركه. يظهر تخطيط لدينا السائل التعامل مع الروبوت المنضدة، على الرغم من المناضد البديلة يمكن أن تستخدم أيضا هناك مواقع يعادل المتاحة. يتكون الإعداد لمحطة غسيل (WS) ل (8 قنوات الرأس مناولة السائل (يحة))، حاملتي صفيحة ميكروسكوبية مع 4 مواقف لكل (MP4، مواقف 1-4 و 5-8)، ومحطة فراغ مع 2 مناصب (تي-شركات القيمة المضافة، مواقف 9 و 10)، حاملة صفيحة ميكروسكوبية مع 3 وظائف (MP3، المواقف 11-13)، واثنين من الهزازات لوحة مع 2 مواقف كل (تي-الهزازات، والمواقف 14-15 16-17) والناقل للحصول على نصائح القابل للتصرف مع 3 وظائف (DiTi، المواقف 18-20). بالإضافة لإعادة نوعان من شركات الطيران فندق لوحات بئر عميقة واحدة لmicroplates (لا يظهر). الأجهزة المثبتة على الروبوت التعامل مع السائل هو الذراع 96-الأقنية (MCA96) للاستخدام مع نصائح القابل للتصرف، في 8 قنوات التعامل مع السائل الرأس (يحة) مع نصائح الثابتة ومناور الروبوتية (روما) التي تتحرك لوحات / المعدات حولها على على المنضدة. يشار ترقيم مواقف لجميع أنحاء البروتوكول.

الرقم 5. تخطيطي لنقل من واحد لوحة 96 جيدا إلى أربعة 24 لوحات جيدة.

الرقم 6. وتظهر نتائج الممثل للعرض على الشاشة تعبيرا عن 96-ثاني كبريتيد الغنية السم المواليةالبروتينات. وأعرب عن البروتينات كما اندماج HIS-DsbC في السيتوبلازم وتنقيتها باستخدام 50 ميكرولتر من الراتنج النيكل (بروتوكول 8.2-B). A) التعبير فحص النتائج، والتي تبين هلام الظاهرية والعائد التعبير التهديف. تم تعديل التباين في هلام الظاهرية حارة إلى حارة للتعويض عن العصابات خافت جدا أو شديدة. لاحظ أن بعض الأهداف يمكن أن ينظر شريطين، والفرقة العلوية المقابلة للانصهار بروتين سليمة وانخفاض الفرقة المقابلة لعلامة الانصهار وحده. B) نسبة البروتينات التي أعرب عنها في كل مستوى التعبير مقارنة مع عدد السندات ثاني كبريتيد في البروتين. وoverlayed العدد الفعلي من البروتينات في كل مجموعة على الرسم البياني. C) توزيع مستويات التعبير على أساس نقطة تساوي الكهربية (PI) وعدد من المخلفات. D) مثال على نتائج قياس الطيف الكتلي ل-ثاني كبريتيد الغنية السم 5.7 كيلو دالتون البروتين مع السندات ثاني كبريتيد 4. الطيف علىيظهر الجانب الأيسر البروتين قبل التخفيض مع التلفزيون الرقمي الأرضي وطيف على الجانب الأيمن يدل على انخفاض البروتين مع DTT ثم المحلاة. وتتميز الأيونات المقابلة للجماهير التجريبية مع السهام وترد مهامهم باللون الأخضر. الجماهير التجريبية للبروتين قبل التخفيض وبعد التخفيض وترد في الجدول وتظهر فرقا كتلة 8 دا الموافق لوجود البروتين تتأكسد قبل إضافة عامل الاختزال. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم .
| عنصر | وصفة | تعليق |
| ZY | ~ 928 مل 10 ز تريبتون 5 ز خلاصة الخميرة 925 مل ماء | مزيج ثم لتعقيم الأوتوكلاف. |
| 2 M MgSO 4 | 100 مل 49.3 غرام MgSO 4 · 7H 2 O ~ 60 مل من الماء | يحرك حتى يذوب ثم لتعقيم الأوتوكلاف. |
| 50X 5052 | 1 L 250 غ من الجلسرين 730 مل من الماء 25 غرام غلوكوز 100 غرام α اللاكتوز | إضافة في تسلسل، وإثارة على نار حتى يذوب ثم كل لتعقيم الأوتوكلاف. |
| 20x وNPS | 1 L 900 مل من الماء 66 ز (NH 4) 2 SO 4 136 غ KH 2 PO 4 142 ز نا 2 هبو 4 | إضافة في تسلسل ويحرك حتى يذوب ثم كل لتعقيم الأوتوكلاف. |
الجدول 1. وصفة لمكونات ZYP-5052 المتوسط.
Discussion
ليس هناك بروتوكول عالمي واحد للتعبير عن ذوبان، مطوية، والبروتينات وظيفية. أن تكون التكاليف والوقت فعالة، معظم المختبرات أو المرافق الأساسية من البروتين العمل مع أهداف متعددة وبالتالي استخدام عالية الإنتاجية التعبير البروتين فحص للعثور على أفضل مزيج 'عام' من المتغيرات للحصول على البروتين النشط للذوبان بالنسبة لغالبية الأهداف. حددنا DsbC باعتبارها شريكا الانصهار المطبقة عموما للتعبير قابلة للذوبان من الببتيدات والبروتينات الغنية ثاني كبريتيد 11. باستخدام اندماج DsbC وأساليب إنتاجية عالية، في غضون أسبوع التعبير القابلة للذوبان من أهداف متعددة يمكن ملاحظة 11 ثم متغيرات إضافية، مثل تلك التي نوقشت في المقدمة، ويمكن عرضه في الجولات اللاحقة على تلك الأهداف التي تتطلب مزيدا من التحسين. وتهدف البروتوكولات الموصوفة هنا في التعبير عن البروتينات ثاني كبريتيد الغنية والببتيدات. ومع ذلك، بالنسبة للمستخدمين الذين يرغبون في إكسبالبروتينات غير شبكية ريس بطريقة إنتاجية عالية، وقد نشرت البروتوكولات المقابلة سابقا ويمكن العثور عليها في أي مكان آخر 22،24.
الإعداد إنتاجية عالية مثالية لعدد من التطبيقات، بما في ذلك فحص عدد كبير من البروتينات المختلفة للتعبير قابلة للذوبان أو فحص عدد كبير من بنيات التعبير (بما في ذلك مختلف الانصهار به) لعدة الجينات المستهدفة في نفس الوقت ( أو التعبير متعددة يبني لهدف واحد) من أجل تحسين معدلات النجاح. ويمكن أيضا أن تستخدم منصة لقياس والتحقق من بروتوكولات جديدة على عدد كبير من الأهداف. وتشمل التطبيقات الأخرى فحص المتغيرات لهدف صعب واحد، على سبيل المثال، كل orthologs أو أفراد من عائلة واحدة، أو لاختبار نجاح الإنتاج من لجنة من المسوخ من هدف واحد في تجربة واحدة. كما تم استخدام هذا البروتوكول في تركيبة مع ناقلات شارك في التعبير (الطرافة ح واحد الموسومة البروتين فقط) للسماح للالمنسدلة وتوصيف الأولية للمجمعات البروتين البروتين يتبعه أكثر تحليل شامل الفيزيائية الحيوية لتأكيد تشكيل معقدة الصحيح والعناصر المتفاعلة 33. كمية البروتين المنقى مناسبة في بعض الأحيان لفحوصات الدقيقة (اختبارات وظيفية، البروتين DNA 34 أو البروتين البروتين المقايسات التفاعل). وهناك العديد من المزايا للإنتاجية عالية استراتيجية الفحص التعبير: (ط) القدرة على اختبار عدد كبير من الأهداف أو عدد كبير من المتغيرات في تجربة واحدة، (ب) الاختلاف محدودة دفعة إلى دفعة، (ج) و البساطة وسهولة العمل على نطاق أصغر باستخدام الآبار العميقة، (د) قابلية التوسع والتكاثر في نطاق أوسع، (ت) إمكانية التشغيل الآلي، و (السادس) بساطة تتبع والتعامل مع (أي وسم أنابيب الفردية، وأقل أخطاء أدخلت عند استخدام شكل لوحة من التعامل مع أنابيب الفردية في خلط أو تبادل من الحيوانات المستنسخة).
الطبقة = "jove_content"> على الرغم من أن لم تناقش في قسم البروتوكول، وهناك العديد من الاعتبارات الهامة لإعداد التجربة التي سيتم مناقشتها بإيجاز أدناه. للاطلاع على مناقشة أكثر شمولا يرجى الاطلاع على المنشور السابق 24. لأقصى قدر من الكفاءة، من المفيد أن يكون هناك نظام مناسب لإنتاجية عالية الاستنساخ، لتبسيط الاستنساخ الفرعي أعداد كبيرة من الأهداف. للمرحلة الأولى من المشروع VENOMICS، ونحن الاستفادة من نظام إعادة التركيب تنوعا بوابة 25 التي تسمح subcloning في أي ناقلات الوجهة بوتيرة مئات من الحيوانات المستنسخة في الأسبوع. بروتوكولات لبوابة إعادة التركيب الاستنساخ ويمكن الاطلاع على موقع إينفيتروجن. وتشمل بدائل أخرى لإنتاجية عالية الاستنساخ-ربط مستقلة الاستنساخ (LIC) 35،36 وخالية من التقييد (RF) استنساخ 37. هناك طرق متعددة للحصول على الجينات المستهدفة للتعبير، بما في ذلك عن طريق الحمض النووي PCR من القالب، من مجموعات استنساخ دخول أو كماالجينات الاصطناعية، والتي هي الاستراتيجية المختارة للمشروع VENOMICS. ويمكن طلب الجينات الاصطناعية مع مواقع إعادة التركيب على كل نهاية التوليف الجيني والجينات يتيح سهولة الأمثل كودون تسلسل الجين الهدف (استبعاد نادرة E. القولونية الكودونات). ويوصى هذا ولكنه ليس أساسيا. للأهداف دون كودون الأمثل التي تحتوي على عدد كبير من كودونات نادرة، رشيد 2 (DE3) pLysS (الذي يحمل tRNAs للكودونات النادرة التي لا يتم التعبير عن غاية في كولاي) قد يكون أكثر ملاءمة من BL21 (DE3) pLysS. في حين أن هناك سلالات المتاحة التي تحد من خفض السندات ثاني كبريتيد في البيئة والحد من عادة السيتوبلازم، في أيدينا أنها لم تكن ناجحة كما E. العادية القولونية سلالات 11.
يتم إجراء تنقية تقارب نطاق والتحليلية من الثقافات اختبار التعبير من أجل استرداد البروتينات القابلة للذوبان والانصهار تقدير الغلة. ويمكن الحصول على البيانات الكمية على اله غلة قابلة للذوبان البروتينات الانصهار أعرب ضمن مجموعة من ،1-100 ملغ / لتر من الثقافة. إذا كان الهدف غير قابل للذوبان والتعبير والحث درجات الحرارة البديلة، والسلالات أو وسائل الإعلام يمكن اختبارها قبل أن يتم السعي شركاء الانصهار مختلفة. للتعبير عن ذوبان البروتينات ثاني كبريتيد الغنية، ونحن في المرتبة سابقا تأثير شركاء الانصهار كما DsbC> DsbA> GST> MBP> TRX> HIS علامة للتعبير حشوية 11. التعبير محيط بالجبلة هو احتمال آخر قد تساعد للطي الناجح لأهداف ثاني كبريتيد الغنية. والجبلة المحيطية هي بيئة خفض أقل من السيتوبلازم ويحتوي على المحرمين الأكسدة مفيدة لمساعدة ثاني كبريتيد الترابط. يتم ترجمة DsbC، DsbA، وMBP البروتينات عادة إلى الجبلة المحيطية التي كتبها متواليات إشارة محيط بالجبلة بهم. هذا يتيح الفرصة لاستغلال هذه العلامات لتوجيه أهداف ثاني كبريتيد الغنية إلى الفضاء محيط بالجبلة من أجل مساعدة للطي. لأهداف مستعصية على الحل، فإن الخطوة التالية هي عurify الهدف غير قابلة للذوبان HIS الموسومة من الهيئات إدراج، وذوبان refold (هذا هو خارج نطاق هذا البروتوكول ولن يتم مناقشتها هنا 3 9). وهذا يمكن أن يكون بسيطا إلى حد ما للأهداف مع واحد فقط أو اثنين من السندات ثاني كبريتيد، ولكنه يصبح أكثر صعوبة حيث بلغ عدد السندات ثاني كبريتيد الزيادات. بدلا من ذلك، وخاصة بالنسبة للبروتينات والببتيدات مع أربعة أو أكثر من السندات ثاني كبريتيد، فإنه قد يكون من المفيد محاولة نظم الإنتاج أكثر تعقيدا مثل الخميرة، أو التعبير الحشرات الثدييات.
مع التقدم في التصغير والأتمتة، سوف بالمشاركه الكهربية المختبر على واحد في رقاقة التكنولوجيات 28 سيكون بلا شك طريق المستقبل للتحليلات الوظيفية. ونحن نتصور أن لمعظم الأغراض (ربما باستثناء الدراسات البنيوية) وهذا سوف ينفي الحاجة إلى الثقافات على نطاق واسع. سوف الثقافات الصغيرة أن تكون مفيدة ليس فقط لفحص ظروف التعبير، ولكن أيضا أن تكون قادرة على توفير SUFتبلغ ficient من العينة لهذه المقايسات الفنية المنمنمة. فإن القدرة على إنتاج أهداف متعددة بالتوازي بكميات كافية لتوصيف وظيفي خفض تكاليف زراعة واستخدام هذا النوع من المنصات، والتعبير وتوصيف البروتينات المؤتلف تصبح أكثر تكلفة وفعالية من حيث الوقت.
البروتوكولات هنا تم تطبيقها على التعبير عن الببتيدات والبروتينات الغنية ثاني كبريتيد في المرحلة الأولية للمشروع FP7 VENOMICS الأوروبي. السموم هي مصدر ممتاز من الببتيدات النشطة بيولوجيا التي غالبا ما تنطوي على إمكانات الدوائية مثيرة للاهتمام. ومع ذلك، إنتاجها يمثل تحديا بسبب أنماط معقدة ثاني كبريتيد الربط، وحجمها صغير. باستخدام منصات عالية الإنتاجية مثل واحد الموصوفة هنا، يهدف المشروع VENOMICS لإنشاء مكتبة من 10،000 الببتيدات السم رواية لإعادة إنتاج التنوع التي لوحظت في الطبيعة. سوف تستغل هذه المكتبة لتوصيف ثاني كبريتيد-Rالببتيدات معنوى مع الدوائية المحتملة أو التطبيقات العلاجية بهدف تطوير أدوية جديدة. ويجري حاليا استخدام منصة لقياس والتحقق من صحة بروتوكولات جديدة لاستخدامها في المشروع VENOMICS.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
وأيد هذا العمل من قبل المشروع VENOMICS والأوروبية منحة المشروع N ° 278346 من خلال برنامج الإطاري السابع (FP7 الصحة 2011-2015). المشروع VENOMICS هو التعاون بين عدة مؤسسات البحوث والشركات في أوروبا:
AFMB، إيكس مرسيليا جامعة (فرنسا)، CEA Saclay (فرنسا)، NZYTech (البرتغال)، SistemasGenomicos (إسبانيا)، جامعة لياج (بلجيكا)، VenomeTech (فرنسا)، Vitamib (فرنسا)، نيوزيلندا فارما (الدنمارك)
وأيد هذا العمل من قبل البنية التحتية الفرنسية لعلم الأحياء الإنشائية المتكاملة (FRISBI) ANR-10-INSB-05-01.
فإن الكتاب أود أيضا أن أشكر السيد جيريمي Turchetto للمساعدة في التحضير للإطلاق النار على الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| Tecan Freedom EVO 200 liquid handling robot | Tecan Group Ltd. | Protocols can be adapted to any liquid handling robot with a vacuum manifold for plates. http://www.tecan.com/platform/apps/product/index.asp?MenuID=2694&ID=5270&Menu=1&Item=21.1.8 | |
| 96-well PCR (PCR96) plates | Greiner Bio-One | 652270 | http://us.gbo.com/bioscience/detail/2504/ |
| LB medium | Autoclaved for sterility. | ||
| Antibiotic stocks | Kanamycin (50 mg/ml), ampicillin (100 mg/ml), chloramphenicol (34 mg/ml in ethanol), store stocks at −20 °C. Use a 1:1,000 dilution. | ||
| Deep-well 96 (DW96) plate with 2.42 ml volume capacity | Greiner Bio-One | 780270 | Autoclaved for sterility. http://us.gbo.com/bioscience/detail/2462/ |
| Expression vectors | For the expression of target constructs. Store at −20 °C. | ||
| BL21 (DE3) pLysS competent cells | Or alternative E. coli expression strain of the user's choice. Store at −80 °C. | ||
| Breathseal breathable adhesive film | Greiner Bio-One | 676050 | |
| PCR machine with 96-well plate block | For the transformation heat shock and boiling of SDS-PAGE/Caliper samples. | ||
| 24-well sterile tissue culture plates | Greiner Bio-One | 662165 | http://us.gbo.com/bioscience/detail/2220/ |
| LB-agar | Autoclaved for sterility. | ||
| 200 μl sterile disposable tips | Tecan Group Ltd. | 30 038 617 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Multitron shaking incubator, with 3 mm throw | Infors | AJ103 | Not essential, a regular shaking incubator can also be used. http://www.infors-ht.com/index.php/en/ |
| Plate incubator | |||
| Microtiter plate | For glycerol stocks and elution using purification protocol B. | ||
| Glycerol | For the preparation of glycerol stocks. | ||
| 200 μl disposable tips | Tecan Group Ltd. | 30 038 616 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Adhesive tape pads | Qiagen | 19570 | http://www.qiagen.com/Products/Catalog/Lab-Essentials-and-Accessories/Tape-Pads |
| Bactinyl | Orapi Group | Or equivalent microbial disinfectant. | |
| ZYP-5052 medium | See Table 1 for recipes of components. | ||
| Deep well 24 (DW24) plates, 10 ml capacity | Whatman | 7701-5102 | Autoclaved for sterility. http://www.whatman.com/UNIPLATECollectionandAnalysisMicroplates.aspx#7701-5102 |
| Flat-bottomed, clear microtiter plate | Greiner Bio-One | 655101 | For absorbance readings. http://us.gbo.com/bioscience/detail/2029/ |
| Plate reading spectrophotometer | Optional. For measuring OD600 of cultures. | ||
| Centrifuge with rotor for deep well plates | Suitable for 3,800 x g. | ||
| Lysozyme | 50 mg/ml in water. Store at −20 °C. | ||
| Imidazole ACS grade | Merck | IX0005-1 | A high quality grade of imidazole must be used so that it will not interfere with A280 readings for calculating protein yield. |
| Lysis buffer | 50 mM Tris, 300 mM NaCl, 10 mM imidazole pH 8 containing 0.25 mg/ml lysozyme (or your preferred buffer). Add lyzozyme from stocks each time and do not store for extended periods. | ||
| Water bath | |||
| Plate sonicator (Ultrasonic processor XL, adapted for deep well plates) | Misonix Inc. | Not essential. Lysozyme alone is normally sufficient for nearly complete lysis. | |
| DNase | 2 mg/ml stock in water, filter sterilized. Store aliquots at −20 °C. | ||
| Magnesium sulphate (MgSO4) | 2 M stock in water, autoclaved. | ||
| SDS-PAGE or Caliper sample buffer | |||
| Binding buffer | 50 mM Tris, 300 mM NaCl, 10 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| Wash buffer | 50 mM Tris, 300 mM NaCl, 50 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| Elution buffer | 50 mM Tris, 300 mM NaCl, 250 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| 96-well Receiver/Filter Plate 20 µm, 1.8 ml capacity | Macherey-Nagel | 740686.4 | http://www.mn-net.com/ProductsBioanalysis/Accessories/tabid/10909/language/en-US/Default.aspx |
| 200 μl disposable wide bore tips | Tecan Group Ltd. | 30 050 348 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Ni Sepharose 6 Fast Flow resin | GE Healthcare | 17-5318-02 | For purification of target fusion proteins. Store at 4 °C. Wash and equilibrate before use. http://www.gelifesciences.com/webapp/wcs/stores/servlet/productById/en/GELifeSciences/17531802 |
| Tobacco Etch Virus (TEV) protease | Optional, for cleavage. 2 mg/ml, without reducing agents in storage buffer. Store at −80 °C. | ||
| 96-well 0.22 µm filter plate | Millipore | MSGV N22 10 | Optional. To filter the soluble fraction after cleavage. http://www.millipore.com/catalogue/item/msgvn2210 |
| SDS-PAGE/dot blot equipment or Caliper Labchip GXII equipment | Electrophoresis apparatus and choice of gel type is at the user’s discretion. | ||
| Spectrophotometer and cuvettes | For measuring absorbance at 280 nm (A280) to calculate yield of soluble proteins. Not required if the analysis is done on the Caliper. | ||
| ZipTip pipette tips | Millipore | Optional. The type of ZipTip is at the user's discretion. C4 resin should be used for larger proteins, while for peptides C18 may be better. Alternative methods for desalting of samples may also be used to clean up samples before further quality control. http://www.millipore.com/catalogue/module/c5737#0 | |
| Materials are listed in the order in which they are required in the Protocol section. Reagents can be stored at room temperature unless noted otherwise. Reference numbers for the author’s preferred choice of materials are provided, however equivalent products may also be suitable. For reagents where the brand will not influence the outcome of the experiment, the company details have been omitted. | |||
References
- Berrow, N. S., et al. Recombinant protein expression and solubility screening in Escherichia coli: a comparative study. Acta Crystallographica Section D-Biological Crystallography. 62, 1218-1226 (2006).
- Correa, A., Oppezzo, P. Tuning different expression parameters to achieve soluble recombinant proteins in E. coli: advantages of high-throughput screening. Biotechnol J. 6, 715-730 (2011).
- Graslund, S., et al. Protein production and purification. Nat Methods. 5, 135-146 (2008).
- Vera, A., Gonzalez-Montalban, N., Aris, A., Villaverde, A. The conformational quality of insoluble recombinant proteins is enhanced at low growth temperatures. Biotechnol Bioeng. 96, 1101-1106 (2007).
- Graslund, S., et al. The use of systematic N- and C-terminal deletions to promote production and structural studies of recombinant proteins. Protein Expr Purif. 58, 210-221 (2008).
- Bird, L. E. High throughput construction and small scale expression screening of multi-tag vectors in Escherichia coli. Methods. 55, 29-37 (2011).
- Davis, G. D., Elisee, C., Newham, D. M., Harrison, R. G. New fusion protein systems designed to give soluble expression in Escherichia coli. Biotechnol Bioeng. 65, 382-388 (1999).
- Kapust, R. B., Waugh, D. S. Escherichia coli maltose-binding protein is uncommonly effective at promoting the solubility of polypeptides to which it is fused. Protein science: a publication of the Protein Society. 8, 1668-1674 (1999).
- LaVallie, E. R., Lu, Z., Diblasio-Smith, E. A., Collins-Racie, L. A., McCoy, J. M. Thioredoxin as a fusion partner for production of soluble recombinant proteins in Escherichia coli. Methods Enzymol. 326, 322-340 (2000).
- Marblestone, J. G., et al. Comparison of SUMO fusion technology with traditional gene fusion systems: enhanced expression and solubility with SUMO. Protein science: a publication of the Protein Society. 15, 182-189 (2006).
- Nozach, H., et al. High throughput screening identifies disulfide isomerase DsbC as a very efficient partner for recombinant expression of small disulfide-rich proteins in E. coli. Microb Cell Fact. 12, 37 (2013).
- Sachdev, D., Chirgwin, J. M. Fusions to maltose-binding protein: control of folding and solubility in protein purification. Methods Enzymol. 326, 312-321 (2000).
- Smith, D. B. Generating fusions to glutathione S-transferase for protein studies. Methods Enzymol. 326, 254-270 (2000).
- de Marco, A., Deuerling, E., Mogk, A., Tomoyasu, T., Bukau, B. Chaperone-based procedure to increase yields of soluble recombinant proteins produced in E. coli. BMC Biotechnol. 7, 32 (2007).
- Hatahet, F., Nguyen, V. D., Salo, K. E., Ruddock, L. W. Disruption of reducing pathways is not essential for efficient disulfide bond formation in the cytoplasm of E. coli. Microb Cell Fact. 9, 67 (2010).
- de Marco, A. Recent contributions in the field of the recombinant expression of disulfide bonded proteins in bacteria. Microb Cell Fact. 11, 129 (2012).
- Katzen, F., Beckwith, J. Disulfide bond formation in periplasm of Escherichia coli. Methods Enzymol. 348, 54-66 (2002).
- Klint, J. K., et al. Production of recombinant disulfide-rich venom peptides for structural and functional analysis via expression in the periplasm of E. coli. PloS One. 8, e63865 (2013).
- Braud, S., et al. Dual expression system suitable for high-throughput fluorescence-based screening and production of soluble proteins. Journal of Proteome Research. 4, 2137-2147 (2005).
- Douzi, B. G. A., et al. A new system for expressing recombinant animal toxins in E. coli. (Collection Rencontres en Toxicologie, Publications de la SFET, Chatenay-Malabry). Advances and new technologies in toxinology. , 149-152 (2010).
- Groisillier, A., et al. MARINE-EXPRESS: taking advantage of high throughput cloning and expression strategies for the post-genomic analysis of marine organisms. Microb Cell Fact.. 9, 45 (2010).
- Vincentelli, R., et al. High-throughput protein expression screening and purification in Escherichia coli. Methods. 55, 65-72 .
- Xiao, R., et al. The high-throughput protein sample production platform of the Northeast Structural Genomics Consortium. Journal of Structural Biology. 172, 21-33 (2010).
- Saez, N. J., Vincentelli, R., Chen, Y. W. Ch3 High-throughput expression screening and purification of recombinant proteins in E. coli. Structural Genomics: General Applications : Methods in Molecular Biology. 1091, 33-53 (2014).
- Katzen, F. Gateway (R) recombinational cloning: a biological operating system. Expert. Opin. Drug Discov. 2, 571-589 (2007).
- Vincentelli, R., Canaan, S., Offant, J., Cambillau, C., Bignon, C. Automated expression and solubility screening of His-tagged proteins in 96-well format. Analytical Biochemistry. 346, 77-84 (2005).
- Studier, F. W. Protein production by auto-induction in high density shaking cultures. Protein Expr Purif. 41, 207-234 (2005).
- Spencer, C. I., et al. Ion channel pharmacology under flow: automation via well-plate microfluidics. Assay Drug Dev Technol. 10, 313-324 (2012).
- Sala, E., de Marco, A. Screening optimized protein purification protocols by coupling small-scale expression and mini-size exclusion chromatography. Protein Expr Purif. 74, 231-235 (2010).
- Moon, A. F., Mueller, G. A., Zhong, X., Pedersen, L. C. A synergistic approach to protein crystallization: combination of a fixed-arm carrier with surface entropy reduction. Protein science: a publication of the Protein Society. 19, 901-913 (2010).
- Zanier, K., et al. . Structural basis for hijacking of cellular LxxLL motifs by papillomavirus E6 oncoproteins. 339, 694-698 (2013).
- Kapust, R. B., Tozser, J., Copeland, T. D., Waugh, D. S. The P1' specificity of tobacco etch virus protease. Biochemical and Biophysical Research Communications. 294, 949-955 (2002).
- Vincentelli, R., Romier, C. Expression in Escherichia coli: becoming faster and more complex. Current Opinion in Structural Biology. 23, 326-334 (2013).
- Jolma, A., et al. DNA-binding specificities of human transcription factors. Cell. 152, 327-339 (2013).
- Aslanidis, C., de Jong, P. J. Ligation-independent cloning of PCR products (LIC-PCR). Nucleic Acids Research. 18, 6069-6074 (1990).
- Haun, R. S., Serventi, I. M., Moss, J. Rapid, reliable ligation-independent cloning of PCR products using modified plasmid vectors. BioTechniques. 13, 515-518 (1992).
- van den Ent, F., Lowe, J. RF cloning: a restriction-free method for inserting target genes into plasmids. Journal of Biochemical and Biophysical Methods. 67, 67-74 (2006).
- Vincentelli, R., et al. High-throughput automated refolding screening of inclusion bodies. Protein science: a publication of the Protein Society. 13, 2782-2792 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved