Method Article
High Throughput Screening expressão quantitativa e Purificação Aplicada à recombinante Dissulfeto ricos em proteínas veneno produzido em
Neste Artigo
Resumo
Um protocolo para o, a expressão elevada rendimento quantitativo de rastreio e purificação de análise de proteínas de fusão em pequena escala a partir de culturas de Escherichia coli é descrita e aplicada para a expressão de proteínas alvo veneno animais ricos em disulfureto.
Resumo
Escherichia coli (E. coli) é o sistema de expressão mais amplamente utilizado para a produção de proteínas recombinantes para estudos estruturais e funcionais. No entanto, a purificação de proteínas é muitas vezes difícil uma vez que as proteínas são expressas numa forma insolúvel. Quando se trabalha com metas difíceis ou múltiplas é, portanto, recomenda-se usar alto rendimento (HTP) a expressão da proteína de triagem em pequena escala (1-4 ml culturas) para identificar rapidamente as condições para expressão solúvel. Para lidar com os vários programas de genoma estrutural do laboratório, uma quantitativa (em um intervalo de 0,1-100 mg / L cultura de proteína recombinante) e proteína HTP protocolo expressão rastreio foi implementado e validado em milhares de proteínas. Os protocolos foram automatizadas com o uso de um tratamento de robô líquido, mas também pode ser executada manualmente, sem equipamento especializado.
Proteínas do veneno rico em dissulfeto estão ganhandocrescente reconhecimento por seu potencial como líderes de drogas terapêuticas. Eles podem ser altamente potente e seletivo, mas suas redes de ligação dissulfeto complexos torná-los difíceis de produzir. Como um membro do projeto FP7 Europeia Venomics ( www.venomics.eu ), o nosso desafio é desenvolver estratégias de produção de sucesso com o objectivo de produzir milhares de proteínas do veneno novas para a caracterização funcional. Ajudado pelas propriedades redox de ligação dissulfeto isomerase DsbC, adaptamos nossa linha de produção HTP para a expressão de oxidados, peptídeos do veneno funcionais no E. citoplasma coli. Os protocolos são também aplicáveis para a produção de diversas proteínas ricas em dissulfureto. Aqui demonstramos nosso pipeline aplicada para a produção de proteínas do veneno de animais. Com os protocolos aqui descritos, é provável que as proteínas ricas em dissulfureto solúveis serão obtidos em tão pouco como uma semana. Mesmo a partir de uma pequena escala, há o potencial para usar the proteínas purificadas para validar o estado de oxidação por espectrometria de massa, para a caracterização em estudos-piloto, ou por micro-ensaios sensíveis.
Introdução
Motivados pelo avanço da genômica e ritmo acelerado de descoberta de novas proteínas, dutos de alto rendimento têm sido desenvolvidas para paralelizar as abordagens tradicionais para a triagem e identificação de estratégias de produção de proteína ideal. Variáveis potenciais que ser optimizados incluem, mas não estão limitadas a, estirpes de expressão que varia de 1,2, 3,4 temperatura, meios de 2,3, 5-alvo variantes, 6-13, parceiros de fusão de co-expressão com o acompanhante 14,15, citoplasmática ou periplasmáticas expressão 16-18, e tampão de purificação de componentes 3. Com a implementação de abordagens de alto rendimento, muitas variáveis ou muitos alvos podem ser testadas em paralelo com um alto nível de eficiência, enquanto limita a variação de lote para lote. Em nossa experiência, a estratégia também dá uma boa reprodutibilidade após scale-up usando a mesma cultura (temperatura, meios de comunicação, aeração, etc) e as condições de purificação (mesmo resin, tampões, etc). Várias plataformas de alto rendimento tem sido utilizado na última década para identificar as condições para a expressão de proteínas solúveis, isto é, através de parâmetros variáveis, tais como parceiros de fusão, as estirpes de expressão ou a temperatura 19-23.
Recentemente utilizado nossa abordagem de triagem de alto rendimento para a expressão de proteínas ricas em dissulfureto solúveis 11. As proteínas foram selecionados não só a partir de fontes venenosas, mas também incluiu inibidores da enzima rica em dissulfeto de uma grande variedade de espécies, incluindo plantas, porcos, vacas e seres humanos. O ensaio comparou os efeitos de 12 parceiros de fusão diferentes e três estirpes diferentes de expressão em que a solubilidade e dobragem de 28 proteínas reticuladas por dissulfureto. Nós demonstramos que o uso DsbC como um parceiro de fusão para a produção no BL21 (DE3) pLysS vastamente outproduced (tanto em rendimento e número de proteínas solúveis obtidos) qualquer outra combinação de tensão e fusão testadas 11. Oresultados desta experiência formou a base para a adaptação a tubagem originais geral de alto rendimento (que foi utilizado para o rastreio de uma grande variedade de proteínas de expressão) 22,24 para um mais adequado para a expressão de alvos ricos em disulfureto. Proteínas ricas em dissulfureto de venenos de animais, são de particular interesse. Venenos são uma mistura complexa de peptídeos e proteínas bioativas, com valor potencial farmacologicamente e terapeuticamente. No entanto, a expressão de proteínas dissulfureto contendo ligação não é trivial. Estas proteínas contêm geralmente entre 1-7 ligações dissulfureto, e deve ser oxidado com os padrões de ligação dissulfureto-correcção, a fim de ser activo. Atualmente, a plataforma está sendo usado para o rastreio a expressão de um grande número de proteínas do veneno de animais ricos em dissulfeto, como parte do Projeto VENOMICS europeu FP7 (www.venomics.eu) e aferição de novos protocolos para a expressão de alta taxa de transferência de milhares de alvos . Aqui, um método automatizadoé fornecido para a produção elevada de pequena escala de triagem expressão e purificação (ver Figura 1) aplicado a proteínas do veneno de animais dissulfureto-rico. A estratégia para o dissulfureto péptidos e proteínas ricas utiliza uma cauda de His para purificação e o parceiro de fusão redox-activo, DsbC, criando cliváveis fusões HIS-DSBC para as proteínas-alvo (ver Figura 2).
Embora o foco dos protocolos aqui é automatização usando um manuseamento electroforese robô e HTP líquido, estes métodos são também adequados para uma abordagem manual de alto rendimento, o que significa que mesmo os laboratórios com uma configuração básica podem tirar vantagem dos protocolos sem qualquer pré-requisito para o equipamento caro . Protocolos manuais para a transformação para a purificação e análise (não específica a proteínas ricas em dissulfeto) ter sido publicado anteriormente 24 e não será repetida aqui. A taxa de transferência do procedimento manual (do clone de expressão, produzidos por recombinaçãoclonagem nacional 25, para análise de níveis de proteína solúvel) é de 96 (utilizando a detecção de SDS-PAGE) ou de 384 (4 x 96, utilizando dot blot e SDS-PAGE 26) culturas por semana (ver Figura 1). Este pode ser aumentado se for realizado de forma semi-automatizada (utilizando um robot de manuseamento de líquidos e dot blot 26 ou electroforese HTP, tal como com um sistema Caliper GXII LabChip 22 para análise de resultados) a até 1152 (12 x 96) culturas em paralelo mais de uma semana, tal como aqui descritos. A cultura é realizada em poço profundo 24 format (DW24) para que as incubadoras agitação regulares pode ser usado em contraste com as culturas cultivadas no poço profundo 96 format (DW96), que exigem o uso de incubadoras orbitais curtos agitação de alta velocidade para arejamento suficiente (agitação a 800 rpm). O uso de meios de auto-indução 27 também simplifica a expressão, eliminando a etapa de indução manual. Mesmo onde os laboratórios já usam expressão e puri pré-definidoficação condições, estes podem ser transferidos directamente para o sistema HTP simplesmente para melhorar a eficiência. Um esquema detalhado da alta gasoduto throughput screening para proteínas ricas em dissulfeto é fornecido na Figura 3. Os parâmetros no pipeline foram selecionados com base em extensas experiências de rastreio 11, 22, o que nos permitiu escolher as condições mais úteis para a produção de proteínas.
Caracterização pode ser realizada sobre as proteínas marcadas são purificadas directamente a partir de expressões de pequena escala em estudos-piloto onde dezenas de microgramas de amostra é suficiente, ou para ensaios funcionais sensíveis e ensaios de ligação (por exemplo, sistemas de baixo volume do patch HTP braçadeira 28). O mesmo pode ainda ser realizada sobre os alvos não marcados depois da clivagem, desde que a etiqueta e a protease são removidos (por exemplo, por HPLC de fase inversa). O controle de qualidade pode também ser realizada por espectrometria de massa (para confirmar o tamanho esperado e oxidação rcomi) ou métodos cromatográficos (para confirmar a pureza ou a heterogeneidade) 29. Às vezes, marcar a clivagem é desnecessário ou até mesmo indesejável (particularmente para as proteínas pouco solúveis 30,31), por isso, esta clivagem protocolo é opcional. Independentemente disso, em todas as construções existe um sítio de clivagem de protease de TEV (ENLYFQ / [L] 32) precedendo directamente o gene alvo para a produção de proteína nativa após clivagem (ver Figura 2 e Discussão). Se a clivagem da marca de fusão é desejada, a clivagem pode ser testado (na fracção de eluição ou 'na coluna') em pequena escala para analisar a eficiência, a optimização das condições exigidas e, se obter estimativas fiáveis de rendimentos para experiências subsequentes de aumento de escala.
Há duas opções para o volume de esferas utilizadas durante a purificação por afinidade, de acordo com os objectivos e as expectativas do experimento. Para ser capaz de captar tanta proteína quanto possível (para purificar por ensaios-piloto ou MS, ou para extrapolComemos por rendimentos de aumento de escala) num volume final de 200 ul de resina deve ser utilizado, permitindo a detecção de proteína solúvel no intervalo de 1-100 mg / L de cultura antes da saturação do sistema (ver protocolo (A) no ponto 8.1) . No entanto, se o objectivo da experiência é a detecção de pequenas quantidades de proteínas solúveis, em seguida, num volume final de 50 ul de resina é adequada, permitindo a detecção de proteína solúvel no intervalo de 0,1-25 mg / l de cultura (ver protocolo (B ) na Seção 8.2).
A produção pode ser aumentado, se necessário, para obter quantidades de miligrama de alvos purificadas para estudos estruturais e funcionais, utilizando as condições estabelecidas para a expressão solúvel. Os detalhes de protocolos de scale-up usados no AFMB foram discutidas em outros lugares 22,24.
Mais detalhes relevantes para a configuração experimental, etapas críticas no âmbito do protocolo, modificações e resolução de problemas e limitações da técnica são fornecidos no discoussion. Por favor, leia a discussão antes de iniciar os experimentos.
Durante os protocolos que esperar uma taxa de sucesso de 90% em cada passo (por exemplo, pelo menos 90% das culturas devem crescer em qualquer etapa). Se a taxa de sucesso de qualquer passo na experiência cai abaixo de 90%, as amostras são descartados e a experiência é repetida para a recolha completa de construções. No entanto, esta taxa de sucesso não é aplicável ao número de construções que expressam proteínas solúveis ou como a percentagem de construções que clivam com uma eficiência de 100%, como este será altamente dependente das proteínas ensaiadas.
Os detalhes específicos para o set-up da mesa de trabalho do robô são fornecidas para cada protocolo (ver também Figura 4), porém eles podem ser adaptados conforme necessário para mesa de trabalho alternativa set-ups. O hardware do robô (Tecan) consiste de um braço de 96 multicanal (MCA96), manipulador robótico (Roma) e do chefe de manipulação de líquidos de 8 canais (Liha). Todos os passos que utilizam a MCA96 também pode ser realizada utilizando o LIHA se uma MCA96 não está disponível, no entanto demoram mais tempo porque a LIHA terão de ser lavadas entre as etapas. Enquanto o robô não é tecnicamente um ambiente estéril, a inclusão de antibióticos geralmente assegura que não existem problemas com a contaminação ou a esterilidade.
Protocolo
Parte A: Transformação e Expressão Teste
Procedimentos manuais para clonagem 22 e transformação de purificação são discutidos noutro local 24. O protocolo de transformação pode ser totalmente realizado no robô 26, mas geralmente é mais para fazê-lo manualmente eficiente em termos de tempo. Por conseguinte, os protocolos aqui começar a partir da inoculação das pré-culturas de expressão e plaqueamento da transformação a partir da transformação de calor chocado mistura feito manualmente. Para mais detalhes sobre os procedimentos de clonagem e transformação manuais consulte as referências relevantes 22,24.
1. Precultura e chapeamento
- Prepare a mesa de trabalho robô (veja a Figura 4 para os cargos):
- Coloque uma calha de 300 ml contendo 150 ml de caldo LB estéril (suplementado com ampicilina (100 ug / ml) / cloranfenicol (34 ug / ml), ou outro antibiótico apropriado) na posição 8.
- Coloque um DW estéril96 na posição 11. Coloque 4x pré-preparada de 24 poços LB agar (Amp / CAM) placas de cultura de tecidos (contendo 2 ml de agar em cada poço) com suas tampas em em posições 14 a 17.
- Colocar a placa de transformação (que contém a mistura de transformação 96 após choque térmico) na posição 13. Isto será usado para inocular as pré-culturas líquidas e placas de agar LB. Coloque uma caixa de estéreis pontas de pipeta 200 mL na posição 18.
- Usando o braço 96 multicanal (MCA96) e 200 ul dicas, aspirado de 200 mL de caldo de LB (posição 8), e dispensar no DW96 na posição 11. Repetir até que não é um volume final de 1 ml de caldo de LB em cada poço de o DW96. Isto vai tornar-se a pré-cultura líquida.
- Usando o manipulador robótico (Roma), remover a tampa da primeira placa de 24 poços de agar LB e colocá-lo noutro local (por exemplo, num transportador de hotel) até que o revestimento é terminado para aquela placa.
- Usando o líquido de 8 canais manipulação (liha) cabeça, misture, em seguida, aspirar 50 mL de tele a primeira coluna de mix transformação na posição 13. Este volume de mistura de transformação é apenas o suficiente para cobrir o LB-Agar bem.
- Com os primeiros 4 canais, de dispensar para a primeira coluna da primeira placa de 24 poços de agar LB a posição 14 (como mostrado na Figura 5).
- Com os últimos quatro canais, para dispensar a segunda coluna da primeira placa de 24 poços de agar LB.
- Lave todas as dicas muito bem depois de dispensar.
- Continuar o processo até que todas as transformações foram plaqueadas sobre a primeira placa na posição 14, a transferência de 96 - de 24 poços, usando o esquema proporcionado na Figura 5.
- Uma vez que a primeira placa foi concluída, use os ciganos para substituir a tampa e retire a tampa da próxima placa na posição 15. Continue a utilizar o esquema de chapeamento para os próximos 3 placas.
- Uma vez chapeamento está terminado, defina o Te-Shake a 1.200 rpm e agitar todas as placas de 1 min para ter uma distribuição homogênea da mistura de transformação.
- Usando o MCA96 e as pontas das pipetas originais, misturar em seguida aspirado de 60 ul da mistura de transformação restante (posição 13) e distribua no DW96 contendo caldo LB na posição 11.
- Vedar as precultura DW96 com película adesiva respirável para permitir que a cultura de aeração.
- Colocar numa incubadora a 37 ° C com agitação a velocidade máxima de O / N (200/800 rpm, dependendo agitador orbital).
- As placas de agar LB deve ser colocado numa campânula com as suas tampas fora até secar (10 minutos). Em seguida, são colocados invertido em uma placa de 37 ° C incubadora até a manhã seguinte.
- No dia seguinte, a pré-cultura é usada para inocular a expressão de ensaio no meio de auto-indução e para a preparação de stocks de glicerol. Coloque as placas de ágar em uma geladeira, como um back-up. Se necessário, a partir das placas de agar ou os estoques de glicerol, a expressão de teste poderiam ser re-feito por inoculação de uma pré-cultura LB fresco directamente.
2. Preparação de DW24 ZYP-5052 Plates
NOTA: Este procedimento leva cerca de 5 min para completar para cada conjunto de placas 4x DW24.
- Certifique-se 500 ml de meio de auto-indução ZYP-5052 para cada repetição de 96 culturas (média 464 ml ZY, 250 mL 2 M MgSO 4, 10 ml 50x 5052, 20x 25 ml NPS, nessa ordem - as receitas para cada componente são fornecida no Quadro 1) suplementado com os antibióticos apropriados.
- Prepare a mesa de trabalho do robô:
- Colocar duas calhas 300 ml, cada um contendo aproximadamente 250 ml de meio na posição 5 e 6. Coloque quatro placas DW24 estéreis nas posições 14 a 17. Coloque 200 ul pontas na posição 18.
- Usando o MCA96 e 200 ul dicas, aspirado de 200 ul de ZYP-5052 a partir da posição 5 e dispensar para a primeira placa de DW24 na posição 14. Fazer isto um total de 5 vezes (quatro pontas irá dispensar para um único poço de uma vez para um total de 4 ml). Repita o procedimento para os restantes 3 placas x DW24 em posições 15 a 17, switChing ao ZYP-5052 na posição 6 para os dois últimos DW24 placas.
3. Inoculação e crescimento das culturas expressão de teste
NOTA: A inoculação demora cerca de 10 min para completar para cada conjunto de placas 4x DW24, eo crescimento continua O / N.
- Prepare a mesa de trabalho do robô:
- Colocar a placa de DW96 contendo os pré-culturas (a partir do passo 1.15) na posição 11. Colocar os quatro DW24 placas contendo meio ZYP-5052 (a partir do passo 2.3), em posições 14 a 17.
- Usando o aspirado LIHA 100 mL de pré-cultura a partir da posição 11 para inocular as culturas de expressão de teste (1/40 de diluição) usando o esquema proporcionado na Figura 5. Lavar a cabeça LIHA completamente na estação de lavagem entre cada coluna de pré-culturas de 96 cavidades.
- Selar as placas com película de DW24 respirável e incubar a 37 ° C com agitação (200/400 rpm) durante 4 horas. Este é o tempo da fase de crescimento, durante o qual glucose do meio será preferencialmente ser esgotado 27.
- Reduzir a temperatura a 17 ° C. Depois de 4 horas e a depleção de glicose, lactose vai começar a ser metabolizado, o que leva à indução da expressão, desde que as condições óptimas de crescimento para BL21 (DE3) pLysS ou 2 Rosetta (DE3) pLysS, neste trabalho 22. Deixe as células para expressar O / N. Use o pré-cultivo restante para fazer estoques de glicerol.
4. Preparação de Stocks glicerol
NOTA: stocks glicerol deve ser feita em triplicata a ser armazenados em locais diferentes, em caso de falha do congelador.
- Prepare a mesa de trabalho do robô:
- Coloque placas de microtitulação na posição 5 a 7 para abrigar os estoques de glicerol. Coloque um 300 ml de calha cheia com 50 ml de 100% de glicerol na posição 8. Coloque um DW96 contendo 800 mL de pré-cultura (após o passo 3.2) em cada poço na posição 11. Coloque 200 ul pontas na posição 18.
- Usando um sloaspiração e distribuição de velocidade w, use o MCA96 e 200 ul dicas para adicionar glicerol na DW96 contendo os pré-culturas.
- Aspirar 200 ul de glicerol (a partir da posição 8).
- Dispensar 150 ul (na posição 11) primeiro, em seguida, uma pausa de 20 segundos para permitir que o restante glicerol a alcançar o fundo da ponta. Dispensar os restantes 50 ul.
- Usando as mesmas pontas, misturar a cultura e glicerol na DW96 na posição 11 até serem completamente misturados. A concentração final de glicerol é de 20%. Aspirar 140 ul do DW96 e dispensar para a primeira placa de microtitulação na posição 5.
- Repetir o passo 4.3 para cada placa de microtitulação restante (posições 6 e 7).
- Selar cada uma das placas de microtitulação de plástico com uma fita adesiva e armazenar a -80 ° C. Descartar o restante cultura no DW96, descontaminar com um agente antimicrobiano antes do descarte.
5. Avaliação do Crescimento das culturas
NOTA: Normalmente, não é necessária para avaliar a taxa de crescimento final como o OD final de 600 é geralmente o mesmo para a maioria das culturas (cerca de 12 nestas condições), porém nenhum culturas que não crescem devem ser observados.
- Tome 50 ul de cada cultura (do passo 3.4) e dispensar em uma placa de microtitulação claro de fundo chato contendo 150 mL de meio.
- Medir a OD 600, tendo em conta a diluição de 4 vezes. Se houver algum que não crescem muito bem, note que este para a análise final.
6. Colheita das células
NOTA: Este procedimento leva aproximadamente 45 minutos para ser concluído.
- Centrifugar as placas 4x DW24 (a partir do passo 3.4) a 3000 xg durante 10 min, em seguida, descartar o sobrenadante para um recipiente de resíduos contendo agente antimicrobiano. Toque as placas, de cabeça para baixo, em papel absorvente para retirar o excesso de qualquer meio.
- No entanto, preparar 100 ml de lisetampão (50 mM Tris, 300 mM de NaCl, 10 mM de imidazol, pH 8, ou outro tampão preferido) contendo lisozima (concentração final de 0,25 mg / ml).
- Prepare a mesa de trabalho do robô:
- Coloque o tampão de lise numa calha 300 ml na posição 5. Coloque um DW96 limpa na posição 11. Colocar as placas 4 x DW24 contendo os peletes de células a partir do passo (6.1), em posições 14-17. Coloque 200 dicas ul na posição 18.
- Usando o MCA96 e 200 ul dicas, aspirado de 125 ul de tampão de lise a partir de posição 5 e dispensar em cada placa de DW24 (posições 14-17). Repetir. NOTA: 4 dicas irá dispensar para um único poço de uma vez para um volume final de 1 ml em cada poço das placas de DW24.
- Agite as placas em posições 14-17 usando o Te-Shake (1.000 rpm) por 15 min para voltar a suspender as pelotas.
- Uma vez que as peletes são ressuspensas, usar os primeiros 4 canais do LIHA para aspirar 550 ul das amostras de 1 a 4 (a primeira coluna da primeira DW24, na posição 14), em seguida, utilizando o last quatro canais do aspirado LIHA 550 ul de amostras de 5 a 8 (a segunda coluna da primeira DW24). Distribui-se a primeira linha do DW96 na posição 11.
- Repetir o passo 6.6, de modo que toda a suspensão celular é transferida para o DW96.
- Depois de cada conjunto de amostras lavar as pontas liha na estação de lavagem.
- Repita os passos de 6,6-6,8 para cada coluna em cada placa de DW24 (posições 15-17), utilizando o esquema proporcionado na Figura 5. Selar com um filme de plástico.
- Para a purificação, no mesmo dia ou congelamento de curto prazo, armazenar a -80 ° C durante um mínimo de 1 hora, caso contrário, armazenar a -20 ° C.
Parte B: Purificação e Análise
7. Lise celular
NOTA: Este procedimento leva cerca de 60 minutos para ser concluído.
- Descongelar as suspensões de células congeladas a partir do passo (6.10) em um banho de água (à TA ou 37 ° C) durante aproximadamente 15 minutos e ressuspender no incubador com agitação por um umdicional 10 min. As culturas devem tornar-se viscosa.
- Tome 500 mL de estoque DNase e misture com 1 ml de MgSO4 estoque. Manualmente com uma pipeta de 8 canais ou com o robô LIHA, dispensar 15 ul a cada poço da DW96, para dar uma concentração final de 10 ug / ml de DNase e 20 mM de MgSO4.
- Re-selar a placa com fita plástica e agitar por mais 15 min. Neste ponto, as culturas devem ser não-viscoso. Verifique com cuidado (através de um exame visual) de que todas as culturas não são mais viscoso. NOTA: Este é crítica, se algumas culturas são ainda viscoso (por exemplo, se a ADNase foi acidentalmente esquecidos ou não dispensada apropriadamente em alguns poços), o filtro vai obstruir, gerando uma pressão desigual sobre as amostras e transbordamento ou entupimento total do placa de filtro pode acontecer durante a purificação.
- Para amostras de SDS-PAGE de todo o ligado celular, aspirado de 10 ul de lisado e dispensar em uma placa de 96 poços contendo PCR10 ml de tampão de amostra 4x SDS-PAGE e 20 l de água. Desnaturar durante 3 min a 95 ° C e congelar até à análise (fracção total). Se um sistema de eletroforese HTP está disponível, as amostras podem ser analisadas neste lugar seguindo o protocolo recomendado pelo fabricante para a preparação da amostra. Para mais detalhes sobre a análise das amostras ver a Secção 10.
8. Ni Purificação por afinidade
NOTA: A velocidade de aspiração lento deve ser usado para todas as suspensões de resina de pipetagem, como as suspensões são bastante espessos. Sobre-secagem da resina vai resultar em uma redução na capacidade de ligação. Para a purificação, as concentrações de imidazole especificados são aplicáveis a resina de afinidade com níquel. Se forem utilizados íons alternativas (por exemplo, cobalto), em seguida, as concentrações devem ser ajustados em conformidade.
- A - Ni purificação por afinidade para a detecção na gama de 1-100 mg / L (volume final da resina = 200 ul)
NOTA: To procedimento de purificação leva cerca de 1,5 horas para se completar, o que significa que se a 4 pode ser realizada em um dia.- Prepare a mesa de trabalho do robô:
- Coloque 300 ml de calhas contendo tampão de ligação (Tris 50 mM, NaCl 300 mM, imidazol 10 mM, pH 8), tampão de lavagem (Tris 50 mM, NaCl 300 mM, imidazol 50 mM, pH 8) e tampão de eluição (50 mM Tris, 300 mM NaCl, 250 mM de imidazol, pH 8) nas posições 6 e 8, respectivamente.
- Deixar um vazio de 300 ml calha na posição 5 para a suspensão de resina. Na posição 9 e 10 suportes de placa de venda. Na posição 10 colocar um DW96 com o bloco de SPE e placa de filtro / receptor (20 mm) no topo.
- Coloque o DW96 contendo o lisado (a partir do passo 7.3) na posição 14. Na posição 18 e 19 de colocar as 200 dicas furo mL de largura e 200 dicas ml, respectivamente. Coloque duas placas DW96 peças para a lavagem e eluição em um hotel. NOTA: Também pode ser colocado em um local alternativo na mesa de trabalho se um hotel não está disponível.
- Prepare 105ml de equilibrada 33% pasta de resina (35 ml de resina + 70 ml de tampão de ligação). Adicionar a suspensão de resina, para a calha na posição 5, imediatamente antes do início do procedimento.
- Usando o MCA96 e 200 ul dicas furo largas (posição 18), misturar a pasta de resina na posição 5 exaustivamente antes de aspirar e dispensar a 200 ul de suspensão de resina à DW96 contendo o ligado na posição 14. Repita duas vezes para que 600 ul de suspensão de resina foi adicionado ao lisado, a mistura da suspensão de resina, antes de cada aspiração.
- Realizar uma etapa de mistura de 10 min, utilizando o MCA96 na posição 14 para permitir a ligação e para impedir que a resina de granulação.
- Aspirar a partir da posição 14 e dispensar 800 ul (em 200 ul lotes) para a placa de filtro na posição 9, a mistura antes de cada aspiração caso contrário a resina vai ser retido na parte inferior do DW96.
- Ligue o vácuo na na posição 10 para cerca de 90 segundos para filtrar o ligado através da placa para oDW96 para recolher o flow-through, tomando cuidado para não secar a resina. Ligue o vácuo desligado.
- Repita os passos 8.1.5 e 8.1.6, de modo que toda a resina é em seguida na placa de filtro.
- Usando o braço RoMa mover o bloco de SPE segurando a placa de filtro a partir da posição 10 para a posição 9, de modo que o próximo passo de lavagem vai directamente para o lixo e transferir o DW96 contendo o fluxo de passagem na posição 10 para outro local (por exemplo, para um hotel veículo) até ao fim do procedimento.
- Com um novo conjunto de pontas 200 ul (na posição 19), lava-se a resina (na posição 9) com um total de 800 ul de tampão de ligação (a partir da posição 6), e aplicar o vácuo na posição 9, até que o buffer tenha passado através . Repita mais uma vez.
- Use o braço RoMa para colocar um novo DW96 na posição 10 para recolher a lavagem imidazol 50 mM e mover o bloco SPE e placa de filtro de volta ao topo (posição 10).
- Adicionar 800 mL de tampão de lavagem a partir da posição 7 para a posição 10, gire ovácuo até que o tampão tem de passar. Desligue o off vácuo.
- Com a ROMA, remova o bloco SPE e placa de filtro para a posição 9 eo DW96 contendo a amostra de lavagem para o hotel, e mantê-lo de lado até o fim do procedimento.
- Lava-se a resina com mais 800 ul de tampão de lavagem (a partir da posição 7 para a posição 9), aplicam-se a vácuo até que o buffer passou. Repita mais uma vez.
- Use os ciganos para colocar um novo DW96 na posição 10 e coloque o bloco SPE e placa de filtro de volta ao topo para coletar a eluição.
- Adicionar um total de 500 ul de tampão de eluição (a partir da posição 8 na posição 9) e incuba-se in situ, durante 3 min. Ligue o vácuo até todo o tampão de passou.
- Opcional: Para expressar as proteínas altamente, uma segunda eluição pode ser realizada em um fresco DW96 como nos passos 8.1.14 e 8.1.15.
- Tome amostras do escoamento, lavar e eluição / s para SDS-PAGE ou eletroforese HTP.
- Para amostras de SDS-PAGE do flow-through, dispensar 10 ml em uma placa de 96 poços PCR contendo 10 ml de tampão de amostra 4X SDS-PAGE e 20 l de água. Para amostras de SDS-PAGE da lavagem e eluição / s dispensar 30 ul em placas de PCR contendo 10 ul de tampão de amostra de SDS-PAGE de 4x. Desnaturar durante 3 min a 95 ° C e congelar até à análise.
- Para amostras de eletroforese HTP, siga as instruções do fabricante. Para mais detalhes sobre a análise das amostras ver a Secção 10.
- Prepare a mesa de trabalho do robô:
- B - Ni de purificação por afinidade para a detecção na gama de 0,1-25 mg / L (volume final da resina = 50 ul)
NOTA: Este procedimento de purificação leva cerca de 30 minutos para completar, o que significa que cerca de 12 pode ser realizada em um dia.- Prepare a mesa de trabalho do robô:
- Coloque 300 ml de calhas contendo tampão de ligação (Tris 50 mM, NaCl 300 mM, imidazol 10 mM, pH 8), tampão de lavagem (50 mM Tris, 300 mM de NaCl, 50 mM de imidazol, pH 8)e tampão de eluição (50 mM Tris, 300 mM de NaCl, 250 mM de imidazol, pH 8) nas posições 6 e 8, respectivamente.
- Deixar um vazio de 300 ml calha na posição 5 para a suspensão de resina. Na posição 9 e 10 suportes de placa de venda. Na posição 10 colocar um DW96 com o bloco de SPE e placa de filtro / receptor (20 mm) no topo.
- Coloque o DW96 contendo o lisado (a partir do passo 7.3) na posição 14. Na posição 18 e 19 colocou 200 mL dicas furo de largura e 200 dicas ml, respectivamente. Coloque uma placa de 96 poços de microtitulação de reposição para a eluição em um hotel. NOTA: Este também poderia ser colocado em um local alternativo na mesa de trabalho se um hotel não está disponível.
- Preparar 50 ml de 25% de pasta equilibrada resina (resina de 12,5 ml + 37,5 ml de tampão de ligação). Adicionar a suspensão de resina, para a calha na posição 5, imediatamente antes do início do procedimento.
- Usando o MCA96 e 200 dicas furo mL de largura (posição 18), misture a pasta de resina na posição 5 exaustivamente antes de aspirar e dispensing 200 ul de suspensão de resina à DW96 contendo o ligado na posição 14.
- Incubar à temperatura ambiente com agitação, utilizando o Te-shake a 1400 rpm durante 10 min para permitir a ligação.
- Aspirar a partir da posição 14 e completa a dispensar 1,200 mL (em 200 ul lotes) utilizando as pontas de furo largas (18) para posicionar a placa de filtro na posição 10. Misturar antes de cada aspiração caso contrário a resina vai ser retido na parte inferior do DW96.
- Ligue o vácuo na na posição 10 para cerca de 30 segundos para filtrar o ligado através da placa para a DW96 para recolher o fluxo de passagem, tendo o cuidado de não secar a resina. Ligue o vácuo desligado.
- Usando o braço RoMa, mover o bloco de SPE segurando a placa de filtro a partir da posição 10 para a posição 9, de modo que o próximo passo de lavagem vai directamente para o lixo e transferir o DW96 contendo o fluxo de passagem na posição 10 para outro local (por exemplo, numa hotel transportadora) até ao fim do procedimento.
- Com os 200 μl pontas (na posição 19), lava-se a resina (na posição 9) com um total de 800 ul de tampão de ligação (a partir da posição 6), e aplicar o vácuo na posição 9, até que o tampão tem de passar. Repetir.
- Use o braço RoMa para colocar o DW96 fresco na posição 10 para recolher a lavagem imidazol 50 mM e mover o bloco SPE e placa de filtro de volta ao topo (posição 10).
- Adicionar 150 ul de tampão de lavagem a partir da posição 7 para a posição 10, a girar no vácuo, até o tampão tem de passar. Desligue o off vácuo.
- Com a ROMA remover o bloco SPE e placa de filtro para a posição 9 eo DW96 que contém a amostra de lavagem para o hotel, e mantê-lo de lado até o fim do procedimento.
- Lava-se a resina com mais 800 ul de tampão de lavagem (a partir da posição 7 para a posição 9), aplicam-se a vácuo até que o buffer passou. Repetir.
- Use os ciganos para colocar a microplaca na posição 9 e colocar o bloco SPE e placa de filtro de volta ao topo de recolher ªe eluição.
- Adicionar 190 ul de tampão de eluição (a partir da posição 8 na posição 9) e incuba-se in situ, durante 3 min. Aplicar o vácuo até todo o tampão de passou.
- Tome amostras do escoamento, lavagem e eluição por SDS-PAGE ou eletroforese HTP.
- Para amostras de SDS-PAGE de fluxo de passagem, dispensar 10 ul numa placa de 96 poços de PCR contendo 10 ul de tampão de amostra de SDS-PAGE 4X e 20 ul de água. Para amostras de SDS-PAGE da lavagem e eluição / s dispensar 30 ul em placas de PCR contendo 10 ul de tampão de amostra de SDS-PAGE de 4x. Desnaturar durante 3 min a 95 ° C e congelar até à análise.
- Para amostras de eletroforese HTP, siga as instruções do fabricante. Para mais detalhes sobre a análise das amostras ver a Secção 10.
- Prepare a mesa de trabalho do robô:
9. Tag Cleavage (Opcional)
- Adicionar a protease TEV (2 mg / mL) para a proteína eluida (a partir do passo 8.1.15 (e 8.1,16) ou passo 8.2.14) em uma proporção de 1/10 (v / v).
- Incubar a temperatura ambiente (ou 4 ° C para proteínas sensíveis à temperatura) O / N com agitação suave.
- No final da clivagem dispensar 30 mL em uma placa de PCR contendo 10 ml de tampão de amostra 4x SDS-PAGE ou seguir as instruções do fabricante para amostras de eletroforese HTP.
- Filtra-se a mistura de clivagem remanescente (a partir do passo 9.2) através de um de 96 poços da placa de filtro de 0,22 um, e recolher o fluxo através solúvel num DW96 por aplicação de vácuo. Isto pode ser feito a um dos locais de vácuo (por exemplo, a posição 10) no tratamento de robô líquido, como para os passos de eluição nas Secções 8.1 e 8.2. Isso remove qualquer proteína que precipitou durante a clivagem.
- Após filtração, dispensar 30 ul numa placa de PCR contendo 10 ul de tampão de amostra de SDS-PAGE 4x ou preparar as amostras para electroforese HTP. Isto permite a comparação da proteína antes da clivagem, a mistura de clivagem e após o solenóideproteína uble remanescente após clivagem e dá boas indicações de os resultados esperados em experiências scale-up subseqüentes. Para mais detalhes sobre a análise das amostras ver a Secção 10.
10. Análise dos Resultados
- Identificar as construções que expressam a proteína solúvel por meio da análise das amostras de purificação em SDS-PAGE, mancha de pontos, ou sistema de electroforese HTP como o Caliper LabChip.
- Analisar as amostras de eluição em primeiro lugar para identificar construções produzem proteínas solúveis. Na maioria dos casos, apenas as amostras de eluição são analisados se construções solúveis são identificados, para minimizar o tempo gasto na análise.
- Se a proteína não está no eluição, executar as de lavagem e de escoamento amostras para ver se ele foi expressa e não se ligaram adequadamente à resina.
- Para construções onde nenhuma proteína solúvel podem ser detectados de execução de todo o lisado celular para ver se a proteína foi expressa.
NOTA: Uma limitação aqui é que se o protein de interesse não está presente acima dos níveis de expressão de fundo, pode não ser possível ver a proteína e pode levar a um falso negativo. Deve-se notar que é sempre possível para as proteínas de furar e precipitar sobre a resina de afinidade e isso pode levar a um falso negativo ou sub-estimativa do rendimento usando o protocolo recomendado (um evento raro neste trabalho). No caso em que a proteína precipita mediante eluição (um sedimento branco é visível de alguns minutos / hora após eluição), recomenda-se alterar a composição do tampão (por exemplo, a concentração de sal) e / ou realizar um ensaio fluorimétrico de varrimento diferencial para optimizar o tampões. Uma pequena amostra da resina também pode ser ressuspenso em tampão de amostra de SDS-PAGE e fervida para se detectar a proteína está a ser retida sobre a resina. - Se a proteína não foi expressa, mas as células que crescem, seguir uma nova estratégia de expressão, ou se a OD 600 não era suficientemente elevada regredir e reanálise da cultura. >
- Se as amostras de clivagem estão a ser analisados, eles devem ser analisadas de uma forma lado-a-lado, de modo que cada construção pode ser mostrado antes da clivagem de uma após a clivagem em faixas adjacentes, para simplificar a análise.
- A menos que utilizando um método que dá a quantificação directa da concentração de eluição, a quantificação seja realizada em amostras positivas através da medição da absorvância a 280 nm (A280).
- Medir a A280, tendo a extinção co-eficiente de proteína em conta e utilizando o tampão de eluição a um branco, para fornecer uma estimativa do rendimento de proteína com o fim de identificar as maiores construções solúveis que expressam.
- Para a comparação mais fiável dos rendimentos solúveis, recomenda-se para normalizar os rendimentos pela densidade da cultura (medida usando o OD 600), o qual foi tomado no ponto 5. Se todas as culturas cresceram para, aproximadamente, a mesma densidade, a normalização não é necessário.
- As amostras podem ser analisadas directamente a partir da amostra de eluição ou de clivagem por espectrometria de massa de cromatografia líquida (LC / MS).
- Alternativamente, dessalinizar primeiro (para remover o imidazol e quaisquer sais tampão, que podem estar presentes) utilizando pontas de pipetas ZipTip ou métodos de cromatografia líquida, em seguida, analisar o uso de matriz assistida por dessorção / ionização por laser tempo-de-voo (MALDI-TOF) ou ionização por electrospray ( ESI) espectrometria de massa.
- Estudos funcionais em pequena escala pode ser realizada para verificar se a função da proteína é o esperado. Se quantidades maiores são necessários para a função, uma cultura scale-up podem ser feitas e testadas a função da cultura mais ampla, uma vez tamanho e estado de oxidação foram confirmados em pequena escala.
Resultados
Os resultados representativos são mostrados na Figura 6, para o rastreio de 96 proteínas ricas em dissulfureto do oleoduto VENOMICS expressão. As proteínas são dispostas pelo aumento do número de ligações de dissulfureto, em seguida, o aumento do número de resíduos. Os péptidos foram expressas no citoplasma com uma cauda de His e DsbC parceiro de fusão. Ao utilizar as condições de cultura recomendados, um OD 600 de 12 é normalmente conseguida. Os peptídeos foram purificados usando o protocolo 8.2-B, com um volume final de 50 ul de resina de afinidade com níquel, de modo que um máximo de ~ proteína de 25 mg / L de fusão podia ser detectado nesta experiência.
A Figura 6A mostra o resultado da electroforese de o sistema Caliper LabChip (mostrando a fusão antes de clivagem) e o sistema de classificação baseado na extrapolação para se obter, em mg / L de cultura da proteína de fusão (em níveis de 0,1 a 2 mg / L de cultura, de 2 a 10 mg / L de cultura, 10 a 25 mg / L de cultura e nenhuma t detectado.) Note-se que a etiqueta de DsbC clivados normalmente trabalha a cerca de 32 kDa, em vez de 27 kDa, conforme o esperado. Similarmente, as fusões DSBC também executar cerca de 5 kDa, mais elevados do que o esperado. Para muitas das metas não só ver a fusão intacta (banda superior), mas também o parceiro de fusão sozinho (banda inferior). Para alguns desses alvos optimizar as condições de cultura podem melhorar o rácio de fusão intacta (banda superior) em comparação com DsbC sozinho permitindo um aumento do rendimento final. A pontuação é baseada apenas no nível de fusão intacta. Apenas 16 dos 96 proteínas não pode ser detectada ao nível de fusão. Isto corresponde a um nível de sucesso total de 83%. Dos 80 proteínas que poderiam ser detectados, que 45 destes foram detectados em níveis superiores a 2 mg / l de cultura (56%). Dependendo do alvo e de fusão, rendimentos proteicos são geralmente na gama de 2-100 mg / L de cultura (embora, neste exemplo, usando o protocolo B, no máximo 8,2 de ~ proteína de 25 mg / L de fusão pode ser detectado).
t "> Uma análise de sucesso por número de ligações dissulfureto presentes (como mostrado na Figura 6B) mostra sucesso razoável para todos os números de ligações dissulfureto testadas (entre 1 e 7), com o menor nível de sucesso de 66% para ser alvos contendo 6 dissulfureto títulos. uma análise da distribuição de expressão sucesso com base no ponto isoelétrico e número de resíduos (mostrado na Figura 6) mostra nenhum viés particular para a técnica, com ambos os objetivos e metas que não foram detectados espalhados por todo o enredo expressas com sucesso.A Figura 6D mostra um exemplo dos resultados obtidos por espectrometria de massa espectrometria de massa de ionização por electrospray (ESI-MS) para um único alvo, antes e depois da redução da amostra com DTT. Normalmente, este tipo de análise de espectrometria de massa exaustiva não precisa ser realizada (uma amostra reduzida não necessita de ser analisada), no entanto, para os fins de demonstratio completan temos mostrado ambos resultados. A meta apresentada é uma proteína do veneno rico em dissulfeto de 5,7 kDa, com 4 pontes dissulfeto. O espectro da esquerda mostra os resultados para a proteína antes da redução com DTT, como foi depois de clivagem e dessalinização, sem outra intervenção. O espectro do lado direito mostra a proteína depois da redução com DTT, seguido por dessalinização para remover qualquer excesso de DTT. Os íons correspondentes às massas experimentais são marcadas com setas no espectro ea designação para cada íon é mostrado em verde. As massas mãe experimentais calculados para estes iões (para a proteína antes da redução (-DTT) e após redução (+ DTT)) são mostrados na tabela. As massas (5709,6 Da para a amostra antes da redução e 5717,6 Da para a amostra reduzida) exibem uma diferença de massa de 8 Da. A diferença de massa de 2 Da corresponde à presença de uma ligação de dissulfureto oxidado, por conseguinte, uma diferença de massa de 8 Da indica a presença de 4 ligações dissulfureto (como esperado) ema amostra não reduzida.
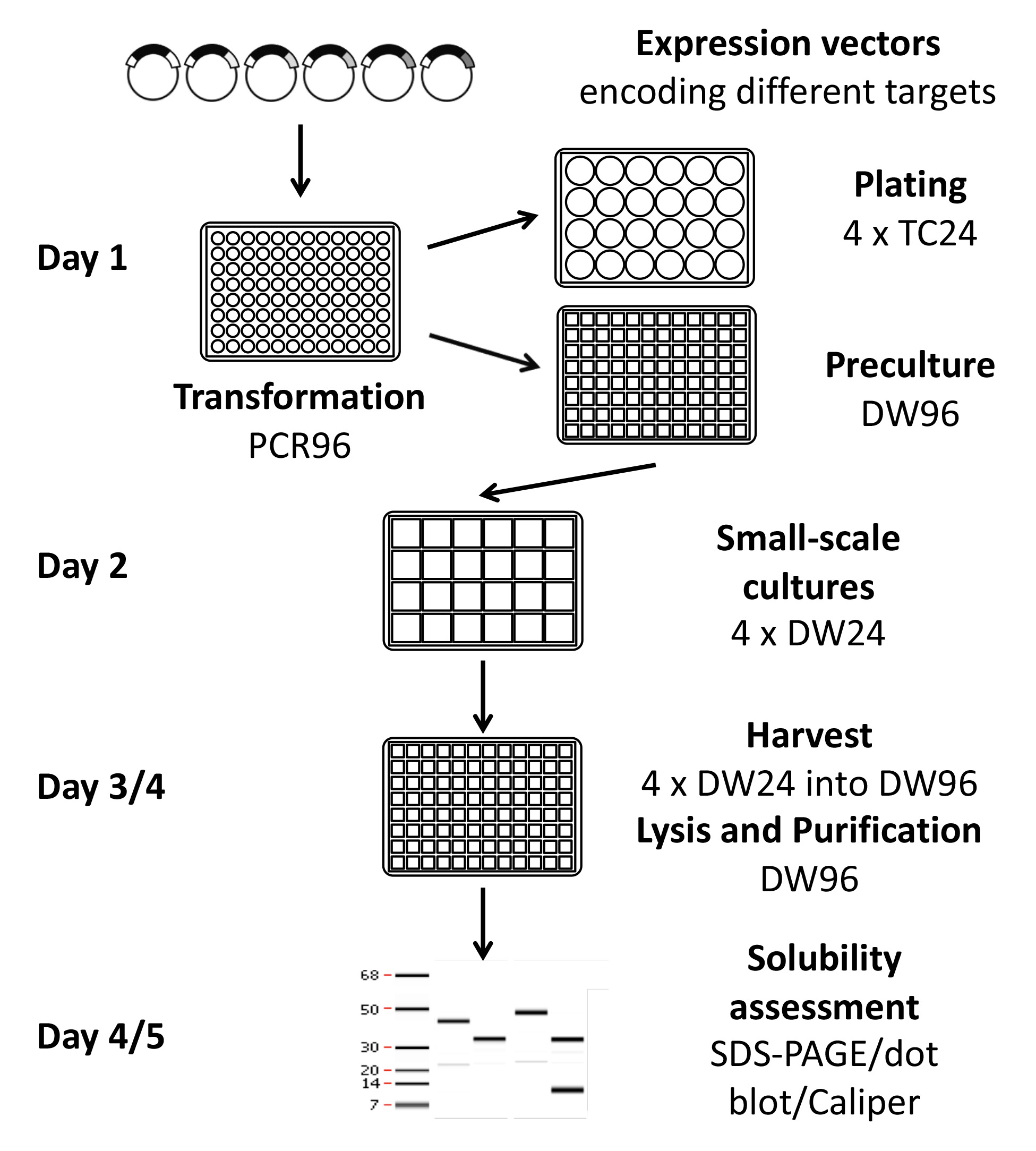
Representação Figura 1. Esquemática do protocolo de pesquisa de expressão de alto rendimento. Usando este protocolo, 96-384 condições podem ser testadas por uma única pessoa dentro de uma semana, utilizando métodos manuais, ou até 1152, com as condições do equipamento semi-automatizado descrito. Os plasmídeos de expressão são construídos utilizando uma tecnologia de clonagem de modo a que a recombinação numerosos alvos podem ser sub-clonados de uma só vez. Uma vez que as condições de expressão solúveis têm sido identificados e clivagem realizada, se desejado, a proteína pode proceder a um controlo de qualidade para verificar a pureza e a oxidação, microassays e / ou a produção em grande escala.
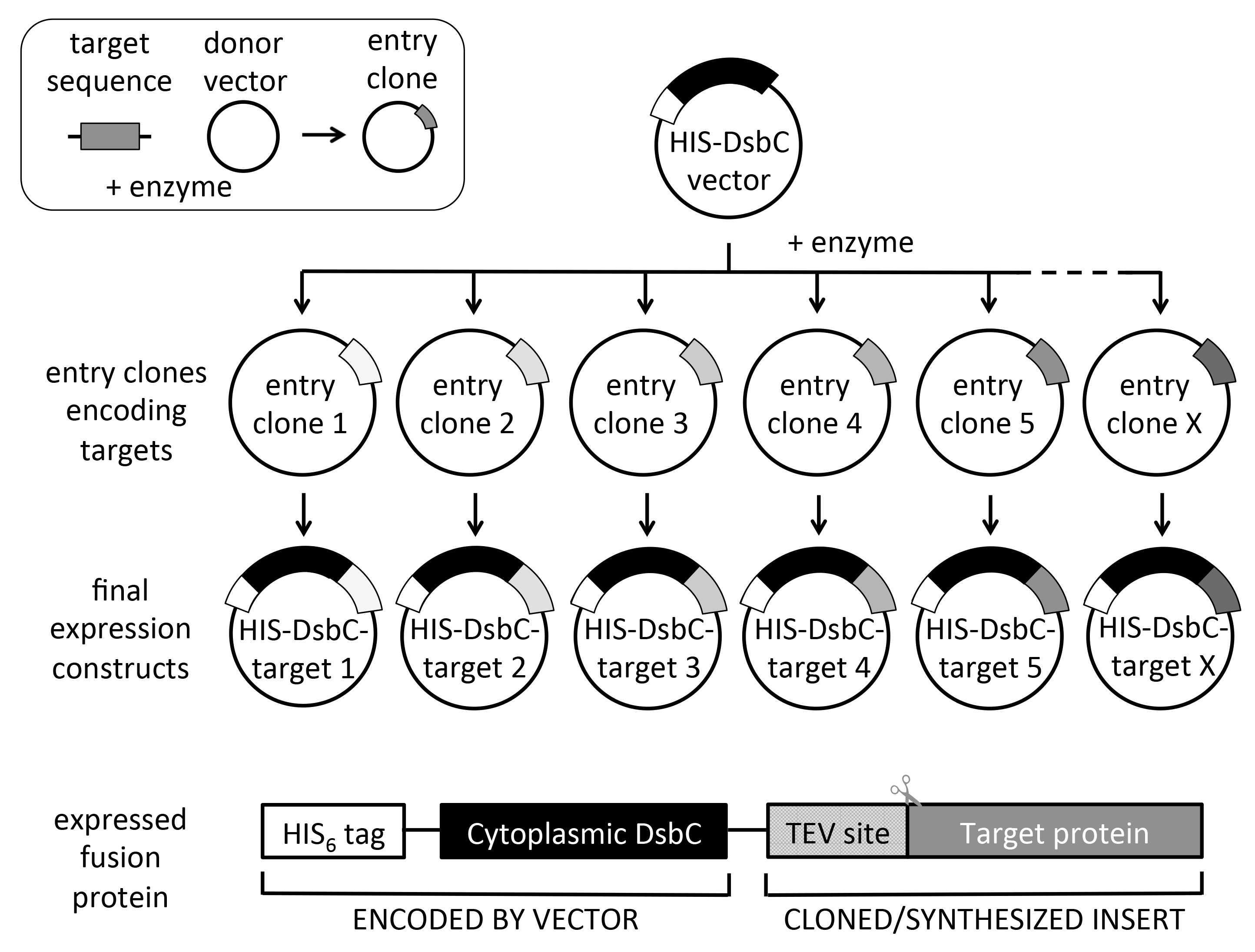
Figura 2. Esquema de clonagem recombinacional universal e construir design. Dos clones entrada alvo, vários vetores de expressão pode ser sub-clonado em um único experimento de uma forma de alto rendimento (até 6 x 96 clones de entrada em uma semana). A proteína expressa codifica uma cauda de His para purificação de afinidade de níquel. O DsbC (sem a sua sequência de sinal para a expressão periplasmática citoplasmático) parceiro de fusão é utilizado para aumentar a solubilidade e / ou auxílio de dobragem e oxidação correctas da proteína alvo. Note-se que a sequência de codificação do alvo deve conter um sítio de protease TEV N-terminal (ENLYFQ) se tag clivagem é desejada. A inserção na parte superior esquerda mostra a produção de clones de entrada utilizando um vector dador e as sequências alvo, que pode ser obtido por PCR ou síntese de genes. Clones de entrada também podem ser obtidas a partir de colecções de clones de entrada comerciais. Vários sistemas de clonagem recombinacional estão disponíveis, no entanto, utilizar o syste gatewaym, tal como mostrado no esquema.
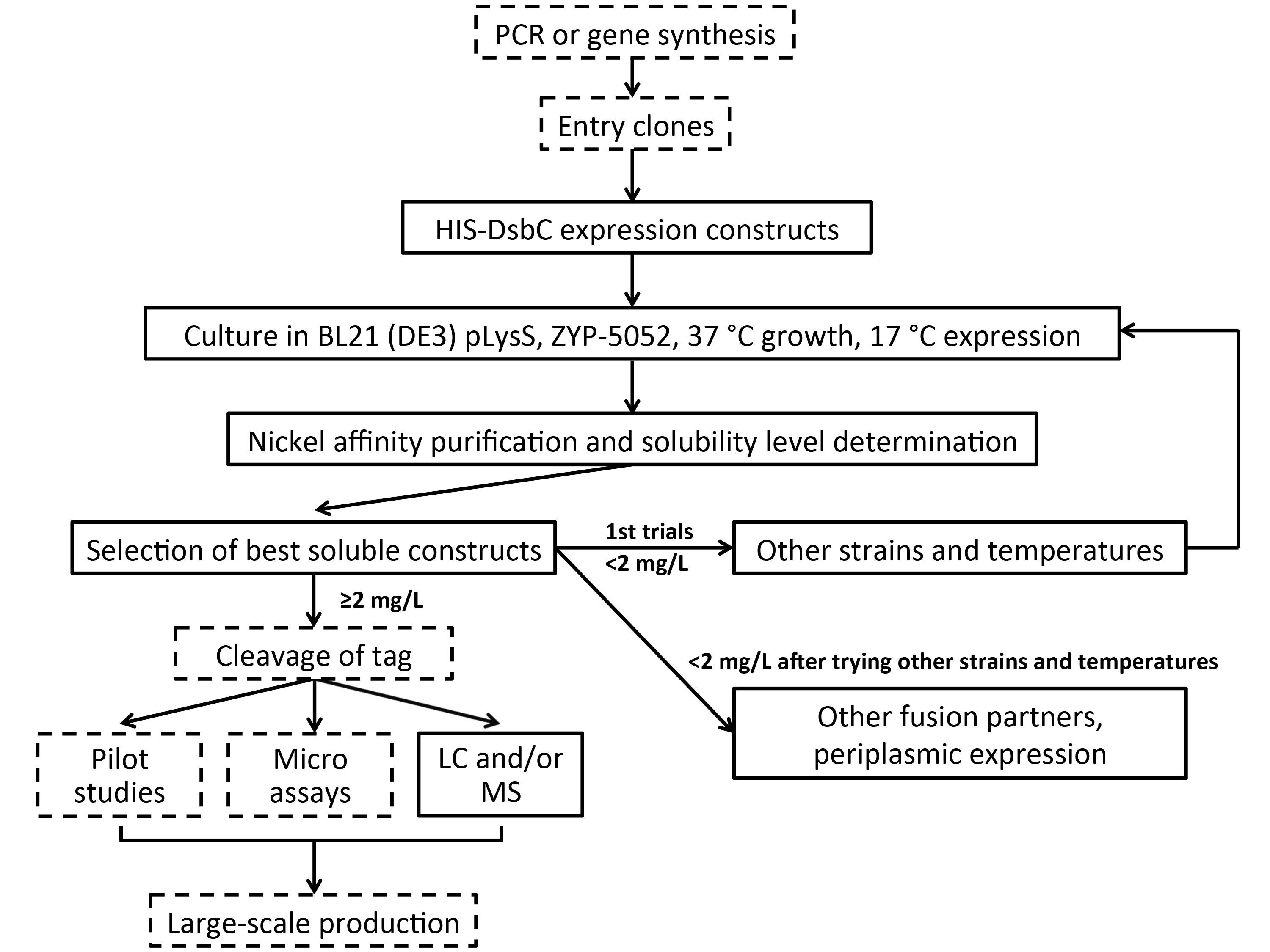
Alta transferência oleoduto rastreio Figura 3. De alvos múltiplos rico em dissulfureto. Alvos são inicialmente expressos como fusões HIS-DSBC no citoplasma das células BL21 (DE3) pLysS de E. coli em 37/17 ° C utilizando um meio de auto-indução (ZYP-5052). A purificação é realizada em resina de níquel, seguido por detecção de construções solúveis por electroforese HTP (ou com dot blot / SDS-PAGE). Se a primeira rodada de expressão rastreio não for bem sucedida, as condições de cultura alternativos são julgados. Se construções produzem proteínas solúveis em altas o suficiente rendimentos, microassays e controle de qualidade pode ser realizada e, se necessário, a produção em larga escala pode ser perseguido. Para alvos onde os rendimentos solúveis não são altos o suficiente, a expressão de triagem pode continuar com stra alternativains e as temperaturas, em seguida, outros parceiros de fusão e de expressão periplasmic. Os passos opcionais são indicados por caixas tracejadas.
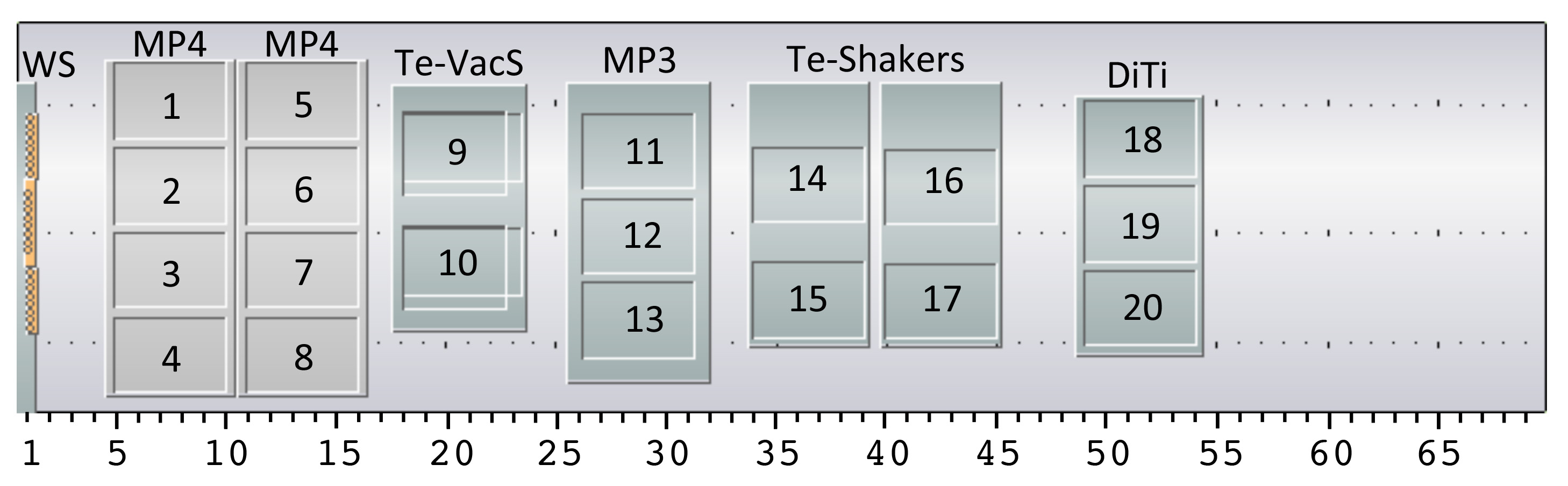
Configuração Figura 4. Robô da mesa de trabalho para a plataforma HTP. A disposição do nosso líquido manuseamento robô mesa de trabalho é apresentado, apesar de mesas de trabalho alternativas também podem ser utilizadas desde há locais equivalentes disponíveis. A instalação consiste em uma estação de lavagem (WS) para o (8 canais cabeça manipulação de líquidos (liha)), dois portadores de microplacas com 4 posições cada (MP4, posições 1-4 e 5-8), uma estação de vácuo com 2 posições (Te-VAC, posições 9 e 10), um portador de microplacas com 3 posições (MP3, posições 11-13), dois shakers placa com 2 posições de cada um (Te-Shakers, posições 14-15 e 16-17) e um transportador para pontas descartáveis com 3 posições (Diti, posições 18-20). Além disso, ore são dois porta do hotel para placas de poços profundos e um para microplacas (não mostrado). O hardware instalado no robô de manipulação de líquidos é um braço de 96 multicanal (MCA96) para uso com pontas descartáveis, uma cabeça de 8 canais de manipulação de líquidos (liha) com pontas fixas e um manipulador robótico (Roma) que se move placas / equipamentos em torno de a mesa de trabalho. A numeração das posições é referida em todo o protocolo.

Figura 5. Esquemático por transferência a partir de uma única placa de 96 poços em quatro placas de 24 poços.

Figura 6. Resultados representativos são mostrados para a tela de 96 rico em dissulfeto de veneno pro expressãoproteínas. As proteínas foram expressas como fusões HIS-DSBC no citoplasma e purificados utilizando 50 mL de resina de níquel (Protocolo 8.2-b). A) Expressão triagem resultados, mostrando gel virtual e marcando para o rendimento expressão. O contraste no gel virtual foi ajustado pista-a-pista para compensar bandas muito fracos ou intensos. Note-se que para alguns alvos duas bandas pode ser visto, a banda superior corresponde à proteína de fusão intacta e a banda inferior correspondente à marca de fusão por si só. B) A proporção de proteínas expressas em cada nível de expressão em comparação com o número de ligações de dissulfureto em a proteína. O número real de proteínas em cada grupo é sobreposto no gráfico. C) A distribuição dos níveis de expressão com base no ponto isoeléctrico (pi) e do número de resíduos. D) Um exemplo dos resultados de espectrometria de massa para um veneno rico em dissulfureto de 5,7 kDa proteína com 4 pontes dissulfeto. O espectro emo lado esquerdo mostra a proteína antes da redução com DTT e o espectro do lado direito mostra a proteína reduzida com DTT e depois dessalinizada. Os íons correspondentes às massas experimentais são marcadas com setas e suas atribuições são mostrados em verde. As massas experimentais para a proteína antes e após a redução da redução são mostrados na tabela e apresentam uma diferença de massa de 8 Da, correspondente à presença de proteína oxidada antes da adição do agente redutor. Clique aqui para ver uma versão maior desta figura .
| Componente | Receita | Comentário |
| ZY | ~ 928 ml 10 g de triptona 5 g de extracto de levedura 925 ml de água | Misture e autoclave para esterilizar. |
| 2 M MgSO4 | 100 ml 49,3 g de MgSO 4 7H 2 O · ~ 60 ml de água | Mexa até dissolver, em seguida, autoclave para esterilizar. |
| 50x 5052 | 1 L 250 g de glicerol 730 ml de água 25 g de glucose 100 g α-lactose | Adicionar em seqüência, mexa em fogo até que todos dissolvido depois autoclave para esterilizar. |
| 20x NPS | 1 L 900 ml de água 66 g de (NH 4) 2 SO 4 136 g de KH 2 PO 4 142 g de Na 2 HPO 4 | Adicionar em seqüência e mexa até ficar tudo dissolvido depois autoclave para esterilizar. |
Tabela 1. Receita para componentes do meio ZYP-5052.
Discussão
Não existe um protocolo universal único para a expressão de dobradas, as proteínas solúveis, funcionais. Para ser eficiente em termos de custos e de tempo, a maioria dos laboratórios ou instalações de centrais de proteínas que trabalham com múltiplos alvos, portanto, usar a expressão da proteína de alta throughput screening para encontrar a melhor combinação "genérico" de variáveis para se obter uma proteína solúvel ativo para a maioria dos alvos. Identificámos DsbC como sendo um parceiro de fusão de aplicação geral para a expressão solúvel de péptidos e proteínas 11 rico em dissulfureto. Utilizando fusões DsbC e métodos de elevada capacidade, dentro de uma semana a expressão solúvel de alvos múltiplos pode ser observado 11 e, em seguida, as variáveis adicionais, tais como os discutidos na introdução, pode ser rastreada em ciclos subsequentes sobre os alvos que requerem uma maior optimização. Os protocolos aqui descritos destinam-se a expressão de proteínas e péptidos ricos em disulfureto. No entanto, para os usuários que desejam expas proteínas não-reticuladas ress em uma forma de alto rendimento, os protocolos correspondentes têm sido publicados anteriormente e pode ser encontrado em outros lugares 22,24.
A instalação de alto rendimento é ideal para um número de aplicações, incluindo o rastreio de um grande número de proteínas diferentes para a expressão solúvel em água ou o rastreio de um grande número de construções de expressão (incluindo as etiquetas de fusão diferentes) para os vários genes-alvo, ao mesmo tempo ( ou expressão múltipla constrói para um único alvo), a fim de melhorar as taxas de sucesso. A plataforma também pode ser utilizada para avaliação dos desempenhos e validação de novos protocolos de um grande número de alvos. Outras aplicações incluem o rastreio de variantes de um único alvo difícil, por exemplo, todos os ortólogos ou membros da mesma família, ou para testar o sucesso da produção de um painel de mutantes de um único alvo no um experimento. Este protocolo tem também sido utilizado em combinação com a co-expressão de vectores (with uma proteína marcado apenas) para permitir que o empuxo para baixo e caracterização preliminar dos complexos proteína-proteína, seguido de análise biofísica mais minuciosa para confirmar a formação do complexo de estequiometria correcta e 33. A quantidade de proteína purificada é por vezes adequado para micro-ensaios (ensaios funcionais, proteína-ADN 34 ou ensaios de interacção proteína-proteína). Existem várias vantagens para a estratégia de expressão rastreio de alto rendimento: (i) a capacidade para testar um grande número de alvos, ou um grande número de variáveis em uma única experiência, (ii) limitada de variação de lote para lote, (iii) o simplicidade e facilidade de trabalhar em uma escala menor usando poços profundos, (iv) a escalabilidade e reprodutibilidade em maior escala, (v) o potencial de automação, e (vi) a simplicidade de controle e manipulação (sem rotulagem de tubos individuais, menos os erros introduzidos quando se utiliza o formato de placa que com o tratamento de tubos individuais na mistura ou troca dos clones).
Embora não discutidos na secção de protocolo, há várias considerações importantes para a preparação do ensaio, que serão discutidas brevemente abaixo. Para uma discussão mais completa, por favor ver a publicação anterior 24. Para uma eficiência máxima, é vantajoso ter um sistema adequado para a clonagem de alto rendimento, para simplificar a sub-clonagem de um grande número de alvos. Para a fase inicial do projecto VENOMICS, que utilizam o sistema de recombinação versátil gateway 25, que permite a subclonagem em qualquer vector de destino a um ritmo de centenas de clones por semana. Protocolos para gateway recombinação clonagem podem ser encontradas no site da Invitrogen. Outras alternativas para alto rendimento clonagem incluem independente de ligadura de clonagem (LIC) 35,36 e sem restrição (RF) clonagem 37. Existem várias maneiras de obter os genes-alvo para a expressão, inclusive por PCR a partir de DNA modelo, a partir de coleções de clones de entrada ou comogenes sintéticos, o que é a estratégia escolhida para o projeto VENOMICS. Os genes sintéticos podem ser ordenados com locais de recombinação em cada extremidade da síntese do gene e gene permite a optimização de codões fácil da sequência do gene alvo (a excluir codões raros E. coli). Isto é recomendado, mas não essencial. Para objectivos de optimização sem codão que contêm um elevado número de codões raros, 2 Rosetta (DE3) pLysS (o qual transporta para tRNAs raros codões que não são altamente expressas em E. coli) pode ser mais adequada do que se BL21 (DE3) pLysS. Embora existam disponíveis estirpes que limitar a redução de pontes dissulfeto no ambiente redutor normalmente do citoplasma, nas nossas mãos, não foram tão bem sucedidos como E. regulares coli 11.A purificação por afinidade escala analítica é realizada a partir das culturas de expressão de teste, a fim de recuperar as proteínas de fusão solúveis e quantificar os rendimentos. Os dados quantitativos podem ser obtidas no the rendimentos solúveis de proteínas de fusão expressas dentro de uma gama de 0,1 - 100 mg / L de cultura. Se um alvo não é solúvel, expressão e indução temperaturas, estirpes ou mídia alternativa podem ser testados antes de diferentes parceiros de fusão são perseguidos. Para a expressão solúvel de proteínas ricas em dissulfeto, que anteriormente classificou o efeito de parceiros de fusão como DsbC> DsbA> GST> MBP> TRX> HIS-tag para a expressão citoplasmática 11. Expressão periplasmática é uma outra possibilidade que pode ajudar a dobragem de sucesso de alvos ricos em disulfureto. O periplasma é um ambiente menos do que a redução do citoplasma e contém chaperonas redox úteis para auxiliar a ligação dissulfureto. DsbC, DsbA, e MBP proteínas estão normalmente localizados para o periplasma por suas sequências de sinal periplásmicas. Isto proporciona a oportunidade para tirar partido destas marcas para dirigir os alvos ricos em disulfureto para o espaço periplasmático, a fim de auxiliar dobrável. Para alvos difíceis, o próximo passo seria a de purify o insolúvel alvo HIS-marcado a partir de corpos de inclusão, solubilizar e redobre (isso está fora do âmbito deste protocolo e não será discutido aqui 3 9). Isso pode ser bastante simples para alvos com apenas uma ou duas pontes dissulfeto, mas se torna cada vez mais difícil, pois o número de pontes dissulfeto aumenta. Em alternativa, e em especial para as proteínas e péptidos com quatro ou mais ligações dissulfureto, pode ser benéfico para tentar sistemas de produção mais complexos, tais como leveduras, de insectos ou de expressão de mamífero.
Com os avanços na miniaturização e automação, HTP eletrofisiologia lab-on-a-chip tecnologias 28 será sem dúvida o caminho do futuro para análises funcionais. Prevemos que, para a maioria dos fins (talvez com a exceção de estudos estruturais) isso vai negar a necessidade de culturas em grande escala. Culturas em pequena escala, não só será útil para o rastreio de condições de expressão, mas também de ser capaz de fornecer sufciente quantidades de amostra para estes ensaios funcionais miniaturizados. A capacidade de produzir vários alvos em paralelo, em quantidades suficientes para a caracterização funcional irá reduzir os custos de cultura e utilizar este tipo de plataformas, expressão e caracterização de proteínas recombinantes irão tornar-se mais o custo e tempo eficaz.
Os protocolos aqui foram aplicadas para a expressão de péptidos e proteínas ricas em dissulfureto na fase inicial do projecto europeu FP7 VENOMICS. Venenos são uma excelente fonte de peptídeos bioativos que muitas vezes têm potencial farmacológico interessante. No entanto, a sua produção é um desafio devido a seus padrões de dissulfeto por entrelaçamento complexos e tamanho pequeno. Usando plataformas de alto rendimento, como o aqui descrito, o projecto VENOMICS pretende gerar uma biblioteca de 10.000 novos peptídeos do veneno de reproduzir a diversidade observada na natureza. Esta biblioteca vai ser explorada para a caracterização de dissulfureto-rpeptídeos ich com potencial farmacológico ou aplicações terapêuticas com o objetivo de desenvolver novos medicamentos. A plataforma está sendo usada para aferir e validar novos protocolos para uso no projeto VENOMICS.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
Este trabalho foi apoiado pelo projeto VENOMICS, Europeu N ° 278346 subvenção de projecto através do Sétimo Programa-Quadro (FP7 SAÚDE 2011-2015). O projeto VENOMICS é uma colaboração entre várias instituições de pesquisa e empresas na Europa:
AFMB, Aix-Marseille Université (França), CEA Saclay (França), NZYTech (Portugal), SistemasGenomicos (Espanha), Universidade de Liege (Bélgica), VenomeTech (França), Vitamib (França), Zealand Pharma (Dinamarca)
Este trabalho foi apoiado pela infra-estrutura francês de Biologia Estrutural Integrado (Frisbi) ANR-10-InSb-05-01.
Os autores também gostariam de agradecer ao Sr. Jeremy Turchetto para ajudar com os preparativos para a filmagem do vídeo.
Materiais
| Name | Company | Catalog Number | Comments |
| Tecan Freedom EVO 200 liquid handling robot | Tecan Group Ltd. | Protocols can be adapted to any liquid handling robot with a vacuum manifold for plates. http://www.tecan.com/platform/apps/product/index.asp?MenuID=2694&ID=5270&Menu=1&Item=21.1.8 | |
| 96-well PCR (PCR96) plates | Greiner Bio-One | 652270 | http://us.gbo.com/bioscience/detail/2504/ |
| LB medium | Autoclaved for sterility. | ||
| Antibiotic stocks | Kanamycin (50 mg/ml), ampicillin (100 mg/ml), chloramphenicol (34 mg/ml in ethanol), store stocks at −20 °C. Use a 1:1,000 dilution. | ||
| Deep-well 96 (DW96) plate with 2.42 ml volume capacity | Greiner Bio-One | 780270 | Autoclaved for sterility. http://us.gbo.com/bioscience/detail/2462/ |
| Expression vectors | For the expression of target constructs. Store at −20 °C. | ||
| BL21 (DE3) pLysS competent cells | Or alternative E. coli expression strain of the user's choice. Store at −80 °C. | ||
| Breathseal breathable adhesive film | Greiner Bio-One | 676050 | |
| PCR machine with 96-well plate block | For the transformation heat shock and boiling of SDS-PAGE/Caliper samples. | ||
| 24-well sterile tissue culture plates | Greiner Bio-One | 662165 | http://us.gbo.com/bioscience/detail/2220/ |
| LB-agar | Autoclaved for sterility. | ||
| 200 μl sterile disposable tips | Tecan Group Ltd. | 30 038 617 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Multitron shaking incubator, with 3 mm throw | Infors | AJ103 | Not essential, a regular shaking incubator can also be used. http://www.infors-ht.com/index.php/en/ |
| Plate incubator | |||
| Microtiter plate | For glycerol stocks and elution using purification protocol B. | ||
| Glycerol | For the preparation of glycerol stocks. | ||
| 200 μl disposable tips | Tecan Group Ltd. | 30 038 616 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Adhesive tape pads | Qiagen | 19570 | http://www.qiagen.com/Products/Catalog/Lab-Essentials-and-Accessories/Tape-Pads |
| Bactinyl | Orapi Group | Or equivalent microbial disinfectant. | |
| ZYP-5052 medium | See Table 1 for recipes of components. | ||
| Deep well 24 (DW24) plates, 10 ml capacity | Whatman | 7701-5102 | Autoclaved for sterility. http://www.whatman.com/UNIPLATECollectionandAnalysisMicroplates.aspx#7701-5102 |
| Flat-bottomed, clear microtiter plate | Greiner Bio-One | 655101 | For absorbance readings. http://us.gbo.com/bioscience/detail/2029/ |
| Plate reading spectrophotometer | Optional. For measuring OD600 of cultures. | ||
| Centrifuge with rotor for deep well plates | Suitable for 3,800 x g. | ||
| Lysozyme | 50 mg/ml in water. Store at −20 °C. | ||
| Imidazole ACS grade | Merck | IX0005-1 | A high quality grade of imidazole must be used so that it will not interfere with A280 readings for calculating protein yield. |
| Lysis buffer | 50 mM Tris, 300 mM NaCl, 10 mM imidazole pH 8 containing 0.25 mg/ml lysozyme (or your preferred buffer). Add lyzozyme from stocks each time and do not store for extended periods. | ||
| Water bath | |||
| Plate sonicator (Ultrasonic processor XL, adapted for deep well plates) | Misonix Inc. | Not essential. Lysozyme alone is normally sufficient for nearly complete lysis. | |
| DNase | 2 mg/ml stock in water, filter sterilized. Store aliquots at −20 °C. | ||
| Magnesium sulphate (MgSO4) | 2 M stock in water, autoclaved. | ||
| SDS-PAGE or Caliper sample buffer | |||
| Binding buffer | 50 mM Tris, 300 mM NaCl, 10 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| Wash buffer | 50 mM Tris, 300 mM NaCl, 50 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| Elution buffer | 50 mM Tris, 300 mM NaCl, 250 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| 96-well Receiver/Filter Plate 20 µm, 1.8 ml capacity | Macherey-Nagel | 740686.4 | http://www.mn-net.com/ProductsBioanalysis/Accessories/tabid/10909/language/en-US/Default.aspx |
| 200 μl disposable wide bore tips | Tecan Group Ltd. | 30 050 348 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Ni Sepharose 6 Fast Flow resin | GE Healthcare | 17-5318-02 | For purification of target fusion proteins. Store at 4 °C. Wash and equilibrate before use. http://www.gelifesciences.com/webapp/wcs/stores/servlet/productById/en/GELifeSciences/17531802 |
| Tobacco Etch Virus (TEV) protease | Optional, for cleavage. 2 mg/ml, without reducing agents in storage buffer. Store at −80 °C. | ||
| 96-well 0.22 µm filter plate | Millipore | MSGV N22 10 | Optional. To filter the soluble fraction after cleavage. http://www.millipore.com/catalogue/item/msgvn2210 |
| SDS-PAGE/dot blot equipment or Caliper Labchip GXII equipment | Electrophoresis apparatus and choice of gel type is at the user’s discretion. | ||
| Spectrophotometer and cuvettes | For measuring absorbance at 280 nm (A280) to calculate yield of soluble proteins. Not required if the analysis is done on the Caliper. | ||
| ZipTip pipette tips | Millipore | Optional. The type of ZipTip is at the user's discretion. C4 resin should be used for larger proteins, while for peptides C18 may be better. Alternative methods for desalting of samples may also be used to clean up samples before further quality control. http://www.millipore.com/catalogue/module/c5737#0 | |
| Materials are listed in the order in which they are required in the Protocol section. Reagents can be stored at room temperature unless noted otherwise. Reference numbers for the author’s preferred choice of materials are provided, however equivalent products may also be suitable. For reagents where the brand will not influence the outcome of the experiment, the company details have been omitted. | |||
Referências
- Berrow, N. S., et al. Recombinant protein expression and solubility screening in Escherichia coli: a comparative study. Acta Crystallographica Section D-Biological Crystallography. 62, 1218-1226 (2006).
- Correa, A., Oppezzo, P. Tuning different expression parameters to achieve soluble recombinant proteins in E. coli: advantages of high-throughput screening. Biotechnol J. 6, 715-730 (2011).
- Graslund, S., et al. Protein production and purification. Nat Methods. 5, 135-146 (2008).
- Vera, A., Gonzalez-Montalban, N., Aris, A., Villaverde, A. The conformational quality of insoluble recombinant proteins is enhanced at low growth temperatures. Biotechnol Bioeng. 96, 1101-1106 (2007).
- Graslund, S., et al. The use of systematic N- and C-terminal deletions to promote production and structural studies of recombinant proteins. Protein Expr Purif. 58, 210-221 (2008).
- Bird, L. E. High throughput construction and small scale expression screening of multi-tag vectors in Escherichia coli. Methods. 55, 29-37 (2011).
- Davis, G. D., Elisee, C., Newham, D. M., Harrison, R. G. New fusion protein systems designed to give soluble expression in Escherichia coli. Biotechnol Bioeng. 65, 382-388 (1999).
- Kapust, R. B., Waugh, D. S. Escherichia coli maltose-binding protein is uncommonly effective at promoting the solubility of polypeptides to which it is fused. Protein science: a publication of the Protein Society. 8, 1668-1674 (1999).
- LaVallie, E. R., Lu, Z., Diblasio-Smith, E. A., Collins-Racie, L. A., McCoy, J. M. Thioredoxin as a fusion partner for production of soluble recombinant proteins in Escherichia coli. Methods Enzymol. 326, 322-340 (2000).
- Marblestone, J. G., et al. Comparison of SUMO fusion technology with traditional gene fusion systems: enhanced expression and solubility with SUMO. Protein science: a publication of the Protein Society. 15, 182-189 (2006).
- Nozach, H., et al. High throughput screening identifies disulfide isomerase DsbC as a very efficient partner for recombinant expression of small disulfide-rich proteins in E. coli. Microb Cell Fact. 12, 37 (2013).
- Sachdev, D., Chirgwin, J. M. Fusions to maltose-binding protein: control of folding and solubility in protein purification. Methods Enzymol. 326, 312-321 (2000).
- Smith, D. B. Generating fusions to glutathione S-transferase for protein studies. Methods Enzymol. 326, 254-270 (2000).
- de Marco, A., Deuerling, E., Mogk, A., Tomoyasu, T., Bukau, B. Chaperone-based procedure to increase yields of soluble recombinant proteins produced in E. coli. BMC Biotechnol. 7, 32 (2007).
- Hatahet, F., Nguyen, V. D., Salo, K. E., Ruddock, L. W. Disruption of reducing pathways is not essential for efficient disulfide bond formation in the cytoplasm of E. coli. Microb Cell Fact. 9, 67 (2010).
- de Marco, A. Recent contributions in the field of the recombinant expression of disulfide bonded proteins in bacteria. Microb Cell Fact. 11, 129 (2012).
- Katzen, F., Beckwith, J. Disulfide bond formation in periplasm of Escherichia coli. Methods Enzymol. 348, 54-66 (2002).
- Klint, J. K., et al. Production of recombinant disulfide-rich venom peptides for structural and functional analysis via expression in the periplasm of E. coli. PloS One. 8, e63865 (2013).
- Braud, S., et al. Dual expression system suitable for high-throughput fluorescence-based screening and production of soluble proteins. Journal of Proteome Research. 4, 2137-2147 (2005).
- Douzi, B. G. A., et al. A new system for expressing recombinant animal toxins in E. coli. (Collection Rencontres en Toxicologie, Publications de la SFET, Chatenay-Malabry). Advances and new technologies in toxinology. , 149-152 (2010).
- Groisillier, A., et al. MARINE-EXPRESS: taking advantage of high throughput cloning and expression strategies for the post-genomic analysis of marine organisms. Microb Cell Fact.. 9, 45 (2010).
- Vincentelli, R., et al. High-throughput protein expression screening and purification in Escherichia coli. Methods. 55, 65-72 .
- Xiao, R., et al. The high-throughput protein sample production platform of the Northeast Structural Genomics Consortium. Journal of Structural Biology. 172, 21-33 (2010).
- Saez, N. J., Vincentelli, R., Chen, Y. W. Ch3 High-throughput expression screening and purification of recombinant proteins in E. coli. Structural Genomics: General Applications : Methods in Molecular Biology. 1091, 33-53 (2014).
- Katzen, F. Gateway (R) recombinational cloning: a biological operating system. Expert. Opin. Drug Discov. 2, 571-589 (2007).
- Vincentelli, R., Canaan, S., Offant, J., Cambillau, C., Bignon, C. Automated expression and solubility screening of His-tagged proteins in 96-well format. Analytical Biochemistry. 346, 77-84 (2005).
- Studier, F. W. Protein production by auto-induction in high density shaking cultures. Protein Expr Purif. 41, 207-234 (2005).
- Spencer, C. I., et al. Ion channel pharmacology under flow: automation via well-plate microfluidics. Assay Drug Dev Technol. 10, 313-324 (2012).
- Sala, E., de Marco, A. Screening optimized protein purification protocols by coupling small-scale expression and mini-size exclusion chromatography. Protein Expr Purif. 74, 231-235 (2010).
- Moon, A. F., Mueller, G. A., Zhong, X., Pedersen, L. C. A synergistic approach to protein crystallization: combination of a fixed-arm carrier with surface entropy reduction. Protein science: a publication of the Protein Society. 19, 901-913 (2010).
- Zanier, K., et al. . Structural basis for hijacking of cellular LxxLL motifs by papillomavirus E6 oncoproteins. 339, 694-698 (2013).
- Kapust, R. B., Tozser, J., Copeland, T. D., Waugh, D. S. The P1' specificity of tobacco etch virus protease. Biochemical and Biophysical Research Communications. 294, 949-955 (2002).
- Vincentelli, R., Romier, C. Expression in Escherichia coli: becoming faster and more complex. Current Opinion in Structural Biology. 23, 326-334 (2013).
- Jolma, A., et al. DNA-binding specificities of human transcription factors. Cell. 152, 327-339 (2013).
- Aslanidis, C., de Jong, P. J. Ligation-independent cloning of PCR products (LIC-PCR). Nucleic Acids Research. 18, 6069-6074 (1990).
- Haun, R. S., Serventi, I. M., Moss, J. Rapid, reliable ligation-independent cloning of PCR products using modified plasmid vectors. BioTechniques. 13, 515-518 (1992).
- van den Ent, F., Lowe, J. RF cloning: a restriction-free method for inserting target genes into plasmids. Journal of Biochemical and Biophysical Methods. 67, 67-74 (2006).
- Vincentelli, R., et al. High-throughput automated refolding screening of inclusion bodies. Protein science: a publication of the Protein Society. 13, 2782-2792 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados