Method Article
High Throughput Screening espressione quantitativa e purificazione Applicata al ricombinante Disulfide ricchi di Venom proteine prodotte in
In questo articolo
Riepilogo
Un protocollo per l'espressione elevato throughput screening e quantitativa analitica purificazione di proteine di fusione di piccoli culture Escherichia coli è descritto ed applicato alla espressione di proteine bersaglio veleno animale ricchi di disolfuro.
Abstract
Escherichia coli (E. coli) è il sistema di espressione più utilizzato per la produzione di proteine ricombinanti per studi strutturali e funzionali. Tuttavia, purificare proteine è talvolta difficile poiché molte proteine sono espresse in una forma insolubile. Quando si lavora con obiettivi difficili o multipli pertanto si consiglia di utilizzare un elevato throughput (HTP) controlli l'espressione proteica su piccola scala (1-4 ml culture) per identificare rapidamente le condizioni per l'espressione solubile. Per far fronte ai vari programmi strutturali genomica del laboratorio, una quantitativa (in un intervallo di 0,1-100 mg / L cultura della proteina ricombinante) e proteina HTP protocollo di screening espressione è stato implementato e validato su migliaia di proteine. I protocolli sono stati automatizzate con l'uso di un robot manipolatore liquido, ma possono anche essere eseguite manualmente senza attrezzature specializzate.
Proteine del veleno ricco di disolfuro stanno guadagnandocrescente riconoscimento per il loro potenziale come lead terapeutiche di farmaco. Possono essere molto potente e selettivo, ma le loro reti legame disolfuro complesse renderli difficili da produrre. Come membro del progetto europeo FP7 Venomics ( www.venomics.eu ), la nostra sfida è quella di sviluppare strategie di produzione di successo con l'obiettivo di produrre migliaia di proteine del veleno nuovi per la caratterizzazione funzionale. Aiutato dalle proprietà redox di legame disolfuro isomerasi DsbC, abbiamo adattato la nostra pipeline di produzione HTP per l'espressione del ossidati, peptidi veleno funzionali del E. citoplasma coli. I protocolli sono applicabili alla produzione di diverse proteine ricche di disolfuro anche. Qui mostriamo nostra conduttura applicata alla produzione di proteine del veleno animale. I protocolli descritti nel presente documento è probabile che le proteine ricche di disolfuro solubili saranno ottenuti in appena una settimana. Anche da una piccola scala, esiste la possibilità di utilizzare the proteine purificate per convalidare lo stato di ossidazione mediante spettrometria di massa, per la caratterizzazione in studi pilota, o sensibili micro-saggi.
Introduzione
Motivati dal progresso della genomica e accelerare il tasso di scoperta di nuove proteine, gasdotti ad alta velocità effettiva sono stati sviluppati per parallelizzare approcci tradizionali per lo screening e l'identificazione di strategie ottimali di produzione di proteine. Potenziali variabili da ottimizzare includono, ma non sono limitati a, l'espressione varia ceppi 1,2, temperatura di 3,4, 2,3 dei media, bersaglio varianti 5, partner di fusione 6-13, co-espressione con accompagnatori 14,15, citoplasmatica o espressione 16-18, e tampone purificazione componenti periplasmatiche 3. Implementando approcci di throughput elevati, molte variabili o più bersagli possono essere testati in parallelo con un elevato livello di efficienza, limitando variazione da lotto a lotto. Nella nostra esperienza, la strategia dà anche una buona riproducibilità su scala industriale utilizzando la stessa cultura (temperatura, media, aerazione, ecc) e le condizioni di depurazione (stessa resin, tamponi, ecc.) Diverse piattaforme high throughput sono stati utilizzati in passato decennio per identificare le condizioni per l'espressione della proteina solubile, cioè attraverso diversi parametri come partner di fusione, ceppi espressione o temperatura 19-23.
Recentemente abbiamo usato il nostro metodo di screening ad alta produttività per l'espressione di ricco-disolfuro proteine solubili 11. Le proteine selezionati non erano solo da fonti velenosi, ma comprendevano anche ricco di disolfuro inibitori enzimatici da una vasta gamma di specie tra piante, maiali, mucche e gli esseri umani. L'esperimento ha confrontato gli effetti di 12 diversi partner di fusione e di tre diversi ceppi di espressione sulla solubilità e la piegatura di 28 proteine disolfuro-reticolato. Abbiamo dimostrato che utilizzando DsbC come partner di fusione per la produzione del ceppo BL21 (DE3) pLysS notevolmente outproduced (sia resa e numero di proteine solubili ottenuti) qualsiasi altra combinazione di deformazione e fusione testata 11. Ilrisultati di questo esperimento si è basata adattare nostra conduttura originale generale throughput elevato (che è stato utilizzato per lo screening espressione di una vasta gamma di proteine) 22,24 in uno più adatto per l'espressione di bersagli ricchi di disolfuro. Proteine ricche di disolfuro di veleni animali sono di particolare interesse. Veleni sono una miscela complessa di peptidi bioattivi e proteine, con valore potenziale farmacologicamente e terapeuticamente. Tuttavia, l'espressione di proteine disolfuro obbligazionari contenenti non è banale. Queste proteine contengono generalmente tra 1-7 legami disolfuro, e devono essere ossidati con i corretti modelli disolfuro-bonding per essere attivi. Attualmente, la piattaforma viene utilizzato per lo screening di espressione di un gran numero di proteine veleno animale ricchi di disolfuro nell'ambito del Progetto FP7 VENOMICS europeo (www.venomics.eu) e comparativa nuovi protocolli per l'espressione ad alto rendimento di migliaia di bersagli . Qui, un metodo automatizzatoè previsto per alta velocità su piccola scala di screening espressione e purificazione (vedi Figura 1) applicato alle proteine animali veleno disolfuro-ricco. La strategia per disolfuro ricchi peptidi e proteine utilizza una HIS-tag per la purificazione e il partner di fusione redox-attiva, DsbC, creando scindibili fusioni HIS-DsbC alle proteine bersaglio (vedi Figura 2).
Mentre l'attenzione dei protocolli è qui automazione mediante elettroforesi robot e HTP gestione di liquidi, questi metodi sono adatti anche per un approccio manuale elevato throughput, il che significa che anche i laboratori con una configurazione di base possono usufruire dei protocolli, senza alcuna condizione preliminare per costose attrezzature . Protocolli manuali per la trasformazione di purificazione e analisi (non specifico alle proteine ricche di disolfuro) sono stati pubblicati altrove 24 e non saranno ripetuti qui. La velocità della procedura manuale (dall'espressione clone, prodotto dalla ricombinazioneclonazione nazionale 25, all'analisi dei livelli di proteina solubile) è 96 (utilizzando l'individuazione SDS-PAGE) o 384 (4 x 96; usando dot blot e SDS-PAGE 26) colture a settimana (vedere Figura 1). Questo può essere aumentato se eseguita in modo semi-automatico (usando un robot manipolatore liquido e dot blot 26 o elettroforesi HTP, ad esempio con un sistema Pinza GXII LabChip 22 per l'analisi dei risultati) per un massimo di 1.152 (12 x 96) colture in parallelo superiori a una settimana, come descritto nel presente documento. Coltivazione viene eseguita in pozzo profondo 24 formato (DW24) in modo che regolari incubatori stringono possono essere utilizzati in contrasto con colture cresciute in pozzo profondo formato 96 (DW96), che necessitano l'uso di brevi orbitali incubatori ad alta velocità di agitazione per aerazione sufficiente (scuotimento 800 rpm). L'utilizzo di mezzi di auto-induzione 27 semplifica anche espressione, eliminando la fase di induzione manuale. Anche quando i laboratori utilizzano già espressione e puri pre-definiticondizioni cazione, questi possono essere trasferiti direttamente in questo sistema HTP semplicemente per migliorare l'efficienza. Uno schema dettagliato del throughput elevato pipeline di screening per le proteine ricche di disolfuro è fornita in Figura 3. I parametri del gasdotto sono stati selezionati sulla base di ampi esperimenti di screening 11, 22, che ci ha permesso di scegliere le condizioni più utili per la produzione di proteine.
Caratterizzazione può essere eseguita su proteine purificate con targhetta direttamente dalle espressioni di piccole dimensioni in studi pilota, dove decine di microgrammi di campione è sufficiente, o per saggi funzionali sensibili e saggi di legame (ad esempio, sistemi a basso volume di patch clamp HTP 28). Lo stesso può anche essere eseguita sugli obiettivi senza tag dopo la scissione, a condizione che l'etichetta e la proteasi sono stati rimossi (per esempio, mediante HPLC in fase inversa). Il controllo di qualità può essere eseguita anche mediante spettrometria di massa (per confermare la dimensione prevista e ossidazione stmangiato) o metodi cromatografici (per confermare purezza o eterogeneità) 29. Talvolta tag scissione è inutile o addirittura indesiderabile (in particolare per le proteine scarsamente solubili 30,31), quindi in questo scissione protocollo è facoltativo. Indipendentemente, in tutti i costrutti vi è un sito di scissione della proteasi TEV (ENLYFQ / [G] 32) immediatamente precedente il gene bersaglio per produrre proteina nativa dopo taglio (vedi figura 2 e Discussione). Se si desidera scissione del tag di fusione, scissione può essere testato (sulla frazione di eluizione o 'a colonna') alla piccola scala per analizzare l'efficienza, ottimizzare le condizioni se necessario e di ottenere stime attendibili dei rendimenti per esperimenti di scale-up successivi.
Ci sono due opzioni per il volume di perline utilizzati durante la purificazione per affinità, a seconda degli obiettivi e aspettative dell'esperimento. Per essere in grado di catturare più proteine possibile (per purificare per saggi pilota o MS, o per extrapolmangiato per rendimenti di scale-up) un volume finale di 200 ml di resina deve essere utilizzato, permettendo la rilevazione di proteine solubili nell'intervallo 1-100 mg / L cultura prima saturazione del sistema (vedere protocollo (A) al punto 8.1) . Tuttavia, se l'obiettivo dell'esperimento è il rilevamento di basse quantità di proteine solubili quindi un volume finale di 50 ml di resina è adatto, permettendo la rilevazione di proteine solubili nell'intervallo 0,1-25 mg / L di coltura (vedi protocollo (B ) nella sezione 8.2).
La produzione può essere scalata, se necessario, per ottenere quantitativi milligrammi di bersagli purificati per ulteriori studi strutturali e funzionali utilizzando le condizioni identificate per l'espressione solubile. I dettagli dei protocolli scale-up usati a AFMB sono stati discussi altrove 22,24.
Ulteriori dettagli relativi al setup sperimentale, fasi critiche all'interno del protocollo, le modifiche e la risoluzione dei problemi e limiti della tecnica sono forniti nel discoussion. Si prega di leggere la discussione prima di iniziare gli esperimenti.
Durante i protocolli ci aspettiamo un tasso di successo del 90% ad ogni passo (per esempio, almeno il 90% delle colture deve crescere in ogni fase). Se il tasso di successo di ogni fase dell'esperimento scende al di sotto del 90% i campioni vengono scartati e l'esperimento viene ripetuto per l'intera collezione di costrutti. Tuttavia, questo tasso di successo non è applicabile al numero di costrutti che esprimono proteine solubili o la percentuale di costrutti che solcano con un'efficienza del 100%, in quanto questo sarà fortemente dipendente dalle proteine testate.
I dettagli specifici per il set-up del piano di lavoro del robot sono forniti per ciascun protocollo (vedi anche figura 4), ma possono essere adattati come richiesto per tabella di lavoro alternativo set-up. L'hardware robot (Tecan) è costituito da un braccio di 96-multicanale (MCA96), manipolatore robotico (Roma) e 8 canali di gestione dei liquidi di testa (LiHa). Tutti i passi che utilizzano il MCA96 possono essere eseguite anche utilizzando il LiHa se un MCA96 non è disponibile, tuttavia ci vorrà più tempo perché il LiHa avrà bisogno di essere lavati tra i passaggi. Mentre il robot non è tecnicamente un ambiente sterile, l'inclusione di antibiotici generalmente assicura che non ci sono problemi di contaminazione o sterilità.
Protocollo
Parte A: Transformation and Test Expression
Procedure manuali per la clonazione 22 e la trasformazione di depurazione sono discussi altrove 24. Il protocollo di trasformazione può essere eseguita completamente sul robot 26 ma di solito è più tempo efficiente per farlo manualmente. Pertanto, i protocolli qui cominciano da inoculazione dei precultures espressione e placcatura della trasformazione dalla trasformazione scioccato calore mescola effettuata manualmente. Per ulteriori dettagli sulle procedure di clonazione e trasformazione manuali vedere i riferimenti pertinenti 22,24.
1. Precultures e placcatura
- Preparare il piano di lavoro del robot (vedi Figura 4 per le posizioni):
- Mettere un recipiente contenente 300 ml 150 ml sterile brodo LB (integrato con ampicillina (100 ug / ml) / Cloramfenicolo (34 mcg / ml), o altro antibiotico appropriato) alla posizione 8.
- Mettere un DW sterile96 alla posizione 11. Metti 4x pre-preparati 24 e LB agar (Amp / Cam) piastre di coltura tissutale (contenente 2 ml di agar in ogni pozzetto) con i loro coperchi sulle posizioni da 14 a 17.
- Mettere la piastra di trasformazione (contenente la trasformazione 96 mescola dopo heatshock) alla posizione 13. Verrà utilizzato per inoculare i precultures liquidi e le piastre di agar LB. Mettere una scatola di sterili punte di pipetta 200 microlitri alla posizione 18.
- Utilizzo del braccio 96-multicanale (MCA96) e 200 microlitri punte, aspirare 200 ml di brodo LB (posizione 8), ed erogare in DW96 in posizione 11. Ripetere finché vi è un volume finale di 1 ml di brodo LB in ciascun pozzetto di il DW96. Questo diventerà la precoltura liquido.
- Utilizzo del manipolatore robotico (Roma), rimuovere il coperchio del primo 24 pozzetti piastra LB agar e posizionarlo altrove (per esempio in un vettore hotel) finché la placcatura è finito per quel piatto.
- Utilizzo di movimentazione (LiHa) testa il liquido a 8 canali, mescolare e quindi aspirarla 50 ml di tlui prima colonna della trasformazione mix alla posizione 13. Questo volume di trasformazione mix è appena sufficiente a coprire bene il LB-Agar.
- Con i primi 4 canali, dispensare sulla prima colonna della prima piastra 24 pozzetti LB agar in posizione 14 (come mostrato in Figura 5).
- Con gli ultimi 4 canali, dispensare sulla seconda colonna della prima piastra 24 pozzetti LB agar.
- Lavare accuratamente tutti i suggerimenti dopo l'erogazione.
- Continuare questo processo fino a quando tutte le trasformazioni sono stati placcati sul primo piatto in posizione 14, il trasferimento da 96 - a 24 pozzetti utilizzando lo schema riportato in Figura 5.
- Una volta che la prima piastra è stata completata, utilizzare il RoMa per sostituire il coperchio e rimuovere il coperchio dalla piastra successiva in posizione 15. Continuare utilizzando lo schema di placcatura per i prossimi 3 piastre.
- Una volta placcatura è finito, impostare il Te-Shake a 1.200 rpm e agitare tutte le piastre per 1 min per avere una distribuzione omogenea del mix trasformazione.
- Utilizzando il MCA96 e le punte delle pipette originali, mescolare e quindi aspirarla 60 microlitri della miscela trasformazione rimanente (posizione 13) e distribuire in DW96 contenente brodo LB in posizione 11.
- Sigillare le precultures DW96 con pellicola adesiva traspirante per consentire cultura aerazione.
- Posto in un incubatore a 37 ° C agitando a velocità massima O / N (200/800 rpm a seconda agitatore orbitale).
- Le piastre di agar LB devono essere collocati in un cappuccio con i loro coperchi fuori fino a secco (10 min). Poi si sono posti invertita a 37 ° C incubatore piatto fino alla mattina seguente.
- Il giorno successivo, il precoltura viene utilizzato per inoculare l'espressione in esame nel mezzo di auto-induzione e per la preparazione degli stock di glicerolo. Mettere le piastre di agar in frigorifero, come back up. Se necessario, partendo dalle piastre di agar o degli stock di glicerolo, l'espressione di controllo potrebbe essere rifatta inoculando direttamente un fresco LB precoltura.
2. Preparazione del DW24 zyp-5052 Piatti
NOTA: Questa procedura richiede circa 5 minuti per completare per ogni set di piastre 4x DW24.
- Portare 500 ml di media auto-induzione zyp-5052 per ciascuna replica di 96 culture (464 ml ZY medie, 250 ml 2 M MgSO 4, 10 ml 50x 5052, 25 ml 20x NPS, in questo ordine - le ricette per ogni componente sono fornito in Tabella 1) supplementato con antibiotici appropriati.
- Preparare il piano di lavoro del robot:
- Metti due 300 ml depressioni, contenenti ciascuna ~ 250 ml di mezzo in posizione 5 e 6. Metti quattro piastre DW24 sterili in posizioni 14-17. Metti 200 consigli microlitri alla posizione 18.
- Utilizzando il MCA96 e 200 microlitri suggerimenti, aspirare 200 ml di Zyp-5052 dalla posizione 5 e distribuire nella prima piastra DW24 in posizione 14. Fate questo per un totale di 5 volte (4 punte erogherà in un singolo bene in una sola volta, per un totale di 4 ml). Ripetere l'operazione per i restanti 3 piastre x DW24 in posizioni da 15 a 17, Switching al zyp-5052 in posizione 6 per gli ultimi due DW24 piatti.
3. Inoculazione e crescita delle Culture prova di espressione
NOTA: inoculazione richiede circa 10 minuti per completare per ciascun set di piastre 4x DW24, e la crescita continua O / N.
- Preparare il piano di lavoro del robot:
- Mettere la piastra DW96 contenente le precultures (dal punto 1.15) in posizione 11. Mettere le quattro DW24 piastre contenenti terreno zyp-5052 (dal punto 2.3) nelle posizioni da 14 a 17.
- Utilizzando il aspirare LiHa 100 ml di precoltura dalla posizione 11 a inoculare le culture espressione di test (1/40 di diluizione) utilizzando lo schema riportato in Figura 5. Lavare accuratamente la testa LiHa presso la stazione di lavaggio tra ogni colonna delle precultures 96 pozzetti.
- Sigillare le piastre DW24 con la pellicola traspirante e incubare a 37 ° C con agitazione (200/400 rpm) per 4 ore. Questo è il tempo della fase di crescita durante il quale glucose dal mezzo sarà preferenzialmente essere esaurita 27.
- Ridurre la temperatura a 17 ° C. Dopo 4 ore e l'esaurimento del glucosio, lattosio inizierà a essere metabolizzato, con conseguente induzione di espressione, fornendo le condizioni di crescita ottimali per BL21 (DE3) pLysS o Rosetta 2 (DE3) pLysS, in questo lavoro 22. Lasciare le cellule per esprimere O / N. Utilizzare il precoltura rimanente per fare scorte di glicerolo.
4. Preparazione di titoli Glicerina
NOTA: scorte Glicerolo devono essere effettuate in triplicato per essere memorizzati in posizioni diverse in caso di guasto congelatore.
- Preparare il piano di lavoro del robot:
- Mettere micropiastre in posizione 5 a 7 per ospitare le scorte glicerolo. Mettere un 300 ml depressione riempita con 50 ml di 100% glicerolo in posizione 8. Metti una DW96 contenente 800 ml di precoltura (dopo la fase 3.2) in ciascun pozzetto alla posizione 11. Metti 200 consigli microlitri alla posizione 18.
- Utilizzando un slow aspirazione e l'erogazione di velocità, utilizzare il MCA96 e 200 consigli microlitri per aggiungere glicerolo nella DW96 contenente le precultures.
- Aspirare 200 ml di glicerolo (dalla posizione 8).
- Pipettare 150 microlitri (posizione 11), poi pausa di 20 secondi per consentire il glicerolo rimanente per raggiungere il fondo della punta. Erogare i restanti 50 ml.
- Utilizzando gli stessi consigli, mescolare la cultura e glicerolo nella DW96 alla posizione 11 fino a quando non siano ben amalgamati. La concentrazione finale di glicerolo è del 20%. Aspirare 140 microlitri dal DW96 e dispensare nella prima micropiastre alla posizione 5.
- Ripetere passo 4.3 per ogni micropiastra rimanente (posizioni 6 e 7).
- Sigillare ogni piastra con un nastro adesivo di plastica e conservare a -80 ° C. Eliminare il rimanente cultura nella DW96, decontaminazione con un agente antimicrobico prima dello smaltimento.
5. Valutare la crescita delle Culture
NOTA: Non è in genere necessario per valutare il tasso di crescita finale come OD finale 600 di solito è lo stesso per la maggior parte delle culture (circa 12 in queste condizioni), ma tutte le culture che non crescono devono essere notato.
- Prendere 50 ml di ogni cultura (dal punto 3.4) ed erogare in una micropiastra chiaro a fondo piatto contenente 150 ml di mezzo.
- Misurare il diametro esterno 600, tenendo conto della diluizione 4 volte. Se ci sono quelli che non crescono molto bene, notare che questa per l'analisi finale.
6. Raccolta celle
NOTA: Questa procedura richiede circa 45 minuti per completare.
- Centrifugare le piastre 4x DW24 (dal punto 3.4) a 3000 g per 10 minuti poi scartare il surnatante in un contenitore di rifiuti che contengono agente antimicrobico. Toccare i piatti, a testa in giù, su carta assorbente per eliminare ogni eccesso di terreno.
- Nel frattempo, preparare 100 ml di lisitampone (Tris 50 mM, NaCl 300 mM, 10 mM imidazolo pH 8, o altro buffer preferito) contenente lisozima (concentrazione finale di 0,25 mg / ml).
- Preparare il piano di lavoro del robot:
- Mettere il tampone di lisi in un trogolo ml 300 nella posizione 5. Mettere un DW96 pulito in posizione 11. Mettere i 4 piastre DW24 x contenenti pellet cellulari (dal punto 6.1) in posizioni 14-17. Mettere 200 consigli microlitri alla posizione 18.
- Utilizzando il MCA96 e 200 consigli microlitri, aspirare 125 ml di tampone di lisi da posizione 5 e dispensare in ogni piastra DW24 (posizioni 14-17). Ripeti. NOTA: 4 consigli vi dispensare in un singolo bene immediatamente per un volume finale di 1 ml in ciascun pozzetto delle piastre DW24.
- Agitare le piastre a posizioni 14-17 utilizzando la Te-shake (1000 rpm) per 15 minuti per risospendere il pellet.
- Una volta che i pellet vengono risospesi, utilizzare i primi 4 canali del LiHa per aspirare 550 microlitri da campioni da 1 a 4 (la prima colonna della prima DW24, in posizione 14), quindi utilizzando il lAST 4 canali del aspirato LiHa 550 microlitri di campioni da 5 a 8 (seconda colonna della prima DW24). Distribuire in prima fila della DW96 in posizione 11.
- Ripetere passo 6.6, in modo che tutta la sospensione cellulare viene trasferito al DW96.
- Dopo ogni serie di campioni lavare le punte LihA nella stazione di lavaggio.
- Ripetere i passaggi 6,6-6,8 per ogni colonna in ogni piastra DW24 (posizioni 15-17) utilizzando lo schema riportato in Figura 5. Sigillare con pellicola di plastica.
- Per purificazione nello stesso giorno o il congelamento breve termine, conservare a -80 ° C per almeno 1 ora, altrimenti conservare a -20 ° C.
Parte B: La purificazione e analisi
7. Lisi cellulare
NOTA: Questa procedura richiede circa 60 minuti per completare.
- Scongelare le sospensioni di cellule congelate (dal punto 6.10) in un bagno d'acqua (a temperatura ambiente oa 37 ° C) per circa 15 minuti e risospendere in incubatrice agitazione per un altre 10 min. Le culture dovrebbero diventare viscoso.
- Prendete 500 ml di DNasi magazzino e mescolare con 1 ml di MgSO 4 stock. Manualmente con una pipetta a 8 canali o con il robot LiHa, dispensare 15 microlitri in ciascun pozzetto della DW96, per ottenere una concentrazione finale di 10 mg / ml di DNasi e 20 mM MgSO 4.
- Re-sigillare la piastra con nastro di plastica e agitare per altri 15 min. A questo punto le colture devono essere non viscoso. Controllare accuratamente (esame visivo) che tutte le culture non sono più viscoso. NOTA: Questo è fondamentale, se alcune culture sono ancora viscoso (ad esempio, se la DNasi è stato accidentalmente dimenticato o non erogato opportunamente in alcuni pozzetti), il filtro si intasa, generando una pressione uniforme sui campioni e troppopieno o intasamento totale Piastra filtro potrebbe accadere durante la purificazione.
- Per i campioni SDS-PAGE di tutto il lisato cellulare, aspirare 10 ml di lisato e distribuire in una piastra a 96 pozzetti PCR contenente10 ml di 4x tampone campione SDS-PAGE e 20 ml di acqua. Denaturare per 3 min a 95 ° C e congelare fino all'analisi (frazione totale). Se un sistema di elettroforesi HTP è disponibile, i campioni possono essere analizzati su questo, invece seguendo il protocollo consigliato dal produttore per la preparazione del campione. Per ulteriori dettagli sulle analisi dei campioni si veda la Sezione 10.
8. Ni Affinity Purification
NOTA: Una velocità di aspirazione lenta dovrebbe essere utilizzato per pipettaggio tutte le sospensioni in resina, come le sospensioni sono piuttosto denso. Oltre ad asciugatura della resina si tradurrà in una riduzione della capacità di legame. Per purificazione, le concentrazioni imidazolo specificati sono applicabili al nichel resina di affinità. Se si utilizzano ioni alternativi (ad esempio, cobalto), poi le concentrazioni devono essere regolati di conseguenza.
- A - Ni purificazione di affinità per il rilevamento nell'intervallo 1-100 mg / L (volume di resina finale = 200 microlitri)
NOTA: Tla procedura di purificazione dura circa 1,5 ore per completare, il che significa che fino a 4 possono essere eseguite in un solo giorno.- Preparare il piano di lavoro del robot:
- Mettere 300 ml depressioni contenenti tampone di legame (Tris 50 mM, NaCl 300 mM, 10 mM imidazolo pH 8), tampone di lavaggio (Tris 50 mM, NaCl 300 mM, imidazolo 50 mM pH 8) e tampone di eluizione (50 mM Tris, 300 mM NaCl, 250 mM imidazolo pH 8) in posizioni 6 a 8, rispettivamente.
- Lasciare un vuoto 300 ml trogolo in posizione 5 per lo slurry resina. Nella posizione 9 e 10 titolari put piastra. Alla posizione 10 mettere un DW96 con il blocco SPE e la piastra filtro / ricevitore (20 micron) sulla parte superiore.
- Mettere il DW96 contenente il lisato (dal punto 7.3) in posizione 14. Nella posizione 18 e 19, rispettivamente, mettere i 200 consigli foro microlitri di larghezza e 200 microlitri punte,. Metti due piastre DW96 di ricambio per il lavaggio ed eluizione in un albergo. NOTA: Potrebbero anche essere messi in un sito alternativo sul piano di lavoro se un hotel non è disponibile.
- Preparare 105ml di equilibrato 33% resina slurry (35 ml di resina + 70 ml tampone di legame). Aggiungere la sospensione resina al trogolo in posizione 5 immediatamente prima di iniziare la procedura.
- Utilizzando il MCA96 e 200 consigli foro microlitri di larghezza (posizione 18), mescolare l'impasto di resina in posizione 5 accuratamente prima di aspirare e dispensare 200 ml di resina liquami nella DW96 contenente il lisato in posizione 14. Ripetete due volte in modo che 600 ml di resina liquami è stato aggiunto al lisato, mescolando la sospensione resina prima di ogni aspirazione.
- Eseguire una fase di miscelazione 10 min usando l'MCA96 in posizione 14 per eseguire la rilegatura e per evitare che la resina in pellet.
- Aspirare dalla posizione 14 e dispensare 800 microlitri (in 200 microlitri lotti) sulla piastra filtro in posizione 9, miscelazione prima di ogni aspirazione altrimenti la resina verrà trattenuto sul fondo del DW96.
- Ruotare il vuoto su alla posizione 10 per circa 90 sec per filtrare il lisato attraverso la piastra nellaDW96 per raccogliere il flusso continuo, facendo attenzione a non asciugare la resina. Ruotare il vuoto off.
- Ripetere i punti 8.1.5 e 8.1.6 in modo che tutta la resina viene poi nella piastra filtro.
- Utilizzando il braccio RoMa spostare il blocco SPE tiene la piastra filtro dalla posizione 10 alla posizione 9 in modo che il lavaggio successivo passo va direttamente ai rifiuti e trasferire il DW96 contenente il flusso continuo alla posizione 10 ad un altro sito (per esempio, in un hotel carrier) fino alla fine della procedura.
- Con una nuova serie di punte 200 microlitri (posizione 19), lavare la resina (in posizione 9) con un totale di 800 ml di tampone di legame (dalla posizione 6), e applica il vuoto nella posizione 9 finché il buffer è passato attraverso . Ripetere ancora una volta.
- Usare il braccio RoMa per inserire un nuovo DW96 alla posizione 10 per raccogliere l'imidazolo lavaggio 50 mm e spostare il blocco SPE e la piastra filtro in alto (posizione 10).
- Aggiungere 800 ml di tampone di lavaggio dai posizione 7 sulla posizione 10, girare laaspirazione finché il buffer è attraversato. Spegnere il vuoto.
- Con la ROMA, rimuovere il blocco SPE e la piastra del filtro per posizionare 9 e il DW96 contenente il campione di lavaggio per l'hotel, e tenerlo da parte fino alla fine della procedura.
- Lavare la resina con altri 800 ml di tampone di lavaggio (dalla posizione 7 sulla posizione 9), applicare il vuoto finché il buffer è passato attraverso. Ripetere ancora una volta.
- Utilizzare i rom a mettere una nuova DW96 alla posizione 10 e posizionare il blocco SPE e la piastra filtro in alto per raccogliere il eluizione.
- Aggiungere un totale di 500 microlitri di tampone di eluizione (dalla posizione 8 sulla posizione 9) e incubare in situ per 3 min. Accendere il vuoto fino a quando tutti buffer è passato attraverso.
- Opzionale: Per altamente esprimere proteine, una seconda eluizione può essere eseguita in una nuova DW96 come nei passi 8.1.14 e 8.1.15.
- Prendere campioni del flow-through, lavare e eluizione / s per SDS-PAGE o elettroforesi HTP.
- Per i campioni SDS-PAGE del flow-through, dispensare 10 microlitri in una piastra a 96 pozzetti PCR contenente 10 ml di 4X tampone campione SDS-PAGE e 20 ml di acqua. Per i campioni SDS-PAGE di lavaggio ed eluizione / s dispensare 30 ml in piastre PCR contenente 10 ml di 4x tampone campione SDS-PAGE. Denaturare per 3 min a 95 ° C e congelare fino all'analisi.
- Per i campioni elettroforesi HTP, seguire le istruzioni del produttore. Per ulteriori dettagli sulle analisi dei campioni si veda la Sezione 10.
- Preparare il piano di lavoro del robot:
- B - Ni purificazione di affinità per il rilevamento nell'intervallo 0,1-25 mg / L (volume di resina finale = 50 microlitri)
NOTA: Questa procedura di purificazione richiede circa 30 minuti per completare, il che significa che fino a 12 può essere eseguita in un giorno.- Preparare il piano di lavoro del robot:
- Mettete 300 ml depressioni contenenti binding buffer (50 mM Tris, 300 mM NaCl, 10 mM imidazolo pH 8), tampone di lavaggio (50 mM Tris, NaCl 300 mm, 50 mm imidazolo pH 8)e tampone di eluizione (Tris 50 mM, NaCl 300 mM, imidazolo 250 mM pH 8) in posizioni 6 a 8, rispettivamente.
- Lasciare un vuoto 300 ml trogolo in posizione 5 per lo slurry resina. Nella posizione 9 e 10 titolari put piastra. Alla posizione 10 mettere un DW96 con il blocco SPE e la piastra filtro / ricevitore (20 micron) sulla parte superiore.
- Mettere il DW96 contenente il lisato (dal punto 7.3) in posizione 14. Nella posizione 18 e 19 mettono rispettivamente 200 microlitri consigli foro di larghezza e 200 microlitri punte,. Mettere un micropiastra a 96 pozzetti di ricambio per l'eluizione in un hotel. NOTA: Questo potrebbe anche essere messo in un sito alternativo sul piano di lavoro se un hotel non è disponibile.
- Preparare 50 ml di equilibrato impasto di resina 25% (12,5 ml di resina + 37,5 ml tampone di legame). Aggiungere la sospensione resina al trogolo in posizione 5 immediatamente prima di iniziare la procedura.
- Utilizzando il MCA96 e 200 consigli foro microlitri di larghezza (posizione 18), mescolare l'impasto di resina in posizione 5 accuratamente prima di aspirare e Vernicensing 200 ml di resina liquami nella DW96 contenente il lisato in posizione 14.
- Incubare a RT con agitazione con il Te-Shake a 1400 rpm per 10 minuti per consentire il legame.
- Aspirare dalla posizione 14 e dispensare la piena 1,200 microlitri (in 200 microlitri lotti) utilizzando i suggerimenti foro largo (posizione 18) sulla piastra di filtro alla posizione 10. Mescolare prima ogni aspirazione altrimenti la resina verrà trattenuto sul fondo del DW96.
- Accendere il vuoto su alla posizione 10 per circa 30 secondi per filtrare il lisato attraverso la piastra nella DW96 per raccogliere il flusso continuo, facendo attenzione a non asciugare la resina. Ruotare il vuoto off.
- Utilizzando il braccio RoMa, spostare il blocco SPE tiene la piastra filtro dalla posizione 10 alla posizione 9 in modo che il lavaggio successivo passo va direttamente ai rifiuti e trasferire il DW96 contenente il flusso continuo alla posizione 10 ad un altro sito (per esempio, in un carrier hotel) fino alla fine della procedura.
- Con i 200 μHa l (posizione 19), lavare la resina (in posizione 9) con un totale di 800 ml di tampone di legame (dalla posizione 6), e applicare il vuoto nella posizione 9 finché il buffer è passato attraverso. Ripeti.
- Usare il braccio RoMa per posizionare il DW96 fresca alla posizione 10 per raccogliere l'imidazolo lavaggio 50 mm e spostare il blocco SPE e la piastra filtro in alto (posizione 10).
- Aggiungere 150 ml di tampone di lavaggio dai posizione 7 su posizione 10, ruotare la aspirazione finché il buffer è attraversato. Spegnere il vuoto.
- Con la ROMA rimuovere il blocco SPE e piastra filtro in posizione 9 e il DW96 contenente il campione di lavaggio in albergo, e tenerlo da parte fino alla fine della procedura.
- Lavare la resina con altri 800 ml di tampone di lavaggio (dalla posizione 7 sulla posizione 9), applicare il vuoto finché il buffer è passato attraverso. Ripeti.
- Utilizzare i rom a porre la micropiastra alla posizione 9 e posizionare il blocco SPE e la piastra filtro in alto a raccogliere °e eluizione.
- Aggiungere 190 microlitri di tampone di eluizione (dalla posizione 8 su posizione 9) e incubare in situ per 3 min. Applicare il vuoto fino a tutto il buffer è passato attraverso.
- Prendere campioni del flow-through, lavaggio ed eluizione per SDS-PAGE o elettroforesi HTP.
- Per i campioni SDS-PAGE del flow-through, dispensare 10 microlitri in una piastra a 96 pozzetti PCR contenente 10 ml di 4X tampone campione SDS-PAGE e 20 ml di acqua. Per i campioni SDS-PAGE di lavaggio ed eluizione / s dispensare 30 ml in piastre PCR contenente 10 ml di 4x tampone campione SDS-PAGE. Denaturare per 3 min a 95 ° C e congelare fino all'analisi.
- Per i campioni elettroforesi HTP, seguire le istruzioni del produttore. Per ulteriori dettagli sulle analisi dei campioni si veda la Sezione 10.
- Preparare il piano di lavoro del robot:
9. Tag Cleavage (facoltativo)
- Aggiungere la proteasi TEV (2 mg / ml) per la proteina eluita (dal punto 8.1.15 (e 8.1.16) o passo 8.2.14) in un rapporto di 1/10 (v / v).
- Incubare a temperatura ambiente (o 4 ° C per proteine termosensibili) O / N agitando delicatamente.
- Al termine della scissione erogare 30 ml in una piastra PCR contenente 10 ml di 4x tampone campione SDS-PAGE o seguire le istruzioni del produttore per i campioni elettroforesi HTP.
- Filtrare la miscela di clivaggio restante (dal punto 9.2) attraverso un 96-ben 0,22 micron piastra di filtraggio e raccogliere il flusso continuo solubile in un DW96 applicando il vuoto. Questo può essere fatto in uno dei siti vuoto (ad esempio, posizione 10) sul trattamento robot liquido, come per le fasi di eluizione Sezioni 8.1 e 8.2. Ciò elimina ogni proteina che precipitato nel corso scissione.
- Dopo filtrazione, dispensare 30 ml in una piastra PCR contenente 10 ml di 4x tampone campione SDS-PAGE o preparare come campioni di elettroforesi HTP. Questo permette il confronto delle proteine prima scissione, la miscela dopo clivaggio e il solproteina uble rimanente dopo la scissione e dà buone indicazioni dei risultati attesi negli esperimenti di scale-up successivi. Per ulteriori dettagli sulle analisi dei campioni si veda la Sezione 10.
10. Analisi dei risultati
- Identificare i costrutti esprimenti proteina solubile analizzando i campioni purificazione su SDS-PAGE, dot blot o elettroforesi sistema HTP come la pinza LabChip.
- Analizzare i campioni eluizione primo a identificare costrutti che producono proteina solubile. Nella maggior parte dei casi solo i campioni di eluizione vengono analizzati se sono identificati costrutti solubili, per ridurre al minimo il tempo impiegato per l'analisi.
- Se la proteina non è nella eluizione, eseguire gli esempi di lavaggio e flusso continuo per vedere se è stato espresso e non lega correttamente alla resina.
- Per i costrutti in cui nessuna proteina solubile può essere rilevata corsa tutta lisato cellulare per vedere se è stata espressa la proteina.
NOTA: Una limitazione è che se il protein di interesse non è presente sopra dei livelli di espressione di sfondo, potrebbe non essere possibile vedere la proteina e potrebbe portare a un falso negativo. Si deve notare che è sempre possibile per le proteine di bastone e precipitano sulla resina di affinità e questo potrebbe portare ad un falso negativo o sotto-stima della resa utilizzando il protocollo raccomandato (caso raro in questo lavoro). Nel caso in cui la proteina precipita su eluizione (a pellet bianco è visibile solo pochi minuti / ore dopo l'eluizione) si raccomanda di modificare la composizione del tampone (per esempio, concentrazione di sale) e / o eseguire un saggio fluorimetrico scansione differenziale per ottimizzare l' buffer. Un piccolo campione di resina può anche essere risospeso in tampone campione SDS-PAGE e bollito per rilevare se una proteina viene trattenuto sulla resina. - Se la proteina non è stata espressa ma le cellule è cresciuto, perseguire una nuova strategia di espressione, o se la OD 600 non era abbastanza alto ricrescere e rianalizzare la cultura. >
- Se i campioni scissione devono essere analizzati, essi dovrebbero essere analizzati in modo side-by-side, in modo che ogni costrutto può essere visualizzata prima fenditura un dopo clivaggio in corsie adiacenti, per semplificare l'analisi.
- Se non utilizzando un metodo che dà quantificazione diretta della concentrazione eluizione, quantificazione deve essere eseguita per campioni positivi misurando l'assorbanza a 280 nm (A280).
- Misurare la A280, prendendo l'estinzione coefficiente della proteina in considerazione e con il tampone di eluizione come bianco, per fornire una stima della resa di proteine al fine di individuare i costrutti solubili alti esprimenti.
- Per il confronto più affidabile dei rendimenti solubili, si raccomanda di normalizzare le rese dalla densità della coltura (usando l'OD 600 misura), che è stato preso in Sezione 5. Se tutte le culture cresciute a circa la stessa densità, la normalizzazione non è richiesto.
- I campioni possono essere analizzati direttamente dalla eluizione o campione clivaggio da cromatografia-spettrometria di massa liquida (LC / MS).
- In alternativa, desalt prima (per rimuovere imidazolo e gli eventuali sali tampone che possono essere presenti) con punte di pipetta ZipTip o metodi di cromatografia liquida, quindi analizzare con matrix-assisted laser desorbimento / ionizzazione tempo di volo (MALDI-TOF) o della ionizzazione elettrospray ( ESI) spettrometria di massa.
- Studi funzionali su piccola scala possono essere eseguite per verificare se la funzione della proteina è come previsto. Se sono necessarie grandi quantità per la funzione, una cultura scale-up può essere fatto e la funzione testato dalla cultura più ampia volta dimensione e stato di ossidazione sono stati confermati alla piccola scala.
Risultati
Risultati rappresentativi sono mostrati in Figura 6 per lo screening dell'espressione di 96 ricchi di proteine disolfuro dalla pipeline VENOMICS. Le proteine sono disposte aumentando il numero di legami disolfuro poi crescente numero di residui. I peptidi sono stati espressi nel citoplasma con una HIS-tag e DsbC partner di fusione. Quando si utilizzano le condizioni di coltura raccomandate, un OD 600 del 12 si ottiene normalmente. I peptidi sono stati purificati utilizzando il protocollo 8.2-B con un volume finale di 50 ml di nichel resina di affinità, quindi un massimo di proteina ~ 25 mg / L di fusione potrebbe essere rilevato in questo esperimento.
Figura 6A mostra il risultato elettroforesi dal sistema Pinza LabChip (mostrando la fusione prima scissione) e il sistema di punteggio basato su estrapolazione di cedere in mg / L cultura della proteina di fusione (in livelli da 0,1 a 2 mg / L cultura, 2 a 10 mg / L cultura, da 10 a 25 mg / L cultura e nessun t rilevato.) Si noti che il tag DsbC spaccati normalmente funziona a circa 32 kDa, piuttosto che 27 kDa come previsto. Allo stesso modo, le fusioni DsbC anche eseguire circa 5 kDa superiori alle attese. Per molti obiettivi non solo vediamo la fusione intatta (banda superiore), ma anche il compagno di fusione solo (banda inferiore). Per alcuni di questi obiettivi ottimizzando le condizioni di coltura può migliorare il rapporto della fusione intatta (banda superiore) rispetto alla sola DsbC consentendo un aumento della resa finale. Il punteggio è basato solo sul piano della fusione intatta. Solo 16 su 96 proteine non potevano essere rilevati a livello di fusione. Questo corrisponde ad un livello di successo complessivo del 83%. Delle 80 proteine che potrebbero essere rilevati, 45 di queste sono state rilevate a livelli maggiori di 2 mg / L cultura (56%). A seconda del bersaglio e fusione, rese di proteine sono di solito nell'intervallo 2-100 mg / L cultura (sebbene in questo esempio utilizzando il protocollo 8.2 B un massimo di proteina ~ 25 mg / L di fusione può essere rilevata).
t "> L'analisi del successo per numero di ponti disolfuro presenti (Figura 6B) mostra ragionevole successo per tutti i numeri di legami disolfuro testate (tra 1 e 7), con il livello di successo più basso è il 66% per le destinazioni contenenti 6 disolfuro obbligazioni. L'analisi della distribuzione di successo espressione in base al punto isoelettrico e numero di residui (Figura 6C) mostra alcun pregiudizio particolare per la tecnica, con obiettivi sia non rilevate sparsi trama espressi con successo.Figura 6D mostra un esempio dei risultati ottenuti dalla spettrometria di massa spettrometria di massa a ionizzazione elettrospray (ESI-MS) per un singolo bersaglio, prima e dopo la riduzione del campione con DTT. Normalmente, tale analisi esaustiva spettrometria di massa non dovrebbe essere eseguita (un campione ridotto non avrebbe bisogno di essere analizzato), ma ai fini della demonstratio approfonditan abbiamo dimostrato entrambi i risultati. L'obiettivo indicato è un ricco di disolfuro di proteine del veleno 5,7 kDa con 4 ponti disolfuro. Lo spettro a sinistra mostra i risultati per la proteina prima della riduzione con DTT, come dopo clivaggio e dissalazione senza ulteriori interventi. Lo spettro sul lato destro mostra la proteina dopo la riduzione con DTT seguita da demineralizzazione per eliminare ogni eccesso DTT. Gli ioni corrispondenti alle masse sperimentali sono contrassegnati con frecce sullo spettro e la designazione per ogni ione è mostrato in verde. Le masse progenitrici sperimentali calcolati per questi ioni (per la proteina prima della riduzione (-DTT) e dopo la riduzione (+ DTT)) sono riportati nella tabella. Le masse (5709,6 Da per campione prima riduzione e 5717,6 Da per campione ridotto) presentano una differenza di massa 8 bis. Una differenza di massa 2 Da corrisponde alla presenza di 1 legame disolfuro ossidato, quindi una differenza di massa 8 Da indica la presenza di 4 ponti disolfuro (come previsto) inil campione non ridotto.
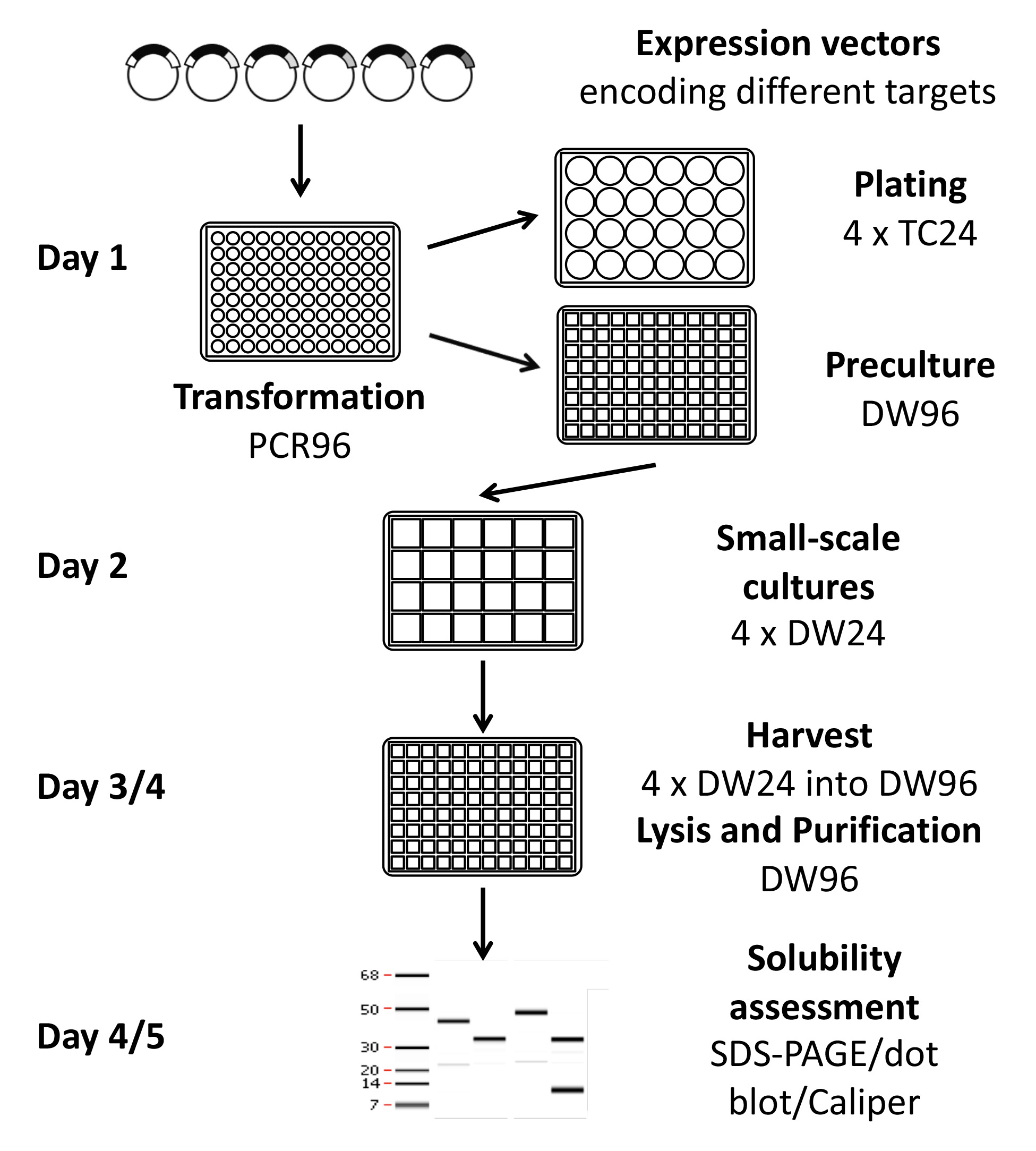
Figura 1. Rappresentazione schematica del protocollo di screening espressione elevato throughput. Usando questo protocollo, 96-384 condizioni possono essere provati da una sola persona in una settimana con metodi manuali, o fino a 1152 condizioni con il descritto attrezzature semi-automatico. Plasmidi di espressione sono costruiti utilizzando una tecnologia di clonazione ricombinazione modo che numerosi obiettivi possono essere sub-clonate in una sola volta. Condizioni di espressione volta solubili sono stati identificati e scissione effettuate, se lo si desidera, la proteina in grado di procedere al controllo di qualità per controllare l'ossidazione e la purezza, microassays e / o di produzione su larga scala.
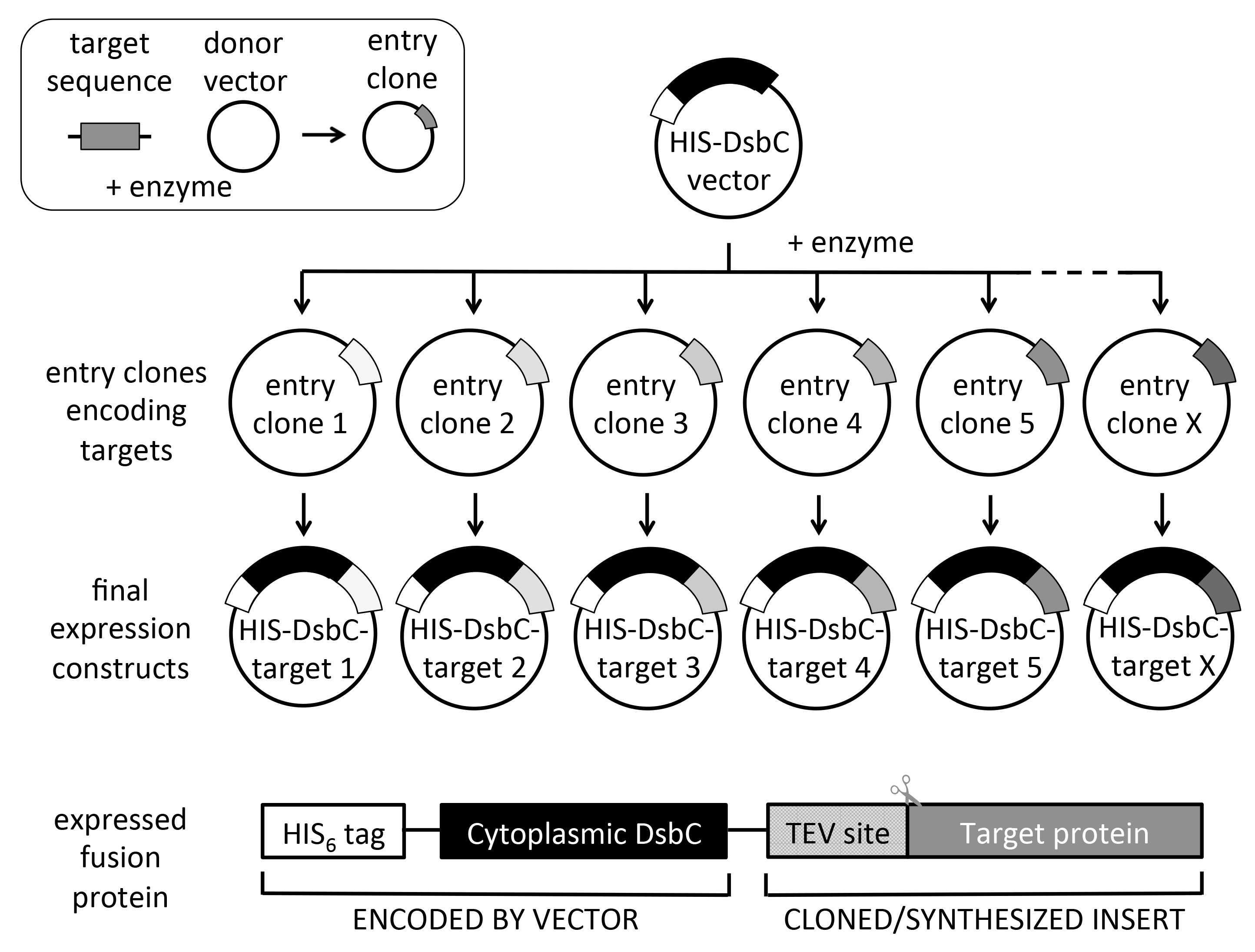
Figura 2. Schema per clonazione ricombinazione universale e costruire disegno. Dai cloni voce di destinazione, più vettori di espressione possono essere sub-clonate in un singolo esperimento in modo velocità elevata (fino a 6 x 96 cloni di ingresso in una settimana). La proteina espressa codifica una HIS tag per il nichel purificazione per affinità. Il DsbC (privo sua sequenza segnale periplasmic per espressione citoplasmatica) partner di fusione è usato per aumentare la solubilità e / o aiuti piegatura e corretta ossidazione della proteina bersaglio. Si noti che la sequenza codificante obiettivo dovrebbe contenere un sito di TEV proteasi N-terminale (ENLYFQ) se tag scissione si desidera. L'inserto in alto a sinistra mostra la produzione dei cloni ingresso utilizzando un vettore donatore e le sequenze bersaglio, che può essere ottenuta tramite PCR o sintesi del gene. Cloni di ingresso possono essere ottenuti anche da collezioni commerciali clone di ingresso. Molteplici sistemi di clonazione ricombinazione sono disponibili, tuttavia utilizziamo il syste Gatewaym, come mostrato nello schema.
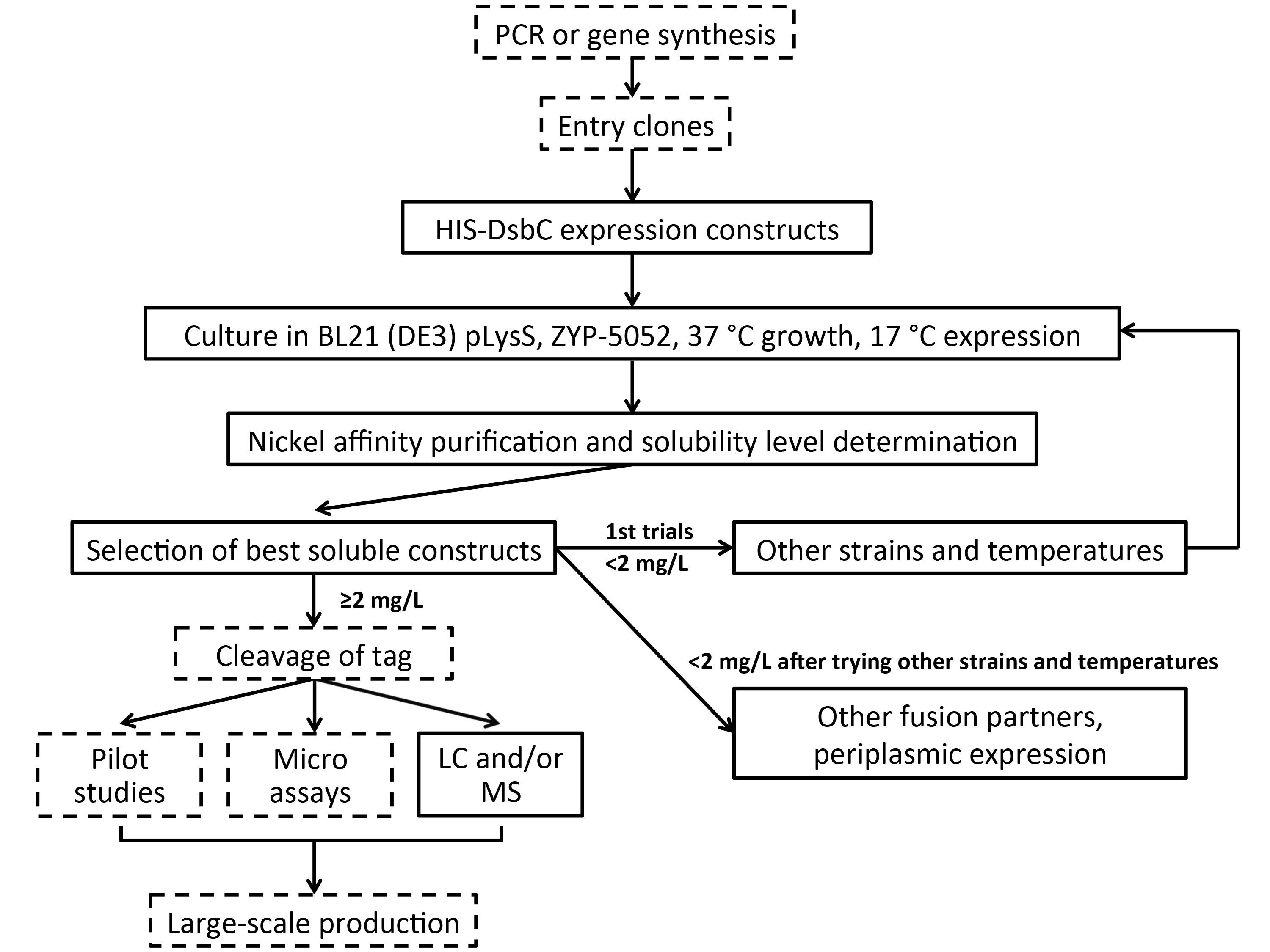
Figura 3. Alta velocità pipeline di screening per più destinazioni ricche di disolfuro. Obiettivi sono inizialmente espressi come fusioni HIS-DsbC nel citoplasma di BL21 (DE3) pLysS E. coli a 37/17 ° C con medie di auto-induzione (zyp-5052). La purificazione viene eseguita su resina nichel seguito da rilevamento dei costrutti solubili mediante elettroforesi HTP (o con dot blot / SDS-PAGE). Se il primo turno di selezione espressione è riuscita, condizioni di coltura alternativi sono provati. Se costrutti producono proteine solubili in rendimenti abbastanza elevati, microassays e controllo di qualità può essere eseguito e, se necessario, la produzione su larga scala può essere perseguito. Per le destinazioni dove i rendimenti solubili non sono abbastanza alti, lo screening espressione può continuare con stra alternativains e le temperature poi altri partner di fusione e di espressione periplasmica. Passaggi facoltativi sono indicati da caselle tratteggiate.
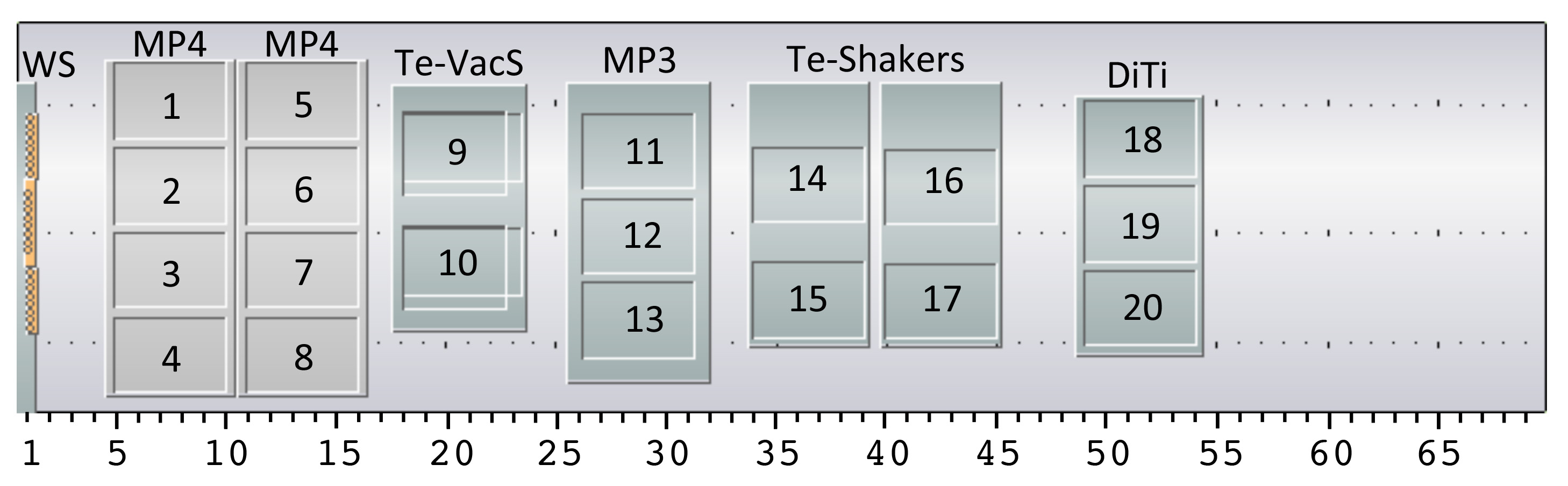
Figura 4. Configurazione Robot Piano di lavoro per la piattaforma HTP. Il layout del nostro liquido movimentazione robot tavola portapezzo è mostrato, sebbene worktables alternative possono anche essere utilizzati purché ci sono siti equivalenti disponibili. L'installazione consiste in una stazione di lavaggio (WS) per il (8 canali testa di gestione dei liquidi (LiHa)), due vettori micropiastra con 4 posizioni di ciascuno (MP4, posizioni 1-4 e 5-8), una stazione di vuoto con 2 posizioni (Te-Aspiratori, posizioni 9 e 10), un vettore micropiastra con 3 posizioni (MP3, le posizioni 11-13), due agitatori piastra con 2 posizioni di ciascuno (Te-Shakers, le posizioni 14-15 e 16-17) e un vettore per le punte monouso con 3 posizioni (Diti, posizioni 18-20). Inoltre l're sono due vettori hotel pozzetti profondi e uno per micropiastre (non mostrato). L'hardware installato sul robot liquido di trattamento è un braccio di 96-multicanale (MCA96) per l'utilizzo con punte monouso, un 8 canali di gestione dei liquidi testa (LiHa) con punte fisse e un manipolatore robotico (Roma), che si muove piastre / attrezzature giro su il piano di lavoro. La numerazione delle posizioni è indicato tutto il protocollo.

Figura 5. Schema per il trasferimento da una singola piastra a 96 pozzetti in quattro piastre da 24 pozzetti.

Figura 6. Risultati rappresentativi sono indicati per la schermata di espressione di 96 ricchi di disolfuro veleno proproteine. Le proteine sono state espresse come fusioni HIS-DsbC nel citoplasma e purificato utilizzando 50 ml di resina Nickel (protocollo 8.2-B). A) Espressione di screening risultati, mostrando gel virtuale e segnando per la resa di espressione. Il contrasto nel gel virtuale è stato regolato corsia a corsia per compensare bande molto deboli o intensi. Si noti che per alcuni target due bande possono essere visti, la banda superiore corrispondente alla proteina di fusione intatta e la banda inferiore corrispondente al tag fusion solo. B) La proporzione di proteine espresse a ciascun livello di espressione rispetto al numero di legami disolfuro in la proteina. Il numero effettivo di proteine in ciascun gruppo è sovrapposto sul grafico. C) La distribuzione dei livelli di espressione in base al punto isoelettrico (pI) e il numero di residui. D) Un esempio dei risultati di spettrometria di massa per un ricco di disolfuro veleno 5,7 kDa proteina con 4 ponti disolfuro. Lo spettro susinistra mostra la proteina prima della riduzione con DTT e lo spettro sul lato destro indica la proteina ridotta con DTT e poi dissalato. Gli ioni corrispondenti alle masse sperimentali sono contrassegnati con frecce e loro assegnazioni sono visualizzati in verde. Le masse sperimentali per la proteina prima riduzione e dopo la riduzione sono riportati nella tabella e mostrano una differenza di massa di 8 Da, corrispondente alla presenza di proteine ossidate prima aggiunta di agente riducente. Cliccate qui per vedere una versione più grande di questa figura .
| Componente | Ricetta | Commento |
| ZY | ~ 928 ml 10 g di triptone 5 g di estratto di lievito Acqua 925 ml | Mescolare e poi autoclave per sterilizzare. |
| 2 M MgSO 4 | 100 ml 49.3 g MgSO 4 · 7H 2 O ~ 60 ml di acqua | Mescolare fino a scioglimento poi in autoclave per la sterilizzazione. |
| 50x 5052 | 1 L 250 g di glicerolo 730 ml di acqua 25 g di glucosio 100 g α-lattosio | Aggiungere in sequenza, mescolate a fuoco fino a quando tutti disciolto poi in autoclave per la sterilizzazione. |
| 20x NPS | 1 L Acqua 900 ml 66 g (NH 4) 2 SO 4 136 g KH 2 PO 4 142 g di Na 2 HPO 4 | Aggiungere in sequenza e mescolare fino a quando tutto dissolto allora autoclave per la sterilizzazione. |
Tabella 1. Ricetta per i componenti di media zyp-5052.
Discussione
Non esiste un protocollo universale unico per l'espressione di, piegato, proteine funzionali solubili. Per essere costi e in tempi rapidi, la maggior parte dei laboratori o strutture di base delle proteine che lavorano con obiettivi multipli utilizzano quindi alta espressione della proteina Throughput Screening per trovare la migliore combinazione 'generico' di variabili per ottenere una proteina solubile attivo per la maggior parte degli obiettivi. Abbiamo identificato DsbC come partner di fusione generalmente applicabile per l'espressione solubile di peptidi e proteine 11 ricco di disolfuro. Uso fusioni DsbC e metodi high throughput, entro una settimana l'espressione solubile di bersagli multipli può essere osservato 11 e poi ulteriori variabili, come quelli discussi nell'introduzione, può essere proiettato nei turni successivi su quei bersagli che richiedono ulteriore ottimizzazione. I protocolli qui descritte sono finalizzate alla espressione di proteine e peptidi ricchi di disolfuro. Tuttavia, per gli utenti che desiderano express proteine non reticolari in un alto modo di throughput, i protocolli corrispondenti sono stati pubblicati in precedenza e può essere trovato altrove 22,24.
La configurazione high throughput è ideale per una serie di applicazioni, tra cui lo screening di un gran numero di differenti proteine di espressione solubile o lo screening di un gran numero di costrutti di espressione (compresi i tag vari fusione) per diversi geni bersaglio contemporaneamente ( o l'espressione più costruisce per un singolo bersaglio) al fine di migliorare il tasso di successo. La piattaforma può essere utilizzato anche per l'analisi comparativa e validazione di nuovi protocolli su un gran numero di bersagli. Altre applicazioni includono la proiezione di varianti per un singolo bersaglio difficile, ad esempio, tutti ortologhi o membri di una stessa famiglia, o per verificare il successo della produzione di un pannello di mutanti di un singolo bersaglio in un esperimento. Questo protocollo è stato utilizzato anche in combinazione con vettori co-espressione (spiritoh uno tagged proteine solo) per consentire il pull down e caratterizzazione preliminare di complessi proteina-proteina seguita da un'analisi più approfondita biofisica per confermare la corretta formazione complessa e stechiometria 33. La quantità di proteina purificata è talvolta indicato per micro-test (test funzionali, proteina-DNA 34 o proteina-proteina Prove di interazione). Ci sono diversi vantaggi per l'high throughput screening strategia espressione: (i) la possibilità di testare un gran numero di bersagli o un gran numero di variabili in un singolo esperimento, (ii) limitata variazione da lotto a lotto, (iii) l' semplicità e la facilità di lavorare ad una scala ridotta utilizzando profondi pozzi, (iv) la scalabilità e la riproducibilità su scala più ampia, (v) la possibilità per l'automazione, e (vi) la semplicità di monitoraggio e di manutenzione (senza etichettatura dei singoli tubi, meno errori introdotti quando si utilizza il formato lastra che con la manipolazione di singoli tubi in miscela o scambio di cloni).
Sebbene non discusso nella sezione del protocollo, ci sono diverse considerazioni importanti per la preparazione dell 'esperimento che verrà discusso brevemente di seguito. Per una discussione più approfondita si veda il nostro precedente pubblicazione 24. Per la massima efficienza, è utile avere un sistema adeguato per la clonazione alto rendimento, per semplificare la sub-clonazione di un gran numero di obiettivi. Per la fase iniziale del progetto VENOMICS, utilizziamo il versatile sistema di ricombinazione Gateway 25 che permette subcloning in qualsiasi vettore destinazione ad un ritmo di centinaia di cloni settimana. Protocolli per Gateway clonazione ricombinazione possono essere trovati sul sito web di Invitrogen. Altre alternative per la clonazione throughput elevato includono legatura-indipendente clonazione (LIC) 35,36 e senza restrizioni (RF) clonazione 37. Ci sono diversi modi per ottenere i geni bersaglio per l'espressione, anche mediante PCR da DNA stampo, da ingresso collezioni clone o comegeni sintetici, che è la strategia scelta per il progetto VENOMICS. Geni sintetici possono essere ordinati con siti di ricombinazione su ciascuna estremità della sintesi gene e gene permette una facile ottimizzazione codone della sequenza del gene bersaglio (per escludere rare codoni di E. coli). Questo è consigliato ma non indispensabile. Per obiettivi senza ottimizzazione codone che contengono un elevato numero di codoni rari, Rosetta 2 (DE3) pLysS (che svolge tRNA rare codoni che non sono espressi in E. coli) può essere più adatto di BL21 (DE3) pLysS. Mentre ci sono ceppi disponibili che limitano la riduzione dei legami disolfuro nell'ambiente normalmente riducente del citoplasma, nelle nostre mani non hanno avuto successo come regolare E. coli ceppi 11.Bilancia analitica purificazione per affinità è eseguita dalle colture espressione prova al fine di recuperare le proteine di fusione solubili e quantificare i rendimenti. I dati quantitativi possono essere ottenuti on the rese solubili di proteine di fusione espresse in un intervallo di 0,1-100 mg / L di cultura. Se un bersaglio non è solubile, di espressione e induzione temperature, ceppi o media alternativi possono essere testati prima di diversi partner di fusione vengono perseguiti. Per l'espressione solubile di proteine ricche di disolfuro, abbiamo precedentemente in classifica l'effetto di partner di fusione come DsbC> DsbA> GST> MBP> TRX> HIS-tag per l'espressione citoplasmatica 11. Espressione periplasmatico è un'altra possibilità che può aiutare la piegatura successo degli obiettivi ricchi di disolfuro. Periplasma è un ambiente meno riducendo del citoplasma e contiene chaperon redox utili che facilitano il legame solforico. DsbC, DsbA, e MBP proteine sono normalmente localizzati nel periplasma dalle loro sequenze segnale periplasmatiche. Ciò fornisce la possibilità di sfruttare questi tag per dirigere gli obiettivi ricchi di disolfuro di spazio periplasmatico per assistere piegatura. Per gli obiettivi intrattabili, il passo successivo sarebbe quello di purify il insolubile obiettivo HIS-tagged dai corpi di inclusione, solubilizzare e ripiegare (questo è fuori della portata di questo protocollo e non sarà discusso qui 3 9). Questo può essere abbastanza semplice per gli obiettivi con solo uno o due legami disolfuro, ma diventa sempre più difficile quanto il numero di legami disolfuro aumenta. In alternativa, e in particolare per le proteine e peptidi con quattro o più legami disolfuro, può essere utile per provare sistemi di produzione più complessi come lievito, di insetto o di espressione di mammifero.
Con i progressi nella miniaturizzazione e l'automazione, tecnologie HTP elettrofisiologia lab-on-a-chip 28 sarà senza dubbio la via del futuro per analisi funzionali. Prevediamo che per la maggior parte degli scopi (forse con l'eccezione di studi strutturali) questo negare la necessità di colture su larga scala. Colture su piccola scala non sarà solo utile per lo screening delle condizioni di espressione, ma anche essere in grado di fornire sufciente quantità di campione per questi test funzionali miniaturizzati. La capacità di produrre più bersagli in parallelo in quantità sufficiente per la caratterizzazione funzionale ridurrà i costi di coltura ed utilizzando questi tipi di piattaforme, espressione e caratterizzazione di proteine ricombinanti diventeranno più costo e tempo efficace.
I protocolli qui sono state applicate alla espressione di peptidi e proteine ricche di disolfuro nella fase iniziale del progetto FP7 europeo VENOMICS. Veleni sono una fonte eccellente di peptidi bioattivi che spesso hanno interessante potenziale farmacologico. Tuttavia, la loro produzione è impegnativo a causa dei loro complessi modelli di disolfuro di legame e di piccole dimensioni. Utilizzando piattaforme high-throughput come quello qui descritto, il progetto VENOMICS mira a generare una libreria di 10.000 nuovi peptidi veleno per riprodurre la diversità osservata in natura. Questa libreria verrà sfruttata per la caratterizzazione di disolfuro-rpeptidi ich con potenziale farmacologico o applicazioni terapeutiche con l'obiettivo di sviluppare nuovi farmaci. La piattaforma è attualmente utilizzato per l'analisi comparativa e convalidare nuovi protocolli per l'uso nel progetto VENOMICS.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
Questo lavoro è stato supportato dal progetto VENOMICS, concessione progetto europeo N ° 278346 attraverso il Settimo programma quadro (7 ° PQ HEALTH 2011-2015). Il progetto VENOMICS è una collaborazione tra diversi istituti di ricerca e aziende in Europa:
AFMB, Aix-Marseille Université (Francia), CEA Saclay (Francia), NZYTech (Portogallo), SistemasGenomicos (Spagna), Università di Liegi (Belgio), VenomeTech (Francia), Vitamib (Francia), Zealand Pharma (Danimarca)
Questo lavoro è stato supportato dal Infrastructure francese per la Biologia Integrata strutturale (FRISBI) ANR-10-InSb-05-01.
Gli autori desiderano inoltre ringraziare il Sig. Jeremy Turchetto per aiutare con i preparativi per le riprese del video.
Materiali
| Name | Company | Catalog Number | Comments |
| Tecan Freedom EVO 200 liquid handling robot | Tecan Group Ltd. | Protocols can be adapted to any liquid handling robot with a vacuum manifold for plates. http://www.tecan.com/platform/apps/product/index.asp?MenuID=2694&ID=5270&Menu=1&Item=21.1.8 | |
| 96-well PCR (PCR96) plates | Greiner Bio-One | 652270 | http://us.gbo.com/bioscience/detail/2504/ |
| LB medium | Autoclaved for sterility. | ||
| Antibiotic stocks | Kanamycin (50 mg/ml), ampicillin (100 mg/ml), chloramphenicol (34 mg/ml in ethanol), store stocks at −20 °C. Use a 1:1,000 dilution. | ||
| Deep-well 96 (DW96) plate with 2.42 ml volume capacity | Greiner Bio-One | 780270 | Autoclaved for sterility. http://us.gbo.com/bioscience/detail/2462/ |
| Expression vectors | For the expression of target constructs. Store at −20 °C. | ||
| BL21 (DE3) pLysS competent cells | Or alternative E. coli expression strain of the user's choice. Store at −80 °C. | ||
| Breathseal breathable adhesive film | Greiner Bio-One | 676050 | |
| PCR machine with 96-well plate block | For the transformation heat shock and boiling of SDS-PAGE/Caliper samples. | ||
| 24-well sterile tissue culture plates | Greiner Bio-One | 662165 | http://us.gbo.com/bioscience/detail/2220/ |
| LB-agar | Autoclaved for sterility. | ||
| 200 μl sterile disposable tips | Tecan Group Ltd. | 30 038 617 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Multitron shaking incubator, with 3 mm throw | Infors | AJ103 | Not essential, a regular shaking incubator can also be used. http://www.infors-ht.com/index.php/en/ |
| Plate incubator | |||
| Microtiter plate | For glycerol stocks and elution using purification protocol B. | ||
| Glycerol | For the preparation of glycerol stocks. | ||
| 200 μl disposable tips | Tecan Group Ltd. | 30 038 616 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Adhesive tape pads | Qiagen | 19570 | http://www.qiagen.com/Products/Catalog/Lab-Essentials-and-Accessories/Tape-Pads |
| Bactinyl | Orapi Group | Or equivalent microbial disinfectant. | |
| ZYP-5052 medium | See Table 1 for recipes of components. | ||
| Deep well 24 (DW24) plates, 10 ml capacity | Whatman | 7701-5102 | Autoclaved for sterility. http://www.whatman.com/UNIPLATECollectionandAnalysisMicroplates.aspx#7701-5102 |
| Flat-bottomed, clear microtiter plate | Greiner Bio-One | 655101 | For absorbance readings. http://us.gbo.com/bioscience/detail/2029/ |
| Plate reading spectrophotometer | Optional. For measuring OD600 of cultures. | ||
| Centrifuge with rotor for deep well plates | Suitable for 3,800 x g. | ||
| Lysozyme | 50 mg/ml in water. Store at −20 °C. | ||
| Imidazole ACS grade | Merck | IX0005-1 | A high quality grade of imidazole must be used so that it will not interfere with A280 readings for calculating protein yield. |
| Lysis buffer | 50 mM Tris, 300 mM NaCl, 10 mM imidazole pH 8 containing 0.25 mg/ml lysozyme (or your preferred buffer). Add lyzozyme from stocks each time and do not store for extended periods. | ||
| Water bath | |||
| Plate sonicator (Ultrasonic processor XL, adapted for deep well plates) | Misonix Inc. | Not essential. Lysozyme alone is normally sufficient for nearly complete lysis. | |
| DNase | 2 mg/ml stock in water, filter sterilized. Store aliquots at −20 °C. | ||
| Magnesium sulphate (MgSO4) | 2 M stock in water, autoclaved. | ||
| SDS-PAGE or Caliper sample buffer | |||
| Binding buffer | 50 mM Tris, 300 mM NaCl, 10 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| Wash buffer | 50 mM Tris, 300 mM NaCl, 50 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| Elution buffer | 50 mM Tris, 300 mM NaCl, 250 mM imidazole pH 8 (or your preferred buffer). Store at 4 °C. | ||
| 96-well Receiver/Filter Plate 20 µm, 1.8 ml capacity | Macherey-Nagel | 740686.4 | http://www.mn-net.com/ProductsBioanalysis/Accessories/tabid/10909/language/en-US/Default.aspx |
| 200 μl disposable wide bore tips | Tecan Group Ltd. | 30 050 348 | http://www.tecan.com/platform/apps/product/index.asp?MenuID=2283&ID=4118&Menu=1&Item=21.4.1.2 |
| Ni Sepharose 6 Fast Flow resin | GE Healthcare | 17-5318-02 | For purification of target fusion proteins. Store at 4 °C. Wash and equilibrate before use. http://www.gelifesciences.com/webapp/wcs/stores/servlet/productById/en/GELifeSciences/17531802 |
| Tobacco Etch Virus (TEV) protease | Optional, for cleavage. 2 mg/ml, without reducing agents in storage buffer. Store at −80 °C. | ||
| 96-well 0.22 µm filter plate | Millipore | MSGV N22 10 | Optional. To filter the soluble fraction after cleavage. http://www.millipore.com/catalogue/item/msgvn2210 |
| SDS-PAGE/dot blot equipment or Caliper Labchip GXII equipment | Electrophoresis apparatus and choice of gel type is at the user’s discretion. | ||
| Spectrophotometer and cuvettes | For measuring absorbance at 280 nm (A280) to calculate yield of soluble proteins. Not required if the analysis is done on the Caliper. | ||
| ZipTip pipette tips | Millipore | Optional. The type of ZipTip is at the user's discretion. C4 resin should be used for larger proteins, while for peptides C18 may be better. Alternative methods for desalting of samples may also be used to clean up samples before further quality control. http://www.millipore.com/catalogue/module/c5737#0 | |
| Materials are listed in the order in which they are required in the Protocol section. Reagents can be stored at room temperature unless noted otherwise. Reference numbers for the author’s preferred choice of materials are provided, however equivalent products may also be suitable. For reagents where the brand will not influence the outcome of the experiment, the company details have been omitted. | |||
Riferimenti
- Berrow, N. S., et al. Recombinant protein expression and solubility screening in Escherichia coli: a comparative study. Acta Crystallographica Section D-Biological Crystallography. 62, 1218-1226 (2006).
- Correa, A., Oppezzo, P. Tuning different expression parameters to achieve soluble recombinant proteins in E. coli: advantages of high-throughput screening. Biotechnol J. 6, 715-730 (2011).
- Graslund, S., et al. Protein production and purification. Nat Methods. 5, 135-146 (2008).
- Vera, A., Gonzalez-Montalban, N., Aris, A., Villaverde, A. The conformational quality of insoluble recombinant proteins is enhanced at low growth temperatures. Biotechnol Bioeng. 96, 1101-1106 (2007).
- Graslund, S., et al. The use of systematic N- and C-terminal deletions to promote production and structural studies of recombinant proteins. Protein Expr Purif. 58, 210-221 (2008).
- Bird, L. E. High throughput construction and small scale expression screening of multi-tag vectors in Escherichia coli. Methods. 55, 29-37 (2011).
- Davis, G. D., Elisee, C., Newham, D. M., Harrison, R. G. New fusion protein systems designed to give soluble expression in Escherichia coli. Biotechnol Bioeng. 65, 382-388 (1999).
- Kapust, R. B., Waugh, D. S. Escherichia coli maltose-binding protein is uncommonly effective at promoting the solubility of polypeptides to which it is fused. Protein science: a publication of the Protein Society. 8, 1668-1674 (1999).
- LaVallie, E. R., Lu, Z., Diblasio-Smith, E. A., Collins-Racie, L. A., McCoy, J. M. Thioredoxin as a fusion partner for production of soluble recombinant proteins in Escherichia coli. Methods Enzymol. 326, 322-340 (2000).
- Marblestone, J. G., et al. Comparison of SUMO fusion technology with traditional gene fusion systems: enhanced expression and solubility with SUMO. Protein science: a publication of the Protein Society. 15, 182-189 (2006).
- Nozach, H., et al. High throughput screening identifies disulfide isomerase DsbC as a very efficient partner for recombinant expression of small disulfide-rich proteins in E. coli. Microb Cell Fact. 12, 37 (2013).
- Sachdev, D., Chirgwin, J. M. Fusions to maltose-binding protein: control of folding and solubility in protein purification. Methods Enzymol. 326, 312-321 (2000).
- Smith, D. B. Generating fusions to glutathione S-transferase for protein studies. Methods Enzymol. 326, 254-270 (2000).
- de Marco, A., Deuerling, E., Mogk, A., Tomoyasu, T., Bukau, B. Chaperone-based procedure to increase yields of soluble recombinant proteins produced in E. coli. BMC Biotechnol. 7, 32 (2007).
- Hatahet, F., Nguyen, V. D., Salo, K. E., Ruddock, L. W. Disruption of reducing pathways is not essential for efficient disulfide bond formation in the cytoplasm of E. coli. Microb Cell Fact. 9, 67 (2010).
- de Marco, A. Recent contributions in the field of the recombinant expression of disulfide bonded proteins in bacteria. Microb Cell Fact. 11, 129 (2012).
- Katzen, F., Beckwith, J. Disulfide bond formation in periplasm of Escherichia coli. Methods Enzymol. 348, 54-66 (2002).
- Klint, J. K., et al. Production of recombinant disulfide-rich venom peptides for structural and functional analysis via expression in the periplasm of E. coli. PloS One. 8, e63865 (2013).
- Braud, S., et al. Dual expression system suitable for high-throughput fluorescence-based screening and production of soluble proteins. Journal of Proteome Research. 4, 2137-2147 (2005).
- Douzi, B. G. A., et al. A new system for expressing recombinant animal toxins in E. coli. (Collection Rencontres en Toxicologie, Publications de la SFET, Chatenay-Malabry). Advances and new technologies in toxinology. , 149-152 (2010).
- Groisillier, A., et al. MARINE-EXPRESS: taking advantage of high throughput cloning and expression strategies for the post-genomic analysis of marine organisms. Microb Cell Fact.. 9, 45 (2010).
- Vincentelli, R., et al. High-throughput protein expression screening and purification in Escherichia coli. Methods. 55, 65-72 .
- Xiao, R., et al. The high-throughput protein sample production platform of the Northeast Structural Genomics Consortium. Journal of Structural Biology. 172, 21-33 (2010).
- Saez, N. J., Vincentelli, R., Chen, Y. W. Ch3 High-throughput expression screening and purification of recombinant proteins in E. coli. Structural Genomics: General Applications : Methods in Molecular Biology. 1091, 33-53 (2014).
- Katzen, F. Gateway (R) recombinational cloning: a biological operating system. Expert. Opin. Drug Discov. 2, 571-589 (2007).
- Vincentelli, R., Canaan, S., Offant, J., Cambillau, C., Bignon, C. Automated expression and solubility screening of His-tagged proteins in 96-well format. Analytical Biochemistry. 346, 77-84 (2005).
- Studier, F. W. Protein production by auto-induction in high density shaking cultures. Protein Expr Purif. 41, 207-234 (2005).
- Spencer, C. I., et al. Ion channel pharmacology under flow: automation via well-plate microfluidics. Assay Drug Dev Technol. 10, 313-324 (2012).
- Sala, E., de Marco, A. Screening optimized protein purification protocols by coupling small-scale expression and mini-size exclusion chromatography. Protein Expr Purif. 74, 231-235 (2010).
- Moon, A. F., Mueller, G. A., Zhong, X., Pedersen, L. C. A synergistic approach to protein crystallization: combination of a fixed-arm carrier with surface entropy reduction. Protein science: a publication of the Protein Society. 19, 901-913 (2010).
- Zanier, K., et al. . Structural basis for hijacking of cellular LxxLL motifs by papillomavirus E6 oncoproteins. 339, 694-698 (2013).
- Kapust, R. B., Tozser, J., Copeland, T. D., Waugh, D. S. The P1' specificity of tobacco etch virus protease. Biochemical and Biophysical Research Communications. 294, 949-955 (2002).
- Vincentelli, R., Romier, C. Expression in Escherichia coli: becoming faster and more complex. Current Opinion in Structural Biology. 23, 326-334 (2013).
- Jolma, A., et al. DNA-binding specificities of human transcription factors. Cell. 152, 327-339 (2013).
- Aslanidis, C., de Jong, P. J. Ligation-independent cloning of PCR products (LIC-PCR). Nucleic Acids Research. 18, 6069-6074 (1990).
- Haun, R. S., Serventi, I. M., Moss, J. Rapid, reliable ligation-independent cloning of PCR products using modified plasmid vectors. BioTechniques. 13, 515-518 (1992).
- van den Ent, F., Lowe, J. RF cloning: a restriction-free method for inserting target genes into plasmids. Journal of Biochemical and Biophysical Methods. 67, 67-74 (2006).
- Vincentelli, R., et al. High-throughput automated refolding screening of inclusion bodies. Protein science: a publication of the Protein Society. 13, 2782-2792 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon