A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عالية الدقة تحليل الزمانية المكانية من مستقبلات حيوية من قبل جزيء واحدة الإسفار الميكروسكوب
In This Article
Summary
This protocol describes how to use total internal reflection fluorescence microscopy to visualize and track single receptors on the surface of living cells and thereby analyze receptor lateral mobility, size of receptor complexes as well as to visualize transient receptor-receptor interactions. This protocol can be extended to other membrane proteins.
Abstract
واحدة جزيء المجهري والناشئة باعتبارها طريقة فعالة لتحليل سلوك الجزيئات مما يشير، ولا سيما فيما يتعلق بتلك الجوانب (على سبيل المثال، حركية، التعايش بين مختلف الدول والشعوب، والتفاعلات عابرة)، التي خبأتها عادة في القياسات الفرقة، مثل تلك التي حصلنا عليها مع أساليب الكيمياء الحيوية أو المجهري القياسية. وبالتالي، الأحداث الحيوية، مثل التفاعلات مستقبلات مستقبلات، يمكن اتباعها في الوقت الحقيقي في الخلية الحية لقرار الزمانية المكانية العالية. يصف هذا البروتوكول أسلوب يعتمد على وضع العلامات مع fluorophores العضوية الصغيرة ومشرق ومجموع مضان انعكاس الداخلي (TIRF) المجهري لتصور مباشرة المستقبلات واحد على سطح الخلايا الحية. هذا النهج يسمح احد لتوطين بالضبط المستقبلات، وقياس حجم المجمعات مستقبلات، والتقاط الأحداث الديناميكية مثل عابرة التفاعلات مستقبلات مستقبلات. يوفر بروتوكول وصفا مفصلا لكيفية المؤسسة العامةrform تجربة واحدة جزيء، بما في ذلك إعداد العينات، والحصول على الصور وتحليل الصور. على سبيل المثال، تطبيق هذا الأسلوب لتحليل اثنين G-مستقبلات البروتين يقترن، مثال.، β 2 الأدرينالية وγ أمينوبتيريك نوع حمض B (GABA B) مستقبلات، ويقال. البروتوكول يمكن تكييفها لغيرها من البروتينات الغشاء ونماذج مختلفة من الخلايا، وأساليب ترنسفكأيشن واستراتيجيات التوسيم.
Introduction
المستقبلات الموجودة على سطح الخلية الشعور البيئة خارج الخلية والرد على مجموعة متنوعة من المحفزات، مثل عطر، والأيونات، والهرمونات العصبية الصغيرة البروتين كبيرة. طبيعة السائل من الأغشية الخلوية يسمح تحركات المستقبلات والبروتينات الغشاء الأخرى. هذا أمر ضروري لتشكيل مجمعات البروتين وحدوث عابرة البروتين البروتين التفاعلات، مثل تلك المستخدمة من قبل المستقبلات إلى التجمع في وحدات وظيفية وتنبيغ إشارات إلى داخل الخلية. على سبيل المثال، وقد اقترحت G-البروتين يقترن مستقبلات (GPCRs)، والتي تشكل أكبر عائلة من المستقبلات على سطح الخلية 1 إلى تشكيل di-/oligomers، والذي يظهر أن تشارك في التنظيم صقلها من نقل الإشارة و قد يكون لها عواقب فيزيولوجية والدوائية الهامة 2-5.
واحدة جزيء المجهري لديه إمكانات كبيرة من تصور مباشرة مع spatiotemp عاليةقرار شفوي السلوك الديناميكي للمستقبلات الفردية الموجودة على سطح الخلايا الحية، بما في ذلك ارتباطهم لتشكيل dimers وأعلى ترتيب المجمعات الجزيئية 6-10. هذا يوفر مزايا عدة بالمقارنة مع الطرق البيوكيميائية والمجهري القياسية، والتي عادة ما يقدم تقريرا متوسط السلوك الآلاف أو الملايين من الجزيئات.
وضع العلامات البروتين مع fluorophore مشرق وصامد كاف أمر ضروري لجزيء واحد المجهري. هذا البروتوكول يستفيد من العلامة SNAP أدخلت مؤخرا 11 لنعلق تساهميا fluorophores العضوية الصغيرة ومشرق لمستقبلات سطح الخلية. SNAP هو 20 دينار كويتي علامة البروتين المستمد من إصلاح الحمض النووي انزيم O-DNA alkyltransferase 6 alkylguanine الإنسان، والتي يمكن أن توصف بشكل لا رجعة فيه مع fluorophore مترافق benzylguanine (fluorophore-BG) المشتقات. CLIP، علامة مزيد المهندسة المستمدة من SNAP، يمكن بدلا من ذلك المسمى مع fluorophore جالمشتقات benzylcytosine onjugated 12.
بروتوكول ورد في هذا المخطوط يشرح كيفية بالنقل والتسمية SNAP-11 مستقبلات الموسومة مع fluorophores العضوية الصغيرة واستخدام مجموع مضان انعكاس الداخلي (TIRF) المجهري لتصور واحد أو المجمعات مستقبلات مستقبلات على سطح الخلايا الحية 10. نتائج بروتوكول ورد في> 90٪ كفاءة تسمية أحد SNAP الموسومة بروتين سطح الخلية خارج الخلية 10. ، يتم توفير مزيد من المعلومات حول كيفية استخدام بيانات واحدة جزيء لتحليل حجم وتنقل مستقبلات المجمعات، وكذلك لالتقاط عابرة التفاعلات مستقبلات مستقبلات. ويرد سير العمل التخطيطي للبروتوكول كامل في الشكل 1. وكمثال على ذلك، فإن ترنسفكأيشن الصينية الهامستر المبيض (شو) الخلايا مع SNAP الموسومة G-البروتين يقترن مستقبلات (GPCRs)، يليه وضع العلامات مع مشتق fluorophore-BG كما وكذلك تطبيقه على quantifذ موصوفة ورصد مستقبلات di-/oligomerization. ويمكن تمديد هذا البروتوكول إلى غيرها من البروتينات على سطح الخلية والعلامات الفلورية (على سبيل المثال، CLIP)، فضلا عن وضع العلامات وترنسفكأيشن أساليب أخرى.
Protocol
1. إعداد نموذج
- تنظيف ساترة
ملاحظة: العمل تحت غطاء الدخان.- استخدام ملاقط نظيفة لوضع coverslips الزجاج (24 مم) إلى حامل ساترة الذي يفصل coverslips الفردية.
- وضع حامل مع coverslips في كوب وإضافة الكلوروفورم حتى يتم تغطية لل coverslips. تغطية الكأس مع رقائق الألومنيوم لخفض التبخر ويصوتن في sonicator الحمام لمدة 1 ساعة على RT. اتخاذ حامل ساترة للخروج من الكأس والسماح لل coverslips الجافة.
- كرر الخطوة 1.1.2 مع حل 5M هيدروكسيد الصوديوم بدلا من الكلوروفورم.
- اتخاذ ساترة حامل في دورق جديدة ويغسل ثلاث مرات مع الماء المقطر. وضع coverslips تنظيفها في لوحة الثقافة خلية زجاجية مملوءة الإيثانول بنسبة 100٪.
- إعداد عينات المعايرة
- حل صبغة الفلورسنت في المذيبات المناسبة.
- إعداد 1:10 التخفيف التسلسلي للصبغة الفلورسنت تتراوحمن 1:00 إلى 1 نانومتر في فلتر تعقيم (0.22 ميكرون) المياه.
- اتخاذ coverslips تنظيفها المخزنة في الإيثانول بنسبة 100٪ ويغسل بالماء فلتر تعقيم. بقعة 20 ميكرولتر من كل تخفيف صبغة الفلورسنت على ساترة تنظيفها منفصلة. السماح لل coverslips يجف تحت غطاء العقيمة. حماية لل coverslips عن الضوء والغبار حتى الاستخدام. استخدام هذه العينات لتقدير كثافة الجزيئات فلوري واحد (راجع الخطوة 3).
- ترنسفكأيشن
- خلايا الثقافة CHO في 01:01 Dulbecco لتعديل النسر خليط المتوسطة / المغذيات F-12 (DMEM/F12) تستكمل مع 10٪ مصل بقري جنيني (FBS)، و 100 U / البنسلين مل و 100 ميكروغرام / مل الستربتوميسين عند 37 درجة مئوية، في 5٪ CO 2 ملاحظة: استخدام وسائل الإعلام خالية من الفينول الأحمر في كافة مراحل التجربة للحد من تألق ذاتي.
- اتخاذ coverslips تنظيفها من 100٪ حل الإيثانول، وغسلها مع الفوسفات مخزنة المالحة عقيمة (PBS)، ووضع ساترة واحد في كل بئر من ثقافة رر 6 خلايا جيدايأكلون.
- يعرض للتريبسين، عد والخلايا CHO البذور في مناطق ذات كثافة من 3 × 10 5 خلية / جيدا في 6 جيدا لوحة الثقافة الخلية التي تحتوي لل coverslips. السماح للخلايا تنمو في حاضنة (37 درجة مئوية، 5٪ CO 2) لمدة 24 ساعة من أجل تحقيق تقريبا. 80٪ confluency، والذي هو الأمثل لكثافة الخلية ترنسفكأيشن.
- لكل بئر، وتمييع 2 ميكروغرام من الحمض النووي البلازميد المطلوب (على سبيل المثال، SNAP الموسومة مستقبلات β-2 الأدرينالية) و 6 ميكرولتر Lipofectamine عام 2000 في اثنين من أنابيب منفصلة تحتوي على 500 ميكرولتر OptiMem المتوسط. احتضان عند RT لمدة 5 دقائق.
- الجمع بين الحلول من الخطوة 1.3.4 في أنبوب واحد ومزيج للحصول على خليط ترنسفكأيشن. احتضان الخليط ترنسفكأيشن على RT لمدة 20 دقيقة.
- أثناء الحضانة (1.3.5)، وتأخذ الخلايا CHO ويغسل مرتين مع قبل حرارة (37 درجة مئوية) في برنامج تلفزيوني. استبدال برنامج تلفزيوني مع 1 مل / جيد من الفينول الحمراء الخالية المتوسطة DMEM/F12 تستكمل مع FBS 10٪ ولكن لا المضادات الحيوية.
- إضافة بالنقل كاملخليط أيون (1 مل) من الخطوة 1.3.5 قطرة قطرة إلى كل بئر، وبلطف الصخور لوحة ذهابا وإيابا لضمان خلط كاملة.
- احتضان لمدة 2-4 ساعة عند 37 درجة مئوية، في 5٪ CO 2 والشروع فورا بعد ذلك إلى الخطوة التالية ملاحظة: لقد تم تحسين هذه الظروف ترنسفكأيشن لتحقيق كثافة مستقبلات <0.45 الجسيمات / ميكرون 2، التي هي مناسبة لواحد التصوير الجزيء. قد تكون هناك حاجة التعديلات عند استخدام خلايا مختلفة، أو يبني الكواشف.
- وضع العلامات البروتين
- تمييع 1 ميكرولتر من fluorophore-BG محلول المخزون في 1 مل DMEM/F12 المتوسطة تستكمل مع FBS 10٪ للحصول على تركيز النهائي من 1 ميكرومتر. تأخذ الخلايا المصابة بالعدوى بالنقل من الحاضنة ويغسل مرتين مع prewarmed (37 درجة مئوية) في برنامج تلفزيوني. استبدال برنامج تلفزيوني مع 1 مل من 1 ميكرومتر fluorophore-BG الحل واحتضان لمدة 20 دقيقة عند 37 درجة مئوية 5٪ CO 2 في حاضنة.
- بعد الحضانة، وغسل الخلايا الثلاثمرات مع DMEM/F12 المتوسطة تستكمل مع FBS 10٪، في كل مرة تليها 5 دقائق الحضانة عند 37 درجة مئوية. اتخاذ ساترة (مع الخلايا المسمى) مع ملاقط ووضعه إلى غرفة التصوير.
- يغسل مرتين مع 300 ميكرولتر العازلة التصوير. إضافة 300 ميكرولتر من العازلة التصوير الطازجة والشروع فورا في التصوير (الجزء 2).
2. الحصول على صورة
ملاحظة: استخدام الانعكاس الكلي الداخلي مضان (TIRF) المجهر، ومجهزة هدفا النفط الغمر الفتحة العددية عالية (على سبيل المثال، 100X magnification/1.46 الفتحة العددية.)، وأشعة الليزر مناسبة (على سبيل المثال، 405 نانومتر، 488 نانومتر، 561 نانومتر و 645 ليزر ديود نانومتر)، الإلكترون ضرب المسؤول إلى جانب جهاز (EMCCD) الكاميرا، وحاضنة والتحكم في درجة الحرارة لتصور جزيئات فلوري واحد.
- تعيين المعلمات المجهر المطلوب، مثال.، خط ليزر، وزاوية TIRF (هذه المعلمة يتحكم في penetraعمق نشوئها الحقل زائل)، وقت التعرض، ومعدل الإطار، وعدد من الصور في الفيلم 10. الحفاظ على سخان / حاضنة والتحكم في درجة الحرارة دائما على تجنب الانجرافات درجة الحرارة وتكثف الرطوبة.
- وضع قطرة من زيت الغمر على الهدف 100X المجهر. وضع غرفة التصوير مع الخلايا المسمى على حامل عينة من المجهر، وجعل الخلايا في التركيز باستخدام إضاءة brightfield.
- التبديل إلى TIRF الإضاءة. الحفاظ على قوة الليزر منخفض قدر الإمكان للسماح بالبحث عن الخلية المطلوب ولكن في نفس الوقت تقليل photobleaching من.
- حدد الخلية المطلوب وغرامة ضبط التركيز. تعيين قوة الليزر إلى المستوى الذي يسمح التصور من fluorophores واحد. الحصول على تسلسل الصور وحفظ الملف الخام تسلسل الصورة باسم. شجار.
3. معايرة (Fluorophores واحدة على الزجاج وأحادى / الضوابط مستقبلات مثنوي)
- تجميع كل sampl المعايرةه أعد كما هو موضح في 1.2 في غرفة التصوير. وضع كل عينة على المجهر واختيار العينة تحتوي على فصل جيدا بقع محدودة حيود أن التبييض في واحد خطوة ملاحظة: تمثل هذه البقع الجزيئات واحدة من صبغة الفلورسنت.
- الحصول على تسلسلات الصور TIRF كما هو موضح في الخطوة 2 هامة: يجب استخدام المعلمات التصوير نفسه بالنسبة لجميع التجارب، بما في ذلك تلك التي للمعايرة.
- إجراء الكشف والتحليل تتبع على النحو المفصل في 4،1-4،2. استخراج كثافة كل الجسيمات كما هو موضح في 4.2.6. من هذه البيانات، وحساب متوسط (μ) والانحراف المعياري (σ) من شدة fluorophores واحد.
- اختياري: تؤدي نفس التحليل على الخلايا transfected مع لأحادى مستقبلات سطح الخلية (. على سبيل المثال، CD86)، N-عضال الموسومة مع واحد أو نسختين من SNAP 10 والمسمى مع مشتق fluorophore-BG. فولو فوتبال شيث الإجراء الموضح أعلاه لfluorophore واحد على الزجاج. تقدير كفاءة وضع العلامات كما هو موضح في Calebiro، D. آخرون 10
4. تحليل الصور
- إعداد تسلسل الصور
- استخدام برامج معالجة الصور (مثل.، يماغيج) لاقتصاص الصور.
- وتوفير الأطر الفردية ومنفصلة. الصور شجار في مجلد جديد، مما يدل على كل صورة عدد الإطار.
- قياس مساحة سطح الخلية عن طريق رسم المنطقة ذات الاهتمام (ROI) على طول كفاف من خلية وباستخدام أداة قياس في ImageJ أو أداة مشابهة في برامج أخرى. استخدام هذه القيمة لحساب كثافة الجسيمات عن طريق قسمة إجمالي عدد الجزيئات في بداية الفيلم من مساحة سطح الخلية.
- الكشف عن الجسيمات تتبع و
ملاحظة: استخدام البرمجيات غير التجارية مثل يو المسار 13، والعمل في Matlabالبيئة، للكشف تلقائيا وتتبع الجزيئات المستقبلة واحد.
ملاحظة: يستند الخوارزمية يو المسار على النهج متعددة تتبع الفرضية. يربط هذا النهج بين الإطارات الجسيمات عن طريق بناء مصفوفات التكلفة، حيث يتم تعيين الاحتمالات الفردية التي جزيء معين في إطار واحد يناظر الجسيمات التي وردت في الإطار التالي، يظهر، يختفي أو يدمج / انشقاقات مع / من الجزيئات الأخرى. الحل الذي يقلل من التكاليف عالميا، أي، واحد مع احتمال أعلى، يتم تحديد نهاية المطاف. وهذا يسمح أيضا تتبع الجسيمات تختفي مؤقتا، وهي ظاهرة نموذجية الناجمة عن fluorophore امض. أحدث إصدار من يو المسار (2.1.0) واجهات المستخدم الرسومية التي تسهل تنفيذ هذه التحليلات.- من موجه الأوامر ماتلاب، اكتب "movieSelectorGUI" لفتح واجهة اختيار الفيلم. اتبع الإرشادات لإنشاءقاعدة بيانات الفيلم بدءا من صور منفصلة تم حفظها سابقا (انظر 4.1.2).
- توفير حجم بكسل في نانومتر، الفاصل الزمني في ثوان، والفتحة العددية، وعمق الكاميرا قليلا والطول الموجي الانبعاثات من fluorophore، المطلوبة للكشف عن الجسيمات وتتبع. حفظ قاعدة البيانات الفيلم.
- من واجهة اختيار الفيلم، تشغيل التحليل، واختيار "جزيئات واحدة" كنوع من الكائنات. سوف تظهر نافذة جديدة حيث يمكن تعريف المعايير المستخدمة للكشف عن الجسيمات وتتبع. تبدأ مع المعلمات الافتراضية. في وقت لاحق، وضبط هذه المعايير إذا كانت نوعية الكشف و / أو تتبع ليست مرضية (على سبيل المثال، لا يتم الكشف عن بعض الجزيئات أو المسارات مجزأة) اختياري: تحت إعدادات تتبع، تحقق "نتائج تتبع تصدير إلى تنسيق مصفوفة" للتخزين الإحداثيات وسعة من جميع الجزيئات في مصفوفة واحدة (حقل يسمى "trackedFeaturedInfo"). للحصول على وصف مفصل لهذه المعايير، راجع وثائق يو المسار.
- تشغيل خوارزمية الكشف. هذه الخوارزمية تلقائيا تحديد موقع وشدة فوق خلفية من كل بقعة محدودة الحيود (أي. والمجمعات مستقبلات احد / مستقبلات) من خلال تركيب وظيفة التمويه ثنائي الأبعاد مع انحراف معياري يساوي وظيفة انتشار نقطة المجهر حول ماكسيما كثافة المحلية . ثم، تشغيل خوارزمية تتبع. تخزين نتائج التحليلات في ملف حصيرة.
- استخدام "movieViewer" روتينية، والواردة في حزمة يو المسار، أو تلك العادة مشابهة لتصور مسارات والتحقق من نوعية الكشف والتعقب.
- فتح ملف حصيرة. لمعرفة موقف والسعة (أي.، وكثافة) من جزيئات تعقب في كل إطار. وترد البيانات التي تم إنشاؤها في الخطوة 4.2.4 في مجال tracksCoordAmpCG من ع tracksFinalراي و / أو في trackedFeaturedInfo. من العدد الكلي للجسيمات الكشف عن حساب كثافة الجسيمات تقسيم هذه القيمة من قبل منطقة سطح الخلية قياسها 4.1.3.
- اختياري: استخدام ينسق الجسيمات على مر الزمن (انظر 4.2.6) لتحليل حركة الجسيمات مستقبلات. حساب تشريد متوسط مربع (MSD) ومعاملات الانتشار (D) باستخدام ماتلاب أو برامج مماثلة. لكل الجسيمات وكل فترة زمنية (Δ ر) النظر، وحساب متوسط مربع الإزاحة (MSD) باستخدام الصيغة التالية:
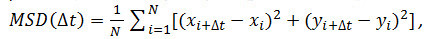
حيث Δ t هو الفاصل الزمني في الإطارات، N هو عدد من الخطوات تحليلها، x و y هي س الجسيمات و y إحداثيات في الإطار يتبين من المؤشر. استخدام MSD على المؤامرات الوقت لتقييم نوع حركة الجسيمات الممنوحة: العلاقات الخطيةتشير نشرها الحرة (أي، الحركة البراونية)، انحناء إيجابية (أي.، منحنى يشبه القطع المكافئ) إلى الحركة الموجهة، انحناء سلبي يدل تقتصر الحركة 14. في حالة الجسيمات نشرها بحرية، وحساب معامل الانتشار (D) من كل جسيم من المناسب البيانات التي تم الحصول عليها مع MSD المعادلة التالية: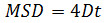
- حساب حجم الجسيمات مع طريقة تركيب جاوس
ملاحظة: مرة واحدة ومن المعروف توزيع كثافة عينات المعايرة (fluorophores واحدة على الزجاج و / أو مستقبلات أحادى fluorescently المسمى)، نفذ نوبة مختلطة التمويه على توزيع كثافة الجسيمات في بداية تسلسل الصورة لتحديد حجم المجمعات مستقبلات (أي.، وعدد من المستقبلات في الجسيمات) 10. أداء هذه التحليلات باستخدام ماتلاب أو لياليبرامج imilar.- حساب كثافة كل الجسيمات عن طريق حساب متوسط كثافة الجسيمات من الإطار الأول إلى الإطار قبل التغيير الأول في شدة وقعت (في معظم الحالات انخفاضا بسبب photobleaching من).
- إجراء المناسب جاوس المختلطة وفقا للمعادلة التالية:
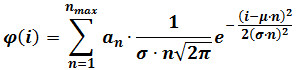
حيث φ (ط) هو التردد من الجسيمات وجود كثافة ط، ن هو عدد مكون، α n هو معلمة التي تساهم في ارتفاع عنصر ن، μ σ هي والمتوسط والانحراف المعياري من شدة إشارة fluorophores واحد (حساب كما هو موضح في الخطوة 3) ملاحظة: تحديد ركان العدد الأقصى من مكونات (ن كحد أقصى) لكل تسلسل الصور من خلال زيادة تدريجية ن ماكس حتى إضافة عنصر لا لم تعد تنتج أفضل المناسب إحصائيا، كما تقرره لاختبار F. - اختياري: (على سبيل المثال، 60 لقطة أخير تسلسل الإطار 400) إجراء مناسبا جاوس مختلطة على توزيع كثافة الحصول على إطارات الأخير من الفيلم. استبدال μ σ ومع القيم التي تم الحصول عليها بعد هذه المناسب، والتي توفر تقديرات المكرر لتلك المعايير، وكرر الخطوة 4.3.2.
- حساب مساحة تحت المنحنى (AUC) من كل عنصر من عناصر تناسب التمويه مختلطة. حساب الوفرة النسبية للجسيمات مستقبلات مختلفة الحجم (أي مونومر، ديمر، ترايمر، الخ) عن طريق قسمة قيمة AUC كل مكون من قبل الجامعة الأمريكية بالقاهرة لتوزيع بأكمله.
- اختياري: استخدام بيانات من خلايا مختلفة وكثافة الجسيمات المقابلة (محسوبة كما هو موضح في 4.2.6) لتوليد المؤامرات حيث يرتبط توزيع الجسيمات مع حجم مختلفة مع كثافة الجسيمات 10.
- حساب حجم الجسيمات مع خطوة طريقة تركيب
ملاحظة: استخدام التحليل المناسب خطوة كطريقة بديلة لتحديد حجم المجمعات مستقبلات 10. الأساس لهذا التحليل هو أن الدمار الناجم عن الضوء (photobleaching من) من نتائج fluorophore واحد في اختفائها لحظية - وبالتالي الجزيئات التي تحتوي على ن fluorophores ومن المتوقع أن التبييض تدريجيا انتاج ملف كثافة مع n الخطوات.- استخراج ملامح كثافة كل الجسيمات من ملف حصيرة التي تولدها يو المسار أو ما شابه ذلك برنامج الكشف عن / تتبع (انظر 4.2.6).
- استخدام خوارزمية تركيب الخطوة، مثل واحد قدمفي المرجع. 10، لحساب عدد من الخطوات تبيض لكل الجسيمات.
- اختياري: استخدام النتائج لتوليد توزيعات تظهر الوفرة النسبية للجسيمات مستقبلات مختلفة الحجم وربط لهم مع كثافة الجسيمات كما هو موضح سابقا عن نتائج مختلطة المناسب جاوس (انظر 4.3).
النتائج
ويمكن تطبيق البروتوكول وصف لمجموعة متنوعة من البروتينات الغشاء مختلفة. على سبيل المثال، يتم الإبلاغ عن النتائج التي تم الحصول عليها مع ممثل β المستقبلات الأدرينالية و2 GABA B 10. منذ إشارات الفلورسنت من الجزيئات واحدة ضعيفة، والحد من مضان الخلفية هي ال...
Discussion
بروتوكول صفها يسمح تحليل الترتيب المكاني، والتنقل وحجم المجمعات مستقبلات سطح الخلية في مستوى واحد جزيء. بالمقارنة مع استخدام البروتينات الفلورية، ووضع العلامات مع fluorophores العضوية الصغيرة، والتي هي أكثر إشراقا وأكثر صامد، لديه ميزة السماح التصور طويلة من جزيئات مست...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
The development of this protocol was supported by grants from the European Research Council (Advanced Grant TOPAS to M.J.L.) and the Deutsche Forschungsgemeinschaft (Grants CA 1014/1-1 to D.C. and SFB487 to M.J.L.). T.S. was supported by the Alexander von Humboldt Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| Chloroform | AppliChem GmbH | A1585 | CAUTION: toxic and irritating substance as well as a possible carcinogen |
| NaOH | Sigma-Aldrich | S8045 | CAUTION: strong base and highly corrosive reagent |
| Absolute ethanol | Sigma-Aldrich | 32205 | |
| Glass coverslip | Marienfeld-Superior | 111640 | 24 mm diameter, 0.13-0.16 mm thickness |
| 0.2 mm sterile filter | Sarstedt | 83.1826.001 | |
| CHO cells | ATCC, USA | ATCC CCL-61 | Chinese hamster ovary cell line |
| 6-well cell culture plate | Nunc | 140675 | |
| DMEM/F-12 medium | GIBCO, Life Technologies | 11039-021 | Phenol-red free medium |
| Fetal bovine serum | Biochrom | S 0115 | |
| Penicillin - streptomycin | Pan Biotech GmbH | P06-07 100 | |
| Trypsin-EDTA | Pan Biotech GmbH | P10-23100 | |
| Lipofectamine 2000 | Invitrogen, Life Technologies | 11668-019 | |
| Opti-MEM I Reduced Serum Medium | Invitrogen, Life Technologies | 31985-047 | |
| Fluorophore-conjugated benzylguanine | New England BioLabs | S9136S | SNAP-Surface Alexa Fluor 647. Make a 1 mM stock solution in DMSO. Store at -20°C. |
| DMSO | AppliChem GmbH | A1584 | |
| Imaging buffer: | 137 mM NaCl, 5.4 mM KCl, 2 mM CaCl2, 1 mM MgCl2, 10 mM HEPES, pH 7.3, sterile-filtered | ||
| NaCl | AppliChem GmbH | A1371 | |
| KCl | AppliChem GmbH | A3582 | |
| CaCl2 | AppliChem GmbH | A2303 | |
| MgCl2 | AppliChem GmbH | A3618 | |
| HEPES | AppliChem GmbH | A3724 | |
| Imaging chamber | Molecular Probes, Life Technologies | A-7816 | Attofluor Cell Chamber, for microscopy |
| TIRF-M | Leica | Model: DMI6000B | |
| TIRF objective | Leica | 11 506 249 | HCX PL Apo 100x/1.46 Oil CORR |
| EM-CCD camera | Roper Scientific | Photometrics Cascade 512B | |
| Temperature controller | Pecon | Tempcontrol 37-2 digital | |
| ImageJ software | NIH, USA | http://rsbweb.nih.gov/ij | |
| u-track software | Laboratory for computational cell biology, Dept. of Cell Biology, Harvard Medical School, USA | http://lccb.hms.harvard.edu/software.html | |
| Matlab software | The MathWorks, USA |
References
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Angers, S., Salahpour, A., Bouvier, M. Dimerization: an emerging concept for G protein-coupled receptor ontogeny and function. Annu Rev Pharmacol Toxicol. 42, 409-435 (2002).
- Ferré, S., et al. Building a new conceptual framework for receptor heteromers. Nat Chem Biol. 5, 131-134 (2009).
- Milligan, G. G. protein-coupled receptor hetero-dimerization: contribution to pharmacology and function. Br J Pharmacol. 158, 5-14 (2009).
- Lohse, M. J. Dimerization in GPCR mobility and signaling. Curr Opin Pharmacol. 10, 53-58 (2010).
- Ulbrich, M. H., Isacoff, E. Y. Subunit counting in membrane-bound proteins. Nat Methods. 4, 319-321 (2007).
- Triller, A., Choquet, D. New concepts in synaptic biology derived from single-molecule imaging. Neuron. 59, 359-374 (2008).
- Hern, J. A., et al. Formation and dissociation of M1 muscarinic receptor dimers seen by total internal reflection fluorescence imaging of single molecules. Proc Natl Acad Sci U S A. 107, 2693-2698 (2010).
- Kasai, R. S., et al. Full characterization of GPCR monomer-dimer dynamic equilibrium by single molecule imaging. J Cell Biol. 192, 463-480 (2011).
- Calebiro, D., et al. Single-molecule analysis of fluorescently labeled G-protein-coupled receptors reveals complexes with distinct dynamics and organization. Proc Natl Acad Sci U S A. 110, 743-748 (2013).
- Keppler, A., et al. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nat Biotechnol. 21, 86-89 (2003).
- Gautier, A., et al. An engineered protein tag for multiprotein labeling in living cells. Chem Biol. 15, 128-136 (2008).
- Jaqaman, K., et al. Robust single-particle tracking in live-cell time-lapse sequences. Nat Methods. 5, 695-702 (2008).
- Saxton, M. J., Jacobson, K. Single-particle tracking: applications to membrane dynamics. Annu Rev Biophys Biomol Struct. 26, 373-399 (1997).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved