Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tek molekül Floresan Mikroskopi Reseptör Dinamiği Yüksek çözünürlüklü Spatiotemporal Analizi
Bu Makalede
Özet
This protocol describes how to use total internal reflection fluorescence microscopy to visualize and track single receptors on the surface of living cells and thereby analyze receptor lateral mobility, size of receptor complexes as well as to visualize transient receptor-receptor interactions. This protocol can be extended to other membrane proteins.
Özet
Tek molekül mikroskopi bu yönünü (örneğin., Kinetik, farklı devletler ve toplumlarda, geçici etkileşimler birlikteliği), genellikle topluluk ölçümleri gizlidir, gibi ilgili özellikle, sinyal molekülleri davranışını analiz etmek için güçlü bir yaklaşım olarak ortaya çıkmaktadır standart biyokimyasal veya mikroskopi yöntemleri ile elde edilen. Bu nedenle, böyle bir reseptör-reseptör etkileşimleri gibi dinamik olaylar, yüksek uzaysal çözünürlüklü bir canlı hücrede gerçek zamanlı olarak takip edilebilir. Bu protokol küçük ve parlak bir organik florofor ve doğrudan canlı hücre yüzeyi üzerinde bir reseptörleri görselleştirmek için toplam iç yansıma flüoresans (TIRF) mikroskopisi ile etiketleme göre bir yöntem tarif edilir. Bu yaklaşım, bir tam, reseptörleri lokalize reseptör komplekslerinin boyutunu ölçmek ve bu geçici reseptör-reseptör etkileşimleri gibi dinamik olayları yakalamak için izin verir. Protokol pe nasıl ayrıntılı bir açıklamasını sağlarnumune hazırlama, görüntü elde etme ve görüntü analizi de dahil olmak üzere, tek bir molekül deney, rform. Bir örnek olarak, bu yöntemin uygulanması, iki G-proteinine kenetlenmiş reseptörlerin analiz etmek için, yani., 2-adrenerjik ve γ-aminobütirik asit tipi B (GABA B) reseptörü β, bildirilir. Protokol başka zar proteinleri ve farklı hücre modellerinde, transfeksiyon yöntemleri ve etiketleme stratejileri adapte edilebilir.
Giriş
Hücre yüzeyi üzerinde bulunan reseptörler hücre dışı ortamı algılar ve bu tür koku maddeleri, iyonlar küçük, nörotransmiterler ve büyük protein hormonları olarak uyaranlara, çeşitli yanıt. Hücresel zarların akışkan doğası, reseptörler ve diğer membran proteinleri hareketlerini sağlar. Bu protein kompleksleri ve bu gibi fonksiyonel birimleri içine monte ve hücre içine sinyalleri nakletmek için reseptörler tarafından kullanılan gibi geçici protein-protein etkileşimleri, oluşumu oluşumu için gereklidir. Örneğin, hücre yüzey reseptörlerinin 1 en büyük ailesini oluşturan G-protein bağlı reseptörler (GPCR'ler), sinyal transdüksiyon ince ayarlı düzenleme dahil olmak üzere görünür ve di-/oligomers oluşturmak üzere önerilmiştir önemli fizyolojik ve farmakolojik sonucu 2-5 olabilir.
Tek molekül mikroskopi doğrudan yüksek spatiotemp ile görselleştirme büyük bir potansiyele sahipOral çözünürlük ilişkisi de dahil olmak üzere canlı hücrelerin yüzeyinde yer alan ayrı ayrı reseptörler dinamik davranışı dimerler ve yüksek dereceli moleküler kompleksleri oluşturmak için 6-10. Bu genellikle moleküllerin binlerce veya milyonlarca ortalama davranışını rapor standart biyokimyasal ve mikroskopi yöntemleri ile karşılaştırıldığında çeşitli avantajlar sunmaktadır.
Yeterince parlak ve ışığa floroforuyla Protein etiketleme tek-molekül mikroskopi için esastır. Bu protokol, kovalent olarak hücre yüzeyi reseptörlerine küçük ve parlak bir organik florofor takmak için son zamanlarda ortaya SNAP etiketi 11 yararlanır. SNAP dönüşümsüz flüoroforla konjuge benzilguanin (flüoroforla-BG) türevleri ile etiketlenmiş olabilir insan DNA onarım enzimi O 6-alkylguanine-DNA alkyltransferase, türetilen bir 20 kD protein etikettir. CLIP, SNAP türetilen bir başka mühendislik etiket yerine, florofor-c ile etiketlenebilironjugated benzylcytosine türevleri 12.
Bu yazıda bildirilen protokol transfect ve etiket küçük organik floroforlar ile 11 reseptörlerini SNAP-etiketli ve canlı hücrelerin 10 yüzeyinde tek reseptörler veya reseptör kompleksleri görselleştirmek için toplam iç yansıma floresan (TIRF) mikroskopi için nasıl kullanılacağı açıklanır. Bir hücre dışında SNAP-etiketli hücre yüzey proteininin 10>% 90 verim, en etiketleme bildirilen protokol ile sonuçlanır. Reseptör komplekslerinin boyut ve hareketlilik analiz etmek için, hem de geçici reseptör-reseptör etkileşimlerinin yakalamak için tek molekül verilerin kullanımı ile ilgili daha fazla bilgi sağlanır. Tüm protokolünün şematik bir iş akışı, Şekil 1 'de verilmiştir. Bir örnek olarak, Çin Hamsteri Yumurtalık SNAP-etiketli G-protein-bağlanmış reseptörler (GPCR'ler) ile (CHO) hücrelerinin transfeksiyonu gibi bir florofor BG türevi ile etiketleme ve ardından iyi uygulama quantif olaraky ve monitör reseptör di-/oligomerization açıklanmıştır. Bu protokol, diğer hücre yüzey proteinleri ve floresan etiketler (örneğin,., CLIP), hem de diğer transfeksiyon ve etiketleme yöntemleri için uzatılabilir.
Protokol
1.. Numune Hazırlama
- Lamel temizleme
NOT: Bir davlumbaz altında çalışın.- Bireysel lamelleri ayıran bir lamel tutucu içine cam lamelleri (24 mm çap) yerleştirmek için temiz cımbız kullanın.
- Bir beher içine lamelleri ile tutucu koyun ve lamelleri kaplıdır kadar kloroform ekleyin. Oda sıcaklığında 1 saat boyunca bir banyo sonikatörü içinde buharlaştırma ve sonikasyon azaltmak için alüminyum folyo ile beher örtün. Beher dışına lamel tutucu alın ve lamelleri kurumaya bırakın.
- Yerine kloroform içinde 5 M NaOH çözeltisi ile adımı 1.1.2 tekrarlayın.
- Yeni bir behere lamel tutucu alın ve damıtılmış su ile üç kez yıkayın. % 100 etanol ile dolu bir cam hücre kültürü plakasında lamelleri temizlenmiş koyun.
- Kalibrasyon örneklerinin hazırlanması
- Uygun bir çözücü içinde floresan boya çözülür.
- Arasında değişen floresan bir boya 01:10 seri seyreltme hazırlanması13:00 1 nM'ye filtre (0.22 um) steril su.
- % 100 etanol içinde saklanan temizlenmiş lamelleri ayırın ve filtre ile sterilize edilmiş su ile yıkayın. Ayrı bir temizlenmiş lamel floresan için seyreltme Noktası 20 ul. Lamelleri steril bir başlık altında kurumaya bırakın. Kullanıma kadar ışık ve tozdan lamelleri koruyun. Tek flüoresan moleküllerinin yoğunluğunu (adım 3) tahmin etmek için, bu örnekler kullanın.
- Transfection
- 1:01 Dulbecco tadil edilmiş Eagle ortamı / besleyici karışımı içinde kültür CHO hücreleri, F-12,% 10 fetal sığır serumu (FBS), 100 U / ml penisilin ve 37 ° C'de 100 ug / ml streptomisin, in takviye (DMEM/F12) .% 5 CO2 Not: otoflüoresanı en aza indirmek için deney boyunca fenol kırmızısız ortamını kullanın.
- ,% 100 etanol çözeltisi temizlenmiş lamelleri al steril fosfat-tamponlu tuzlu su (PBS) ile yıkayın ve bir 6 yuvalı hücre kültürü pl her oyuğuna bir lamelyedik.
- Trypsinize, sayısı ve 3 x 10 5 hücre / göz lamelleri içeren 6 oyuklu hücre kültürü plakasının içindeki bir yoğunlukta tohum CHO hücreleri. Hücrelerin yaklaşık elde etmek için 24 saat boyunca (37 ° C,% 5 CO2), bir kuluçka makinesi içinde büyümesine izin. Transfeksiyon için en uygun hücre yoğunluğu% 80 kaynaşma.
- Her bir için, (örneğin,., 2-adrenerjik reseptörü β SNAP-etiketli) Arzu edilen plazmid DNA 2 ug seyreltilmiş ve 500 ul Optimem ortamı ihtiva eden iki ayrı tüplerde 6 ul Lipofektamin 2000. 5 dakika boyunca oda sıcaklığında inkübe edin.
- Tek bir tüp içine adım 1.3.4 arasındaki çözüm birleştirin ve bir transfeksiyon karışım elde etmek için karıştırılır. 20 dakika boyunca, oda sıcaklığında, transfeksiyon karışımı inkübe edin.
- İnkübasyonun (1.3.5) 'sırasında, CHO hücreleri almak ve önceden ısıtılmış (37 ° C) iki kez PBS ile yıkayın. 1 ml /% 10 FBS ile desteklenmiş fenol kırmızısı içermeyen DMEM/F12 ortamında oyuk ama hiçbir antibiyotik ile PBS değiştirin.
- Tüm transfekte eklemeKarışım, yavaşça iyon de her adım 1.3.5 damla damla dan (1 mi), ve tam karışmasını sağlamak için ileri ve geri plakayı sallayın.
- % 5 CO2 içinde, 37 ° C'de 2-4 saat süreyle inkübe edin ve bir sonraki adım için daha sonra hemen devam Not:. Transfeksiyon Bu koşullar için uygun olan tek reseptör yoğunlukları <0.45 partikül / 2 um, elde etmek için optimize edilmiş molekül görüntüleme. Farklı hücreler, yapıları veya reaktifler kullanırken ayarlamaları gerekli olabilir.
- Protein etiketleme
- 1 uM'lik nihai konsantrasyon elde etmek üzere,% 10 FBS ile takviye edilmiş 1 ml DMEM/F12 ortamı içinde fluorofor BG stok çözeltisinden 1 ul seyreltin. Inkübatör transfekte edilmiş hücrelerin almak ve önceden ısıtılmış (37 ° C) iki kez PBS ile yıkayın. 1 uM fluorofor BG çözeltisi, 1 ml PBS ile değiştirin ve bir kuluçka makinesi içinde 37 ° C,% 5 CO2 'de 20 dakika boyunca inkübe edin.
- İnkübasyondan sonra, hücreler üç yıkama% 10 FBS ile desteklenmiş DMEM/F12 ortamı ile, bir kez, her seferinde 37 ° C de 5 dakika inkübasyon ile takip Cımbız ile (etiketli hücreler) bir lamel alın ve bir görüntüleme odasına yerleştirin.
- 300 ul görüntüleme tamponu ile iki kere yıkayın. Taze görüntüleme tampon 300 ul ekleyin ve görüntüleme (Part 2) hemen geçin.
2.. Image Acquisition
NOT: toplam iç yansıma floresan bir yağ daldırma yüksek sayısal açıklık objektif (. Örneğin, 100x magnification/1.46 sayısal diyafram), uygun lazerler (örn., 405 nm, 488 nm, 561 nm ve 645 ile donatılmış (TIRF) mikroskop kullanın nm diyod lazerleri), bir elektron çarparak şarj akuplaj düzenli (EMCCD) kamera, bir kuluçka makinesi ve bir floresan moleküller görselleştirmek için bir sıcaklık kontrolü.
- İstenilen mikroskop parametreleri, yani ayarlayın., Lazer çizgi, TIRF açısı (bu parametre İçeri nüfuz kontrolfani alan tion derinliği), pozlama süresi, kare hızı ve film başına 10 görüntü sayısı. Sıcaklık sürükleniyor ve nem yoğunlaşmasını önlemek için her zaman ısıtıcı / inkübatör ve sıcaklık kontrol altında tutun.
- Mikroskop 100X objektif daldırma bir damla yağ koyun. Mikroskop numune tutucu üzerine etiketli hücreleri ile görüntüleme odasına yerleştirin ve aydınlık aydınlatma kullanarak odak hücreleri getirmek.
- TIRF aydınlatma geçin. Ama aynı zamanda da arzu edilen bir hücre için aramaya photobleaching en aza indirmek izin vermek için mümkün olduğu kadar düşük bir lazer gücü tutun.
- İstediğiniz hücreyi seçin ve ince odak ayarı. Tek Flüoroforlann görselleştirme sağlayan bir seviyeye lazer gücünü ayarlayın. Görüntü dizisi kazanmak ve. Tiff gibi ham görüntü sırası dosyasını kaydedin.
3.. Kalibrasyon (Cam ve moleküllü / dimerik Reseptör Kontroller Tek Flüoroforlar)
- Her kalibrasyon sampl birleştirinGörüntüleme odası içinde 1.2 'de tarif edildiği gibi hazırlanmıştır e. Mikroskop her örnek koyun ve tek aşamalı bir NOT ağartma iyi ayrılmış kırınım sınırlı noktalar içeren örnek tercih:. Bu lekeler flüoresan boya tek moleküller temsil eder.
- Adım 2 de tarif edildiği gibi TIRF görüntü dizilerini elde edin Önemli:. Aynı görüntüleme parametreleri kalibrasyon için olanlar dahil olmak üzere tüm deneyler için kullanılmalıdır.
- 4.2 - algılama ve 4.1 ayrıntılı olarak izleme analizi yapın. 4.2.6 tarif edildiği gibi her bir parçacık yoğunluğunu ekstrakte edin. Bu verilerden, ortalama (μ) ve tek florofor yoğunluğunun standart sapması (σ) hesaplar.
- İsteğe bağlı: tek moleküllü bir hücre yüzeyi reseptörüne (. Örneğin, CD86) ile transfekte edilmiş hücreler üzerinde aynı analizi, N-terminal olarak SNAP 10 arasında bir ya da iki kopya ile etiketlendi ve fluorofor BG türevi ile etiketlenir. FolloCam üzerinde tek bir florofor için yukarıda tarif edilen prosedüre w. Calebiro, D. ve diğerleri de tarif edildiği gibi etiketleme verimliliği tahmin. 10
4.. Görüntü Analizi
- Görüntü dizisi hazırlama
- Görüntü kırpma bir görüntü işleme yazılımı (örneğin., ImageJ) kullanın.
- Ayrı olarak tek kare kaydedin. Tiff görüntüleri yeni bir klasöre, her görüntünün kare sayısı üzerinde göstermektedir.
- Bir hücrenin konturu boyunca ilgi (ROI) bir bölge çizim ve ImageJ ölçü aleti veya başka bir yazılıma benzer bir aracı kullanarak hücre yüzey alanını ölçün. Hücre yüzeyi alanı ile filmin başında parçacıkların toplam sayısına bölünmesiyle parçacık yoğunluğunu hesaplamak için bu değeri kullanın.
- Parçacık algılama ve izleme
NOT: Matlab çalışma, bu tür u-track 13 gibi ticari olmayan yazılımı kullanınotomatik olarak algılar ve tek reseptör partikülleri izlemek için ortam.
NOT: U-track algoritması çoklu hipotez izleme yaklaşıma dayanmaktadır. Bu yaklaşım, bir çerçeve içinde verilen bir parçacık, bir sonraki çerçeve içinde verilen bir parçacığa karşılık görünür, kaybolur ya da / diğer parçacıklardan / ile böler birleşir bireysel olasılıklar atanır maliyet matrisleri, bina çerçeveler arasında parçacıkları bağlar. Global olarak masrafları en aza indirir Çözelti, yani. En yüksek olasılık ile bir, son olarak seçilir. Bu aynı zamanda bir geçici yok parçacık, florofor yanıp sönen neden olduğu tipik fenomen izleme sağlar. U-track (2.1.0) en son sürümü bu analizlerin yürütülmesini kolaylaştırmak grafik kullanıcı arayüzü vardır.- Film seçimi arayüzünü açmak için Matlab komut isteminden "movieSelectorGUI". Bir oluşturmak için yönergeleri izleyinÖnceden kaydedilen görüntülerin ayrı itibaren yeni bir film veritabanı (4.1.2 bakınız).
- Parçacık tespiti ve takibi için gerekli piksel boyutunu nm, saniye zaman aralığı, sayısal açıklık, kamera bit derinliği ve floroforun emisyon dalga boyu, sağlayın. Film veritabanına kaydetmek.
- Film seçimi arayüzü, nesnelerin türü olarak "tek-parçacıklar" seçerek, analizi çalıştırın. Parçacık algılama ve izleme için kullanılan parametreler tanımlanabilir yeni bir pencere açılacaktır. Varsayılan parametreleri ile başlayın. . Algılama ve / veya izleme kalitesi İsteğe bağlı (örneğin, bazı parçacıklar tespit veya parça parçalanmış olan değildir) tatmin edici değilse, daha sonra, bu parametreleri ayarlamak: izleme ayarları altında, saklamak "matris formatında İhracat izleme sonuçlarını" kontrol "trackedFeaturedInfo adlı tek bir matris (alanına koordinatlar ve tüm parçacıkların genlikleri"). Bu parametrelerin ayrıntılı bilgi için, u-parça belgelerine bakın.
- Algılama algoritması çalıştırın. Bu algoritma otomatik olarak her kırınım-sınırlı yerinde yerel yoğunluk maksimanın etrafında mikroskop nokta dağılım fonksiyonu eşit standart sapma ile iki boyutlu bir Gauss fonksiyonu takarak (yani., Tek reseptörler / reseptör kompleksleri) arka planı üzerinde yerini ve yoğunluğunu belirlemek . Daha sonra, izleme algoritması çalıştırın. A. Mat dosyası analizlerin sonuçlarını saklayın.
- Parçaları görselleştirmek ve algılama ve izleme kalitesini kontrol etmek için u-parça paketin içerdiği "movieViewer" rutin, veya benzer özel olanları kullanın.
- Her karede izlenen parçacıkların konumunu ve genliği (yani., Yoğunluk) görmek için. Mat dosyasını açın. Adım 4.2.4 üretilen veriler tracksFinal AR'nin tracksCoordAmpCG alan içinde bulundurulurray ve / veya trackedFeaturedInfo içinde. Parçacıkların toplam sayısından 4.1.3 ölçülen hücre yüzey alanı ile bu değer ikiye bölen parçacık yoğunluğunu hesaplamak tespit edildi.
- İsteğe bağlı: parçacık reseptör parçacıkların hareketini analiz etmek için (4.2.6 bakınız) zamanla koordinatları kullanın. Matlab ve benzer yazılımı kullanarak ortalama kare yer değiştirmeleri (MSD) ve difüzyon katsayıları (D) hesaplayın. Her parçacık ve her zaman aralığı (Δ t) için düşünülen, aşağıdaki formül kullanılarak ortalama kare yer değiştirmesini (MSD) hesaplamak:
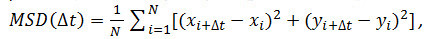
Δ t dilimlerinde zaman aralığı olduğu yerde, N analiz adımların sayısını, x ve y, parçacığın x ve y indeksi ile gösterilen karede koordinatları bulunmaktadır. Doğrusal ilişkileri: belirli bir parçacığın hareket türünü değerlendirmek için zaman alanı üzerinde MSD kullanınserbest difüzyon (yani., Brown hareketi), olumlu bir eğrilik gösterir (yani., eğri bir parabol gibi görünüyor) yönettiği hareketi göstermektedir, negatif eğrilik sınırlı hareket 14 göstergesidir. Serbestçe difüzyon parçacık halinde, aşağıdaki denklemle elde edilen MSD verileri uydurularak her parçacığın difüzyon katsayısı (D) hesaplayınız: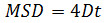
- Gaussian montaj yöntemi ile partikül boyutunun hesaplanması
Not: kalibrasyon numuneleri (cam ve / veya floresan etiketli monomerik reseptörleri üzerinde bir flüorofor) yoğunluğu dağılımı bilindiği zaman, reseptör komplekslerinin boyutunu belirlemek için bir görüntü dizisinin başında tanecik yoğunluklarının dağılımı üzerinde karışık bir Gauss uyum gerçekleştirmek (yani., parçacık başına reseptörlerin sayısı) 10. Matlab veya s kullanarak bu analizleri yapmakimilar yazılım.- Yoğunluğundaki ilk değişiklik (nedeniyle, ışıkla ağartma çoğu durumda bir düşüş) oluşmadan önce üst kısmın çerçeveye göre birinci çerçeveden parçacığın yoğunluğu ortalaması alınarak her bir parçacık yoğunluğunu hesaplar.
- Aşağıdaki denkleme göre karma Gauss montaj yapın:
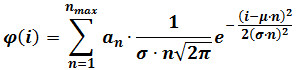
φ (i) parçacıkları i yoğunluğu olan frekans, n bileşen sayısını, n α bileşen n yüksekliğine katkıda bulunan bir parametre olduğu, μ ve σ ortalama ve referans bir florofor yoğunluğunun standart sapma . (Adım 3'te tarif edildiği gibi hesaplanmıştır) Not: t belirlemebir F-testi ile değerlendirildiği gibi o kademeli bir bileşenin ilave edilmesine kadar n maksimum arttırarak her bir görüntü dizisi için bileşenler (n max) en yüksek sayısı artık, istatistiksel olarak daha iyi uygun üretir. - İsteğe bağlı: (. Örneğin, 400 çerçeve dizisinin son 60 kare) filmin son kare elde yoğunluk dağılımı üzerinde bir karma Gauss uyum gerçekleştirin. Bu parametreler için rafine tahminleri sağlamak bu uydurma sonra elde edilen değerler, ve tekrar adım 4.3.2 ile μ ve σ değiştirin.
- Karışık Gauss uyum her bir bileşeninin, eğri (AUC) altındaki alanı hesaplanır. Farklı boyut tüm dağıtım EAA ile her bir bileşenin AUC değerine bölünmesiyle (örneğin, monomer, dimer, trimer, vb) reseptör parçacıkların görece bolluk hesaplayın.
- İsteğe bağlı: farklı hücreler ve farklı partikül büyüklüğü dağılımı parçacık yoğunluğu 10 ile ilişkilidir araziler oluşturmak için (4.2.6 açıklandığı gibi hesaplanan) karşılık gelen tanecik yoğunluklarının ikinci kullanımlar verileri.
- Aşaması uygun bir yöntem ile partikül boyutunun hesaplanması
NOT: reseptör komplekslerinin 10 boyutunu belirlemek için alternatif bir yöntem olarak bir adım oturan analizini kullanın. N florofor içeren, böylece parçacıklar kademeli ağartıcı n adımlarla bir yoğunluk profili üreten beklenmektedir - Bu analiz için temel olan anlık kaybolması tek bir florofor sonuç ışık kaynaklı yıkımı (ışıkla ağartma) olmasıdır.- U-parça veya benzer algılama / izleme yazılımı (4.2.6 bakınız) tarafından oluşturulan. Mat dosyasından her parçacığın yoğunluğu profillerini ayıklayın.
- Bu tür bir yer olarak, adım uydurma algoritması kullanarakref. 10, her bir parçacık için ağartma basamaklarının sayısını saymak için.
- İsteğe bağlı (4.3 'e bakınız), farklı boyutta reseptör parçacıkların görece bolluğu gösteren dağılımları oluşturmak ve daha önce karışık Gauss fitingin sonuçları için tarif edildiği gibi parçacık yoğunluğu ile ilişkili sonuçları kullanın.
Sonuçlar
Açıklanan protokol, farklı zar proteinlerinin çeşitli uygulanabilir. Bir örnek olarak, β-2 adrenerjik ve GABA B reseptörleri ile elde edilen sonuçlar Örnek 10, rapor edilmiştir. Tek moleküllerin floresan sinyaller zayıf olduğu için, eşiğe minimizasyonu başarılı sonuçlar için ilk önemli adımdır. Bu nedenle, geniş bir temizlenmiş lamelleri (Şekil 2A) kullanımı yanı sıra örnek otoflüoresanı (örn.., Fenol kırmızısız ortamını...
Tartışmalar
Açıklanan protokol, tek molekül düzeyinde mekansal, hareket ve hücre yüzeyi reseptör komplekslerinin boyut analizi sağlar. Floresan proteinlerin kullanımı ile karşılaştırıldığında, daha parlak ve daha ışığa karşı olan küçük organik florofor ile etiketleme, tek reseptör parçacıkların genişletilmiş görselleştirme işlemini ifa etmesi avantajına sahiptir. Son derece düşük ekspresyon düzeyi elde edildiği (<0.45 reseptör parçacıkları / um 2), reseptörler ve diğer z...
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
The development of this protocol was supported by grants from the European Research Council (Advanced Grant TOPAS to M.J.L.) and the Deutsche Forschungsgemeinschaft (Grants CA 1014/1-1 to D.C. and SFB487 to M.J.L.). T.S. was supported by the Alexander von Humboldt Foundation.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Chloroform | AppliChem GmbH | A1585 | CAUTION: toxic and irritating substance as well as a possible carcinogen |
| NaOH | Sigma-Aldrich | S8045 | CAUTION: strong base and highly corrosive reagent |
| Absolute ethanol | Sigma-Aldrich | 32205 | |
| Glass coverslip | Marienfeld-Superior | 111640 | 24 mm diameter, 0.13-0.16 mm thickness |
| 0.2 mm sterile filter | Sarstedt | 83.1826.001 | |
| CHO cells | ATCC, USA | ATCC CCL-61 | Chinese hamster ovary cell line |
| 6-well cell culture plate | Nunc | 140675 | |
| DMEM/F-12 medium | GIBCO, Life Technologies | 11039-021 | Phenol-red free medium |
| Fetal bovine serum | Biochrom | S 0115 | |
| Penicillin - streptomycin | Pan Biotech GmbH | P06-07 100 | |
| Trypsin-EDTA | Pan Biotech GmbH | P10-23100 | |
| Lipofectamine 2000 | Invitrogen, Life Technologies | 11668-019 | |
| Opti-MEM I Reduced Serum Medium | Invitrogen, Life Technologies | 31985-047 | |
| Fluorophore-conjugated benzylguanine | New England BioLabs | S9136S | SNAP-Surface Alexa Fluor 647. Make a 1 mM stock solution in DMSO. Store at -20°C. |
| DMSO | AppliChem GmbH | A1584 | |
| Imaging buffer: | 137 mM NaCl, 5.4 mM KCl, 2 mM CaCl2, 1 mM MgCl2, 10 mM HEPES, pH 7.3, sterile-filtered | ||
| NaCl | AppliChem GmbH | A1371 | |
| KCl | AppliChem GmbH | A3582 | |
| CaCl2 | AppliChem GmbH | A2303 | |
| MgCl2 | AppliChem GmbH | A3618 | |
| HEPES | AppliChem GmbH | A3724 | |
| Imaging chamber | Molecular Probes, Life Technologies | A-7816 | Attofluor Cell Chamber, for microscopy |
| TIRF-M | Leica | Model: DMI6000B | |
| TIRF objective | Leica | 11 506 249 | HCX PL Apo 100x/1.46 Oil CORR |
| EM-CCD camera | Roper Scientific | Photometrics Cascade 512B | |
| Temperature controller | Pecon | Tempcontrol 37-2 digital | |
| ImageJ software | NIH, USA | http://rsbweb.nih.gov/ij | |
| u-track software | Laboratory for computational cell biology, Dept. of Cell Biology, Harvard Medical School, USA | http://lccb.hms.harvard.edu/software.html | |
| Matlab software | The MathWorks, USA |
Referanslar
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nat Rev Mol Cell Biol. 3, 639-650 (2002).
- Angers, S., Salahpour, A., Bouvier, M. Dimerization: an emerging concept for G protein-coupled receptor ontogeny and function. Annu Rev Pharmacol Toxicol. 42, 409-435 (2002).
- Ferré, S., et al. Building a new conceptual framework for receptor heteromers. Nat Chem Biol. 5, 131-134 (2009).
- Milligan, G. G. protein-coupled receptor hetero-dimerization: contribution to pharmacology and function. Br J Pharmacol. 158, 5-14 (2009).
- Lohse, M. J. Dimerization in GPCR mobility and signaling. Curr Opin Pharmacol. 10, 53-58 (2010).
- Ulbrich, M. H., Isacoff, E. Y. Subunit counting in membrane-bound proteins. Nat Methods. 4, 319-321 (2007).
- Triller, A., Choquet, D. New concepts in synaptic biology derived from single-molecule imaging. Neuron. 59, 359-374 (2008).
- Hern, J. A., et al. Formation and dissociation of M1 muscarinic receptor dimers seen by total internal reflection fluorescence imaging of single molecules. Proc Natl Acad Sci U S A. 107, 2693-2698 (2010).
- Kasai, R. S., et al. Full characterization of GPCR monomer-dimer dynamic equilibrium by single molecule imaging. J Cell Biol. 192, 463-480 (2011).
- Calebiro, D., et al. Single-molecule analysis of fluorescently labeled G-protein-coupled receptors reveals complexes with distinct dynamics and organization. Proc Natl Acad Sci U S A. 110, 743-748 (2013).
- Keppler, A., et al. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nat Biotechnol. 21, 86-89 (2003).
- Gautier, A., et al. An engineered protein tag for multiprotein labeling in living cells. Chem Biol. 15, 128-136 (2008).
- Jaqaman, K., et al. Robust single-particle tracking in live-cell time-lapse sequences. Nat Methods. 5, 695-702 (2008).
- Saxton, M. J., Jacobson, K. Single-particle tracking: applications to membrane dynamics. Annu Rev Biophys Biomol Struct. 26, 373-399 (1997).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır