A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مضان استنادا تمديد التمهيدي تقنية لتحديد ما الترانسكربتي المنطلقات ومواقع الشق من RNases
In This Article
Summary
We here describe a fluorescence based primer extension method to determine transcriptional starting points from bacterial transcripts and RNA processing in vivo using an automated gel sequencer.
Abstract
مضان مقرها تمديد التمهيدي (FPE) هي طريقة الجزيئية لتحديد نقاط الانطلاق النسخي أو مواقع تصنيع جزيئات الحمض النووي الريبي. ويتحقق هذا عن طريق النسخ العكسي من الحمض النووي الريبي من الفائدة باستخدام بادئات fluorescently المسمى محددة والتحليل اللاحق للشظايا [كدنا الناجم عن تغيير طبيعة هلام بولي أكريلاميد الكهربائي. في الوقت نفسه، يتم تشغيل رد فعل التسلسل التقليدي سانجر على جل لرسم نهايات شظايا [كدنا لقواعد المناظرة الدقيقة الخاصة بهم. وعلى النقيض من 5'-RACE (السريع التضخيم من [كدنا ينتهي)، حيث يجب استنساخ المنتج ومرشحين متعددين التسلسل، فإن الجزء الأكبر من شظايا [كدنا] الناتجة عن تمديد التمهيدي يمكن الكشف في وقت واحد في واحدة المدى هلام. وبالإضافة إلى ذلك، فإن الإجراء بأكمله (من النسخ العكسي إلى التحليل النهائي لنتائج) يمكن أن تكتمل في يوم عمل واحد. باستخدام بادئات fluorescently المسمى، واستخدام النظائر المشعة الخطرة وصفت الكواشفويمكن تجنب وخفض أوقات المعالجة كما يمكن الكشف عن المنتجات أثناء إجراء الكهربائي.
في البروتوكول التالي، نحن تصف طريقة تمديد التمهيدي الفلورسنت في الجسم الحي موثوق وسريع لكشف نهايات 5 'من الرنا للاستدلال النسخي نقطة البداية وتجهيز مواقع RNA (على سبيل المثال، من خلال مكونات النظام السم الترياق) في س. الذهبية، E. كولاي وغيرها من البكتيريا.
Introduction
تمديد التمهيدي 1 هي طريقة الجزيئية لتحديد الغايات 5 'من جزيئات RNA محددة تصل إلى قرار قاعدة واحدة. ميزة لأساليب أخرى مثل 5'-RACE (التضخيم السريع ل[كدنا ينتهي) هي الفترة الزمنية السريعة والقدرة على تحليل بسهولة مزيج من أطوال مختلفة من جزيئات الحمض النووي الريبي.
يعمل هذا الأسلوب بإخضاع جزيئات الحمض النووي الريبي لعكس ردود الفعل النسخ باستخدام بادئات محددة الفلورسنت، وتوليد شظايا [كدنا بعض الأطوال. وتدار هذه الجزيئات [كدنا] جنبا إلى جنب مع سانجر تسلسل ردود الفعل التقليدية 2 على تغيير طبيعة المواد الهلامية بولي أكريلاميد ويمكن الكشف عنها بواسطة مضان من جراء استخدام بادئات fluorescently المسمى. ثم يتم تقييم أطوال شظايا [كدنا] من خلال المقارنة لسلم التسلسل، والسماح للرسم الخرائط من 'بنتيجة 5 RNA.
تقليديا، يتم استخدام ردود الفعل تمديد التمهيدي بالاشتراكمع النظائر المشعة للكشف عن جزيئات [كدنا على أفلام الأشعة السينية. بسبب المخاطر الصحية، وقضايا التخلص من النفايات وسهولة التعامل معها والبروتوكولات تستخدم أحدث مضان للكشف عن تمديد التمهيدي مع التعاقب الآلي، وإن كان حساسيتها أقل قليلا. باستخدام بادئات fluorescently المسمى، ويمكن حذف تكرار الإجراء الإذاعة وضع العلامات، والاشعال الفلورسنت مستقرة لفترة طويلة (أكثر من سنة في أيدينا).
طريقة وصفنا هنا يستخدم هلام المنظم الآلي، ولكن مع تعديلات طفيفة، التعاقب الشعرية يمكن أن تستخدم أيضا لفصل [كدنا] والكشف عن 3. طبيعة موازية لتحليل هلام تجعل من الممكن للكشف حتى كمية صغيرة من الانقسام RNA أو المعالجة. ميزة أخرى هي عالية الدقة لهذه الطريقة، والانقسام الطرفي أو تجهيز قاعدة واحدة حتى يمكن الكشف عنها.
في ما يتعلق بالكشف عن انشقاق RNA أو المعالجة، رypically نوعين مختلفين من ملحقات التمهيدي متميزة. في حالة واحدة، ويتم علاج الأنزيمية في المختبر باستخدام انزيم RNA المنقى والمنقى، بينما في الحالة الأخرى، ويتم تجهيز في الجسم الحي ويتم تنقيته من RNA الناتجة عن ذلك. في كلتا الحالتين تتعرض RNA لتنفيذ تمديد التمهيدي في المختبر، ومع ذلك، اعتمادا على مصدر من الحمض النووي الريبي، وطريقة إما يسمى في المختبر أو في الجسم الحي تمديد التمهيدي. في بروتوكول نقدم هنا، ونحن نركز فقط على المجراة التمهيدي التمديد، بسبب سهولة الاستخدام (لا يوجد تنقية البروتينات الضرورية) وإمكانية تحديد نقاط انطلاق النسخي والمعالجة في نفس الوقت. ومع ذلك، في المختبر ملحقات التمهيدي من حيث المبدأ اقامة بنفس الطريقة وهذا البروتوكول يمكن أن تكون بمثابة نقطة الانطلاق.
طريقة موضح هنا يمكن تطبيقها على العديد من الأنواع البكتيرية طالما أنها قابلة للارتفاعالنقاء وعالية الغلة إعداد الأحماض النووية.
البحث في مختبرنا يركز على نطاق تنظيمي نظم السامة الترياق (TA-) 4،5، وهو الحقل الذي يتم استخدام طريقة تمديد التمهيدي على نطاق واسع. TA-النظم هي عناصر جينية صغيرة موجودة في الجينوم بدائية النواة التي تتكون من البروتين السام مستقر ونشط التطور الطبيعي ومعظمها غير مستقر البروتين أو RNA الترياق الذي يصد سمية 6،7. النشاط السم يمارس أحيانا عن طريق تثبيط تكرار، تركيب جدار الخلية أو آليات أخرى، لكن في معظم الأحيان حسب النشاط ريبونوكلياز 8،9. عادة، يتم تحديد ريبونوكلياز خصوصية عن طريق إجراء اختبارات مختلفة، واحدة منها هي طريقة تمديد التمهيدي. ردود الفعل تمديد التمهيدي هي مناسبة تماما لهذا التطبيق، وخليط من شظايا طول المشقوق وكاملة يمكن تحليلها في وقت واحد لتحديد من 5 'تنتهي. باستخدام مزيج من في المختبر وفي الجسم الحي ملحقات التمهيدي، والسم محدد ريبونوكلياز الانقسام، على سبيل المثال، خصوصية التسلسل يمكن تحديد 10-13.

الشكل 1. نظرة عامة على إجراء تمديد التمهيدي. يتم تحضين الثقافات البكتيرية وعلاجها وفقا لاحتياجات التجريبية. يتم استخراج الحمض النووي الريبي مجموع من الخلايا، وتعامل مع الدناز أنا لإزالة آثار الحمض النووي وتعرض لردة فعل عكس النسخ باستخدام بادئات محددة الهدف الحمض النووي الفلورسنت ذات العوائد [كدنا]. يتم استخراج الحمض النووي الجيني أو البلازميدات وتستخدم بعد ذلك لالفلورسنت ردود الفعل سانجر تسلسل للمقارنة مع حجم شظايا [كدنا]. تدار المنتجات تمديد التمهيدي إلى جانب المنتجات التسلسل سانجر على تغيير طبيعة هلام بولي أكريلاميد اليوريا وتحليلها مع الليزر الآلي والمجهر. قاعدة التسلسل الذي يصطف مع الفرقة [كدنا] هي لاالحادي قاعدة 5 "نهاية [كدنا] (السهم الأزرق). مزيد من المعلومات في Fekete، وآخرون. 3 الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
لمحة عامة عن الإجراء بأكمله تمديد التمهيدي يمكن العثور عليها في الشكل 1. باختصار، الخلايا البكتيرية هي مثقف، تحصد، بيليه الخلايا هي lysed والحمض النووي الريبي المستخرج. ثم يتم التعامل مع RNA المنقى مع الدناز أنا لإزالة آثار لجزيئات الحمض النووي التي يمكن أن تكون بمثابة نماذج للالناسخ العكسي. تضاف الاشعال الفلورسنت محددة إلى RNA، المهجنة إلى المنطقة في وقت لاحق من الاهتمام وعكس كتب، مما أدى إلى واحد DNA مكملة الذين تقطعت بهم السبل ([كدنا]). يتم إنشاء سلم التسلسل بواسطة التسلسل التقليدي سانجر استخدام بادئات الفلورسنت وفصلها على تغيير طبيعة هلام بولي أكريلاميد جانب من شظايا تمديد التمهيدي [كدنا]. الناتجويتم تحليل هلام بمقارنة العصابات الفلورسنت، مما يسمح بتحديد الغايات 5 'من الفائدة. نقطة الانطلاق النسخي ومواقع المعالجة ثم يتم تقييمها بشكل فردي عن طريق مقارنات تسلسل.
Protocol
1. عالية الإنتاجية التحضير RNA
- عزل الحمض النووي الريبي
وهناك حاجة إلى تركيزات عالية من الحمض النووي الريبي مجموع للتفاعل تمديد التمهيدي: ملاحظة. مجموعات عمود الدوران عادة لا تسفر عن كمية من الحمض النووي الريبي الحاجة (~ 5-16 ميكروغرام في حجم 5 ميكرولتر). ولتنقية باستخدام الحمض guanidinium طريقة استخراج ثيوسيانات-الفينول كلوروفورم يوصى، المبينة أدناه.
ملاحظة: الفينول هو مادة مسرطنة، السامة والمسببة للتآكل. يرجى قراءة ورقة بيانات سلامة المواد واستخدامها تحت غطاء الدخان مع الحماية المناسبة!- تنمو أو علاج الخلايا البكتيرية (بكتريا المكورة العنقودية البرتقالية أو كولاي في هذا المثال) على النحو المرغوب فيه والحصاد قبل 10 دقيقة الطرد المركزي في 4600 × ز و 4 درجات مئوية. ملاحظة: عادة نحن حصاد OD إجمالي 600 من 20 - 70. الكريات خلية يمكن تخزينها لعدة أسابيع في -20 درجة مئوية.
- resuspend الكرية خلية في 1 مل من حمض guanidinium حل ثيوسيانات-الفينول كلوروفورم ونقل إلى2 مل المسمار كوب يحتوي على 0.5 مل من 0.1 ملم الخرز الزجاجي الزركونيوم / السيليكا.
- ليز الخلايا ثلاث مرات في الخافق الإعدادية سريع / حبة في 6.5 متر / ثانية لمدة 30 ثانية لثلاث جولات، تبريد العينات على الجليد لمدة 5 دقائق بعد كل شوط. ملاحظة: يمكن تخزين عينة متجانسة في -80 درجة مئوية لعدة أسابيع.
- احتضان المحللة لمدة 5 دقائق على RT ثم إضافة 200 ميكرولتر من الكلوروفورم.
- هزة بقوة أو دوامة العينة لمدة 30 ثانية لاستخراج الحمض النووي الريبي.
- في احتضان RT لمدة 3 دقائق ثم الطرد المركزي لمدة 15 دقيقة في 13،000 - 15،000 × ز و 4 درجات مئوية. ملاحظة: يتم فصل المذيبات العضوية إلى مرحلة أدنى (وردي، ويحتوي على البروتينات)، والطور البيني (أبيض، ويحتوي على الحمض النووي)، والمرحلة المائية العليا (واضحة، ويحتوي على RNA).
ملاحظة: من هذه الخطوة على استخدام الكواشف فقط ريبونوكلياز حرة والأدوات البلاستيكية! - إعداد جديدة خالية من ريبونوكلياز 1.5 مل أنابيب رد فعل، والتسمية بشكل مناسب وإضافة حوالي 500 ميكرولتر من 100٪ الأيزوبروبانول ريبونوكلياز مجانا كل (استخدم تقريبا نفس فوكما لوم المرحلة المائية في الأنبوب السابق).
- عقد أنبوب بزاوية ونقل المرحلة المائية (حوالي 500 ميكرولتر) إلى أنابيب أعدت باستخدام ريبونوكلياز نصائح مجانية. لا تخل البيني.
- ترسيب الحمض النووي الريبي التي كتبها قلب عدة مرات واحتضان لمدة 10 دقيقة في RT.
- الطرد المركزي عينات لمدة 15 دقيقة عند 13000 - 15000 × ز و 4 درجات مئوية وإزالة طاف بواسطة pipetting أو الطموح (مضخة المياه النفاثة وزجاجة الرضاعة). لا تخل الأبيض بيليه RNA شفافة في القاع.
- إضافة 1 مل من 70-80٪ من الإيثانول ريبونوكلياز الحرة (لا الدوامة) لغسل. ملاحظة: RNA في الإيثانول يمكن تخزينها لعدة أسابيع في -20 درجة مئوية.
- أجهزة الطرد المركزي لمدة 5 دقائق في 7500 × ز و 4 درجات مئوية، وتجاهل طاف بواسطة pipetting أو يفضل الطموح.
- الهواء الجاف بيليه RNA لمدة 15 - 30 دقيقة تحت غطاء الدخان. لا overdry، قد يكون خلاف ذلك من الصعب أن تنحل الكريات.
- resuspend الكرية في 50 ميكرولتر من ريبونوكلياز خالية DDH 2 O أو عازلة تخزين الحمض النووي الريبي.
- قياس تركيز الحمض النووي الريبي مع microvolume الأشعة فوق البنفسجية فيس معمل أو كوفيت الكوارتز (ومضواء التقليدي)، والشروع في الدناز أنا الهضم.
- أنا الدناز الهضم من الحمض النووي الريبي لإزالة آثار الحمض النووي
ملاحظة: بما أن الحمض النووي قد يكون بمثابة القالب زائفة في رد فعل النسخ العكسي (تمديد التمهيدي)، ينبغي إزالته من العينة. وطرق مختلفة لإزالة الحمض النووي RNA من الحلول المتاحة والتي تعتمد عادة على الدناز الهضم. ويرد وهناك طريقة بسيطة لكنها فعالة وتكلفة فعالة لإزالة الحمض النووي أدناه.- حمام ماء سخن إلى 37 درجة مئوية.
- مزيج من المركبات المدرجة في الجدول 1 في أنبوب 1.5 مل التفاعل.
- احتضان الخليط لمدة 1 ساعة عند 37 درجة مئوية في حمام مائي، ثم الانتقال مباشرة إلى استخراج الفينول / الكلوروفورم. ملاحظة: لا ينصح تعطيل حرارة الدناز الأول، لأن ذلك قد تحط من الحمض النووي الريبي.
- استخراج الفينول / الكلوروفورم من الحمض النووي الريبي بعد الدناز أنا الهضم
ملاحظة: يجب تنقية RNA لإزالة النيوكليوتيدات الحرة، شظايا الحمض النووي ومكونات عازلة من الدناز أنا الهضم. استخراج الفينول / الكلوروفورم يسمح لاسترداد عالية وتركيز عينة الحمض النووي الريبي، وبالتالي هو مبين أدناه. ويمكن أيضا أن تستخدم أساليب أخرى لتنقية RNA، إذا كانت تلبية هذه المتطلبات.- تقسيم الدناز 500 ميكرولتر أنا الهضم المزيج إلى قسمين 250 عينات ميكرولتر في 2 مل أنابيب رد فعل.
- إضافة 1 الحجم (250 ميكرولتر) من الحمضية P / C / I الحل (في المياه المشبعة الفينول، والكلوروفورم وisopentanol، نسبة 25: 24: 1، ودرجة الحموضة 4،5-5).
ملاحظة: P / C / I الحل هو مادة مسرطنة، السامة والمسببة للتآكل. يرجى قراءة ورقة بيانات سلامة المواد واستخدامها تحت غطاء الدخان مع الحماية المناسبة! - بقوة دوامة أو مكان في منصة vortexing لل1 - 3 دقيقة.
- أجهزة الطرد المركزي لمدة 30 دقيقة عند 13000 - 15000 × ز و 4 درجات مئوية.
- جمع (مائي) المرحلة العليا ونقل إلى أنبوب جديد (250 ميكرولتر).
- إضافة 1/9 حجم (28 ميكرولتر) من 3 M خلات الصوديوم الهيدروجيني 5.2.
- إضافة 2.5-3 مجلدات من الإيثانول النقي (700 ميكرولتر).
- مزيج من قبل vortexing فترة وجيزة ومكان في -80 درجة مئوية لمدة 30 دقيقة أو في -20 درجة مئوية لمدة 2 - 3 في الساعة. إذا لزم الأمر، وتخزين الحمض النووي الريبي O / N في -20 درجة مئوية.
- الطرد المركزي لمدة 30 - 60 دقيقة عند 13000 - 15000 × ز و 4 درجات مئوية.
- إزالة طاف بواسطة pipetting أو الطموح.
- غسل بيليه بإضافة 1 مل من الايثانول 70٪ على بيليه. لا عينة دوامة.
- عينة الطرد المركزي لمدة 5 دقائق عند 13000 - 15000 × ز و 4 درجات مئوية.
- إزالة طاف بواسطة pipetting أو الطموح.
- بيليه الهواء الجاف تحت غطاء الدخان. تخزين بيليه في -20 درجة CO / N إذا لزم الأمر.
- حل بيليه في 30 ميكرولتر DEPC المعاملة H 2 O من قبل vortexing لمدة 2 دقيقة واستخدام هذا الحل على حل بيllet من الأنبوب الثاني المناظرة في العينة (30 ميكرولتر الحل لكل زوج استخراج واحد).
- قياس تركيز الحمض النووي الريبي، والتأكد من أنه يتجاوز 1 ميكروغرام / ميكرولتر لاستخدامها في تمديد التمهيدي للمن mRNAs أعرب المعدل.
- إذا لزم الأمر، وتخزين الحمض النووي الريبي في -20 درجة مئوية لعدة أسابيع إلى عدة أشهر.
2. تمديد التمهيدي رد الفعل
- التصميم التمهيدي
ملاحظة: عند تصميم الاشعال لتجربة التمديد التمهيدي، طاعة المبادئ التوجيهية العامة للPCR التصميم التمهيدي (انظر دليل يرافق الجل المنظم الآلي لمزيد من المعلومات والنقاش القسم في هذه الورقة).- على وجه التحديد، ضمان الاشعال (ط) لا تحتوي على سلاسل من القواعد، (ب) امتلاك G أو C في نهاية 3 '، (الثالث) لديهم متوازن GC: AT النسبة، (د) لديهم درجة الحرارة الصلب من حوالي 55-60 درجة مئوية و (ت) مأزق لا يقل عن 50 شركة بريتيش بتروليوم، أفضل 100 شركة بريتيش بتروليوم المصب في المنطقة ذات الاهتمام لتلقي صور واضحة.
- رد فعل تمديد التمهيدي
ملاحظة: إن رد فعل تمديد التمهيدي ([كدنا] التوليف) تتطلب كميات عالية من قالب الحمض النووي الريبي. إذا تم اختيار كميات من الحمض النووي الريبي المستخدمة إلى الأقل، قد يكون إشارة منخفضة للغاية للكشف! لذا نوصي تنقية الحمض النووي الريبي على النحو المبين أعلاه.
ملاحظة: تحذير: استخدام الكواشف ريبونوكلياز حرة والبلاستيك وير !!!- سخن الحرارية cycler إلى درجة حرارة 95 درجة مئوية وتنفيذ جميع الخطوات حضانة أخرى في cycler الحرارية لسهولة الاستخدام والتكاثر.
- مزيج من المركبات من الجدول 2 في أنبوب PCR لكل عينة الحمض النووي الريبي.
- تفسد العينات لمدة 1 دقيقة في 95 درجة مئوية.
- وضع أنابيب على الجليد والبرد لمدة 5 دقائق لهجن الرنا والاشعال.
- تعيين جهاز PCR إلى 47 درجة مئوية.
- في هذه الأثناء تحضير مزيج الرئيسي النسخ العكسي كما هو موضح في الجدول رقم 3.
- إضافة 4 ميكرولتر من النسخ العكسي مزيج الرئيسي لكل RNA تهجينعينة.
- احتضان الأنابيب لمدة 1 ساعة عند 47 درجة مئوية. ملاحظة: درجة الحرارة المثلى لAMV RT هي 42 درجة مئوية، ودرجات الحرارة المرتفعة ولكن تساعد على التغلب على الهياكل الثانوية من جزيئات الحمض النووي الريبي.
- وقف رد فعل عن طريق تسخين العينات إلى 95 درجة مئوية لمدة 2 دقيقة.
ملاحظة: الفورماميد غير قابلة للتآكل، سمية، ويمكن أن يكون ضارا لطفل لم يولد بعد. يرجى قراءة ورقة بيانات سلامة المواد، والتعامل مع الرعاية والحماية المناسبة ارتداء! - إضافة 6 ميكرولتر من الفورماميد صبغة تحميل (95٪ (V / V) الفورماميد منزوع الأيونات، 10 ملي EDTA، 0.05٪ (ث / ت) برموفينول الأزرق) ومخزن للO / N لمدة أسبوعين في -20 درجة مئوية في الظلام.
3. إعداد سلم التسلسل
ملاحظة: يتطلب رد فعل التسلسل سلم إما كميات معتدلة من البلازميدات أو كميات عالية من الحمض النووي الجيني. كلما أمكن ذلك، فمن المستحسن استخدام البلازميدات في تسلسل رد الفعل نظرا لسهولة العزلة وسيج عاليةنال شدة. في حالات أخرى، ونحن عادة استخدام أسلوب المعتمد من Marmur 5،14 لإعداد الحمض النووي الجيني من E. كولاي و S. الخلايا العنقودية الذهبية دون الحاجة لاستخدام الفينول. من حيث المبدأ أي طريقة يمكن أن ينتج كميات عالية ونقاء من الحمض النووي الجيني يمكن استخدامها.
- عزل الحمض النووي الجيني
- تنمو 10 مل من E. كولاي أو S. الخلايا العنقودية الذهبية O / N في LB، BM 5 أو TSB المتوسطة.
- حصاد الخلايا بواسطة الطرد المركزي لمدة 10 دقيقة في 4600 × ز في أنبوب الصقر 15 مل.
- بيليه معلق في 2 مل عازلة P1 كما وجدت في بعض مجموعات إعداد صغيرة (50 ملي تريس، حمض الهيدروكلوريك درجة الحموضة 8.0، 10 ملي EDTA، 100 ميكروغرام / مل ريبونوكلياز A).
- خلايا ليز ل45 - 60 دقيقة مع 20 - 40 ليزوستافين ميكرولتر (0.5 ملغ / مل، والتخزين عند درجة حرارة -20 درجة مئوية). ملاحظة: لE. خلايا القولونية والأنزيمية ما قبل المعالجة يمكن أن تكون إما حذف أو يستخدم الليزوزيم.
- إضافة 100 ميكرولتر من محلول مشبع SDS-(في الايثانول 45٪) إلى تعليق وincubatه لمدة 5 دقائق عند 37 درجة مئوية.
- إضافة 650 ميكرولتر 5 M NaClO 4 والخلايا لفترة وجيزة الدوامة.
ملاحظة: الكلوروفورم هو مادة مسرطنة محتملة. يرجى قراءة ورقة بيانات سلامة المواد واستخدامها تحت غطاء الدخان مع الحماية المناسبة !!! - إضافة 3 مل من الكلوروفورم / isopentanol (24: 1 نسبة) إلى الخليط ويهز لمدة 60 ثانية على الأقل. ملاحظة: يجب أن يتحول السائل إلى مستحلب أبيض متجانس.
- عينة الطرد المركزي لمدة 10 دقيقة في 4600 × ز وRT لفصل مراحل.
- نقل بعناية العليا (مائي) مرحلة واضحة لأنبوب جديد. إذا الحل هو عكر، كرر استخراج الكلوروفورم / isopentanol. قياس حجم محلول الحمض النووي وإعداد أنبوب جديد مع 2 مجلدات من الإيثانول (100٪).
- صب ببطء أو ماصة الحل الحمض النووي في أنبوب يحتوي على الايثانول. ملاحظة: الحمض النووي يجب أن يعجل شفافة كما، لفائف كثيفة على الجزء السفلي أو عندما المجففة تماما كمجموعة البيضاء العائمة.
- استرداد DNA استخدام السنانير المصنوعة من الزجاج الماصات باستور (الشكل 2) وتغسل كل عينة مرتين من قبل غمس في أنبوب الفردية من 1 مل من الايثانول 70٪.
- وضع السنانير تستقيم في رف والهواء الجاف بيليه لمدة 60 دقيقة. إذا لزم الأمر، وتخزين الحمض النووي المجففة لعدة أيام في RT.
- حل الحمض النووي عن طريق كسر قبالة DNA مغطاة السنانير الزجاج ووضع في أنبوب 2.0 مل رد فعل تحتوي على 100-500 ميكرولتر DDH 2 O. ضبط مستوى الصوت إلى تركيز الحمض النووي الأخير من 1000 - 1500 نانوغرام / ميكرولتر. رد فعل لتسلسل واحد، استخدم 10 - 18 ميكروغرام من الحمض النووي الجيني.

الرقم 2. التعليمات حول كيفية إنشاء قصبة الصيد DNA. امسك طرف ماصة باستير الزجاج في لهب الموقد بنسن. هذا يتسبب في الزجاج لبدء ذوبان بعد عدة ثوان، وخلق ربط صغير في رانه ينتهي. إزالة بسرعة من اللهب والسماح لتبرد لمدة 1 دقيقة.
- عزل البلازميدات
- إعداد البلازميدات باستخدام أدوات إعداد مصغرة القياسية وتذوب في شطف العازلة (10 ملي تريس، الكلور، ودرجة الحموضة 8.5). اعتمادا على حجم البلازميد، استخدم 100-500 نانوغرام البلازميد واحد سلم التسلسل.
- رد فعل سانجر تسلسل
ملاحظة: البحث أدناه بروتوكول بسيط يستخدم عدة التسلسل التمهيدي fluorescently المسمى مع 7-deaza-dGTP التي تعمل بشكل جيد لغرض تمديد التمهيدي. الرجوع إلى دليل عدة التسلسل للحصول على معلومات مفصلة. يرجى ملاحظة أن رد الفعل التسلسل يجب استخدام نفس التمهيدي كرد فعل تمديد التمهيدي لخلق منتجات من نفس الطول.- مزيج 12 ميكرولتر من الحمض النووي الجيني (~ 15 - 10 ميكروغرام) مع 1 ميكرولتر DMSO و 1 ميكرولتر التمهيدي fluorescently المسمى (2 بمول / ميكرولتر).
- لكل 1 ميكرولتر من أربعة يمزج رد فعل التسلسل (A، C، G أو T)، إضافة 3 ميكرولتر من الحمض النووي / DMSO / مزيج التمهيدي.
- وضع العينات في جهاز PCR، وتشغيل البرنامج PCR التالية: 95 درجة مئوية لمدة 2 دقيقة. 35 دورات من 95 درجة مئوية لمدة 20 ثانية، 54 درجة مئوية لمدة 20 ثانية، 70 درجة مئوية لمدة 30 ثانية؛ الحفاظ على 4 درجات مئوية إلى الأبد.
- بعد تشغيل، وإزالة عينات من الجهاز، إضافة 6 ميكرولتر من صبغة تحميل وتخزين على الجليد (قصيرة الأجل) أو في -20 درجة مئوية لعدة أيام إلى أسابيع.
4. إعداد جل وجهاز تشغيل
ملاحظة: معلومات تفصيلية عن كيفية تجميعها جهاز هلام التسلسل، ويتم إعداد جل وكيف يتم تشغيل هلام يمكن العثور عليها في بروتوكول الشركة المصنعة.
- التحضيرات
- إعداد 10X TBE كما هو مبين في الجدول رقم 4.
- يوم المدى هلام تحضير 1 لتر من العازلة 1X TBE مع عالى النقاء ده 2 O.
- إعداد 10٪ (ث / ت) وكالة الأنباء الجزائرية. ملاحظة: يمكن تخزينها في 200 مكل في -20 درجة مئوية لعدة أشهر، ولكن النشاط قد ينخفض مع مرور الوقت <./ لى>
- التجمع من هلام غرفة الصب
- تجنب الغبار والوبر بين ألواح الزجاج. أسطح العمل وبالتالي نظيفة تماما باستخدام مناديل مبللة.
- تنظيف زوج من ألواح الزجاج 25 سم باستخدام مناشف ورقية يمكن التخلص منها والماء المقطر على كلا الجانبين ثم الأيزوبروبانول للجانب الداخلي من ألواح الزجاج.
- وضع الفواصل 0.25 ملم على لوحة الزجاج الخلفي وأسفل لوحة زجاج حقق على رأس (الشكل 3).
- نعلق على القضبان هلام لكلا الجانبين من لوحات الزجاج مع نهاية حقق والطيارين دخول السكك الحديدية التي تواجه صعودا وتشديد المقابض طفيفة.
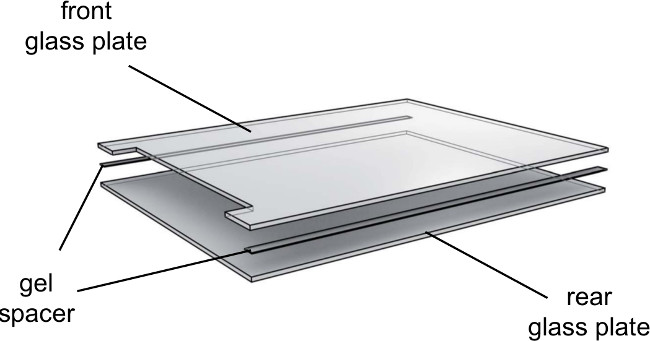
الشكل 3. عرض من هلام لوحات الزجاج الكهربائي انفجرت. وحات الزجاج ينبغي استخدام إتجاهي. رعاية لمواجهة الجانب الداخلي من ألواح الزجاج إلى الداخل والخارجيجنبا إلى الخارج.
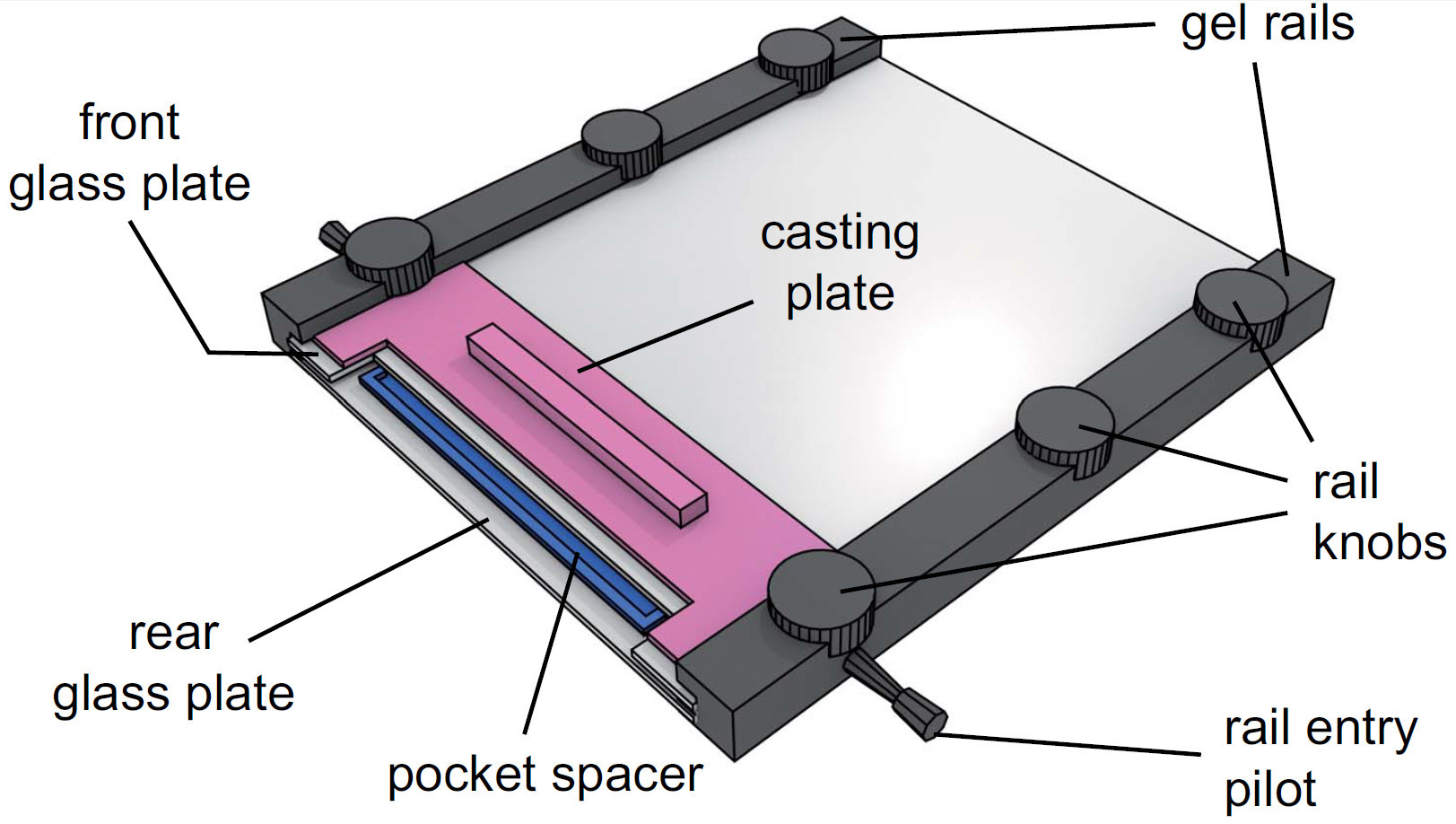
الرقم 4. عرض من جهاز هلام تجميعها. وبعد حقن محلول هلام، يتم وضع فاصل جيب في الحل بين ألواح الزجاج. ثم انزلق لوحة صب بين لوحة من الزجاج الأمامي والقضبان جل وتأمين طريق الربط المقابض السكك الحديدية.
- صب جل
ملاحظة: مادة الأكريلاميد غير بلمرة هو أعصاب! يرجى قراءة ورقة بيانات سلامة المواد واستخدامها مع الحماية المناسبة !!!- إضافة المركبات المدرجة في الجدول رقم 5 في كوب وتخلط باستخدام بقضيب ومحرك مغناطيسي.
- فورا بعد إضافة وكالة الأنباء الجزائرية وTEMED، تولي جل الحل في حقنة 50 مل ووضع مرشح 0.45 نانومتر على طرف.
- إما الاستمرار على الحافة العلوية للوحة من الزجاج مع يد واحدة أو وضع الشطائرح في صب جل الوقوف إلى إنشاء منحدر الزاوية 10-20 درجة.
- الاستغناء ببطء الحل هلام بين ألواح الزجاج بينما تتحرك باستمرار غيض حقنة من جانب واحد على الآخر، ووقف مرة واحدة الحل هلام يلبي نهاية الجزء السفلي.
- الانتقال إلى الجانب أو إزالة أي فقاعات تشكلت باستخدام هوك فقاعة.
- هل حرك جل جيب (0.25 مم) بين ألواح الزجاج في نهاية حقق، غمر في محلول هلام وإصلاح عن طريق ربط لوحة الصب.
- مسامير ربط السكك الحديدية العلوي بخفة (انظر الشكل رقم (4) لجهاز تجميعها بشكل كامل).
- السماح لمجموعة هلام 1 - 2 ساعة.
- إزالة لوحة الصب وجيب فاصل وتنظيف جيب من الملح وهلام المخلفات.
- شطف مع DDH 2 O ويمسح عن حل الزائد مع أوراق الأنسجة.
- تشغيل وتصور هلام
ملاحظة: يتم إخضاع المواد الهلامية التسلسل مباشرة الكهربائي في تصوير هلام، في حينتم الكشف عن مضان في وقت واحد بواسطة المجهر الليزر. وعلى النقيض من هلام الكهربائي التقليدي، حيث يتم تشغيل جل أولا ثم الملون وتصور، يتم إصلاح وحدة الكشف وبفحص العصابات في الوقت الحقيقي لأنها تمر الليزر. دون إجراء لبرنامج جمع البيانات ImagIR على OS / 2 ويرد، والتي يمكن اعتمادها لمزيد من الإصدارات الأخيرة. لمزيد من المعلومات راجع دليل المستخدم.- حرك حامل دبابة عازلة داخل القضبان الجل على لوحات الزجاج الأمامية وتشديد المقابض.
- وضع الجل في الخزان السفلي من هلام هلام تصوير الآلي على لوحة التدفئة وإصلاح طريق تحريك دخول الطيار السكك الحديدية في الأقواس الجهاز.
- ملء 1X عازلة TBE في غرف عازلة هلام الدنيا والعليا، إغلاق غرفة عازلة الدنيا وربط غرفة عازلة العليا للسلطة باستخدام سلك الطاقة.
- إذا كان موجودا، وتنظيف جيب هلام من الملح بقايا من قبل pipetting مرارا عازلة في الجيب.
- إغلاق أعلى خزان غرفة عازلة باستخدام غطاء رأس العازلة.
- إغلاق باب الجهاز والتبديل على تصوير وجهاز الكمبيوتر والبدء في برنامج جمع قاعدة بيانات ImagIR.
- إنشاء ملف مشروع جديد (ملف> جديد ...)، أدخل اسم ملف المشروع، وتحديد نطاقات الليزر المناسبة (700 أو 800 نانومتر) وثبت لOK.
- حدد خيارات> السيارات مكاسب ... من القائمة الصورة في الأعلى، انقر فوق تلقائي لبدء صناعة السيارات مكاسب قياس واستعرض الإعدادات بالنقر فوق موافق.
- تركيز الليزر عن طريق اختيار خيارات> التركيز ... من قائمة التحكم الماسح الضوئي، والنقر على زر السيارات وقبول الإعدادات بالنقر فوق موافق.
- كرر الإجراء لضبط السيارات مكاسب في المنطقة تركز حديثا.
- الإعداد لسيطرة الماسح الضوئي وفقا لهذه الإعدادات: 2000 V، 35 أمبير، 45 W، 45 ° C، مرشح المسح الضوئي: 3، سرعة المسح الضوئي: 3.
- Prerun الهلام الخالي لمدة 20 دقيقة (الجهد اختر تشغيل واضغط على ).
- في هذه الأثناء، يسخن سلم التسلسل والمنتجات تمديد التمهيدي في جهاز PCR لمدة 2 دقيقة إلى 90 درجة مئوية، ثم تبرد على الجليد.
- وقف الكهربائي، فتح هلام المنظم الآلي وإزالة الجزء العلوي من غطاء خزان العازلة.
- إدراج سمك القرش الأسنان في مشط بين ألواح الزجاج واختراق قليلا من الجل مع أسنان سمك القرش (انظر الشكل 5).

يتم تطبيق الشكل 5. عن قرب عرض من هلام مع أسنان سمك القرش مشط. عينة (البنفسجية) بين أسنان سمك القرش.
- ماصة إما 1 - 2 ميكرولتر من المنتجات تمديد التمهيدي أو ردود فعل التسلسل سلم في كل جيب هلام (التي شكلتها وأسنان سمك القرش).
- إذا كانت هناك حاجة ليس كل جيوب، وملء جيوب فارغة مع صبغة التحميل لمنع والسلوك تشغيل ثابت.
- إغلاق خزان العازلة وباب المنظم هلام.
- بدء الكهربائي وتشغيل الليزر (اختر الجهد على والليزر على والصحافة ).
- وقف الكهربائي مرة واحدة المنطقة ذات الاهتمام اجتاز الليزر.
النتائج
كما هو مبين في الشكل (6)، يمكن استخدام رد فعل تمديد التمهيدي لتحديد نقاط الانطلاق النسخي من النصوص ذات الأهمية ويمكن أن يساعد على استخلاص مناطق المروج (التي تم تحديدها عادة من قبل -10 و -35 العناصر). يمثل العلوي (أطول) [كدنا] جزء من "نهاية 5 من مرنا وبالتالي يمكن ت...
Discussion
تمديد التمهيدي الفلورسنت هو طريقة بسيطة وسريعة لتحديد الغايات 5 'من الرنا، إما لTSP- أو تحديد معالجة RNA الثانوي. بسبب استخدام بادئات الفلورسنت، ويمكن ضبط ردود الفعل صعودا وتشغيل دون احتياطات أمنية إضافية (على عكس في حالة الاشعال المسمى بالإشعاع). كما تم الكشف عن عينات...
Disclosures
The authors have nothing to disclose that would present a conflict of interest.
Acknowledgements
We thank Anne Wochele for her assistance in the laboratory and Vera Augsburger for help with the automated gel sequencer. We thank the Deutsche Forschungsgemeinschaft for funding by grants BE4038/2 and BE4038/5 within the “priority programmes” SPP1316 and SPP1617.
Materials
| Name | Company | Catalog Number | Comments |
| AMV Reverse Transcriptase (20-25 U/µl) | NEB / Roche | NEB: M0277-T / Roche: 10109118001 | |
| DNase I (RNase free) | Ambion (life technologies) | AM2222 | |
| FastPrep-24 Instrument | MPBio | 116004500 | |
| Fluorescently labeled primers | Biomers | n/a | 5’ DY-681 modification of “ordinary” DNA oligonucleotides. Compatible dyes such as the LICOR IRDye 700/800 are also available from other suppliers such as IDTdna. |
| Li-Cor 4200 Sequencer incl. ImagIR Data collection software | Li-Cor | Product discontinued | |
| NanoDrop 2000 | Thermo Scientific | ||
| Nuclease free water | Ambion (life technologies) | AM9915G | |
| Plasmid mini preparation kit | QIAGEN | 12125 | |
| RapidGel-XL-40% Concentrate | USB | US75863 | |
| RNA STORAGE BUFFER | Ambion (life technologies) | AM7000 | |
| Roti-Aqua-P/C/I | Carl Roth | X985.3 | Alternative: “Acid-Phenol:Chloroform, pH 4.5 (with IAA, 125:24:1)” from Ambion (AM9720) |
| SUPERase•In RNase Inhibitor | Ambion (life technologies) | AM2696 | |
| Thermo Sequenase fluorescently labelled primer cycle sequencing kit with 7-deaza-dGTP | GE Healthcare | RPN2538 | |
| TRIzol reagent | life technologies | 15596-026 | |
| Zirconia/Silica Beads 0.1 mm | BioSpec | 11079101z |
References
- Simpson, C. G., Brown, J. W. Primer extension assay. Methods Mol. Biol. 49, 249-256 (1995).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proc. Natl. Acad. Sci. U. S. A. 74, 5463-5467 (1977).
- Fekete, R. A., Miller, M. J., Chattoraj, D. K. Fluorescently labeled oligonucleotide extension: a rapid and quantitative protocol for primer extension. Biotechniques. 35, 90-94 (2003).
- Schuster, C. F., et al. Characterization of a mazEF Toxin-Antitoxin Homologue from Staphylococcus equorum. J. Bacteriol. 195, 115-125 (2013).
- Nolle, N., Schuster, C. F., Bertram, R. Two paralogous yefM-yoeB loci from Staphylococcus equorum encode functional toxin-antitoxin systems. Microbiology. 159, 1575-1585 (2013).
- Yamaguchi, Y., Park, J. H., Inouye, M. Toxin-antitoxin systems in bacteria and archaea. Annu. Rev. Genet. 45, 61-79 (2011).
- Schuster, C. F., Bertram, R. Toxin-antitoxin systems are ubiquitous and versatile modulators of prokaryotic cell fate. FEMS Microbiol. Lett. 340, 73-85 (2013).
- Goeders, N., Van Melderen, L. Toxin-antitoxin systems as multilevel interaction systems. Toxins. 6, 304-324 (2014).
- Yamaguchi, Y., Inouye, M. mRNA interferases, sequence-specific endoribonucleases from the toxin-antitoxin systems. Progress in molecular biology and translational science. 85, 467-500 (2009).
- Park, J. H., Yamaguchi, Y., Inouye, M. Bacillus subtilis MazF-bs (EndoA) is a UACAU-specific mRNA interferase. FEBS Lett. 585, 2526-2532 (2011).
- Zhu, L., et al. et al.Staphylococcus aureus MazF specifically cleaves a pentad sequence, UACAU, which is unusually abundant in the mRNA for pathogenic adhesive factor SraP. J. Bacteriol. 191, 3248-3255 (2009).
- Zhu, L., et al. The mRNA interferases, MazF-mt3 and MazF-mt7 from Mycobacterium tuberculosis target unique pentad sequences in single-stranded RNA. Mol. Microbiol. 69, 559-569 (2008).
- Fu, Z., Donegan, N. P., Memmi, G., Cheung, A. L. Characterization of MazFSa, an endoribonuclease from Staphylococcus aureus. J. Bacteriol. 189, 8871-8879 (2007).
- Marmur, J. A procedure for the isolation of deoxyribonucleic acid from micro-organisms. J. Mol. Biol. 3, 208-218 (1961).
- Emory, S. A., Belasco, J. G. The ompA 5' untranslated RNA segment functions in Escherichia coli as a growth-rate-regulated mRNA stabilizer whose activity is unrelated to translational efficiency. J. Bacteriol. 172, 4472-4481 (1990).
- Cole, S. T., Bremer, E., Hindennach, I., Henning, U. Characterisation of the promoters for the ompA gene which encodes a major outer membrane protein of Escherichia coli. Mol. Gen. Genet. 188, 472-479 (1982).
- Schleifer, K. H., Kilpper-Bälz, R., Devriese, L. Staphylococcus arlettae sp. nov., S. equorum sp. nov. and S. kloosii sp. nov.: Three New Coagulase-Negative, Novobiocin-Resistant Species from Animals. Syst. Appl. Microbiol. 5, 501-509 .
- Yu, H., Goodman, M. F. Comparison of HIV-1 and avian myeloblastosis virus reverse transcriptase fidelity on RNA and DNA templates. J. Biol. Chem. 267, 10888-10896 (1992).
- Ying, B. W., Fourmy, D., Yoshizawa, S. Substitution of the use of radioactivity by fluorescence for biochemical studies of RNA. RNA. 13, 2042-2050 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved