Method Article
النظام الشمي كنموذج لدراسة أنماط نمو محور عصبي ومورفولوجيا
In This Article
Summary
We describe a protocol for in vivo labeling of olfactory sensory neurons by electroporation and subsequent confocal laser-scanning or multiphoton microscopy to visualize neuronal morphology and its development over time.
Abstract
The olfactory system has the unusual capacity to generate new neurons throughout the lifetime of an organism. Olfactory stem cells in the basal portion of the olfactory epithelium continuously give rise to new sensory neurons that extend their axons into the olfactory bulb, where they face the challenge to integrate into existing circuitry. Because of this particular feature, the olfactory system represents a unique opportunity to monitor axonal wiring and guidance, and to investigate synapse formation. Here we describe a procedure for in vivo labeling of sensory neurons and subsequent visualization of axons in the olfactory system of larvae of the amphibian Xenopus laevis. To stain sensory neurons in the olfactory organ we adopt the electroporation technique. In vivo electroporation is an established technique for delivering fluorophore-coupled dextrans or other macromolecules into living cells. Stained sensory neurons and their axonal processes can then be monitored in the living animal either using confocal laser-scanning or multiphoton microscopy. By reducing the number of labeled cells to few or single cells per animal, single axons can be tracked into the olfactory bulb and their morphological changes can be monitored over weeks by conducting series of in vivo time lapse imaging experiments. While the described protocol exemplifies the labeling and monitoring of olfactory sensory neurons, it can also be adopted to other cell types within the olfactory and other systems.
Introduction
The lifelong turnover of sensory neurons distinguishes the olfactory system from many other sensory and neuronal systems1,2. Newly formed sensory neurons are continuously generated in the basal portion of the olfactory epithelium3 and extend their axons into the olfactory bulb, the first relay station of the olfactory system4. However, the cellular and molecular mechanisms controlling the formation and maintenance of the olfactory map are far from being fully understood4,5.
Here, we describe a protocol for labeling sensory neurons of the olfactory organ of larval X. laevis by in vivo electroporation of fluorophore-coupled dextrans. The presented protocol allows visualization of axonal morphology and connectivity, track axonal development over time and study mechanisms regulating axonal wiring and guidance.
Electroporation is a well established method to introduce charged macromolecules, like dextran-coupled dyes and DNA, into cells6,7. The cell membrane is permeabilized by application of short voltage pulses and the molecules are electrophoretically delivered into the cytosol8. Spatially restricted electroporation using a micropipette permits selective labeling of cells including neurons and has been applied in various neuronal systems including the visual system of X. laevis9,10.
We show how the electroporated animals can be used to study axonal growth patterns and morphology in living animals using confocal laser-scanning or multiphoton microscopy. The described procedure allows identifying the coarse topology of axonal projections of sensory neurons of the main and accessory olfactory system11,12. Using in vivo time lapse imaging, it is also suitable to supervise the glomerular connections of single mature sensory neurons, and to monitor the evolution of the axonal projection patterns of immature sensory neurons12. The described protocol can be applied to investigate the structure and formation of olfactory circuits in the intact animal and can be adapted to other cell types within the olfactory and other neuronal systems.
Protocol
أجريت التعامل مع الحيوانات والتجارب التي وافقت عليها لجنة جامعة غوتنغن لأخلاقيات التجارب على الحيوانات: ملاحظة.
1. إعداد أدوات وماصة تلفيق
- تأكد من أن الإعداد Electroporation لليتكون من stereomicroscope مع المسافة العمل كبيرة ومجهزة الإضاءة الفلورسنت وتصفية مجموعات للصبغة المستخدمة.
- ل electroporation استخدام إما electroporator خلية واحدة مخصصة أو عام مولد النبض مربع تعلق على الذبذبات. ربط مخرجات electroporator إلى حامل ماصة والقطب حمام. توصيل الطرف الموجب للمولد النبض لصاحب ممص مكروى والسالب إلى القطب حمام. ضمان كلا من حامل ماصة والقطب حمام يحتوي الأسلاك الفضة المطلية بطبقة رقيقة من كلوريد الفضة.
- جبل حامل ماصة على micromanipulator للسماح تحديد المواقع بدقة.
- افتعال بال micropipettes Electroporation للمن الشعيرات الدموية الزجاج البورسليكات مع خيوط الداخلي.
- استخدام مجتذب micropipette الأفقي وتطبيق البروتوكول المعدل لتصنيع الماصات للتجارب المشبك التصحيح كما وصفها Bestman وآخرون 13.
- التكيف مع المعلمات لإنتاج ساق طويلة وفتحة طرف أصغر مما أدى إلى مقاومة ماصة ارتفاع حوالي 15-20 MOHM ل electroporation خلية واحدة. يجب أن تكون المقاومة ماصة أقل من ذلك، على سبيل المثال، 3-4 MOHM، لوضع العلامات على مجموعات من الخلايا.
- قياس المقاومة ماصة إما مباشرة مع electroporator وحيدة الخلية مخصص أو حساب مع قانون أوم بعد قياس تدفق التيار مع الذبذبات بعد تطبيق نبضة الجهد المحددة.
2. إعداد Electroporation للحلول
- حل ديكستران يقترن fluorophore في المسابقة ضفدع (98 ملي مول كلوريد الصوديوم، 2 ملي بوكل، 1 ملم CaCl 2، 2 مم MGCL 2، 5 ملي الجلوكوز، 5 ملي نا البيروفات، 10 ملي HEPES، بعد تعديلها لدرجة الحموضة 7.8، وكانت الأسمولية 230 mOsmol / لتر) بتركيز 3 مم. الخلايا قد لا تكون كذلك وصفت الزاهية إذا تم استخدام تركيزات أقل الصبغة. إعداد محلول المخزون الحجم الكبير وتقسيمه إلى مأخوذة الصغيرة. تجميدها للتخزين (مستقر لعدة أشهر).
هي Dextrans المتاحة في مختلف الأحجام ومجموعة متنوعة من الانبعاثات / الإثارة أطياف (على سبيل المثال، اليكسا 488 ديكستران 10kD، اليكسا 546-ديكستران 10kD، اليكسا 568 ديكستران 10kD، اليكسا 594-ديكستران 10kD، TMR-ديكستران 3kD.): ملاحظة. - الردم على ممص مكروى مع تلميح ماصة ممدود مع كمية صغيرة من محلول ديكستران (1-5 ميكرولتر). نفض الغبار بعناية ممص مكروى مع إصبع لإزالة فقاعات الهواء المتبقية من طرف ماصة.
- تركيب ممص مكروى في حامل ماصة. تأكد من أن أسلاك الفضة داخل ماصة على اتصال مع محلول الصبغة.
3. اختيار اليرقية اكس. المورق </ EM>
- استخدام اليرقات البيضاء من X. المورق للتجارب. الحيوانات البرية نوع تمتلك melanophores مليئة الصباغ التي تظهر انبعاث تألق ذاتي خلال متحد البؤر / التصوير multiphoton وبالتالي فهي لا تصلح لوصف التجارب.
- تنظيم الضفادع الصغيرة premetamorphotic بعد Nieuwkoop وفابر 14. اختيار الضفادع الصغيرة من مراحل 45-53 للتجارب.
4. Electroporation للمن جانب Dextrans Fluorophore-
- ضع قطعة صغيرة من الأنسجة في طبق بتري وتغطية ذلك مع كمية صغيرة من المياه التي تحتوي على 0.02٪ تريكين (الأثيل methanesulfonate 3-أمينوبنزوات، بعد تعديلها لدرجة الحموضة 7).
- تخدير الضفادع في المياه التي تحتوي على 0.02٪ تريكين. بعد بعض دقائق من الحيوانات تتوقف عن التحرك. تأكيد التخدير المناسبة من خلال لمس الضفادع الصغيرة. ينبغي أن تكون غير مستجيبة.
- نقل بعناية الشرغوف من مخدر إلى الأنسجة مغطاة طبق بتري.
- تأكد من إلكترونيات حمامقصيدة إغلاق الدائرة Electroporation لل. تأكد من أن القطب هو في اتصال مع النسيج الرطب. على اتصال مباشر مع الشرغوف ليست ضرورية.
- وضع وثيقة ممص مكروى تلميح إلى الجهاز باستخدام حاسة الشم مياداة مجهرية.
- اختراق الجلد تغطي الجهاز الشمي مع طرف ماصة والتقدم بحذر طرف في طبقة الخلايا العصبية الحسية في موقع مركزي من الظهارة الشمية الرئيسية أو ظهارة الميكعي.
- يؤدي البقول الإيجابية الجهد مربع لنقل الصبغة في الخلايا العصبية الحسية. تطبيق الجهد نبض واحد (على سبيل المثال، 25 V، طول النبض 25 ميللي ثانية) أو القطارات من البقول متعددة (على سبيل المثال، 50 V، طول النبض μsec 300، 400 ميللي ثانية مدتها القطار بسرعة 200 هرتز).
ملاحظة: تحديد المعايير المثلى نبض الجهد المطلوب للتمديد لوضع العلامات. تقليل الجهد نبض السعة والمدة وعدد من حالات التكرار إلى خفض عدد الخلايا المسمى. تطبيق أعلى الجهد نبض السعة والمدة وعدد من صulses لوضع العلامات أكثر انتشارا. - تصور ناجح قذف الصبغة و electroporation بواسطة نبضات أثار استخدام إضاءة الفلورسنت من stereomicroscope. الصبغة ينتشر بسرعة في جسم الخلية والتغصنات بعد Electroporation للنجاح.
- كرر الخطوات من 4،5-4،9 عن الجهاز الشمي الثاني من الشرغوف.
- نقل الشرغوف في كوب مملوء بالماء النقي لتحقيق الانتعاش. بعد حوالي 5 دقائق الشراغيف يستيقظ من التخدير وتبدأ حركات السباحة العادية.
- بعد 24 ساعة ينتشر الصبغة electroporated في الخلايا العصبية الحسية وتصل إلى البصلة الشمية عبر نقل محور عصبي في نهاية المطاف.
5. الحيوانات تركيب لفي فيفو التصور من الخلايا والعمليات محور عصبي
- تخدير الضفادع في المياه التي تحتوي على 0.02٪ تريكين.
- نقل بعناية الضفادع الصغيرة إلى غرفة التصوير، على سبيل المثال، تغطي المطاط السيليكون صغير طبق بتري مع توقف دام الشرغوف الحجم.
- قطع مستطيل صغير في شريط من بارافيلم. تغطية الشرغوف مع بارافيلم، وترك الدماغ الانتهائي الأمامي يتعرض من خلال النافذة خفض التدريجي. إصلاح بارافيلم مع الإبر على طبق دون إصابة الشرغوف.
- تأكد من الشرغوف مغمورة في الماء كافية تحتوي على 0.02٪ تريكين.
- جبل غرفة التصوير على مسرح المجهر multiphoton تستقيم أو متحد البؤر المجهر.
- الحصول على كومة ثلاثي الأبعاد من الصور من البصلة الشمية. ضمان إجراء التصوير هو قصيرة قدر الإمكان و لا تتجاوز 10-15 دقيقة.
- العودة الشرغوف في الماء العادي في خزان منفصل ومنع التعرض للضوء. بعد 5 دقائق، الشرغوف يستيقظ من التخدير.
- كرر الخطوات من 5،1-5،7 بعد فترات زمنية محددة، على سبيل المثال، كل يوم.
6. الحيوانات تركيب لفيفو السابقين التصور من الخلايا والعمليات محور عصبي
- بدلا من ذلك إلى القسم 5من البروتوكول، استخدم إعداد الدماغ رفعه لتصور الخلايا العصبية الحسية المسمى.
- تخدير وقتل الشرغوف من قبل transection من الدماغ في الانتقال إلى الحبل الشوكي. استئصال كتلة من الأنسجة التي تحتوي على أجهزة الشم وحاسة الشم الأعصاب والدماغ الانتهائي الأمامي.
- نقل كتلة الأنسجة لضفدع حل المسابقة وإزالة النسيج الضام مع مقص غرامة لفضح الجانب البطني من الدماغ.
- نقل كتلة الأنسجة إلى غرفة التصوير واصلاحها مع إطار البلاتين الوترية بخيوط النايلون.
- جبل غرفة التصوير على مسرح المجهر متحد البؤر / multiphoton.
- الحصول على كومة ثلاثي الأبعاد من الصور من البصلة الشمية.
7. معالجة الصور وتقييم البيانات
- 15 تحسين وتطبيق الوسائل غير الحكومية المحلية من الترشيح لتحسين جودة الصورة والتصور الهياكل العصبية كما وصفها كوبيه، P. وآخرون..
وغالبا ما تكون صاخبة بيانات من تجارب التصوير في طبقات الأنسجة العميقة من العينات الحية: ملاحظة. - خلق توقعات كثافة القصوى للمداخن صورة لمحة عامة.
- عن الوقت الفاصل بين شاشة تجارب التصوير مجموعات البيانات لاحد محاور تحديدها بشكل لا لبس فيه من الخلايا العصبية الحسية.
- إعادة التشكل الخلوي عن طريق تتبع بمساعدة برنامج العمليات العصبية كما وصفها بنغ وآخرون 16.
النتائج
ويمكن تطبيق بروتوكول صفها بنجاح ول electroporation في الجسم الحي التصور العمليات محور عصبي من الخلايا العصبية الحسية للنظام حاسة الشم من اكس تخدير المورق، وذلك باستخدام ليزر متحد البؤر المسح المجهري أو multiphoton (الشكل 1).
Electroporation للتسمح dextrans يقترن fluorophore للدخول وانتشرت بسرعة داخل خلايا الجهاز الشمي. فإنه من المفيد أن تطبيق إضاءة الفلورسنت للتحقق من وضع العلامات ناجحة بعد مما اثار نبضات الجهد. اعتمادا على المعلمات Electroporation لل، على سبيل المثال، المقاومة ماصة، وصفت مجموعات من الخلايا (الشكل 2A، B) أو الخلايا واحد (الشكل 2C) من جهاز حاسة الشم. محاور عصبية من الخلايا العصبية الحسية وصفت يمكن تصور في العصب الشمي (الشكل 2D) وعمليات محور عصبي يمكن ملاحظتها أيضا في البصلة الشمية، عادة 24 ساعة بعد Electroporation للنجاح(الشكل 3). Electroporation للمن مجموعات من الخلايا العصبية الحسية يسمح تصور أنماط الأسلاك الخشنة في البصلة الشمية (الشكل 3A). يمكن تطبيقها Electroporation للخلية واحدة للتحقيق في أنماط الفردية محور عصبي إسقاط، التشعبات محور عصبي والربط مع الهياكل الكبيبي في البصلة الشمية (الشكل 3C-E).
الضفادع الصغيرة البيضاء الشفافة من X. تصريح المورق في الجسم الحي أو متحد البؤر التصوير multiphoton من الخلايا العصبية الحسية وصفت في الدماغ سليمة من الشرغوف تخدير. يمكن تتبع تطور أنماط النمو محور عصبي على مدى عدة أيام / أسابيع بواسطة المتكررة في التصور المجراة من نفس المسمى الخلايا العصبية الحسية (الشكل 4). اعتمادا على نضج الخلايا العصبية الحسية في نقطة زمنية من Electroporation للنمط محور عصبي في البصلة الشمية يمكن أن تختلف إلى حد كبير. الخلايا العصبية الناضجة تمتلك بالفعل محور عصبي الفروع تفصيلا التي تتميز خصلالمناطق إد متصل الكبيبات. نمط النمو محور عصبي من الخلايا العصبية الناضجة مستقرة نوعا ما، ولكن استطالة فروع محور عصبي والتحسينات من خصلات الكبيبي ملحوظة (الشكل 4A-E). ويمكن ملاحظة الخلايا العصبية الحسية في الجسم الحي لفترات زمنية طويلة، على سبيل المثال، أكثر من ثلاثة أسابيع (الشكل 4F-I). من ناحية أخرى، محاور عصبية من الخلايا العصبية غير الناضجة لا تزال في طور النمو الأولي، لا يملكون arborizations معنقدة ولم إتصال بعد إلى أهدافهم النهائية الكبيبي. بروتوكول تجريبي يسمح تتبع تطور هذه العصبونات أثناء النضج، على سبيل المثال، استطالة المحور، التشعبات وإنشاء arborizations معنقدة (الشكل 4J-L). لمزيد من الأمثلة انظر أيضا Hassenklöver ومانزيني 12.
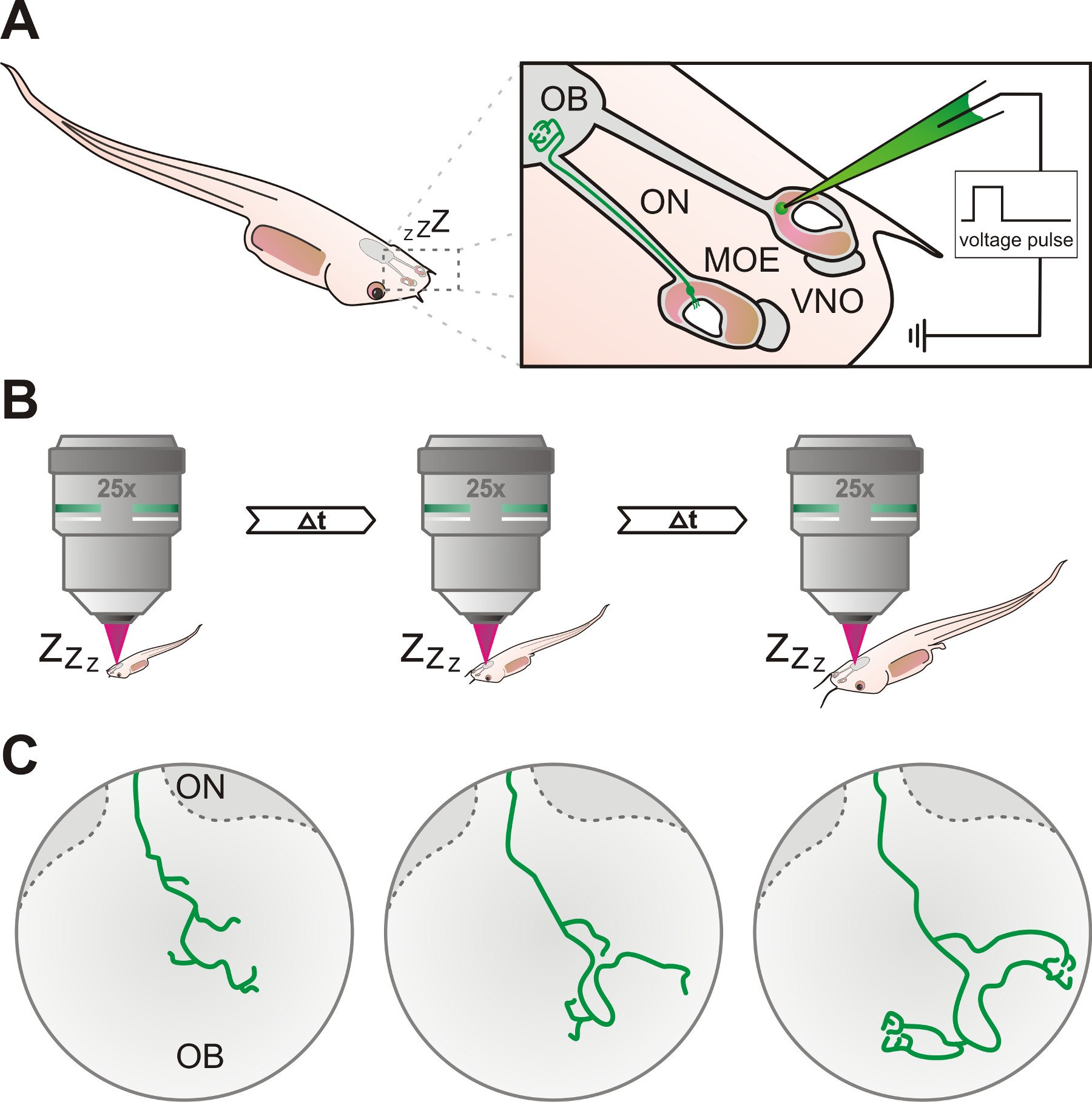
الشكل 1. نظرة تخطيطية للبروتوكول تجريبي. (A) الخلايا العصبية الحسية في الظهارة الشمية الرئيسية (وزارة التربية) أو الجهاز الميكعي الأنفي (VNO) من جهاز حاسة الشم من اكس تخدير وصفت المورق اليرقات عبر Electroporation للباستخدام ماصة زجاجية مملوءة بمحلول ديكستران الفلورسنت. يمكن أن يتبع من محاور الخلايا العصبية المسماة عبر العصب الشمي (ON) وتصل في نهاية المطاف إلى البصلة الشمية (OB). وتخدير (ب) الشرغوف ويتم التحقيق في الخلايا العصبية وصفت مرارا باستخدام مجهر متحد البؤر أو multiphoton في فترات زمنية محددة. (ج) زيادة تطوير أنماط النمو محور عصبي من الخلايا المسمى يمكن اتباعها على مدى فترات زمنية من أيام إلى أسابيع.
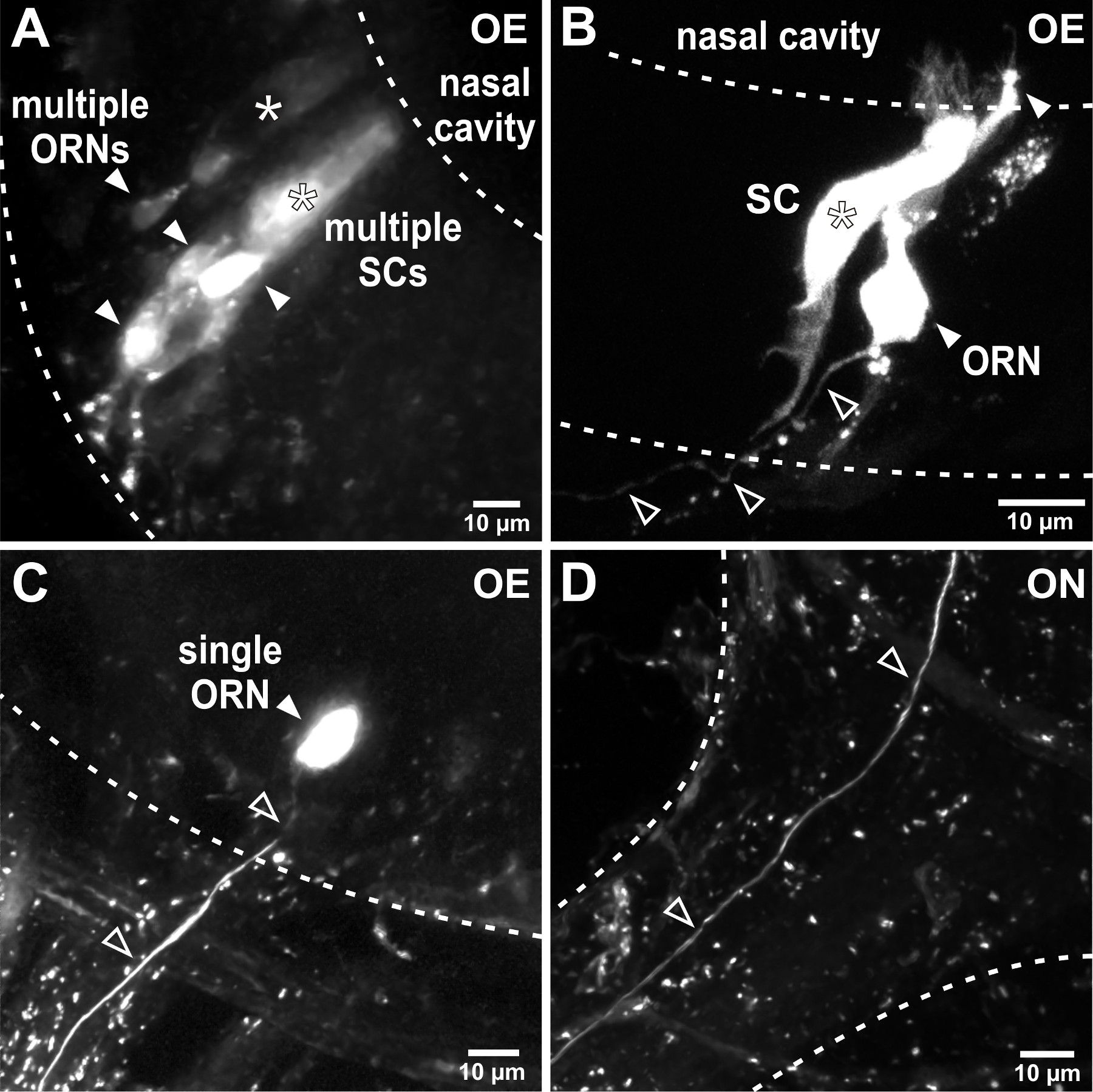
الشكل 2. كهربائيtroporation من الخلايا العصبية الحسية في الجهاز الشمي. (A) Electroporation للمع الماصات مقاومة منخفضة يؤدي إلى وضع العلامات من عدة خلايا في الجهاز الشمي. في هذا المثال التمثيلي كانت ملطخة متعددة الخلايا العصبية مستقبلات الشم (ORNs، النصال شغل) واثنين من خلايا عمودية على شكل دعم (SCS، العلامات النجمية). الخطوط المتقطعة ترسيم حدود ظهارة الشم (عمر الفاروق). (ب) صقل المعلمات Electroporation لل، على سبيل المثال، زيادة مقاومة ماصة، يحد من عدد من الخلايا المسمى. في هذا المثال، تم صبغ الخلايا العصبية الحسية واحدة (النصال شغل) واحد المجاورة دعم الخلية (النجمة) بعد Electroporation لل. ملاحظة محور عصبي واحد ترك الظهارة الشمية (النصال مفتوحة). (C) الناجح Electroporation للخلية واحدة يؤدي إلى وسم خاص من الخلايا العصبية الحسية الفردية (شغل رأس السهم) ومحور عصبي متصل بها (النصال مفتوحة) في الظهارة الشمية. (D) محور عصبي واحد المسمى (النصال مفتوحة) يمكن اتباعها من خلال العصب الشمي (ON) في البصلة الشمية.
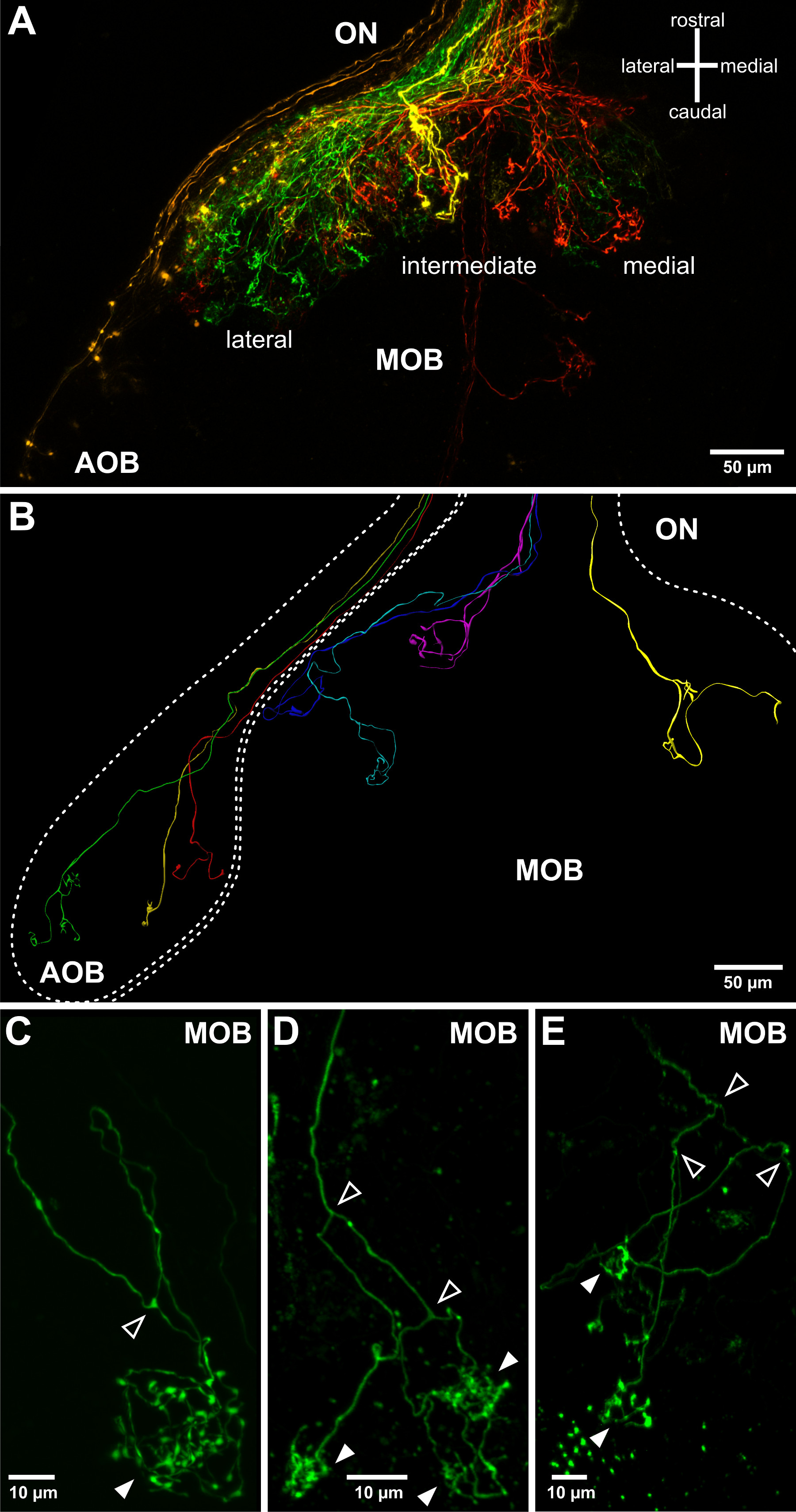
الشكل 3. تصور التوقعات محور عصبي حاسة الشم في البصلة الشمية رفعه. (A) وطوبولوجيا الخشنة من التوقعات محور عصبي من الخلايا العصبية الحسية في البصلة الشمية يمكن تصور استخدام أقل الماصات Electroporation للمقاومة. وصفت واحدة الشم نصف الكرة مبة وما يرتبط بها من العصب الشمي لها (ON). تم electroporated أربعة dextrans إلى جانب fluorophores مختلفة في أربعة أماكن بعيدة من الجهاز الشمي: الجانبي (الأخضر)، متوسطة (الصفراء)، وسطي زارة التربية والتعليم (أحمر) وVNO (البرتقالي). وهذا يسمح تصور لمبة حاسة الشم التبعي (AOB) وحقول الإسقاط الثلاثة الرئيسية من البصلة الشمية الرئيسية (MOB). (ب) أنماط مختلفة من نمو محور عصبي واحد الخلايا العصبية الحسية الشمية فرضه على بنية البصلة الشمية. صورت يتم الجمع بين ثلاث عمليات إعادة البناء الأبعاد المتعددة stainings وحيدة الخلية المستمدة من عينات اليرقات المختلفة. (CE) أمثلة على محاور عصبية شمية واحدة توقع في البصلة الشمية وتشكيل arborizations معنقدة / نقاط الاشتباك العصبي في الكبيبات كروية (النصال شغل). لاحظ أنه في اكس المورق محاور عصبية شمية المشعب بانتظام (النصال مفتوحة) قبل الاتصال احدا أو اثنين أو متعددة الكبيبات (النصال شغلها، كما يرى Hassenklöver ومانزيني 12).
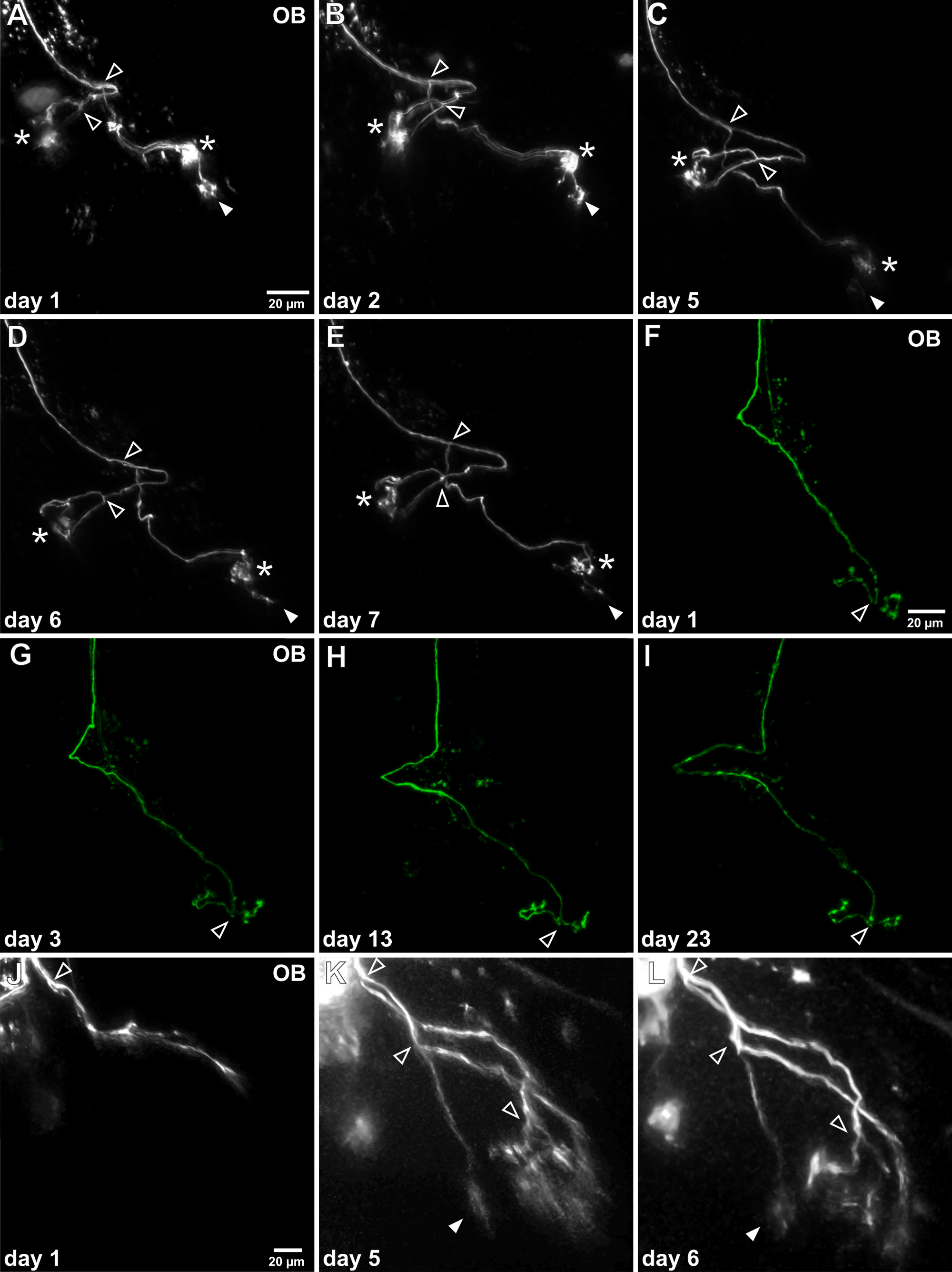
الرقم 4. في الجسم الحي الوقت الفاصل بين التصوير احدة من محاور الخلايا العصبية الشمية. (AE)بعد نجاح Electroporation للخلية واحدة محور عصبي وصفت يمكن تصور مرارا في البصلة الشمية (OB). يوضح هذا المثال محور عصبي الفردية التي تم التحقيق لمدة أسبوع واحد. لا يغير مورفولوجيا العام إلى حد كبير ويمكن تحديد نقطتين المتفرعة الكبرى (النصال مفتوحة). لاحظ أنه على مدار الوقت، خصل الكبيبي واحد يخضع تخفيض مستمر (شغل رأس السهم)، في حين لا تزال الأخريين خصلات الكبيبي مستقرة (النجمة). (FI) يوضح هذا المثال التمثيلي جدوى من الملاحظات على المدى الطويل كما تم التحقيق هذا محور عصبي معين لأكثر من ثلاثة أسابيع. ويمكن الكشف عن أي تغيير واضح من نمط نموها. (JL) ويصور مثال على محور عصبي حسي غير ناضجة في عملية النمو. لم ترتبط بعد ذلك إلى الكبيبات وخصلات الكبيبي مميزة مفقودة. بعد 5 أيام وممدود الفروع محور عصبي، منقسمة محور عصبي عدة مرات وarborizations الجميلة هيأنشئت.
Discussion
الإجراء التجريبي وصفها هنا يسمح وضع العلامات الخلايا العصبية الحسية من الجهاز الشمي من اليرقات X. المورق بواسطة الصعق الكهربائي من dextrans يقترن fluorophore والتصور اللاحق للنمو محور عصبي حسي في الحيوانات الحية. من خلال تغيير معالم Electroporation للفي الجسم الحي من الممكن السيطرة على عدد الخلايا العصبية الحسية المسمى. وبالتالي فمن الممكن لتسمية مجموعات كبيرة من الخلايا العصبية الحسية من الظهارة، وعدد قليل جدا أو حتى خلايا مفردة.
لضمان تمديد المطلوب لوضع العلامات العصبية من المهم توخي الحذر بشكل خاص حول خصائص ممص مكروى والبقول Electroporation لل. يمكن المقاومات ماصة أعلى والحد من الجهد نبض السعة والمدة وعدد من حالات التكرار تقلل من كمية الخلايا المسمى، في حين خفض المقاومة ماصة وارتفاع الجهد نبض السعة والمدة وعدد النبضات يمكن أن يؤدي إلى وضع العلامات أكثر انتشارا. عشراستخدام البريد من dextrans الفلورسنت ل electroporation يوفر ملاحظات مرئية فورية إذا كان تطبيق الإعدادات المناسبة. يجب الحرص على أن استخدام المعلمات لاتساع ومدة وعدد النبضات التي تتجاوز القيم المنصوص عليها في بروتوكول يمكن أن تؤدي إلى تلف الخلايا أو حتى موت الخلايا 17. انسداد أو مكسورة نصائح من بال micropipettes يمكن أيضا أن تعيق Electroporation للنجاح.
في الجسم الحي Electroporation للفي الجهاز الشمي من X. المورق يقتصر على مراحل اليرقات منذ جلد الضفادع postmetamorphotic هو أكثر صرامة والتي لا يمكن اختراقها بسهولة مع ممص مكروى. التصور في الجسم الحي من العمليات العصبية يمكن أن يعوق تناثر الضوء الإثارة / الانبعاثات في المناطق الأكثر عمقا في الدماغ أو عن طريق الأوعية الدموية. تصبح هذه مشكلة واضحة خاصة في مراحل اليرقات أعلى بسبب الدماغ أكبر ويمكن أن يؤدي إلى إشارات صاخبة جعل تحديد واضح لعمليات محور عصبي غرامة أكثر صعوبة.
تصاريح بروتوكول المعروضة لتصور الخلايا العصبية الحسية في نظام حاسة الشم سليمة دون تشريح الحيوان، وإتلاف الخلايا خلال وضع العلامات، وإعداد شرائح الأنسجة أو إصلاح الأنسجة عند الضرورة لطرق بديلة، مثل وضع العلامات في التصحيح خلية كاملة تجارب -clamp 18. عند الجمع بين العلامات القليلة احدة أو الخلايا العصبية الحسية في الجسم الحي مع مرور وقت التصوير، فمن الممكن تصور الاتصالات الكبيبي واحدة من الخلايا العصبية الحسية الناضجة على مدى فترات زمنية طويلة. بهذه الطريقة فإنه من الممكن أيضا لمراقبة تطور أنماط إسقاط محور عصبي من الخلايا العصبية الحسية غير الناضجة على مدى عدة أسابيع. هذا الخيار الأخير هو اهتمام بوجه خاص لأنه يتيح مراقبة أنماط نمو محاور عصبية واحدة في الحيوانات الحية. هذا يفتح إمكانية للتحقيق في الآليات الخلوية والجزيئية التي تتحكم في توجيه محور عصبي والاستطلاعية. عدة عوامل، بما في ذلك مستقبلات الرائحة التعبير، ومختلف الذخائر المتروكةوقد تبين أن الجزيئات التوجيه ن والتي يسببها الرائحة / النشاط العفوي من الخلايا العصبية الحسية لتنظيم النتيجة المستهدفة من محاور الخلايا العصبية الحسية 4،5.ولا يقتصر تطبيق البروتوكول إلى الخلايا العصبية الحسية الشمية، ولكن يمكن أيضا أن تطبق على دراسة أنواع الخلايا الأخرى، على سبيل المثال، الخلايا الجذعية / السلف من المناطق العصبية من الدماغ النامي أو الخلايا التاجية من البصلة الشمية. بالإضافة إلى تقنية أثبتت ويمكن أيضا أن تستخدم في تركيبة مع dextrans الحساسة الكالسيوم أو حقن الأصباغ الكالسيوم غشاء منفذ للحصول على المعلومات الوظيفية حول الخلايا العصبية المسماة و / أو الدوائر المتصلة 7،19. توفر مجموعة واسعة من fluorophores إلى جانب dextrans يسمح وضع العلامات من الخلايا الفردية متعددة أو السكان مع ألوان مختلفة. البلازميد أيضا حل الحمض النووي، على سبيل المثال لترميز البروتينات الفلورية، هو مناسبة ل electroporation ويمكن زيادة تعزيز versatiliتاي وفائدة هذه التقنية 6. يمكن زيادة تعزيز بروتوكول للسماح للElectroporation للمجتمعة dextrans وDNA أو morpholinos تهمة التلاعب التعبير الجيني 13،17.
الطريقة الموصوفة يمثل بالتأكيد أداة جديدة للتحقيق في مجمع والعمليات لا تزال غير مفهومة تماما أن تنظيم التوجيه محور عصبي في النظام الشمي الفقاريات.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by DFG Schwerpunktprogramm 1392 (project MA 4113/2-2), cluster of Excellence and DFG Research Center Nanoscale Microscopy and Molecular Physiology of the Brain (project B1-9), and the German Ministry of Research and Education (BMBF; project 1364480).
Materials
| Name | Company | Catalog Number | Comments |
| SZX16 | Olympus | Stereomicroscope with fluorescent illumination | |
| Axon Axoporator 800A | Molecular Devices | Single cell electroporator | |
| ELP-01D | npi electronic | Electroporator | |
| MMJ | Märzhäuser Wetzlar | Manual micromanipulator | |
| P-1000 | Sutter | Horizontal micropipette puller | |
| G150F-4 | Warner Instruments | Glass capillaries for electroporation pipette fabrication; internal filament makes backfilling easier | |
| Alexa 488-dextran 10 kD | Life Technologies | D22910 | |
| Alexa 546-dextran 10 kD | Life Technologies | D22911 | |
| Alexa 568-dextran 10 kD | Life Technologies | D22912 | |
| Alexa 594-dextran 10 kD | Life Technologies | D22913 | |
| TMR-dextran 3 kD (micro-Ruby) | Life Technologies | D7162 | |
| Microloader pipette tips | Eppendorf | 930001007 | |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10521 | Anesthetic; use gloves |
| A1-MP | Nikon | Multiphoton microscope | |
| LSM 780 | Zeiss | Confocal microscope | |
| Imaris | Bitplane | Alternative software for neuronal tracing |
References
- Huard, J. M., Youngentob, S. L., Goldstein, B. J., Luskin, M. B., Schwob, J. E. Adult olfactory epithelium contains multipotent progenitors that give rise to neurons and non-neural cells. J. Comp. Neurol. 400 (4), 486-4810 (1998).
- Schwob, J. E. Neural regeneration and the peripheral olfactory system. Anat. Rec. 269 (1), 33-49 (2002).
- Leung, C. T., Coulombe, P. A., Reed, R. R. Contribution of olfactory neural stem cells to tissue maintenance and regeneration. Nat. Neurosci. 10 (6), 72-726 (2007).
- Lodovichi, C., Belluscio, L. Odorant receptors in the formation of the olfactory bulb circuitry. Physiology (Bethesda. 27 (4), 212-2110 (2012).
- Mori, K., Sakano, H. How is the olfactory map formed and interpreted in the mammalian brain). Annu. Rev. Neurosci. 34, 467-499 (2011).
- De Vry, J., et al. In vivo electroporation of the central nervous system: a non-viral approach for targeted gene delivery. Prog. Neurobiol. 92 (3), 227-244 (2010).
- Hovis, K. R., Padmanabhan, K., Urban, N. N. A simple method of in vitro electroporation allows visualization, recording, and calcium imaging of local neuronal circuits. J. Neurosci. Methods. 191 (1), 1-10 (2010).
- Chen, C., Smye, S. W., Robinson, M. P., Evans, J. A. Membrane electroporation theories: a review. Med. Biol. Eng. Comput. 44 (1-2), 5-14 (2006).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70 (4-5), 148-154 (2002).
- Hewapathirane, D. S., Haas, K. Single cell electroporation in vivo within the intact developing brain. J. Vis. Exp. (17), (2008).
- Gliem, S., et al. Bimodal processing of olfactory information in an amphibian nose: odor responses segregate into a medial and a lateral stream. Cell. Mol. Life Sci. 70 (11), 1965-1984 (2013).
- Hassenklöver, T., Manzini, I. Olfactory wiring logic in amphibians challenges the basic assumptions of the unbranched axon concept. J. Neurosci. 33 (44), 17252-1710 (2013).
- Bestman, J. E., Ewald, R. C., Chiu, S. -. L., Cline, H. T. In vivo single-cell electroporation for transfer of DNA and macromolecules. Nat. Protoc. 1 (3), 1272-1210 (2006).
- Nieuwkoop, P. D., Faber, J., Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis. , (1994).
- Coupé, P., Munz, M., Manjón, J. V., Ruthazer, E. S., Collins, D. L. A CANDLE for a deeper in vivo insight. Med. Image Anal. 16 (4), 849-864 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nat. Biotechnol. 28 (4), 348-353 (2010).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7 (107), (2007).
- Nezlin, L. P., Schild, D. Individual olfactory sensory neurons project into more than one glomerulus in Xenopus laevis tadpole olfactory bulb. J. Comp. Neurol. 481 (3), 233-239 (2005).
- Nagayama, S., et al. In vivo simultaneous tracing and Ca2+ imaging of local neuronal circuits. Neuron. 53 (6), 789-803 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved