Method Article
모델로 후각 시스템은 축삭 성장 패턴 및 형태를 연구하는
요약
We describe a protocol for in vivo labeling of olfactory sensory neurons by electroporation and subsequent confocal laser-scanning or multiphoton microscopy to visualize neuronal morphology and its development over time.
초록
The olfactory system has the unusual capacity to generate new neurons throughout the lifetime of an organism. Olfactory stem cells in the basal portion of the olfactory epithelium continuously give rise to new sensory neurons that extend their axons into the olfactory bulb, where they face the challenge to integrate into existing circuitry. Because of this particular feature, the olfactory system represents a unique opportunity to monitor axonal wiring and guidance, and to investigate synapse formation. Here we describe a procedure for in vivo labeling of sensory neurons and subsequent visualization of axons in the olfactory system of larvae of the amphibian Xenopus laevis. To stain sensory neurons in the olfactory organ we adopt the electroporation technique. In vivo electroporation is an established technique for delivering fluorophore-coupled dextrans or other macromolecules into living cells. Stained sensory neurons and their axonal processes can then be monitored in the living animal either using confocal laser-scanning or multiphoton microscopy. By reducing the number of labeled cells to few or single cells per animal, single axons can be tracked into the olfactory bulb and their morphological changes can be monitored over weeks by conducting series of in vivo time lapse imaging experiments. While the described protocol exemplifies the labeling and monitoring of olfactory sensory neurons, it can also be adopted to other cell types within the olfactory and other systems.
서문
The lifelong turnover of sensory neurons distinguishes the olfactory system from many other sensory and neuronal systems1,2. Newly formed sensory neurons are continuously generated in the basal portion of the olfactory epithelium3 and extend their axons into the olfactory bulb, the first relay station of the olfactory system4. However, the cellular and molecular mechanisms controlling the formation and maintenance of the olfactory map are far from being fully understood4,5.
Here, we describe a protocol for labeling sensory neurons of the olfactory organ of larval X. laevis by in vivo electroporation of fluorophore-coupled dextrans. The presented protocol allows visualization of axonal morphology and connectivity, track axonal development over time and study mechanisms regulating axonal wiring and guidance.
Electroporation is a well established method to introduce charged macromolecules, like dextran-coupled dyes and DNA, into cells6,7. The cell membrane is permeabilized by application of short voltage pulses and the molecules are electrophoretically delivered into the cytosol8. Spatially restricted electroporation using a micropipette permits selective labeling of cells including neurons and has been applied in various neuronal systems including the visual system of X. laevis9,10.
We show how the electroporated animals can be used to study axonal growth patterns and morphology in living animals using confocal laser-scanning or multiphoton microscopy. The described procedure allows identifying the coarse topology of axonal projections of sensory neurons of the main and accessory olfactory system11,12. Using in vivo time lapse imaging, it is also suitable to supervise the glomerular connections of single mature sensory neurons, and to monitor the evolution of the axonal projection patterns of immature sensory neurons12. The described protocol can be applied to investigate the structure and formation of olfactory circuits in the intact animal and can be adapted to other cell types within the olfactory and other neuronal systems.
프로토콜
참고 : 동물 실험 윤리에 대한 괴팅겐 대학위원회의 승인을 동물 취급 및 실험을 수행 하였다.
악기와 피펫 제조 1. 준비
- 전기 설치는 큰 작동 거리와 실체 현미경으로 구성되어 있으며 사용 된 염료 형광 조명 및 필터 세트가 장착되어 있는지 확인합니다.
- 전기를위한 전용 단일 세포 electroporator 또는 오실로스코프에 부착 된 일반적인 사각 펄스 발생기를 사용합니다. 피펫 홀더와 목욕 전극에 electroporator 출력을 연결합니다. 마이크로 피펫 홀더 및 목욕 전극에 음의 단자에 펄스 발생기의 양극 단자를 연결한다. 피펫 홀더 및 목욕 전극 모두 염화은의 얇은 층으로 코팅은 와이어를 포함하는 확인.
- 정확한 위치 할 수 있도록 미세 조작기에 피펫 홀더를 탑재합니다.
- 내부 필라멘트와 붕규산 유리 모세관에서 전기의 마이크로 피펫을 제작합니다.
- 수평 마이크로 피펫 풀러를 사용 Bestman 등. (13)에 의해 설명 된대로 패치 클램프 실험 피펫의 제조를 위해 수정 된 프로토콜을 적용 할 수 있습니다.
- 긴 생크 및 단일 세포에 대한 전기 천공 15-20 옴의 높은 저항 피펫 결과 작아 선단 구를 생산하는 파라미터를 적응. 피펫 저항은 세포의 그룹의 표시를 위해, 3-4 옴, 예를 들어, 낮아야한다.
- 전용 단일 셀 electroporator로 피펫 저항 직접 측정 또는 정의 전압 펄스의인가 후에 오실로스코프로 전류를 측정하여 오옴의 법칙으로 계산.
일렉트로 솔루션 2. 준비
- 개구리 벨소리 (98 mM의 NaCl을, 2 mM의 KCl을에 형광 결합 된 덱스 트란을 녹이고, 1 mM의 염화칼슘 2, 2 mM의 MGC2 리터, 3 mM의 농도의 5 mM의 포도당, pH를 7.8로 조정하고 5 mM의 나트륨 피루 베이트, 10 mM의 HEPES, 삼투압은 mOsmol / l 230이었다). 낮은 염료 농도가 사용되는 경우 세포는 매우 밝게 표시되지 않을 수 있습니다. 대량의 원액을 준비하고 작은 분취 량으로 나눈다. 저장 (개월간 안정)을 위해 그들을 동결.
참고 : 덱스 트란은 서로 다른 크기와 배출 / 여기 스펙트럼의 다양한 사용할 수 있습니다. (예를 들어, 알렉사 488 덱스 트란 10kD, 알렉사 546 - 덱스 트란 10kD, 알렉사 568 - 덱스 트란 10kD, 알렉사 594 - 덱스 트란 10kD, TMR-덱스 트란 3kD). - 덱스 트란 용액 (5 μL)의 작은 부피와 긴 피펫 팁으로 마이크로 피펫 백필. 조심스럽게 피펫 팁에서 잔류 기포를 제거하기 위해 손가락으로 마이크로 피펫을 가볍게.
- 피펫 홀더에 마이크로 피펫을 탑재합니다. 피펫 내부의 실버 와이어는 염료 용액과 접촉에 있는지 확인하십시오.
애벌레 X의 3. 선택 laevis의 </ EM>
- X의 흰둥이 유충을 사용하여 실험 laevis의. 야생형 동물 공 초점 / 다 광자 영상화 동안 자기 형광 발광 표시하므로 기재된 실험에 적합하지 않은 안료 채워진 melanophores을 갖는다.
- Nieuwkoop 및 페이버 (14) 후 premetamorphotic 올챙이 단계입니다. 실험 단계 45-53의 올챙이를 선택합니다.
형광 결합 된 덱스 트란 4. 일렉트로
- 페트리 접시에서 조직의 작은 조각을 놓고 (pH 7로 조정 에틸 3- 벤조 에이트 메탄) 0.02 %의 tricaine를 포함하는 물을 작은 볼륨으로 커버.
- 0.02 %의 tricaine를 포함하는 물에 올챙이를 마취. 몇 분 후 동물 이동 중지. 올챙이를 터치하여 적절한 마취를 확인합니다. 그들은 비 응답해야합니다.
- 조심스럽게 조직 덮여 페트리 접시에 마취에서 올챙이를 전송합니다.
- 반드시 목욕 ELECTR 확인ODE는 전기 회로를 닫습니다. 전극이 젖은 조직과 접촉에 있는지 확인; 올챙이에 직접 접촉 할 필요가 없습니다.
- 미세 조작기를 이용하여 후각 기관에 마이크로 피펫 팁 가까이 놓습니다.
- 피펫 팁과 후각 기관을 덮고있는 피부에 침투 조심스럽게 주 후각 상피 또는 골비 상피 세포의 중앙에 위치한 감각 신경 층으로 끝을 진행합니다.
- 감각 신경에 염료를 전송하는 데 긍정적 인 정사각형 전압 펄스를 트리거합니다. 하나의 전압 펄스를 적용 (예., 25 V, 펄스 길이 25 밀리 초) 또는 복수의 펄스에 (예., 50 V, 펄스 길이 300 마이크로 초, 200 Hz에서 400 밀리 기차 시간).
라벨의 확장 요구에 대한 최적의 전압 펄스 매개 변수를 결정합니다. 표지화 된 세포의 수를 낮추기 위해 전압 펄스 진폭, 지속 시간 및 반복 횟수를 줄인다. P의 높은 전압의 펄스 진폭, 기간 및 횟수를 적용널리 보급 된 라벨에 대한 ulses. - 실체 현미경의 형광 조명을 사용하여 트리거 펄스에 의해 성공적으로 염료 압출 및 전기를 시각화. 염료는 성공적인 전기 후 세포체와 수상 돌기로 빠르게 확산됩니다.
- 반복 올챙이의 두 번째 후각 기관에 대한 4.5-4.9 단계를 반복합니다.
- 복구를 위해 신선한 물이 가득 비커에 올챙이를 전송합니다. 약 후 5 분은 올챙이가 마취에서 깨어나 정상적인 수영 운동을 시작합니다.
- 24 시간 후 일렉트릭 염료는 감각 신경에 퍼져 결국 축삭 수송을 통해 후각 망울에 도달합니다.
세포와 축삭 프로세스의 생체 시각화 5. 설치 동물
- 0.02 %의 tricaine를 포함하는 물에 올챙이를 마취.
- 조심스럽게 예를 들어, 영상 실,에 올챙이를 전송, 작은 실리콘 고무는 올챙이 크기의 홈에 페트리 접시에 덮여있다.
- 파라 필름의 스트라이프에 작은 사각형을 잘라. 컷 아웃 창을 통해 노출 된 전방 telencephalon를 떠나, 파라 필름과 올챙이를 커버. 올챙이를 손상없이 접시에 바늘 파라 필름을 고정합니다.
- 올챙이가 0.02 %의 tricaine을 포함하는 충분한 물에 잠긴되어 있는지 확인합니다.
- 수직 광자 현미경 공 초점 현미경의 무대에서 이미징 챔버를 탑재합니다.
- 후각 망울의 이미지의 3 차원 스택을 획득. 이미지를 만드는 절차는 가능한 한 짧게하고 10 ~ 15 분을 초과하지 않도록하십시오.
- 별도의 탱크에 일반 물에 올챙이를 돌려 빛에 노출되는 것을 방지. 5 분 후, 올챙이는 마취에서 깨어.
- 반복, 지정된 시간 간격 후 5.1-5.7 단계를 예. 매일.
세포와 축삭 프로세스의 전의 VIVO 시각화 6. 설치 동물
- 다른 섹션 5프로토콜의 레이블이 감각 신경을 시각화하기 위해 절제 뇌의 준비를 사용합니다.
- 마취와 척수로의 전환에 뇌의 절개하여 올챙이를 죽일. 후각 기관, 후각 신경과 앞쪽에 telencephalon을 포함하는 조직의 블록을 절제.
- 개구리 링거 용액에 조직 블록을 전송하고 두뇌의 복부 측면을 노출 미세 가위로 결합 조직을 제거합니다.
- 촬상 챔버 조직 블록을 전송하고 나일론 스레드 현악기 백금 프레임 고칠.
- 공 초점 / 다 광자 현미경의 무대에서 이미징 챔버를 탑재합니다.
- 후각 망울의 이미지의 3 차원 스택을 획득.
7. 이미지 처리 및 데이터 평가
- 쿠페, P. 등에 의해 기술 된 바와 같이 최적화하고 이미지 품질과의 연결 구조의 시각화를 개선하기 위해 필터링을 로컬이 아닌 수단에 적용된다. 15.
참고 : 라이브 표본의 깊은 조직 층에 영상 실험의 데이터는 종종 시끄러운. - 개요에 대한 이미지 스택의 최대 강도 예측을 만듭니다.
- 시간 경과를 들어 이미징 실험은 감각 뉴런의 단일 명백하게 식별 축삭 대한 데이터 세트를 화면.
- 펭 등 알에 의해 설명 된대로 신경 프로세스의 소프트웨어를 이용한 추적을 통해 세포의 형태를 재구성. (16).
결과
설명 된 프로토콜이 성공적으로 전기 및 마취 X.의 후각 시스템의 감각 뉴런의 축삭 프로세스 생체 시각화 적용될 수있다 laevis의, 공 초점 레이저 스캐닝 또는 광자 현미경 (그림 1)를 사용하여.
전기는 형광 결합 된 덱스 트란 입력하고 빠르게 후각 기관의 세포 내부에 확산 할 수 있습니다. 이것은 전압 펄스 트리거링 후 성공적인 라벨을 확인하는 형광 조명을 적용하는 것이 도움이된다. , 전기 파라미터들에 따라 예를 들면., 피펫 저항은, 세포 (도 2A, B) 또는 후각 기관의 단셀 (도 2c)의 그룹이 표시되어있다. 표시된 감각 뉴런의 축삭은 후각 신경 (그림 2D)으로 시각화 할 수 있으며 축삭 프로세스는 성공적인 전기 후, 후각 망울도 보통 24 시간을 관찰 할 수있다(그림 3). 감각 뉴런의 그룹 일렉트로는 후각 망울 (도 3a)에서 거친 배선 패턴을 시각화 허용한다. 단세포 전기 천공은 후각 망울 (도 3C-E)에서 사구체 구조 개별 축색 돌기 패턴, 축삭 분기점 및 연결성을 조사하기 위해 적용될 수있다.
X의 투명 흰둥이 올챙이 생체 공 초점 또는 마취 올챙이의 그대로 뇌에 표시된 감각 뉴런의 광자 이미징 laevis의 허가. 동일한 표지 감각 뉴런 (도 4)의 생체 내에서 반복하여 시각화 축삭 성장 패턴의 개발은 며칠 / 주에 걸쳐 추적 될 수있다. 후각 망울의 축삭 패턴이 상당히 달라질 수 일렉트로 시점 감각 신경 세포의 성숙에 따라. 성숙한 신경 세포는 이미 술을 특징으로 정교한 축삭 가지를 가지고사구체에 연결 ED 지역. 성숙한 신경 세포의 축삭의 성장 패턴은 오히려 안정적이지만, 축삭 분기 및 사구체 터프 개선의 신장 (그림 4A-E) 관찰 할 수 있습니다. 감각 뉴런, 연장 된 시간 기간 동안 생체 내에서 관찰 할 수있다 예를 들어., 이상 3 주 이상 (도 4F-I). 한편, 미성숙 신경 축색은 터프 arborizations를 가지지 않는, 초기 성장 과정에 여전히 아직 최종 사구체 타겟에 연결되지 않았다. 실험적 프로토콜은 성숙 동안 이러한 뉴런의 발달을 추적 가능 예., 축삭 신도 분기점 터프 arborizations (도 4J-L)의 확립. 더 예를 들어도 Hassenklöver과 만지니 (12)을 참조하십시오.
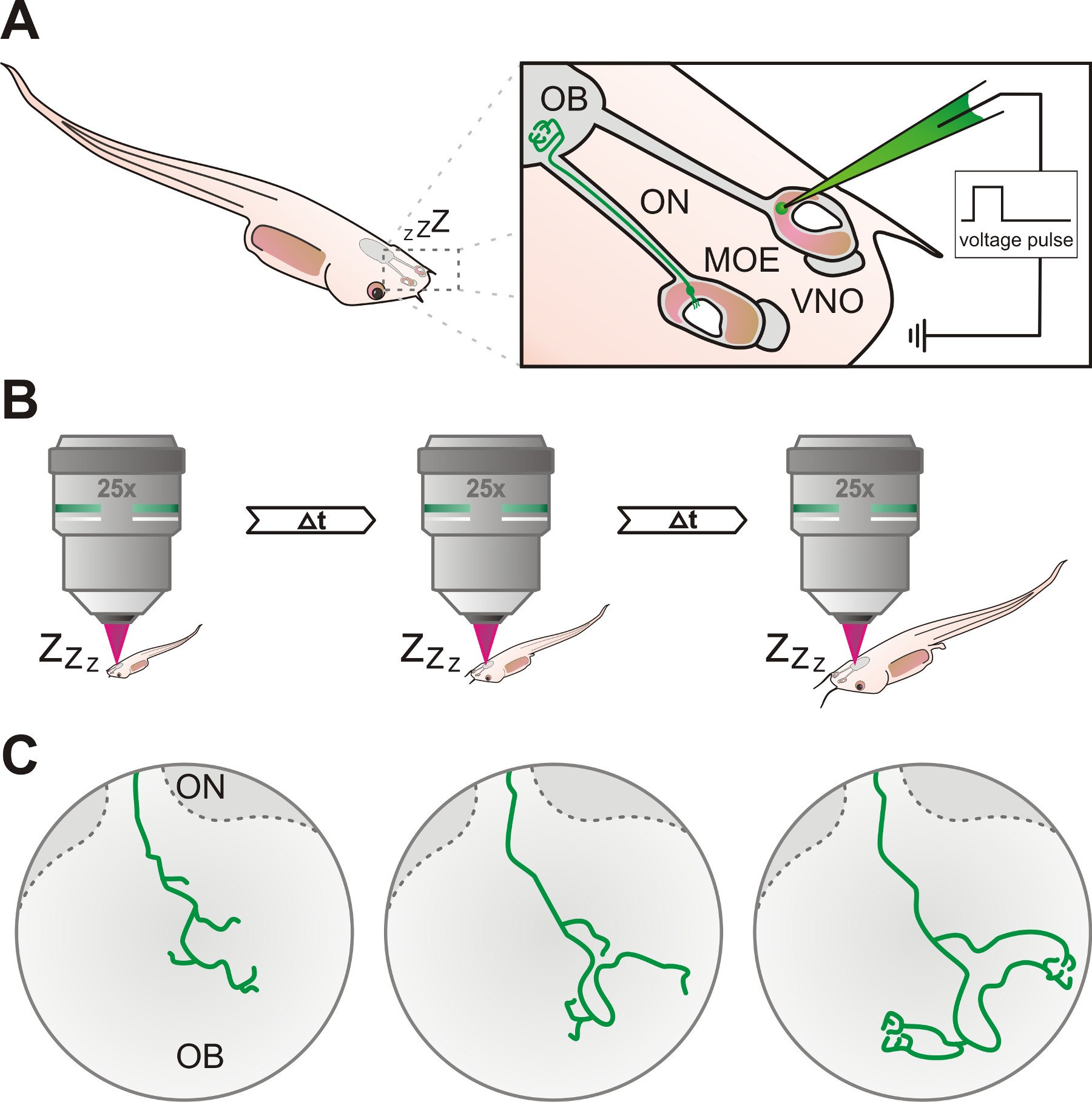
마취 X의 후각 기관의 실험 프로토콜의 그림 1. 개요도. (A) 주 후각 상피의 감각 신경 세포 (MOE) 또는 서 골비 기관 (VNO) laevis의 유충은 형광 덱스 트란 용액을 가득 유리 피펫을 사용하여 전기로 표시되어 있습니다. 표지 된 신경 세포의 축삭은 후각 신경 (ON)을 통해 다음과 결국 후각 망울 (OB)에 도달. (B) 올챙이는 마취 및 레이블 뉴런을 반복해서 특정 시간 간격으로 공 초점 또는 다 광자 현미경을 사용하여 조사 하였다 할 수있다. (C)라고 표시된 세포의 축삭의 성장 패턴의 점증 적 개발은 주 일의 시간 범위에 걸쳐 올 수 있습니다.
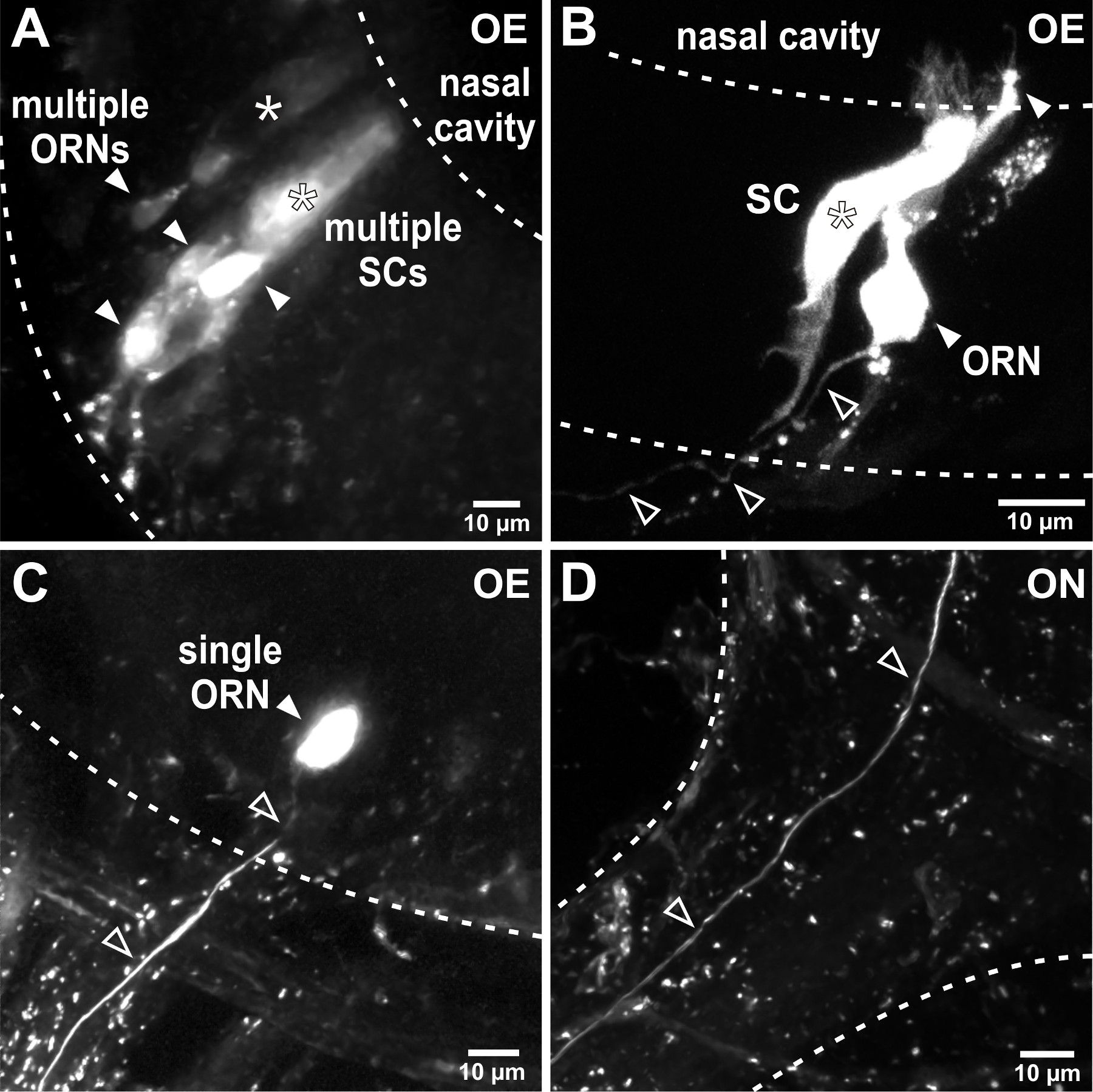
그림 2. 선거법후각 기관에서 감각 신경의 troporation. 낮은 저항 피펫으로 (A) 일렉트로는 후각 기관의 여러 세포의 라벨링에 연결됩니다. 이 대표적인 예에서 다수의 후각 수용체 뉴런 (ORNs, 작성 화살촉)와 두 개의 기둥 모양의 세포를 지원 SCS (별표) 염색 하였다. 점선은 피펫 저항을 증가, 표지화 된 세포의 수를 제한하고, 후각 상피 (OE). (B) 전기 파라미터를 정제, 예를 들면.의 경계를 구별. 이 예에서, 하나의 감각 신경 세포 (작성 화살촉)와 하나의 인접한지지 세포 (별표)는 전기 후 염색 하였다. 후각 상피 (오픈 화살촉)를 떠나 하나의 축삭을합니다. (C)을 성공적으로 단일 세포 전기 개별 감각 신경 세포 (채워진 화살표) 및 후각 상피의 연결 축삭 (오픈 화살촉)의 독점적 인 라벨로 이어집니다. (D) 단일 레이블 축삭 (오픈 화살촉)는 후각 망울로 후각 신경 (ON)을 통해 올 수 있습니다.
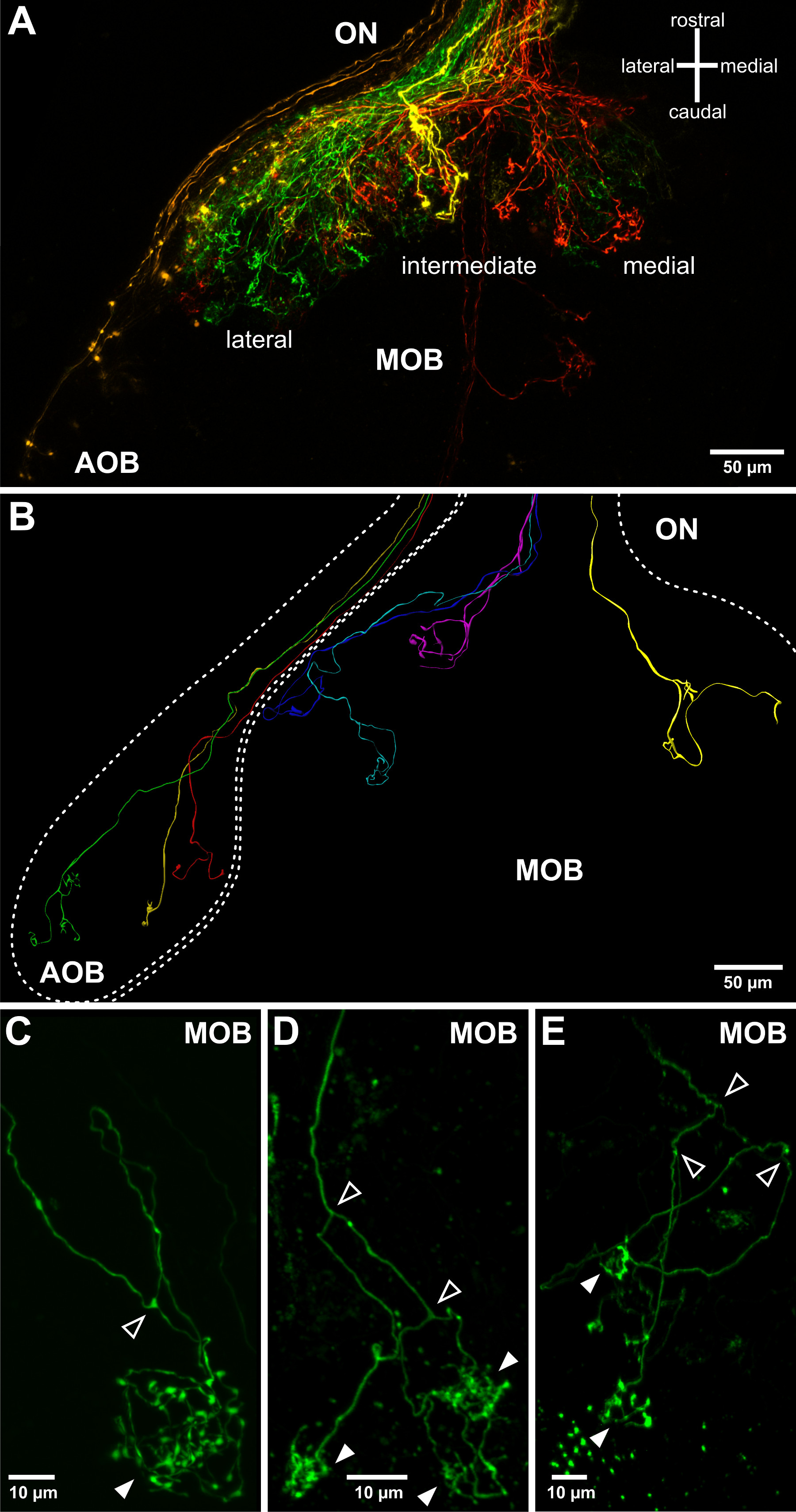
그림 3. 절제 후각 망울의 후각 축삭 돌기를 시각화. (A) 후각 망울에서 감각 신경의 축삭 돌기의 거친 토폴로지는 낮은 저항 전기 피펫을 사용하여 시각화 할 수 있습니다. 하나의 후각 망울의 반구와 관련 후각 신경 (ON)이 그려져있다. 다른 형광 물질에 결합 된 네 덱스 트란이 후각 기관의 네 먼 위치에서 일렉트로되었다 : 횡 (녹색), 중간 (노란색), 환경부 (적색)과 VNO (오렌지)를 내측. 이것은 액세서리 후각 망울 (AOB) 및 메인 후각 망울 (MOB)의 세 가지 주요 투영 필드를 시각화한다. (B) 후각 망울의 구조에 중첩 단일 후각 감각 뉴런의 다른 축삭의 성장 패턴. 묘사는 다른 애벌레 표본에서 파생 된 여러 개의 단일 세포의 염색의 3 차원 재구성을 결합됩니다. 후각 망울로 돌출 된 구형 사구체 (작성 화살촉)에서 술을 arborizations / 시냅스를 형성하는 하나의 후각 축삭 (CE) 예. X에서 그 주 후각 축삭이 (작성 화살촉이, 또한 Hassenklöver 및 만지니 12 참조) 한 개, 두 개 또는 여러 개의 사구체에 연결하기 전에 정기적으로 (오픈 화살촉을) 두 갈래 laevis의.
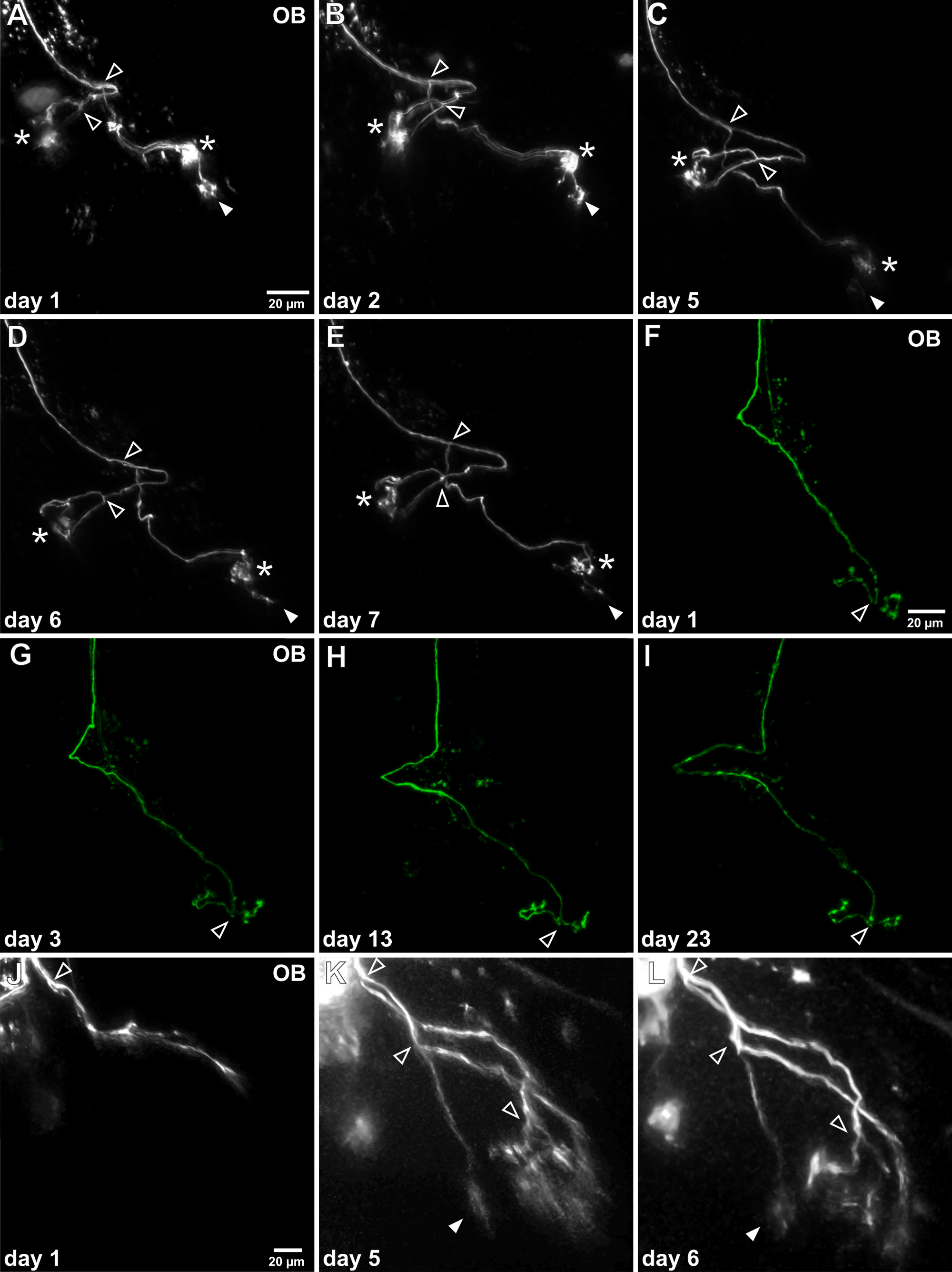
단일 후각 신경 세포의 축삭의 생체 시간 경과 영상에서 그림 4. (AE)성공적인 단일 세포 전기 후 레이블 축삭 반복 후각 망울 (OB)으로 시각화 할 수 있습니다. 이 예는 일주일 동안 조사 된 개별 축삭을 보여줍니다. 전체적인 형태는 현저하게 변경되지 않으며, 두 개의 주요 분기점 삭제 (오픈 화살촉) 식별 될 수있다. 다른 두 사구체 다발 안정 (별표)를 유지하는 반면 시간의 과정을 통해, 하나의 사구체 술이 지속적으로 감소 (채워진 화살표)를 거쳐 있습니다. (FI)이 대표적인 예는 장기적인 관찰의 가능성을 보여줍니다이 특정 축삭을 조사 하였다으로 3 주 이상합니다. 성장 패턴의 어떠한 명백한 변화가 검출 될 수 없다. (JL)은 성장 과정에서 미성숙 감각 축삭의 예가 도시된다. 그것은 아직 사구체하고 특성 사구체 깃이없는 연결되지 않았습니다. 축삭 가지가 가늘고 긴 오일 후, 축삭은 여러 번 미세 arborizations은 두 갈래로 갈라설립했다.
토론
여기에 설명 된 실험 절차 유생 X.의 후각 기관의 라벨링 감각 뉴런을 허용 형광 결합 된 덱스 트란과 살아있는 동물에서 감각 축삭의 성장 이후의 시각화의 전기에 의해 laevis의. 생체 내 전기 천공의 파라미터를 변화시킴으로써 표지화 감각 뉴런의 수를 제어 할 수있다. 그것은 거의 또는 단일 셀 감각 상피의 신경 세포의 큰 그룹 레이블을 억제 할 수있는 효과가있다.
이 마이크로 피펫 특성과 전기 펄스에 대해 특히주의하는 것이 중요하다 신경 라벨의 확장 원하는 보장합니다. 높은 피펫 저항 및 전압 펄스 진폭, 지속 시간 및 반복 횟수의 감소는 더 광범위 라벨링 이어질 수 피펫 저항 및 높은 전압 펄스 진폭, 지속 시간 및 펄스의 개수를 감소시키는 반면, 표지화 된 세포의 양을 줄일 수있다. 목전기에 대한 형광 덱스 트란의 전자 사용은 적용되는 설정이 적절한 경우에 즉각적인 시각적 피드백을 제공합니다. 주의 그 진폭, 기간 및 잠재적으로 세포 손상으로 이어질이나 사망 17 셀 수있는 프로토콜에서 제공하는 값을 초과 펄스 수에 대한 매개 변수를 사용하여. 마이크로 피펫의 막힘 또는 파손 팁도 성공적으로 전기를 방해 할 수 있습니다.
X의 후각 기관에서 생체 전기에서 postmetamorphotic 개구리의 피부는 강인하고 쉽게 마이크로 피펫으로 침투 할 수 없기 때문에 laevis의 유생 단계로 제한됩니다. 신경 프로세스 생체 가시화 깊은 뇌 영역 또는 혈관에 의해 여기 / 발광 빛의 산란에 의해 방해 될 수있다. 이 문제는 더 큰 뇌에 더 높은 유생 단계에서 특히 분명하게 미세 축삭 프로세스의 명확한 식별이 더 어려워 노이즈 신호가 발생할 수 있습니다.
제시된 프로토콜은 허가 클래스는 전체 세포 패치의 라벨처럼, 동물을 해부 라벨 동안 세포를 손상, 조직 슬라이스를 준비하거나 다른 방법에 필요한 조직을 고정하지 않고 그대로 후각 시스템의 감각 신경을 시각화 -clamp 실험 18. 생체 시간 경과 이미징 또는 몇 번의 감각 뉴런의 라벨링을 결합 할 때, 긴 시간 간격 동안 하나의 성숙한 감각 뉴런의 사구체 연결을 시각화 할 수있다. 이 방법은 여러 주 동안 미성숙 감각 뉴런의 축삭 돌기 패턴의 발전을 모니터 할 수도있다. 그것은 살아있는 동물에서 하나의 축삭의 성장 패턴을 모니터링 할 수 있습니다으로이 후자의 옵션은 특히 흥미 롭다. 이 축삭지도와 길 찾기를 제어 세포 및 분자 메커니즘을 조사 할 수있는 가능성을 엽니 다. 후각 수용체 발현을 포함하여 여러 가지 요인, 각종 AXOn 개의 안내 분자 및 후각 감각 뉴런의 유도 / 운동량은 감각 신경 축삭 4,5의 목표 발견을 조절하는 것으로 나타났다.프로토콜 어플리케이션은 후각 감각 뉴런에 한정되지 않고, 또한 예를 들어, 다른 세포 유형을 연구하기 위해 적용될 수있다., 뇌 발달 또는 후각 망울의 승모판 세포의 신경성 영역 / 전구 줄기 세포. 또한 증명 기술은 또한 신경 세포 표지 및 / 또는 연결된 회로 7,19 대한 기능적 정보를 얻을 막 투과성 칼슘 염료를 칼슘 민감성 덱스 트란과 병용하거나 주입 할 수있다. 덱스 트란에 결합 된 형광 물질의 광범위한 이용 가능성은 복수의 개별 셀 또는 다른 색 개체군 표지를 허용한다. 또한 형광 단백질 예 인코딩 DNA 용액을, 플라스미드, 전기 천공에 적합하고 더욱 versatili을 향상시킬 수있다타이 및 기술 (6)의 유용성. 프로토콜은 또한 덱스 트란 및 DNA 또는 청구 morpholinos의 결합 된 전기는 유전자 발현 (13 및 17)를 조작 할 수 있도록 향상 될 수있다.
한 방법은 확실히 복잡하고 척추 동물의 후각 시스템의 축삭 지침을 조절 아직 완전히 이해되지 프로세스를 조사 할 수있는 새로운 도구를 나타냅니다.
공개
The authors have nothing to disclose.
감사의 말
This work was supported by DFG Schwerpunktprogramm 1392 (project MA 4113/2-2), cluster of Excellence and DFG Research Center Nanoscale Microscopy and Molecular Physiology of the Brain (project B1-9), and the German Ministry of Research and Education (BMBF; project 1364480).
자료
| Name | Company | Catalog Number | Comments |
| SZX16 | Olympus | Stereomicroscope with fluorescent illumination | |
| Axon Axoporator 800A | Molecular Devices | Single cell electroporator | |
| ELP-01D | npi electronic | Electroporator | |
| MMJ | Märzhäuser Wetzlar | Manual micromanipulator | |
| P-1000 | Sutter | Horizontal micropipette puller | |
| G150F-4 | Warner Instruments | Glass capillaries for electroporation pipette fabrication; internal filament makes backfilling easier | |
| Alexa 488-dextran 10 kD | Life Technologies | D22910 | |
| Alexa 546-dextran 10 kD | Life Technologies | D22911 | |
| Alexa 568-dextran 10 kD | Life Technologies | D22912 | |
| Alexa 594-dextran 10 kD | Life Technologies | D22913 | |
| TMR-dextran 3 kD (micro-Ruby) | Life Technologies | D7162 | |
| Microloader pipette tips | Eppendorf | 930001007 | |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10521 | Anesthetic; use gloves |
| A1-MP | Nikon | Multiphoton microscope | |
| LSM 780 | Zeiss | Confocal microscope | |
| Imaris | Bitplane | Alternative software for neuronal tracing |
참고문헌
- Huard, J. M., Youngentob, S. L., Goldstein, B. J., Luskin, M. B., Schwob, J. E. Adult olfactory epithelium contains multipotent progenitors that give rise to neurons and non-neural cells. J. Comp. Neurol. 400 (4), 486-4810 (1998).
- Schwob, J. E. Neural regeneration and the peripheral olfactory system. Anat. Rec. 269 (1), 33-49 (2002).
- Leung, C. T., Coulombe, P. A., Reed, R. R. Contribution of olfactory neural stem cells to tissue maintenance and regeneration. Nat. Neurosci. 10 (6), 72-726 (2007).
- Lodovichi, C., Belluscio, L. Odorant receptors in the formation of the olfactory bulb circuitry. Physiology (Bethesda. 27 (4), 212-2110 (2012).
- Mori, K., Sakano, H. How is the olfactory map formed and interpreted in the mammalian brain). Annu. Rev. Neurosci. 34, 467-499 (2011).
- De Vry, J., et al. In vivo electroporation of the central nervous system: a non-viral approach for targeted gene delivery. Prog. Neurobiol. 92 (3), 227-244 (2010).
- Hovis, K. R., Padmanabhan, K., Urban, N. N. A simple method of in vitro electroporation allows visualization, recording, and calcium imaging of local neuronal circuits. J. Neurosci. Methods. 191 (1), 1-10 (2010).
- Chen, C., Smye, S. W., Robinson, M. P., Evans, J. A. Membrane electroporation theories: a review. Med. Biol. Eng. Comput. 44 (1-2), 5-14 (2006).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70 (4-5), 148-154 (2002).
- Hewapathirane, D. S., Haas, K. Single cell electroporation in vivo within the intact developing brain. J. Vis. Exp. (17), (2008).
- Gliem, S., et al. Bimodal processing of olfactory information in an amphibian nose: odor responses segregate into a medial and a lateral stream. Cell. Mol. Life Sci. 70 (11), 1965-1984 (2013).
- Hassenklöver, T., Manzini, I. Olfactory wiring logic in amphibians challenges the basic assumptions of the unbranched axon concept. J. Neurosci. 33 (44), 17252-1710 (2013).
- Bestman, J. E., Ewald, R. C., Chiu, S. -. L., Cline, H. T. In vivo single-cell electroporation for transfer of DNA and macromolecules. Nat. Protoc. 1 (3), 1272-1210 (2006).
- Nieuwkoop, P. D., Faber, J., Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis. , (1994).
- Coupé, P., Munz, M., Manjón, J. V., Ruthazer, E. S., Collins, D. L. A CANDLE for a deeper in vivo insight. Med. Image Anal. 16 (4), 849-864 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nat. Biotechnol. 28 (4), 348-353 (2010).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7 (107), (2007).
- Nezlin, L. P., Schild, D. Individual olfactory sensory neurons project into more than one glomerulus in Xenopus laevis tadpole olfactory bulb. J. Comp. Neurol. 481 (3), 233-239 (2005).
- Nagayama, S., et al. In vivo simultaneous tracing and Ca2+ imaging of local neuronal circuits. Neuron. 53 (6), 789-803 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유