Method Article
El sistema olfativo como un modelo para estudiar los patrones de crecimiento axonal y Morfología
En este artículo
Resumen
We describe a protocol for in vivo labeling of olfactory sensory neurons by electroporation and subsequent confocal laser-scanning or multiphoton microscopy to visualize neuronal morphology and its development over time.
Resumen
The olfactory system has the unusual capacity to generate new neurons throughout the lifetime of an organism. Olfactory stem cells in the basal portion of the olfactory epithelium continuously give rise to new sensory neurons that extend their axons into the olfactory bulb, where they face the challenge to integrate into existing circuitry. Because of this particular feature, the olfactory system represents a unique opportunity to monitor axonal wiring and guidance, and to investigate synapse formation. Here we describe a procedure for in vivo labeling of sensory neurons and subsequent visualization of axons in the olfactory system of larvae of the amphibian Xenopus laevis. To stain sensory neurons in the olfactory organ we adopt the electroporation technique. In vivo electroporation is an established technique for delivering fluorophore-coupled dextrans or other macromolecules into living cells. Stained sensory neurons and their axonal processes can then be monitored in the living animal either using confocal laser-scanning or multiphoton microscopy. By reducing the number of labeled cells to few or single cells per animal, single axons can be tracked into the olfactory bulb and their morphological changes can be monitored over weeks by conducting series of in vivo time lapse imaging experiments. While the described protocol exemplifies the labeling and monitoring of olfactory sensory neurons, it can also be adopted to other cell types within the olfactory and other systems.
Introducción
The lifelong turnover of sensory neurons distinguishes the olfactory system from many other sensory and neuronal systems1,2. Newly formed sensory neurons are continuously generated in the basal portion of the olfactory epithelium3 and extend their axons into the olfactory bulb, the first relay station of the olfactory system4. However, the cellular and molecular mechanisms controlling the formation and maintenance of the olfactory map are far from being fully understood4,5.
Here, we describe a protocol for labeling sensory neurons of the olfactory organ of larval X. laevis by in vivo electroporation of fluorophore-coupled dextrans. The presented protocol allows visualization of axonal morphology and connectivity, track axonal development over time and study mechanisms regulating axonal wiring and guidance.
Electroporation is a well established method to introduce charged macromolecules, like dextran-coupled dyes and DNA, into cells6,7. The cell membrane is permeabilized by application of short voltage pulses and the molecules are electrophoretically delivered into the cytosol8. Spatially restricted electroporation using a micropipette permits selective labeling of cells including neurons and has been applied in various neuronal systems including the visual system of X. laevis9,10.
We show how the electroporated animals can be used to study axonal growth patterns and morphology in living animals using confocal laser-scanning or multiphoton microscopy. The described procedure allows identifying the coarse topology of axonal projections of sensory neurons of the main and accessory olfactory system11,12. Using in vivo time lapse imaging, it is also suitable to supervise the glomerular connections of single mature sensory neurons, and to monitor the evolution of the axonal projection patterns of immature sensory neurons12. The described protocol can be applied to investigate the structure and formation of olfactory circuits in the intact animal and can be adapted to other cell types within the olfactory and other neuronal systems.
Protocolo
NOTA: Manejo de animales y los experimentos se llevaron a cabo tal como fue aprobado por el Comité de la Universidad de Göttingen para la Ética en la Experimentación Animal.
1. Preparación de Instrumentos y pipeta Fabricación
- Asegúrese de que la configuración de la electroporación consiste en un estereomicroscopio con una gran distancia de trabajo y está equipado con iluminación y conjuntos de filtros fluorescentes para el colorante utilizado.
- Para la electroporación utilizar un electroporador sola célula dedicado o un generador de pulso cuadrado genérico conectado a un osciloscopio. Conecte las salidas electroporador a un soporte de pipetas y un electrodo de baño. Conectar el terminal positivo del generador de impulsos a la titular de la micropipeta y el terminal negativo al electrodo de baño. Asegurar tanto el soporte de pipeta y el electrodo de baño contienen alambres de plata recubiertas con una fina capa de cloruro de plata.
- Monte el soporte de la pipeta en un micromanipulador para permitir un posicionamiento exacto.
- Fabrique micropipetas de electroporación de capilares de vidrio borosilicato con filamento interno.
- Use un extractor de micropipeta horizontal y aplicar un protocolo modificado para la fabricación de pipetas para experimentos de patch clamp como se describe por Bestman et al. 13.
- Adaptar los parámetros para producir una caña más larga y una abertura de la punta más pequeña que resulta en una resistencia superior de la pipeta de alrededor de 15 a 20 MOhm para electroporación sola célula. La resistencia de la pipeta debe ser inferior, por ejemplo, 3-4 MOhm, para el etiquetado de los grupos de células.
- Medir la resistencia de la pipeta ya sea directamente con un electroporador de una sola célula dedicada o calcularla con la Ley de Ohm después de medir el flujo de corriente con un osciloscopio después de la aplicación de un pulso de voltaje definido.
2. Preparación de la solución de electroporación
- Disolver dextrano fluoróforo acoplado en el timbre de la rana (98 mM NaCl, 2 mM KCl, CaCl2 1 mM, 2 mM MgC2 l, glucosa 5 mM, 5 mM Na-piruvato, 10 mM HEPES, ajustado a pH 7,8, la osmolaridad era de 230 mOsmol / l) a una concentración de 3 mM. Las células pueden no ser tan brillantemente etiquetados si se utilizan concentraciones de colorante inferiores. Preparar una solución de gran volumen de existencias y dividirla en pequeñas alícuotas. Congelarlos para el almacenamiento (estable durante meses).
NOTA: Los dextranos están disponibles en diferentes tamaños y una variedad de emisión / espectros de excitación (por ejemplo, Alexa 488-dextrano 10 kD, Alexa 546-dextrano 10 kD, Alexa 568-dextrano 10 kD, Alexa 594-dextrano 10 kD, TMR-dextrano 3 kD.). - Rellene la micropipeta con una punta de pipeta alargada con un pequeño volumen de solución de dextrano (1-5 l). Flick cuidadosamente la micropipeta con el dedo para eliminar las burbujas de aire residuales de la punta de la pipeta.
- Monte la micropipeta en el soporte de la pipeta. Asegúrese de que el alambre de plata dentro de la pipeta está en contacto con la solución de colorante.
3. Selección de larvas X. laevis </ Em>
- Utilice larvas albino de X. laevis para los experimentos. El tipo de animales salvajes poseen melanóforos pigmento llena que muestran emisión de autofluorescencia en imagen confocal / multifotónica y por lo tanto no son adecuados para los experimentos descritos.
- Etapa renacuajos premetamorphotic después de Nieuwkoop y Faber 14. Seleccione los renacuajos de las etapas 45 a 53 para los experimentos.
4. Electroporación de dextranos acoplados fluoróforo
- Coloque un pequeño pedazo de tejido en una placa de Petri y se cubre con un pequeño volumen de agua que contiene 0,02% tricaína (etil metanosulfonato 3-aminobenzoato, ajustado a pH 7).
- Anestesiar los renacuajos en el agua que contienen 0,02% tricaína. Después de algunos minutos, los animales dejan de moverse. Confirme la anestesia adecuada tocando renacuajos. Deben ser no responde.
- Transferir cuidadosamente el renacuajo de la anestesia a la cubierta de tejido placa de Petri.
- Asegúrese de que el coc bañooda cierra el circuito de la electroporación. Asegúrese de que el electrodo está en contacto con el tejido húmedo; un contacto directo con el renacuajo no es necesario.
- Coloque la punta de la micropipeta cerca del órgano olfativo utilizando el micromanipulador.
- Penetran en la piel que cubre el órgano olfativo con la punta de pipeta y cautelosamente avanzar la punta en la capa de neurona sensorial situado en el centro de la epitelio olfativo principal o epitelio vomeronasal.
- Dispare impulsos de tensión cuadrada positiva para transferir líquido de contraste en las neuronas sensoriales. Aplicar un pulso de tensión (por ejemplo., 25 V, longitud de pulso de 25 ms) o trenes de pulsos múltiples (por ejemplo., 50 V, longitud de pulso de 300 microsegundos, 400 duración de tren ms a 200 Hz).
NOTA: Determinar los parámetros del pulso de tensión óptimas para el que desee ampliar de etiquetado. Reducir la amplitud del pulso de voltaje, duración y el número de repeticiones para reducir el número de células marcadas. Aplicar mayor amplitud de pulso de voltaje, duración y número de pulses para un etiquetado más generalizada. - Visualice extrusión tinte éxito y la electroporación por impulsos desencadenados utilizando iluminación fluorescente del microscopio estereoscópico. El tinte se propaga rápidamente en el cuerpo celular y las dendritas después de la electroporación éxito.
- Repita los pasos 4.5 a 4.9 para el segundo órgano olfativo del renacuajo.
- Transferir el renacuajo en un vaso lleno de agua fresca para la recuperación. Después de ca. 5 min de los renacuajos se despiertan de la anestesia y comienzan los movimientos normales de natación.
- Después de 24 horas el medio de contraste a electroporación se propaga en las neuronas sensoriales y, finalmente, llega al bulbo olfativo a través del transporte axonal.
5. Los animales de montaje para En Vivo visualización de las células y axones
- Anestesiar los renacuajos en el agua que contienen 0,02% tricaína.
- Transferir cuidadosamente renacuajos en una cámara de formación de imágenes, por ejemplo, una pequeña cubierta de caucho de silicona placa de Petri con un receso de renacuajo tamaño.
- Corte un pequeño rectángulo en una franja de Parafilm. Cubrir el renacuajo con el Parafilm, dejando el telencéfalo anterior expuesta a través de la ventana de corte. Fijar el Parafilm con agujas en el plato sin dañar el renacuajo.
- Asegúrese de que el renacuajo se sumerge en el agua suficiente que contiene 0,02% tricaína.
- Monte la cámara de imágenes en el escenario de un microscopio multifotónica en posición vertical o un microscopio confocal.
- Adquirir una pila de tres dimensiones de imágenes de la bulbo olfatorio. Asegúrese de que el procedimiento de formación de imágenes es lo más corta posible y no excede de 10-15 min.
- Devolver el renacuajo en agua normal en un tanque separado y evitar la exposición a la luz. Después de 5 min, el renacuajo se despierta de la anestesia.
- Repita los pasos 5.1 a 5.7 después de intervalos de tiempo especificados, por ejemplo., Todos los días.
6. Los animales de montaje para Ex Vivo visualización de las células y axones
- Como alternativa a la sección 5del protocolo, utilizar una preparación de cerebro extirpado para visualizar las neuronas sensoriales etiquetados.
- Anestesiar y matar al renacuajo por la transección del cerebro en la transición a la médula espinal. Escindir un bloque de tejido que contiene los órganos olfatorios, los nervios olfatorios y el telencéfalo anterior.
- Transferir el bloque de tejido a la solución del timbre de la rana y eliminar el tejido conectivo con tijeras finas para exponer la parte ventral del cerebro.
- Transferir el bloque de tejido a una cámara de imágenes y fijarla con un marco de platino cuerdas con hilos de nylon.
- Monte la cámara de imágenes en el escenario de un microscopio confocal / multifotónica.
- Adquirir una pila de tres dimensiones de imágenes de la bulbo olfatorio.
7. Procesamiento de Imágenes y Evaluación de Datos
- Optimizar y medios no locales de filtrado para mejorar la calidad de la imagen y la visualización de las estructuras neuronales como se describe por Coupé, P. et al. 15.
NOTA: Los datos de los experimentos de imagen en capas de tejido más profundas de especímenes vivos son a menudo ruidoso. - Crear proyecciones de máxima intensidad de las pilas de imagen para una visión general.
- Por lapso de tiempo la pantalla experimentos de imagen de los conjuntos de datos individuales axones inequívocamente identificables de las neuronas sensoriales.
- Reconstruir la morfología celular a través del software asistida por el rastreo de los procesos neuronales como se describe por Peng et al. 16.
Resultados
El protocolo descrito puede aplicarse con éxito para la electroporación y la visualización en vivo de los procesos axonales de las neuronas sensoriales del sistema olfativo de X. anestesiado laevis, usando confocal láser de barrido o microscopía multifotónica (Figura 1).
La electroporación permite dextranos fluoróforo acoplado a entrar y se extendieron rápidamente dentro de las células del órgano olfativo. Es útil aplicar iluminación fluorescente para verificar etiquetado con éxito después de la activación de pulsos de voltaje. Dependiendo de los parámetros de electroporación, por ejemplo., Resistencia a la pipeta, grupos de células (Figura 2A, B) o células individuales (Figura 2C) del órgano olfativo están etiquetados. Los axones de las neuronas sensoriales etiquetados pueden ser visualizados en el nervio olfatorio (Figura 2D) y los procesos axonales se pueden observar también en el bulbo olfatorio, generalmente 24 horas después de la electroporación con éxito(Figura 3). Electroporación de grupos de neuronas sensoriales permite visualizar los patrones de cableado gruesos en el bulbo olfatorio (Figura 3A). Electroporación de células individuales se puede aplicar para investigar los patrones individuales de proyección axonal, bifurcaciones axonal y la conectividad a las estructuras glomerulares en el bulbo olfatorio (Figura 3C-E).
Renacuajos albinos transparentes de X. permiso laevis en confocal in vivo o formación de imágenes multifotónica de las neuronas sensoriales marcadas en el cerebro intacto de renacuajo anestesiado. El desarrollo de los patrones de crecimiento axonal se puede seguir durante varios días / semana por repetido en la visualización in vivo de la misma neurona sensorial marcado (Figura 4). Dependiendo de la madurez de la neurona sensorial en el punto de tiempo de la electroporación el patrón axonal en el bulbo olfatorio puede variar considerablemente. Neuronas maduras ya poseen ramas axonales elaborados que cuentan con penachoáreas ed conectados a glomérulos. El patrón de crecimiento axonal de las neuronas maduras es bastante estable, pero la elongación de las ramas de los axones y refinamientos de mechones glomerulares son observables (Figura 4A-E). Las neuronas sensoriales pueden observarse in vivo durante períodos de tiempo prolongados, por ejemplo., Más de tres semanas (Figura 4F-I). Por otro lado, los axones de las neuronas inmaduras se encuentran todavía en el proceso de crecimiento inicial, no poseen arborizaciones con pelo insertado y aún no se han conectado a sus objetivos glomerulares finales. El protocolo experimental permite el seguimiento del desarrollo de estas neuronas durante la maduración, por ejemplo., El alargamiento del axón, bifurcaciones y el establecimiento de arborizaciones mechón insertado (Figura 4J-L). Para más ejemplos, vea también Hassenklöver y Manzini 12.
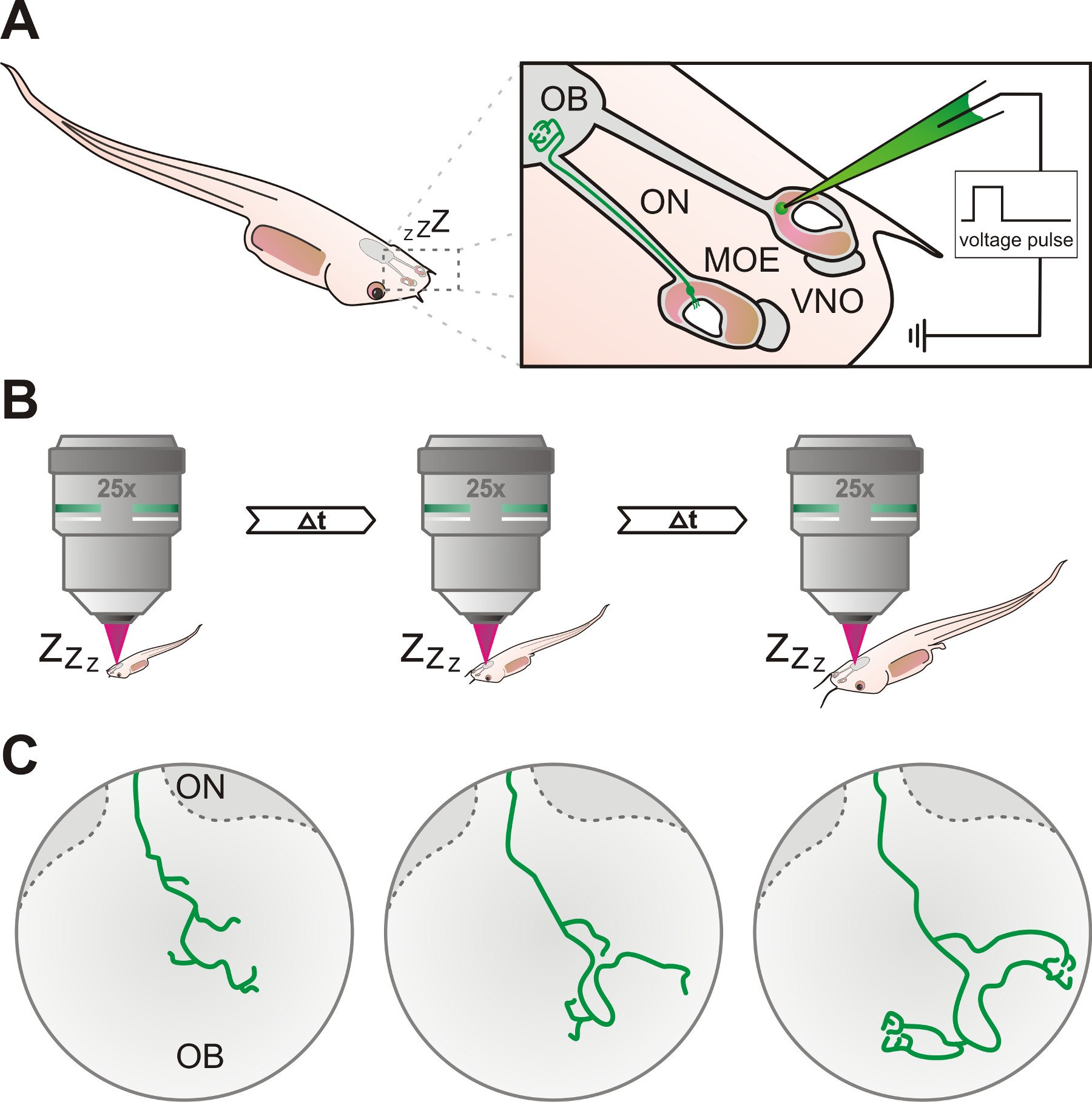
Figura 1. Esquema general del protocolo experimental. (A) las neuronas sensoriales en el epitelio olfativo principal (MOE) u órgano vomeronasal (OVN) del órgano olfativo de X. anestesiado larvas laevis se etiquetan mediante electroporación utilizando una pipeta de vidrio lleno de solución de dextrano fluorescente. Los axones de neuronas marcadas se pueden seguir a través del nervio olfatorio (ON) y, finalmente, alcanzan el bulbo olfatorio (OB). (B) El renacuajo se anestesiaron y las neuronas marcadas se investigaron varias veces utilizando un microscopio confocal multifotónica o en intervalos de tiempo específicos. (C) El desarrollo incremental de patrones de crecimiento axonal de las células marcadas se puede seguir a través de períodos de tiempo de días a semanas.
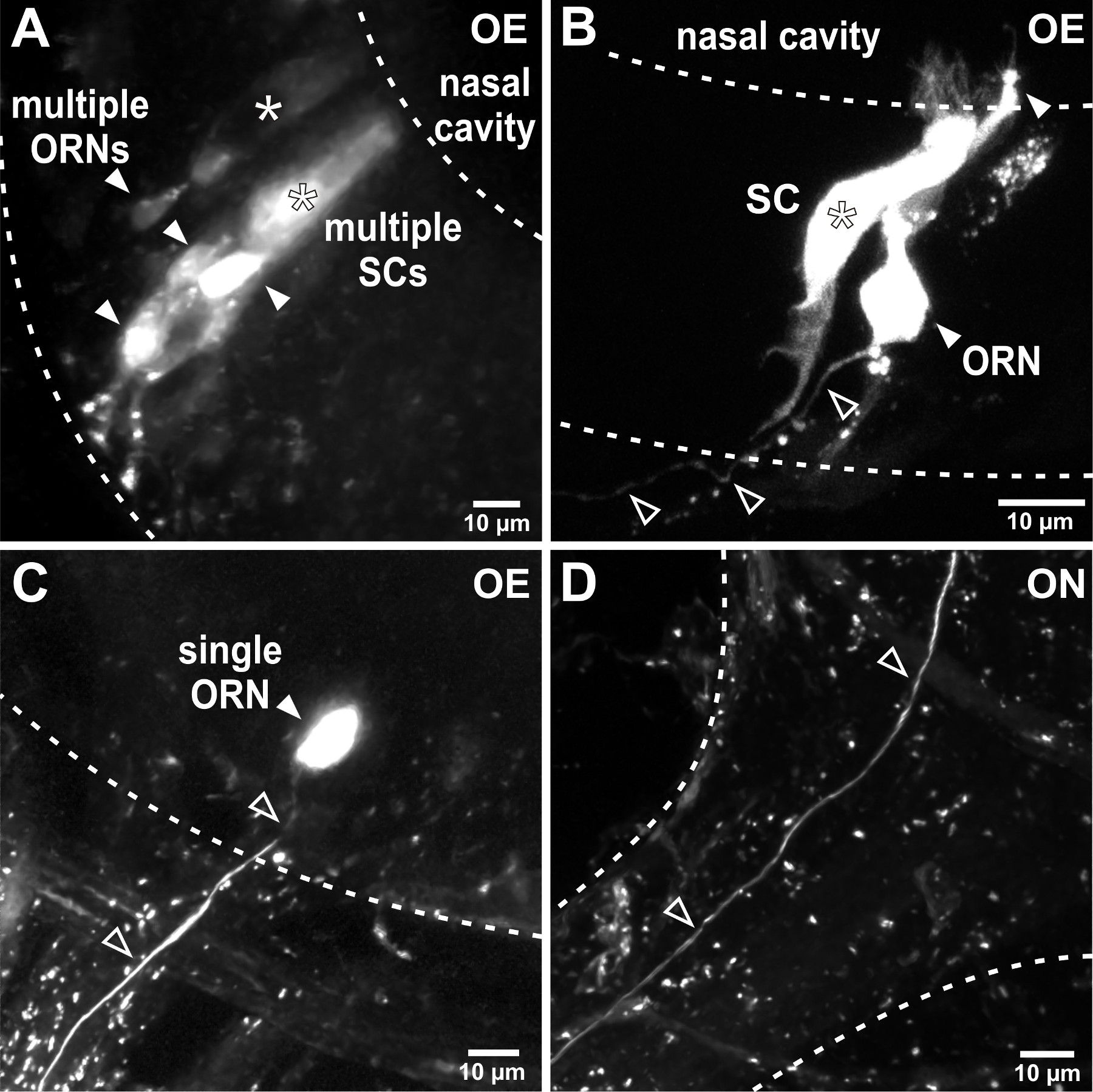
Figura 2. Electroporation de las neuronas sensoriales en el órgano olfativo. (A) La electroporación con pipetas de baja resistencia conduce a etiquetado de múltiples células en el órgano olfativo. En este ejemplo representativo se tiñeron múltiples neuronas receptoras olfativas (ORNs, puntas de flecha rellenos) y dos células en forma de columna de soporte (SC, asteriscos). Las líneas discontinuas demarcan las fronteras del epitelio olfatorio (OE). (B) Perfeccionamiento de los parámetros de electroporación, por ejemplo., El aumento de la resistencia a la pipeta, restringe el número de células marcadas. En este ejemplo, una sola neurona sensorial (puntas de flecha llenas) y uno adyacente de soporte celular (asterisco) se tiñeron después de la electroporación. Tenga en cuenta el solo axón dejando el epitelio olfativo (puntas de flecha abiertas). (C) El éxito de la electroporación de células individuales conduce a etiquetado exclusiva de una neurona individual sensorial (punta de flecha llena) y su axón conectado (puntas de flecha abiertas) en el epitelio olfativo. (D) El axón de marcaje único (puntas de flecha abiertas) se puede seguir a través del nervio olfatorio (ON) en el bulbo olfativo.
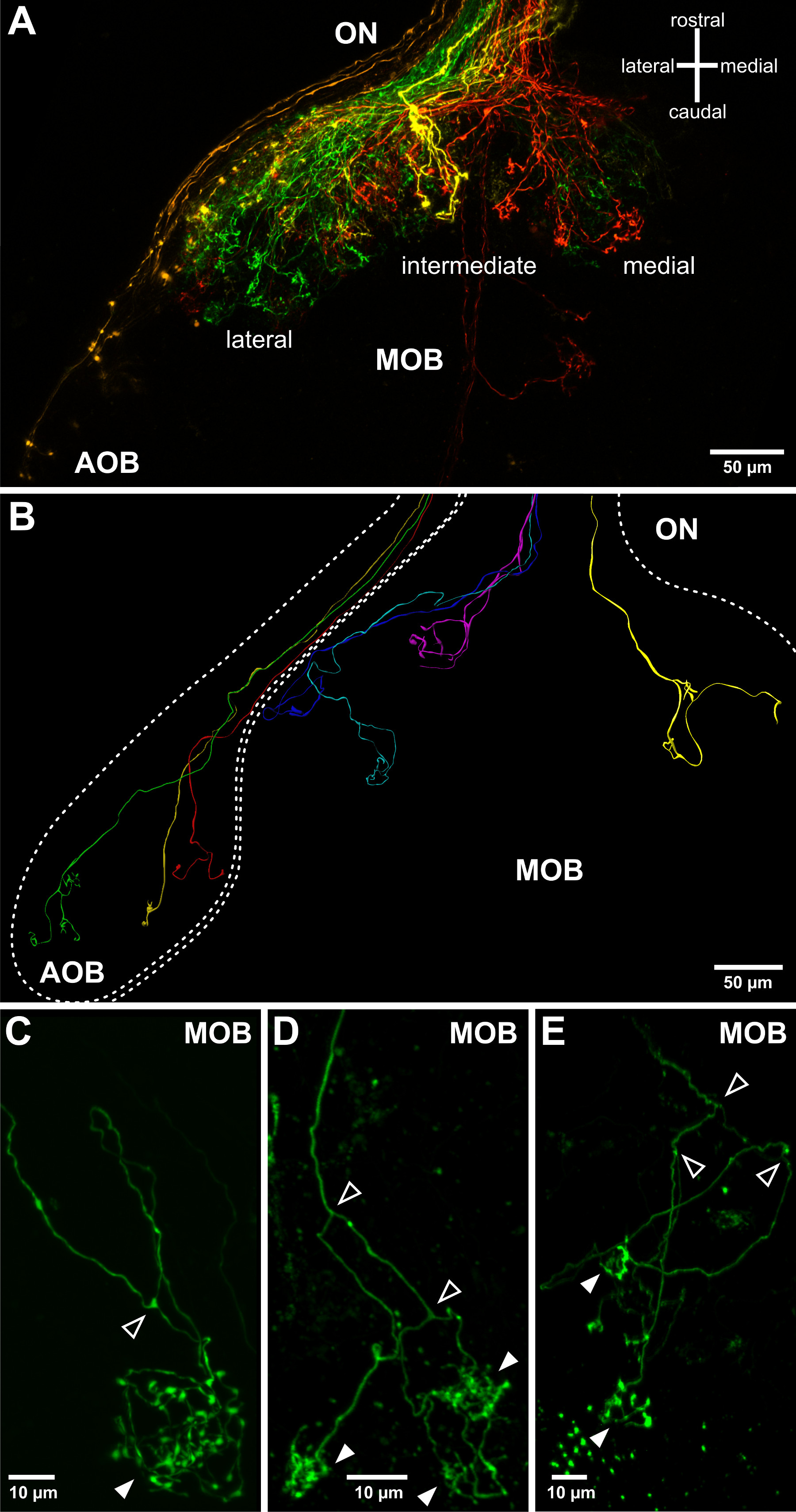
Figura 3. Visualización de las proyecciones de los axones olfativos en el bulbo olfatorio extirpado. (A) La topología grueso de las proyecciones axonales de las neuronas sensoriales en el bulbo olfativo puede ser visualizado utilizando pipetas de electroporación más bajos de resistencia. Un hemisferio bulbo olfatorio y su nervio olfatorio asociado (ON) se representan. Cuatro dextranos acoplados a diferentes fluoróforos se sometieron a electroporación en cuatro lugares distantes del órgano olfativo: lateral (verde), medio (amarillo), medial MOE (rojo) y el OVN (naranja). Esto permite visualizar el bulbo olfativo accesorio (AOB) y los tres campos principales de proyección del bulbo olfatorio principal (MOB). (B) Diferentes patrones de crecimiento axonal de las neuronas sensoriales olfativas individuales superpuestas en la estructura del bulbo olfatorio. Representado se combinan tres reconstrucciones tridimensionales de múltiples tinciones de células individuales derivados de diferentes muestras de larvas. (CE) Ejemplos de axones olfativos individuales que sobresalen en el bulbo olfativo y que forman arborizaciones mechón insertado / sinapsis en los glomérulos esférica (puntas de flecha rellenas). Nótese que en X. laevis axones olfativos bifurcan regularmente (puntas de flecha en blanco) antes de conectar a una, dos o múltiples glomérulos (puntas de flecha llenos, también ven Hassenklöver y Manzini 12).
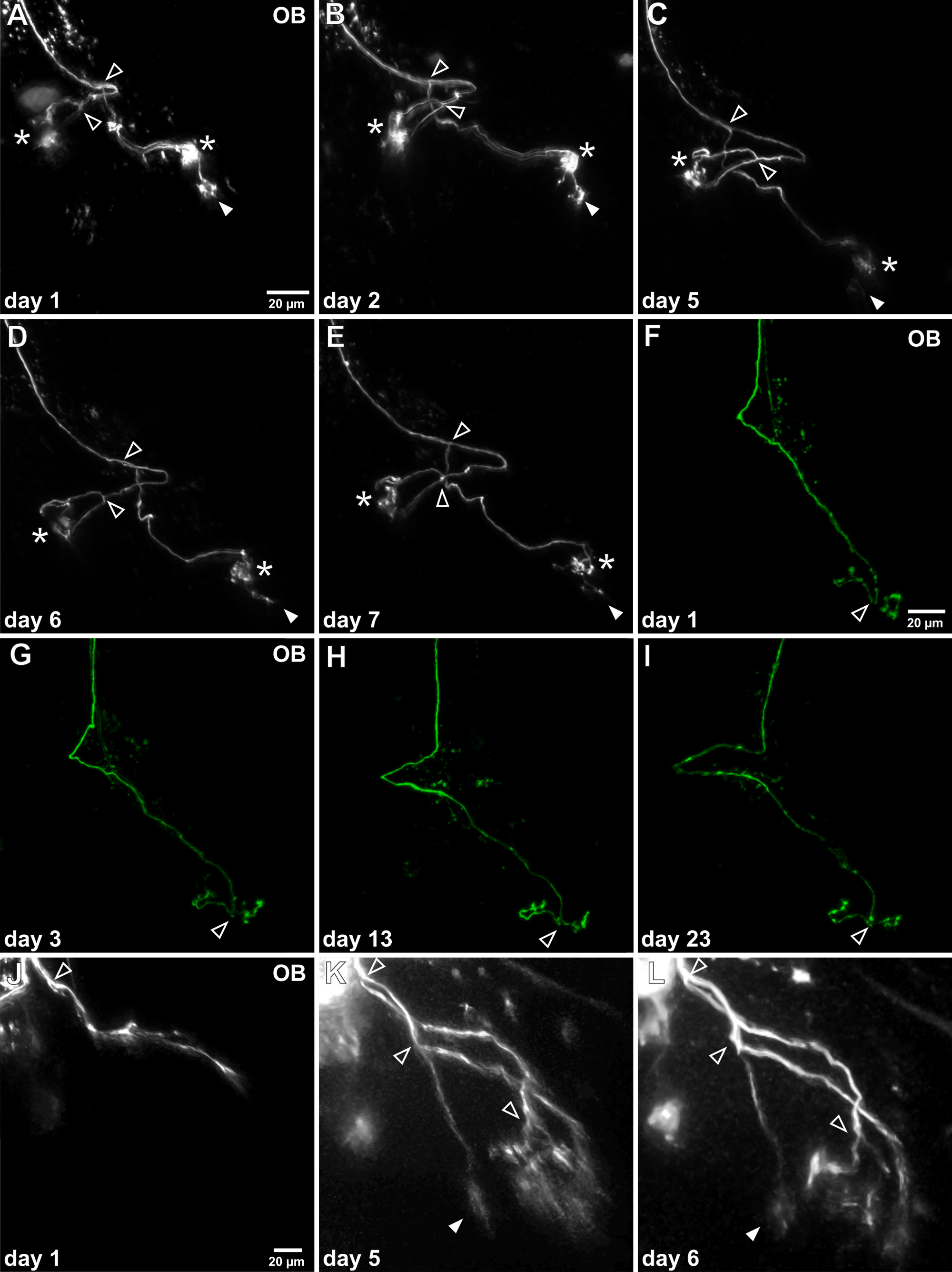
Figura 4. En vivo de imágenes de lapso de tiempo de los axones de las neuronas individuales olfativo. (AE)Después de la electroporación de células individuales éxito el axón marcado puede ser visualizado en repetidas ocasiones en el bulbo olfatorio (OB). Este ejemplo muestra un axón individuo que fue investigado durante una semana. La morfología general no cambia considerablemente y dos importantes puntos de ramificación puede ser identificado (puntas de flecha abierta). Tenga en cuenta que en el transcurso del tiempo, un penacho glomerular sufre reducción continua (punta de flecha llena), mientras que los otros dos mechones glomerulares permanecen estables (asteriscos). (FI) Este ejemplo muestra representativa de la viabilidad de las observaciones a largo plazo, ya que esto axón específica fue investigado durante más de tres semanas. No aparente cambio de su patrón de crecimiento puede ser detectado. (JL) Un ejemplo de un axón sensorial inmaduros en el proceso de crecimiento se representa. Todavía no se ha conectado a los glomérulos y mechones glomerulares característicos están desaparecidos. Después de 5 días las ramas axonales son alargadas, el axón bifurcado en múltiples ocasiones y arborizaciones finos sonestablecida.
Discusión
El procedimiento experimental descrito aquí permite etiquetado neuronas sensoriales del órgano olfativo de X. larval laevis por electroporación de dextranos fluoróforo acoplado y la posterior visualización de crecimiento axonal sensorial en el animal vivo. Mediante la variación de los parámetros de la electroporación in vivo es posible controlar el número de neuronas sensoriales etiquetados. Es por lo tanto posible etiquetar grandes grupos de neuronas de un epitelio sensorial, muy pocos o incluso células individuales.
Para asegurar la deseada extensión de etiquetado neuronal es importante ser particularmente cauteloso sobre las características de micropipeta y los pulsos de electroporación. Resistencias más altas de pipeta y la reducción de la amplitud de pulso de voltaje, duración y número de repeticiones pueden reducir la cantidad de células marcadas, mientras que la disminución de las resistencias de las pipetas y una mayor amplitud de pulso de voltaje, duración y número de pulsos puede conducir a un etiquetado más generalizada. The uso de dextranos fluorescentes para la electroporación proporciona retroalimentación visual inmediata si los ajustes aplicados son apropiados. Tenga cuidado de que el uso de parámetros de amplitud, duración y número de pulsos que exceden los valores previstos en el protocolo puede potencialmente conducir a daño celular o incluso la muerte celular 17. Consejos obstruidos o rotos de micropipetas también pueden dificultar la electroporación éxito.
En electroporación in vivo en el órgano olfativo de X. laevis se limita a estadios larvarios ya que la piel de ranas postmetamorphotic es más dura y no puede ser fácilmente penetrado con una micropipeta. La visualización en vivo de los procesos neuronales puede verse obstaculizado por la dispersión de la luz de excitación / emisión en las zonas más profundas del cerebro o por los vasos sanguíneos. Este problema se hace especialmente evidente en estadios larvarios más altos debido a un cerebro más grande y puede dar lugar a señales ruidosas haciendo la clara identificación de los procesos axonales finas más difícil.
jove_content permisos El protocolo presentado para visualizar las neuronas sensoriales en el sistema olfatorio intacto sin disección del animal, dañando las células durante el etiquetado, preparación de cortes de tejido o la fijación del tejido que sea necesario para los métodos alternativos, como el etiquetado en el parche de células enteras experimentos -clamp 18. Cuando se combinan el etiquetado de los pocos o individuales con las neuronas sensoriales en vivo de imágenes de lapso de tiempo, es posible visualizar las conexiones glomerulares de las neuronas sensoriales maduros individuales durante intervalos de tiempo largos. De esta manera también es posible monitorizar el desarrollo de los patrones de proyección axonal de las neuronas sensoriales inmaduros durante varias semanas. Esta última opción es particularmente interesante ya que permite el seguimiento de los patrones de crecimiento de los axones individuales en el animal vivo. Esto abre la posibilidad de investigar los mecanismos celulares y moleculares que controlan la orientación axón y búsqueda de caminos. Varios factores, incluyendo la expresión del receptor odorante, varios Axomoléculas de orientación y n / actividad espontánea olor inducida de las neuronas sensoriales han sido demostrado que regulan el hallazgo de destino de los axones de las neuronas sensoriales 4,5.La aplicación del protocolo no se limita a las neuronas sensoriales olfativas, pero también se puede aplicar para estudiar otros tipos de células, por ejemplo., Las células madre / progenitoras de las zonas neurogénicos del cerebro en desarrollo o las células mitrales del bulbo olfativo. Además, la técnica mostrada también se puede utilizar en combinación con dextranos de calcio sensibles o se inyecta colorantes de calcio de membrana permeable para obtener información funcional sobre la neurona marcado y / o el sistema de circuitos conectado 7,19. La disponibilidad de una amplia gama de fluoróforos acoplados a dextranos permite el etiquetado de múltiples células individuales o poblaciones con diferentes colores. También plásmido solución de ADN, por ejemplo de codificación para las proteínas fluorescentes, es adecuado para la electroporación y se puede mejorar aún más la versatiliTy y utilidad de la técnica 6. El protocolo puede ser mejorado aún más para permitir que la electroporación combinada de dextranos y ADN o morfolinos cargadas para manipular la expresión génica 13,17.
El método descrito sin duda representa una nueva herramienta para investigar la compleja y procesos aún no se entiende completamente que regulan la guía axonal en el sistema olfativo de los vertebrados.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported by DFG Schwerpunktprogramm 1392 (project MA 4113/2-2), cluster of Excellence and DFG Research Center Nanoscale Microscopy and Molecular Physiology of the Brain (project B1-9), and the German Ministry of Research and Education (BMBF; project 1364480).
Materiales
| Name | Company | Catalog Number | Comments |
| SZX16 | Olympus | Stereomicroscope with fluorescent illumination | |
| Axon Axoporator 800A | Molecular Devices | Single cell electroporator | |
| ELP-01D | npi electronic | Electroporator | |
| MMJ | Märzhäuser Wetzlar | Manual micromanipulator | |
| P-1000 | Sutter | Horizontal micropipette puller | |
| G150F-4 | Warner Instruments | Glass capillaries for electroporation pipette fabrication; internal filament makes backfilling easier | |
| Alexa 488-dextran 10 kD | Life Technologies | D22910 | |
| Alexa 546-dextran 10 kD | Life Technologies | D22911 | |
| Alexa 568-dextran 10 kD | Life Technologies | D22912 | |
| Alexa 594-dextran 10 kD | Life Technologies | D22913 | |
| TMR-dextran 3 kD (micro-Ruby) | Life Technologies | D7162 | |
| Microloader pipette tips | Eppendorf | 930001007 | |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10521 | Anesthetic; use gloves |
| A1-MP | Nikon | Multiphoton microscope | |
| LSM 780 | Zeiss | Confocal microscope | |
| Imaris | Bitplane | Alternative software for neuronal tracing |
Referencias
- Huard, J. M., Youngentob, S. L., Goldstein, B. J., Luskin, M. B., Schwob, J. E. Adult olfactory epithelium contains multipotent progenitors that give rise to neurons and non-neural cells. J. Comp. Neurol. 400 (4), 486-4810 (1998).
- Schwob, J. E. Neural regeneration and the peripheral olfactory system. Anat. Rec. 269 (1), 33-49 (2002).
- Leung, C. T., Coulombe, P. A., Reed, R. R. Contribution of olfactory neural stem cells to tissue maintenance and regeneration. Nat. Neurosci. 10 (6), 72-726 (2007).
- Lodovichi, C., Belluscio, L. Odorant receptors in the formation of the olfactory bulb circuitry. Physiology (Bethesda. 27 (4), 212-2110 (2012).
- Mori, K., Sakano, H. How is the olfactory map formed and interpreted in the mammalian brain). Annu. Rev. Neurosci. 34, 467-499 (2011).
- De Vry, J., et al. In vivo electroporation of the central nervous system: a non-viral approach for targeted gene delivery. Prog. Neurobiol. 92 (3), 227-244 (2010).
- Hovis, K. R., Padmanabhan, K., Urban, N. N. A simple method of in vitro electroporation allows visualization, recording, and calcium imaging of local neuronal circuits. J. Neurosci. Methods. 191 (1), 1-10 (2010).
- Chen, C., Smye, S. W., Robinson, M. P., Evans, J. A. Membrane electroporation theories: a review. Med. Biol. Eng. Comput. 44 (1-2), 5-14 (2006).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70 (4-5), 148-154 (2002).
- Hewapathirane, D. S., Haas, K. Single cell electroporation in vivo within the intact developing brain. J. Vis. Exp. (17), (2008).
- Gliem, S., et al. Bimodal processing of olfactory information in an amphibian nose: odor responses segregate into a medial and a lateral stream. Cell. Mol. Life Sci. 70 (11), 1965-1984 (2013).
- Hassenklöver, T., Manzini, I. Olfactory wiring logic in amphibians challenges the basic assumptions of the unbranched axon concept. J. Neurosci. 33 (44), 17252-1710 (2013).
- Bestman, J. E., Ewald, R. C., Chiu, S. -. L., Cline, H. T. In vivo single-cell electroporation for transfer of DNA and macromolecules. Nat. Protoc. 1 (3), 1272-1210 (2006).
- Nieuwkoop, P. D., Faber, J., Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis. , (1994).
- Coupé, P., Munz, M., Manjón, J. V., Ruthazer, E. S., Collins, D. L. A CANDLE for a deeper in vivo insight. Med. Image Anal. 16 (4), 849-864 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nat. Biotechnol. 28 (4), 348-353 (2010).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7 (107), (2007).
- Nezlin, L. P., Schild, D. Individual olfactory sensory neurons project into more than one glomerulus in Xenopus laevis tadpole olfactory bulb. J. Comp. Neurol. 481 (3), 233-239 (2005).
- Nagayama, S., et al. In vivo simultaneous tracing and Ca2+ imaging of local neuronal circuits. Neuron. 53 (6), 789-803 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados