Method Article
يستند التحقيق، في الوقت الحقيقي PCR مقاربات للقياس الكمي من microRNAs
In This Article
Summary
وقد ظهرت الرنا الميكروية المتداولة مؤخرا في المؤشرات الحيوية واعدة وجديدة لمختلف أنواع السرطان وأمراض أخرى. والهدف من هذه المقالة هو لمناقشة ثلاثة في الوقت الحقيقي PCR منصات مختلفة القائم على التحقيق والأساليب المتوفرة لقياس وتحديد وفرة تعميم الرنا الميكروية.
Abstract
يستند التحقيق-PCR الكمي (QPCR) هو وسيلة مفضلة للقياس وفرة النص، لأنها هي واحدة من طرق الكشف الأكثر حساسية أن يقدم تحليلا دقيقا وقابلة للتكرار. الكيمياء يستند التحقيق، ويقدم أقل مضان الخلفية بالمقارنة مع غيرها كيمياء (على صبغ). في الوقت الحاضر، هناك العديد من المنابر المتاحة أن الكيمياء أساس تحقيق الاستخدام ل quantitate فرة النص. QPCR في 96 لوحة جيدا هو الأكثر استخداما بشكل روتيني طريقة، ولكن فقط كحد أقصى من 96 عينات أو miRNAs يمكن اختبارها في تشغيل واحد. هذا هو وقتا طويلا ومملا إذا كان عدد كبير من العينات / miRNAs هي لتحليلها. عالية الإنتاجية المنصات المرتكزة إلى تحقيق مثل على microfluidics (على سبيل المثال TAQMAN بطاقة صفيف) والمصفوفات علم الموائع النانوي (على سبيل المثال OpenArray) عرض سهولة بتكاثر وكفاءة للكشف عن وفرة من microRNAs متعددة في عدد كبير من العينات في وقت قصير. هنا، ونحن لشرح إعداد التجريبيالثانية بروتوكول لميرنا الكميات من المصل أو عينات البلازما EDTA، وذلك باستخدام الكيمياء القائم على التحقيق وثلاث منصات مختلفة (96 لوحة جيدا، على microfluidics والمصفوفات علم الموائع النانوي) تقدم مستويات متزايدة من الإنتاجية.
Introduction
الرنا الميكروية (miRNAs) هي ~ 22 النوكليوتيدات غير الترميز (نورث كارولاينا) الرنا، كما تعمل الجهات التنظيمية في التعبير الجيني 1-3. معظم miRNAs في الحيوانات وظيفة من خلال تسلسل محدد قاعدة الاقتران مع مرنا، واستهداف "UTR 3، مما يؤدي إلى تنظيم السلبي للالتعبير الجيني 2-4. هذا يحدث عادة عن طريق تثبيط الترجمة مرنا أو عن طريق الريباسي الانزال. وقد ثبت miRNAs في التداول أن تكون المؤشرات الحيوية الجديدة في مجال البحوث والمجالات السريرية لمجموعة متنوعة من الأمراض، مثل السكري 5-7 والمبيض 8، 9 البروستاتا وسرطان الثدي 10،11، والتهاب الكبد B 12 و أمراض المناعة الذاتية الأخرى 13. وقد أجريت الأبحاث لتحديد miRNAs وفرة في الخلايا أو الأنسجة المختلفة، وكذلك في الدورة الدموية من البلازما البشرية وعينات مصل الدم، والتي هي أكثر يسرا وأقل تغلغلا 9،11-15.
وكانت وسائل مختلفة من ميرنا الكمي هأقاموا باستخدام منصات متعددة، مثل منصة لوحة معيار 96-جيدا 4،12،16-18، ومنصة بطاقة على microfluidics 12،18-23 ومنصة علم الموائع النانوي مجموعة 17،24. الكمي في الوقت الحقيقي PCR (QPCR) يوفر القدرة على قياس الأعداد النسبية أو المطلقة من النصوص باستخدام متعددة (dye- أو القائم على التحقيق) كيمياء. يستند التحقيق في الوقت الحقيقي PCR الكيمياء يقدم فائدة منخفضة مضان الخلفية وحساسية عالية للكشف عن نسخة نسخة واحدة. ومن نسبيا فعالة من حيث التكلفة، وسهلة الاستخدام وقابلة للتكرار للغاية، مما يجعل الطريقة المفضلة لقياس وتحديد ميرنا التعبير 25. طريقة QPCR يستند التحقيق-ينطوي عموما خطوتين: النسخ (RT) وQPCR 4،26،27 عكس. RT هو المكان الذي تهجين التمهيدي الجذعية حلقة RT إلى ناضجة أو الأساسي جزيء ميرنا وتحويلها إلى مكمل (ج) DNA. يتم بعد ذلك إجراء تقدير حجم المنتج [كدنا خارج باستخدام بادئات PCR ميرنا محددة26-28. ويستند مبدأ QPCR يستند التحقيق على الكشف عن تمديد حبلا التكميلية في الوقت الحقيقي، والذي ينطوي على التحلل من التحقيق fluorescently الموسومة. وتهدف هذه المجسات لاحتواء مراسل الفلورسنت وفاكهه تقضي التي هي مجرد بصرف النظر للسماح الحنق (نقل الإسفار الرنين الطاقة). وملثمين الكشف عن الانبعاثات من مراسل مضان (باعث) من قبل مقربة من جزيء فاكهه تقضي. عندما طق بوليميريز (بول) يمتد من التمهيدي المنبع ويصل شوكة (5 'نهاية التحقيق)، وطق النشاط بول نوكلياز خارجية مائيا التحقيق، مما يؤدي إلى التفكك المادي / فصل باعث الفلورسنت من فاكهه تقضي. يتم تسجيل هذا الإصدار من جزيء واحد من مضان باعث بواسطة كاشف وعرضها على أنها الزيادة التدريجية في إشارة مضان من ذلك جيدا / رد فعل. الزيادة في مضان يتناسب مع كمية من الناتج PCR ولدت، السماح لتشو دقيقةantification من 26،28 الهدف تضخيم.
مع تزايد الطلب في ميرنا الكمي، وقد وضعت المتوسطة على التكنولوجيات الإنتاجية العالية للسماح لعدد أكبر من العينات التي سيتم تجهيزها في فترة قصيرة من الزمن. TAQMAN منخفض الكثافة صفيف (TLDA) هو المتوسطة الإنتاجية تصميم ميكروفلويديك مبتكرة على أساس القائمة على التحقيق QPCR الكيمياء تقدم زيادة في عدد miRNAs تحليلها على لوحة واحدة. TLDA تنطوي على استخدام بركة معرفة مسبقا من RT-الاشعال التي تستخدم لتجميع كدنا]. ثم يتم نسج هذه cDNAs إلى 384 بطاقة جيدا الصغرى الموائعية مخصصة لتحديد التعبير عن miRNAs متعددة باستخدام QPCR 22،26،29. كل بئر من بطاقة يحتوي الاشعال وتحقيقات المجففة لتضخيم ميرنا معين (ق)، وبالتالي تصل إلى 384 ردود الفعل يمكن معالجتها في بطاقة TLDA واحد 26.
مجموعة علم الموائع النانوي هي عبارة عن منصة عالية الإنتاجية التي يتم استخدامها للكشف عن النصوص الجين 24 باستخدام نفس الكيمياء القائم على التحقيق. فإنه يستخدم مصفوفة الملكية تقدم التفاعلات مسعور-محبة للماء لتسهيل تحميل السهل لل33 نانولتر خليط التفاعل في صفيف من 3072 من خلال الثقوب على شريحة الفولاذ المقاوم للصدأ 24. تركز هذه المقالة على إظهار كيف يتم تنفيذ هذه الأساليب لقياس miRNAs في المصل / البلازما والعوامل الحاسمة التي يجب مراعاتها عند تنفيذ وتفسير هذه البيانات. المتخذة لالاعتبار، وسيتم مناقشة فوائدها الفردية والقيود في هذه المقالة.
Protocol
مجموع RNA يمكن عزلها عن مصل باستخدام بروتوكول أنشئت في مختبرنا 30 أو استخدام غيرها من مجموعات المتاحة تجاريا.
وتقدم (وشكلت مع حجم فائض 5٪ للpipetting لوشملت) جداول البيانات التفاعلية التكميلية لحساب حجم رد الفعل في كل تجربة: ملاحظة.
1. القائم على التحقيق في الوقت الحقيقي QPCR باستخدام 96-جيدا منصة لوحة قياسي
- التوليف [كدنا] (النسخ العكسي) على عينات الحمض النووي الريبي المصل / البلازما لميرنا
- حساب وإخراج 10 نانوغرام من الحمض النووي الريبي لكل رد فعل التوليف [كدنا]. إضافة nuclease خالية من المياه لجلب الحجم النهائي من 10 نانوغرام RNA إلى 1.67 ميكرولتر (لرد فعل 5 ميكرولتر). الاحتفاظ بعينات على الجليد.
- حدد ميرنا وذوبان الجليد الاشعال RT الخاصة بهم.
- ذوبان الجليد في RT مكونات المزيج كاشف: RT العازلة (10X)، dNTPs (100 ملم)، ريبونوكلياز المانع (20 U / ميكرولتر). أبدا حفاظ على انزيم مكان (المؤتلف فيروس اللوكيميا مولوني الفئران(rMoMuLV)) (recombinanat مولوني فيروس اللوكيميا الفئران (rMoMuLV) الناسخ العكسي (50 U / ميكرولتر) على الجليد. تخزينه في -20 ° C لحين الحاجة إليها أو في كتلة الفريزر.
- إعداد RT كاشف المزيج على الجليد كما هو موضح في الجدول 1A. فمن المستحسن لإعداد لا يقل عن 5٪ حجم الفائض للتعويض عن الخطأ pipetting ل.
- إضافة 2.33 ميكرولتر من كاشف مزيج RT كل في 0.2 مل PCR أنبوب / لوحة.
- دوامة الأنابيب التمهيدي RT إلى المزيج، ثم الطرد المركزي لفترة وجيزة في 10،000 x ج لمدة 10 ثانية. إضافة 1 ميكرولتر من ميرنا RT التمهيدي محدد لأنابيب من PCR منها أو لوحة. إضافة 1.67 ميكرولتر من الحمض النووي الريبي المخفف لأنابيب PCR كل منها أو الآبار في اللوحة. أداء جميع الإضافات على الجليد.
- أجهزة الطرد المركزي أنبوب رد فعل أو لوحة في 1،950 x ج لمدة 5 دقائق في 4 درجات مئوية.
- إعداد برنامج تركيب ميرنا [كدنا على cycler الحرارية مع الظروف الإعداد التالي: 16 درجة مئوية لمدة 30 دقيقة، 42 درجة مئوية لمدة 30 دقيقة، 85 °C لمدة 5 دقائق و 4 ° C في الانتظار.
- تعيين حجم رد الفعل إلى 10 ميكرولتر. تحميل أنابيب رد فعل أو لوحة في cycler الحرارية. بدء تشغيل RT. تخزين ردود الفعل [كدنا] (RT) في -20 ° C، إذا لم يتم شرع في الوقت الحقيقي PCR التضخيم على الفور.
- التحقيق على أساس الوقت الحقيقي QPCR للكشف عن miRNAs ناضجة
- ذوبان الجليد المقايسات اختيار القائم على التحقيق QPCR (20X) للمنتج RT منها.
- مزيج من اللياقة الحل الوحيد في الوقت الحقيقي PCR (QPCR كاشف مزيج) من خلال يحوم زجاجة.
- إعداد كاشف مزيج QPCR لكل ميرنا لتحليلها. لإعداد QPCR الحصول على أنبوب معقم microcentrifuge 1.5 مل لكل عينة ميرنا وإضافة عناصر إلى كل أنبوب كما هو موضح في الجدول 1B. فمن المستحسن لإعداد لا يقل عن 5٪ حجم الفائض للتعويض عن الخطأ pipetting ل.
- إضافة 4.2 ميكرولتر من QPCR كاشف مزيج منهما إلى كل بئر من لوحة 96-جيدا البصرية (أو أنابيب). إضافة 0.8 ميكرولترمن رد فعل [كدنا المعني (توليفها في الخطوة 1.1 لكل miRNAs) إلى ما المعنيين.
- ختم لوحة مع غطاء البصري المناسب. أجهزة الطرد المركزي لوحة (أو أنابيب) في 1،950 x ج لمدة 5 دقائق في 4 درجات مئوية
- بدوره على جهاز الكمبيوتر، 96-جيدا لوحة / على microfluidics القارئ مجموعة وأخيرا إطلاق البرنامج. تأكد من أن أجهزة موصولة بشكل صحيح وكتلة الصحيح وغطاء ساخن (لسريع 96 لوحة جيدا) في مكانها الصحيح.
- اختر التجربة إلى 96 جيدا كتلة سريع (0.1 مل)، ومنحنى القياسية والكواشف TAQMAN وطريقة سريع. إعداد QPCR على النظام في الوقت الحقيقي PCR باستخدام الشروط الدراجات البرنامج التالي: 95 درجة مئوية لمدة 20 ثانية، 50 دورة (95 درجة مئوية لمدة 1 ثانية، 60 درجة مئوية لمدة 30 ثانية).
- تعيين حجم رد الفعل إلى 10 ميكرولتر. تحميل أنبوب رد فعل أو لوحة في الصك. اضغط على "بدء تشغيل". هذا البرنامج سوف تستغرق حوالي 1 ساعة لإكمال.
2. القائم على التحقيق بطاقة على microfluidics صفيف (الكالسيومالثالثة A و B)
وتأتي استنادا التحقيق لوحة ميرنا كمجموعة من اثنين من بطاقات 384 جيدا ميكروفلويديك (بطاقة صفيف ألف وصفيف بطاقة B): ملاحظة. كل بطاقة تحتوي على الاشعال وتحقيقات المجففة لمدة تصل إلى 380 miRNAs والضوابط. يتم تحميل المنتجات [كدنا] (مع أو بدون ما قبل التضخيم) الخاصة بطاقة A أو B بطاقة على مجموعة منها عن الوقت الحقيقي PCR.
- عكس النسخ (RT)
- استخدام هذا البروتوكول لمجموع المدخلات RNA من 1-1،000 نانوغرام. إذا كان الإدخال بين 1-350 نانوغرام، نفذ الخطوة ما قبل التضخيم (قبل أمبير). للمدخلات فوق 350 نانوغرام، تحميل [كدنا مباشرة على بطاقات مجموعة دون ما قبل أمبير.
ملاحظة: للحصول على التنميط ميرنا مصل، وتبدأ مع 100 نانوغرام من الحمض النووي الريبي مجموع. لمحة ميرنا كاملة، تشغيل اثنين من حمامات محددة مسبقا من مجموعات RT-التمهيدي من ردود الفعل RT (المجموعة أ وبركة B) لكل عينة. - ذوبان الجليد الكواشف التالية على الجليد. RT الاشعال (10X): المجموعة (أ) وبركة B، dNTPs مع dTTP (100 ملم)، RT العازلة (10X)، MgCl 2 (25 ملم)، ريبونوكلياز المانع (20 U / &# 181؛ ل). لا تبقي لإنزيم (المؤتلف فيروس اللوكيميا مولوني الفئران (rMoMuLV)) الناسخ العكسي (50 U / ميكرولتر) على الجليد. تخزينه في -20 ° C لحين الحاجة إليها.
- دوامة بلطف عن الكواشف، باستثناء انزيم، ثم الطرد المركزي لفترة وجيزة الأنابيب في 10،000 x ج لمدة 10 ثانية.
- الجمع بين الكواشف، كما هو موضح في الجدول 2A، إلى أنبوبين. أنبوب واحد للبركة، والآخر للبركة B. سيكون لكل أنبوب يحتوي على بركة سباحة واحدة فقط معرفة مسبقا من RT مجموعة التمهيدي، سواء من المجموعة (أ) أو من بركة B. ينصح للتحضير لا يقل عن 5٪ حجم الفائض للتعويض عن الخطأ pipetting ل .
- عكس لخلط، لفترة وجيزة ثم الطرد المركزي في 10،000 x ج لمدة 10 ثانية. قسامة 100 نانوغرام لكل عينة الحمض النووي الريبي في أنبوب جديد، ثم إضافة حجم مناسب من الماء nuclease خالية لجعل ما مجموعه 3 ميكرولتر.
- قسامة 4.5 ميكرولتر من المزيج المناسب كاشف RT في أنابيب منها. عكس لخلط، ثم الطرد المركزي لفترة وجيزة في 10،000 x ج لمدة 10 ثانية. احتضان على الجليدلمدة 5 دقائق.
- مكان عينات إلى thermocycler وبدء RT باستخدام الشروط التالية: 40 دورات (16 درجة مئوية لمدة 2 دقيقة، 42 ° C لمدة 1 دقيقة، 50 درجة مئوية لمدة 1 ثانية)، 85 درجة مئوية لمدة 5 دقائق، وعقد في 4 درجات C. متجر [كدنا إنشاء باستخدام هذه بركة معرفة مسبقا من RT-الاشعال في -15 إلى -25 ° C أو استخدامها على الفور.
- استخدام هذا البروتوكول لمجموع المدخلات RNA من 1-1،000 نانوغرام. إذا كان الإدخال بين 1-350 نانوغرام، نفذ الخطوة ما قبل التضخيم (قبل أمبير). للمدخلات فوق 350 نانوغرام، تحميل [كدنا مباشرة على بطاقات مجموعة دون ما قبل أمبير.
- قبل التضخيم
- ذوبان الجليد بركة معرفة مسبقا من الاشعال قبل أمبير على الجليد. بلطف الاشعال دوامة، ثم الطرد المركزي لهم لفترة وجيزة في 10،000 x ج لمدة 10 ثانية. دوامة TAQMAN preamp وكاشف مزيج (2X) من خلال التنصت لطيف، لخلط.
- الجمع بين الكواشف، كما هو موضح في الجدول 2B، إلى أنبوبين. أنبوب واحد للبركة، والآخر للبركة B.
ملاحظة: كما هو موضح أعلاه، سوف بركة الاشعال وقبل أمبير الذهاب إلى أنبوب ألف ويجب الاشعال سباحة B الذهاب إلى أنبوب B. ينصح للتحضير لا يقل عن 5٪ حجم الفائض للتعويض عن الخطأ pipetting ل. - عكس لخلط، ثم الطرد المركزي لفترة وجيزة في 10،000 x ج لمدة 10 ثانية.قسامة 22.5 ميكرولتر من مزيج preamp وكاشف المناسب في أنابيب جديدة. قسامة 2.5 ميكرولتر من عينة [كدنا] (المعد في الخطوة RT) في أنبوب المعنيين.
- عكس لخلط، ثم الطرد المركزي لفترة وجيزة في 10،000 x ج لمدة 10 ثانية. احتضان على الجليد لمدة 5 دقائق. مكان عينات إلى thermocycler وتبدأ دورة ما قبل أمبير. شروط ركوب الدراجات: 95 درجة مئوية لمدة 10 دقيقة، 55 ° C لمدة 2 دقيقة، 72 ° C لمدة 2 دقيقة و 12 دورات (95 درجة مئوية لمدة 15 ثانية، 60 درجة مئوية لمدة 4 دقائق)، 99.9 درجة مئوية لمدة 10 دقيقة، وعقد في 4 درجات مئوية.
- عكس ما قبل تضخيم [كدنا لخلط، ثم لفترة وجيزة الطرد المركزي في 10،000 x ج لمدة 10 ثانية. إضافة 75 ميكرولتر من 0.1X TE العازلة (درجة الحموضة 8.0) تضخيم مسبقا ل[كدنا] (1: 4 التخفيف). عكس عينات ما قبل أمبير المخفف لخلط، ثم الطرد المركزي لفترة وجيزة في 10،000 x ج لمدة 10 ثانية. متجر المخفف تضخيم ما قبل كدنا] في -15 إلى -25 ° C لمدة أسبوع وتصل إلى واحد، أو استخدامها على الفور.
- تحميل بطاقات على microfluidics وأداء QPCR
- تبقي على microfluidicsبطاقات ميرنا خارج لمدة ساعة ونصف على الأقل للوصول إلى درجة حرارة الغرفة. ذوبان الجليد المخفف تضخيم ما قبل كدنا] على الجليد وتخلط بواسطة قلب الأنابيب تليها تدور وجيزة. مزيج QPCR كاشف مزيج من قبل يحوم زجاجة.
- في أنبوب جديد إضافة 450 ميكرولتر من QPCR كاشف مزيج إلى 9 ميكرولتر من المخفف تضخيم ما قبل كدنا]. للحصول على بطاقة A، استخدام ما قبل تضخيم المنتج إعدادها باستخدام بركة التمهيدي A. إضافة 441 ميكرولتر من المياه مجانا نوكلياز لتعويض الحجم النهائي إلى 900 ميكرولتر. عكس أنبوب لخلط، ثم الطرد المركزي لفترة وجيزة في 10،000 x ج لمدة 10 ثانية.
- إزالة بطاقة TLDA من عبوته (مرة واحدة أن تصل درجة حرارة الغرفة) ووضعه على منطقة نظيفة مع الجانب احباط أسفل. إضافة 100 ميكرولتر من PCR مزيج التفاعل إلى كل من الموانئ ملء 8 على البطاقة. هناك 2 الموانئ على كل من خزان (8 خزانات في المجموع على كل بطاقة).
ملاحظة: المنفذ ملء هو أكبر ثقب حيث يتم إضافة مزيج التفاعل، في حين أن منفذ تهوية هو ثقب أصغر. كل بطاقة ميرنا TLDA ديها 8 الخزانالصورة، كل منها يؤدي إلى 48 بئرا (24 بئرا في عمود واحد × 2 الأعمدة)، وبالتالي تحميل جميع الآبار 384 في البطاقة مع نفس PCR مزيج التفاعل. تأكد من أن المجموعة (أ) ويتم تحميل سباحة B من كل عينة على بطاقات TLDA منها. ضع بطاقة مصفوفة في مصفوفة على microfluidics دلاء حامل البطاقة المتخصصة في أجهزة الطرد المركزي. - لبطاقات مجموعة على microfluidics، واستخدام أجهزة الطرد المركزي مناسب (مثل هيراوس Multifuge 3SR، 230V الطرد المركزي) والدلاء محددة (مثل حاملي "بطاقة صفيف TAQMAN"). كل دلو يمكن أن تعقد ما يصل إلى 3 بطاقات (تحميل / فارغ). تأكد دائما أن جميع فتحات 3 من دلو واحتل ومتوازن دلو من خلال وضع دلو مماثل (وينبغي أن تتضمن هذه دلو أيضا 3 بطاقات، إما فارغة أو كاملة) في فتحة نقيض من أجهزة الطرد المركزي. في حين وضع البطاقة في حامل دلو، وتأكد من أن 8 خزانات تتوقع صعودا ويواجه آبار رد فعل الجدار الخارجي للطرد المركزي.
- تدور البطاقات في 331 x ج لمدة 1 دقيقة في درجة حرارة الغرفة. بعدالأول تدور، فتح الطرد المركزي وضمان بصريا تم الاستغناء عن مزيج التفاعل من خلال الآبار 384. كرر تدور في نفس الإعدادات ل1 المزيد من الوقت. إزالة البطاقة من دلو والتأكد من أن مستوى مزيج رد فعل في كل من 8 خزانات غير موحد. أي تضارب في حجم السائل اليسار في الخزانات تجعل البطاقة غير مناسب لمواصلة استخدامها.
- بطاقات مجموعة على microfluidics تحتاج إلى سداده المتخصصة التي لديها التجمع الدقة القلم (النقل) لاغلاق قنوات التوزيع السوائل للمجموعة وتوزيعها بالتساوي على مزيج رد فعل في جميع الآبار (إجمالي حجم رد الفعل 1 ميكرولتر / جيد).
- جلب النقل إلى نقطة الانطلاق، وإدخال بطاقة تحميلها في سداده مع الجانب احباط صعودا واصطف إلى دبابيس القلم على سداده. في خطوة مفاجئة وموحدة بطيئة وثابتة واحدة، ودفع عربة عبر البطاقة حتى يصل إلى نقطة نهاية سداده. إزالة بطاقة مجموعة مختومة ثم قطع الخزانالصورة من البطاقة باستخدام المقص.
- ضمان أن يتم تثبيت كتلة الصحيح، غطاء ساخنة وعينة الناقل في مجموعة على microfluidics في الوقت الحقيقي نظام PCR / آلة.
- بدوره على جهاز الكمبيوتر، ثم نظام مجموعة على microfluidics وأخيرا إطلاق البرنامج. تأكد من أن أجهزة موصولة بشكل صحيح. اختر التجربة وبطاقة مصفوفة، منحنى القياسية والكواشف TAQMAN والوضع القياسي. استيراد ملفات الإعداد لأي من بطاقة ألف وبطاقة B. حفظ الملف.
- ضع بطاقة مختومة في علبة أداة مع جيدا A1 في أعلى الزاوية اليسرى والباركود نحو الجزء الأمامي من الصك. اضغط على "بدء تشغيل". هذا البرنامج سوف تستغرق حوالي 2 ساعة لإكمال.
لوحة علم الموائع النانوي ميرنا الإنسان ومقره مسبار-3.
- عكس النسخ (RT)
- استخدام هذا البروتوكول لمجموع المدخلات RNA من 50-200 نانوغرام، ولكن 100 نانوغرام هو الأمثل بالنسبة لمعظم العينات. لمحة ميرنا كاملة، تشغيل اثنين predefiحمامات نيد مجموعات RT-التمهيدي من ردود الفعل RT (المجموعة أ وبركة B) لكل عينة.
- ذوبان الجليد الكواشف على الجليد: بركة معرفة مسبقا من مجموعات RT التمهيدي (10X)، dNTPs مع dTTP (100 ملم)، RT العازلة (10X)، MgCl 2، (25 ملم)، ريبونوكلياز المانع (20 U / ميكرولتر). لا تبقي لإنزيم (المؤتلف فيروس اللوكيميا مولوني الفئران (rMoMuLV) الناسخ العكسي (50 U / ميكرولتر) على الجليد. تخزينه في -20 ° C لحين الحاجة إليها. دوامة بلطف عن الكواشف، باستثناء الانزيم، وأجهزة الطرد المركزي لفترة وجيزة لهم في 10،000 x ج لمدة 10 ثانية.
- الجمع بين الكواشف، كما هو موضح في الجدول رقم 3A، إلى أنبوبين. أنبوب واحد للبركة، والآخر للبركة B. سيكون لكل أنبوب يحتوي على بركة سباحة واحدة فقط معرفة مسبقا من مجموعة RT-التمهيدي، سواء من المجموعة (أ) أو من بركة B. ينصح للتحضير لا يقل عن 5٪ حجم الفائض لتعويض pipetting ل الخطأ.
- ماصة لخلط لفترة وجيزة ثم الطرد المركزي في 10،000 x ج لمدة 10 ثانية. قسامة 100 نانوغرام لكل عينة الحمض النووي الريبي في أنبوب جديد، ثم إضافة حجم مناسبمن nuclease خالية من المياه لجعل ما مجموعه 3 ميكرولتر. قسامة 4.5 ميكرولتر من المزيج المناسب كاشف RT في أنبوب المعنيين.
- عكس لخلط، ثم الطرد المركزي لفترة وجيزة في 10،000 x ج لمدة 10 ثانية. احتضان على الجليد لمدة 5 دقائق. مكان عينات إلى thermocycler وبدء برنامج RT. شروط ركوب الدراجات: 40 دورات (16 درجة مئوية لمدة 2 دقيقة، 42 ° C لمدة 1 دقيقة، 50 درجة مئوية لمدة 1 ثانية)، 85 درجة مئوية لمدة 5 دقائق، وعقد في 4 درجات مئوية. متجر كدنا] تم إنشاؤها باستخدام هذه بركة معرفة مسبقا من RT-التمهيدي وضعت في -15 إلى -25 ° C أو استخدامها على الفور.
- قبل التضخيم (قبل أمبير)
- ذوبان الجليد بركة معرفة مسبقا من قبل أمبير التمهيدي تعيين على الجليد. بلطف الاشعال دوامة، ثم الطرد المركزي لهم لفترة وجيزة في 10،000 x ج لمدة 10 ثانية. دوامة TAQMAN preamp وكاشف مزيج (2X) لخلط.
- الجمع بين الكواشف، كما هو موضح في الجدول 3B، إلى أنبوبين. أنبوب واحد للبركة، والآخر للبركة B. سيكون لكل أنبوب يحتوي على بركة سباحة واحدة فقط معرفة مسبقا من مجموعات RT-التمهيدي، إما الابام بركة A أو B. من بركة فمن المستحسن أن إعداد لا يقل عن 5٪ حجم الفائض لتعويض pipetting لخطأ.
- ماصة لخلط، ثم لفترة وجيزة أجهزة الطرد المركزي لهم في 10،000 x ج لمدة 10 ثانية. قسامة 22.5 ميكرولتر من مزيج preamp وكاشف المناسب في أنابيب جديدة. قسامة 2.5 ميكرولتر من عينة [كدنا] في أنبوب المعنيين. عكس لخلط، ثم الطرد المركزي لفترة وجيزة الأنابيب في 10،000 x ج لمدة 10 ثانية. احتضان على الجليد لمدة 5 دقائق.
- مكان عينات إلى thermocycler وتشغيل ما قبل أمبير. تعيين حجم رد الفعل إلى 25 ميكرولتر. شروط ركوب الدراجات: 95 درجة مئوية لمدة 10 دقيقة، 55 ° C لمدة 2 دقيقة، 72 ° C لمدة 2 دقيقة و 12 دورات (95 درجة مئوية لمدة 15 ثانية، 60 درجة مئوية لمدة 4 دقائق)، 99.9 درجة مئوية لمدة 10 دقيقة، وعقد في 4 درجات مئوية.
- عكس ما قبل تضخيم [كدنا لخلط، ثم لفترة وجيزة الطرد المركزي في 10،000 x ج لمدة 10 ثانية. في أنابيب جديدة إضافة 4 ميكرولتر من تضخيم ما قبل [كدنا إلى 156 ميكرولتر من 0.1X TE العازلة درجة الحموضة 8.0 (01:40 تمييع). عكس المخفف عينات ما قبل أمبير لمزيج، ثم لفترة وجيزة مntrifuge في 10،000 x ج لمدة 10 ثانية. متجر تضعف وكدنا] تضخيم ما قبل مخفف في -15 إلى -25 ° C لمدة أسبوع وتصل إلى واحد، أو استخدام على الفور.
- تحميل علم الموائع النانوي صفائف والأدائية QPCR
- تحميل الملف لوحة ذات الصلة (.tpf) من موقع 31 باستخدام مجموعة علم الموائع النانوي الشريحة الرقم التسلسلي. هذا يحتوي على المعلومات خوض انتخابات محددة الشريحة مجموعة علم الموائع النانوي.
- ذوبان الجليد المخفف [كدنا وTAQMAN في الوقت الحقيقي QPCR مزيج كاشف تضخيم ما قبل (في حال استخدام لأول مرة) على الجليد. مزيج QPCR كاشف مزيج من قبل يحوم زجاجة. في أنابيب جديدة إضافة 22.5 ميكرولتر من QPCR كاشف مزيج إلى 22.5 ميكرولتر من المخفف تضخيم ما قبل كدنا]. بلطف دوامة لخلط، ثم الطرد المركزي لفترة وجيزة في 10،000 x ج لمدة 10 ثانية.
- قسامة 5 ميكرولتر من كل عينة إلى 8 آبار (2 الأعمدة، 4 صفوف) من سير العمل علم الموائع النانوي مجموعة 384 جيدا لوحة العينة. تأكد من أن المجموعة (أ) وبركة B من كل عينة هي في المتاخمة كتل 8-جيدا (انظر شملت رقمه 1 أو التكميلية التفوق ورقة للتخطيط).
- يمكن أن تحتوي كل لوحة عينة تصل إلى ثمانية شرائح قيمتها من العينات. ومع ذلك، يمكن للنظام لعلم الموائع النانوي مجموعة العملية فقط 4 صفائف علم الموائع النانوي في شوط واحد. إذا كان أكثر من أربعة شرائح بقيمة العينات ليتم تحميلها على لوحة عينة واحدة، يرجى التأكد من مختومة المقاطع المتبقية. ختم مع OpenArray لوحة عينة سداده.
ملاحظة: من المستحسن قبل قطع على لسداده إلى الأقسام المطلوبة، لذلك قد تكون مختومة الأقسام / تفض بشكل فردي لتقليل التبخر. بدلا من ذلك، لوحة قد تكون مختومة مع السداده سليمة، ومن ثم أقسام يمكن خفض بشكل فردي من عند تحميل.
- يمكن أن تحتوي كل لوحة عينة تصل إلى ثمانية شرائح قيمتها من العينات. ومع ذلك، يمكن للنظام لعلم الموائع النانوي مجموعة العملية فقط 4 صفائف علم الموائع النانوي في شوط واحد. إذا كان أكثر من أربعة شرائح بقيمة العينات ليتم تحميلها على لوحة عينة واحدة، يرجى التأكد من مختومة المقاطع المتبقية. ختم مع OpenArray لوحة عينة سداده.
- لوحة أجهزة الطرد المركزي في 490 x ج لمدة 1 دقيقة على 4 درجات مئوية. تحميل علم الموائع النانوي الشرائح مجموعة في حدود 1 ساعة. نظرا لضيق الوقت المسموح به لختم الشرائح، يرجى تحميل فقط شريحة واحدة في وقت واحد. إزالة الشريحة علم الموائع النانوي مجموعة من الثلاجة واتركه حتى يأتي إلى درجة حرارة الغرفةerature (~ 15 دقيقة).
- تأكد من تثبيت كتلة الصحيح، غطاء ساخنة وعينة الناقل في نظام علم الموائع النانوي مجموعة. بدوره على جهاز الكمبيوتر، والوقت الحقيقي نظام PCR ونظام التحميل. الوصول إلى البرنامج منها، وتأكد من أن أجهزة متصلة. إزالة المواد الاستهلاكية نظام التحميل (صفيف غطاء الشريحة، والمكونات والسوائل الغمر) من التعبئة والتغليف.
- سحب بلطف على المكبس من حقنة السائل الغمر لتخفيف. إزالة الغطاء، ضع طرف على الهواء وتدفق من غيض. ضع نصائح نظام التحميل داخل الجهاز وإزالة الغطاء. وضع لوحة عينة داخل نظام PCR.
- وضع قفازات على. تأكد من أنها المناسب بإحكام لتقليل خطر بمناسبة قصد غطاء الشريحة. التعبئة والتغليف الشريحة مفتوحة بعناية. تلميح ببطء الانزلاق الى جنب. لا تلمس الجزء العلوي من الشريحة.
- ضع الشريحة في النظام PCR، مع الباركود على اليسار. إزالة سداده من جزء من لوحة عينة المعدة للتحميل. استخدام نظام التحميلبرنامج لدخول الباركود الشريحة، الشريحة الموقف، موقف العينة والتكوين طرف.
- عندما يتم الانتهاء من جميع الشيكات ذات الصلة، الشريحة تحميل الصحافة. في حين أن نظام PCR يتم تحميل الشريحة، وإزالة البلاستيك واضح والأحمر من الجزء السفلي من غطاء الشريحة. عند الانتهاء من التحميل، وإزالة بعناية وختم الشريحة في غضون 90 ثانية.
- ضع الشريحة داخل لوحة المشبك. ضع غطاء الشريحة على الشريحة. المشبك لمدة 30 ثانية. ضمان يتم وضع الغطاء بحيث يتم عرض الباركود بشكل صحيح. إزالة التجميع من لوحة المشبك.
- موقف الغمر السائل حقنة داخل الشريحة بحيث غيض تضغط ضد الغطاء. ملء ببطء الشريحة مع السائل الغمر، وضمان تشغيل السوائل على طول غطاء. مرة واحدة كاملة، وختم الشريحة مع المكونات، وتحول المسمار حتى يكسر مقبض قبالة.
- إزالة غطاء من البلاستيك على الجزء العلوي من غطاء الشريحة، ومن ثم وضع بعناية في الناقل الشريحة من الوقت الحقيقي نظام PCR. ضمان وجود سوpport على الجزء السفلي من الشريحة كما يتم خفض عليه، حتى لا تسقط فجأة، ولا تلمس الجزء العلوي من الشريحة. وهو موافق لتلمس جوانب الشريحة النظام / cassette.Initialize على PCR والبدء في برنامج لQPCR في حدود 1 ساعة.
- حدد "OpenArray" داخل البرنامج PCR-النظام. اضغط على "البحث عن معرفات الشريحة". هذا وسوف يستغرق بضع دقائق. إذا كان البرنامج لا يمكن العثور على ID لوحة، وسوف تسأل عن ذلك إلى إدخالها يدويا.
- اضغط على "تأكيد مراكز لوحة". مرة أخرى، وهذا سوف يستغرق بضع دقائق. تأكد من أن النقطة الحمراء هي داخل المركز وأنه لا توجد بصمات الأصابع / علامات على الجزء العلوي من الشريحة. تحميل الملف .tpf منها لكل شريحة وحدد اسم ملف النتيجة والموقع. اضغط على "بدء تشغيل". هذا البرنامج سوف تستغرق حوالي 2 ساعة لإكمال.
النتائج
حجم الموصى بها لمقايسة على أساس التحقيق ميرنا QPCR التفاعل 20 ميكرولتر. ملاحظة: لقد أكدنا أن حجم رد الفعل من 5 ميكرولتر قادر على تحقيق نتائج مماثلة لتلك التي تحققت باستخدام 20 ميكرولتر حجم 4،7،30. خفض حجم رد الفعل إلى 5 ميكرولتر يسمح لانخفاض 75٪ في تكاليف كاشف دون خسارة ملموسة في الحساسية. كما وردت في الشكل 2، حجم رد فعل 20 ميكرولتر و 5 ميكرولتر تظهر وجود علاقة قوية حتى 39 دورات (مع ص 2 من 0.92، P = 0.0002).
وتقدم مجموعة على microfluidics أداة للحصول على بيانات عن 754 miRNAs أعرب في عينة في حوالي 5 ساعات (للحصول على بطاقة ألف وبطاقة B)، والذي هو وسيلة أكثر كفاءة لتحليل عينات متعددة بالمقارنة مع التقليدية 96 تقارير إتمام المشروعات لوحة جيدا. قارنا ميرنا بطاقات مجموعة على microfluidics لنفس العينة (عينة ألف وعينة تكرار) الشكل 3A - B يظهر مؤامرة بلاند-التمان (<قوي> 3A) ومؤامرة الارتباط (3B) لجميع miRNAs 754 اختبار هذه العينات. هناك 3 miRNAs التحكم المختلفة (U6، RNU44 وRNU48) وضعت بشكل عشوائي على كل من بطاقات (بطاقة ألف وباء) في مواقع متعددة. عند مقارنة عتبة دورة U6 (ط) القيم بين أشواط 2، ونحن لم نلاحظ اختلافات كبيرة بين القيم (الجدول 4). ومن المهم أيضا أن نلاحظ هنا أن يتم التعبير عن U6 في أكبر وفرة (انخفاض قيمة ط م) في العينة التي تم تقييمها. نحن ثم مقارنة كل miRNAs التي تحتوي على قيم ط م بين 0-19،99 في كل من أشواط (ن = 150)، والتي كان التعبير مماثل من miRNAs عموما مع المشارك الفعال في تقرير من 98٪ (الشكل 3C-D). جميع 277 miRNAs التي تحتوي على قيم ط م بين 20 و 29.99 في كل من يدير، اختلف 16 ميرس كبيرا بين أشواط الأصلية وتكرار (الشكل 3E - F) عدد من miRNAs مع اختلاف كبير بين:.ن تشغيل زادت (89 من 327) عندما تم اختيار القيم ط بين 30-40 لكل من يعمل (الشكل 3G - H).
وتوفر منصة علم الموائع النانوي مجموعة البيانات عن 754 miRNAs من كل عينة المصل / البلازما اختبارها، والمتمثلة في الشكل 4A ومن المهم دراسة هذه المنحنيات التضخيم - كما هو الحال مع جميع QPCR - لضمان أن تكون النتيجة هي تدل على التضخيم صحيح. يحتوي كل من 48 subarrays (الشكل 1) أيضا فحص ل "التدبير المنزلي" ncRNAs الأكثر شعبية الثلاثة:. U6، RNU44 وRNU48 الشكل 4B يوضح تجميع نموذجية من U6 يتطابق من عينة واحدة. تعرض هذه مكررات منخفضة الانحراف المعياري (SD <0.5) وهلم هي مؤشر على الاعتمادية. بدلا من ذلك، الشكل 4C يدل على التباين المتزايد للمكررات U6 (SD> 0.5) في العينة الثانية. هذا لا ينفي صحة سو المقايسات المتبقية، على الرغم من أنه لا يتطلب نقد أكثر شمولا. U6، كما هو الحال مع معظم miRNAs "التدبير المنزلي" في السوائل البيولوجية، يمكن أن يكون تعبيرا متغير. وتجدر الإشارة إلى أن واحدة من العينات، والموضحة في الشكل 4C، يعرض 4 أضعاف أقل محتوى من U6 التي قدمت في الشكل 4B. إذ أن مستوى U6 في العينة المعروضة في 4C هو 75٪ أقل لتبدأ من واحد قدم في لوحة 4B، ومن المتوقع بسبب توزيع بواسون من النصوص، التي تزداد تفاقما بسبب حجم رد الفعل صغير 17 تقلب الفني أكبر.
أداة أخرى مفيدة وهي مراقبة الجودة (QC) صور، المتاحة للتصدير مرة واحدة اكتمال التشغيل. مجموعة مختارة من هذه تستخدم مضان من ROX، الصبغة السلبي وجدت في كاشف مزيج QPCR، للتأكد من أن كل من خلال حفرة تم تحميل (الشكل 5) بشكل صحيح. A-حفرة من خلال، أو في الواقع EN subarray الإطارات، قد لا يتم تحميل بسبب عدم كفاية حجم العينة، التبخر، فقاعات موجودة في آبار من لوحة عينة 384 أيضا، فشل تماما لإزالة ختم لوحة عينة، أو عيوب في إطار منظومة Accufill أو نصائح به. أي تفريغ يجب تحديدها من خلال ثقوب لتجنب miRNAs وضع العلامات على أنها "غير قابلة للكشف"، بينما في الحقيقة الفحص تم تحميل أبدا. إذا واجهت هذه المشكلة، تأكد من أن لا يقل عن 5 ميكرولتر من عينة / mastermix يتم تحميل في كل بئر من لوحة عينة 384 أيضا، يتم طرد لوحة عينة بشكل صحيح قبل التحميل، وختم احباط هو إزالتها تماما، وOpenArray تحميل مختومة الشرائح وتشغيلها ضمن الوقت المخصص لجميع أشواط متتالية. إذا القضايا تحميل لا تزال قائمة، وهذه قد تكون أكثر عرضة المتعلقة دفعة محددة أو الكثير من صفائف أو المواد الاستهلاكية ذات الصلة ومزيد من المساعدة ينبغي السعي من خلال الشركة المصنعة.
"SRC =" / الملفات / ftp_upload / 52586 / 52586fig1.jpg "/>
الشكل 1: التخطيط من العينات لصفيف سير العمل علم الموائع النانوي: (A) كل لوحة عينة 384 بشكل جيد يمكن أن تعقد عينات لمدة تصل إلى 8 صفائف علم الموائع النانوي. (B) المخففة، يتم وضع تضخيم ما قبل [كدنا إلى 8 آبار (2 الأعمدة بنسبة 4 صفوف)، حمام سباحة للوبركة B في مجموعات 8 جيدا المجاورة. كل دائرة تمثل بئر واحدة. (C) كل بئر من لوحة عينة سيتم تحميلها في subarray واحدة من مجموعة علم الموائع النانوي. ويمثل كل مربع صغير subarray واحد.
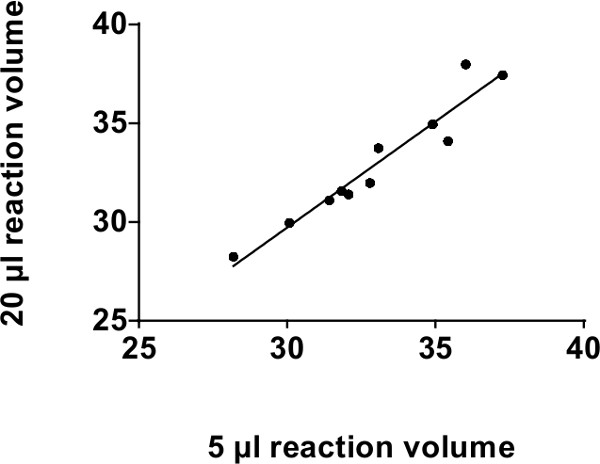
الشكل 2: تحليل المشارك بالنسبة للالتقليدية 96-جيدا منصات PCR: شارك في العلاقة بين 20 ميكرولتر و 5 مجلدات ميكرولتر رد فعل على TAQMAN في الوقت الحقيقي QPCR باستخدام منصة لوحة معيار 96-جيدا في القيم CT (39 دورات). قارنا 4 الرنا الميكروية مختلفة (مير-375، مير 30C، 30D مير ومير-7) في 4 المصل والبلازما العينات البشرية المختلفة. يتم رسم نقاط البيانات فقط 11 منذ كان الآخرون لا يمكن الكشف عنها. R 2 = 0.92، ع = 0.0002.
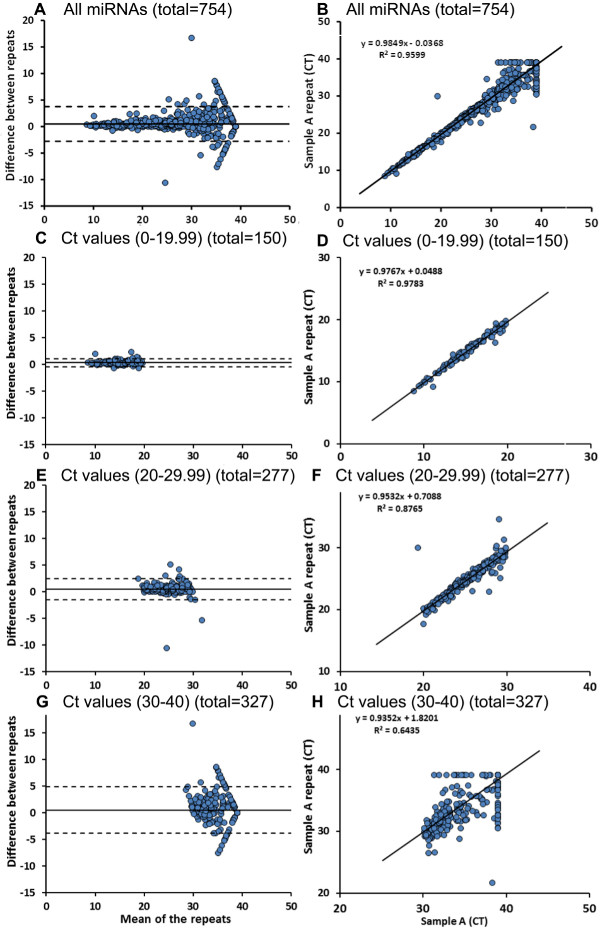
. الشكل (3): تداول ميرنا التنميط باستخدام بطاقات على microfluidics مجموعة عن طريق بطاقات 2 على microfluidics (بطاقة-A وبطاقة-B)، يتم إنشاء الملف الشخصى 754 miRNAs (A - B). كما هو موضح هنا، استخدمنا نفس العينة لمدة 2 على microfluidics مجموعة تدير للتحقق استنساخ نتائج بطاقة على microfluidics. لاحظنا تعبير مماثل من miRNAs عموما، مع القيم ط بين 0 حتي 19،99 (C - D). هناك عدد قليل من miRNAs (16 من 277) مع القيم ط بين 20 حتي 29،99 وهامة الاختلافات بين تكرار أشواط (E - F). تسعة وثمانون من 327الرنا الميكروية مع القيم ط أعلى (30-40) أظهرت اختلافات كبيرة بين كل من أشواط (G - H). ويتم تحليل البيانات باستخدام تقرن اختبار T. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
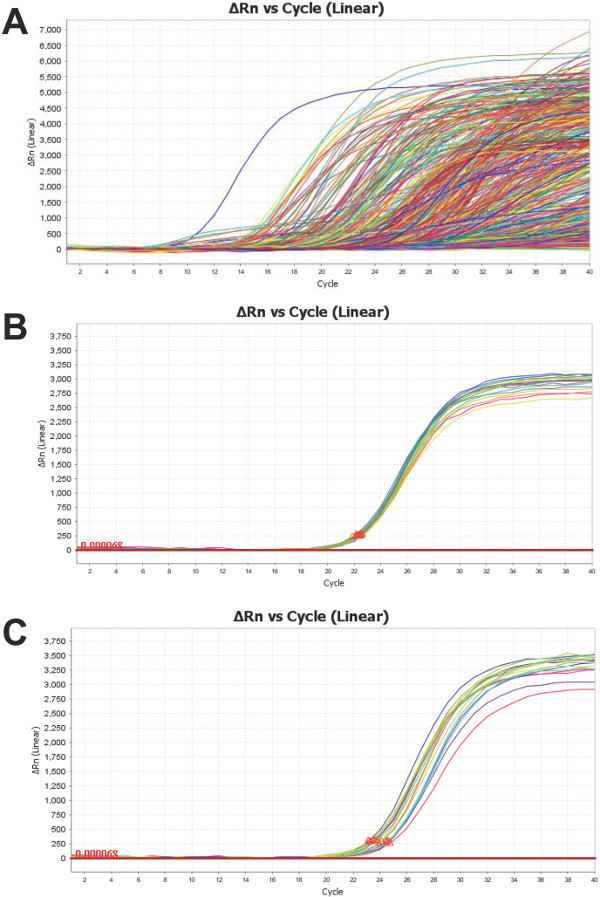
الشكل 4: الممثل الشخصي للمنحنيات PCR المنتج التضخيم: هو شخصية ممثل من الجمع بين منحنيات (A) التضخيم من جميع الأهداف ميرنا لعينة البلازما البشرية. يتم وضع مقايسة لU6 (أ سيطرة مشتركة ncRNA) في كل subarray. يوضح النموذج في (ب) تقلب منخفض (SD <0.5) بينما (C) ويظهر الانحراف المعياري عالية (SD> 0.5) داخل U6 يعيد. كل من العينات TOTAل RNA معزولة من البلازما البشرية. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الشكل 5: تحليل QC من علم الموائع النانوي صفائف: مراقبة الجودة (QC) صور لعلم الموائع النانوي مجموعة تحميلها بشكل صحيح (يسار) وعلم الموائع النانوي مجموعة تحميلها بشكل غير صحيح (يمين). الصبغة السلبي، ROX (موجودة في كاشف مزيج QPCR)، تتفلور للإشارة إلى تحميلها بشكل صحيح من خلال حفرة. مجموعة على اليمين لديها العديد من subarrays / من خلال الثقوب التي لم يتم تحميلها مع كاشف مزيج QPCR وهذه يجب تحديدها على أنها ردود فعل PCR سلبية كاذبة.
| مكونات | حجم في 5 رد فعل ميكرولتر (ميكرولتر) |
| RT عازلة (10X) | 0.5 |
| dNTPs (100 ملي) | 0.05 |
| ريبونوكلياز المانع | 0.6 |
| nuclease خالية من المياه | 1.39 |
| الناسخ العكسي | 0.33 |
| الحجم الإجمالي | 2.33 |
الجدول 1A: RT مكونات المزيج كاشف في 5 ميكرولتر RT إعداد رد فعل لTAQMAN في الوقت الحقيقي QPCR باستخدام منصة موحدة لوحة 96-جيدا.
| مكونات | حجم في 5 رد فعل ميكرولتر (ميكرولتر) | حجم في 20 رد فعل ميكرولتر (ميكرولتر) |
| سريع PCR mastermix (2X) | 2.5 | 10 |
| TAQMAN QPCR فحص (20x و) * | 0.25 | 1 |
| nuclease خاليةماء | 1.45 | 5.8 |
| إجمالى حجم التداول: | 4.2 | 16.8 |
* عنصر الفحص على أساس ميرنا اختيار اختبارها.
الجدول 1B: QPCR مكونات المزيج كاشف في 5 أو 20 ميكرولتر QPCR إعداد رد فعل لTAQMAN في الوقت الحقيقي QPCR باستخدام منصة موحدة لوحة 96-جيدا.
| مكونات | حجم في رد الفعل (ميكرولتر) |
| ميجابلكس RT الاشعال (10X) | 0.8 |
| dNTPs مع dTTp (100 ملي) | 0.2 |
| Multiscribe الناسخ العكسي (50 U / ميكرولتر) | 1.5 |
| 10X RT العازلة | 0.8 |
| MgCl 2 (25 ملي) | 0.9 |
| ريبونوكلياز المانع & # 160؛ (20 U / ميكرولتر) | 0.1 |
| Nuclease خالية من المياه | 0.2 |
| مجموع | 4.5 |
الجدول 2A: RT مكونات المزيج كاشف في 5 ميكرولتر RT إعداد رد فعل لوحة TLDA ميرنا.
| مكونات | حجم في رد الفعل (ميكرولتر) |
| TAQMAN preamp وMastermix (2X) | 12.5 |
| ميجابلكس preamp والاشعال (10X) | 2.5 |
| nuclease خالية من المياه | 7.5 |
| مجموع | 22.5 |
الجدول 2B: preamp ومكونات المزيج كاشف في إعداد رد فعل 25 ميكرولتر قبل amplication لوحة TLDA ميرنا.
"هوامش الخلية =" 0 "> مكونات حجم في رد الفعل (ميكرولتر) ميجابلكس RT الاشعال (10X) 0.75 dNTPs مع dTTp (100 ملي) 0.15 Multiscribe الناسخ العكسي (50 U / ميكرولتر) 1.5 10X RT العازلة 0.75 MgCl 2 (25 ملي) 0.9 ريبونوكلياز المانع (20 U / ميكرولتر) 0.09 Nuclease خالية من المياه 0.35 مجموع 4.53A الجدول: RT مكونات المزيج كاشف في 5 ميكرولتر RT إعداد رد فعل لالقائم على التحقيق لوحة علم الموائع النانوي ميرنا.
| عنصرالصورة | حجم في رد الفعل (ميكرولتر) |
| TAQMAN preamp وMastermix (2X) | 12.5 |
| ميجابلكس preamp والاشعال (10X) | 2.5 |
| nuclease خالية من المياه | 7.5 |
| مجموع | 22.5 |
الجدول 3B: preamp ومكونات المزيج كاشف في إعداد رد فعل 25 ميكرولتر قبل amplication لالقائم على التحقيق لوحة علم الموائع النانوي ميرنا ملاحظة: التكميلية التفاعلية جداول البيانات إكسل ينص على المنصات الثلاث، وحسابات بالفعل لإضافة 5٪ للتعويض عن pipetting لخطأ.
| عينة A | عينة تكرار |
| 15،535 | 16،156 |
| 15،471 | 15،652 |
| 15.623 | 16،063 |
| 15،963 | 15،889 |
| 14،006 | 13.993 |
| 14،502 | 14،623 |
| 14،907 | 14،384 |
| 13،732 | 14،946 |
الجدول 4: تداول ميرنا U6 التنميط باستخدام بطاقة على microfluidics مجموعة. باستخدام اثنين من بطاقات مجموعة على microfluidics (A و B). ط م القيم من ميرنا السيطرة U6 من عينة ألف (الكلي = 8). السيطرة U6 متسقة ميرنا وفرة لوحظ بين أشواط.
Discussion
الخطوات الحاسمة ضمن بروتوكولات QPCR القائم على التحقيق للحصول على نتائج دقيقة وقابلة للتكرار هي للتأكد 1) يتم تحميل نفس حجم وتركيز RT-المنتج في كل رد فعل QPCR، 2) النسب والأحجام الصحيحة للمكونات اللازمة ل تعد رد فعل QPCR ومختلطة جيدا، و3) يتم إضافة كميات صحيحة وثابتة على كل رد فعل QPCR، و4) الانتهاء من إعداد وتحميل كل عينة ورد فعل المزيج في اقصر وقت ممكن، في حين لا تزال تضع في اعتبارها الخطوات الحاسمة المذكورة أعلاه في وقت سابق.
بطاقات مجموعة على microfluidics تحتاج الطرد المركزي مناسبة والدلاء محددة. كل دلو يمكن أن تعقد ما يصل إلى 3 بطاقات (تحميل / فارغ). تأكد دائما أن جميع فتحات 3 من دلو واحتل ومتوازن دلو من خلال وضع دلو مماثل (وينبغي أن تتضمن هذه دلو أيضا 3 بطاقات، إما فارغة أو كاملة) في فتحة نقيض من أجهزة الطرد المركزي. في حين وضع البطاقة في دلور حامل، تأكد من أن 8 خزانات تتوقع صعودا ويواجه آبار رد فعل الجدار الخارجي للطرد المركزي. تدور البطاقات في 331 x ج لمدة 1 دقيقة في درجة حرارة الغرفة. بعد أول تدور، فتح الطرد المركزي وضمان بصريا تم الاستغناء عن مزيج التفاعل من خلال الآبار 384. كرر تدور في نفس الإعدادات ل1 المزيد من الوقت. إزالة البطاقة من دلو والتأكد من أن مستوى مزيج رد فعل في كل من 8 خزانات غير موحد. أي تضارب في حجم السائل اليسار في الخزانات تجعل البطاقة غير مناسب لمواصلة استخدامها.
لدينا نفس التركيز من RT-المنتج، يضاف نفس التركيز المدخلات من الحمض النووي الريبي في كل رد فعل RT. يتم قياس التركيز الكلي RNA باستخدام volumespectrophotometer الدقيقة. لاحظ نسبة 260/280 يمكن أن تكون منخفضة مثل 1.3 لRNA معزولة عن بلازما / مصل. هذا لا يبدو أن يكون لها تأثير على عملية المصب المتعلقة QPCR أو البيانات ولدت 30. وبالمثل، فإن نسبة 260/280 منكانت عينات الحمض النووي الريبي اختبارها هنا بين 1.3-1.7 مع أي آثار غير طبيعية في QPCR ملاحظتها.
عند استخدام عينات منخفضة المحتوى RNA، مثل تلك التي من biofluids، قد يكون من الصعب تحديد RNA قبل المعالجة. ونحن نوصي استخدام الاصطناعية ارتفاع في في عزل الحمض النووي الريبي وكذلك المراحل النسخ العكسي. في تجربتنا، والمرشحين نبات الأرابيدوبسيس thaliana ميرنا (ATH-مير 159a وATH-مير 172a) ويفضل على انواع معينة ايليجانس miRNAs (مثل سل-مير-39 أو سل-مير-54) التي في تجربتنا قد يكون أعلى، التماثل من تلك التي من A. thaliana. استخدام هذا الارتفاع في مرحلة معينة يمكن حساب لتطبيع البيانات ميرنا عبر عينات متعددة يعاير في أوقات مختلفة. باستخدام حجم المدخلات الثابتة من الحمض النووي الريبي لرد فعل التوليف [كدنا] ويوصى أيضا 32،33.
ووصفت البروتوكولات القائمة على التحقيق الثلاثة لميرنا الكمي هنا تتطلب كميات متفاوتةمن إجمالي المدخلات RNA، سير العمل وتكاليف مختلفة. تم تصميم كل من سير العمل لتلبية احتياجات الانتاجية المختلفة استنادا إلى عدد من الأهداف ميرنا وعدد من العينات لتحليلها. مع زيادة الإنتاجية (96 rxn 384 rxn 3072 rxn)، والتكلفة لكل رد فعل تتناقص مع زيادة في كمية البيانات التي تم الحصول عليها خلال وحدة الزمن. بما أن جميع هذه المنصات الاستفادة الكيمياء TAQMAN، ونوعية البيانات التي تم الحصول عليها يمكن أن يتوقع أن تكون مشابهة. TAQMAN QPCR هي طريقة راسخة للتعرف على وفرة من miRNAs في عينات المصل / البلازما 9،11،27. على الرغم من أن المنابر الثلاثة التي نوقشت هنا يشتركان فى نفس والكيمياء، وانخفاض في حجم رد الفعل يؤدي إلى انخفاض في النطاق الديناميكي للكشف عن نسخة (فار RJ آخرون، بيانات غير منشورة). منصة 96-جيدا QPCR هو الإنتاجية أقل، ولكن منصة حساسية عالية ورأينا أن "المعيار الذهبي" للجميع (أو صبغ أساس) القائم على التحقيق منصات PCR. ومع ذلك، وهذا قدلن تكون منصة الأكثر اقتصادا أو كفاءة إذا كان يتم يعاير عدة مئات أو آلاف من العينات وعن الرنا الميكروية متعددة. على microfluidics (TLDA) وعلم الموائع النانوي (OA) منصات هي منصات عالية الإنتاجية / المحتوى صممت للسماح الحصول على بيانات أكبر في وقت أقصر. على الرغم من أن لوحظت اختلافات دفعة في بطاقات TLDA، وهذا يمكن أن يكون الحد الأدنى عن طريق طلب بطاقات TLDA من نفس الدفعة. ونلاحظ أن منصة TLDA (الشكل 3) أظهرت تفاوت كبير في 17٪ من منتصف - miRNAs فرة منخفضة عند اختبارها باستخدام نفس العينة على دفعات مختلفة من بطاقات TLDA. ولذلك نوصي باستخدام الأرقام دفعة نفس لتحليلها باستخدام بطاقات TLDA. يمكن أن يكون هذا الاختلاف أيضا يرجع إلى التباين الفني بما في ذلك أي التحميل وpipetting لأخطاء محتملة. ومع ذلك، فإننا نوصي أمر / طلب نفس دفعة من بطاقات TLDA. وقد لوحظ عدم وجود اختلاف دفعة كبير على منصة OA. على الرغم من هذا، TAQMAN التجربه مقرهانهج التل QPCR العرض سهولة لقياس وفرة miRNAs في عينات البلازما / المصل. النهج الإنتاجية المنخفضة والمتوسطة والعالية مناقشتها هنا توفر المرونة لتحليل مجموعة من العينات وmiRNAs باستخدام كفاءة عالية، قابلة للتكرار ونظيفة (انخفاض الضوضاء في الخلفية) الكيمياء.
Disclosures
تمت تغطية تكاليف تجهيز المادة / نشر بواسطة تقنيات الحياة، بعد قبول هذه المخطوطة للنشر.
Acknowledgements
تعترف جميع المؤلفين دعم البنية التحتية من NHMRC CTC، جامعة سيدني، ومؤسسة أبحاث السكري الأحداث (JDRF)، وأستراليا، ومؤسسة كوبر ريبيكا واستراليا. وقد تم تمويل هذا البحث من خلال المنح المقدمة من المجلس الأسترالي للبحوث (FT110100254) وJDRF، أستراليا (CRN201314) إلى آآآه WW، RJF وحملت MVJ من كل التجارب المخبرية الرطب، قامت ASJ من تحليل البيانات. كتب WW المسودة الأولى. آآآه التخطيط لدراسة وتحليل البيانات. جميع المؤلفين قراءة واتفقت على الصيغة النهائية للمخطوطة والأرقام وأوراق العمل المقدمة للنشر.
Materials
| Name | Company | Catalog Number | Comments |
| 96 well-platform | |||
| For Reverse transcription | |||
| TaqMan MicroRNA Assays INV SM | Applied Biosystems | 4427975 | https://www.lifetechnologies.com/au/en/home/life-science/pcr/real-time-pcr/real-time-pcr-assays/mirna-ncrna-taqman-assays/single-tube-mirna-taqman-assays.html?ICID=search-4427975 The assays comes as a pack of RT primers and PCR primer. |
| TaqMan MicroRNA Reverse Transcription Kit | Applied Biosystems | 4366597 or 4366596 | https://www.lifetechnologies.com/order/catalog/product/4366597?ICID=search-4366597 or http://www.lifetechnologies.com/order/catalog/product/4366596?ICID=search-4366596 The TaqMan MicroRNA Reverse Transcription Kit is the same kit used for reverse transcription in all the threeTaqMan platform- 96-well platform, TLDA and OpenArray. |
| For qPCR run on a 96-well platform | |||
| 2x TaqMan Fast Universal PCR Master Mix, no AmpErase UNG | Applied Biosystems | 4367846 | https://www.lifetechnologies.com/order/catalog/product/4367846?ICID=search-4367846 The 2X TaqMan Fast Universal PCR Master Mix is used for qPCR on the two TaqMan platforms-96-well platform and TLDA. |
| MicroAmp Optical Adhesive Film | Applied Biosystems | 4311971 | https://www.lifetechnologies.com/order/catalog/product/4311971?ICID=search-product |
| MicroAmp Fast Optical 96-Well Reaction Plate, 0.1 ml | Applied Biosystems | 4346907 | https://www.lifetechnologies.com/order/catalog/product/4346907?ICID=search-product |
| Microfluidics platform (TLDA) | |||
| For Reverse transcription | |||
| Refer to 96-well platform TaqMan MicroRNA Reverse Transcription Kit kit (4366597 or 4366596) (as shown above). | |||
| Megaplex RT Primers, Human Pool A v2.1 | Applied Biosystems | 4399966 | https://www.lifetechnologies.com/order/catalog/product/4399966?ICID=search-4399966 The Megaplex RT Primers, Human Pool A v2.1 is used for RT on the two TaqMan platforms- TLDA and OpenArray. |
| Megaplex RT Primers, Human Pool B v3.0 | Applied Biosystems | 4444281 | https://www.lifetechnologies.com/order/catalog/product/4444281?ICID=search-4444281 The Megaplex RT Primers, Human Pool B v3.0 is used for RT on the two TaqMan platforms- TLDA and OpenArray. |
| OR | OR | ||
| Megaplex Primer Pools, Human Pools Set v3.0 | Applied Biosystems | 4444750 | http://www.lifetechnologies.com/order/catalog/product/4444750?ICID=search-4444750 The Megaplex Primer Pools, Human Pools Set v3.0 is used for RT on the two TaqMan platforms- TLDA and OpenArray. |
| For Pre-amplification | |||
| TaqMan PreAmp Master Mix | Applied Biosystems | 4391128 or 4488593 | https://www.lifetechnologies.com/order/catalog/product/4391128?ICID=search-4391128 or http://www.lifetechnologies.com/order/catalog/product/4488593 The TaqMan PreAmp Master Mix is used for pre-amplification of qPCR on the two TaqMan platforms- TLDA and OpenArray. |
| Megaplex PreAmp Primers, Human Pool B v3.0 | Applied Biosystems | 4444303 | https://www.lifetechnologies.com/order/catalog/product/4444303?ICID=search-4444303 The Megaplex PreAmp Primers, Human Pool B v3.0 is used for pre-amplification of qPCR on the two TaqMan platforms- TLDA and OpenArray. |
| Megaplex PreAmp Primers, Human Pool A v2.1 | Applied Biosystems | 4399233 | https://www.lifetechnologies.com/order/catalog/product/4399233?ICID=search-4399233 The Megaplex PreAmp Primers, Human Pool A v2.1 is used for pre-amplification of qPCR on the two TaqMan platforms- TLDA and OpenArray. |
| 1x TE Buffer (100 ml) | Invitrogen | 12090-015 | https://www.lifetechnologies.com/order/catalog/product/12090015?ICID=search-product The 1x TE Buffer is used for pre-amplification of qPCR on the two TaqMan platforms- TLDA and OpenArray. |
| To load and run the 384 well microfluidics (TLDA) card | |||
| TaqMan Array Human MicroRNA A+B Cards Set v3.0 | Applied Biosystems | 4444913 | https://www.lifetechnologies.com/order/catalog/product/4444913 |
| Nanofluidics platform (OpenArray) | |||
| For Reverse transcription | |||
| Refer to 96-well platform TaqMan MicroRNA Reverse Transcription Kit kit (4366597 or 4366596) (as shown above). | |||
| For Pre-amplification | |||
| Refer to TLDA pre-amplification reagents (as shown above) | |||
| To load and run the slides | |||
| TaqMan OpenArray Human MicroRNA Panel, QuantStudio 12K Flex (1 panel) | Applied Biosystems | 4470187 | https://www.lifetechnologies.com/order/catalog/product/4470187?ICID=search-4470187 |
| QuantStudio 12K Flex OpenArray Accessories Kit | Applied Biosystems | 4469576 | https://www.lifetechnologies.com/order/catalog/product/4469576?ICID=search-4469576 |
| OpenArray 384-well Sample Plates | Applied Biosystems | 4406947 | https://www.lifetechnologies.com/order/catalog/product/4406947?ICID=search-4406947 |
| TaqMan OpenArray Real-Time PCR Master Mix | Applied Biosystems | 4462159 | https://www.lifetechnologies.com/order/catalog/product/4462159?ICID=search-4462159 |
| OpenArray AccuFill System Tips | Applied Biosystems | 4457246 | https://www.lifetechnologies.com/order/catalog/product/4457246?ICID=search-4457246 |
| Others | |||
| Nuclease-Free Water | Qiagen | 129117 | http://www.qiagen.com/products/catalog/lab-essentials-and-accessories/nuclease-free-water |
References
- Ambros, V. The functions of animal microRNAs. Nature. 431, 350-355 (2004).
- Alvarez-Garcia, I., Miska, E. A. MicroRNA functions in animal development and human disease. Development. 132, 4653-4662 (2005).
- Bartel, D. P. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 116, 281-297 (2004).
- Joglekar, M. V., Wei, C., Hardikar, A. A. Quantitative estimation of multiple miRNAs and mRNAs from a single cell. Cold Spring Harb Protoc. 2010, pdb prot5478(2010).
- Joglekar, M. V., Parekh, V. S., Hardikar, A. A. Islet-specific microRNAs in pancreas development, regeneration and diabetes. Indian J Exp Biol. 49, 401-408 (2011).
- Farr, R. J., Joglekar, M. V., Taylor, C. J., Hardikar, A. A. Circulating non-coding RNAs as biomarkers of beta cell death in diabetes. Pediatr Endocrinol Rev. 11, 14-20 (2013).
- Joglekar, M. V., Joglekar, V. M., Hardikar, A. A. Expression of islet-specific microRNAs during human pancreatic development. Gene Expr Patterns. 9, 109-113 (2009).
- Iorio, M. V., Croce, C. M. MicroRNA profiling in ovarian cancer. Methods Mol Biol. 1049, 187-197 (2013).
- Mitchell, P. S., et al. Circulating microRNAs as stable blood-based markers for cancer detection. P Natl Acad Sci USA. 105, 10513-10518 (2008).
- Mattie, M. D., et al. Optimized high-throughput microRNA expression profiling provides novel biomarker assessment of clinical prostate and breast cancer biopsies. Mol Cancer. 5, 24(2006).
- Zhu, W., Qin, W., Atasoy, U., Sauter, E. R. Circulating microRNAs in breast cancer and healthy subjects. BMC Res Notes. 2, 89(2009).
- Zhu, H. T., et al. Identification of suitable reference genes for qRT-PCR analysis of circulating microRNAs in hepatitis B virus-infected patients. Mol Biotechnol. 50, 49-56 (2012).
- Yamada, H., Itoh, M., Hiratsuka, I., Hashimoto, S. Circulating microRNAs in autoimmune thyroid diseases. Clin Endocrinol (Oxf). , (2014).
- Liu, R., et al. Serum MicroRNA Expression Profile as a Biomarker in the Diagnosis and Prognosis of Pancreatic Cancer. Clinical Chemistry. 58, 610-618 (2012).
- Gilad, S., et al. Serum microRNAs are promising novel biomarkers. PLoS One. 3, e3148(2008).
- Joglekar, M. V., Parekh, V. S., Mehta, S., Bhonde, R. R., Hardikar, A. A. MicroRNA profiling of developing and regenerating pancreas reveal post-transcriptional regulation of neurogenin3. Dev Biol. 311, 603-612 (2007).
- Hardikar, A. A., Farr, R. J., Joglekar, M. V. Circulating microRNAs: understanding the limits for quantitative measurement by real-time PCR. J Am Heart Assoc. 3, e000792(2014).
- Wu, C., et al. Diagnostic and Prognostic Implications of a Serum miRNA Panel in Oesophageal Squamous Cell Carcinoma. PLoS One. 9, e92292(2014).
- McDonald, M. K., Capasso, K. E., Ajit, S. K. Purification and microRNA profiling of exosomes derived from blood and culture media. J Vis Exp. , e50294(2013).
- Joglekar, M. V., et al. The miR-30 family microRNAs confer epithelial phenotype to human pancreatic cells. Islets. 1, 137-147 (2009).
- Genda, Y., et al. microRNA changes in the dorsal horn of the spinal cord of rats with chronic constriction injury: A TaqMan(R) Low Density Array study. Int J Mol Med. 31, 129-137 (2013).
- Wang, B., et al. Systematic evaluation of three microRNA profiling platforms: microarray, beads array, and quantitative real-time PCR array. PLoS One. 6, e17167(2011).
- Cuk, K., et al. Circulating microRNAs in plasma as early detection markers for breast cancer. Int J Cancer. 132, 1602-1612 (2013).
- Morrison, T., et al. Nanoliter high throughput quantitative PCR. Nucleic Acids Res. 34, e123(2006).
- Git, A., et al. Systematic comparison of microarray profiling, real-time PCR, and next-generation sequencing technologies for measuring differential microRNA expression. RNA. 16, 991-1006 (2010).
- Benes, V., Castoldi, M. Expression profiling of microRNA using real-time quantitative PCR, how to use it and what is available. Methods. 50, 244-249 (2010).
- Chen, C., et al. Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Res. 33, e179(2005).
- Schmittgen, T. D., et al. Real-time PCR quantification of precursor and mature microRNA. Methods. 44, 31-38 (2008).
- Kodani, M., et al. Application of TaqMan low-density arrays for simultaneous detection of multiple respiratory pathogens. J Clin Microbiol. 49, 2175-2182 (2011).
- Taylor, C. J., Satoor, S. N., Ranjan, A. K., Pereirae Cotta,, V, M., Joglekar, M. V. A protocol for measurement of noncoding RNA in human serum. Exp Diabetes Res. 2012, 168368(2012).
- TPF & SPF File Download Options [Internet]. , Available from: http://www.appliedbiosystems.com/absite/us/en/home/products/tpf-spf-download.html (2014).
- Turchinovich, A., Weiz, L., Langheinz, A., Burwinkel, B. Characterization of extracellular circulating microRNA. Nucleic Acids Res. 39, 7223-7233 (2011).
- Li, Y., Kowdley, K. V. Method for microRNA isolation from clinical serum samples. Anal Biochem. 431, 69-75 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved