Method Article
EPA الطريقة 1615. قياس الفيروسة المعوية ونوروفيروس التواجد في المياه عن طريق الثقافة وRT-QPCR. الجزء الثالث. كشف الفيروس عن طريق RT-QPCR
In This Article
Summary
Here we present a procedure to quantify enterovirus and norovirus in environmental and drinking waters using reverse transcription-quantitative PCR. Mean virus recovery from groundwater with this standardized procedure from EPA Method 1615 was 20% for poliovirus and 30% for murine norovirus.
Abstract
EPA Method 1615 measures enteroviruses and noroviruses present in environmental and drinking waters. This method was developed with the goal of having a standardized method for use in multiple analytical laboratories during monitoring period 3 of the Unregulated Contaminant Monitoring Rule. Herein we present the protocol for extraction of viral ribonucleic acid (RNA) from water sample concentrates and for quantitatively measuring enterovirus and norovirus concentrations using reverse transcription-quantitative PCR (RT-qPCR). Virus concentrations for the molecular assay are calculated in terms of genomic copies of viral RNA per liter based upon a standard curve. The method uses a number of quality controls to increase data quality and to reduce interlaboratory and intralaboratory variation. The method has been evaluated by examining virus recovery from ground and reagent grade waters seeded with poliovirus type 3 and murine norovirus as a surrogate for human noroviruses. Mean poliovirus recoveries were 20% in groundwaters and 44% in reagent grade water. Mean murine norovirus recoveries with the RT-qPCR assay were 30% in groundwaters and 4% in reagent grade water.
Introduction
الكمي PCR (QPCR؛ انظر المواد التكميلية للحصول على تعريفات للمصطلحات المستخدمة في هذه المخطوطة) وعكس النسخ-QPCR (RT-QPCR) هي أدوات قيمة لكشف وقياس الفيروسات المعوية الإنسان في البيئة وشرب المياه، وخصوصا بالنسبة للعديد من الفيروسات التي تفعل لا تكرار أو تكرار ضعيفا في أنظمة زراعة الخلايا. وقد أثبتت كل من الأدوات أن العديد من أنواع الفيروسات الموجودة في المياه البيئية والشرب في جميع أنحاء العالم 1-6. وقد وفرت استخدامها إلى جانب تسلسل الجينوم شظايا تضخيم أثناء التحقيقات تفشي الأمراض دليل على انتقال الفيروس التي تنقلها المياه، كما أظهرت أن الفيروس الذي عثر عليه في مياه الشرب مطابقة لتلك التي تسلط من قبل المرضى اندلاع 7-10.
كلا QPCR وRT-QPCR هي أدوات الصحة العامة مفيدة. على سبيل المثال، أظهرت بيانات من الدراسات التي أجرتها وكالة حماية البيئة الأمريكية (EPA) علاقة قوية تكونقياسات مؤشر توين التي كتبها QPCR والآثار الصحية في المياه الترفيهية. ونتيجة لذلك، النهائية 2012 معايير جودة المياه الترفيهية وكالة حماية البيئة تشمل طريقة QPCR لرصد الشواطئ الترفيهية 11،12. كما وجدت بوركهارت وزملاؤه علاقة قوية بين التهاب المعدة والأمعاء الحاد في المجتمعات باستخدام المياه الجوفية غير المعالجة والفيروسات في المياه الجوفية التي تقاس RT-QPCR 1.
والغرض من هذه الورقة هو وصف المكون الفحص الجزيئي للEPA الطريقة 13،14 1615. يستخدم هذا الاختبار RT-QPCR لتقديم تقدير كمي لالمعوي ونسخ الجينوم نوروفيروس (GC) للتر الواحد استنادا إلى حجم الأصلي للمياه البيئي أو شرب مرت من خلال فلتر كهربي. وأظهرت لمحة عامة عن إجراء الجزيئي في الشكل القسم 1. بروتوكول 1 تفاصيل إجراءات إعداد منحنى قياسي. تم إعداد هذه المعايير من كاشف يحتوي على RNنسخة من تسلسل الهدف لجميع مجموعات التمهيدي / التحقيق. يصف القسم 2 الإجراء التركيز العالي. القسم 3 يعطي الإجراء لاستخراج الحمض النووي الريبي من عينات المياه والسيطرة المركزة. هو كتب الحمض النووي الريبي من كل عينة الاختبار العكس باستخدام فحوصات ثلاث نسخ والاشعال عشوائية لرئيس النسخ (القسم 4). يتم تقسيم كدنا] من كل رد فعل عكس النسخ إلى خمسة فحوصات الفيروس محددة منفصلة التي يتم تحليلها في ثلاث نسخ من قبل QPCR (القسم 5؛ الشكل 2). يستخدم فحص الاشعال وتحقيقات من الأدبيات العلمية (الجدول 1) التي تم تصميمها للكشف عن العديد من الفيروسات المعوية والنوروفيروس وكاشف تحتوي على التهاب الكبد G RNA لتحديد عينات الاختبار التي المثبطة لRT-QPCR 15.
Protocol
ملاحظة: اوراق البيانات استخدامها لتعقب جميع الخطوات من البروتوكول؛ يتم إعطاء أوراق سبيل المثال البيانات في جداول المواد التكميلية S2-S4.
1. معيار إعداد كيرف
- إعداد الأسهم عمل كاشف المنحنى القياسي (على سبيل المثال، المدرعة RNA EPA-1615) من خلال تمييع من تركيز الموردة من قبل الشركة المصنعة لتركيز 2.5 × 10 8 الجسيمات / مل (2.5 × 10 8 GC / مل) باستخدام TSM III العازلة. تقسيم الأسهم العمل إلى 250 مكل باستخدام 1.5 مل أنابيب microcentrifuge وتخزينها في -20 ° C.
ملاحظة: انظر تكميلية بروتوكول مواد الخطوة S1 حصول على تعليمات حول مخزونات العمل التي تعد من الفيروسات والبلازميدات لاستخدامها الكواشف منحنى القياسية البديلة. - ذوبان الجليد واحد أو أكثر من الأسهم قسامات العمل. إعداد خمسة التخفيفات المسلسل 10 أضعاف باستخدام 1.5 مل أنابيب microcentrifuge، وإعطاء تركيزات 2.5 × 10 7، 2.5 × 10 6، 2.5 ×10 5، 2.5 × 10 4، و 2.5 × 10 3 GC / مل.
- إعداد تخفيف الأول عن طريق إضافة 25 ميكرولتر من 2.5 × 10 8 GC / مل الأوراق المالية تعمل على 225 ميكرولتر من العازلة TSM III. مزيج من 5-15 ثانية باستخدام خلاط دوامة.
- إعداد تخفيف التالي من خلال إضافة 25 ميكرولتر من التخفيف أعدت في الخطوة 1.2.1 إلى 225 ميكرولتر من العازلة TSM III. مزيج من جديد ومواصلة عملية مماثلة لإعداد ثلاث التخفيفات 10 أضعاف المقبلة.
- استخراج الحمض النووي الريبي من الأسهم العمل المنحنى القياسي والتخفيفات الخمسة فورا باستخدام الإجراء في القسم 3.
2. التركيز العالي
- إعداد المكثف الطرد المركزي (30000 الجزيئي قطع الوزن) لكل عينة تم جمعها عن طريق إضافة ما لا يقل عن 10 مل من برنامج تلفزيوني 1X، 0.2٪ ألبومين المصل البقري (BSA) إلى حجرة العينة العليا. تأكد من أن الحل قد ملأت الغرفة تركيز قناة رقيقة، ثم اضغط O / N عند 4 درجات مئوية.
- تجاهل السائل. شطف المكثف مرة واحدة مع لا يقل عن 10 مل من الماء كاشف الصف معقم لإزالة BSA الزائد ومن ثم التخلص من المياه.
- إضافة كمية من التركيز المياه الثانوي من كل عينة اختبار تساوي S، وفحص حجم العينة في مركزات الطرد المركزي منفصلة.
- حساب S باستخدام المعادلة 1،
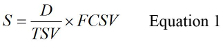
حيث D هو حجم الأصلي عينة المياه يعاير، TSV هو مجموع عينة حجم وFCSV هو النهائي المركزة عينة وحدة التخزين. انظر المواد التكميلية S2 للحصول على مثال لحساب S.
- حساب S باستخدام المعادلة 1،
- الطرد المركزي كل عينة الاختبار في 3،000-6،000 x ج في 4 درجات مئوية في الدوار دلو يتأرجح عن 20-30 دقيقة. تحقق وحدة التخزين في غرفة تركيز قناة رقيقة.
- وإذا كان حجم أكبر من 400 ميكرولتر، الطرد المركزي مرة أخرى لمدة 20 دقيقة أو أكثر. تواصل الطرد المركزي حتى العينة في التم تخفيض ه غرفة تركيز قناة رقيقة إلى أقل من 400 ميكرولتر. لا تقم بإزالة طاف.
- غسل جانبي المكثف الطرد المركزي مع 1 مل من العقيمة فوسفات الصوديوم 0.15 M، ودرجة الحموضة 7-7،5 لزيادة الانتعاش الفيروس. الطرد المركزي مرة أخرى في 3،000-6،000 x ج و 4 درجات مئوية حتى تم تخفيض العينة إلى أقل من 400 ميكرولتر. كرر هذه الخطوة يغسل مرة واحدة إضافية.
- باستخدام micropipette 100-200 ميكرولتر، وقياس بعناية ونقل كل عينة مركزة إلى 1.5 مل أنبوب microcentrifuge (أي نقل 200 ميكرولتر إلى أنبوب microcentrifuge ومن ثم قياس تركيز المتبقية عن طريق ضبط micropipette حتى يمكن استخلاص السوائل المتبقية تماما حتى في تلميح pipettor). إضافة 0.15 M فوسفات الصوديوم، ودرجة الحموضة 7-7،5، لضبط الحجم النهائي إلى 400 ± 2 ميكرولتر.
- استخراج الحمض النووي على الفور من قبل الشروع في الخطوة 3. عقد أي عينات المركزة التي لا يمكن بروكيسيد فورا عند 4 درجة مئوية لمدة لا تزيد عن 24 ساعة.
3. عزل الحمض النووي
- إضافة 200 ميكرولتر من استخراج العازلة أعد كما هو موضح في الخطوة 3.3 و 200 ميكرولتر من التركيز العالي من كل عينة اختبار من الخطوة 2.5 أو معيار منحنى التخفيف من الخطوة 1.3 لفصل المسمى 1.5 مل أنابيب microcentrifuge. تجميد المتبقية مركزات العالي عند أو أقل من -70 ° C. استخراج الأحماض النووية من كل عينة وفقا لتعليمات النووي استخلاص الحمض الشركة المصنعة عدة لبروتوكول تدور لعينات الدم مع الاستثناءات التالية.
- لا تقم بإضافة البروتيني لعينات المياه أو استخدام استخراج العازلة المرفق مع عدة استخلاص الحمض النووي.
- إعداد استخراج العازلة مع الناقل RNA
- إضافة 310 ميكرولتر من الناقل RNA العازلة التخفيف إلى قارورة تحتوي على 310 ميكروغرام من الناقل RNA. مزيج بحل ومن ثم تقسيمها إلى 6 قسامات تحتوي على حوالي 50 ميكرولتر. مخزن في -20° C.
- إضافة 28 ميكرولتر من الحمض النووي الريبي الناقل مذاب في مل من استخراج العازلة للحصول على تركيز الناقل RNA من 0.027 ميكروغرام / ميكرولتر. استخدام الحامل المعدل RNA استخراج العازلة بدلا من أن المرفق مع عدة الاستخراج.
- يعد حل سيد شطف العازلة بإضافة ريبونوكلياز (ريبونوكلياز) المانع لتركيز النهائي من 400 وحدة / مل لشطف العازلة المرفق مع عدة الاستخراج.
- أزل الحمض النووي الريبي من الحمض النووي ملزمة عمود الدوران عن طريق وضع 50 ميكرولتر من شطف العازلة مع ريبونوكلياز المانع في العمود. الانتظار لمدة 1 دقيقة، ثم الطرد المركزي في 6000 x ج لمدة 1 دقيقة في RT.
- كرر الخطوة 3.4.1 ومن ثم إزالة والتخلص من العمود.
- إعداد aliquots من مقتطفات الحمض النووي الريبي من الخطوة 3.4.2. إعداد 6 aliquots من المخزون العمل المنحنى القياسي وكل تخفيف منحنى القياسية التي تحتوي على ما لا يقل عن 15 ميكرولتر لكل منهما. إعداد 4 aliquots من جميع عينات الحمض النووي الريبي الأخرى التي تحتوي على ما لا يقل عن22 ميكرولتر لكل منهما. تخزين قسامة واحدة من كل عينة والمنحنى القياسي الضوابط في 4 درجات مئوية إذا كان يمكن معالجتها بواسطة النسخ العكسي في غضون 4 ساعات. خلاف ذلك، وتخزين جميع قسامات عند أو أقل من -70 ° C.
4. عكس النسخ (RT)
- إعداد 100 ميكرومتر حلول الأوراق المالية من كل التمهيدي قليل النوكليوتيد والتحقيق المدرجة في الجدول 1 بإضافة كمية المياه PCR الصف إلى كل قارورة باستخدام مبلغ (في ميكرولتر) يساوي عشرة أضعاف عدد nanomoles (نانومول) من النوكليوتيد الحالية في القارورة (كما هو موضح على الملصق قارورة أو في ورقة مواصفات الشركة المصنعة (على سبيل المثال، و resuspend التمهيدي تحتوي على 36.3 نانومول في 363 ميكرولتر). مزيج حل.
- تمييع 100 ميكرومتر الحلول 1:10 بالماء PCR الصف لإعداد 10 ميكرومتر حلول العمل.
- إعداد RT ميكس ماجستير 1 و 2 في غرفة نظيفة استخدام الدليل في الجدول 2. ماصة 16.5 ميكرولتر من RT Masteص ميكس 1 إلى كل لوحة PCR جيدا باستخدام ماصة الأقنية.
- ذوبان الجليد، إذا جمدت، ومقتطفات الحمض النووي من كل عينة الميدان ومختبر العصائر مصفوفة العينة (LFSM، أي المصنف عينة مصفوفة الماء).
- تمييع كل حقل وعينة LFSM 1: 5 و 1:25 في شطف العازلة التي تحتوي على 400 وحدة / مل من ريبونوكلياز المانع.
- ذوبان الجليد، إذا جمدت، ولكن لا يخفف مختبر المحصنة فارغ (LFB، أي لمراقبة الجودة إيجابية باستخدام كاشف المياه الصف المصنف)، ومختبر الكاشف فارغ (LRB، أي لمراقبة الجودة السلبية باستخدام كاشف المياه الصف)، وتقييم الأداء (PE ، أي كاشف المصنف عينات المياه الصف المستخدمة لتقييم أداء المختبر قبل بدء الدراسة)، واختبار الأداء (PT، أي عينات من المياه المصنف الصف كاشف مع التتر غير معروفة لأحد المحللين التي يتم استخدامها لتقييم أداء المختبر خلال دراسة )، NA دفعة السيطرة استخراج السلبية، أو الحمض النووي الريبي المستخرج من مجموعة منحنى القياسية.
- ضع 6.7 ميكرولتر من الحمض النووي الريبي من كل عينة الاختبار والسيطرة، والمنحنى القياسي في منفصلة الآبار لوحة PCR، وذلك باستخدام الآبار ثلاث نسخ لعينات الاختبار والضوابط وتكرار الآبار للمنحنيات القياسية (انظر الشكل S1 لوحة سبيل المثال RT).
- ضع 6.7 ميكرولتر من شطف العازلة في الآبار لوحة PCR منفصلة عن أي ضوابط القالب (NTC). تشمل 2-8 NTC في RT لوحة، وذلك باستخدام اثنين للعينة الأولى ثم اثنين من أكثر لكل عينة إضافية الرابعة.
- توزيع استخراج سلبي والضوابط المجلس الوطني الانتقالي في جميع أنحاء اللوحة.
- ختم لوحة PCR مع مقاوم للحرارة لوحة سداده. مزج العينات لمدة 5-10 ثانية ثم الطرد المركزي في ≥ 500 x ج لفترة وجيزة.
- احتضان لوحة لمدة 4 دقائق في 99 ° C ثم تبرد بسرعة إلى 4 درجات مئوية في cycler الحرارية. الطرد المركزي مرة أخرى في ≥ 500 x ج لفترة وجيزة.
- إزالة بعناية ختم لوحة ثم قم بإضافة 16.8 ميكرولتر من RT ميكس ماجستير 2 إلى كل بئر. SEآل لوحة مرة أخرى مع لوحة مقاومة للحرارة سداده، تليها خلط والطرد المركزي وجيزة في ≥ 500 ز س.
- وضع لوحة في cycler الحرارية وتشغيل لمدة 15 دقيقة في درجة حرارة 25 درجة مئوية، تليها 60 دقيقة عند 42 ° C، 5 دقائق عند 99 درجة مئوية، ومن ثم من قبل 4 ° C عقد دورة.
- العملية مباشرة أو في غضون 8 ساعات بواسطة QPCR (الخطوة 5)، أو عينات مخزن عند أو أقل من -70 ° C حتى يمكن معالجتها. مخزن العينات التي يمكن معالجتها في غضون 8 ساعات في 4 درجات مئوية.
5. في الوقت الحقيقي الكمي PCR (QPCR)
- تحديد متوسط قيمة التهاب الكبد G CQ لكل الكثير من التهاب الكبد G كاشف قبل تشغيل أي عينات الاختبار.
- تشغيل فحص RT باستخدام 10 مكررات أعد كما هو موضح لعناصر المجلس الوطني الانتقالي (الخطوة 4.1.1). تشغيل التهاب الكبد G QPCR الفحص كما هو موضح أدناه (الخطوات 5.2 إلى 5.5.3). حساب قيمة CQ متوسط من 10 مكررات.
- ضبط التهاب الكبد G كمية كاشف في RT ميكس ماجستير 1 (الجدول 2)، إذا لزم الأمر، للحصول على قيمة CQ متوسط ما بين 25 و 32 وحدة. تعويض بمبلغ رفع أو خفض عن طريق تغيير حجم الماء المضاف للحفاظ على الحجم النهائي RT ميكس ماجستير 1 في 16.5 ميكرولتر في الفحص.
- تأكيد أي تعديلات بتكرار الخطوات 5.1.1 إلى 5.1.2 وتغيير الجدول رقم 2 لتعكس كميات المعدلة.
- إعداد QPCR يمزج الماجستير في غرفة نظيفة باستخدام أدلة في الجدول رقم 3 لالمعوي، الجدول 4 والجدول 5 لنوروفيروس genogroup الأول، الجدول رقم 6 لنوروفيروس genogroup الثاني، الجدول 7 لنوروفيروس الفئران (نوروفيروس genogroup V)، والجدول رقم 8 لالتهاب الكبد G. ميكس كل مزيج الرئيسي ثم الطرد المركزي في ≥ 500 x ج لفترة وجيزة.
- إضافة يمزج سيد PCR إلى الآبار المناسبة وصفت لوحة رد فعل البصرية، وذلك باستخدام 14 ميكرولتر لكل بئر وألواح منفصلة لكل فحص QPCR (انظر الشكل S2 للتخطيط الممكن لفحص QPCR بناء على تخطيط RT في الشكل S1).
- ذوبان الجليد لوحة RT من الخطوة 4.8 في RT، إذا المجمدة. مزيج باستخدام خلاط لوحة ثم الطرد المركزي في ≥ 500 x ج لفترة وجيزة.
- الاستغناء عن 6 ميكرولتر من [كدنا المناسب إلى آبار المناسبة من لوحة رد فعل الضوئية. مزج العينات في لوحة رد فعل الضوئية وأجهزة الطرد المركزي في ≥ 500 x ج لفترة وجيزة.
- تشغيل التهاب الكبد G QPCR فحص على ارض الملعب غير مخفف والمخفف وعينات LFSM قبل تشغيل جميع المقايسات QPCR أخرى. استخدام أدنى التخفيف من الميدان أو عينة LFSM هذا هو <1 CQ قيمة أكبر من قيمة يعني التهاب الكبد G CQ لالمعوي ونوروفيروس المقايسات QPCR.
- إعداد الكمي PCR برنامج cycler الحرارية وفقا لتعليمات الشركة الصانعة. تحديد العينات منحنى القياسية حسب المعايير ولكل منحنى التخفيف القياسي، أدخل القيم نسخة الجينوم هو مبين في الجدول 9. تشغيل لوحة في الكمي PCR cycler الحرارية لمدة 10 دقيقة في درجة حرارة 95 درجة مئوية، تليها 45 دورات من 15 ثانية في 95 ° C و 1 دقيقة في 60 ° C.
- تحديد ما إذا كان كل منحنى قياسي يلتقي القيم المقبولة الواردة في الجدول 10. انظر قسم المواد التكميلية S3 للحصول على أمثلة.
- حساب الانحراف المعياري العام (StdDev) لالمنحنى القياسي باستخدام معادلة 2،
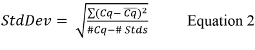
حيث CQ هو قيمة المبلغ عنها لكل منحنى تكرار القياسية، CQ هو القيمة المتوسطة لكل مجموعة من مكررات، #Cq هو العدد الإجمالي للقيم CQ لجميع مكررات التحكم القياسية التي تحتوي على قيم إيجابية (أي ليس غير محددة)، و# الأمراض المنقولة جنسيا هو عدد التحكم القياسية التي تحتوي على قيم إيجابية. - إذا لم الكمي PCR برنامج cycler الحرارية حساب المنحدر لكل منحنى قياسي، وحساب المنحدر باستخدام المعادلة 3،60؛
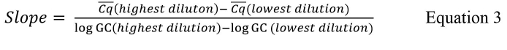
حيث CQ هي القيمة المتوسطة للأعلى وأدنى التخفيفات المستخدمة وتسجيل GC هو سجل من قيمة نسخة الجينومية للأعلى وأدنى التخفيفات المستخدمة من الجدول 9. - حساب قيمة R 2 باستخدام المعادلة 4.
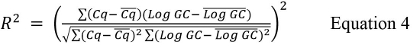
حيث CQ هو متوسط جميع القيم CQ ودخول GC هو متوسط قيمة دخول GC لكل تكرار. - حساب الكفاءة٪ باستخدام المعادلة 5:
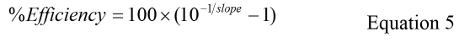
- حساب الانحراف المعياري العام (StdDev) لالمنحنى القياسي باستخدام معادلة 2،
- تسجيل القيم GC تحسب على أساس برنامج cycler الحرارية لجميع عينات الاختبار استنادا إلى منحنيات القياسية التي تفي بالمعايير المحددة في الجدول (10) والقيم GC يعني لكل عينة. إعادة تشغيل أي عينات مع المنحنيات القياسية التي لا تفي بالمعايير الواردة في الجدول 10 أو فيها أي ضوابط السلبية (LRB، NA دفعة السلبية السيطرة الاستخراج، أو NTC) هي إيجابية. إعادة معالجة أي عينات التي تفشل في تلبية معايير أو ضوابط إيجابية كاذبة خلال باعادتها.
- تحديد GC للتر الواحد (GC L) لكل عينة الاختبار باستخدام المعادلة 6:
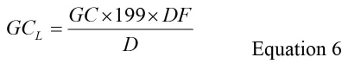
حيث GC هو متوسط عدد النسخ الجيني من الخطوة 5.7، وعامل '199' هو عامل التخفيف الكلي لخفض حدة التخزين التي تحدث أثناء تركيز العالي، استخراج الحمض النووي الريبي والخطوات RT-QPCR، DF هو عامل التخفيف الذي يعوض عن تثبيط وD هو حجم الأصلي عينة المياه يعاير في لتر. انظر المواد التكميلية قسم S4 للحصول على مثال لحساب GC L. - حساب GC الكلي للLFB وLRB عينات بضرب قيمة GC متوسط من الخطوة 5.5 199 وتقسيم بنسبة 0.3.
النتائج
تم تحديد فيروس استرداد الكلي باستخدام المجال تقرن وLFSM عينات المياه الجوفية. وقد تم تحليل ما مجموعه سبع مجموعات العينة باستخدام مجموعتين جمعت في مناسبات منفصلة عن ثلاث محطات لمعالجة العامة، ومجموعة واحدة عينة تم جمعها من البئر الخاص. وكانت مستويات البذور لعينات LFSM 3 × 10 6 MPN من سابين فيروس شلل الأطفال المصلي 3 و 5 × 10 6 PFU من نوروفيروس الفئران. وقد استخدم نوروفيروس الفئران كبديل في تقييم طريقة نظرا لعدم وجود مخزون نوروفيروس الإنسان مع تركيز الفيروس كافية لعينات LFSM. لعينات المياه الجوفية والانتعاش فيروس شلل الأطفال متوسط 20٪، مع الخطأ المعياري من 2٪، في حين أن 14 يعني كان الانتعاش نوروفيروس الفئران بنسبة 30٪، مع معيار الخطأ 3٪ (الشكل 3). وكانت عينة المياه الجوفية ميدانية منتظمة لكل LFSM لا المعوي كشفها أو نوروفيروس.
تم قياس LFB وLRB العينات باستخدام المصنف وغير المصنف وات كاشف الصف إيه. وكانت جميع العينات سلبية LRB (لا تظهر البيانات). متوسط الانتعاش فيروس شلل الأطفال 44٪ مع الخطأ المعياري من 1٪ (الشكل 3)، في حين بلغ متوسط الانتعاش نوروفيروس الفئران 4٪ مع خطأ قياسي من 0.5٪.
يتطلب RT-QPCR استخدام الكافية الكواشف منحنى معيار الشكل 4 يوضح منحنى قياسي نموذجي لالمعوي ونوروفيروس GII. منحنى نوروفيروس GII يفي بمعايير الأداء منحنى القياسية (الجدول 10) مع قيمة R 2 من 0.9987، وهو الانحراف المعياري العام 0.14، وكفاءة 101٪. نوروفيروس GIA والمنحنيات بنك الخليج الدولي (لا يظهر) هي متطابقة تقريبا لتلك التي نوروفيروس GII. منحنى المعوي يفي بمعايير الأداء الأسلوب مع قيمة R 2 من 0.9874، وهو الانحراف المعياري العام 0.58، وكفاءة 103٪، ولكن لديها نحو مئة أقل أضعاف حساسية، وبالتالي حد اكتشاف أعلى من منحنيات نوروفيروس.
الصفحة = "دائما"> 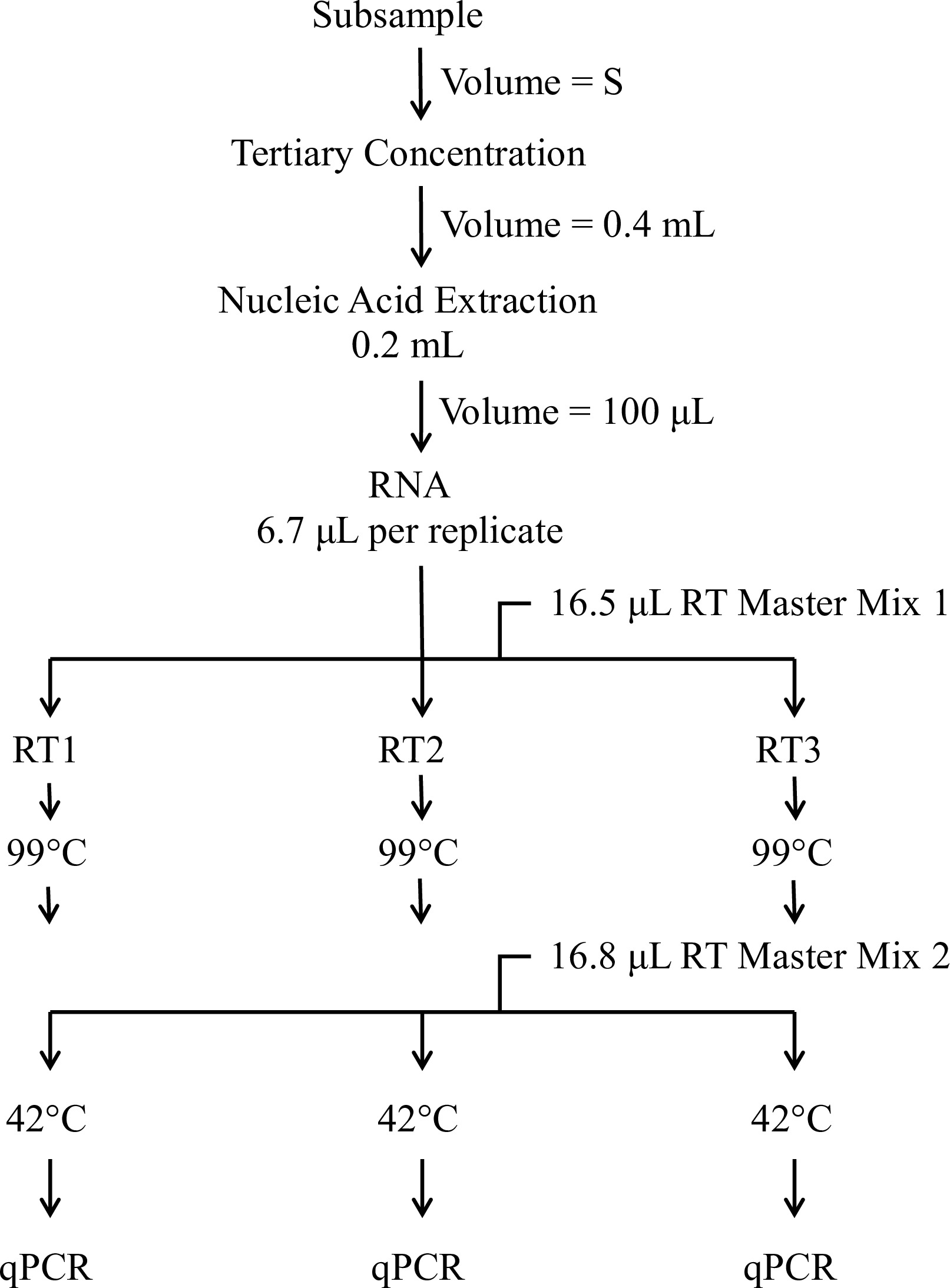
الشكل 1. نظرة عامة على الإجراءات الجزيئية. ويشمل الإجراء الجزيئي تركيز عينة إضافية بعد ذلك يقوم لقياس الفيروسات المعدية، واستخراج الأحماض النووية، على بعد خطوتين عكس النسخ بروتوكول (RT)، وكمي PCR (QPCR). حجم انطلاق (S) يمثل نسبة-طريقة محددة من عينة المياه الأصلية.
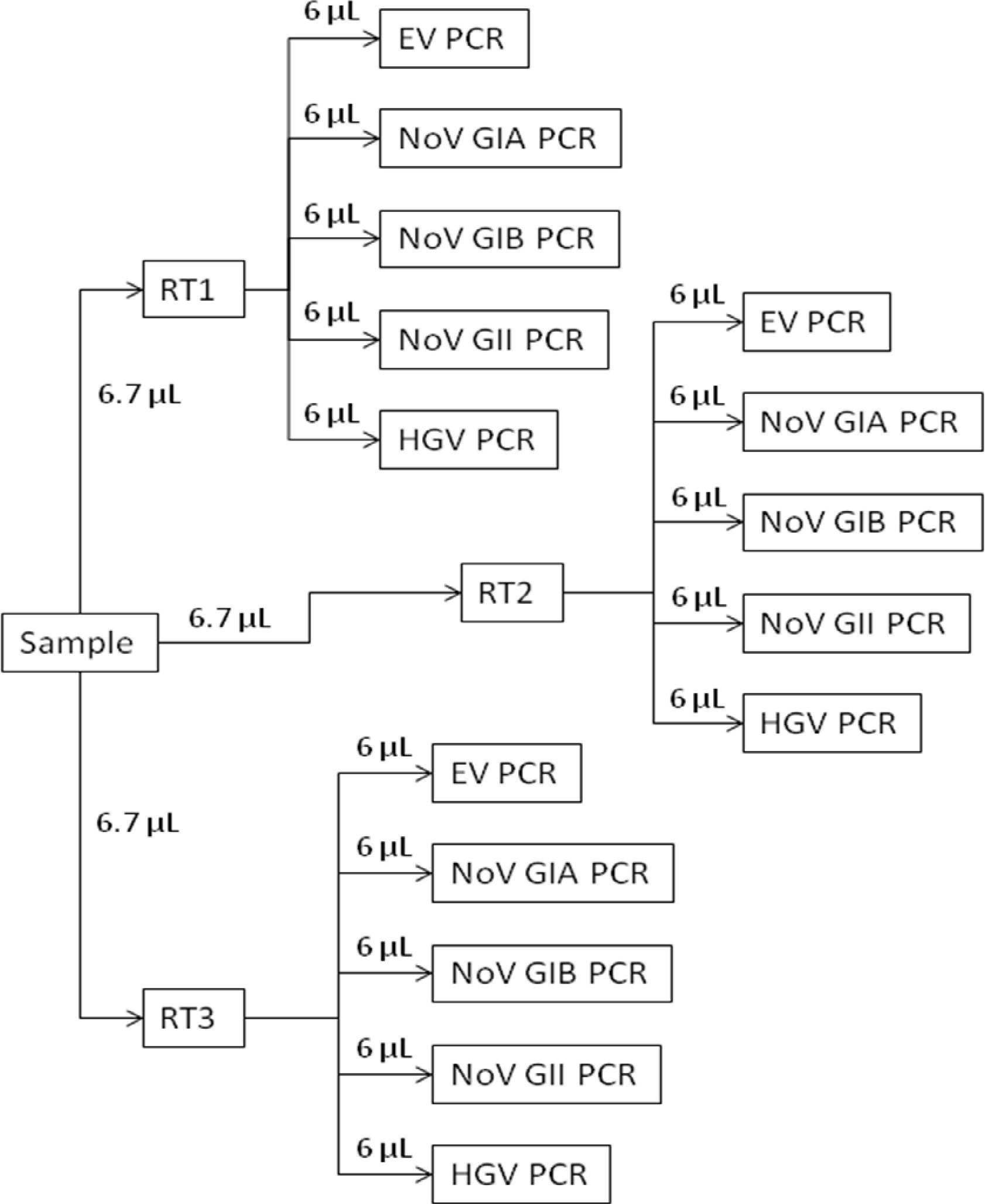
الشكل 2. RT-QPCR التخطيطي الشامل. وكتب كل استخراج عينة اختبار الحمض النووي الريبي عكس باستخدام فحوصات ثلاث نسخ (RT1، RT2، وRT3). [كدنا] من كل من المقايسات RT ثلاث نسخ ومن ثم تحليلها بحثا عن الفيروسات محددة باستخدام المعوي منفصل (EV PCR)، نوروفيروس genogroup الأول (نوفمبر GIA PCR ونوفمبر بنك الخليج الدولي PCR)، نوروفيروس genogroup II (Nاوف GII PCR)، والتهاب الكبد G (الشاحنات الثقيلة PCR) المقايسات.
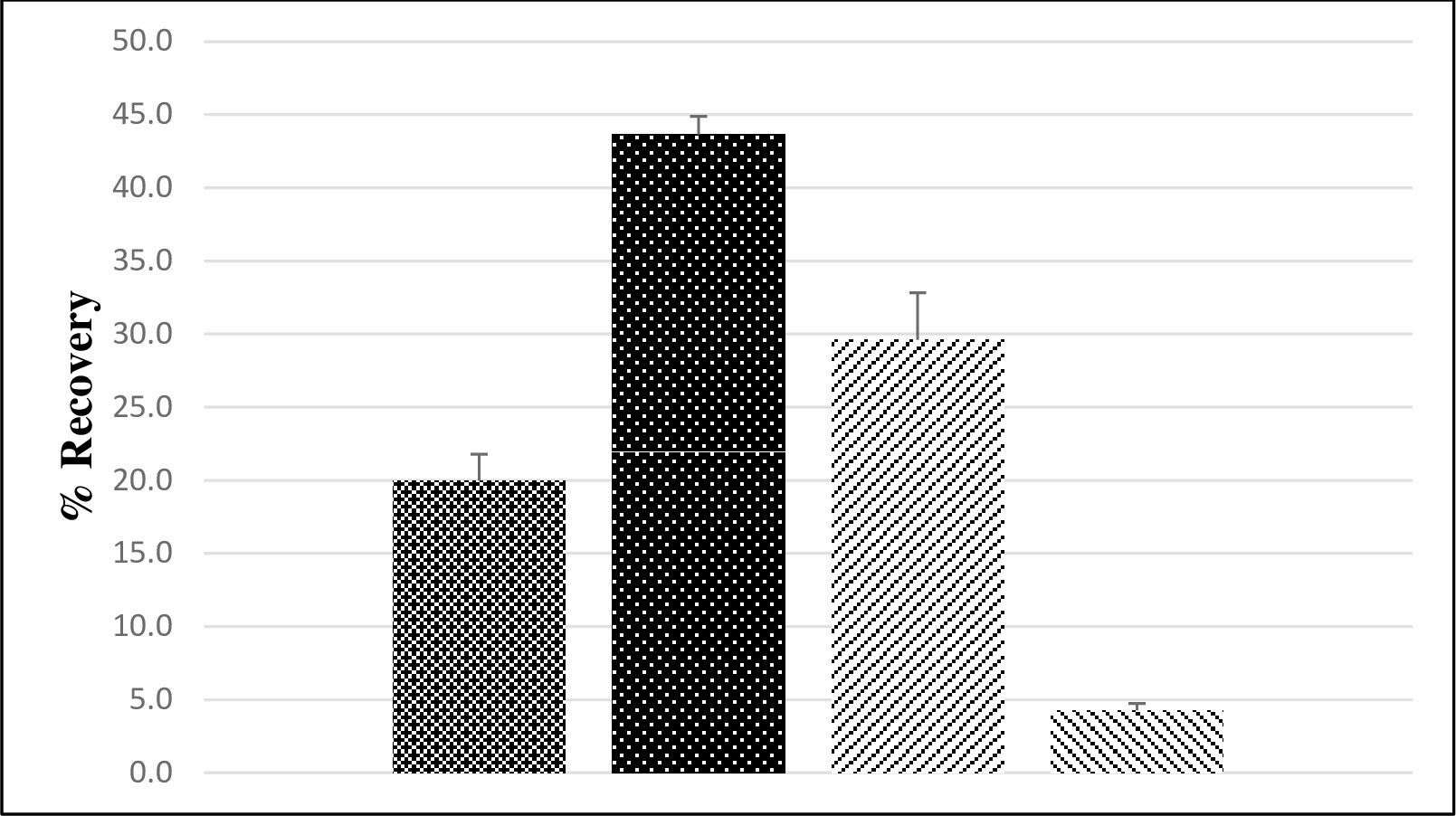
الرقم 3. يظهر متوسط فيروس شلل الأطفال والفئران نوروفيروس الاسترداد (٪) من الأرض والكاشف الصف المياه. انتعاش متوسط في المئة لفيروس شلل الأطفال من الأرض (  ؛ ن = 7) والكاشف من الصف (
؛ ن = 7) والكاشف من الصف (  ؛ ن = 12) المياه ونوروفيروس الفئران من الأرض (
؛ ن = 12) المياه ونوروفيروس الفئران من الأرض (  ؛ ن = 7) والكاشف من الصف (
؛ ن = 7) والكاشف من الصف (  ؛ ن = 12) الماء (1)، حيث "n" هو عدد عينات المياه منفصلة معالجتها. أشرطة الخطأ تمثل الخطأ المعياري.
؛ ن = 12) الماء (1)، حيث "n" هو عدد عينات المياه منفصلة معالجتها. أشرطة الخطأ تمثل الخطأ المعياري.

ويبين الشكل 4. الفيروسة المعوية ونوروفيروس GII ستاندرد المنحنى. منحنيات معيار نموذجي لالمعوي ونوروفيروس GII. تحسب الصيغ إعطاء المنحدر وR 2 القيم لكل منحنى من cycler الحرارية.
التكميلي 1. الملف الرجاء انقر هنا لتحميل هذا الملف.
| المجموعة الفيروسات | التمهيدي / اسم المسبار (1) | التسلسل (2) | مرجع | |
| المعوي | ||||
| EntF (EV-L) | CCTCCGGCCCCTGAATG | 20 | ||
| ENTR (EV-R) | ACCGGATGGCCAATCCAA | 20 | ||
| ENTP (EV-التحقيق) | 6FAM-CGGAACCGACTACTTTGGGTGTCCGT-طمرة | 21 | ||
| نوروفيروس GIA | ||||
| NorGIAF (JJV1F) | GCCATGTTCCGITGGATG | 22 | ||
| NorGIAR (JJV1R) | TCCTTAGACGCCATCATCAT | 22 | ||
| NorGIAP (JJV1P) | 6FAM-TGTGGACAGGAGATCGCAATCTC-طمرة | 22 | ||
| نوروفيروس بنك الخليج الدولي | ||||
| NorGIBF (QNIF4) | CGCTGGATGCGNTTCCAT | 23 | ||
| NorGIBR (NV1LCR) | CCTTAGACGCCATCATCATTTAC | 23 | ||
| NorGIBP (NV1LCpr) | 6FAM-TGGACAGGAGAYCGCRATCT-طمرة | 23 | ||
| نوروفيروس GII | ||||
| NorGIIF (QNIF2d) | ATGTTCAGRTGGATGAGRTTCTCWGA | 25 | ||
| NorGIIR (COG2R) | TCGACGCCATCTTCATTCACA | 25 | ||
| NorGIIP (QNIFS) | 6FAM-AGCACGTGGGAGGGCGATCG-طمرة | 25 | ||
| نوروفيروس GV | ||||
| MuNoVF1 | AGATCAGCTTAAGCCCTATTCAGAAC | 14 | ||
| MuNoVR1 | CAAGCTCTCACAAGCCTTCTTAAA | 14 | ||
| MuNoVP1 | VIC-TGGCCAGGGCTTCTGT-MGB | 14 | ||
| التهاب الكبد G | ||||
| HepF (5'-NCR التمهيدي إلى الأمام) | CGGCCAAAAGGTGGTGGATG | 19 | ||
| HepR (5'-NCR التمهيدي العكسي) | CGACGAGCCTGACGTCGGG | 19 | ||
| HEPP (التهاب الكبد G TAQMAN التحقيق | 6FAM-AGGTCCCTCTGGCGCTTGTGGCGAG-طمرة | 1 | ||
الجدول 1. الترب و TAQMAN المجسات لاكتشاف الفيروسات التي RT-QPCR.
(1) طريقة 1615 التمهيدي والتحقيق أسماء هي الأحرف الثلاثة الأولى من اسم الفيروس متصلا إلى F، R، أو P لالأمام، عكس، والتحقيق. تم تعيينه genogroup نوروفيروس بإضافة GI وGII في الأسماء. ونظرا لاثنين من نوروفيروس مجموعات GI التمهيدي كما تتميز باستخدام A و B. التمهيدي والتحقيق أسماء من المراجع الأساسية في الأمheses.
(2) التوجه من التمهيدي والتحقيق متواليات هو 5 'إلى 3'. وتستخدم مؤشرات قاعدة المنحطة التالية: N-خليط من كل النيوكليوتيدات الأربعة؛ R-A + G؛ Y-T + C؛ W A-+ T؛ وI-إينوزين.
| عنصر | حجم في رد الفعل (ميكرولتر) (2) | التركيز النهائي | حجم في ميكس ماجستير (ميكرولتر) (3) |
| RT ميكس ماجستير 1 | |||
| التمهيدي عشوائي | 0.8 | 10 نانوغرام / ميكرولتر (ج. 5.6 ميكرومتر) | 84 |
| التهاب الكبد G المدرعة RNA (4) | 1 | 105 | |
| PCR المياه الصف | 14.7 | 1543.5 | |
| إلىالتل | 16.5 | 1732.5 | |
| RT ميكس ماجستير 2 | |||
| 10X PCR العازلة II | 4 | 10 ملي تريس، ودرجة الحموضة 8.3، 50 ملي بوكل | 420 |
| 25 ملم MgCl 2 | 4.8 | 3 مم | 504 |
| 10 ملم dNTPs | 3.2 | 0.8 ملم | 336 |
| 100 ملم DTT | 4 | 10 ملي | 420 |
| ريبونوكلياز المانع | 0.5 | 0.5 وحدة / ميكرولتر | 52.5 |
| مرتفع الثاني RT | 0.3 | 1.6 وحدة / ميكرولتر | 31.5 |
| الإجمالي الكلي | 16.8 | 1764 | |
الجدول 2. RT ميكس ماجستير 1 و 2 (1).
(1) إعداد RT ماستر يمزج في البنودغرفة EAN، أي غرفة حيث لم يتم تنفيذ الإجراءات الجزيئية وعلم الأحياء الدقيقة.
(2) النهائي حجم فحص RT هو 40 ميكرولتر.
(3) وتظهر كميات تستند على 105 المقايسات. وهذا يكفي لPCR لوحة 96-جيدا مع اضافت فحوصات إضافية لحساب الخسائر. يمكن تحجيم كمية أعلى أو لأسفل وفقا لعدد من العينات والضوابط التي سيتم تحليلها.
(4) تحديد مقدار التهاب الكبد G الكاشف أن تدرج في مزيج RT ماستر 1 كما هو موضح في المواد التكميلية الخطوة S4.
| عنصر | حجم في رد الفعل (ميكرولتر) (2) | التركيز النهائي | حجم في ميكس ماجستير (ميكرولتر) (3) |
| 2X LightCycler 480 المسابر ميكس ماجستير | 10 | امتلاكي | 1050 |
| إشارة ROXصبغ (4) | 0.4 | 0.5 ملم | 42 |
| PCR المياه الصف | 1 | 105 | |
| 10 ميكرومتر EntF | 0.6 | 300 نانومتر | 63 |
| 10 ميكرومتر ENTR | 1.8 | 900 نانومتر | 189 |
| 10 ميكرومتر ENTP | 0.2 | 100 نانومتر | 21 |
| الإجمالي الكلي | 14 | 1470 |
الجدول 3. PCR ميكس ماجستير عن الفيروسة المعوية (EV) الفحص (1).
(1) إعداد كل ماستر يمزج PCR في غرفة نظيفة.
(2) النهائي حجم فحص QPCR هو 20 ميكرولتر.
(3) وتظهر كميات تستند على 105 المقايسات. وهذا يكفي لPCR لوحة 96-جيدا مع اضافت فحوصات إضافية لحساب الخسائر. يمكن تحجيم كمية أعلى أو لأسفل وفقا لعدد من العينات والضوابط التي من شأنهايتم تحليلها.
(4) البديل PCR المياه الصف لهذا الكاشف عند استخدام الأدوات التي لا تتطلب ذلك.
| عنصر | حجم في رد الفعل (ميكرولتر) (2) | التركيز النهائي | حجم في ميكس ماجستير (ميكرولتر) (3) |
| 2X LightCycler 480 المسابر ميكس ماجستير | 10 | امتلاكي | 1050 |
| ROX صبغ مرجعية (4) | 0.4 | 0.5 ملم | 42 |
| PCR المياه الصف | 1.4 | 147 | |
| 10 ميكرومتر NorGIAF | 1 | 500 نانومتر | 105 |
| 10 ميكرومتر NorGIAR | 1 | 500 نانومتر | 105 |
| 10 ميكرومتر NorGIAP | 0.2 | 100 نانومتر | 21 |
| الإجمالي الكلي | 14 | 1470 |
الجدول 4. PCR ميكس ماجستير لنوروفيروس GIA (نوفمبر GIA) الفحص (1).
انظر الجدول 3 لالحواشي (1) - (4).
| عنصر | حجم في رد الفعل (ميكرولتر) (2) | تركيز النهائي | حجم في ميكس ماجستير (ميكرولتر) (3) |
| 2X LightCycler 480 المسابر ميكس ماجستير | 10 | امتلاكي | 1050 |
| ROX صبغ مرجعية (4) | 0.4 | 0.5 ملم | 42 |
| PCR المياه الصف | 0.3 | 31.5 | |
| 10 ميكرومتر NorGIBF | 1 | 500 نانومتر | 105 |
| 10 ميكرومتر NorGIBR | 1.8 | 900 نانومتر | 189 |
| 10 ميكرومتر NorGIBP | 0.5 | 250 نانومتر | 52.5 |
| الإجمالي الكلي | 14 | 1470 |
الجدول 5. PCR ميكس ماجستير لنوروفيروس بنك الخليج الدولي (GIB نوفمبر) الفحص (1).
انظر الجدول 3 لالحواشي (1) - (4).
| عنصر | حجم في رد الفعل (ميكرولتر) (2) | تركيز النهائي | حجم في ميكس ماجستير (ميكرولتر) (3) |
| 2X LightCycler 480 المسابر ميكس ماجستير | 10 | امتلاكي | 1050 |
| ROX صبغ مرجعية (4) | 0.4 | 0.5 ملم | 42 |
| PCR المياه الصف | 0.3 | 31.5 | |
| 10 ميكرومتر NorGIIF | 1 | 500 نانومتر | 105 |
| 10 ميكرومتر NorGIIR | 1.8 | 900 نانومتر | 189 |
| 10 ميكرومتر NorGIIP | 0.5 | 250 نانومتر | 52.5 |
| الإجمالي الكلي | 14 | 1470 |
الجدول 6. PCR ميكس ماجستير لنوروفيروس GII (نوفمبر GII) الفحص (1).
انظر الجدول 3 لالحواشي (1) - (4).
| عنصر | حجم في رد الفعل (ميكرولتر) (2) | تركيز النهائي | حجم في ميكس ماجستير (ميكرولتر) (3) |
| 2X LightCycler 480 المسابر ميكس ماجستير | 10 | امتلاكي | 1050 |
| ROX صبغ مرجعية (4) | 0.4 | 0.5 ملم | 42 |
| PCR المياه الصف | 0.3 | 31.5 | |
| 10 ميكرومتر MuNoVF1 | 1 | 500 نانومتر | 105 |
| 10 ميكرومتر MuNoVR1 | 1.8 | 900 نانومتر | 189 |
| 10 ميكرومتر MuNoVP1 | 0.5 | 250 نانومتر | 52.5 |
| الإجمالي الكلي | 14 | 1470 |
الجدول 7. PCR ميكس ماجستير عن الفئران نوروفيروس الفحص (1).
انظر الجدول 3 لالحواشي (1) - (4).
| عنصر | الصوتفي رد فعل (ميكرولتر) (2) | تركيز النهائي | حجم في ميكس ماجستير (ميكرولتر) (3) |
| 2X LightCycler 480 المسابر ميكس ماجستير | 10 | امتلاكي | 1050 |
| ROX صبغ مرجعية (4) | 0.4 | 0.5 ملم | 42 |
| PCR المياه الصف | 1.4 | 147 | |
| 10 ميكرومتر HepF | 1 | 500 نانومتر | 105 |
| 10 ميكرومتر HepR | 1 | 500 نانومتر | 105 |
| 10 ميكرومتر HEPP | 0.2 | 100 نانومتر | 21 |
| الإجمالي الكلي | 14 | 1470 |
الجدول 8. PCR ميكس ماجستير لالتهاب الكبد الوبائي G (الشاحنات الثقيلة) الفحص (1).
شاهد الجدول 3 لالحواشي (1) - (4).
| تركيز المنحنى القياسي | نسخ الجينوم في RT-QPCR الفحص (1، 2) |
| 2.5 × 10 8 | 502500 |
| 2.5 × 10 7 | 50250 |
| 2.5 × 10 6 | 5025 |
| 2.5 × 10 5 | 502.5 |
| 2.5 × 10 4 | 50.25 |
| 2.5 × 10 3 | 5،025 |
الجدول 9. نسخ ستاندرد المنحنى الجينوم.
(1) تحديد الآبار منحنى القياسية حسب المعايير ووضع نسخ الجينوم في RT-QPCR القيم الفحص في المكان المناسب في البرنامج thermocycler.
(2) إن منحنى مستوى مقبول سيكون لها كفاءة 70٪ -110٪، قيمة R 2> 0.97، والانحراف المعياري العام لل<0.5 لنوروفيروس و <1.0 لالمعوي.
| المعايير | القيمة المقبولة | |
| نوروفيروس | المعوي | |
| الانحراف المعياري العام | <0.5 | <1.0 |
| R 2 | > 0.97 | > 0.97 |
| كفاءة | 70٪ إلى 115٪ | 70٪ إلى 115٪ |
الجدول 10. معايير القياسية المنحنى القبول (1).
(1) المنحنيات القياسية مع٪ الكفاءة من 70٪ -110٪ مقبولة، ولكن القيم في 90٪ -115٪ النطاق مثالية. قد القيم أقل من 90٪ إلى pipetting لأو تخفيف الأخطاء.
| QA مكون | يعني المدى الاسترداد (٪) | معامل الاختلاف (٪) |
| مختبر الكاشف فارغة. PT أو PE العينات سلبية | 0 | N / A (1) |
| مختبر العصائر فارغة. مختبر العصائر مصفوفة عينة | 5-200 | N / A |
| عينات إيجابية PT وPE | 15-175 | ≤130 |
الجدول 11. أسلوب 1615 معايير الأداء.
(1) لا ينطبق.
| وسائل الإعلام | تركيب |
| 0.15 M فوسفات الصوديوم، ودرجة الحموضة 7،0-7،5 | إعداد الفوسفات 0.15 M الصوديوم عن طريق إذابة 40.2 غرام من فوسفات الصوديوم، ثنائي القاعدة (نا 2 هبو 4 · 7H 2 O) في الحجم النهائي من 1 L درهم 2 O. ضبط درجة الحموضة إلى 7،0-7،5 مع حمض الهيدروكلوريك. الأوتوكلاف في 121 ° C، 15 رطل لمدة 15 دقيقة. مخزن حل فوسفات الصوديوم في RT لمدة تصل إلى 12 شهرا. |
| 5٪ BSA | إعداد بحل 5 غرام من BSA في 100 مل من درهم 2 O. تعقيم عن طريق تمرير الحل من خلال تعقيم مرشح 0.2 ميكرون. |
| PBS، 0.2٪ BSA | إعداد بإضافة 4 مل من 5٪ BSA إلى 96 مل من برنامج تلفزيوني. تعقيم عن طريق تمرير الحل من خلال تعقيم مرشح 0.2 ميكرون. |
| عازلة TSM III | حل 1.21 غرام Trisma القاعدة، 5.84 جم كلوريد الصوديوم، 0.203 غرام MgCl 2، 1 مل الجيلاتين Prionex، و 3 مل Microcide الثالث في 950 مل من الماء الصف كاشف. ضبط درجة الحموضة إلى 7.0 ثم جلب الحجم النهائي إلى 1 L. تعقيم عن طريق تمرير الحل من خلال تعقيم مرشح 0.2 ميكرون. |
| 0.525٪ هيبوكلوريت الصوديوم (NaClO) | إعداد NaClO الحل 0.525٪ عن طريق تمييع التبييض المنزلية 1:10 في دH 2 O. تخزين 0.525٪ حلول NaClO لمدة تصل إلى 1 في الاسبوع في RT. |
| 1-M ثيوكبريتات الصوديوم (نا 2 S 2 O 3) pentahydrate | إعداد محلول 1 M عن طريق إذابة 248.2 غرام من نا 2 S 2 O 3 في 1 لتر من درهم 2 O. متجر ثيوكبريتات الصوديوم لمدة تصل إلى 6 أشهر في RT. |
الجدول 12. الجدول من وسائل الإعلام.
Discussion
تتطلب دراسات وطنية واسعة النطاق من التلوث الفيروسي من مياه الشرب المصدر واستخدام المختبرات التحليلية متعددة. في ظل هذه الظروف هناك حاجة إلى طريقة موحدة للتأكد من أن البيانات التي تم إنشاؤها من قبل مختبرات متعددة غير قابلة للمقارنة. هناك العديد من الأساليب الجزيئية نشرت للكشف عن الفيروس، ولكن عدد قليل جدا من الأساليب الجزيئية موحدة. EPA أسلوب 1615 هو طريقة موحدة صممت خصيصا للكشف عن الفيروس المعوي ونوروفيروس في المصفوفات المياه RT-QPCR. تتوفر للكشف عن الفيروس في الأطعمة الطرق الجزيئية موحدة (CEN / ISO TS 15216-1 وCEN / ISO TS 15216-2، 7 أبريل 2013) 16،17 كما تم تطبيقها للكشف عن التهاب الكبد الوبائي فيروس ونوروفيروس في الربيع المياه 16. ويجب أن يشمل جميع الأساليب القياسية ضوابط جودة الأداء ومعايير للحد المشترك بين والاختلاف داخل المختبر وبيانات إيجابية كاذبة بسبب تلوث المختبر. لمزيد من خفض بيانات غير صحيحة، Eالطريقة PA 1615 يلي إرشادات وكالة حماية البيئة على الطرق الجزيئية، 18 الذي ينص على الفصل بين العمل خلال تجهيز واتجاه واحد تدفق العمل. ويتضمن G التهاب الكبد 1،19 الرقابة وإجراءات للحد من النتائج السلبية الكاذبة بسبب مثبطات RT-15 QPCR الداخلية. ويستخدم المقايسات الكمية جنبا إلى جنب مع وحدات التخزين الموحدة من كل من الماء وأخذ عينات المياه تحليلها بحيث يتم أعرب جميع البيانات الميدانية في نسخ الجينوم للتر الواحد من الميدان أو عينات مياه الشرب. على الرغم من أنبوب واحد فعال (خطوة واحدة) المقايسات RT-PCR متاحة تجاريا، يستخدم أسلوب عمدا فحوصات منفصلة. وهذا يشكل عائقا لتقليل كمية من العينة التي يمكن أن يعاير في كل رد فعل، ولكنه يعطي مرونة أكبر في استخدام مجموعات التمهيدي متعددة. المقايسات RT-QPCR تقتصر من قبل وفقط جيدة كما الاشعال وتحقيقات المستخدمة وعلى الأرجح لن مجموعة التمهيدي كشف عن المتغيرات الفيروس ضمن مجموعة. وقد تم اختيار مجموعة المعوي التمهيدي لأنها تستهدف 5'-المنطقة غير الترميز الحفظ، 20،21 بالكشف عن مجموعة واسعة من الأنماط المصلية المعوي، وترتبط الفيروسات الكشف عنها من قبل مع الآثار الصحية الناجمة عن استهلاك المياه الجوفية غير المعالجة 1. تستخدم مجموعتين التمهيدي للكشف عن genogroup I النوروفيروس 22،23. وقد اختير أول نظرا لارتباط قوي بين الآثار الصحية عند الأطفال الصغار والكشف عن الفيروسات 1. تم اختيار genogroup الثاني I التمهيدي مجموعة ومجموعة التمهيدي تستخدم لgenogroup II النوروفيروس لأنهم كشف أكبر مجموعة من سلالات 24،25.
وعلى الرغم من المزايا الرئيسية لQPCR وRT-QPCR إجراءات الكشف عن RNA الفيروسي في الماء، وهناك العديد من القيود. أولا، كل من جزيئات الفيروس المعدية وغير المعدية، بما في ذلك تلك المعطل من قبل المطهرات، يمكن تضخيمه من قبل هذه الإجراءات. وتشير نتائج بوركهارت أن هذا هو أقل من مشكلة المياه الجوفية غير المعالجة و لطبقات المياه الجوفية مدمج مماثلة لتلك الموجودة في المجتمعات المدروسة من أجل المياه السطحية تطهيرها 1. يمكن للفيروسات زروع يمكن التغلب على هذه المشكلة باستخدام PCR في تركيبة مع الثقافة 26،27. كما تم تناول مشكلة بالنسبة لبعض الفيروسات من خلال استخدام الحمض النووي ربط عبر وكلاء 28-30. هذا النهج الأخير هو أكثر فعالية للبحث عن الفيروسات المعطل من قبل هيبوكلوريت وغير فعالة بالنسبة لأولئك المعطل بسبب الأشعة فوق البنفسجية.
والقيد الثاني من هذه الإجراءات الجزيئية هو أن حجم العينة تتركز التي يمكن أن يعاير عادة أصغر بكثير من تلك المستخدمة لإجراءات الثقافة 6،31. وغالبا ما تعالج هذه المشكلة عن طريق إما باستبدال الإجراء القائم على غليكول البولي إيثيلين لتركيز الثانوي القياسي التلبد العضوي، والذي يسمح العينة إلى أن معلق في حجم أصغر، أو عن طريق إضافة تركيز خطوة عينة العالي 6،32،33 . طريقة 1615 يستخدم centrifالترشيح الفائق ugal لتوفير التركيز العالي. الترشيح الفائق الطرد المركزي يزيل الماء ومكونات أقل من 30،000 دالتون الناتجة في كل من تركيز أي فيروس في عينات الاختبار والحد من مثبطات الوزن الجزيئي صغيرة من المقايسات الجزيئية. هذه النتائج خطوة العالي التركيز في معامل التركيز الكلي لل> 10 5 لأي فيروس التي كانت موجودة في المياه التي يجري اختبارها.
A الحد الثالث هو وجود مثبطات الإجراءات الجزيئية في العينات البيئية. على الرغم من أن نهج عديدة لإزالة مثبطات تم وضعها، أي نهج فعال لجميع المصفوفات المياه وأنواع فيروس 6،34،35، مما يجعل استخدام الضوابط الداخلية تهدف إلى تقدير مستوى تثبيط ضروري. كاشف التهاب الكبد G المستخدمة في هذه الطريقة يلبي هذا المطلب من خلال تقديم مستوى ثابت من RNA الفيروسي في جميع التفاعلات وفحص RT-QPCR لتقدير كبت. عندما الأفضل ركان المانع فشل النهج إزالة لإزالة تثبيط ومركزات عينة يمكن أن تضعف طالما تركيزات أعلى من فيروس مثبط تركيزات 14،15.
الإجراء المنحنى القياسي الموصوفة هنا على حد سواء مزايا وجود قيود كبير. ميزة هي أن كاشف استخدام إمدادات جميع المكونات الضرورية في كاشف واحد، مما يسمح للتحكم واحد لاستخدامها في جميع المقايسات. هذا الكاشف خاصة ميزة لفحوصات نوروفيروس. لا يمكن الحصول على جسيمات نوروفيروس من الأشخاص المصابين مما يجعل من الصعب جدا الحصول على جسيمات فيروسية لاستخدامها كمعايير. وهناك ميزة أكثر أهمية هو أنه يوفر مستوى RNA لجميع فيروسات RNA المستهدفة في كاشف واحد، كما وجود معيار RNA ضروري لتقدير دقيق لRNA 36. ومع ذلك، وقدرتها على تحديد الفيروس بدقة محدودة بسبب حقيقة أن الآثار مصفوفة لا تؤخذ بعين الاعتبار. وهذا يعني أن نسخة الجينوميةلا يمكن اعتبار القيم العدد المطلق، وينبغي النظر فيها إلا بصورة نسبية. فمن المستحسن أن وجود عدد كاف من المنحنى القياسي قسامات الأسهم العمل (الخطوة 1.2) تكون على استعداد لتغطية دراسات كاملة. على سبيل المثال، توفر كل 250 قسامة ميكرولتر كاشف يكفي لمدة 6 لوحات RT. إذا كان من المعروف أن دراسة سيتطلب تحليل 500 عينة، ستكون هناك حاجة لا تقل عن 12 قسامات (500 عينة / 7 عينات في RT لوحة / 6 RT لوحات في قسامة).
EPA أسلوب 1615 هو الأسلوب القائم على الأداء. العديد من الشركات المصنعة تجعل الكواشف تعادل تلك المحددة في هذه الوثيقة وهذه الكواشف يمكن أن تكون بديلا طالما تم استيفاء معايير الأداء. المنحنى القياسي، الذي يشغل أيضا منصب السيطرة RT-QPCR الإيجابية، هي ذات قيمة في القضايا أداء استكشاف الأخطاء وإصلاحها. الأداء يمكن أن تنخفض بسبب تدهور RNA، كاشف مدة الصلاحية، فشل المجمدات، معايرة الأدوات، وخطأ فني. يجب أن تكون مشاكل الأداء المشتبه بهإد إذا تختلف منحنيات القياسية من هو موضح في الشكل (4) أو إذا كانت لا تلبي مواصفات الأداء لمنحنيات القياسية. فحص RT-QPCR قوي جدا؛ ومن المرجح فشلت فشلا ذريعا بسبب سوء التعامل من الحمض النووي الريبي أو خطأ فني (على سبيل المثال، كاشف عداد المفقودين). يجب توخي الحذر الشديد في التعامل مع عينات الحمض النووي الريبي بين استخراج والخطوة RT للحد من تدهور RNA من ribonucleases.
اجتمع المستردة فيروس شلل الأطفال من المياه الجوفية وكاشف الصف والمبالغ المستردة نوروفيروس الفئران من المياه الجوفية وكالة حماية البيئة أسلوب 1615 معايير القبول الأداء (الجدول 11) ومماثلة لتلك التي ذكرت من قبل الآخرين 33،37،38. كانت المبالغ المستردة نوروفيروس الفئران من عينات LFB أقل بكثير من تلك التي لفيروس شلل الأطفال، وسوف لا يكون تفي بمعايير القبول فيروس شلل الأطفال محددة. أسباب انخفاض الانتعاش نوروفيروس الفئران من الماء الصف كاشف غير معروفة. مشابهة لنتائج هذا القانون، كريم وcolleaذكرت تحزر الانتعاش لنوروفيروس GI.1 من 4٪ من مياه الصنبور 39. لي وآخرون. 37 ذكرت المستردة متوسط لنوروفيروس الفئران وGII.4 نوروفيروس الإنسان من 18٪ و 26٪ من الماء المقطر باستخدام مرشحات القرص، على التوالي. استخدام ظروف مماثلة للي وزملاؤه، لاحظ كيم كو والمبالغ المستردة من 46٪ و 43٪ لهذه الفيروسات على التوالي 38. جيبونز وآخرون 40 التي تم الحصول عليها حول استرداد 100٪ من GII.4 نوروفيروس الإنسان من مياه البحر، ولكن وجدت كيم وكو 38 أن إضافة الملح إلى الماء المقطر بتركيزات مماثلة أو أعلى من مياه البحر بشكل كبير انخفاض المبالغ المستردة من الفيروس الفئران وأسفرت في نحو الحد من شقين في الانتعاش GII.4.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Dr. Eric Rhodes for preparing the clones used in the development of Standard curve reagent, Brian McMinn for assistance in sample processing, Larry Wymer for statistical analysis, Dr. Mark Borchardt, U.S. Department of Agriculture, Marshfield, WI, for supplying the Sabin poliovirus serotype 3 used in this study and Dr. H. W. Virgin, Washington University, St. Louis, MO, for murine norovirus. The authors also acknowledge Gretchen Sullivan for assistance in preparation of stock laboratory reagents, Dr. Mohammad Karim for propagation of murine norovirus stocks, and local private well owners and utilities for allowing us to collect water samples. Although this work was reviewed by EPA and approved for publication, it may not necessarily reflect official Agency policy. Mention of trade names or commercial products does not constitute endorsement or recommendation for use.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 ml tube chamber | Diversified Biotech | CHAM-3000 | |
| 1 °C cool brick | Diversified Biotech | BRIK-2501 | |
| 10x PCR Buffer II and 25-mM MgCl2 | Life Technologies | N8080130 | |
| -20 °C freezer | VWR | 97043-346 | Must be a manual defrost freezer |
| -70 °C or colder freezer | Thermo Scientific | MBF700LSAO-E | |
| 96-well chamber | Diversified Biotech | CHAM-1000 | |
| Absolute ethanol | Fisher Scientific | BP2818-100 | |
| Armored RNA EPA-1615 | Asuragen | Custom order | Used for quantifying the RT-qPCR assay |
| Armored RNA Hepatitis G virus | Asuragen | 42024 | |
| Autoclave | Steris | Amsco Lab Series | |
| Biosafety cabinet | NuAir Laboratory Equipment Supply | Labgard 437 ES | |
| Bovine serum albumin (BSA) | Affymetrix | 10856 | Crystalline grade or better |
| Buffer AVE | Qiagen | 1026956 | Carrier RNA dilution buffer |
| Buffer AVL | Qiagen | 19073 | Extraction buffer |
| Carrier RNA | Qiagen | Not applicable | Use carrier RNA supplied with Buffer AVL |
| Centrifuge bottles | Fisher Scientific | 05-562-23 or 05-562-26 | |
| Centrifuge rotors | Beckman Coulter | 339080, 336380 | |
| Cool safe box | Diversified Biotech | CSF-BOX | |
| Dithiothreitol (DTT) | Promega | P1171 | |
| LightCycler® 480 Probes Master kit | Roche Diagnostics | 4707494001 | |
| Microcentrifuge tubes | Fisher Scientific | 02-682-550 | Use ribonuclease- and deoxyribonuclease-free tubes with snap caps |
| Microcide III | Fitzgerald | 99R-103 | |
| Microseal 'A' film | Bio-Rad Laboratories | HSA5001 | Heat resistant |
| Microseal 'F' film | Bio-Rad Laboratories | MSA1001 | Freezer resistant |
| Mini-plate spinner | Labnet International | MPS1000 | |
| Multichannel pipette | Rainin | L8-20 | |
| Multi-tube chamber | Diversified Biotech | CHAM-5000 | |
| Optical reaction plate | Life Technologies | 4314320 | |
| PCR nucleotide mix | Promega | U1515 | |
| PCR plate | Bio-Rad Laboratories | HSS9601 | |
| PCR-grade water | Roche | 3315932001 | |
| Phosphate buffered saline (PBS) | U.S. Biological | D9820 | |
| Plate mixer | Scientific Industries | MicroPlate Genie | |
| Prionex gelatin | Sigma Aldrich | G0411 | |
| QIAamp DNA Blood Mini Kit | Qiagen | 51104 | Includes Buffers AW1 (first wash buffer), AW2 (second wash buffer), AE (elution buffer); ethanol must be added to Buffers AW1 and AW2 before use; Do not use Buffer AL supplied with the kit |
| Quantitative PCR thermal cycler | Life Technologies | 4351405 | |
| Random primer | Promega | C1181 | |
| Reagent Reservoir | Fisher Scientific | 21-381-27E | |
| Refrigerated centrifuge | Beckman Coulter | 367501 | |
| RNase Inhibitor | Promega | N2515 or N2615 | |
| ROX reference dye | Life Technologies | 12223 | |
| SuperScript II or III Reverse Transcriptase | Life Technologies | 18064-022 or 18080044 | |
| Surgical gloves | Fisher Scientific | 19-058-800 | |
| Thermal cycler | Life Technologies | 4314879 | |
| Trisma base | Sigma Aldrich | T1503 | |
| Vivaspin 20 centrifugal concentrator units | Sartorius-Stedim | VS2022 |
References
- Borchardt, M. A., Spencer, S. K., Kieke, B. A., Lambertini, E., Loge, F. J. Viruses in nondisinfected drinking water from municipal wells and community incidence of acute gastrointestinal illness. Environ. Health Perspect. 120 (9), 1272-1279 (2012).
- Ye, X. Y., et al. Real-time PCR detection of enteric viruses in source water and treated drinking water in Wuhan, China. Curr. Microbiol. 65 (3), 244-253 (2012).
- Williamson, W. M., et al. Enteric viruses in New Zealand drinking-water sources. Water Sci. Technol. 63 (8), 1744-1751 (2011).
- Lambertini, E., Borchardt, M. A., Kieke, B. A., Spencer, S. K., Loge, F. J. Risk of viral acute gastrointestinal illness from nondisinfected drinking water distribution systems. Environ. Sci. Technol. 46 (17), 9299-9307 (2012).
- Chigor, V. N., Okoh, A. I. Quantitative RT-PCR detection of hepatitis A virus, rotaviruses and enteroviruses in the Buffalo River and source water dams in the Eastern Cape Province of South Africa. Int. J. Environ. Res. Public Health. 9 (11), 4017-4032 (2012).
- Fout, G. S., Martinson, B. C., Moyer, M. W., Dahling, D. R. A multiplex reverse transcription-PCR method for detection of human enteric viruses in groundwater. Appl. Environ. Microbiol. 69 (6), 3158-3164 (2003).
- Hewitt, J., Bell, D., Simmons, G. C., Rivera-Aban, M., Wolf, S., Greening, G. E. Gastroenteritis outbreak caused by waterborne norovirus at a New Zealand ski resort. Appl. Environ. Microbiol. 73 (24), 7853-7857 (2007).
- Jack, S., Bell, D., Hewitt, J. Norovirus contamination of a drinking water supply at a hotel resort. New Zealand Med. J. 126 (1387), 98-107 (2013).
- Anderson, A. D., et al. A waterborne outbreak of Norwalk-like virus among snowmobilers-Wyoming, 2001. J. Infect. Dis. 187 (2), 303-306 (2003).
- Parshionikar, S. U., et al. Waterborne outbreak of gastroenteritis associated with a norovirus. Appl. Environ. Microbiol. 69 (9), 5263-5268 (2003).
- U.S. Environmental Protection Agency Office of Water. . 820-F-12-058: Recreational Water Quality Criteria. , 1-63 (2012).
- Wade, T. J., et al. Rapidly measured indicators of recreational water quality and swimming-associated illness at marine beaches: a prospective cohort study. Environ. Health. 9, 66 (2010).
- Fout, G. S., et al. . Method 1615: Measurement of enterovirus and norovirus occurrence in water by culture and RT-qPCR (EPA/600/R-10/181). , 1-91 (2012).
- Cashdollar, J. L., et al. Development and Evaluation of EPA Method 1615 for Detection of Enterovirus and Norovirus in Water. Appl. Environ. Microbiol. 79 (1), 215-223 (2013).
- Gibson, K. E., Schwab, K. J., Spencer, S. K., Borchardt, M. A. Measuring and mitigating inhibition during quantitative real time PCR analysis of viral nucleic acid extracts from large-volume environmental water samples. Water Res. 46 (13), 4281-4291 (2012).
- Fuentes, C., et al. Standardized multiplex one-step qRT-PCR for hepatitis A virus, norovirus GI and GII quantification in bivalve mollusks and water. Food Microbiol. 40, 55-63 (2014).
- Coudray, C., Merle, G., Martin-Latil, S., Guillier, L., Perelle, S. Comparison of two extraction methods for the detection of hepatitis A virus in lettuces using the murine norovirus as a process control. J. Virol. Methods. 193 (1), 96-102 (2013).
- Sen, K., et al. . EPA 815-B-04-001: Quality assurance/quality control guidance for laboratories performing PCR analyses on environmental samples. , 1-56 (2004).
- Schlueter, V., Schmolke, S., Stark, K., Hess, G., Ofenloch-Haehnle, B., Engel, A. M. Reverse transcription-PCR detection of hepatitis G virus. J. Clin. Microbiol. 34 (11), 2660-2664 (1996).
- De Leon, R., Shieh, C., Baric, R. S., Sobsey, M. D. Detection of enteroviruses and hepatitis A virus in environmental samples by gene probes and polymerase chain reaction. Proc. Water Qual. Technol. Conf. , 833-853 (1990).
- Monpoeho, S., et al. Quantification of enterovirus RNA in sludge samples using single tube real-time RT-PCR. BioTechniques. 29 (1), 88-93 (2000).
- Jothikumar, N., et al. Rapid and sensitive detection of noroviruses by using TaqMan-based one-step reverse transcription-PCR assays and application to naturally contaminated shellfish samples. Appl. Environ. Microbiol. 71 (4), 1870-1875 (2005).
- da Silva, A. K., et al. Evaluation of removal of noroviruses during wastewater treatment, using real-time reverse transcription-PCR: different behaviors of genogroups I and II. Appl. Environ. Microbiol. 73 (24), 7891-7897 (2007).
- Butot, S., et al. Evaluation of various real-time RT-PCR assays for the detection and quantitation of human norovirus. J. Virol. Methods. 167 (1), 90-94 (2010).
- Loisy, F., et al. Real-time RT-PCR for norovirus screening in shellfish. J. Virol. Methods. 123 (1), 1-7 (2005).
- Reynolds, K. A., Gerba, C. P., Pepper, I. L. Detection of infectious enteroviruses by an integrated cell culture-PCR procedure. Appl. Environ. Microbiol. 62 (4), 1424-1427 (1996).
- Ming, H. X., Zhu, L., Zhang, Y. Rapid quantification of infectious enterovirus from surface water in Bohai Bay, China using an integrated cell culture-qPCR. Mar. Pollut. Bull. 62 (10), 2047-2054 (2011).
- Parshionikar, S., Laseke, I., Fout, G. S. Use of propidium monoazide in reverse transcriptase PCR to distinguish between infectious and noninfectious enteric viruses in water samples. Appl. Environ. Microbiol. 76 (13), 4318-4326 (2010).
- Sanchez, G., Elizaquivel, P., Aznar, R. Discrimination of infectious hepatitis A viruses by propidium monoazide real-time RT-PCR. Food Environ. Virol. 4 (1), 21-25 (2012).
- Kim, S. Y., Ko, G. Using propidium monoazide to distinguish between viable and nonviable bacteria, MS2 and murine norovirus. Lett. Appl. Microbiol. 55 (3), 182-188 (2012).
- Fout, G. S., Schaefer, F. W., Messer, J. W., Dahling, D. R., Stetler, R. E. . EPA/600/R-95/178: ICR Microbial Laboratory Manual, I.1-ApD-23. , (1996).
- Abbaszadegan, M., Stewart, P., LeChevallier, M. A strategy for detection of viruses in groundwater by PCR. Appl. Environ. Microbiol. 65 (2), 444-449 (1999).
- Lambertini, E., et al. Concentration of enteroviruses, adenoviruses, and noroviruses from drinking water by use of glass wool filters. Appl. Environ. Microbiol. 74 (10), 2990-2996 (2008).
- Rodriguez, R. A., Thie, L., Gibbons, C. D., Sobsey, M. D. Reducing the effects of environmental inhibition in quantitative real-time PCR detection of adenovirus and norovirus in recreational seawaters. J. Virol. Methods. 181 (1), 43-50 (2012).
- Iker, B. C., Bright, K. R., Pepper, I. L., Gerba, C. P., Kitajima, M. Evaluation of commercial kits for the extraction and purification of viral nucleic acids from environmental and fecal samples. J. Virol. Methods. 191 (1), 24-30 (2013).
- Fey, A., et al. Establishment of a real-time PCR-based approach for accurate quantification of bacterial RNA targets in water, using Salmonella as a model organism. Appl. Environ. Microbiol. 70 (6), 3618-3623 (2004).
- Lee, H., et al. Evaluation of electropositive filtration for recovering norovirus in water. J. Water Health. 9 (1), 27-36 (2011).
- Kim, M., Ko, G. Quantitative characterization of the inhibitory effects of salt, humic acid, and heavy metals on the recovery of waterborne norovirus by electropositive filters. J. Water Health. 11 (4), 613-622 (2013).
- Karim, M. R., Rhodes, E. R., Brinkman, N., Wymer, L., Fout, G. S. New electropositive filter for concentrating enteroviruses and noroviruses from large volumes of water. Appl. Environ. Microbiol. 75 (8), 2393-2399 (2009).
- Gibbons, C. D., Rodriguez, R. A., Tallon, L., Sobsey, M. D. Evaluation of positively charged alumina nanofibre cartridge filters for the primary concentration of noroviruses, adenoviruses and male-specific coliphages from seawater. J. Appl. Microbiol. 109 (2), 635-641 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved