Method Article
EPA方法1615测量肠道病毒和诺瓦克病毒发生水由文化和RT-qPCR的了。第三部分。病毒检测用RT-qPCR的
摘要
Here we present a procedure to quantify enterovirus and norovirus in environmental and drinking waters using reverse transcription-quantitative PCR. Mean virus recovery from groundwater with this standardized procedure from EPA Method 1615 was 20% for poliovirus and 30% for murine norovirus.
摘要
EPA Method 1615 measures enteroviruses and noroviruses present in environmental and drinking waters. This method was developed with the goal of having a standardized method for use in multiple analytical laboratories during monitoring period 3 of the Unregulated Contaminant Monitoring Rule. Herein we present the protocol for extraction of viral ribonucleic acid (RNA) from water sample concentrates and for quantitatively measuring enterovirus and norovirus concentrations using reverse transcription-quantitative PCR (RT-qPCR). Virus concentrations for the molecular assay are calculated in terms of genomic copies of viral RNA per liter based upon a standard curve. The method uses a number of quality controls to increase data quality and to reduce interlaboratory and intralaboratory variation. The method has been evaluated by examining virus recovery from ground and reagent grade waters seeded with poliovirus type 3 and murine norovirus as a surrogate for human noroviruses. Mean poliovirus recoveries were 20% in groundwaters and 44% in reagent grade water. Mean murine norovirus recoveries with the RT-qPCR assay were 30% in groundwaters and 4% in reagent grade water.
引言
定量PCR(qPCR的;参见在此手稿中使用的术语的定义的补充材料)和逆转录的qPCR(RT-qPCR的)可用于检测和定量在环境人类肠道病毒和饮用水水域有价值的工具,尤其是对许多病毒做不能复制或在细胞培养系统中复制较差。这两种工具已经表明,许多病毒类型中存在的环境和饮用水在全世界1-6。在其使用期间的疾病爆发调查加上扩增的基因组片段的测序提供了证据水性病毒传输,因为它们已经表明,在饮用水中发现的病毒是相同的梭口由暴发患者7-10。
两者的qPCR和RT-qPCR的是有用的公共卫生工具。例如,由美国环境保护署(EPA)进行的研究数据显示,牢固的关系是吐温指标的测量通过qPCR和娱乐用水健康的影响。其结果是,美国环保署的最后2012娱乐水质标准包括定量PCR方法监测休闲海滩11,12。博查特和他的同事还发现,在使用未经处理的地下水和病毒地下水社区急性胃肠炎之间有很强的关系,通过RT-qPCR的1计量。
本文的目的是描述的EPA方法1615 13,14分子检测组件。该检测使用RT-qPCR的通过正电滤色片提供肠病毒和每根据通过环境或饮用水的原体积升诺罗病毒基因组拷贝(GC)的一个定量估计。分子过程的概述示于图1。议定书部分1的详细信息的步骤制备标准曲线。这些标准是由一个包含RN试剂准备靶序列的所有的引物/探针组的副本。第2节描述的第三浓度的过程。部分3给出了从浓缩水和对照样品中提取的RNA的过程。每个测试样品的RNA是使用一式三份检测和随机引物素转录(第4)反转录。从各逆转录反应中的cDNA被分成五个分离的病毒特异性测定法所通过qPCR一式三份进行分析(第5部分; 图2)。该测定法使用引物和探针从科学文献(表1)被设计为检测许多肠病毒和诺如病毒和含有庚型肝炎的RNA,以确定测试样品是抑制至RT-qPCR的15的试剂。
研究方案
注意:使用数据表来跟踪所有步骤的协议;例子的数据表中给出的补充材料表S2-S4中 。
1.标准曲线准备
- 准备标准曲线试剂的工作股票( 如装甲RNA环保局1615年)通过从制造商到2.5×10 8个/毫升(2.5×10 8 GC /毫升)使用TSM浓度所提供的浓度稀释三缓冲区。划分工作进入股票使用的1.5 ml离心管中,并储存在-20℃的250微升等分。
注:请参阅补充材料协议的步骤S1对病毒的编写工作股和质粒使用说明作为替代标准曲线的试剂。 - 解冻一个工作原液等分试样的一个或多个。准备使用1.5 ml微量离心管5 10倍连续稀释,得到的2.5×10 7个浓度 ,2.5×10 6,2.5×10 5,2.5×10 4,2.5×10 3的GC /毫升。
- 加入25微升2.5×10 8 GC / ml工作存量为225微升TSM三缓冲区准备第一稀释。混合使用旋涡混合器5-15秒。
- 加入25微升准备步骤1.2.1至225微升TSM III缓冲稀释的准备下一次的稀释。再次混合,继续类似的过程,以备未来三年10倍稀释。
- 提取从标准曲线工作原液RNA和立即使用第3步骤的五个稀释。
2.第三浓度
- 制备离心浓缩(30,000分子量截留),用于通过将至少10 ml的1×PBS中,0.2%牛血清白蛋白(BSA)在上样品室收集的每个样本。确保解决方案填补了薄通道浓度室,然后按住O / N在4℃。
- 丢弃液体。冲洗集中一次与至少加入10ml无菌试剂级水,以除去过量的BSA,然后丢弃的水。
- 从各试样等于S,则检测样品体积为单独的离心浓缩添加辅助水浓缩物的量。
- 使用等式1计算S,
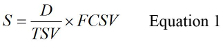
其中D是原水样测定由卷,TSV是总样本量和FCSV是最后的浓缩样品的体积。见补充材料S2以S的计算的一个例子
- 使用等式1计算S,
- 离心机以3,000-6,000×g离心在吊桶式转子20各测试样品,在4℃ - 30分钟。检查在薄通道浓度室内的容量。
- 如果卷是大于400微升,离心再次进行20分钟或更长的时间。继续离心,直至日样本Ë薄通道浓度室已减少到不足400微升。不要除去上清液。
- 用1ml的无菌磷酸盐0.15钠,pH 7-7.5洗离心浓缩的两侧,以提高病毒回收。离心再次在3,000-6,000×g离心4℃直到样品已经减少到小于400微升。重复此清洗步骤一个额外的时间。
- 使用100-200微升微量,仔细测量和每个浓缩的样品转移至1.5ml微量管(即,传输200微升至微量离心管,然后通过调节微量测量剩下的浓缩物,直至剩余流体可以完全拟定进入移液器提示)。添加的0.15M磷酸钠,pH 7-7.5,以调整最终体积至400±2微升。
- 立即进到步骤3.握住不能被任何processe浓缩的样品中提取核酸ð立即在4℃下为不超过24小时。
3.核酸分离
- 加入200微升按步骤3.3和200微升叔浓缩来自步骤1.3中所述从每个测试样品来自步骤2.5或标准曲线稀释以分离标记的1.5 ml微量离心管制备的提取缓冲液。冻结或低于-70℃,其余三级精矿。根据核酸提取试剂盒制造商的自旋协议血样有以下例外的指令从每个样品中提取核酸。
- 不要添加蛋白酶的水样,或使用与核酸提取试剂盒中提供的提取缓冲液。
- 准备提取液与载体RNA
- 添加310微升载体RNA稀释缓冲液到含有310微克的载体RNA的小瓶。混合溶解,然后分成6等份含有约50微升。储存于-20C。
- 添加28微升每毫升提取缓冲液的解冻载体RNA,得到0.027微克/微升的载体RNA浓度。使用载体RNA修订的提取缓冲液代替,随着提取试剂盒提供。
- 通过加入核糖核酸酶制备的洗脱缓冲液中的主溶液(RNA酶)抑制剂,以400单位/ ml的终浓度与提取试剂盒中提供的洗脱缓冲液。
- 洗脱RNA的核酸通过将50微升洗脱缓冲液与RNA酶抑制剂到柱结合旋转柱。等待1分钟,然后离心以6000 xg离心在RT 1分钟。
- 重复步骤3.4.1,然后取出并丢弃列。
- 从步骤3.4.2准备RNA提取物等分。准备标准曲线的工作股票的6等份,并包含每个至少15微升每个标准曲线的稀释。制备4等份含有至少所有其它RNA样品每22微升。存储每个样品和标准曲线控制中的一个等分试样在4℃下,如果它们可以通过逆转录4小时内进行处理;否则,存储所有分装置于或低于-70℃。
4.反转录(RT)
- 通过使用的量(以微升)等于十倍寡核苷酸的纳摩尔(纳摩尔)存在于所述的数量添加的PCR级水的体积,以每个小瓶制备100μM的储备溶液的每一寡核苷酸引物和探针在表1中列出的瓶(如图所示在瓶签或在制造商的规格表( 例如 ,含有悬浮在363微升36.3纳摩尔)引物。混合溶解。
- 稀释100微米的解决方案1:10 PCR级水准备10微米的工作解决方案。
- 使用导向表准备RT主混合物1和2在清洁室2。移液器16.5微升的RT Maste的- [R混合1到每个PCR板以及使用多道移液器。
- 解冻,如果冻,从每场采样和实验室强化样品基质的核酸提取物(LFSM, 即接种水基质样品)。
- 在含有RNA酶抑制剂400单位/毫升洗脱缓冲液5和1:25的稀释:每场LFSM样品1。
- 解冻,如果冻,但不稀实验室强化剂空白(LFB; 即使用种子试剂级水阳性质控),实验室试剂空白(LRB; 即使用试剂级水阴性质量控制),绩效评估(PE ; 也就是说 ,接种试剂级的水样用来评估实验室的操作前的研究开始),性能测试(PT, 即接种试剂级水样品滴度未知的分析师,用于评估实验室性能研究中),NA批次负提取控制,或者从标准曲线组中提取出的RNA。
- 放置6.7微升的RNA从每个测试样本,控制和成单独的PCR板孔的标准曲线,使用一式三份孔的测试样品和对照和复制井标准曲线(见图S1为一个RT板的例子)。
- 将6.7微升洗脱缓冲液为单独PCR板井无模板对照(NTC)。包括每个RT平板2-8 NTC,使用两个第一个样品,然后两个,每第四个额外的样品。
- 分发整个板的负萃取和NTC控制。
- 密封该PCR板具有耐热板盖。混合样本5-10秒,然后离心≥500 XG简单。
- 将培养板4分钟,在99℃,然后迅速冷却至4℃在热循环仪。再次离心在≥500 XG简单。
- 小心取出板密封,然后添加16.8微升RT预混2,每孔。硒人再次在板与耐热板密封,接着混合并在≥500×g的离心简短。
- 将板在热循环仪并在42℃下在99℃运行15分钟,在25℃,随后60分钟,5分钟,然后用4℃保持周期。
- 立即或内8小时通过qPCR(步骤5),或商店的样品或低于过程-70℃,直到它们可以被处理。商店的样品,可以在8个小时,在4℃下进行处理。
5.实时定量PCR(定量PCR)
- 每批庚型肝炎试剂的平均庚型肝炎CQ值确定正在运行的所有检测样品之前。
- 运行使用如对于NTC控制(步骤4.1.1)中制备10个重复一个RT测定。运行如下所述(步骤5.2到5.5.3)的庚型肝炎qPCR分析。计算10次重复的平均值CQ值。
- 调整在RT主混合物1庚型肝炎试剂量(表2),如果需要的话,以获得25和32个单位之间的平均Cq的值。补偿通过改变水的体积升高或降低的量加入,以保持对RT主混合物1终体积在每次测定16.5微升。
- 重复步骤5.1.1至5.1.2和变化表2,以反映调整后的数量确认任何调整。
- 在洁净室用导向件在表3为肠道准备QPCR试 剂盒, 如表4和表5的诺如病毒基因型组I, 表6为诺罗病毒基因型组II, 表7鼠诺罗病毒(诺罗病毒基因型组V)和表8对肝炎G.混合每个主结构,然后离心≥500 XG简单。
- PCR主混合物添加至标记的光学反应板的适当的孔中,使用每孔单独板14微升的每个qPCR分析(见图S2 用于基于图S1中的RT布局的qPCR分析)一个可能的布局。
- 解冻来自步骤4.8对RT板在RT,如果冻结。混合使用板混合器,然后离心在≥500 xg离心简要。
- 分配6微升适当的cDNA到光学反应板的适当的孔中。混合光学反应板和离心机样品在≥500 XG简单。
- 运行的所有其他qPCR实验前在未稀释和稀释后场LFSM样品庚型肝炎qPCR分析。使用场或LFSM样品即<1 Cq的值大于用于肠道病毒和诺沃克病毒qPCR实验的平均庚型肝炎的Cq值的最低稀释。
- 根据制造商的说明建立的定量PCR热循环仪软件。指出标准曲线样品作为标准,并为每个标准曲线稀释, 输入如表9中所示的基因组拷贝的值。 运行板中的定量PCR热循环仪进行10分钟,在95℃,接着进行45个循环15秒的在95℃和在60℃下1分钟。
- 确定每个标准曲线是否符合表 10中给出的可接受值,见补充材料部分S3的例子。
- 计算总体标准偏差(STDDEV),用于使用方程2的标准曲线,
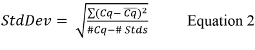
其中Cq的是报告对每个标准曲线复制的值,Cq的是对每一组重复的平均值,#Cq是Cq的值的具有正值(即不未确定)的所有标准控制重复的总数,和#性病是具有正值标准控制的数量。 - 如果定量PCR热循环仪软件不计算斜率为每个标准曲线,计算使用公式3的斜率60;
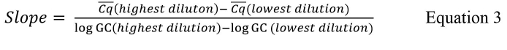
其中Cq的是所用的最高和最低稀释度的平均值和日志的GC为从表9中所用的最高和最低稀释的基因组拷贝值的对数。 - 计算使用公式4的R 2值。
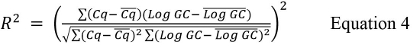
其中Cq的是所有的Cq值的平均值和日志的GC是每个重复的平均值日志GC值。 - 计算使用公式5%的效率:
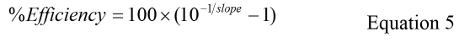
- 计算总体标准偏差(STDDEV),用于使用方程2的标准曲线,
- 记录由热循环仪软件为基于符合于表10中指定的条件,并为每个样本的平均值的GC值的标准曲线的所有测试样品中计算出的GC值。重新运行与标准曲线的任何样本不符合标准, 表10或者任何阴性对照(LRB,NA批负面提取控制,或NTC)是积极的。重新处理不符合条件或有假阳性对照的重新运行过程中的任何样本。
- 确定由GC每升(GC L)使用公式6各试验样品:
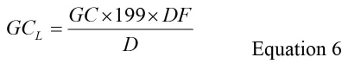
其中的GC是来自步骤5.7的平均基因组拷贝数,因子'199'是叔浓度期间发生的体积减少的总稀释因子,RNA提取和RT-qPCR的步骤,DF是用于补偿抑制稀释因子和D是原水样检测大鼠中升的容积。见补充材料部分S4为进行GC L时计算的一个例子。 - 通过199乘以来自步骤5.5的平均GC值和0.3分计算LFB的总GC和LRB样品。
结果
总体病毒恢复使用配对场和LFSM地下水样品确定。使用来自三个公共处理厂,并从私人井收集一个样本集收集在分开的场合两组共有七个样品组进行了分析。种子水平为LFSM样品3×10 6个鼠诺罗病毒的MPN萨宾脊髓灰质炎病毒的血清型3和5×10 6 PFU的。鼠诺罗病毒被用作在该方法评估替代由于缺乏人类诺罗病毒股用病毒浓度足以LFSM样品。地下水样品平均脊髓灰质炎病毒回收率为20%,以2%的标准误差,而14意味着鼠诺罗病毒回收率为30%,以3%(图3)的标准误差。每个LFSM定期现场地下水样品没有检出肠道病毒或诺如病毒。
LFB和LRB样品用种子和非种子选手试剂级笏测呃。所有LRB样品是阴性的(数据未示出)。脊髓灰质炎病毒回收率平均为44%,以1%(图3)的标准误差,而鼠诺罗病毒回收率平均为4%,其中0.5%的标准误差。
RT-qPCR的要求使用适当的标准曲线的试剂。 图4显示了一个典型的标准曲线为肠病毒和诺沃克病毒GII。诺罗病毒GII曲线满足标准曲线的性能标准(表10)与R 2值的0.9987,0.14总标准差,和101%的效率。诺如病毒GIA和GIB曲线(未显示)几乎相同,诺如病毒GII的。肠道病毒曲线符合方法性能标准带有R 2值为 0.9874,0.58总标准差,和103%的效率,但具有大约一百折以下灵敏度,因此比诺罗病毒曲线更高的检测限。
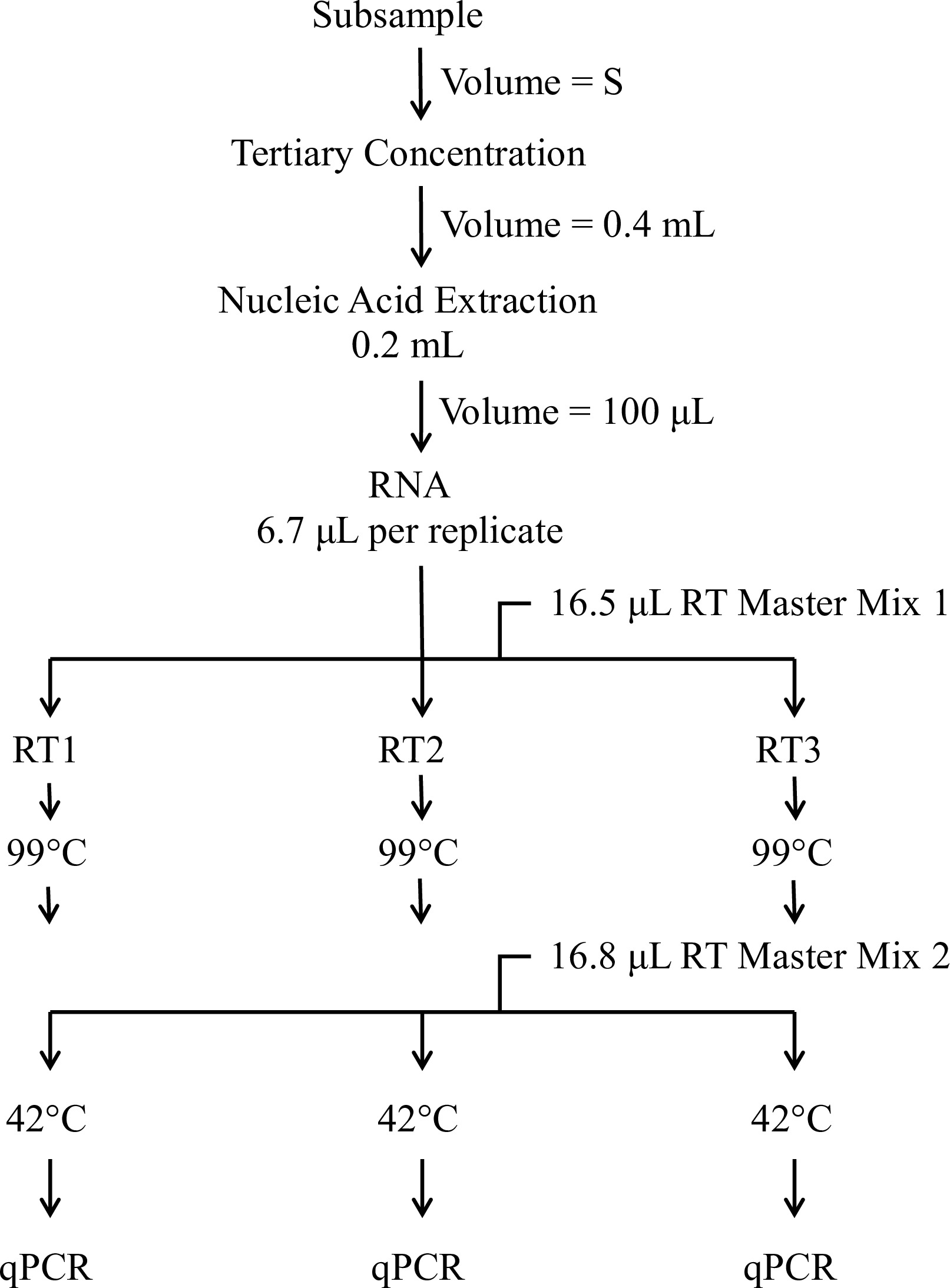
图中的分子操作步骤1.概述的分子过程包括超出测定感染性病毒,提取的核酸进行额外样品浓度,一个两步逆转录(RT)协议,和定量PCR(qPCR的)。初始体积(S)表示原始水试样的方法定义的比例。
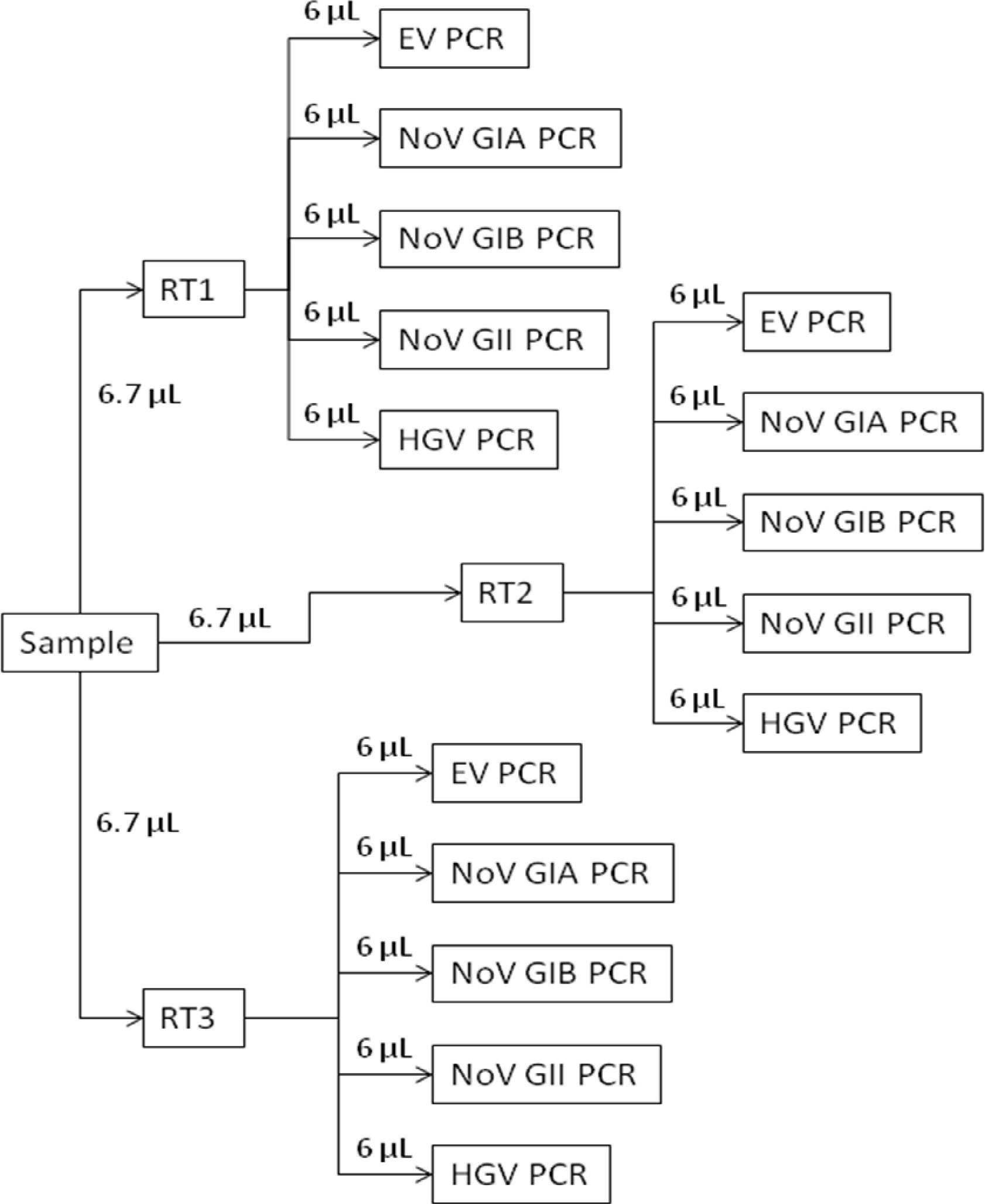
图2. RT-qPCR的概述示意图。每个提取的测试样品的RNA是使用一式三份测定(RT1,RT2,和RT3)反转录。从各一式三份RT检测然后用不同的肠道病毒(EV PCR)特定的病毒进行分析,诺如病毒基因型组I(GIA十一月PCR和NOV GIB PCR),诺如病毒基因型组II的cDNA(NOV GII PCR)和庚型肝炎(HGV PCR)测定。
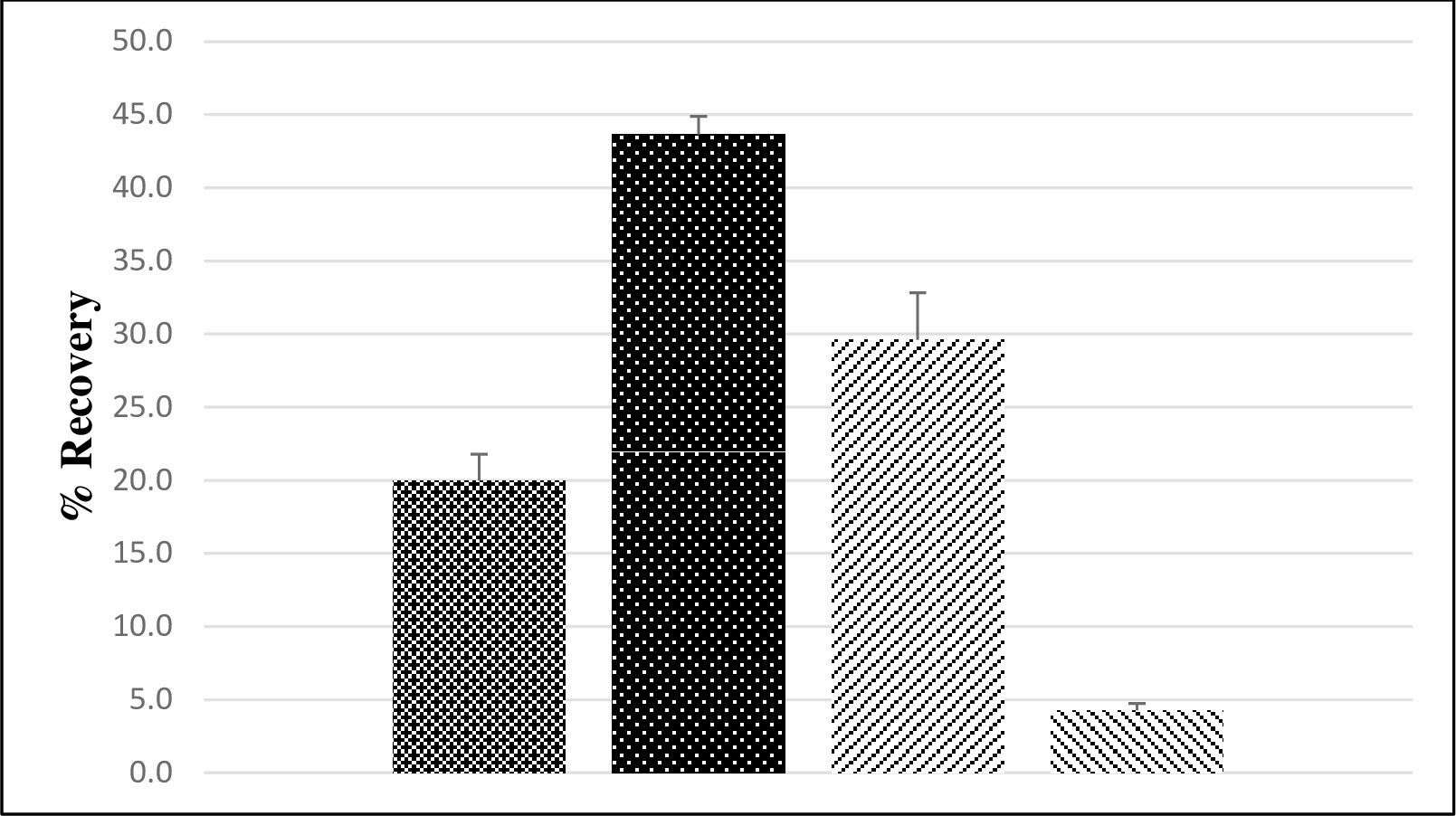
图3.平均脊髓灰质炎病毒和鼠诺如病毒回收率(%)从地面和试剂级的水,平均回收率表示从地面脊髓灰质炎病毒(  ; N = 7),并从试剂级(
; N = 7),并从试剂级(  ; N = 12),水和地面鼠诺如病毒(
; N = 12),水和地面鼠诺如病毒(  ; N = 7),并从试剂级(
; N = 7),并从试剂级(  ; 12例)水(1),其中"n"是处理后分离水采样的数量。误差条代表标准误差。
; 12例)水(1),其中"n"是处理后分离水采样的数量。误差条代表标准误差。

图4.肠道病毒和诺如病毒GII标准曲线。肠道病毒典型的标准曲线和诺如病毒GII显示。式给予斜率和 R 2的值对于每个曲线由热循环仪来计算。
补充文件1. 请点击这里下载此文件。
| 病毒集团 | 底漆/探测器名称(1) | 序(2) | 参考 | |
| 肠道病毒 | ||||
| EntF(EV-L)的 | CCTCCGGCCCCTGAATG | 20 | ||
| ENTR(EV-R) | ACCGGATGGCCAATCCAA | 20 | ||
| ENTP(EV-探头) | 6FAM-CGGAACCGACTACTTTGGGTGTCCGT-TAMRA | 21 | ||
| 诺如病毒GIA | ||||
| NorGIAF(JJV1F) | GCCATGTTCCGITGGATG | 22 | ||
| NorGIAR(JJV1R) | TCCTTAGACGCCATCATCAT | 22 | ||
| NorGIAP(JJV1P) | 6FAM-TGTGGACAGGAGATCGCAATCTC-TAMRA | 22 | ||
| 诺如病毒GIB | ||||
| NorGIBF(QNIF4) | CGCTGGATGCGNTTCCAT | 23 | ||
| NorGIBR(NV1LCR) | CCTTAGACGCCATCATCATTTAC | 23 | ||
| NorGIBP(NV1LCpr) | 6FAM-TGGACAGGAGAYCGCRATCT-TAMRA | 23 | ||
| 诺如病毒GII | ||||
| NorGIIF(QNIF2d) | ATGTTCAGRTGGATGAGRTTCTCWGA | 25 | ||
| NorGIIR(COG2R) | TCGACGCCATCTTCATTCACA | 25 | ||
| NorGIIP(QNIFS) | 6FAM-AGCACGTGGGAGGGCGATCG-TAMRA | 25 | ||
| 诺如病毒GV | ||||
| MuNoVF1 | AGATCAGCTTAAGCCCTATTCAGAAC | 14 | ||
| MuNoVR1 | CAAGCTCTCACAAGCCTTCTTAAA | 14 | ||
| MuNoVP1 | VIC-TGGCCAGGGCTTCTGT-MGB | 14 | ||
| 庚型肝炎 | ||||
| HepF(5'-NCR正向引物) | CGGCCAAAAGGTGGTGGATG | 19 | ||
| HEPR(5'-NCR反向引物) | CGACGAGCCTGACGTCGGG | 19 | ||
| 赫普(庚型肝炎TaqMan探针 | 6FAM-AGGTCCCTCTGGCGCTTGTGGCGAG-TAMRA | 1 | ||
表1.引物和TaqMan探针用于病毒检测用RT-qPCR的。
(1)方法1615引物和探针名称是连结到F,R或P为正向,反向,和探头病毒名的前三个字母。诺罗病毒基因型组是通过将GI和GII的姓名指定。这两个诺如病毒GI引物组还使用A和B引物和探针从主引用名杰出的父母给出heses。
(2)引物和探针序列的方向是5'到3'。以下简并碱基指示灯用于:所有4种核苷酸的N-混合物; R-A + G; Y型T + C; W-A + T;我肌苷。
| 成分 | 每个反应体积(微升)(2) | 最终浓度 | 每个主混合物(微升)卷(3) |
| RT主混合物1 | |||
| 随机引物 | 0.8 | 10毫微克/μL(约5.6μM) | 84 |
| 庚型肝炎装甲RNA(4) | 1 | 105 | |
| PCR级水 | 14.7 | 1543.5 | |
| 至TAL | 16.5 | 1732.5 | |
| RT主混合物2 | |||
| 10X PCR缓冲液II | 4 | 的10mM TRIS,pH值8.3,50mM的氯化钾 | 420 |
| 25毫MgCl 2的 | 4.8 | 3毫米 | 504 |
| 10毫的dNTPs | 3.2 | 0.8毫米 | 336 |
| 100毫DTT | 4 | 10毫 | 420 |
| 核糖核酸酶抑制剂 | 0.5 | 0.5单位/微升 | 52.5 |
| 的SuperScript II RT | 0.3 | 1.6单位/微升 | 31.5 |
| 总 | 16.8 | 1764 | |
表2. RT主混合物1和2(1)。
(1)准备RT预混在CLEAN室, 即 ,在不执行分子和微生物过程的房间。
(2)最终的RT测定体积是40微升。
(3)卷显示是基于105测定。这是足够的96孔PCR板的额外测定加到占损失。量可以放大或缩小根据将要分析样品和对照的数量。
(4)确定庚型肝炎试剂的量如补充材料的步骤S4中所述的RT主混合物1为包括。
| 成分 | 每个反应体积(微升)(2) | 最终浓度 | 每个主混合物(微升)卷(3) |
| 2倍的LightCycler 480探头预混 | 10 | 所有权 | 1050 |
| ROX参考染料(4) | 0.4 | 0.5毫米 | 42 |
| PCR级水 | 1 | 105 | |
| 10μMEntF | 0.6 | 300纳米 | 63 |
| 10μMENTR | 1.8 | 900纳米 | 189 |
| 10μMENTP | 0.2 | 100纳米 | 21 |
| 总 | 14 | 1470 |
表3. PCR主要混合液为肠病毒(EV) 测定(1)。
(1)准备所有的PCR预混在干净的房间。
(2)最后的qPCR分析体积为20微升。
(3)卷显示是基于105测定。这是足够的96孔PCR板的额外测定加到占损失。量可以放大或缩小根据样品和对照即会的数进行分析。
使用不要求它文书时,(4)替代PCR级水此试剂。
| 成分 | 每个反应体积(微升)(2) | 最终浓度 | 每个主混合物(微升)卷(3) |
| 2倍的LightCycler 480探头预混 | 10 | 所有权 | 1050 |
| ROX参考染料(4) | 0.4 | 0.5毫米 | 42 |
| PCR级水 | 1.4 | 147 | |
| 10μMNorGIAF | 1 | 500纳米 | 105 |
| 10μMNorGIAR | 1 | 500纳米 | 105 |
| 10μMNorGIAP | 0.2 | 100纳米 | 21 |
| 总 | 14 | 1470 |
表4. PCR主要混合液为诺如病毒GIA(NOV GIA)分析 (1)。
请参阅表3脚注(1) - (4)。
| 成分 | 每反应体积(微升)(2) | 终浓度 | 每个主混合物(微升)卷(3) |
| 2倍的LightCycler 480探头预混 | 10 | 所有权 | 1050 |
| ROX参考染料(4) | 0.4 | 0.5毫米 | 42 |
| PCR级水 | 0.3 | 31.5 | |
| 10μMNorGIBF | 1 | 500纳米 | 105 |
| 10μMNorGIBR | 1.8 | 900纳米 | 189 |
| 10μMNorGIBP | 0.5 | 250纳米 | 52.5 |
| 总 | 14 | 1470 |
表5. PCR主要混合液为诺如病毒GIB(NOV GIB)分析 (1)。
请参阅表3脚注(1) - (4)。
| 成分 | 每反应体积(微升)(2) | 终浓度 | 每个主混合物(微升)卷(3) |
| 2倍的LightCycler 480探头预混 | 10 | 所有权 | 1050 |
| ROX参考染料(4) | 0.4 | 0.5毫米 | 42 |
| PCR级水 | 0.3 | 31.5 | |
| 10μMNorGIIF | 1 | 500纳米 | 105 |
| 10μMNorGIIR | 1.8 | 900纳米 | 189 |
| 10μMNorGIIP | 0.5 | 250纳米 | 52.5 |
| 总 | 14 | 1470 |
表6. PCR主要混合液为诺如病毒GII(NOV GII)分析 (1)。
请参阅表3脚注(1) - (4)。
| 成分 | 每反应体积(微升)(2) | 终浓度 | 每个主混合物(微升)卷(3) |
| 2倍的LightCycler 480探头预混 | 10 | 所有权 | 1050 |
| ROX参考染料(4) | 0.4 | 0.5毫米 | 42 |
| PCR级水 | 0.3 | 31.5 | |
| 10μMMuNoVF1 | 1 | 500纳米 | 105 |
| 10μMMuNoVR1 | 1.8 | 900纳米 | 189 |
| 10μMMuNoVP1 | 0.5 | 250纳米 | 52.5 |
| 总 | 14 | 1470 |
表7. PCR主要混合液的小鼠诺如病毒检测 (1)。
请参阅表3脚注(1) - (4)。
| 成分 | 卷每反应(微升)(2) | 终浓度 | 每个主混合物(微升)卷(3) |
| 2倍的LightCycler 480探头预混 | 10 | 所有权 | 1050 |
| ROX参考染料(4) | 0.4 | 0.5毫米 | 42 |
| PCR级水 | 1.4 | 147 | |
| 10μMHepF | 1 | 500纳米 | 105 |
| 10μMHEPR | 1 | 500纳米 | 105 |
| 10μM赫普 | 0.2 | 100纳米 | 21 |
| 总 | 14 | 1470 |
表8. PCR主要混合液的庚型肝炎(HGV)分析 (1)。
看到的表3脚注(1) - (4)。
| 标准曲线浓度 | 每RT-qPCR分析基因组拷贝(1,2) |
| 2.5×10 8 | 502500 |
| 2.5×10 7个 | 50,250 |
| 2.5×10 6个 | 5025 |
| 2.5×10 5个 | 502.5 |
| 2.5×10 4个 | 50.25 |
| 2.5×10 3 | 5.025 |
表9.标准曲线基因组拷贝。
(1)确定的标准曲线孔中作为标准和放置每个RT-qPCR分析值基因组拷贝在热循环仪软件的适当位置。
(2)一种可以接受的标准曲线将具有70%-110%的效率中,R 2值> 0.97,以及对于诺罗病毒总标准差<0.5和<1.0肠病毒。
| 标准 | 可接受的值 | |
| 诺如病毒 | 肠道病毒 | |
| 总体标准差 | <0.5 | <1.0 |
| R 2 | > 0.97 | > 0.97 |
| 效率 | 的70%至115% | 的70%至115% |
表10.标准曲线验收标准 (1)。
(1)用70%-110%效率%标准曲线是可以接受的,但在90%-115%的范围内的值是理想的。小于90%的值可以指示移液或稀释误差。
| QA组件 | 平均回收率范围(%) | 变异系数(%) |
| 实验室试剂空白;负PT或PE样品 | 0 | N / A(1) |
| 实验室强化空白;实验室强化样品基质 | 5-200 | N / A |
| 正PT和PE样品 | 15-175 | ≤130 |
表11.方法1615的性能标准。
(1)不适用。
| 媒体 | 组成 |
| 的0.15M磷酸钠,pH 7.0-7.5 | 制备磷酸盐0.15M的钠通过在1升的dh的终体积溶解40.2克的磷酸钠,二元( 磷酸氢二钠·7H 2 O)的 2 O.将pH调节到7.0-7.5,用HCl。高压釜在121℃,15psi的15分钟。在RT商店磷酸钠溶液长达12个月。 |
| 5%BSA的 | 通过在100毫升卫生署2 O的将5g BSA的准备通过使溶液通过0.2微米的无菌过滤器进行消毒。 |
| 的PBS,0.2%BSA的 | 通过加入4 ml的5%BSA的96毫升的PBS制备。通过使溶液通过0.2微米的无菌过滤器进行消毒。 |
| TSM三缓冲 | 溶解1.21克Trisma碱,5.84克氯化钠,0.203克MgCl 2的1毫升Prionex明胶,和3ml Microcide III在950 ml的试剂级水。将pH调节至7.0,然后通过将溶液通过0.2微米的无菌过滤器使终体积至1L灭菌。 |
| 0.525%次氯酸钠(次氯酸钠) | 通过在D稀释家用漂白水1点10分准备0.525%次氯酸钠溶液H 2 O存储0.525%次氯酸钠溶液长达1星期RT。 |
| 1-1M硫代硫酸钠(钠2 S 2 O 3)五水合物 | 在1升的dh 2 O溶解248.2克的 Na 2 S 2 O 3准备 1M溶液商店硫代硫酸钠长达6个月的,在室温。 |
表12.表媒体。
讨论
源和饮用水水体病毒污染的国家大型研究需要使用多个分析实验室。在这些条件下,需要一个标准方法,以确保由多个实验室产生的数据是具有可比性。有许多已发表的分子生物学方法进行病毒检测,但很少有标准化的分子生物学方法。 EPA方法1615专门用于检测肠道病毒和诺如病毒的水基体,通过RT-qPCR的设计了一个标准化的方法。标准化的分子的方法可用于病毒检测在食品(CEN / ISO TS 15216-1和CEN / ISO TS 15216-2; 4月7,2013年)16,17和已应用于肝炎的检测病毒和诺沃克病毒在弹簧水16。所有的标准方法必须包括质量性能的控制和标准,以尽量减少内部和实验室变异,由于实验室污染误报数据。为了进一步减少虚假数据,EPA方法1615以下环保局的指导分子方法,18时的处理和单向工作流程规定的工作分开。它包括一个庚型肝炎1,19的内部控制和程序,以最小化由于RT-qPCR的15的抑制剂假阴性结果。它使用定量检测连同两者水取样,水分析,以使所有字段信息中的表示每升场或饮用水采样基因组拷贝的标准化体积。虽然高效的单管(一步)的RT-PCR测定法是市售的,所述方法有意使用单独的测定。这具有最小化的样品,可以在每个反应进行测定的量的缺点,但给出了使用多个引物组更大的灵活性。 RT-qPCR实验是由只有不如引物和探针使用,可能没有引物组将检测组中的所有病毒变种的限制。肠道病毒引物的选择,因为它的目标的保守5'-非编码区,20,21检测多种肠病毒血清型,和通过将其检测到的病毒与来自未处理的地下水1的消耗量的健康影响相关联。两套引物用于检测基因型组的诺如病毒我22,23。第一个被选为由于幼儿健康影响之间的强相关性,并检测到的病毒1。第二个基因型组I组引物和用于基因型组II诺如病毒引物对被选中,是因为他们发现最广泛株24,25。
尽管中的qPCR和RT-qPCR的程序在水中检测病毒RNA的主要优点外,还有一些限制。首先,无论感染性和非感染性的病毒颗粒,包括由消毒剂失活,可以通过这些程序扩增。博尔夏特的结果表明,这是一个问题较少未处理地下水˚FROM含水层类似于那些在社区学习比消毒地表水1。对于培养的病毒这个问题可以用PCR结合文化26,27加以克服。该问题还通过使用核酸交联剂28-30中讨论某些病毒。这后一种方法是更有效的病毒通过次氯酸盐灭活和不能有效地那些通过UV灭活。
这些分子的程序的第二个限制是,浓缩的样品的体积是通常可以测定是比用于培养程序6,31小得多。这个问题通常是由任一对由有机絮凝标准次级浓度,这允许样品被重新悬浮在更小的体积,或通过加入叔样品浓度步骤6,32,33的代以聚乙二醇为基础的程序处理。方法1615使用centrifugal超滤提供三级浓度。离心超滤除去水和组件小于30,000道尔顿造成任何病毒的测试样品中的浓度和在分子检测的小分子量抑制剂的降低。此第三浓度步骤的结果在> 10 5的总浓度因子为任何病毒,这是存在于水中的被测试。
第三个限制是环境样品中分子程序抑制剂的存在。尽管众多的方法来除去抑制剂已经被开发出来,没有办法是有效的所有水矩阵和病毒类型6,34,35,使得利用设计来估计抑制必需的水平的内部控制。在此方法中使用的庚型肝炎试剂通过提供病毒RNA的恒定水平在所有的反应和用于估计抑制一个RT-qPCR分析满足这一要求。当最好的t他除去抑制剂的方法无法除去抑制,样品浓缩物可以,只要病毒浓度比抑制剂浓度14,15更高稀释。
这里所描述的标准曲线方法既有优点也有一个主要的限制。一个优点是,该试剂耗材使用所有必要的组件在一个单一的试剂,从而允许使用用于所有检测的单一控制。该试剂是尤其对于诺罗病毒测定的优点。诺罗病毒颗粒仅能从感染个体使它很难获得病毒颗粒,用作标准获得。一个更重要的优点是,它提供了所有目标RNA病毒的RNA标准在一种试剂,作为具有的RNA标准是用于RNA 36的准确的定量是必不可少的。然而,它的准确量化病毒能力是由基体效应不考虑这一事实的限制。这意味着,基因组拷贝号值不能被认为是绝对的,只应在相对术语加以考虑。所以建议的标准曲线工作原液等分足够数目(步骤1.2)来制备以覆盖完整的研究。例如,每250微升等分试样提供足够的试剂为6 RT板。如果已知一个研究需要500个样品的分析,至少12等份,将需要(500个样品每RT板/ 7个样品/每等分6 RT平板)。
EPA方法1615是一种基于业绩的方法。许多制造商作出等效试剂与本文指定,这些试剂可以只要性能标准得到满足被取代。标准曲线,其也用作正的RT-qPCR的控制,是在解决性能问题值。性能可以拒绝由于降解RNA的试剂保质期,冷藏箱出现故障,仪器校准和技术性错误。性能问题应该是犯罪嫌疑人编如果标准曲线从图 4中所示的不同,或者如果它们不符合标准曲线的性能规格。在RT-qPCR分析是相当稳健;彻底失败可能是由于操作不当RNA或技术错误 (例如,缺少试剂)。大应小心处理提取和RT步骤,以减少RNA降解的核糖核酸酶的RNA样品。
脊髓灰质炎病毒回收率从地面和试剂级水和鼠诺如病毒回收率为地下水满足EPA方法1615性能验收标准 (表11),并有类似报道他人33,37,38。鼠诺如病毒回收率LFB样品均高于脊髓灰质炎病毒的要低得多,不会遇到脊髓灰质炎病毒的具体验收标准。其原因来自试剂级水低鼠诺如病毒的恢复是未知的。类似的结果在此,卡里姆和collea客串报告恢复为4%,从自来水39诺罗病毒GI.1。 Lee等37报道平均回收率为鼠诺罗病毒和18%的人的诺罗病毒GII.4和从蒸馏水用盘式过滤器,分别为26%。使用相似的条件,以利和他的同事,金和Ko观察回收率为46%和43%的这些病毒, 分别为38。 Gibbons等40绕从海水人类诺罗病毒GII.4的100%的回收率获得,但金和Ko 38发现,加入盐,以蒸馏水的浓度相似或比海水更高鼠病毒显著减少回收率并导致在大约一个两倍减少GII.4恢复。
披露声明
The authors have nothing to disclose.
致谢
The authors thank Dr. Eric Rhodes for preparing the clones used in the development of Standard curve reagent, Brian McMinn for assistance in sample processing, Larry Wymer for statistical analysis, Dr. Mark Borchardt, U.S. Department of Agriculture, Marshfield, WI, for supplying the Sabin poliovirus serotype 3 used in this study and Dr. H. W. Virgin, Washington University, St. Louis, MO, for murine norovirus. The authors also acknowledge Gretchen Sullivan for assistance in preparation of stock laboratory reagents, Dr. Mohammad Karim for propagation of murine norovirus stocks, and local private well owners and utilities for allowing us to collect water samples. Although this work was reviewed by EPA and approved for publication, it may not necessarily reflect official Agency policy. Mention of trade names or commercial products does not constitute endorsement or recommendation for use.
材料
| Name | Company | Catalog Number | Comments |
| 1.5 ml tube chamber | Diversified Biotech | CHAM-3000 | |
| 1 °C cool brick | Diversified Biotech | BRIK-2501 | |
| 10x PCR Buffer II and 25-mM MgCl2 | Life Technologies | N8080130 | |
| -20 °C freezer | VWR | 97043-346 | Must be a manual defrost freezer |
| -70 °C or colder freezer | Thermo Scientific | MBF700LSAO-E | |
| 96-well chamber | Diversified Biotech | CHAM-1000 | |
| Absolute ethanol | Fisher Scientific | BP2818-100 | |
| Armored RNA EPA-1615 | Asuragen | Custom order | Used for quantifying the RT-qPCR assay |
| Armored RNA Hepatitis G virus | Asuragen | 42024 | |
| Autoclave | Steris | Amsco Lab Series | |
| Biosafety cabinet | NuAir Laboratory Equipment Supply | Labgard 437 ES | |
| Bovine serum albumin (BSA) | Affymetrix | 10856 | Crystalline grade or better |
| Buffer AVE | Qiagen | 1026956 | Carrier RNA dilution buffer |
| Buffer AVL | Qiagen | 19073 | Extraction buffer |
| Carrier RNA | Qiagen | Not applicable | Use carrier RNA supplied with Buffer AVL |
| Centrifuge bottles | Fisher Scientific | 05-562-23 or 05-562-26 | |
| Centrifuge rotors | Beckman Coulter | 339080, 336380 | |
| Cool safe box | Diversified Biotech | CSF-BOX | |
| Dithiothreitol (DTT) | Promega | P1171 | |
| LightCycler® 480 Probes Master kit | Roche Diagnostics | 4707494001 | |
| Microcentrifuge tubes | Fisher Scientific | 02-682-550 | Use ribonuclease- and deoxyribonuclease-free tubes with snap caps |
| Microcide III | Fitzgerald | 99R-103 | |
| Microseal 'A' film | Bio-Rad Laboratories | HSA5001 | Heat resistant |
| Microseal 'F' film | Bio-Rad Laboratories | MSA1001 | Freezer resistant |
| Mini-plate spinner | Labnet International | MPS1000 | |
| Multichannel pipette | Rainin | L8-20 | |
| Multi-tube chamber | Diversified Biotech | CHAM-5000 | |
| Optical reaction plate | Life Technologies | 4314320 | |
| PCR nucleotide mix | Promega | U1515 | |
| PCR plate | Bio-Rad Laboratories | HSS9601 | |
| PCR-grade water | Roche | 3315932001 | |
| Phosphate buffered saline (PBS) | U.S. Biological | D9820 | |
| Plate mixer | Scientific Industries | MicroPlate Genie | |
| Prionex gelatin | Sigma Aldrich | G0411 | |
| QIAamp DNA Blood Mini Kit | Qiagen | 51104 | Includes Buffers AW1 (first wash buffer), AW2 (second wash buffer), AE (elution buffer); ethanol must be added to Buffers AW1 and AW2 before use; Do not use Buffer AL supplied with the kit |
| Quantitative PCR thermal cycler | Life Technologies | 4351405 | |
| Random primer | Promega | C1181 | |
| Reagent Reservoir | Fisher Scientific | 21-381-27E | |
| Refrigerated centrifuge | Beckman Coulter | 367501 | |
| RNase Inhibitor | Promega | N2515 or N2615 | |
| ROX reference dye | Life Technologies | 12223 | |
| SuperScript II or III Reverse Transcriptase | Life Technologies | 18064-022 or 18080044 | |
| Surgical gloves | Fisher Scientific | 19-058-800 | |
| Thermal cycler | Life Technologies | 4314879 | |
| Trisma base | Sigma Aldrich | T1503 | |
| Vivaspin 20 centrifugal concentrator units | Sartorius-Stedim | VS2022 |
参考文献
- Borchardt, M. A., Spencer, S. K., Kieke, B. A., Lambertini, E., Loge, F. J. Viruses in nondisinfected drinking water from municipal wells and community incidence of acute gastrointestinal illness. Environ. Health Perspect. 120 (9), 1272-1279 (2012).
- Ye, X. Y., et al. Real-time PCR detection of enteric viruses in source water and treated drinking water in Wuhan, China. Curr. Microbiol. 65 (3), 244-253 (2012).
- Williamson, W. M., et al. Enteric viruses in New Zealand drinking-water sources. Water Sci. Technol. 63 (8), 1744-1751 (2011).
- Lambertini, E., Borchardt, M. A., Kieke, B. A., Spencer, S. K., Loge, F. J. Risk of viral acute gastrointestinal illness from nondisinfected drinking water distribution systems. Environ. Sci. Technol. 46 (17), 9299-9307 (2012).
- Chigor, V. N., Okoh, A. I. Quantitative RT-PCR detection of hepatitis A virus, rotaviruses and enteroviruses in the Buffalo River and source water dams in the Eastern Cape Province of South Africa. Int. J. Environ. Res. Public Health. 9 (11), 4017-4032 (2012).
- Fout, G. S., Martinson, B. C., Moyer, M. W., Dahling, D. R. A multiplex reverse transcription-PCR method for detection of human enteric viruses in groundwater. Appl. Environ. Microbiol. 69 (6), 3158-3164 (2003).
- Hewitt, J., Bell, D., Simmons, G. C., Rivera-Aban, M., Wolf, S., Greening, G. E. Gastroenteritis outbreak caused by waterborne norovirus at a New Zealand ski resort. Appl. Environ. Microbiol. 73 (24), 7853-7857 (2007).
- Jack, S., Bell, D., Hewitt, J. Norovirus contamination of a drinking water supply at a hotel resort. New Zealand Med. J. 126 (1387), 98-107 (2013).
- Anderson, A. D., et al. A waterborne outbreak of Norwalk-like virus among snowmobilers-Wyoming, 2001. J. Infect. Dis. 187 (2), 303-306 (2003).
- Parshionikar, S. U., et al. Waterborne outbreak of gastroenteritis associated with a norovirus. Appl. Environ. Microbiol. 69 (9), 5263-5268 (2003).
- U.S. Environmental Protection Agency Office of Water. . 820-F-12-058: Recreational Water Quality Criteria. , 1-63 (2012).
- Wade, T. J., et al. Rapidly measured indicators of recreational water quality and swimming-associated illness at marine beaches: a prospective cohort study. Environ. Health. 9, 66 (2010).
- Fout, G. S., et al. . Method 1615: Measurement of enterovirus and norovirus occurrence in water by culture and RT-qPCR (EPA/600/R-10/181). , 1-91 (2012).
- Cashdollar, J. L., et al. Development and Evaluation of EPA Method 1615 for Detection of Enterovirus and Norovirus in Water. Appl. Environ. Microbiol. 79 (1), 215-223 (2013).
- Gibson, K. E., Schwab, K. J., Spencer, S. K., Borchardt, M. A. Measuring and mitigating inhibition during quantitative real time PCR analysis of viral nucleic acid extracts from large-volume environmental water samples. Water Res. 46 (13), 4281-4291 (2012).
- Fuentes, C., et al. Standardized multiplex one-step qRT-PCR for hepatitis A virus, norovirus GI and GII quantification in bivalve mollusks and water. Food Microbiol. 40, 55-63 (2014).
- Coudray, C., Merle, G., Martin-Latil, S., Guillier, L., Perelle, S. Comparison of two extraction methods for the detection of hepatitis A virus in lettuces using the murine norovirus as a process control. J. Virol. Methods. 193 (1), 96-102 (2013).
- Sen, K., et al. . EPA 815-B-04-001: Quality assurance/quality control guidance for laboratories performing PCR analyses on environmental samples. , 1-56 (2004).
- Schlueter, V., Schmolke, S., Stark, K., Hess, G., Ofenloch-Haehnle, B., Engel, A. M. Reverse transcription-PCR detection of hepatitis G virus. J. Clin. Microbiol. 34 (11), 2660-2664 (1996).
- De Leon, R., Shieh, C., Baric, R. S., Sobsey, M. D. Detection of enteroviruses and hepatitis A virus in environmental samples by gene probes and polymerase chain reaction. Proc. Water Qual. Technol. Conf. , 833-853 (1990).
- Monpoeho, S., et al. Quantification of enterovirus RNA in sludge samples using single tube real-time RT-PCR. BioTechniques. 29 (1), 88-93 (2000).
- Jothikumar, N., et al. Rapid and sensitive detection of noroviruses by using TaqMan-based one-step reverse transcription-PCR assays and application to naturally contaminated shellfish samples. Appl. Environ. Microbiol. 71 (4), 1870-1875 (2005).
- da Silva, A. K., et al. Evaluation of removal of noroviruses during wastewater treatment, using real-time reverse transcription-PCR: different behaviors of genogroups I and II. Appl. Environ. Microbiol. 73 (24), 7891-7897 (2007).
- Butot, S., et al. Evaluation of various real-time RT-PCR assays for the detection and quantitation of human norovirus. J. Virol. Methods. 167 (1), 90-94 (2010).
- Loisy, F., et al. Real-time RT-PCR for norovirus screening in shellfish. J. Virol. Methods. 123 (1), 1-7 (2005).
- Reynolds, K. A., Gerba, C. P., Pepper, I. L. Detection of infectious enteroviruses by an integrated cell culture-PCR procedure. Appl. Environ. Microbiol. 62 (4), 1424-1427 (1996).
- Ming, H. X., Zhu, L., Zhang, Y. Rapid quantification of infectious enterovirus from surface water in Bohai Bay, China using an integrated cell culture-qPCR. Mar. Pollut. Bull. 62 (10), 2047-2054 (2011).
- Parshionikar, S., Laseke, I., Fout, G. S. Use of propidium monoazide in reverse transcriptase PCR to distinguish between infectious and noninfectious enteric viruses in water samples. Appl. Environ. Microbiol. 76 (13), 4318-4326 (2010).
- Sanchez, G., Elizaquivel, P., Aznar, R. Discrimination of infectious hepatitis A viruses by propidium monoazide real-time RT-PCR. Food Environ. Virol. 4 (1), 21-25 (2012).
- Kim, S. Y., Ko, G. Using propidium monoazide to distinguish between viable and nonviable bacteria, MS2 and murine norovirus. Lett. Appl. Microbiol. 55 (3), 182-188 (2012).
- Fout, G. S., Schaefer, F. W., Messer, J. W., Dahling, D. R., Stetler, R. E. . EPA/600/R-95/178: ICR Microbial Laboratory Manual, I.1-ApD-23. , (1996).
- Abbaszadegan, M., Stewart, P., LeChevallier, M. A strategy for detection of viruses in groundwater by PCR. Appl. Environ. Microbiol. 65 (2), 444-449 (1999).
- Lambertini, E., et al. Concentration of enteroviruses, adenoviruses, and noroviruses from drinking water by use of glass wool filters. Appl. Environ. Microbiol. 74 (10), 2990-2996 (2008).
- Rodriguez, R. A., Thie, L., Gibbons, C. D., Sobsey, M. D. Reducing the effects of environmental inhibition in quantitative real-time PCR detection of adenovirus and norovirus in recreational seawaters. J. Virol. Methods. 181 (1), 43-50 (2012).
- Iker, B. C., Bright, K. R., Pepper, I. L., Gerba, C. P., Kitajima, M. Evaluation of commercial kits for the extraction and purification of viral nucleic acids from environmental and fecal samples. J. Virol. Methods. 191 (1), 24-30 (2013).
- Fey, A., et al. Establishment of a real-time PCR-based approach for accurate quantification of bacterial RNA targets in water, using Salmonella as a model organism. Appl. Environ. Microbiol. 70 (6), 3618-3623 (2004).
- Lee, H., et al. Evaluation of electropositive filtration for recovering norovirus in water. J. Water Health. 9 (1), 27-36 (2011).
- Kim, M., Ko, G. Quantitative characterization of the inhibitory effects of salt, humic acid, and heavy metals on the recovery of waterborne norovirus by electropositive filters. J. Water Health. 11 (4), 613-622 (2013).
- Karim, M. R., Rhodes, E. R., Brinkman, N., Wymer, L., Fout, G. S. New electropositive filter for concentrating enteroviruses and noroviruses from large volumes of water. Appl. Environ. Microbiol. 75 (8), 2393-2399 (2009).
- Gibbons, C. D., Rodriguez, R. A., Tallon, L., Sobsey, M. D. Evaluation of positively charged alumina nanofibre cartridge filters for the primary concentration of noroviruses, adenoviruses and male-specific coliphages from seawater. J. Appl. Microbiol. 109 (2), 635-641 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。