Method Article
نموذج الأنسجة 3D الرئة الإنسان للدراسات وظيفية على
In This Article
Summary
Human tuberculosis infection is a complex process, which is difficult to model in vitro. Here we describe a novel 3D human lung tissue model that recapitulates the dynamics that occur during infection, including the migration of immune cells and early granuloma formation in a physiological environment.
Abstract
السل (TB) لا يزال يحمل خطرا كبيرا على صحة الناس في جميع أنحاء العالم، وهناك حاجة لنماذج فعالة من حيث التكلفة ولكن يمكن الاعتماد عليها لتساعدنا على فهم آليات المرض وتقدم الاكتشافات من خيارات العلاج الجديدة. في المختبر الثقافات خلية من الطبقات الوحيدة أو زملاء الثقافات تفتقر إلى ثلاثية الأبعاد (3D) والبيئة والردود الأنسجة. وهنا، نحن تصف مبتكر في نموذج المختبر من أنسجة الرئة الإنسان، والتي تبشر بالخير لتكون أداة فعالة لدراسة الأحداث المعقدة التي تحدث أثناء الإصابة بمرض السل المتفطرة (M. السل). يتكون نموذج الأنسجة 3D من الخلايا والخلايا الليفية الظهارية الأنسجة محددة، والتي يتم تربيتها في مصفوفة الكولاجين على رأس غشاء مسامي. عند التعرض للهواء، والخلايا الظهارية تطبق وتفرز المخاط في الجانب قمي. عن طريق إدخال الضامة الأولية مع M. الإنسان بالعدوى السل إلى وضع الأنسجةلتر، ونحن قد أظهرت أن الخلايا المناعية تهاجر إلى الأنسجة المصابة وتشكل المراحل المبكرة من الورم الحبيبي السل. هذه الهياكل تلخيص سمة مميزة لمرض السل البشري، الحبيبي، والذي يختلف جذريا أو لم يلاحظ عادة في استخدامها على نطاق واسع النماذج الحيوانية التجريبية. هذه الطريقة ثقافة عضوي النمط يمكن التصور 3D والتحليل الكمي القوي الذي يوفر معلومات مهمة حول الميزات المكانية والزمانية لخلايا المضيف الممرض التفاعلات. معا، ويقدم نموذجا أنسجة الرئة والأنسجة البيئة الصغرى ذات الصلة من الناحية الفسيولوجية للدراسات على مرض السل. وبالتالي، فإن النموذج أنسجة الرئة آثار محتملة على كل الدراسات الميكانيكية والتطبيقية الأساسية. الأهم من ذلك أن النموذج يسمح إضافة أو التلاعب من أنواع الخلايا الفردية، والتي بالتالي يوسع استخدامه لنمذجة مجموعة متنوعة من الأمراض المعدية التي تؤثر على الرئتين.
Introduction
في البشر، والاستجابات للعدوى، والتهاب الأنسجة، والتوظيف الخلوية، وإعادة عرض الأنسجة وتنظيم توازن الأنسجة هي الأحداث المعقدة التي تنطوي على أنواع مختلفة من الخلايا. وبالتالي، فإن هذه العمليات أفضل درس في بيئة النسيج المحلية. سابقا، وقد كان هذا أساسا الممكن استخدام النماذج الحيوانية التجريبية. ومع ذلك، فإن حيوانات التجارب المستخدمة على نطاق واسع عقد العديد من حدود لأنها غالبا ما تستجيب لمسببات الأمراض بطريقة مختلفة من البشر وأيضا عرض مسارا مختلفا من مرض 1. A البشرية في المختبر نموذج أنسجة الرئة يحمل إمكانيات دراسة الاستجابات المناعية محددة في رئة الإنسان.
عدوى السل البشري (TB) هو أساسا مرض يصيب الرئتين. المتفطرة السلية (M. السل)، العامل المسبب للمرض السل، تصل إلى الرئة عن طريق قطرات التي يتم نقلها إلى الفضاء السنخية، حيث اجتاحت البكتيريا عن طريق dendri الرئويةخلايا التشنج والضامة السنخية كجزء من الاستجابة المناعية الفطرية للعدوى 2،3. البلعمة من مسببات المرض يؤدي إلى تجزئة علة ضمن يبلوع ومثالي يؤدي إلى تحييد وقتل العامل الممرض من قبل بلعمية. ما يصل الى 50٪ من الأشخاص الذين تعرضوا لM. ويعتقد أن مرض السل لتكون قادرة على مسح العدوى عن طريق الاستجابة المناعية الفطرية 4. النتائج الأخرى للعدوى هي تطهير من قبل النظام المناعي التكيفي في مرحلة لاحقة، والعدوى كامنة أو في أسوأ الحالات المرض المزمن النشط 5.
في السابق لم تكن هناك نماذج الأنسجة في المختبر للدراسات السل البشري. وكثيرا ما استخدمت الثقافات وحيدة الخلية الضامة الإنسان أو خلايا الدم الطرفية الأخرى 6،7. وعيب هذا النهج هو أنها لا يمكن أن تعكس ديناميكية أنواع مختلفة من الخلايا التي تعمل معا في نسيج الرئة تتعرض لM. مرض السل . وبالتالي، هناك حاجة إلى نموذج في المختبر لتكون قادرة على إجراء دراسات الفنية والميكانيكية على السل. أنشئت في المختبر نموذج أنسجة الرئة الإنسان هو موضح هنا خلية القاعدة في الأصل من قبل مجموعتنا لإجراء دراسات عن وظائف الخلية الجذعية 8 لقد تكيفت هذه الطريقة لدراسة مرض السل.
نموذج أنسجة الرئة البشرية المقدمة هنا يتكون من خلايا والخلايا الليفية 8 الظهارية الأنسجة محددة. هذه الخلايا يتم تربيتها في مصفوفة الكولاجين على رأس غشاء مسامي في إدراج transwell وهياكل تشبه شكل العادية أنسجة الرئة الإنسان (الشكل 1). عند تعرضها للهواء تبدأ الخلايا على إفراز المخاط في الجانب قمي 8. من خلال زرع الضامة الإنسان الأساسية المصابين M. السل للنموذج، لاحظنا كيف تهاجر الخلايا المناعية في الأنسجة وتشكل المراحل الأولى من حبيبية TB 9. وهذا هو أول البشري نموذج الأنسجة described لمكافحة السل وأنه يشكل أداة واعدة لدراسة الاستجابات المناعية الفطرية لمرض السل وغيرها من الأمراض في الرئة. حتى الآن، وقد استخدمنا فقط وحيدات الضامة كما الخلايا المناعية في النموذج ولكن يمكن زيادة مستوى التعقيد من خلال إدراج أنواع الخلايا الإضافية ذات الصلة.
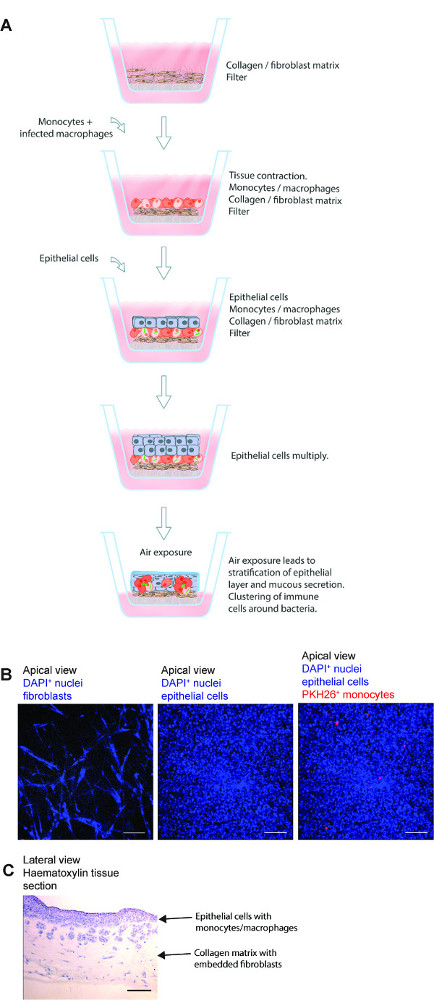
الشكل 1. مخطط تخطيطي لنموذج أنسجة الرئة. (A) ويتكون هذا النموذج من خلايا الرئة البشرية خاصة الظهارية، M. السل -infected الضامة الابتدائية والمصنفة صبغة حمراء حيدات المسمى على الكولاجين جزءا لا يتجزأ من الخلايا الليفية التي أعدت حول مرشح transwell. التعرض للنموذج النسيج في الهواء يبدأ إنتاج البروتينات المصفوفة خارج الخلوي وإفراز المخاط والطبقية التي كتبها الظهارة. نموذج الأنسجة 3D بالتالي المتقدمة هو أداة مفيدة لدراسة M. عدوى السل في بيئة CLOيشبه كتبها sely رئة الإنسان. (B) الصور المجهرية التمثيلية للخطوات المختلفة في إعداد نموذج الأنسجة. (C) الهيكل الكامل للقسم الأنسجة نموذج الرئة. على نطاق و- 100 ميكرون الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
ملاحظة: الدم المحيطي الإنسان من صحة المتبرعين بالدم مجهولة شراؤها في بنك الدم في مستشفى جامعة ينكوبينج، وكان يستخدم السويد كمصدر للخلايا المناعية لهذه الدراسة. تم تصميم هذا البروتوكول لمدة 24 إدراج لوحة مم 6 جيدا. لا ينصح التكيف المباشر إلى صيغ أخرى كذلك منذ عقود نموذجية الأنسجة عموديا وأفقيا خلال التنمية.
1. إعداد المواد والإعلام والثقافة من البكتيريا / خطوط الخليوي
- ثقافة البكتيريا:
- تنمو سلالة الفطرية M. السل H37Rv تحمل البلازميد pFPV2 للتعبير جوهري بروتين الفلورية الخضراء (GFP)، في ميدلبروك 7H9 المتوسطة التي تحتوي على 0.05٪ توين-80، و 0.5٪ الجلسرين، كانامايسين (20 ميكروغرام / مل)، وتستكمل مع ميدلبروك الزلال، وسكر العنب وإثراء الكاتالاز ( ميدلبروك ADC التخصيب)، عند 37 درجة مئوية مع CO 2 5٪ لمدة 7-10 أيام.
ملاحظة: جميع خطوة تجريبيةالصورة التي تنطوي على الهواء مباشرة ضراوة M. يجب أن يتم تنفيذ سلالات السل في منشأة BSL-3.
- تنمو سلالة الفطرية M. السل H37Rv تحمل البلازميد pFPV2 للتعبير جوهري بروتين الفلورية الخضراء (GFP)، في ميدلبروك 7H9 المتوسطة التي تحتوي على 0.05٪ توين-80، و 0.5٪ الجلسرين، كانامايسين (20 ميكروغرام / مل)، وتستكمل مع ميدلبروك الزلال، وسكر العنب وإثراء الكاتالاز ( ميدلبروك ADC التخصيب)، عند 37 درجة مئوية مع CO 2 5٪ لمدة 7-10 أيام.
- إعداد التعديل النسر المتوسطة (DMEM) المتوسطة كاملة 1X Dulbecco و(تستكمل مع 1 ملي البيروفات الصوديوم، 2 مم L-الجلوتامين، و 100 U / البنسلين مل، 100 ميكروغرام / مل الستربتومايسين، 10 ملي HEPES، 0.1 ملم الأحماض الأمينية غير الأساسية و10 الحرارة المعطل٪ مصل بقري جنيني (FBS)). إعداد أيضا DMEM المتوسطة كاملة خالية من المضادات الحيوية.
- إعداد 1X الحد الأدنى المتوسطة (MEM) المتوسطة كاملة الأساسية (1 ملي البيروفات الصوديوم، 2 مم L-الجلوتامين، و 100 U / البنسلين مل، 100 ميكروغرام / مل الستربتومايسين، 10 ملي HEPES، 0.1 ملم الأحماض الأمينية غير الأساسية و 10٪ للحرارة المعطل مصل بقري جنيني (FBS)).
- إعداد فبرونيكتين / قوارير المغلفة الكولاجين (مجموع 10 مل):
- ماصة 8.8 مل العقيمة 1X الفوسفات مخزنة المالحة (PBS) في أنبوب نظيفة. إضافة 1 مل مصل بقري الزلال (1 ملغ / مل)، و 100 نوع ميكرولتر أنا الكولاجين البقري (3 ملغ / مل) و 100 ميكرولتر المؤتلف هو جين تاورجل فبرونيكتين (1 ملغ / مل).
- مزيج الحل من خلال تحويل أنبوب رأسا على عقب 5 مرات. والمغلفة قوارير بمحلول فبرونيكتين / الكولاجين (1 مل لT-25 و 2 مل لT-75 قارورة). ترك الأمر O / N عند 37 درجة مئوية. بعد الحضانة، وإزالة الحل وتخزين قوارير المغلفة في RT.
ملاحظة: يمكن تخزين حل جمعها في 4 ° C وإعادة استخدامها لمدة ثلاث مرات. التخزين لأكثر من 2 أسابيع قد يسبب السائل لتحويل البني (تكوين بلورات)، حيث يجب أن يقوم عليها التخلص منها.
- ثقافة الخلايا الليفية:
- النمو والحفاظ على MRC-5، (خط الخلايا الليفية الرئة حقوق الإنسان مستمد من أنسجة الرئة العادية لل14 أسبوعا الجنين الذكر القديم)، في DMEM الكامل في CO 2 5٪ عند 37 درجة مئوية. استخدام الخلايا الليفية في الممرات 24-26 وتنمو حتى 70-80٪ متموجة.
ملاحظة: MRC-5 خط الخلية في مرور> 30 تميل الى فقدان التشكل وليس من المستحسن للاستخدام في نموذج الأنسجة.
- النمو والحفاظ على MRC-5، (خط الخلايا الليفية الرئة حقوق الإنسان مستمد من أنسجة الرئة العادية لل14 أسبوعا الجنين الذكر القديم)، في DMEM الكامل في CO 2 5٪ عند 37 درجة مئوية. استخدام الخلايا الليفية في الممرات 24-26 وتنمو حتى 70-80٪ متموجة.
- ثقافة الخلايا الظهارية:
- الحصول 16HBE14o- (16HBE)، والقصبي خط الخلية خلد الإنسان الظهارية التي تحتفظ التشكل متباينة وظيفة طبيعية ظهائر الهوائية البشري، (وهذا كان هدية من الدكتور ديتر Gruenert، جبل صهيون مركز السرطان بجامعة كاليفورنيا في سان فرانسيسكو ، الولايات المتحدة الأمريكية (10).). خلايا الثقافة 16HBE في فبرونيكتين / قوارير المغلفة الكولاجين والحفاظ على الخلايا في MEM الكامل في CO 2 5٪ عند 37 درجة مئوية.
- إعداد 5X DMEM
- إعداد 5X DMEM عن طريق إذابة 13.4 غرام من مسحوق DMEM و 3.7 غرام من بيكربونات الصوديوم في 150 مل من الماء المقطر المعقم. ضبط درجة الحموضة في المتوسط إلى 7.3، وجعل ما يصل حجم 200 مل وتصفية باستخدام 0.22 ميكرون فلتر الغشاء. جمع المتوسطة التي تمت تصفيتها في وعاء معقم وتخزينها حتى استخدامها في RT.
2. إعداد الخلايا الليفية الكولاجين جزءا لا يتجزأ من
- قسامات المجمدة ذوبان الجليد من FBS وL-الجلوتامين في 37 ° C حمام الماء.بعد ذوبان حفاظ على عينات على الجليد. وضع بيكربونات الصوديوم (71.2 ملغ / مل)، وجنتاميسين (50 ملغ / مل) في 4 درجات مئوية. قبل بارد 50 مل أنابيب الطرد المركزي و 10 مل ماصات معقمة ل4 ° C.
ملاحظة: يتم برود جميع المواد المستخدمة (باستثناء 5X DMEM) على الجليد قبل استخدامها ويتم تنفيذ كافة الخطوات على الجليد. النوع الأول من الأبقار الكولاجين (1.1 ملغ / مل) يجب أن تبقى باردة، وهذا يمنع تصلب الكولاجين. - إعداد الخلايا الليفية:
- دافئ التربسين في 37 ° C حمام الماء واحتضان كمية كافية مع الخلايا الليفية الرئة (MRC-5) خلايا لمدة 10 دقيقة في CO 2 5٪ عند 37 درجة مئوية. تحييد التربسين بإضافة 1X DMEM كاملة. نضح تعليق الخلية وأجهزة الطرد المركزي في 300 x ج لمدة 5 دقائق. نضح في وطاف resuspend الخلايا في 2.3 × 10 5 خلية / مل في DMEM كاملة. وضع الخلايا على الجليد حتى جاهزة للاستخدام.
- إعداد ما قبل مزيج:
- إضافة ما يلي إلى أنبوب المسمى "قبل مزيج". 395ميكرولتر من 5X DMEM، 40 ميكرولتر L-الجلوتامين، 120 ميكرولتر NaHCO3 (71.2 ملغ / مل)، 440 ميكرولتر FBS، 5 ميكرولتر جنتاميسين (50 ملغ / مل)، السعة الإجمالية 1000 ميكرولتر، ثم دوامة مسبقا تخلط جيدا وتوضع على الثلج.
ملاحظة: وحدات التخزين المعطاة هي واحدة 24 ملم 6 جيدا ثقافة إدراج. حساب المبالغ المحددة اللازمة لعدد من الملاحق ولكن مع إضافة واحد إضافي للتأكد، على استعداد كاف قبل المزيج.
- إضافة ما يلي إلى أنبوب المسمى "قبل مزيج". 395ميكرولتر من 5X DMEM، 40 ميكرولتر L-الجلوتامين، 120 ميكرولتر NaHCO3 (71.2 ملغ / مل)، 440 ميكرولتر FBS، 5 ميكرولتر جنتاميسين (50 ملغ / مل)، السعة الإجمالية 1000 ميكرولتر، ثم دوامة مسبقا تخلط جيدا وتوضع على الثلج.
- تحضير خليط الكولاجين لا خلوي:
- لكل ثقافة إضافة 1 مل من لا خلوي مزيج الكولاجين. إضافة ما يلي إلى أنبوب مخروطي 50 مل على الجليد في ترتيب معين. 686 ميكرولتر من 1.1 ملغ / مل الكولاجين، 250 ميكرولتر قبل المزيج و64 ميكرولتر 1X DMEM الكامل إلى إجمالي حجم 1000 ميكرولتر. مزيج الحل كذلك ضمان عدم وجود فقاعات الهواء. العمل بسرعة وإضافة الكولاجين على جدار الأنبوب لتجنب فقاعات الهواء.
- إضافة 1 مل من الخليط طبقة لا خلوي إلى إدراج وضعها في لوحة 6 جيدا. لا تضيف أي وسيلة إلى البئر خارج إدراج. فيcubate لمدة 30 دقيقة في الحاضنة 37 درجة مئوية. تأكد من أن الخليط لا خلوي يغطي إدراج كامل دون أي فقاعات الهواء.
- تحضير خليط الكولاجين الخلوي:
- خلط مكونات الطبقة الخلوية في 50 مل أنبوب مخروطي أبقى على الجليد في الترتيب التالي. 2 مل الكولاجين، 615 ميكرولتر قبل المزيج، 58 ميكرولتر من 1X DMEM كاملة و 327 تعليق خلية ميكرولتر الخلايا الليفية الرئة (MRC-5) لتعويض الحجم الإجمالي ل3000 ميكرولتر. يتطلب كل ثقافة 3 مل من مزيج الكولاجين الخلوية.
خطوة حاسمة: تأكد من مزيج الكولاجين وبريمكس بعناية قبل إضافة تعليق الخلية. هذا وسوف تحييد الحموضة من الكولاجين لتجنب آثار سامة على الخلايا الليفية. - إضافة طبقة الخلوية (3 مل) على الجزء العلوي من طبقة الكولاجين ديكي واحتضان لمدة 2 ساعة في الحاضنة 37 درجة مئوية. العمل بسرعة وإضافة الكولاجين على جدار الأنبوب لتجنب فقاعات الهواء.
- بعد البلمرة، إضافة 2 مل من DMEM كاملة لركان الجزء السفلي من لوحة 6 جيدا (تحت إدراج)، واحتضان لمدة 24 ساعة.
ملاحظة: إذا البلمرة لم يحدث، تجاهل إدراج لوحة تحتوي على مصفوفة الخلايا الليفية الكولاجين وبدء من جديد. السبب الأكثر احتمالا هو حدوث خطأ في إضافة أو حجم غير صحيح واحد من الكواشف المذكورة أعلاه.
- خلط مكونات الطبقة الخلوية في 50 مل أنبوب مخروطي أبقى على الجليد في الترتيب التالي. 2 مل الكولاجين، 615 ميكرولتر قبل المزيج، 58 ميكرولتر من 1X DMEM كاملة و 327 تعليق خلية ميكرولتر الخلايا الليفية الرئة (MRC-5) لتعويض الحجم الإجمالي ل3000 ميكرولتر. يتطلب كل ثقافة 3 مل من مزيج الكولاجين الخلوية.
3. الثقافة مستمرة من مصفوفة الخلايا الليفية-الكولاجين
- رفع بعناية إدراج باستخدام ملقط نظيفة ونضح وسائل الإعلام الثقافة من قاع البئر. إضافة DMEM 2 مل الكامل إلى أسفل يتبع بشكل جيد من قبل 2 مل DMEM الكامل ضمن إدراج. تجنب إدخال فقاعات الهواء تحت إدراج، حيث سيؤدي ذلك إلى منع نشر المواد الغذائية بين الدوائر الخارجية والداخلية. إزالة فقاعات الهواء مع طرف micropipette.
- تغيير ثقافة وسائل الإعلام (داخل وتحت إدراج) كل يوم الثاني والثقافة لحوالي 5-7 أيام. العناية في إزالة وسائل الإعلام من إدراج. لتجنب حساب المشتركط م مع مصفوفة الخلايا الليفية الكولاجين، وإمالة قليلا إدراج باستخدام ملقط نظيفة ونضح وسائل الإعلام من الجدران إدراج.
خطوة حاسمة: يجب على الخلايا الليفية في مصفوفة الكولاجين الحصول على النمط الظاهري ممدود، وإعادة تشكيل الكولاجين، ثم العقود. في حوالي 5-7 أيام، وقد تعاقدت مصفوفة لتشكيل منصة (10-14 ملم في القطر) في وسط إدراج. مصفوفة التعاقد جاهزة للاستخدام في الخطوة التالية. للحصول انكماش الموحد للمصفوفة فمن الأهمية بمكان أن الخلايا الليفية مختلطة بشكل جيد مع الكولاجين قبل البذر (الخطوة 2.6.1).
4. البذر من الخلايا المناعية (المصابة / غير المصابة الوحيدات البلاعم خليط)
ملاحظة: تشمل الخطوات التجريبية التالية المتفطرات خبيثة، وبالتالي يجب أن يؤديها في منشأة BSL-3.
- إعداد حيدات الابتدائية والضامة:
- عزل حيدات الدموية المحيطية من الدم المانحة باستخدام establiإلقاء البروتوكول. عزل حيدات في نفس اليوم الذي وضع نموذج الأنسجة والثقافة وتميزهم في الضامة ما يقرب من 7 أيام قبل الإصابة مع M. السل.
ملاحظة: هذا سيضمن كلاهما الضامة والمتعاقد مع الخلايا الليفية الكولاجين مصفوفة متوفرة بعد 7 أيام. أيضا عزل حيدات الجديدة التي ستضاف إلى جانب الضامة المصابة.
- عزل حيدات الدموية المحيطية من الدم المانحة باستخدام establiإلقاء البروتوكول. عزل حيدات في نفس اليوم الذي وضع نموذج الأنسجة والثقافة وتميزهم في الضامة ما يقرب من 7 أيام قبل الإصابة مع M. السل.
- إعداد M. السل -infected الضامة
- حصاد البكتيريا مثقف، ويغسل مع برنامج تلفزيوني 1X تحتوي على 0.05٪ توين-80، resuspend في DMEM كاملة خالية من المضادات الحيوية، تمر من خلال اقتطاع العقيمة 27 G إبرة لتفريق كتل البكتيرية وقياس الكثافة الضوئية.
ملاحظة: قبل تحديد M. مستعمرة السل تشكيل حكمه حدة الكثافة البصرية في المختبر. وهذا يعطي تقديرا لعدد من البكتيريا لاستخدامها في العدوى. - احتضان الضامة لمدة 4 ساعة مع <م> M. مرض السل في تعدد العدوى (وزارة الداخلية) 10). بعد الإصابة، وغسل 3X مع برنامج تلفزيوني 1X لإزالة البكتيريا خارج الخلية. استخدام الضامة غير المصابة مثقف في نفس الطريق ولكن دون M. السل، والضوابط.
- فصل الضامة من لوحة الثقافة عن طريق العلاج مع 2 مم EDTA لمدة 10 دقيقة عند 37 درجة مئوية، ومعلق الخلايا في خالية من المضادات الحيوية DMEM كاملة.
- حصاد البكتيريا مثقف، ويغسل مع برنامج تلفزيوني 1X تحتوي على 0.05٪ توين-80، resuspend في DMEM كاملة خالية من المضادات الحيوية، تمر من خلال اقتطاع العقيمة 27 G إبرة لتفريق كتل البكتيرية وقياس الكثافة الضوئية.
- وسمها حيدات
ملاحظة: عزل وتصنيف وحيدات لا يمكن أن يؤديها في مقاعد البدلاء BSL-2 ثم تؤخذ في BSL-3 منشأة لمزيد من المعالجة.- وصمة عار الطازجة وحيدات (2 × 10 7 الخلايا) مع تركيز النهائي من 2 ميكرومتر PKH26 صبغة حمراء لمدة 5 دقائق، وفقا لتعليمات الشركة الصانعة. غسل 3X و resuspend الخلايا مع خالية من المضادات الحيوية DMEM الكامل في كثافة 1 × 10 7 خلية / مل.
- إضافة الخلايا المناعية إلى الخلايا الليفية الكولاجين مصفوفة
- After 5-7 أيام من ثقافة مصفوفة الخلايا الليفية الكولاجين، ونضح وسائل الإعلام الثقافة من الدوائر الخارجية والداخلية وإضافة 1.5 مل من جديد خالية من المضادات الحيوية DMEM الكامل إلى غرفة الخارجي.
- إعداد وصفت الوحيدات البلاعم (غير مصاب / مصابة) خليط مع نسبة MO: MQ (5: 1) في 50 ميكرولتر DMEM كاملة. 50،000 الضامة، واتخاذ 250،000 حيدات المسمى.
- إضافة 50 ميكرولتر MO: MQ المزيج على مصفوفة الخلايا الليفية الكولاجين واحتضان لمدة 1 ساعة في CO 2 5٪ عند 37 درجة مئوية. بعد الحضانة، إضافة بلطف 2 مل من وسائل الإعلام الثقافة في إدراج واحتضان ل24 ساعة إضافية في CO 2 5٪ عند 37 درجة مئوية.
ملاحظة: كما خلايا أضاف تعلق فضفاضة، وينبغي أن تكون إضافة وسائل الإعلام بطيء عن طريق إضافة بلطف على جدران إدراج.
5. بذر خلايا الرئة الظهارية (16HBE)
ملاحظة: يجب أن يتم تنفيذ الخطوات التالية في منشأة BSL-3.
- البذور الرئة هخلايا pithelial (16HBE) على رأس MO: MQ-الليفية الكولاجين طبقة. لتنفيذ هذا، فصل أول 16HBE الخلايا من قارورة عن طريق التعامل مع التربسين (كما في 2.2.1.) و resuspend في 4 × 10 6 خلية / مل في DMEM مجانا المضادات الحيوية.
- نضح في وسائل الإعلام ثقافة داخل وخارج إدراج. ثم يضاف 1.5 مل خالية من المضادات الحيوية DMEM الكامل في قاع البئر خارج إدراج.
- إضافة 50 ميكرولتر من 16HBE على رأس الخلية الليفية المناعة الكولاجين المصفوفة. يترك لمدة 2 دقيقة في غطاء محرك السيارة واحتضان لمدة 1 ساعة في الحاضنة 37 درجة مئوية مع 5٪ CO 2. بعد الحضانة، إضافة بلطف 2 مل من خالية من المضادات الحيوية DMEM الكامل في إدراج والثقافة في 37 درجة مئوية لمدة 3 أيام. الخطوة ثقافة تسهل انتشار الخلايا الظهارية في نموذج الأنسجة.
ملاحظة: كما خلايا أضاف تعلق فضفاضة، وينبغي أن تكون إضافة وسائل الإعلام بطيئة ورقيقة من الانزلاق من خلال الجدران من إدراج.
6. الهواء والتعرض للالرئة 3Dنموذج
ملاحظة: بعد يوم 5 بالإضافة منصب الضامة المصابة، ونماذج الأنسجة هي المعرضة للهواء ويجب أن يتم تنفيذ الخطوات التالية في منشأة BSL-3.
- نضح في وسائل الإعلام ثقافة داخل وخارج إدراج.
ملاحظة: في هذه الخطوة يمكن جمع supernatants للكشف عن العوامل يفرز. أجهزة الطرد المركزي، معقم التصفية وتخزين supernatants في -70 ° C. - إضافة 1.8 مل مجانا المضادات الحيوية DMEM كاملة في غرفة الخارجية واحتضان في CO 2 5٪ عند 37 درجة مئوية الحاضنة لمدة 2 أيام. لا تقم بإضافة سائل الإعلام والثقافة ضمن إدراج.
ملاحظة: الهواء ورفع نموذج الأنسجة تسهل تشكيل ظهائر الطبقية وإفراز المخاط، والذي يوفر قوة إلى الأنسجة وتشابه الفسيولوجية للأنسجة رئة الإنسان.
7. حصاد وتركيب و3D الرئة الأنسجة نموذج
ملاحظة: يجب أن يتم تنفيذ الخطوات التالية في منشأة BSL-3.
- في يوم 7 آخر غرس الضامة المصابة، ونماذج الأنسجة جاهزة للحصاد. إزالة وسائل الإعلام الثقافة تماما عن نموذج الأنسجة. إصلاح نموذج الأنسجة مع بارافورمالدهيد 4٪ لمدة 30 دقيقة في الظلام في RT. هذه الخطوة يقتل البكتيريا وإصلاح الأنسجة التشكل / خلية لمزيد من المعالجة.
- باستخدام مشرط، فصل الغشاء من إدراج جيدا. نقل غشاء التي تحتوي على الأنسجة إلى تحتوي أيضا برنامج تلفزيوني 1X.
- قطع وإزالة الجانبين من نموذج الأنسجة باستخدام مشرط نظيفة. ثم شريحة نموذج الأنسجة إلى 4 قطع مربعة متساوية تقريبا. نقل قطعة من النسيج على شريحة زجاجية superfrost. تخزين القطع الأنسجة في برنامج تلفزيوني 1X في 4 درجات مئوية.
- تجفيف الأنسجة لمدة 5 دقائق وجبل باستخدام إطالة الذهب antifade مع دابي وساترة. مغادرة الشرائح دون إزعاج في الظلام في RT حتى تجف.
ملاحظة: سمك الأنسجة قد تختلف بين المركز والأطراف، مما تسبب في tilti طفيفنانوغرام من ساترة. لتجنب هذا، فاصل (على سبيل المثال parafilm) يجوز أن يوضع على الزاوية من انزلاق الغطاء. - تطبيق طلاء الأظافر إلى حواف ساترة واتركه حتى يجف. تزج الشرائح في الايثانول 70٪ لجعلها آمنة لاخراج مرفق BSL-3.
8. التصور، شراء والتحليل الكمي 3D
- تصور الشرائح الأنسجة باستخدام نظام المجهر متحد البؤر مع الليزر التي ينبعث منها في 488 نانومتر لإثارة GFP (قناة خضراء)، 420 نانومتر لدابي (الأزرق) و 555 نانومتر للحيدات PKH26 المسمى (الحمراء) على التوالي.
- الحصول على صور 3D في قرار 512x512 مع Z-مداخن تغطي على الأقل سماكة 20 ميكرون وجود 1-1،5 ميكرومتر الفصل بين أكوام. الحصول 5-10 مختلف المجالات التي تغطي كامل القطعة من النسيج.
ملاحظة: استخدم التكوين مثل Nyqvist لالإعدادات المثلى من قرار بصري (الطول الموجي، قوة الليزر / التعرض، وحجم بكسل وزووم). تجنب الامم المتحدةدير أو أكثر تشبع بكسل. - تحليل الصور مبائر مع برنامج 3D معالجة الصور. لتقدير 3D من مجموعات الخلايا، وينصح الخطوات التالية لتحليل الأمثل.
- فتح 3D معالجة الصور والبرمجيات وتحميل الصورة. قياس أبعاد الأجسام ليتم تحليلها في الصورة، على سبيل المثال، حجم النواة، الوحيدات الفردية والبكتيريا واحدة. هذه الملاحظات هي مفيدة لتحديد أو تصفية الكائنات.
- باستخدام أداة تعديل العرض، وتحسين جعل حجم عن طريق ضبط كل قناة على النقيض صورة والسطوع ومزيج التعتيم. هذه الخطوة للحد من تدخل الضوضاء في جعل حجم.
ملاحظة: قد يؤدي تصحيح غاما إلى التلاعب في الصور، وبالتالي يجب تجنبها. - إنشاء الأسطح عن طريق اختيار القناة الحمراء (حيدات) وتعيين عتبة (اختيار تلقائي أو يدوي). إذا لزم الأمر، واستخدام المرشحات لتقييد اختيار حيدات حمراء أو استبعاد بackground. وبالمثل، إنشاء الأسطح للأخضر (M. السل) والزرقاء (نوى) القنوات كما هو موضح أعلاه.
- تصدير البيانات إلى ملفات إكسل. فمن الممكن لتصدير معلمة معينة أو كافة البيانات. المعلمات التي هي ذات الصلة لتحليل تجميع الخلية هي وحدة التخزين، وكثافة، وعدد من الأشياء، وعدد من voxels وكروية.
- حفظ وتصدير الصور في شكل صور مناسبة ويفضل TIFF.
ملاحظة: يمكن أيضا أن تكون متحركة باستخدام القائمة الرسوم المتحركة وحفظها كملف وسائل الإعلام. - حفظ الإعدادات تحليل كل قناة باستخدام الخيار إضافة المعلمات ويمكن استرجاعها في وقت لاحق باستخدام وظيفة إعادة الإنشاء. في وقت واحد تحليل المزيد من الملفات باستخدام أداة تجهيز الدفعات.
ملاحظة: جميع الصور يمكن مقارنتها يجب الحصول عليها ومعالجتها وتحليلها بنفس الطريقة. على سبيل المثال لا ينبغي مقارنة صورة 8 بت (256 صحيح) مع صورة 12 بت (4096 صحيح).
النتائج
نموذج الأنسجة 3D الرئة لمكافحة السل البشري يمكن استخدامها بشكل فعال لدراسة التفاعلات المضيف الممرض في M. عدوى السل. الخطوات الأساسية لهذا الأسلوب، وترد الصور المجهرية التمثيلية لمختلف الخطوات وبنية المجهرية العام للقسم الأنسجة في الشكل 1. نموذج لديها العديد من مكونات أنسجة الرئة الإنسان، بما في ذلك الخلايا الليفية الرئة، الخلايا الظهارية الشعب الهوائية وحيدات الأولية / الضامة جزءا لا يتجزأ من البيئة الأنسجة 3D. بالإضافة إلى دمج مكونات أنسجة الرئة الإنسان، ونموذج يشبه الظروف الفسيولوجية وهي الطبقية من ظهائر وإفراز المخاط.
وقدم مثالا لاستخدام نموذج أنسجة الرئة في مراقبة عدوى السل في الشكل 2. لتصور M. السل -immune هجرة الخلايا والتفاعل، قدمنا الضامة المصابة M. السل التي تعبر عن GFP(الأخضر) مع حيدات المسمى PKH26 المعزولة حديثا (الأحمر) في نموذج الأنسجة (الأزرق وملطخة دابي لنوى). في يوم 7 بالإضافة منصب M. السل خلايا -infected لنموذج الأنسجة، والفحص المجهري متحد البؤر يكشف تجميع حيدات حمراء في موقع الإصابة (الأخضر) (الشكل 2)، الذي يحاكي الآفات السمة المميزة لمرض السل البشري 9.
سلسلة من الصور التمثيلية لل3D التصور من M. -infected السل يظهر نموذج الأنسجة وتقدير من مجموعات الخلايا في الشكل (3). والتصور 3D يعطي مرونة للمستخدم التفاعل وفحصها وتحديد العديد من الميزات في صورة 3D. ويمكن النظر إلى الترتيب المكاني من البكتيريا الخضراء ومجموعات الوحيدات الحمراء من وجهة نظر القمي، والتناوب الجانبي كما هو موضح في الشكل 3B، الذي يكشف عن تجميع وحيدات في موقع M. السل. العناقيد لم أوبخدم في الأنسجة غير المصابة (الشكل 3A). نحن كميا حجم وعدد من مجموعات الخلايا الوحيدات وجدت أن حجم (حجم) من مجموعات الخلايا مما يعزز (P <0.001)، في حين انخفض عدد حيدات الفردية (p <0.01) في M. السل إصابة الأنسجة بالمقارنة مع نماذج الأنسجة غير المصابة (الشكل 3C و 3D). بالتحقق من صحة هذه البيانات لدينا الحقائق السابقة من تشكيل الحبيبي في وقت مبكر من M. لاحظ عدوى السل في نماذج أنسجة الرئة تحليلها في 2D أقسام الأنسجة 9.
وتشير البيانات المتوفرة لدينا أن هذا النموذج الأنسجة يوفر الموائل 3D الطبيعي للتحقيق الخلوي المضيف معقدة M. شبكة الاتصالات السل. وجدنا أيضا أن التصور 3D والتحليل الكمي وأدوات أفضل لدراسة الخصائص الموجودة في نموذج الأنسجة (الشكل 3). الكمي من كتلة الخلية (الورم الحبيبي على سبيل المثال) غالبا ما تمتد [هس إلى عدة طبقات الخلايا ويمكن الحصول عليها تماما من قبل التحليل الكمي 3D. وعلاوة على ذلك، والتصور الدقيق من الميزات المكانية والزمانية لخلايا فردية أو البكتيريا الموجودة في نموذج يسمح الحية التصوير والهجرة وتتبع الدراسات في مختبر مخصص.
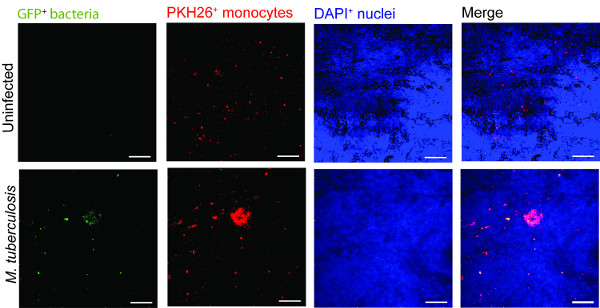
الشكل 2. الوحيدات في الكتلة نموذج الأنسجة المحيطة ضراوة M. السل. الصور مبائر التمثيلية للغير مصاب وM. ويرد السل نموذج الأنسجة المصابة. لوحات من الأخضر (M. tuberculosis- GFP) والأحمر (وحيدات المسمى PKH26) والأزرق (نوى دابي الملون) وقنوات اندمجت تظهر تجنيد حيدات في الأنسجة المصابة بالمقارنة مع الأنسجة غير المصابة. على نطاق و- 100 ميكرون.large.jpg "على غرار =" FONT-SIZE: 14px؛ خط الطول: 28px؛ "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
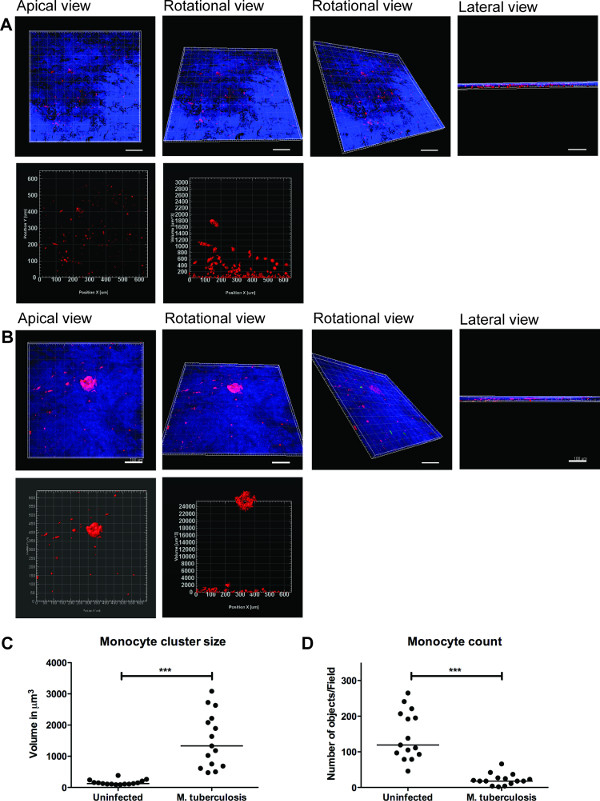
الرقم التصور 3. 3D والتحليل الكمي للنموذج الأنسجة توفير معلومات مفيدة. صور الممثل التصور 3D نموذج الأنسجة كامل (A) الأنسجة غير المصابة، (B) مصابة M. السل، من خلال باجتزاء البصرية باستخدام زايس LSM700 المجهر متحد البؤر والتحليل الكمي Imaris برامج معالجة الصور (الإصدار 7.6.8). تم الحصول على هذه الصور في 20X التكبير، 14 ض مداخن تغطي سمك الأنسجة 19.5 ميكرون مع 1.5 ميكرون الفاصل، مما يسمح التصور من قمية، أفقي التناوب، وعرض الرأسي والأفقي التناوب (A و B). (C) رابعةتحليل ntitative من مجموعات الخلايا الوحيدات تكشف محسن (P <0.0001) حجم الكتل الحبيبي في وقت مبكر بعد M. عدوى السل بالمقارنة مع عدم وجود عدوى. (D) الكمي لعدد من وحيدات أظهر انخفاضا (p <0.01) في الأنسجة المصابة بالمقارنة مع الأنسجة غير المصابة، مؤكدا المزيد من التجمعات في الأنسجة المصابة. الأخضر - M. -GFP السل، والأحمر - وحيدات PKH26 المسمى، الأزرق - نوى الخلايا، مقياس - 100 ميكرون الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
The ability to recruit and form organized cell clusters at the site of infection is the hallmark of human TB 11. These dynamic structures known as tubercle granulomas primarily consist of immune cells (macrophages, monocytes, T-cells and B-cells) and multi-nucleated giant cells surrounding M. tuberculosis. The role of the granuloma has long been considered to wall off the infection, preventing local spread of bacteria. However, more recent studies show that granuloma formation is critical for early bacterial survival, growth and dissemination 12. A strategy of new studies is to identify molecules or pathways that could efficiently be targeted to inhibit the cellular migration in granuloma formation and/or TB dissemination.
A caveat for novel studies on TB is the lack of models that recapitulate human TB. The most widely used experimental animals do not form true granuloma upon M. tuberculosis infection, and are therefore not appropriate choices for studies of TB 13-16. Non-human primates have the closest resemblance to human TB 17, but are not the preferred choice owing to high operational costs and ethical issues. Human TB is a complex immunological process and is difficult to model in vitro. Cell cultures of monolayers or co-cultures lack the 3D environment and tissue responses. Therefore, we have developed an innovative lung tissue model based on human primary immune cells and human lung-specific cell lines 8,9. The model displays characteristic features of human lung tissue, including epithelia with evenly integrated macrophages, formation of extracellular matrix, stratified epithelia and mucus secretion 9.
The 3D human lung tissue model has several benefits over the in vitro single or co-cultures seeded on tissue culture plates or transwell inserts. First, the human lung-specific cells (fibroblasts and epithelial cells) are not commonly included in the in vitro single or co-cultures. Second, the immune cells and lung-specific cells are embedded in a 3D physiological context (collagen rich extra-cellular matrix products). The response of cells to a stimulus/infection and the migratory behaviour of cells, for instance formation of a granuloma, differ significantly between a 2D and 3D environment. Furthermore, the described method enables the 3D visualization and robust 3D quantitative analysis that provides pivotal information on spatial distribution and intricate cellular interactions.
Experimental infection in the model tissue with M. tuberculosis resulted in clustering of macrophages at the site of infection, reminiscent of early TB granuloma (Figure 2 and 3). We have recently demonstrated that mutant strains defective in the ability to secrete the virulence factor ESAT-6 or Mycobacterium bovis BCG that lacks ESAT-6 did not induce the clustering of monocytes (no early granuloma), in contrast to the virulent M. tuberculosis 9. These data are consistent with the observations made from Mycobacterium marinum-infected zebrafish embryos, whose transparency allows for elegant live imaging of granuloma formation 12. As there is no gold-standard model for TB, we took advantage of the surgically resected tissue biopsies from TB patients for validation of the method 9. Our in vitro tissue model shares several characteristics with the lung and lymph node biopsies from TB patients, including the aggregation of macrophages in granuloma, the presence of both intra- and extracellular bacteria 18 and induction of necrosis 11.
Although the described model has physiological relevance to human TB and has several advantages over other in vitro models, it has some limitations. For instance, out of more than 20 collagen proteins identified in humans, only type I is included to the model to mimic the extra-cellular matrix. However, type I collagen is a complex mixture of extra-cellular matrix products and is the most abundant collagen in the human body. Further, we have demonstrated the presence of collagen IV and several extra-cellular matrix proteins such as tropoelastin, vimentin and laminin, which are produced by the epithelial cells and fibroblasts in the tissue model, indicating the synthesis of new collagen 8. Presently, the lung tissue model only has monocytes and macrophages, besides lung-specific cells. It lacks neutrophils and lymphocytes that are also known to be present in the granuloma. Remarkably the model is not limited to the introduction of additional immune cells and is of interest to explore how they contribute to the complex cellular interactions in human TB. Implantation of primary alveolar macrophages, skin-specific cells and lung carcinoma cells has already been tested in the model. Since our objective was to use a model that closely resembles human TB, introduction of mouse cells have not been attempted.
In summary, the lung tissue model has implications for both basic mechanistic and applied studies. Potential applications of the lung model include the study of innate immunity, investigating mechanistic aspects of host defences such as phagosomal maturation, autophagy, production of cytokines, chemokines and anti-microbial peptides, and functional characterization of individual cell types. Strikingly, the in vitro tissue model allows manipulation of one or more cells types and provides a relevant tissue micro-environment, not only for studies on TB, but for a variety of infectious and non-infectious diseases that affect the lungs.
Disclosures
The authors declare no competing financial interests.
Acknowledgements
The authors acknowledge the Microscopy core facility at the Faculty of Health Sciences, Linköping University for providing access to advanced imaging systems; Karl-Eric Magnusson (Emeritus Scientist) at the Dept. of Clinical and Experimental Medicine, Linköping University for providing access to Imaris 3D/4D image processing software (Bitplane, Switzerland); and S. Braian for his help with the lung model cartoon. This work was supported by funds from the Swedish Research Council (Alternatives to animal research, 2012-1951) and Swedish Research Council (2012-3349) to M.L. and Swedish Foundation for Strategic Research to S.B. S.B. receive grants from the Karolinska Institutet, Swedish Research Council, the Swedish International Development Cooperation Agency (Sida) and the Swedish Civil Contingencies Agency (MSB), and the Swedish Heart and Lung Foundation (HLF). M.S. received grants from the Karolinska Institutet and Stockholm County Council.
Materials
| Name | Company | Catalog Number | Comments |
| Cell culture inserts | BD Falcon | 353092 | |
| 6-well culture plates | BD Falcon | 353046 | |
| MRC-5 cells, lung fibroblasts | ATCC#CCL-171 | ||
| 16HBE cells, lung epithelial cells | Gift from Dr. Dieter Gruenert, Mt. Zion Cancer Center, University of California, San Fransisco, USA | ||
| 5 x Dulbecco’s modified Eagle’s medium (5 x DMEM) | Gibco | 12800-082 | Made from powder but add 5 times less water. Adjust pH to 7.3 and filter it using a 0.2 µm filter. |
| Dulbecco’s modified Eagle’s medium with glucose (DMEM) 1x | Gibco | 41965-039 | |
| Minimum Essential Medium (MEM) 1x with Earle’s salts | Sigma | M4655 | |
| Non-Essential Amino Acids Solution, 100x | Life Technologies | 11140-035 | |
| L-glutamine 200 mM (100x) | Gibco | 25030-024 | |
| Sodium Pyruvate | Life Technologies | 11360-039 | |
| NaHCO3 (71.2 mg/ml) | Prepared in house | ||
| Heat inactivated Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Heat inactivated for 30 min, 56 °C |
| Gentamicin (50 mg/ml) | Gibco | 15750-060 | |
| Hepes buffer solution 1M | Gibco | 15630-056 | |
| Penicillin Streptomycin (Pen Strep) | Gibco | 15140-122 | |
| Lymphoprep | Axis-Shield | 7801 | |
| Ultrapure 0.5 M EDTA | Gibco | 15575 | |
| Bovine Collagen PA treated (500 ml) | Organogenesis | 200-055 | |
| Pure col purified Bovine Collagen solution (100 ml) | Advanced biomatrix | 5005-B | |
| Extracellular matrix protein, Fibronectin (1 mg) | BD | 354008 | |
| Primary human monocytes/macrophages | Isolated from human whole blood or buffy coats. | ||
| PKH26 Red fluorescent cell linker | Sigma | MINI26 | |
| Mycobacterium tuberculosis H37Rv expressing green fluorescent protein | M. tuberculosis H37Rv wild type was transformed with the pFPV2 plasmid constitutively expressing GFP. | ||
| Middlebrook 7H9 medium | Difco | 271310 | |
| BBL Middlebrook ADC Enrichment | BBL | 211887 | |
| Tween-80 | |||
| Glycerol | |||
| Kanamycin B sulfate (20 µg/ml) | Sigma | B5264 | |
| Prolong Gold anti=-fade reagent with DAPI | Invitrogen | P36935 | |
| Trypsin -EDTA | |||
| Bovine serum albumin | |||
| Paraformaldehyde | |||
| DAPI | |||
| LSM700 Confocal microscope | Zeiss | ||
| iMaris Scientific 3D/4D image processing software, version 7.6.8 | Bitplane AG |
References
- Sakamoto, K. The pathology of Mycobacterium tuberculosis infection. Veterinary pathology. 49, 423-439 (2012).
- Saunders, B. M., Britton, W. J. Life and death in the granuloma: immunopathology of tuberculosis. Immunol Cell Biol. 85, 103-111 (2007).
- Kaufmann, S. H. New issues in tuberculosis. Ann Rheum Dis. Ann Rheum Dis. 63, ii50-ii56 (2004).
- Morrison, J., Pai, M., Hopewell, P. C. Tuberculosis and latent tuberculosis infection in close contacts of people with pulmonary tuberculosis in low-income and middle-income countries: a systematic review and meta-analysis. Lancet Infect Dis. 8, 359-368 (2008).
- Barry 3rd, C. E., et al. The spectrum of latent tuberculosis: rethinking the biology and intervention strategies. Nat Rev Microbiol. 7, 845-855 (2009).
- Puissegur, M. P., et al. An in vitro dual model of mycobacterial granulomas to investigate the molecular interactions between mycobacteria and human host cells. Cell Microbiol. 6, 423-433 (2004).
- Kapoor, N., et al. Human Granuloma In Vitro Model, for TB Dormancy and Resuscitation. PLoS One. 8, e53657 (2013).
- Nguyen Hoang, ., T, A., et al. Dendritic cell functional properties in a three-dimensional tissue model of human lung mucosa. Am J Physiol Lung Cell Mol Physiol. 302, L226-L237 (2012).
- Parasa, V. R., et al. Modeling Mycobacterium tuberculosis early granuloma formation in experimental human lung tissue. Dis Model Mech. 7, 281-288 (2014).
- Cozens, A. L., et al. CFTR expression and chloride secretion in polarized immortal human bronchial epithelial cells. Am J Respir Cell Mol Biol. 10, 38-47 (1994).
- Brighenti, S., Andersson, J. Local immune responses in human tuberculosis: learning from the site of infection. J Infect Dis. 205, S316-S324 (2012).
- Davis, J. M., Ramakrishnan, L. The role of the granuloma in expansion and dissemination of early tuberculous infection. Cell. 136, 37-49 (2009).
- Gupta, U. D., Katoch, V. M. Animal models of tuberculosis. Tuberculosis (Edinb). 85, 277-293 (2005).
- Kashino, S. S., Napolitano, D. R., Skobe, Z., Campos-Neto, A. Guinea pig model of Mycobacterium tuberculosis latent/dormant infection. Microbes Infect. 10, 1469-1476 (2008).
- Singhal, A., et al. Experimental tuberculosis in the Wistar rat: a model for protective immunity and control of infection. PLoS One. 6, e18632 (2011).
- Subbian, S., et al. Phosphodiesterase-4 inhibition alters gene expression and improves isoniazid-mediated clearance of Mycobacterium tuberculosis in rabbit lungs. PLoS Pathog. 7, e1002262 (2011).
- Lin, P. L., et al. Tumor necrosis factor neutralization results in disseminated disease in acute and latent Mycobacterium tuberculosis infection with normal granuloma structure in a cynomolgus macaque model. Arthritis Rheum. 62, 340-350 (2010).
- Rahman, S., et al. Compartmentalization of immune responses in human tuberculosis: few CD8+ effector T cells but elevated levels of FoxP3+ regulatory t cells in the granulomatous lesions. Am J Pathol. 174, 2211-2224 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved