Method Article
Un modèle de tissu 3D Poumon humain pour les études fonctionnelles sur
Dans cet article
Résumé
Human tuberculosis infection is a complex process, which is difficult to model in vitro. Here we describe a novel 3D human lung tissue model that recapitulates the dynamics that occur during infection, including the migration of immune cells and early granuloma formation in a physiological environment.
Résumé
La tuberculose (TB) détient toujours une menace majeure pour la santé des personnes dans le monde, et il ya un besoin de modèles de coût-efficacité, mais fiables pour nous aider à comprendre les mécanismes de la maladie et de promouvoir les découvertes de nouvelles options de traitement. Cultures in vitro de cellules de monocouches ou co-cultures ont pas la (3D) environnement tridimensionnel et réponses tissulaires. Ici, nous décrivons un innovant modèle in vitro d'un tissu pulmonaire humain, qui tient promesse d'être un outil efficace pour étudier les événements complexes qui se produisent lors de l'infection par Mycobacterium tuberculosis (M. tuberculosis). Le modèle de tissu 3D est constitué de cellules épithéliales et les fibroblastes spécifiques d'un tissu, qui sont cultivées dans une matrice de collagène sur le dessus d'une membrane poreuse. Lors de l'exposition de l'air, les cellules épithéliales de stratifier et sécrètent le mucus au côté apical. En introduisant les macrophages primaires humains infectés par M. tuberculose au mode de tissul, nous avons montré que les cellules immunitaires migrer dans le tissu infecté, et forment des premiers stades de la tuberculose granulome. Ces structures récapitulent la caractéristique distincte de la tuberculose humaine, le granulome, qui est fondamentalement différent ou non couramment observé dans des modèles animaux expérimentaux largement utilisés. Cette méthode de culture organotypique permet la visualisation 3D et l'analyse quantitative robuste qui fournit des informations clé sur les caractéristiques spatiales et temporelles des interactions cellulaires hôtes-pathogènes. Pris ensemble, le modèle de tissu pulmonaire fournit un tissu micro-environnement physiologiquement pertinente pour les études sur la tuberculose. Ainsi, le modèle de tissu pulmonaire a des implications potentielles pour les deux études mécanistiques et appliquées de base. Fait important, le modèle permet l'ajout ou la manipulation de types de cellules individuelles, ce qui élargit ainsi son utilisation pour la modélisation d'une variété de maladies infectieuses qui affectent les poumons.
Introduction
Chez l'homme, les réponses à l'infection, l'inflammation des tissus, le recrutement cellulaire, remodelage tissulaire et la régulation de l'homéostasie tissulaire sont des événements complexes impliquant différents types de cellules. Par conséquent, ces procédés sont le mieux étudiés dans l'environnement tissulaire local. Auparavant, cela a surtout été possible en utilisant des modèles animaux expérimentaux. Toutefois, les animaux de laboratoire largement utilisés détiennent de nombreux limites car ils répondent souvent à des agents pathogènes d'une manière différente que les humains et affichent également un cours différent de la maladie 1. Un être humain dans le modèle de tissu pulmonaire vitro détient les possibilités d'étudier les réponses immunitaires spécifiques dans le poumon humain.
L'infection de la tuberculose humaine (TB) est principalement une maladie affectant les poumons. Mycobacterium tuberculosis (M. tuberculosis), l'agent causal de la tuberculose, atteint le poumon par des gouttelettes d'aérosol qui sont transportés à l'espace alvéolaire, où les bactéries sont engloutis par dendri pulmonairecellules tic et les macrophages alvéolaires dans le cadre de la réponse immunitaire innée à l'infection 2,3. Phagocytose de l'agent pathogène mène à la compartimentation de la bogue dans un phagosome et aboutit à la neutralisation et le meurtre de l'agent pathogène par le phagocyte idéalement. Jusqu'à 50% des personnes exposées à M. la tuberculose sont soupçonnés d'être en mesure d'éliminer l'infection par la réponse immunitaire innée 4. Autres conséquences de l'infection sont un dégagement de la système immunitaire adaptatif à un stade ultérieur, l'infection latente ou dans le pire des cas, la maladie chronique active 5.
Auparavant, il n'y a pas eu de modèles in vitro de tissus pour les études de la tuberculose humaine. Des cultures de cellules uniques de macrophages humains ou d'autres cellules du sang périphérique ont souvent été utilisés 6,7. L'inconvénient de cette approche est qu'ils ne peuvent pas tenir compte de la dynamique de différents types de cellules qui fonctionnent ensemble dans un tissu pulmonaire exposé à M. tuberculose . Ainsi, il existe un besoin d'un modèle in vitro pour être en mesure d'effectuer des études mécanistiques et fonctionnels sur la tuberculose. Le modèle en tissu pulmonaire humain in vitro décrit ici à base de cellules a été initialement créé par notre groupe d'études sur les fonctions de cellules dendritiques 8. Nous avons adapté cette méthode pour l'étude de la tuberculose.
Le modèle de tissu pulmonaire humain présenté ici est constitué de cellules épithéliales et les fibroblastes 8 spécifiques d'un tissu. Ces cellules sont cultivées dans une matrice de collagène sur le dessus d'une membrane poreuse dans un insert Transwell et des structures de forme ressemblant à un tissu de poumon humain normal (figure 1). Lorsqu'il est exposé à l'air, les cellules commencent à sécréter du mucus sur le côté apical 8. En implantant des macrophages primaires humains infectés par M. la tuberculose au modèle, nous avons observé comment les cellules immunitaires migrent dans le tissu et forment premiers stades de granulomes tuberculeux 9. Ceci est la première descr modèle de tissu humainibed pour la tuberculose et elle pose un outil prometteur pour étudier les réponses immunitaires innées à la tuberculose et d'autres maladies du poumon. À ce jour, nous avons utilisé seulement monocytes et les macrophages en cellules immunitaires dans le modèle, mais le niveau de complexité peut être augmentée par l'inclusion d'autres types de cellules pertinentes.
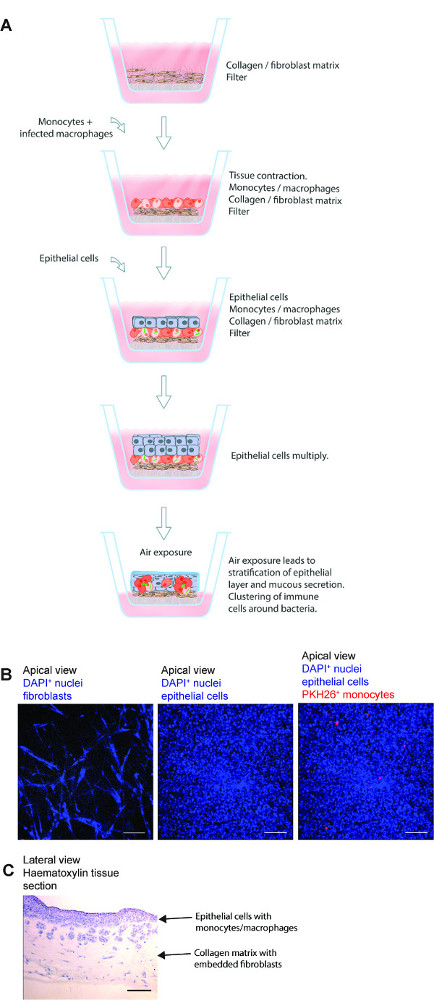
Figure 1. Représentation schématique du modèle de tissu pulmonaire. (A) Le modèle est composé de cellules épithéliales pulmonaires humaines spécifiques, M. tuberculose infectés par l macrophages primaires et le colorant rouge monocytes marqués collagène ensemencés sur des fibroblastes préparés embarqué sur un filtre Transwell. L'exposition du modèle de tissu à l'air initie la production de protéines de la matrice extra-cellulaire, la sécrétion de mucus et de stratification par l'épithélium. Le modèle de tissu 3D ainsi développé est un outil utile pour étudier M. l'infection tuberculeuse dans un environnement qui closely ressemble à un poumon humain. (B) des images microscopiques représentatifs des différentes étapes de la préparation du modèle de tissu. (C) de la structure complète de la section de modèle de tissu du poumon. Scale -. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Protocole
Remarque: le sang périphérique humain de donneurs de sang anonymes sains achetés à la banque de sang de l'hôpital de l'Université de Linköping, en Suède a été utilisé comme source de cellules immunitaires pour cette étude. Ce protocole est conçu pour 24 inserts de plaque mm à 6 puits. Adaptation directe à d'autres formats de puits est pas recommandé car les contrats types de tissu à la fois verticalement et horizontalement au cours du développement.
1. Préparation du matériel, des médias et de la culture de bactéries / lignées cellulaires
- Culture de bactéries:
- Cultivez la souche mycobactérienne M. tuberculosis H37Rv portant le plasmide pFPV2 pour exprimer de manière constitutive la protéine fluorescente verte (GFP), dans un milieu 7H9 Middlebrook contenant 0,05% de Tween-80, 0,5% de glycerol, de la kanamycine (20 ug / ml), et additionné de Middlebrook albumine, le dextrose et l'enrichissement de la catalase ( Enrichissement Middlebrook ADC), à 37 ° C avec 5% de CO 2 pendant 7-10 jours.
Remarque: Tous étape expérimentales impliquant direct virulente M. souches de tuberculose doivent être effectuées dans une installation BSL-3.
- Cultivez la souche mycobactérienne M. tuberculosis H37Rv portant le plasmide pFPV2 pour exprimer de manière constitutive la protéine fluorescente verte (GFP), dans un milieu 7H9 Middlebrook contenant 0,05% de Tween-80, 0,5% de glycerol, de la kanamycine (20 ug / ml), et additionné de Middlebrook albumine, le dextrose et l'enrichissement de la catalase ( Enrichissement Middlebrook ADC), à 37 ° C avec 5% de CO 2 pendant 7-10 jours.
- Préparer milieu de Eagle modifié (DMEM) du milieu complet de 1x Dulbecco (supplémenté avec du pyruvate 1 mM de sodium, 2 mM de L-glutamine, 100 U / ml de pénicilline, 100 ug / ml de streptomycine, 10 mM de HEPES, 0,1 mM d'acides aminés non essentiels et 10 % inactivé par la chaleur de sérum fœtal bovin (FBS)). Préparez également un milieu complet DMEM sans antibiotique.
- Préparer 1x Medium (MEM) du milieu complet Essentiel Minimum (pyruvate de sodium 1 mM, 2 mM de L-glutamine, 100 U / ml de pénicilline, 100 ug / ml de streptomycine, 10 mM de HEPES, 0,1 mM d'acides aminés non essentiels et 10% de la chaleur inactivé de sérum bovin fœtal (FBS)).
- Préparation de fibronectine / flacons revêtus de collagène (total 10 ml):
- Pipette phosphate de 1x 8,8 ml solution saline stérile tamponnée (PBS) dans un tube propre. Ajouter 1 ml de sérum albumine bovine (1 mg / ml), 100 ul type I collagène bovin (3 mg / ml) et 100 pi recombinant huhomme fibronectine (1 mg / ml).
- Mélanger la solution par retournement du tube-bas 5 fois. Les flacons sont revêtus d'une solution de fibronectine / collagène (1 ml de T-25 et de 2 ml pour un flacon T-75). Laissez-O / N à 37 ° C. Après incubation, éliminer la solution et stocker les flacons enduits à la température ambiante.
Remarque: La solution recueillie peut être stocké à 4 ° C et réutilisé pour trois fois. Stockage pendant plus de 2 semaines peut amener le liquide à brunir (formation de cristaux), où sur elle doit être jetée.
- Culture de fibroblastes:
- Cultiver et de maintenir MRC-5 (une lignée humaine de cellules de fibroblaste pulmonaire dérivé de tissu pulmonaire normal de 14 semaines un fœtus mâle), dans du DMEM complet dans 5% de CO2 à 37 ° C. Utilisez les fibroblastes à 24-26 passages et croître jusqu'à 70-80% de confluence.
Remarque: MRC-5 lignée cellulaire au passage> 30 ont tendance à perdre la morphologie et ne sont pas recommandé pour une utilisation dans le modèle de tissu.
- Cultiver et de maintenir MRC-5 (une lignée humaine de cellules de fibroblaste pulmonaire dérivé de tissu pulmonaire normal de 14 semaines un fœtus mâle), dans du DMEM complet dans 5% de CO2 à 37 ° C. Utilisez les fibroblastes à 24-26 passages et croître jusqu'à 70-80% de confluence.
- Culture de cellules epitheliales:
- Obtenir 16HBE14o- (16HBE), une ligne humaine immortalisée bronchique des cellules épithéliales qui conserve la morphologie et la fonction différenciée de l'épithélium respiratoire humain normal, (ce fut un don du Dr. Dieter Gruenert, Mt. Zion Cancer Center, Université de Californie, San Fransisco , Etats-Unis 10.). Culture de cellules 16HBE dans fibronectine / flacons revêtus de collagène et de maintenir les cellules dans du MEM complète dans 5% de CO 2 à 37 ° C.
- Préparation de 5x DMEM
- Préparer 5x DMEM en dissolvant 13,4 g de milieu DMEM poudre et 3,7 g de bicarbonate de sodium dans 150 ml d'eau distillée stérile. Ajuster le pH du milieu à 7,3, porter le volume à 200 ml et filtrer à l'aide de 0,22 um filtre à membrane. Recueillir le milieu filtré dans un récipient stérile et stocké jusqu'à son utilisation à température ambiante.
2. Préparation des fibroblastes collagène embarqués
- Aliquotes Décongeler de FBS et L-glutamine dans un bain d'eau à 37 C °.Après décongélation conserver les échantillons sur la glace. Placer bicarbonate de sodium (71,2 mg / ml) et de gentamicine (50 mg / ml) à 4 ° C. Pré-cool tubes de 50 ml de centrifugeuses et 10 ml Pipettes stériles à 4 ° C.
Remarque: Tous les matériaux utilisés (à l'exception du DMEM 5x) sont refroidis sur la glace avant de l'utiliser et toutes les mesures sont effectuées sur la glace. Le collagène bovin de type I (1,1 mg / ml) doit être maintenu froid, car cela empêche la solidification du collagène. - Préparer les cellules de fibroblastes:
- Chaud trypsine dans une ° C bain d'eau 37 et incuber quantité suffisante avec des fibroblastes pulmonaires (MRC-5) des cellules pendant 10 min à 5% de CO 2 à 37 ° C. Neutraliser la trypsine en ajoutant 1x DMEM complet. Aspirer la suspension de cellules et centrifuger à 300 g pendant 5 min. Aspirer le surnageant et remettre en suspension les cellules à 2,3 x 10 5 cellules / ml dans du DMEM complet. Placez les cellules sur de la glace jusqu'à utilisation.
- Préparer le pré-mélange:
- Ajoutez ce qui suit à un tube étiqueté «pré-mix»; 395pi de 5x DMEM, 40 ul de L-glutamine, 120 ul NaHCO3 (71,2 mg / ml), 440 pi de FBS, 5 pi gentamicine (50 mg / ml), volume total de 1000 pi, puis agiter le pré-bien mélanger et mettre sur glace.
Remarque: Les volumes indiqués sont pour un 24 mm à 6 puits culture insert. Calculer les montants spécifiques requises pour le nombre total d'inserts, mais ajouter une supplémentaire pour être sûr, suffisamment de pré-mélange est préparé.
- Ajoutez ce qui suit à un tube étiqueté «pré-mix»; 395pi de 5x DMEM, 40 ul de L-glutamine, 120 ul NaHCO3 (71,2 mg / ml), 440 pi de FBS, 5 pi gentamicine (50 mg / ml), volume total de 1000 pi, puis agiter le pré-bien mélanger et mettre sur glace.
- Préparer le mélange de collagène acellulaire:
- Pour chaque culture ajouter 1 ml de mélange de collagène acellulaire. Ajoutez ce qui suit à un tube conique de 50 ml sur de la glace dans l'ordre donné; 686 pi de 1,1 mg / ml de collagène, 250 pi pré-mix et 64 1x pi de DMEM complet à un volume total de 1000 pi. Bien mélanger la solution assurant qu'aucune bulle d'air. Travaillez rapidement et ajouter le collagène sur la paroi du tube pour éviter les bulles d'air.
- Ajouter 1 ml de la couche de mélange acellulaire de l'insert placé dans la plaque à 6 puits. Ne pas ajouter de moyen pour le bien en dehors de l'insert. Danscubate pendant 30 min dans un incubateur à 37 ° C. Assurez-vous que le mélange acellulaire couvre la totalité de l'insert sans bulles d'air.
- Préparer le mélange de collagène cellulaire:
- Mélanger les composants de la couche cellulaire dans un tube conique de 50 ml conservé sur de la glace dans l'ordre suivant; 2 ml de collagène, 615 pi de pré-mélange, 58 pi de DMEM complet et 1x 327 suspension de cellules de fibroblastes pulmonaires pi (MRC-5) pour compenser le volume total à 3000 pi. Chaque culture a besoin de 3 ml de mélange de collagène cellulaire.
Étape critique: Assurez-vous de mélanger le collagène et prémélange attentivement avant l'addition de la suspension cellulaire. Cela va neutraliser le pH du collagène pour éviter les effets toxiques sur les fibroblastes. - Ajouter la couche alvéolaire (3 ml) au-dessus de la couche de collagène acellulaire et incuber pendant 2 heures dans un incubateur à 37 ° C. Travaillez rapidement et ajouter le collagène sur la paroi du tube pour éviter les bulles d'air.
- Après la polymérisation, ajouter 2 ml de DMEM complets à til en bas de la plaque à 6 puits (sous l'insert) et incuber pendant 24 heures.
NOTE: Si la polymérisation n'a pas eu lieu, jeter les inserts de plaque contenant la matrice de collagène et des fibroblastes-démarrage encore. La cause la plus probable est une erreur de plus ou de volume incorrect de l'un des réactifs mentionnés ci-dessus.
- Mélanger les composants de la couche cellulaire dans un tube conique de 50 ml conservé sur de la glace dans l'ordre suivant; 2 ml de collagène, 615 pi de pré-mélange, 58 pi de DMEM complet et 1x 327 suspension de cellules de fibroblastes pulmonaires pi (MRC-5) pour compenser le volume total à 3000 pi. Chaque culture a besoin de 3 ml de mélange de collagène cellulaire.
3. La culture continue de la matrice de collagène des fibroblastes-
- Soulevez délicatement l'insert à l'aide d'une pince propre et aspirer le milieu de culture à partir du fond du puits. Ajouter 2 ml de DMEM complet au fond du puits suivi par 2 ml de DMEM complet à l'intérieur de l'insert. Éviter d'introduire des bulles d'air dans la pièce, car cela permettra d'éviter la diffusion des nutriments entre les chambres extérieures et intérieures. Retirer les bulles d'air avec une pointe de micropipette.
- Changer le milieu de culture (à l'intérieur et au-dessous de l'insert) tous les deux jours et de la culture pendant environ 5-7 jours. Prenez soin de retirer le support de l'insert. Pour éviter contact avec la matrice de collagène des fibroblastes, inclinez légèrement l'insert à l'aide d'une pince propre et aspirer les médias depuis les murs d'insertion.
Étape critique: Les fibroblastes dans la matrice de collagène devraient obtenir un phénotype allongée, et remodeler le collagène, qui a ensuite contrats. Dans environ 5-7 jours, la matrice a contracté pour former une plate-forme (10 à 14 mm de diamètre) au centre de l'insert. La matrice contractée est prêt pour une utilisation dans l'étape suivante. Pour obtenir une contraction uniforme de la matrice, il est essentiel que les fibroblastes sont bien mélangés avec le collagène avant le semis (étape 2.6.1).
4. Ensemencement des cellules immunitaires (Infected / Uninfected monocytes-macrophages Mélange)
Remarque: Les étapes suivantes impliquent expérimentales mycobactéries virulentes et doivent donc être effectuées dans une installation BSL-3.
- Préparation des monocytes et des macrophages primaires:
- Isoler des monocytes du sang périphérique provenant de donneurs de sang en utilisant un establijeter protocole. Isoler les monocytes sur le même jour que la mise en place du modèle et de la culture de tissus et de les différencier en macrophages pendant environ 7 jours avant l'infection par M. la tuberculose.
NOTE: Cela permettra d'assurer à la fois les macrophages et la matrice de collagène contracté fibroblastes sont disponibles après 7 jours. Aussi d'isoler les monocytes frais qui seront ajoutées avec les macrophages infectés.
- Isoler des monocytes du sang périphérique provenant de donneurs de sang en utilisant un establijeter protocole. Isoler les monocytes sur le même jour que la mise en place du modèle et de la culture de tissus et de les différencier en macrophages pendant environ 7 jours avant l'infection par M. la tuberculose.
- Préparation de M. macrophages infectés par la tuberculose
- Récolter les bactéries cultivées, laver avec 1x PBS contenant 0,05% de Tween-80, remettre en suspension dans DMEM complet sans antibiotique, passer à travers une aiguille stérile 27 G tronquée pour disperser touffes bactériennes et mesurer la densité optique.
Remarque: pré-déterminer le M. la tuberculose de formation de colonies équivalents unités de densité optique en laboratoire. Cela donnera une estimation du nombre de bactéries à être utilisé pour l'infection. - Incuber les macrophages pendant 4 heures avec M. la tuberculose à la multiplicité d'infection (MOI) 10). Après l'infection, se laver 3x avec PBS 1x pour éliminer les bactéries extracellulaires. Utilisez macrophages non infectées cultivées de la même manière mais sans M. la tuberculose, en tant que témoins.
- Détacher les macrophages de la plaque de culture par traitement avec de l'EDTA 2 mM pendant 10 min à 37 ° C et remis en suspension les cellules dans du milieu DMEM sans antibiotique complet.
- Récolter les bactéries cultivées, laver avec 1x PBS contenant 0,05% de Tween-80, remettre en suspension dans DMEM complet sans antibiotique, passer à travers une aiguille stérile 27 G tronquée pour disperser touffes bactériennes et mesurer la densité optique.
- Étiquetage des monocytes
Note: L'isolement et l'étiquetage des monocytes peuvent être effectuées dans la BSL-2 banc et ensuite pris en BSL-3 installation pour un traitement ultérieur.- Colorer les monocytes fraîchement préparés (2 x 10 7 cellules) avec une concentration finale de 2 uM de colorant rouge PKH26 pendant 5 min, selon les instructions du fabricant. Laver 3x et remettre les cellules avec sans antibiotique DMEM complet à une densité de 1 x 10 7 cellules / ml.
- Ajout de cellules immunitaires pour fibroblastes matrice de collagène
- UNprès avoir 5-7 jours de culture de la matrice de fibroblastes et le collagène, aspirer le milieu de culture à partir des chambres extérieure et intérieure et ajouter 1,5 ml de DMEM frais sans antibiotique complet de la chambre extérieure.
- Préparer un monocyte-macrophage marqué mélange (non infecté / infecté) avec un rapport de MO: MQ (5: 1) dans 50 ul de DMEM complet. Pour 50.000 macrophages, prendre 250.000 monocytes marqués.
- Ajouter 50 ul MO: mélange MQ à la matrice de collagène et des fibroblastes-incuber pendant 1 h à 5% de CO 2 à 37 ° C. Après incubation, ajouter délicatement 2 ml de milieux de culture dans l'insert et incuber pendant 24 heures un supplémentaire dans 5% de CO 2 à 37 ° C.
Remarque: Comme les cellules sont ajoutées lâchement liés, l'addition de médias doit être lente en ajoutant doucement sur les parois de l'insert.
5. Ensemencement des cellules épithéliales du poumon (16HBE)
Remarque: Les étapes suivantes doivent être effectuées dans une installation BSL-3.
- Seed poumon epithelial cellules (de 16HBE) sur le dessus du MO: MQ-fibroblastes collagène couche. Pour effectuer cela, 16HBE premier dissocier des cellules provenant du flacon par traitement avec de la trypsine (comme en 2.2.1.) Et remettre en suspension à 4 x 10 6 cellules / ml dans du DMEM sans antibiotique.
- Aspirer le milieu de culture à l'extérieur et à l'intérieur de l'insert. Puis ajouter 1,5 ml de DMEM sans antibiotique complet dans le fond du puits à l'extérieur de l'insert.
- Ajouter 50 ul de 16HBE au-dessus de la matrice de collagène de cellules fibroblastes immunitaire. Laisser agir pendant 2 min dans le capot et incuber pendant 1 heure à 37 ° C incubateur avec 5% de CO 2. Après incubation, ajouter doucement 2 ml de DMEM sans antibiotique complet à l'intérieur de l'insert et de la culture à 37 ° C pendant 3 jours. L'étape de culture facilite la prolifération des cellules épithéliales dans le modèle de tissu.
Remarque: Comme les cellules ajoutées sont mal fixés, outre des médias devrait être lente et douce en glissant à travers les parois de l'insert.
6. Air-exposition du poumon 3DModèle
Remarque: Après 5 jours plus de poste de macrophages infectés, les modèles de tissus sont exposées à l'air et les étapes suivantes doivent être effectuées dans une installation BSL-3.
- Aspirer le milieu de culture à l'extérieur et à l'intérieur de l'insert.
Remarque: Dans cette étape surnageants peuvent être collectées pour la détection des facteurs sécrétés. Centrifugeuse, stérile Filtrer et conserver les surnageants à -70 ° C. - Ajouter 1,8 ml de DMEM sans antibiotique complets dans la chambre extérieure et incuber à 5% de CO 2 à 37 ° C incubateur pendant 2 jours. Ne pas ajouter de milieux de culture au sein de l'insert.
NOTE: Air levage du modèle de tissu facilite la formation de l'épithélium stratifié et la sécrétion de mucus, ce qui fournit la force pour le tissu et ressemblance physiologique de tissu pulmonaire humain.
7. Récolte et montage du tissu modèle 3D du poumon
Remarque: Les étapes suivantes doivent être effectuées dans une installation BSL-3.
- Au jour 7 après l'implantation des macrophages infectés, les modèles de tissus sont prêtes pour la récolte. Retirer les milieux de culture entièrement à partir du modèle de tissu. Fixer le modèle de tissu avec du paraformaldéhyde 4% pendant 30 minutes dans l'obscurité à la température ambiante. Cette étape tue les bactéries et fixe la morphologie tissulaire / cellulaire pour un traitement ultérieur.
- Avec un scalpel, séparer la membrane de l'insert de puits. Transférer la membrane contenant le tissu à un puits contient 1x PBS.
- Couper et enlever les côtés du modèle de tissu à l'aide d'un scalpel propre. Puis couper le modèle de tissu en 4 morceaux carrés approximativement égales. Transfert d'un morceau de tissu sur une lame de verre superfrost. Stocker les morceaux de tissu en 1x PBS à 4 ° C.
- Sécher le tissu pendant 5 min et monter en utilisant ProLong Or antifade avec DAPI et lamelle. Laissez les diapositives sans déranger dans l'obscurité à la température ambiante jusqu'à ce que sec.
Remarque: L'épaisseur du tissu peut varier entre le centre et la périphérie, provoquant une légère tilting de la lamelle. Pour éviter cela, une entretoise (par exemple parafilm) peut être placé à l'angle de la lamelle. - Appliquer le vernis à ongles sur les bords de la lamelle et laisser sécher. Plonger les lames dans 70% d'éthanol pour assurer leur sécurité à faire sortir de l'installation BSL-3.
8. Visualisation, acquisition et l'analyse quantitative 3D
- Visualiser les lames de tissu à l'aide d'un système de microscope confocal à laser émettant à 488 nm pour l'excitation de la GFP (canal vert), 420 nm pour le DAPI (bleu) et 555 nm pour les monocytes marqués PKH26 (rouge), respectivement.
- Acquérir des images 3D à une résolution de 512x512 avec Z-piles recouvrant au moins une épaisseur de 20 um et ayant une - 1,5 um séparation entre les piles. Acquérir 5-10 champs différents couvrant l'ensemble du morceau de tissu.
Remarque: Utilisez la configuration telle que Nyqvist pour des réglages optimaux de résolution optique (longueur d'onde, puissance laser / exposition, le format de pixels et zoom). Évitez l'ONUder ou sur la saturation de pixels. - Analyser les images confocales avec le logiciel de traitement d'image 3D. Pour la quantification 3D d'amas cellulaires, les étapes suivantes sont recommandées pour l'analyse optimale.
- Ouvrez le logiciel de traitement d'image 3D et charger l'image. Mesurer les dimensions des objets à analyser dans l'image, par exemple, la taille d'un noyau, des monocytes et des bactéries individu unique. Ces observations sont utiles pour définir ou de filtrer les objets.
- L'utilisation d'un outil de réglage de l'affichage, d'optimiser le rendu de volume en ajustant chaque canal pour le contraste, la luminosité et mélanger opacité. Cette étape consiste à réduire au minimum l'interférence de bruit dans le rendu de volume.
Remarque: La correction gamma peut conduire à la manipulation des images et devrait donc être évité. - Créer des surfaces en choisissant le canal rouge (monocytes) et fixer le seuil (de sélection automatique ou manuelle). Si nécessaire, utiliser des filtres pour limiter la sélection des monocytes rouges ou d'exclure le background. De même, pour créer des surfaces vertes (M. tuberculosis) et bleu (noyaux) canaux comme décrit ci-dessus.
- Exporter les données dans des fichiers MS Excel. Il est possible d'exporter un paramètre particulier ou l'ensemble des données. Les paramètres qui sont pertinents pour l'analyse de l'agglomération de cellules sont le volume, l'intensité, nombre d'objets, nombre de voxels et la sphéricité.
- Enregistrer et exporter les images dans un format d'image convenable, de préférence TIFF.
REMARQUE: Animations peut également être faite en utilisant le menu de l'animation et enregistrée comme un fichier multimédia. - Enregistrer les paramètres d'analyse de chaque canal à l'aide de l'option Ajouter des paramètres et peuvent être récupérées plus tard en utilisant la fonction de reconstruction. Analyser simultanément plusieurs fichiers à l'aide de l'outil de traitement par lots.
Remarque: Toutes les images à comparer doivent être acquises, traitées et analysées de la même manière. Par exemple une image de 8 bits (256 entier) ne devrait pas être comparée avec une image 12 bits (4096 entier).
Résultats
Un modèle de tissu 3D pour la tuberculose pulmonaire humain peut être utilisé efficacement pour étudier les interactions hôte-pathogène dans M. l'infection de la tuberculose. Les étapes de base de cette méthode, les images microscopiques représentatives des différentes étapes et une structure microscopique d'ensemble d'une section de tissu sont présenté sur la figure 1. Le modèle comporte plusieurs éléments de tissu pulmonaire humain, y compris des fibroblastes de poumon, des cellules epitheliales bronchiques et les monocytes primaires / macrophages intégré dans l'environnement de tissu 3D. Outre l'incorporation des composants de tissu pulmonaire humain, le modèle ressemble à savoir stratification des conditions physiologiques de l'épithélium et la sécrétion de mucus.
Un exemple de l'utilisation du modèle de tissu pulmonaire dans la surveillance d'une infection par la tuberculose est présentée en figure 2. Pour visualiser l'M. la tuberculose migration cellulaire -immune et l'interaction, nous avons introduit des macrophages infectés par M. la tuberculose qui expriment la GFP(vert) avec les monocytes fraîchement isolés de PKH26 marqué (rouge) dans le modèle de tissu (bleu, DAPI colore les noyaux de). Au jour 7 plus de poste de M. tuberculose cellules infectées par au modèle de tissu, la microscopie confocale révèle regroupement des monocytes rouges sur le site de l'infection (vert) (Figure 2), qui imite les lésions de cachet de la tuberculose humaine 9.
Une série d'images représentatives pour la visualisation 3D de M. la tuberculose infectés par l modèle de tissu et la quantification des amas de cellules est représenté en figure 3. La visualisation 3D donne la flexibilité de l'utilisateur d'interagir, d'examiner et de quantifier plusieurs caractéristiques dans une image 3D. La disposition spatiale des bactéries vertes et rouges grappes de monocytes peut être vu à partir de la vue apicale, et de rotation latérale, comme illustré sur la figure 3B, ce qui révèle le regroupement des monocytes au niveau du site de M. la tuberculose. Les groupes ne sont pas observi dans les tissus non infectés (figure 3A). Nous avons quantifié la taille et le nombre de grappes de cellules monocytes et constaté que la taille (volume) des amas de cellules est améliorée (p <0,001), tandis que le nombre de monocytes individuelles a diminué (p <0,01) dans M. la tuberculose infecte les tissus par rapport aux modèles de tissus non infectés (figure 3C et 3D). Ces données valide notre constatation précédente de la formation de granulomes tôt M. l'infection tuberculeuse observée dans les modèles de tissu pulmonaire analysés dans des coupes de tissus 2D 9.
Nos données suggèrent que le modèle de tissus fournit un habitat 3D naturel pour enquêter sur l'hôte complexe Cell-M. Réseau de communication de la tuberculose. Nous avons également constaté que la visualisation 3D et l'analyse quantitative sont de meilleurs outils pour étudier les caractéristiques dans le modèle de tissu (Figure 3). Quantification d'un amas de cellules (granulome par exemple) souvent stretch hes à plusieurs couches de cellules et peuvent être complètement capturées par une analyse quantitative 3D. En outre, la visualisation des caractéristiques exactes spatiales et temporelles des cellules individuelles ou des bactéries dans le modèle permet études live-imagerie, de migration et de suivi dans un laboratoire désigné.
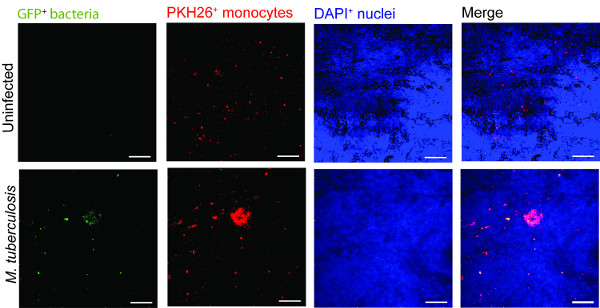
Figure 2. monocytes dans le groupe de modèle de tissu autour virulente M. la tuberculose. des images confocales représentatifs de non infecté et M. modèle de tissus infectés de tuberculose est présentée. Panneaux de couleur verte (GFP M. tuberculosis-), rouge (monocytes PKH26-marqué), DAPI (noyaux bleus colorés) et les canaux fusionnés montrent le recrutement des monocytes dans les tissus infectés par rapport aux tissus non infectés. Scale - 100 um.large.jpg "style =" font-size: 14px; line-height: 28px; "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
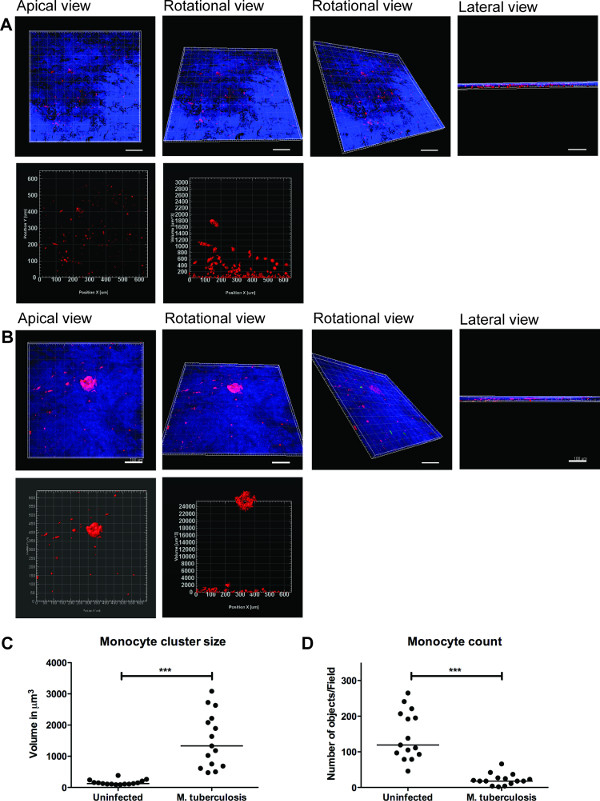
Figure 3. visualisation 3D et l'analyse quantitative d'un modèle de tissu fournissent des informations utiles. Représentatifs de visualisation des images 3D de l'ensemble du modèle de tissu (A) de tissu non infecté, (B) infectées par M. la tuberculose, par sectionnement optique utilisant Zeiss LSM700 microscope confocal et l'analyse quantitative par Imaris logiciel de traitement d'image (version 7.6.8). Ces images ont été acquises à un grossissement de 20x, 14 z-piles couvrant une épaisseur de tissu de 19,5 um à 1,5 um intervalle, permettant la visualisation de apicale, horizontal de rotation, vue verticale et latérale de rotation (A et B). (C) Catntitative analyse des amas de cellules monocytes révèlent améliorée (p <0,0001) taille des grappes début de granulome après M. l'infection tuberculeuse par rapport à l'absence d'infection. (D) de quantification de nombre de monocytes a montré un déclin (p <0,01) dans les tissus infectés par comparaison à un tissu non infecté, réitérant plusieurs grappes dans le tissu infecté. Vert - M. GFP de la tuberculose, Rouge - monocytes PKH26-étiquetés, Bleu - noyaux cellulaires, Scale -. 100 um S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
The ability to recruit and form organized cell clusters at the site of infection is the hallmark of human TB 11. These dynamic structures known as tubercle granulomas primarily consist of immune cells (macrophages, monocytes, T-cells and B-cells) and multi-nucleated giant cells surrounding M. tuberculosis. The role of the granuloma has long been considered to wall off the infection, preventing local spread of bacteria. However, more recent studies show that granuloma formation is critical for early bacterial survival, growth and dissemination 12. A strategy of new studies is to identify molecules or pathways that could efficiently be targeted to inhibit the cellular migration in granuloma formation and/or TB dissemination.
A caveat for novel studies on TB is the lack of models that recapitulate human TB. The most widely used experimental animals do not form true granuloma upon M. tuberculosis infection, and are therefore not appropriate choices for studies of TB 13-16. Non-human primates have the closest resemblance to human TB 17, but are not the preferred choice owing to high operational costs and ethical issues. Human TB is a complex immunological process and is difficult to model in vitro. Cell cultures of monolayers or co-cultures lack the 3D environment and tissue responses. Therefore, we have developed an innovative lung tissue model based on human primary immune cells and human lung-specific cell lines 8,9. The model displays characteristic features of human lung tissue, including epithelia with evenly integrated macrophages, formation of extracellular matrix, stratified epithelia and mucus secretion 9.
The 3D human lung tissue model has several benefits over the in vitro single or co-cultures seeded on tissue culture plates or transwell inserts. First, the human lung-specific cells (fibroblasts and epithelial cells) are not commonly included in the in vitro single or co-cultures. Second, the immune cells and lung-specific cells are embedded in a 3D physiological context (collagen rich extra-cellular matrix products). The response of cells to a stimulus/infection and the migratory behaviour of cells, for instance formation of a granuloma, differ significantly between a 2D and 3D environment. Furthermore, the described method enables the 3D visualization and robust 3D quantitative analysis that provides pivotal information on spatial distribution and intricate cellular interactions.
Experimental infection in the model tissue with M. tuberculosis resulted in clustering of macrophages at the site of infection, reminiscent of early TB granuloma (Figure 2 and 3). We have recently demonstrated that mutant strains defective in the ability to secrete the virulence factor ESAT-6 or Mycobacterium bovis BCG that lacks ESAT-6 did not induce the clustering of monocytes (no early granuloma), in contrast to the virulent M. tuberculosis 9. These data are consistent with the observations made from Mycobacterium marinum-infected zebrafish embryos, whose transparency allows for elegant live imaging of granuloma formation 12. As there is no gold-standard model for TB, we took advantage of the surgically resected tissue biopsies from TB patients for validation of the method 9. Our in vitro tissue model shares several characteristics with the lung and lymph node biopsies from TB patients, including the aggregation of macrophages in granuloma, the presence of both intra- and extracellular bacteria 18 and induction of necrosis 11.
Although the described model has physiological relevance to human TB and has several advantages over other in vitro models, it has some limitations. For instance, out of more than 20 collagen proteins identified in humans, only type I is included to the model to mimic the extra-cellular matrix. However, type I collagen is a complex mixture of extra-cellular matrix products and is the most abundant collagen in the human body. Further, we have demonstrated the presence of collagen IV and several extra-cellular matrix proteins such as tropoelastin, vimentin and laminin, which are produced by the epithelial cells and fibroblasts in the tissue model, indicating the synthesis of new collagen 8. Presently, the lung tissue model only has monocytes and macrophages, besides lung-specific cells. It lacks neutrophils and lymphocytes that are also known to be present in the granuloma. Remarkably the model is not limited to the introduction of additional immune cells and is of interest to explore how they contribute to the complex cellular interactions in human TB. Implantation of primary alveolar macrophages, skin-specific cells and lung carcinoma cells has already been tested in the model. Since our objective was to use a model that closely resembles human TB, introduction of mouse cells have not been attempted.
In summary, the lung tissue model has implications for both basic mechanistic and applied studies. Potential applications of the lung model include the study of innate immunity, investigating mechanistic aspects of host defences such as phagosomal maturation, autophagy, production of cytokines, chemokines and anti-microbial peptides, and functional characterization of individual cell types. Strikingly, the in vitro tissue model allows manipulation of one or more cells types and provides a relevant tissue micro-environment, not only for studies on TB, but for a variety of infectious and non-infectious diseases that affect the lungs.
Déclarations de divulgation
The authors declare no competing financial interests.
Remerciements
The authors acknowledge the Microscopy core facility at the Faculty of Health Sciences, Linköping University for providing access to advanced imaging systems; Karl-Eric Magnusson (Emeritus Scientist) at the Dept. of Clinical and Experimental Medicine, Linköping University for providing access to Imaris 3D/4D image processing software (Bitplane, Switzerland); and S. Braian for his help with the lung model cartoon. This work was supported by funds from the Swedish Research Council (Alternatives to animal research, 2012-1951) and Swedish Research Council (2012-3349) to M.L. and Swedish Foundation for Strategic Research to S.B. S.B. receive grants from the Karolinska Institutet, Swedish Research Council, the Swedish International Development Cooperation Agency (Sida) and the Swedish Civil Contingencies Agency (MSB), and the Swedish Heart and Lung Foundation (HLF). M.S. received grants from the Karolinska Institutet and Stockholm County Council.
matériels
| Name | Company | Catalog Number | Comments |
| Cell culture inserts | BD Falcon | 353092 | |
| 6-well culture plates | BD Falcon | 353046 | |
| MRC-5 cells, lung fibroblasts | ATCC#CCL-171 | ||
| 16HBE cells, lung epithelial cells | Gift from Dr. Dieter Gruenert, Mt. Zion Cancer Center, University of California, San Fransisco, USA | ||
| 5 x Dulbecco’s modified Eagle’s medium (5 x DMEM) | Gibco | 12800-082 | Made from powder but add 5 times less water. Adjust pH to 7.3 and filter it using a 0.2 µm filter. |
| Dulbecco’s modified Eagle’s medium with glucose (DMEM) 1x | Gibco | 41965-039 | |
| Minimum Essential Medium (MEM) 1x with Earle’s salts | Sigma | M4655 | |
| Non-Essential Amino Acids Solution, 100x | Life Technologies | 11140-035 | |
| L-glutamine 200 mM (100x) | Gibco | 25030-024 | |
| Sodium Pyruvate | Life Technologies | 11360-039 | |
| NaHCO3 (71.2 mg/ml) | Prepared in house | ||
| Heat inactivated Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Heat inactivated for 30 min, 56 °C |
| Gentamicin (50 mg/ml) | Gibco | 15750-060 | |
| Hepes buffer solution 1M | Gibco | 15630-056 | |
| Penicillin Streptomycin (Pen Strep) | Gibco | 15140-122 | |
| Lymphoprep | Axis-Shield | 7801 | |
| Ultrapure 0.5 M EDTA | Gibco | 15575 | |
| Bovine Collagen PA treated (500 ml) | Organogenesis | 200-055 | |
| Pure col purified Bovine Collagen solution (100 ml) | Advanced biomatrix | 5005-B | |
| Extracellular matrix protein, Fibronectin (1 mg) | BD | 354008 | |
| Primary human monocytes/macrophages | Isolated from human whole blood or buffy coats. | ||
| PKH26 Red fluorescent cell linker | Sigma | MINI26 | |
| Mycobacterium tuberculosis H37Rv expressing green fluorescent protein | M. tuberculosis H37Rv wild type was transformed with the pFPV2 plasmid constitutively expressing GFP. | ||
| Middlebrook 7H9 medium | Difco | 271310 | |
| BBL Middlebrook ADC Enrichment | BBL | 211887 | |
| Tween-80 | |||
| Glycerol | |||
| Kanamycin B sulfate (20 µg/ml) | Sigma | B5264 | |
| Prolong Gold anti=-fade reagent with DAPI | Invitrogen | P36935 | |
| Trypsin -EDTA | |||
| Bovine serum albumin | |||
| Paraformaldehyde | |||
| DAPI | |||
| LSM700 Confocal microscope | Zeiss | ||
| iMaris Scientific 3D/4D image processing software, version 7.6.8 | Bitplane AG |
Références
- Sakamoto, K. The pathology of Mycobacterium tuberculosis infection. Veterinary pathology. 49, 423-439 (2012).
- Saunders, B. M., Britton, W. J. Life and death in the granuloma: immunopathology of tuberculosis. Immunol Cell Biol. 85, 103-111 (2007).
- Kaufmann, S. H. New issues in tuberculosis. Ann Rheum Dis. Ann Rheum Dis. 63, ii50-ii56 (2004).
- Morrison, J., Pai, M., Hopewell, P. C. Tuberculosis and latent tuberculosis infection in close contacts of people with pulmonary tuberculosis in low-income and middle-income countries: a systematic review and meta-analysis. Lancet Infect Dis. 8, 359-368 (2008).
- Barry 3rd, C. E., et al. The spectrum of latent tuberculosis: rethinking the biology and intervention strategies. Nat Rev Microbiol. 7, 845-855 (2009).
- Puissegur, M. P., et al. An in vitro dual model of mycobacterial granulomas to investigate the molecular interactions between mycobacteria and human host cells. Cell Microbiol. 6, 423-433 (2004).
- Kapoor, N., et al. Human Granuloma In Vitro Model, for TB Dormancy and Resuscitation. PLoS One. 8, e53657 (2013).
- Nguyen Hoang, ., T, A., et al. Dendritic cell functional properties in a three-dimensional tissue model of human lung mucosa. Am J Physiol Lung Cell Mol Physiol. 302, L226-L237 (2012).
- Parasa, V. R., et al. Modeling Mycobacterium tuberculosis early granuloma formation in experimental human lung tissue. Dis Model Mech. 7, 281-288 (2014).
- Cozens, A. L., et al. CFTR expression and chloride secretion in polarized immortal human bronchial epithelial cells. Am J Respir Cell Mol Biol. 10, 38-47 (1994).
- Brighenti, S., Andersson, J. Local immune responses in human tuberculosis: learning from the site of infection. J Infect Dis. 205, S316-S324 (2012).
- Davis, J. M., Ramakrishnan, L. The role of the granuloma in expansion and dissemination of early tuberculous infection. Cell. 136, 37-49 (2009).
- Gupta, U. D., Katoch, V. M. Animal models of tuberculosis. Tuberculosis (Edinb). 85, 277-293 (2005).
- Kashino, S. S., Napolitano, D. R., Skobe, Z., Campos-Neto, A. Guinea pig model of Mycobacterium tuberculosis latent/dormant infection. Microbes Infect. 10, 1469-1476 (2008).
- Singhal, A., et al. Experimental tuberculosis in the Wistar rat: a model for protective immunity and control of infection. PLoS One. 6, e18632 (2011).
- Subbian, S., et al. Phosphodiesterase-4 inhibition alters gene expression and improves isoniazid-mediated clearance of Mycobacterium tuberculosis in rabbit lungs. PLoS Pathog. 7, e1002262 (2011).
- Lin, P. L., et al. Tumor necrosis factor neutralization results in disseminated disease in acute and latent Mycobacterium tuberculosis infection with normal granuloma structure in a cynomolgus macaque model. Arthritis Rheum. 62, 340-350 (2010).
- Rahman, S., et al. Compartmentalization of immune responses in human tuberculosis: few CD8+ effector T cells but elevated levels of FoxP3+ regulatory t cells in the granulomatous lesions. Am J Pathol. 174, 2211-2224 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon