Method Article
طرق لنقل المترجمة على وجه التحديد من الخلايا أو الحمض النووي في Postimplantation المبكر أجنة الفئران
In This Article
Summary
We demonstrate a method for grafting cultured cells into defined sites of early mouse embryos to determine their in vivo potential. We also introduce an optimized electroporation method that uses glass capillaries of known diameter, allowing the precise delivery of exogenous DNA into a few cells in the embryos.
Abstract
التلاعب وثقافة أجنة فئران في مراحلها المبكرة هي قوية إلى حد كبير غير المستغلة تكنولوجيا تعزيز قيمة هذا النظام النموذجي. على العكس من ذلك، فقد تم زراعة الخلايا تستخدم على نطاق واسع في دراسات البيولوجيا التطورية. ومع ذلك، فمن المهم تحديد ما إذا كان في المختبر الخلايا المستزرعة تمثل حقا في أنواع الخلايا الجسم الحي. تطعيم الخلايا في الأجنة، يعقبه تقييم مساهمتها خلال تطوير طريقة مفيدة لتحديد إمكانات في المختبر الخلايا المستزرعة. في هذه الدراسة، ونحن تصف طريقة لترقيع الخلايا إلى موقع محدد من أجنة الفئران postimplantation الأولى، تليها الثقافة فيفو السابقين. كما نقدم طريقة Electroporation للالأمثل يستخدم الشعيرات الدموية كوب من القطر المعروف، مما يسمح للتوطين الدقيق وتعديل عدد الخلايا المستقبلة الحمض النووي الخارجية مع كل من عالية الكفاءة ترنسفكأيشن وموت الخلايا منخفضة. هذه التقنيات، والتي لا تتطلب أي ليرة سوريةمعدات ecialized، وتجعل التلاعب التجريبية لتكون المعيدة وأوائل مرحلة توالد جنين الفأر ممكن، مما يسمح للتحليل الالتزام في القطعان خلايا مستنبتة وتأثير التلاعب الجيني في الموقع على تمايز الخلايا.
Introduction
تم زراعة الخلايا المستخدمة على نطاق واسع في دراسات البيولوجيا التطورية. الماوس الخلايا الجذعية الجنينية (المجالس الاقتصادية والاجتماعية) والخلايا الجذعية الأديم الظاهر (EpiSCs) يمكن أن تفرق في جميع الطبقات الجرثومية الثلاث في المختبر، وتمثل نموذجا مفيدا للتمايز الخلايا في أوائل مرحلة التطور الجنيني الثدييات. وقد فتحت اشتقاق هذه خطوط الخلايا يصل فرصة للفي المختبر التلاعب وتحقيق مفصل للالمترجمة يشير الأحداث وشبكات النسخي تعمل في وقت مبكر خلال الزخرفة الجنينية. ومع ذلك، فإنه لا يزال من المهم تحديد أهميتها في الجسم الحي من أي تلاعب يؤديها في مجال الثقافة. وقد تم تقييم الإمكانيات في الجسم الحي من قبل الغرس المستمدة الجنين المجالس الاقتصادية والاجتماعية الماوس عن طريق تعريفهم مرة أخرى إلى سابق للانغراس الأجنة (morulae أو الكيسات الأريمية) 1. ومع ذلك، يمكن EpiSCs التي تمثل خلايا الأديم الظاهر في الأجنة postimplantation لا تدمج بكفاءة في الأجنة سابق للانغراس 2،3. لدينا previoلنا النتائج أظهرت أن EpiSCs يمكن أن تولد بكفاءة الوهم والمساهمة في كل طبقات جرثومية، وعندما المطعمة إلى الأجنة postimplantation 4. وبالتالي، فإن أفضل طريقة لتقييم الخلايا المستزرعة في المختبر هي لتعريفهم بالبيئة يناظرها في الجسم الحي.
Electroporation للهو الطريقة المستخدمة على نطاق واسع لتقديم جزيئات الخارجية في الخلايا المستهدفة في كل المجراة في التجارب المختبرية. الطاقة الكهربائية يمكن أن يولد عدد كبير من المسام في غشاء الخلية، والذي يسمح حمض النووي الريبي منقوص الأكسجين خارجي (DNA) الحمض النووي الريبي أو (RNA) من دخول الخلايا. واحدة من أكبر التحديات التي تواجه هذا الأسلوب هو الجمع بين بقاء الخلية الأمثل مع electrotransfection عالية الكفاءة 5،6. ل electroporation من الأحماض النووية في الأنسجة الجنينية، والأكثر شيوعا استخدمت أقطاب مطلية بالذهب، مما يسمح استهداف الخلايا في نطاق المكاني الواسع 7-9. لتحقيق المزيد من المحلىنقل الجينات lized، وقد استخدمت القطب على شكل إبرة لتحقيق الحقل الكهربائي البؤري 10،11. باستخدام هذه الطريقة، أظهرت الكتاب أنه بعد Electroporation لل، حوالي 30-60 الخلايا قد اتخذت حتى DNA بناء 11. ومع ذلك، يبدو أن ضبط بدقة عدد الخلايا electroporated يزال من الصعب مع القطب ذو عرض ثابت. وقد استخدمت هذه التقنية Electroporation للالشعرية لتقديم البلازميدات إلى الخلايا واحدة 12-14. ومع ذلك، لم يتم تطبيق هذه التقنية لelectroporating البلازميدات إلى الأجنة خارج الجسم الحي. وفي الآونة الأخيرة، تم الإبلاغ عن microdevice لمحليا electroporate عدد قليل من الخلايا البعيدة الحشوية الأديم الباطن (أقل من 4 خلايا) في postimplantation مبكرة أجنة الفئران 15. ومع ذلك، فإنه لا يزال غير معروف ما إذا كان هذا الجهاز يمكن أن تستهدف بكفاءة الأديم الظاهر والأديم المتوسط خارج الحي.
في هذه الدراسة وصفنا طريقتين جديدة لتقييم وظيفة الخلوية والجينات في آخر في وقت مبكر-implantation الأجنة. علينا أن نبرهن أولا كيفية الكسب غير المشروع في المختبر الخلايا المستزرعة في مواقع محددة في أجنة الفئران في وقت مبكر لتقييم قدراتهم في الجسم الحي. دمج الخلايا المطعمة وأحفادهم، كل وصفت من قبل العلامة الوراثية (على سبيل المثال، وهو البروتين الفلوري الأخضر (GFP)، يمكن فحص مزيدا من المناعية بروتينات معينة الأنسجة 4. ثانيا، نحن تصف طريقة محسنة لتقديم بالضبط DNA لمواقع محلية في جنين عبر Electroporation لل. وبدلا من استخدام القطب على شكل إبرة، ونحن إدخال سلك رفيع داخل غرامة ذات الرؤوس الزجاج الشعرية، وإثبات أن هذا التعديل يمكن أن يحقق الحمض النووي لعدد صغير من الخلايا مع كفاءة عالية ومحدودة خلية الموت. وعلاوة على ذلك، وتبين لنا أنه باستخدام الشعيرات الدموية الزجاج بأحجام مختلفة الافتتاح، نتمكن من السيطرة على عدد الخلايا electroporated. ولذلك، فإننا نعتقد أن هذا الأسلوب يمكن أن تكون ذات فائدة كبيرة لدراسة مبكرة الزخرفة الجنينية التي تضم عدد قليل سخلايا F.
Protocol
وأجريت التجارب على الحيوانات فقط وفقا UK الرئيسية للمكتب على النحو المحدد في الحيوانات (إجراءات علمية) لعام (1986) تحت رخصة المشروع رقم 60/4435. لجمع الأجنة في مراحل نمو محددة، وضعت التزاوج توقيتها حتى O / N. تم تعيين ظهر اليوم من العثور على المكونات المهبلية اليوم الجنينية (E) 0.5.
1. تشريح E7.5 أو E8.5 Postimplantation الأجنة لفيفو السابقين الثقافة
- التضحية إناث الفئران الحوامل خلع عنق الرحم.
- عزل الرحم باستخدام مقص، وعقد مع ملقط، ووضع في صحن 30 ملم مليئة M2 المتوسطة.
- المسيل للدموع بعناية بعيدا عضل الرحم باستخدام اثنين من أزواج من ملقط غرامة.
- قشر بعيدا الساقط، والحرص على عدم ثقب تجاويف خارج الجنين.
- إزالة غشاء رايخرت عن طريق معسر مع ملقط وببطء يفصلها عن الجنين.
- تحقق الأجنة تحت تشريحstereomicroscope لضمان أن الكيس المحي، السلى ومخروط المشيمة الظاهر وسليمة.
- نقل الأجنة إلى صحن نظيف من M2 باستخدام ماصة ومكان على 30 مم البلاستيك طبق بيتري غطاء على الجليد (في 'منصة الجليد') إلى الأجنة البرد جزئيا.
- إذا لزم الأمر، الأجنة مخزن في M2 على منصة الجليد لمدة تصل إلى 1.5 ساعة، على سبيل المثال، أثناء إعداد وسائل الإعلام أو التلاعب في دفعات صغيرة من ~ 3-4 أجنة في RT.
ملاحظة: انتعاش وصفت تشريح الأجنة القوارض بالتفصيل سابقا 7،8،16.
2. إعداد الأجنة الثقافة المتوسطة
- ذوبان الجليد الطازج إما مصل الفئران المتاحة تجاريا (انظر جلانفيل جونز وآخرون. (13) لمواصفات)، أو مصل الفئران أعد في المنزل، وفقا لنفقات المنتجين حسب الغرض وكوكروفت 16 التي كانت المعطل الحرارة لمدة 30 دقيقة في 56 ج والمجمدة في 1 مل aliquots في -80 ج
ملاحظة: مصل الفئران المتاحة تجاريا هو مقبول لفترات ثقافة 24-36 ساعة، على الرغم من المصل أعد في المنزل، في تجربتنا، متفوقة لفترات ثقافة تصل إلى 48 ساعة. - طازجة إعداد وجود فائض (على سبيل المثال، 10 مل) من المكملات محددة تتألف من غلاسكو الأساسية الدنيا والمتوسطة (GMEM) والأحماض الأمينية 1٪ غير الضرورية (NEAA)، 2 مم L-الجلوتامين و 1 ملي البيروفات الصوديوم.
- حساب حجم مستنبت ما هو مطلوب وفقا لعدد من الأجنة من كل المرحلة التي هي على وشك أن مثقف (انظر القسم 3). مزج مصل الفئران مع ملاحق محددة لتعويض 50٪ مستنبت (1: 1 (ت / ت) مصل الفئران: المكملات محددة) و / أو 75٪ مستنبت (3: 1 (ت / ت) مصل الفئران: تعريف المكملات الغذائية).
- تمرير مستنبت الجنين من خلال 0.45 ميكرون تصفية وإضافة 10،000 وحدة دولية / مل البنسلين و 10 ميكروغرام / مل الستربتومايسين.
ملاحظة: إذابة طازجة L-الجلوتامين والبيروفات الصوديوم الحل الحاسم لتطور الجنين خلال الثقافة فيفو السابقين.
- لأجنة E7.5: ثقافة ثابتة باستخدام لوحات 4-جيدا في حاضنة المرفق مع 5٪ CO 2 في الهواء عند 37 مئوية لمدة 24 ساعة. ثقافة ما يصل الى اثنين الأجنة لكل بئر في 1 مل من 50٪ مستنبت.
- لE8.5 الأجنة: استخدام الثقافة الجهاز بكرة 8 الدورية في 35 الدورات / دقيقة دمج بالغاز المستمر مع 5٪ CO 2 في الهواء عند 37 مئوية لمدة 24 ساعة (1 مل 50٪ مستنبت في الجنين).
- لأجنة E9.5: استخدام جهاز الثقافة الأسطوانة الدوارة في 35 الدورات / دقيقة تتضمن الغازات المتوفرة مع 5٪ CO 2، 40٪ O 2 55٪ N 2 عند 37 مئوية لمدة 24 ساعة (1 مل 75٪ مستنبت في جنين).
ملاحظة: الأجنة الثقافة ضمن 3 ساعات بعد القتل الرحيم الفئران كما فترات طويلة في M2 تؤثر سلبا على التنمية. رؤية نفقات المنتجين حسب الغرض وكوكروفت 16 للاطلاع على طريقة فيفو السابقين الثقافة الجنين.
4. Graftinز الخلايا المستزرعة في E7.5 E8.5 أو أجنة الفئران
- كشط جسديا EpiSCs، التي تعبر عن بتواجد مطلق GFP، من لوحة الثقافة 6-جيدا باستخدام ماصة 20-200 ميكرولتر ووضعها في صحن 30 ملم تحتوي على الأجنة
ملاحظة: لإدراج كتل الخلايا في الأجنة والخلايا ينبغي حلها جسديا بدلا من trypsinized. - إرفاق تطعيم الشعرية سحبت يد لأنبوب الشافطة لجعل ماصة الفم.
- تمتص بلطف ماصة الفم لرسم واحد أو أكثر من كتل الخلايا من حجم> 20 الخلايا في الشعرية التطعيم.
- ضربة برفق خارج الخلايا، لتفريق جزئيا كتل كبيرة.
- اختر واحدا أجمة الخلية التي تحتوي ~ 10-20 الخلايا وتمتص في الشعرية التطعيم مرة أخرى، والحفاظ عليها على مقربة من افتتاح الشعرية. يجب الحرص على عدم تحريك أجمة خلية داخل وخارج الشعرية مرارا وتكرارا، لتجنب تفكك إلى أجزاء أصغر.
- عقد الجنين فضفاضة في مكان مع زوج من ملقط وإدراج تطعيمالشعرية في المنطقة التي تهم خلق الافتتاح.
- طرد بلطف أجمة من الشعرية تطعيم، وترك سلسلة قصيرة من 10-20 الخلايا استقرت في الجنين.
- كرر الإجراء تطعيم للالعدد المرغوب فيه من الأجنة. استخدام أحجام دفعة من 3-4 أجنة للراحة.
- ترك الأجنة في نفس طبق من M2 المتوسطة، صورة الأجنة المطعمة باستخدام مركب مضان تشريح المجهر مع الكاميرا، وحفظ وقت التصوير إلى أدنى حد ممكن لتجنب تعرض الأجنة للضوء والحرارة المفرطة.
ملاحظة: تحديد الأوقات التصوير تجريبيا وهذه سوف تعتمد على مواصفات الكاميرا والمجهر، وكذلك طبيعة ومضان شدة fluorophore. - نقل الأجنة في pastette مع حجم الحد الأدنى من M2 المتوسطة إلى معايرتها مسبقا مستنبت (انظر القسم 3) مباشرة بعد التصوير.
ملاحظة: التأني في دراسة مورفولوجية الأجنة بعد التطعيم. الوحيدة ثقافة intacر الأجنة.
5. اليدوية المواد Electroporation للوإعداد جهاز (إعداد وعقب مقدما من التجارب Electroporation لل):
- لماصات حقن الحمض النووي: سحب ماصات حقن الحمض النووي باستخدام micropipette مجتذب الأفقي. يجب أن يكون ماصات حقن تلميح على ما يرام مع افتتاح أقل من 10 ميكرون لتجنب تلف الأنسجة عند حقن الحمض النووي في تجاويف الجنينية.
- للزجاج الشعرية Electroporation لل: استخدام microforge لخفض افتتاح ماصات حقن الحمض النووي ليبلغ قطرها الداخلي 20 أو 30 ميكرون. لتجنب تلف الخلايا عندما الشعرية في اتصال مع الجنين ل electroporation، يجب قطع غيض من الزجاج الشعرية نظيفة وليس احتواء حادة، وحواف مكسورة.
- لقطب كهربائي الشعرية اليدوية (الأنود) (الشكل 1): إدراج 0.2 مم سلك البلاتين إلى الزجاج الشعرية Electroporation للمع افتتاح ثابت من 20 أو 30 ميكرون قطر لتركيز المنتخبريك الحالية وتسليم DNA البلازميد إلى منطقة صغيرة من الفائدة في الجنين.
- لالمصنوعة يدويا على شكل L القطب (الكاثود) (الشكل 1): ثني 0.2 ملم قطر السلك البلاتين خلق "L" شكل، مع الجزء الأفقي من "L" حوالي 1 ملم في الطول.
- نعلق كل قطب البلاتين إلى سلك معزول رقيقة وأدخله حامل microinjection الإبرة بواسطة شريط العزل تغطيتها.
- تحميل أصحاب الإبرة على أصحاب الصك المجهرية القياسية.
- ربط الدائرة كما هو موضح في الشكل رقم 1: ربط الكهربائي الشعرية إلى القطب الموجب من التيار الكهربائي. ربط الكهربائي على شكل L إلى القطب الموجب من متعدد. توصيل السالب للmulimeter إلى الكاثود من امدادات الطاقة.
6. Electroporation للE7.5 E8.5 أو أجنة الفئران
- ملء الزجاج الشعرية Electroporation للمع برنامج تلفزيوني لفي غضون 1-2 ملم من أعلى وإدراج الاجهادGHT الكهربائي البلاتين (الأنود) في الزجاج الشعرية حتى تصل إلى الجزء السفلي من الشعيرات الدموية.
- مرساة القطب على شكل L (الكاثود) على سطح طبق بتري 30 ملم مليئة برنامج تلفزيوني.
- نقل الجنين من M2 المتوسطة في طبق Electroporation للPBS مملوءة.
- إدراج إبرة الحقن من الأديم الظاهر الجانبي في التجويف الذي يحيط بالجنين من الجنين. باستخدام مضخة هوائية بيكو، حقن محلول الحمض النووي (pCAG-لجنة المساواة العرقية: GFP أو pCAG-GFP 1-1.5 ميكروغرام / مل مع 0.01٪ المواد الغذائية الخضراء التلوين صبغة) في تجويف حتى يكون كامل تماما. لأجنة E7.5-E8.5، مطلوب حل DNA أقل من 5 ميكرولتر لجنين واحد. باستخدام الصبغة الخضراء كمؤشر، يجب الحرص على عدم انفجار الجنين.
- وضع بعناية الجنين بين الأقطاب ونقل القطب الشعرية إلى الموقع الدقيق حيث DNA ليتم تسليمها.
ملاحظة: توجه الجنين يعتمد على المنطقة حيث DNA هو أن electroporated. - Electropoمعدل الجنين باستخدام 200 فولت (V) في 6 البقول، كل 50 مللي ثانية مدتها مع فاصل زمني 1 ثانية بين كل نبضة.
- نقل الجنين إلى ما قبل معايرتها مستنبت مباشرة بعد Electroporation لل. إذا رغبت في ذلك، كرر العملية للجنين المقبل.
ملاحظة: إضافة مستنبت في وعاء معقم ووضعه في الحاضنة الثقافة إلى ما قبل تتوازن المتوسط. - للكشف عن خلايا electroporated 2 ساعة بعد الثقافة، ونقل الأجنة إلى 30 مم طبق بتري نظيف من M2 المتوسطة باستخدام pastette. صورة الأجنة كما في الخطوة 5.9 باستخدام مركب مضان تشريح المجهر.
- نقل الأجنة إلى الثقافة باستخدام pastette مباشرة بعد التصوير.
- للكشف عن الخلايا الميتة تسبب بواسطة الصعق الكهربائي، وصمة عار على الأجنة مع خلية غشاء كتيمة الصبغة الحمراء بعيدة النووي (1: 200 في الجنين مستنبت) في 37 مئوية لمدة 10 دقيقة 2 ساعة بعد Electroporation لل(اختياري)
- عد خلايا electroporated، وتحديد امبريالسراج في 4٪ بارافورمالدهيد (PFA) لمدة 2-4 ساعة على 4 ج، وصمة عار النواة مع الأشعة فوق البنفسجية أو تحت الحمراء بعيدة مباين النووية الفلورسنت وصورة أجنة باستخدام مجهر متحد البؤر (اختياري).
ملاحظة: يتأثر نمو الأجنة سلبا إذا ما تركت لفترة طويلة جدا في برنامج تلفزيوني. لذلك، تأكد من أن الوقت الذي يستغرقه لelectroporate كل جنين إلى أدنى حد ممكن (<5 دقائق في الجنين).
النتائج
تطعيم النبات
EpiSCs التي تعبر عن بتواجد مطلق EGFP (R04-GFP، والمستمدة من E6.5 الأديم الظاهر، وC2، مستمدة في المختبر من mESCs) 4 تم كشط يدويا من الطبق الثقافة والمطعمة في مواقع مختلفة من الأجنة E7.5 (الشكل 2A). كان المثقف الأجنة خارج الجسم الحي وتحليلها بعد 24 ساعة. تم تقييم توزيع الخلايا المانحة بواسطة المجهر مضان. إذا أدرجت الخلايا المانحة، وأنها انتشرت ومشتقاتها فرقت داخل الأجنة المضيفة (الشكل 2B). وقد لوحظ أن الطعوم التي تحتوي على 10-16 الخلايا أدرجت بكفاءة في الأجنة المضيفة (الشكل 2A، 2B و)، ومع ذلك، تطعيم أكثر من الخلايا لا يؤدي إلى أفضل chimaerism. بدلا من ذلك، أنتجت خلايا المطعمة كتل الفردية (الشكل 2C و 2D).
Electroporation لل
لssess كفاءة نظام Electroporation لللدينا، ونحن تسليم، معربا عن GFP البلازميدات (pCAG-GFP وpCAG-لجنة المساواة العرقية: GFP) إلى مواقع محددة في الجنين. وتمشيا مع دراسة سابقة 11، تم الكشف عن خلايا GFP + في الأجنة 1-2 ساعة بعد Electroporation لل(الشكل 2E و2G). عندما تم electroporated خلايا الأديم الظاهر البعيدة في أواخر مرحلة بدائية خط الجنين، أسهمت الخلايا المسمى إلى الأديم الظاهر العصبي بعد 24 ساعة في الثقافة (الشكل 2E و2F). هذه النتيجة تتطابق تماما لخرائط مصير معروفة من خلايا الأديم الظاهر في تكون المعيدة مرحلة الأجنة 17. وبالمثل، عندما تم electroporated البلازميد GFP التعبير في خط البدائي في E8.5 (2-5 القطع البدنية النمطية)، GFP + الخلايا ساهمت في الأديم المتوسط المجاور للمحور (الشكل 2G و 2H)، بما يتفق مع خرائط مصير المعروفة المغفور له خط بدائي 18 . وعلاوة على ذلك، لاحظنا مساهمة إلى كل الطبقات الجرثومية الثلاث من خلايا electroporated (الشكل 2I-K)،مما يشير إلى أن هذا الإجراء Electroporation لللا يضر سلوك الخلية في الجسم الحي. ومع ذلك، لاحظنا أيضا أنه بينما الأديم الظاهر (E7.5) أو خلايا متتالية البدائية (E8.5) استهدفت، تم electroporated بعض خلايا الأديم أيضا (الشكل 3C والجدول 1).
واحدة من المزايا الرئيسية لاستخدام نظام الكهربائي الشعري هو أن عدد الخلايا electroporated يمكن السيطرة، وذلك ببساطة عن طريق تغيير قطر من افتتاحه. لتحديد عدد الخلايا electroporated، والأجنة ثابتة 2 ساعة بعد Electroporation للوتصوير في wholemount على المجهر متحد البؤر. وقد أحصى عدد الخلايا GFP + يدويا في مبائر ض المداخن. ويبين الجدول 1، بالنسبة للمرحلة معينة، وزيادة حجم افتتاح الزجاج الشعرية 20-30 ميكرومتر النتائج في امتصاص الحمض النووي عن طريق المزيد من الخلايا. عندما تم مقارنة حجم فتحة واحدة بين المراحل (E7.5 مقابل E8.5)، تم العثور على أكثر من الخلايا إلى أن electroporated في المرحلة الأخيرة. قد يكون راجعا إلى تركيز أعلى من الحاضر DNA في التجويف الذي يحيط بالجنين في E8.5 هذا التأثير. لأنه تم خلط محلول الحمض النووي مع صبغة الطعام الخضراء، يمكننا استخدام اللون الأخضر لتقييم تركيز الحمض النووي في التجويف الذي يحيط بالجنين. في المجهر، فمن الواضح أن، بالمقارنة مع الأجنة E8.5، واللون الأخضر بعد حقن الحمض النووي هو أخف بكثير في تجويف الأجنة E7.5. وعلى الرغم من حقن نفسه تركيز محلول الحمض النووي في E7.5 E8.5 والأجنة، كان أكثر محلول الحمض النووي في التجويف الذي يحيط بالجنين من الأجنة E8.5 من أجل ملئه تماما لأنها أكبر في الحجم. بعد سحب إبرة الحقن، هناك دائما درجة من تسرب محلول الحمض النووي من تجويف الذي يحيط بالجنين، ومنذ ثقب ثقب أكبر بالمقارنة مع حجم التجويف الذي يحيط بالجنين في الأجنة السابقة، فمن المرجح أن هناك متناسب المزيد من التسرب من E7.5 من الأجنة E8.5، مما يؤدي إلى تركيز الحمض النووي أقل. عدد مختلف من transfectedيمكن أن تكون خلايا أيضا يرجع إلى أقطار مختلفة أو الناجم عن الجهد عبر الغشاء (ITV) عتبات الخلايا في مراحل مختلفة.
ومن عيوب Electroporation للهو موت الخلايا المرتبطة بها. وعلى غرار الذهب مطلي التقليدي أو الأقطاب الكهربائية على شكل إبرة، Electroporation للاستخدام القطب الشعرية يسبب أيضا موت الخلية. بعد Electroporation للبدت المنطقة المستهدفة أكثر قتامة في اللون بالمقارنة مع المناطق المجاورة (3A الشكل و3B)، مشيرا إلى أن درجة معينة من موت الخلايا يجب أن يكون حدث في هذا المجال. لمزيد من تحديد عدد من الخلايا الميتة التي تسببها الإجراء Electroporation لل، كانت ملطخة الأجنة مع خلية غشاء كتيمة صبغة الفلورسنت النووي. وصفت نوى الخلايا الميتة مع بعيدة الحمراء صبغ مضان غشاء كتيم. أكد تلطيخ أن هذه التقنية Electroporation للالشعرية النتائج إلا في عدد قليل من الخلايا الميتة بالقرب من موقع Electroporation لل(الشكل 3D وتابلي 1).
لاحظنا أنه على الرغم من الخلايا الميتة تظهر في موقع Electroporation لل، GFP + الخلايا والخلايا الميتة هي أيضا الأكثر تميزا من كل منهما (الشكل 3E و3F). وعلاوة على ذلك، عندما تم electroporated في الأديم الظاهر الجانبي الذيلية في E8.5 مع pCAG-GFP وفتح الزجاج الشعرية من 20μm، وعدد كبير من الخلايا GFP + تم الكشف بعد 48 ساعة في الثقافة (الشكل الجيل الثالث 3G و3H). معا، وهذه النتائج تشير معظم GFP + الخلايا المكتشفة 2 ساعة بعد Electroporation لللا تزال قابلة للحياة خلال ثقافة أخرى.
سجلنا عدد GFP + الخلايا بعد 24 ساعة فيفو السابقين الثقافة. تم electroporated ستة أجنة مع pCAG-GFP في E7.5، وذلك باستخدام افتتاح الشعرية بقطر 20μm. 107 ± 31 (يعني ± SD) تم الكشف عن GFP + خلية / جنين. منذ في بداية ثقافة (2 ساعة)، تم electroporated 9 خلايا في المتوسط في الجنين ( ترونج> الجدول 1)، وهذا يشير إلى أن الخلايا electroporated خضعت 3-4 الانقسامات داخل 2 ساعة. متوسط الخلية مضاعفة الوقت من E7.5 إلى الأجنة E8.5 حوالي 6-7 ساعة في جميع الخلايا وبصرف النظر عن تلك الموجودة في العقدة بطني 19،20. وهذا يشير إلى أن هذا الإجراء Electroporation لللا يعيق نمو الخلايا العادية.
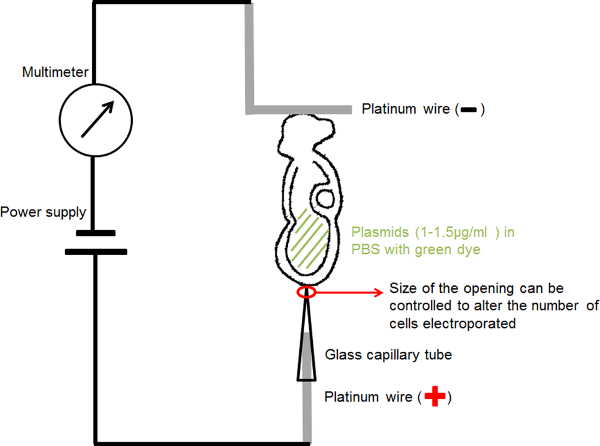
الشكل 1. الدائرة رسم بياني يظهر الإعداد Electroporation للتم وضع الحل DNA الجنين تحتوي في تجويف لها السلوي بين القطبين. التيار في اختيار المعلمات تم توفيرها من قبل مولد نبض موجة مربع (التيار الكهربائي). تم توصيل المتعدد في سلسلة للكشف عن التيار الكهربائي يمر الجنين. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
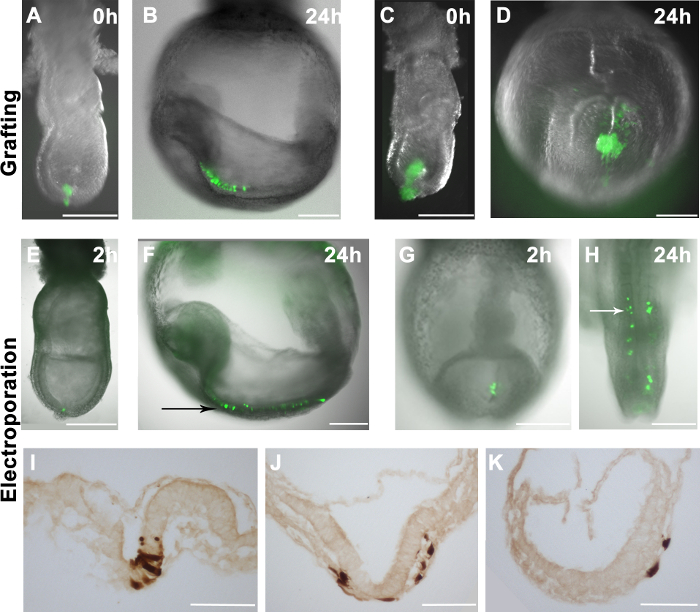
الشكل 2. توزيع الخلايا المطعمة أو electroporated في الأجنة المضيفة. (AH) تراكب GFP مضان (الأخضر) على الصور brightfield الأجنة wholemount (الرمادي) (A) والمطعمة 10-16 GFP + EpiSCs في المنطقة البعيدة في وقت متأخر والمطعمة -streak مرحلة الجنين. (C) A أجمة أكبر من GFP + EpiSCs في المنطقة البعيدة من جنين مرحلة منتصف متتالية. (B و D) توزيع EpiSCs الخلايا المشتقة (الأخضر) في الأجنة المضيفة (كما هو موضح في وأسفرت وC) بعد 24 ساعة في الثقافة. (B) GFP + الخلايا المتفرقة في الجنين المضيف، مما يدل على التكامل الصحيح من الخلايا المانحة. (D) تطعيم أكبر كتل الخلايا في تشكيل أجمة غير مدمج في الجنين المضيف. (EK) pCAG-لجنة المساواة العرقية: GFP البلازميد ايلى ctroporated في مجالات محددة من الأجنة wildtype. Electroporating المنطقة البعيدة من مرحلة الجنين برعم المبكر (E) أو خط بدائي من 2-5 الجسيدة مرحلة الجنين (G) أسفرت عن GFP + الخلايا في هذه المناطق 2 ساعة بعد العملية. (F و H) توزيع GFP + الخلايا في الأجنة المضيف بعد 24 ساعة في الثقافة، والتي تبين أن الخلايا electroporated تساهم في الأديم الظاهر العصبي (السهم الأسود) (F) والأديم المتوسط المجاور للمحور (السهم الأبيض) (H). (IK) DAB المناعية للGFP + الخلايا تبين أن الخلايا electroporated يمكن أن تؤدي إلى الأديم الظاهر العصبي (I)، الأديم المتوسط (J) والأديم الباطن (J و K) بعد 24 ساعة في الثقافة. شريط النطاق (AH) = 250 ميكرون. شريط النطاق (IK) = 100 ميكرون. ملاحظة: يتم طبع 1A الشكل و1B من وجهة نظرنا نشر السابق 4.أ href = "https://www.jove.com/files/ftp_upload/53295/53295fig2large.jpg" الهدف = "_ فارغة"> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
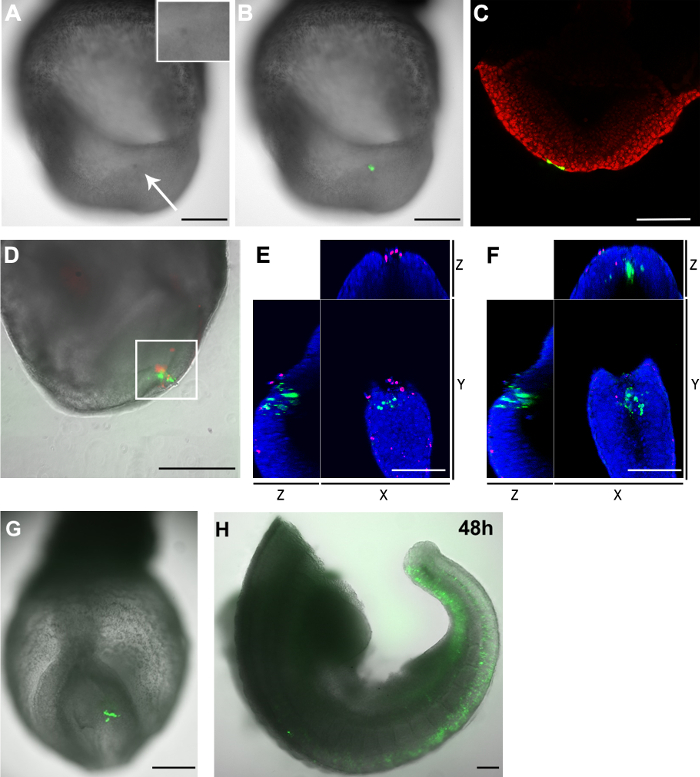
الشكل 3. توزيع GFP + الخلايا والخلايا الميتة في الأجنة بعد Electroporation لل(AC) pCAG-لجنة المساواة العرقية: GFP البلازميد electroporated إلى خلايا الأديم الظاهر الجانبية الذيلية من E8.5 (2-5 مرحلة الجسيدة) الجنين (الشعرية حجم الافتتاح : 20 ميكرون) (A) 2 ساعة بعد العملية، أظهرت المنطقة المستهدفة داكنة اللون (أبيض السهم) بالمقارنة مع أجزاء أخرى من الجنين. يظهر أقحم لتوسيع المنطقة electroporated. (B) صورة Brightfield (الرمادي) مضافين مع قناة الفلورية الخضراء تظهر الخلايا electroporated (الأخضر). (C) A متحد البؤر Z-شريحة تبين أناستغرق خليتين الأديم الباطن (الأخضر) أيضا البلازميد عندما تم استهداف خلايا الأديم الظاهر الجانبية الذيلية. وتظهر نواة الخلية باللون الأحمر (DF) pCAG-لجنة المساواة العرقية: تم electroporated البلازميد GFP في الجانب الذيلية للعقدة من جنين E8.5 (الشعرية حجم الافتتاح: 30 ميكرون). تم تربيتها الجنين لمدة 2 ساعة. وتظهر الخلايا Electroporated في الخلايا الخضراء والميتة باللون الأحمر. (D) وتحتوي المنطقة على حد سواء electroporated GFP + الخلايا وكذلك الخلايا الميتة. تم تحليل المجال في مربع أبيض أيضا في المجهر متحد البؤر. أظهر العد والفرز اليدوي لض المكدس أن هناك 33 GFP + الخلايا و23 الخلايا الميتة في هذا المجال. وكانت خليتين فقط إيجابية لكلا fluorophores. (E و F) عرض XYZ من مبائر Z-شريحة من منطقة محاصر البيضاء في D تظهر الخلايا GFP + منفصلة من الخلايا الميتة. وتظهر نوى في الزرقاء (G و H) pCAG-لجنة المساواة العرقية: تم electroporated GFP البلازميد في عدد قليل من سلليرة سورية في الأديم الظاهر الجانبي الذيلية للجنين E8.5 (الشعرية حجم الافتتاح: 20 ميكرون)، وتصويرها بعد يومين (G) و 48 (H) ساعة فيفو السابقين الثقافة ملاحظة: قطعت (H) الجنين في اثنين بعد الثقافة. تم إزالة مناطق الرأس والقلب. شريط النطاق (A، B، D، G و H) = 250 ميكرون. شريط النطاق (C، E و F) = 100 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| قطر افتتاح أنبوب شعري | مرحلة الجنين | كفاءة Electroporation لل: لا. أجنة تحتوي على GFP + الخلايا بعد 2H / مجموع لا. أجنة electroporated (رقم GFP + الأجنة التي وضعت بشكل طبيعي بعد 24 أو ثقافة 48H) | متوسط عدد GFP + الخلايا في الجنين ± SD (ن = عدد الأجنة فحص) | عددGFP + الأديم الباطن الخلايا في كل جنين ± SD (ن = عدد الأجنة فحص) |
| 20μm | E7.5 (LS-LB) | 7/9 (7) | 9 ± 3 (ن = 4) | 4 ± 2 (ن = 4) |
| 30μm | E7.5 (LS-LB) | 13/15 (12) | 17 ± 2 (ن = 4) | 6 ± 1 (ن = 4) |
| 20μm | E8.5 (2-5 القطع البدنية النمطية) | 12/13 (10) | 21 ± 4 (ن = 4) | 11 ± 4 (ن = 4) |
| 30μm | E8.5 (2-5 القطع البدنية النمطية) | 02/02 (2) | 33 و 26 (ن = 2) | 14 و 16 (ن = 2) |
الجدول 1. كفاءة Electroporation للمن pCAG-لجنة المساواة العرقية: البلازميد GFP في أجنة الفئران.
اختصار: LS، أواخر مرحلة متتالية البدائي؛ LB: مرحلة أواخر مهدها. ونظموا الأجنة وفقا لوهبوطا ديفيز 12
Discussion
تطعيم النبات
في خطوة حاسمة لتجارب التطعيم الخلية ادراج سلسلة مترابطة من الخلايا في موقع مثالي في عمل واحد، لتجنب تفكك أجمة. وتتطلب هذه التقنية بعض الممارسات في السيطرة على ماصة الفم. إذا الخلايا المانحة تتضمن كذلك في البلد المضيف، ومشتقاتها تفريق في الجنين. لمزيد من تحديد ما إذا كان المتبرع فرقت الخلايا المشتقة من التفريق بشكل مناسب في البلد المضيف، المناعية يمكن أن يؤديها على أقسام الجنين. إذا الخلايا المانحة غير متوافقة مع البيئة المضيفة، لأنها إما لا يمكن الكشف عن (كما يتم طردهم من الجنين) أو تشكيل كتل غير مدمج في الأجنة بعد الثقافة. إذا لوحظت كل من الخلايا المتفرقة وكتل الخلايا، وهذا قد يشير إلى والمطعمة أن الكثير من الخلايا وأدى الخلايا المفرطة المانحة التي لا يمكن أن تتفاعل مع توضيح الخلايا المضيفة في تشكيل أجمة. في هذه الحالة، الطعوم إضافية تحتوي علىلا يمكن أن يؤديها عدد أقل من الخلايا.
القيد الرئيسي للتقنية تطعيم خلية هو أنه ليس من الممكن تحديد الإمكانات الكاملة في الجسم الحي من خلايا منذ الماوس الثقافة فيفو السابقين على مدى فترات لم يتحقق أطول من 48 ساعة. ومع ذلك، إذا جنبا إلى جنب مع حقن الخلايا الموجهة بالأمواج فوق الصوتية، قد يكون من الممكن نقل الخلايا المستزرعة إلى الأجنة في الرحم. لتلخيص، وقد استخدمت الخلية تطعيم التجارب على نطاق واسع في مجموعتنا وأعطت لنا ادلة قيمة حول إمكانية في الجسم الحي من مختلف أنواع الخلايا 4،21،22. وهو أسلوب المنفعة العامة لتقييم إمكانات في الجسم الحي في المختبر الخلايا المستزرعة في الأجنة postimplantation مبكرة.
Electroporation لل
على الرغم من أن في هذه الدراسة قمنا يظهر فقط أنه من الأفضل لاستخدام تقنية Electroporation للالشعرية لاستهداف الأديم الظاهر، طتي الممكن أيضا أن تستهدف عمدا طبقات جرثومية أخرى مثل خلايا الأديم. في خطوة حاسمة لتقنية Electroporation للالشعرية هو تقليل الوقت الذي يستغرقه لelectroporate كل جنين (<5 دقائق في الجنين) منذ PBS هو الأمثل للغاية لأجنة فئران في مراحلها المبكرة. بياناتنا أظهرت فوق ذلك، في معظم المناطق في الأجنة، Electroporation لللا يؤثر على نمو الجنين. ومع ذلك، Electroporation للفي عقدة تسبب نمو غير طبيعي وادت الى الوفاة المبكرة للجنين. هذا هو الأرجح بسبب تلف أو موت الخلايا التي تشكل مراكز إشارات هامة 23. وبالتالي، فإن هذه المنطقة لا بد من تجنبها مع هذه التقنية. A مزيد من التحذير هو أنه، على النحو المذكور في قسم النتائج، في حين استهدفت الأديم الظاهر أو خلايا متتالية بدائية، تم electroporated أيضا بعض خلايا الأديم. قد يكون هذا بسبب DNA يصل إلى الأديم الباطن من خلال الفجوات تحت الظهارة الأديم الظاهر. يتكون الأديم الباطن الخلايا الظهارية وتجربتنا عشرخلايا جنوب شرقي لديها الميل العالي لتولي DNA. ولذلك، عند تطبيق هذه التقنية لرسم الخرائط مصير، فمن المهم لتقييم الخلايا التي تتخذ في البداية حتى الحمض النووي.
كما تجدر الإشارة إلى أنه على الرغم من pCAG-GFP وpCAG-لجنة المساواة العرقية: البلازميدات GFP يمكن تقديمها بكفاءة باستخدام المعلمات Electroporation للهو مبين في هذه الدراسة، وكفاءة البنى DNA أخرى قد تختلف وتحتاج الأمثل الفردية. ويمكن إجراء تغييرات في تركيز الحمض النووي، Electroporation للجهد أو عدد النبضات إذا تم العثور على البلازميدات من الصعب ل transfect.
لتلخيص، يمكن أن لدينا الأمثل نظام Electroporation للالشعرية بكفاءة وبتكاثر تسليم GFP أو لجنة المساواة العرقية: البلازميدات GFP في عدد قليل جدا من الخلايا في الجنين مع موت الخلايا محدود. لأن هذا الأسلوب لا يتطلب معدات باهظة الثمن أو درجة عالية من التخصص، ويمكن ان تكون ذات فائدة كبيرة للدراسات تتبع الخلية أو في اختبار تأثير التعبير خارج الرحم أو الشرطي حذف سالجينات و الأجنة في وقت مبكر، ويتم تنفيذ إذا Electroporation للفي الأجنة التي تحمل floxed أليل متحولة المشروطة. لذلك، توفر هذه التقنية Electroporation للأداة وظيفية مفيدة لفهم على أساس خلية تلو خلية أدوار العوامل خلايا الجوهرية في سياق wildtype المترجمة بيئات الجنينية.
Disclosures
The authors have no conflicts of financial or other interest to declare.
Acknowledgements
We thank Filip Wymeersch and Anestis Tsakiridis for comments on the manuscript, staff in the SCRM animal unit for help with animal maintenance and Prof. Stuart Forbes for immunohistochemistry reagents. This work was supported by MRC grant Mr/K011200/1 and the China Scholarship Council
Materials
| Name | Company | Catalog Number | Comments |
| Forceps | Dumostar | T5390 | |
| Dissecting stereomicroscope | Zeiss | Stemi 2000-C | |
| Stereomicroscope system with fluorescence | Nikon | AZ100 | |
| Inverted microscope with a digital camera | Olympus | Olympus BX61 | |
| Inverted confocal microscope | Leica Microsystems | Leica TCS SP8 | |
| Low melting point agarose | Life Technologies | 16520-050 | |
| Pasteur pipettes | Fisher Scientific | 11397863 | |
| 30mm Petri dishes | Fisher Scientific | 121V | |
| 4-well plates | Thermo scientific | 179820 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Phosphate Buffered Saline (PBS) | Life Technologies | 10010015 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | P6148 | |
| Pipettes | NICHIRYO | Nichipet | |
| tips | Greiner Bio One | 685280 | |
| Cell culture incubator | SANYO | MCO-17AIC | |
| Roller culture apparatus | BTC Engineering | ||
| Syringe filters 0.45µm, sterile | Sigma-Aldrich | 10462100 | |
| Glasgow Minimum Essential Medium (GMEM) | Sigma-Aldrich | G5154 | |
| non-essential amino acids (NEAA) | Life Technologies | 11140050 | |
| L-glutamine | Fisher Scientific | SH30549.01 | |
| Sodium pyruvate solution | Fisher Scientific | SH30239.01 | |
| Penicillin and Streptomycin 10.000UI/ml | Lonza | DE17-602E | |
| Gas Cartridge for Portable Meker Burner | COLEMAN | COLEMAN 250 | |
| Thin Wall Borosilicate Capillary Glass with Fillament, OD 1.0 mm, ID 0.78 mm | Harvard Apparatus | 640798 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma-Aldrich | A5177-5EA | |
| Flaming/Brown micropipette puller | Sutter Instrument Company | P-97 | |
| Microforge | De Fonbrune | BS030301 | |
| Pneumatic pico pump | World Precision Instruments | PV830 | |
| Microloader tips | Eppendorf | 5242956.003 | |
| ECM 830 square wave pulse generator | BTX | 45-0002 | |
| Green food coloring dye | Sigma-Aldrich | C.I. 42053 | |
| A far-red cell membrane-impermeable nuclear dye | Biotium | 40060-T | |
| pCAG-Cre:GFP | Addgene | #13776 | |
| pCAG-GFP | Addgene | #16664 | |
| Multimeter | Excel | XL830L | |
| Micromanipulators | Leitz | ||
| 0.2mm diameter platinum wire | Agar Scientific | E404-2 | |
| Anti-GFP antibody | Abcam | ab13970 | |
| Goat anti-Chicken IgY, HRP | Santa Cruz | sc-2428 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3467 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Life Technologies | D21490 | |
| A far-red fluorescence nuclear counterstain | Life Technologies | T3605 |
References
- O'Hagan, A. R., Morton, R., Eid, N. Loss of asthma control in pediatric patients after discontinuation of long-acting Beta-agonists. Pulmonary med. , 894063 (2012).
- Brons, I. G., et al. Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature. 448, 191-195 (2007).
- Tesar, P. J., et al. New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature. 448, 196-199 (2007).
- Huang, Y., Osorno, R., Tsakiridis, A., Wilson, V. In Vivo differentiation potential of epiblast stem cells revealed by chimeric embryo formation. Cell rep. 2, 1571-1578 (2012).
- Sadik, M. M., et al. Scaling relationship and optimization of double-pulse electroporation. Biophys. J. 106, 801-812 (2014).
- Kaestner, L., Scholz, A., Lipp, P. Conceptual and technical aspects of transfection and gene delivery. Bioorg. Med. Chem. Lett. , (2015).
- Soares, M. L., Torres-Padilla, M. E., Zernicka-Goetz, M. Bone morphogenetic protein 4 signaling regulates development of the anterior visceral endoderm in the mouse embryo. Dev. Growth Differ. 50, 615-621 (2008).
- Pierreux, C. E., Poll, A. V., Jacquemin, P., Lemaigre, F. P., Rousseau, G. G. Gene transfer into mouse prepancreatic endoderm by whole embryo electroporation. JOP. 6, 128-135 (2005).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7, 107 (2007).
- Davidson, B. P., Tsang, T. E., Khoo, P. L., Gad, J. M., Tam, P. P. Introduction of cell markers into germ layer tissues of the mouse gastrula by whole embryo electroporation. Genesis. 35, 57-62 (2003).
- Khoo, P. L., Franklin, V. J., Tam, P. P. Fate-Mapping Technique: Targeted Whole-Embryo Electroporation of DNA Constructs into the Germ Layers of Mouse Embryos 7-7.5 Days Post-coitum. CSH protocols. 2007. , pdb.prot4893 (2007).
- Tawk, M., Bianco, I. H., Clarke, J. D. Focal electroporation in zebrafish embryos and larvae. Methods Mol Biol. 546, 145-151 (2009).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70, 148-154 (2002).
- Nolkrantz, K., et al. Electroporation of single cells and tissues with an electrolyte-filled capillary. Anal. Chem. 73, 4469-4477 (2001).
- Mazari, E., et al. A microdevice to locally electroporate embryos with high efficiency and reduced cell damage. Development. 141, 2349-2359 (2014).
- Copp, A. J., Cockroft, D. L. . Postimplantation mammalian embryos : a practical approach. , (1990).
- Tam, P. P., Behringer, R. R. Mouse gastrulation: the formation of a mammalian body plan. Mech. Dev. 68, 3-25 (1997).
- Wilson, V., Beddington, R. S. Cell fate and morphogenetic movement in the late mouse primitive streak. Mech. Dev. 55, 79-89 (1996).
- Tzouanacou, E., Wegener, A., Wymeersch, F. J., Wilson, V., Nicolas, J. F. Redefining the progression of lineage segregations during mammalian embryogenesis by clonal analysis. Dev Cell. 17, 365-376 (2009).
- Bellomo, D., Lander, A., Harragan, I., Brown, N. A. Cell proliferation in mammalian gastrulation: the ventral node and notochord are relatively quiescent. Dev. Dynam. 205, 471-485 (1996).
- Tsakiridis, A., et al. Distinct Wnt-driven primitive streak-like populations reflect in vivo lineage precursors. Development. 141, 1209-1221 (2014).
- Gouti, M., et al. In vitro generation of neuromesodermal progenitors reveals distinct roles for wnt signalling in the specification of spinal cord and paraxial mesoderm identity. PLoS biology. 12, e1001937 (2014).
- Beddington, R. S. Induction of a second neural axis by the mouse node. Development. 120, 613-620 (1994).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved