Method Article
שיטות להעברת לוקליזציה דווקא של תאים או DNA לPostimplantation המוקדם עכבר עוברים
In This Article
Summary
We demonstrate a method for grafting cultured cells into defined sites of early mouse embryos to determine their in vivo potential. We also introduce an optimized electroporation method that uses glass capillaries of known diameter, allowing the precise delivery of exogenous DNA into a few cells in the embryos.
Abstract
מניפולציה והתרבות של עוברי עכברים מוקדם היא עדיין חזקה במידה רבה בטכנולוגית שיפור הערך של מערכת מודל זה תחת שימוש. לעומת זאת, תרבית תאים כבר בשימוש נרחב במחקרי ביולוגיה התפתחותית. עם זאת, חשוב לקבוע אם במבחנה תאים בתרבית באמת מייצגים בסוגי vivo תא. השתלת תאים לעוברי, ואחריו הערכה על תרומתם בפיתוח היא שיטה שימושית כדי לקבוע את הפוטנציאל של תאים בתרבית במבחנה. במחקר זה, אנו מתארים שיטה להשתלת תאים לאתר מוגדר של עוברי עכברי postimplantation המוקדם, ואחריו תרבות לשעבר vivo. גם אנחנו מציגים את שיטת electroporation מותאמת המשתמשת בנימי זכוכית בקוטר ידוע, המאפשרת לוקליזציה והתאמה מדויקות של מספר התאים מקבלים DNA אקסוגני עם שתי יעילות transfection גבוהה ומוות של תאים נמוכים. טכניקות אלה, שאינם דורשים כל spציוד ecialized, לעבד מניפולציות ניסיוניות של gastrulation ועובר עכבר organogenesis שלב מוקדם אפשרי, ניתוח המאפשר למחויבות בתת אוכלוסיות תאים בתרבית ואת ההשפעה של מניפולציות גנטיות באתר על התמיינות תאים.
Introduction
תרבית תאים כבר בשימוש נרחב במחקרי ביולוגיה התפתחותית. תאי גזע העובריים של עכבר (ESCs) ותאי גזע epiblast (EpiSCs) יכולים להתמיין לכל שלוש השכבות הנבט במבחנה והם מודל שימושי להתמיינות תאים בעובר יונקים המוקדם. הגזירה של שורות תאים אלה נפתחה הזדמנות למניפולציה במבחנה וחקירה מפורטת של האירועים מקומי איתות ורשתות תעתיק הפועלים בדפוסים עובריים מוקדמים. עם זאת, הוא נשאר חשוב לקבוע את הרלוונטיות vivo של כל מניפולציות שבוצעו בתרבות. פוטנציאל in vivo של ESCs עכבר נגזר עובר preimplantation כבר העריך ידי החדרת אותם בחזרה לעוברי preimplantation (morulae או blastocysts) 1. עם זאת, EpiSCs המייצגים את תאי epiblast בעוברי postimplantation לא יכול לשלב ביעילות בעוברי preimplantation 2,3. previoשלנו ממצאים הראו כי יעילות EpiSCs יכול ליצור מפלצות ולתרום לכל השכבות הנבט, כאשר מורכב לעוברי postimplantation 4. לפיכך, הדרך הטובה ביותר להעריך התאים בתרבית במבחנה היא להציג אותם לסביבתם המקבילה in vivo.
Electroporation הוא שיטה נפוצה כדי לספק מולקולות אקסוגניים לתאים ממוקדים בשני in vivo ובניסויי מבחנה. אנרגיה חשמלית יכולה לייצר מספר רב של נקבוביות בקרום התא, המאפשר חומצה דאוקסיריבונוקלאית אקסוגניים (DNA) או חומצה ריבונוקלאית (RNA) כדי להזין את התאים. אחד האתגרים הגדולים ביותר עבור טכניקה זו היא לשלב כדאיות תא אופטימליות עם 5,6 יעילות הגבוה electrotransfection. Electroporation של חומצות גרעין ברקמות עובריות, מצופה זהב אלקטרודות שהנפוצות ביותר בשימוש, המאפשר מיקוד של תאים במגוון רחב מרחבי 7-9. כדי להשיג loca יותרהעברת גני lized, אלקטרודה בצורת מחט נוצלה כדי להשיג שדה חשמלי מוקדי 10,11. באמצעות שיטה זו, המחברים הראו כי לאחר electroporation, סביב 30-60 תאים לקחו את ה- DNA לבנות 11. עם זאת, נראה כי באופן מדויק התאמת מספר תאי electroporated עדיין קשה עם אלקטרודה ברוחב קבוע. טכניקת electroporation הנימים נעשתה שימוש כדי לספק פלסמידים לתאים בודדים 12-14. עם זאת, טכניקה זו לא יושמה לelectroporating פלסמידים לעוברי vivo לשעבר. לאחרונה, microdevice דווח מקומי electroporate כמה תאי דיסטלי קרביים האנדודרם (פחות מ 4 תאים) בעוברי עכבר postimplantation המוקדם 15. עם זאת, זה עדיין לא ידוע אם מכשיר זה ביעילות יכול למקד האאקטודרם והמזודרם vivo לשעבר.
במחקר זה אנו מתארים שתי שיטות רומן כדי להעריך את התפקוד תאי וגנטי בהודעה המוקדמת-implantation עוברים. אנו מדגימים כיצד להשתיל ראשון במבחנה תאים בתרבית לאתרים שהוגדרו בעוברי עכברים מוקדם להעריך את הפוטנציאל שלהם in vivo. השילוב של התאים המורכבים וצאצאיהם, כל שכותרתו על ידי תג גנטי (למשל, חלבון ניאון ירוק (GFP), ניתן לבדוק עוד יותר על ידי immunostaining של חלבונים ספציפיים רקמה 4. שנית, אנו מתארים שיטה משופרת להעביר דנ"א בדיוק לאתרים מקומיים בעובר דרך electroporation. במקום להשתמש באלקטרודה בצורת מחט, הכנסנו חוט דק בתוך נימי זכוכית שקצהו קנס, ולהוכיח כי שינוי זה יכול לספק DNA למספר קטן של תאים עם יעילות גבוהה ומוגבל תא מוות. יתר על כן, אנו מראים כי באמצעות נימי זכוכית בגדלים שונים פתיחה, אנחנו יכולים לשלוט על מספר תאי electroporated. לכן, אנו מאמינים בשיטה זו יכולה להיות תועלת רבה ללמוד דפוסים עובריים מוקדמים מעורבות מספרים קטנים oתאים ו.
Protocol
כל הניסויים בבעלי החיים בוצעו בהתאם לתקנות משרד פנים בבריטניה כמפורט בבעלי חיים (הליכים מדעיים) Act (1986) תחת מספר פרויקט רישיון 60/4435. לאסוף עוברים בשלבי התפתחותיים ספציפיים, הזדווגויות מתוזמן הוקמו O / N. בצהריים ביום של מציאת תוסף נרתיק יועד יום עוברי (E) 0.5.
1. הביתור E7.5 או E8.5 Postimplantation עוברים לאקס תרבות Vivo
- להקריב את נקבות העכברים בהריון על ידי נקע בצוואר הרחם.
- לבודד את הרחם באמצעות מספריים, מחזיק אותו עם מלקחיים, ומניח בצלחת 30 מ"מ מלא בינוני M2.
- לקרוע לגזרים את זהירות מכוסה המיומטריום באמצעות שני זוגות מלקחיים בסדר.
- לקלף את decidua, נזהר שלא לנקב את חללי extraembryonic.
- הסר הקרום של רייכרט על ידי צובט אותו עם מלקחיים ולאט לאט מפריד אותו מהעובר.
- בדקו את העוברים תחת לנתחסטראו כדי להבטיח שצק חלמון, amnion וחרוט ectoplacental הם שלמים.
- מעבירים את העוברים לצלחת נקייה של M2 בעזרת פיפטה ומניחים על מכסה צלחת פטרי פלסטיק 30 מ"מ על קרח ("פלטפורמת הקרח ') לעוברי צינה באופן חלקי.
- במידת צורך, עובר חנות בM2 על פלטפורמת קרח לעד 1.5 שעות, למשל., במהלך הכנת תקשורת או מניפולציה של קבוצות קטנות של 3-4 ~ עוברים על RT.
הערה: שחזור ודיסקציה של עוברי מכרסמים תוארה בפירוט בעבר 7,8,16.
2. מכין את העובר תרבות בינונית
- טרי להפשיר או סרום עכברוש מסחרי-זמין (ראה גלנוויל-ג'ונס et al. 13 למפרט), או בסרום חולדה הוכן בבית-פי Copp וCockroft 16 שחום מומת למשך 30 דקות ב 56 C וקפוא ב 1 מיליליטר aliquots ב -80 מעלות
הערה: סרום עכברוש מסחרי-זמין מקובל לתקופות של 24-36 שעות תרבות, אם כי בסרום שהוכנו בבית-הוא, בניסיון שלנו, מעולה לתקופות תרבות עד 48 שעות. - טרי להכין עודף (למשל., 10 מיליליטר) של תוספים מוגדרים בהיקף של גלזגו מזערית בינונית חיוני (GMEM), 1% שאינם חיוניות חומצות אמינו (NEAA), 2 מ"מ L- גלוטמין ופירובט נתרן 1 מ"מ.
- חשב את הנפח של מדיום התרבות שצריך בהתאם למספר העוברים של כל שלב שהולכים להיות מתורבת (ראה סעיף 3). מערבבים את סרום העכברוש עם התוספים המוגדרים כדי לפצות 50% בינוני תרבות (1: 1 (V / V) בסרום חולדה: תוספים מוגדרים) ו / או 75% בינוני תרבות (3: (V / V) בסרום עכברוש 1: הגדרה תוספי תזונה).
- לעבור את מדיום תרבות עובר דרך מסנן 0.45 מיקרומטר ולהוסיף 10,000 IU פניצילין מיליליטר / ו -10 מיקרוגרם / מיליליטר סטרפטומיצין.
הערה: פתרון L- גלוטמין ופירובט נתרן מופשר טרי הוא חיוני לפיתוח עובר במהלך תרבות vivo לשעבר.
- לעוברי E7.5: תרבות סטטי באמצעות צלחות 4-היטב באינקובטור מסופק עם 5% CO 2 באוויר ב 37 צלזיוס למשך 24 שעות. תרבות עד שני עוברים לכל גם ב 1 מיליליטר של 50% בינוניים תרבות.
- לE8.5 עוברים: להשתמש מנגנון תרבות רולר 8 מסתובבים בסיבובים 35 / דקה בשילוב גזים רציפים עם 5% CO 2 באוויר ב 37 צלזיוס למשך 24 שעות (1 מיליליטר של 50% בינוניים תרבות לכל עובר).
- לעוברי E9.5: להשתמש מנגנון תרבות רולר מסתובב בסיבובי 35 גזים / דקה בשילוב מסופקים עם 5% CO 2, O 40% 2 55% N 2 ב 37 צלזיוס למשך 24 שעות (1 מיליליטר של 75% בינוניים תרבות ל עוּבָּר).
הערה: עוברי תרבות בתוך 3 שעות לאחר הרדמת חסד העכברים כתקופות ממושכות בM2 להשפיע לרעה על התפתחות. ראה Copp וCockroft 16 לשיטה של vivo לשעבר תרבות עובר.
4. Graftinתאים בתרבית גרם לE7.5 או E8.5 עכבר עוברים
- מבחינה פיזית לגרד EpiSCs, אשר בכל מקום להביע GFP, מצלחת תרבות 6 היטב באמצעות קצה פיפטה 20-200 μl ומניח אותם בצלחת 30 מ"מ המכילה את העוברים
הערה: כדי להכניס גושי תאים בעוברים, תאים צריכים להיות לגרוטאות פיזית ולא trypsinized. - צרף נימי השתלת יד משכה אל צינור aspirator לעשות פיפטה פה.
- בעדינות למצוץ פיפטה הפה לצייר גושי תא אחד או יותר מגודל> 20 תאים להשתלת הנימים.
- בעדינות לפוצץ את התאים, כדי לפזר באופן חלקי גושים גדולים.
- בחר גוש תא אחד המכיל ~ 10-20 תאים ולמצוץ לתוך נימי השתלה שוב, שמירה על אותה קרוב לפתיחה של הנימים. היזהר שלא להעביר את גוש תא ובמתוך הנימים שוב ושוב, כדי למנוע פריצה לחתיכות קטנות יותר.
- החזק את העובר באופן רופף במקום עם זוג המלקחיים והכנס את ההשתלהנימים לתוך האזור של עניין כדי ליצור פתיחה.
- בעדינות לגרש את הגוש מנימי השתלה, שעזב את המחרוזת הקצרה של 10-20 תאים נתקעו בעובר.
- חזור על תהליך השתלה למספר הרצוי של עוברים. השתמש בגדלים אצווה של 3-4 עובר לנוחות.
- השארת עובר בצלחת של מדיום M2, תמונה עובר המורכבים באמצעות תרכובת הקרינה לנתח מיקרוסקופ עם מצלמה, שמירת זמן הדמיה למינימום, כדי למנוע חשיפה של העוברים לאור וחום מוגזמים.
הערה: קבע פעמים הדמיה באופן אמפירי כמו אלה יהיו תלויים במפרט של המצלמה ומיקרוסקופ, כמו גם את עוצמת הטבע וקרינה של fluorophore. - העבר את העובר בpastette עם נפח מינימאלי של מדיום M2 מראש equilibrated בינוני תרבות (ראה סעיף 3) מייד לאחר הדמיה.
הערה: לבחון בזהירות את המורפולוגיה של העוברים לאחר השתלה. תרבות רק intacעוברים לא.
5. עבודת יד Electroporation חומרים והתקנת מכשירים (הכן את בעקבות מראש של ניסויי Electroporation):
- לטפטפות הזרקת DNA: למשוך טפטפות הזרקת DNA באמצעות חולץ micropipette אופקי. טפטפות הזרקה צריכה להיות טיפ נאה עם פתיחה פחות מ -10 מיקרומטר, כדי למנוע נזק לרקמות כאשר הזרקת DNA לתוך החללים העובריים.
- לelectroporation נימי זכוכית: להשתמש microforge לחתוך את הפתיחה של טפטפות הזרקת DNA לקוטר פנימי של כל אחד או 30 מיקרומטר 20. כדי למנוע נזק לתאים כאשר הנימים נמצאת בקשר עם העובר לelectroporation, הקצה של זכוכית הנימים יש לחתוך בצורה נקיה ולא מכיל, קצוות השבורים חדים.
- לאלקטרודה בעבודת יד נימים (האנודה) (איור 1): להכניס חוט פלטינה קוטר 0.2 מ"מ לזכוכית נימים electroporation עם פתיחה קבועה של או 30 מיקרומטר 20 קוטר להתמקד הנבחרריק הנוכחי ולספק את ה- DNA פלסמיד לאזור קטן של עניין בעובר.
- לאלקטרודה בעבודת יד בצורת L (קתודה) (איור 1): לכופף חוט פלטינה קוטר 0.2 מ"מ יצירת צורה "L", עם החלק האופקי של "L" סביב 1 מ"מ האורך.
- צרף כל אלקטרודה פלטינה לחוט מבודד דק ולהכניס אותו לתוך בעל מחט microinjection מכוסה על ידי סרט בידוד.
- הר מחזיקי מחט על מחזיקי מכשיר מיקרומניפולציה סטנדרטיים.
- חבר את המעגל כפי שמוצג באיור 1: לחבר את האלקטרודה הנימים להאנודה של אספקת החשמל; לחבר את האלקטרודה בצורת L להאנודה של מודד; לחבר את הקתודה של mulimeter לקתודה של אספקת החשמל.
6. Electroporation E7.5 או E8.5 עכבר עוברים
- מלא את נימי זכוכית electroporation עם PBS בתוך 1-2 מ"מ של הראש ולהכניס את straiאלקטרודה להילחם הפלטינה (האנודה) לנימי הזכוכית עד שהוא מגיע לתחתית של הנימים.
- לעגן את האלקטרודה בצורת L (קתודה) על פני השטח של צלחת פטרי 30 מ"מ מלא PBS.
- העבר את העובר מבינוני M2 לתוך צלחת electroporation PBS המלא.
- הכנס את מחט הזריקה מepiblast רוחב לתוך החלל מי השפיר של העובר. באמצעות משאבת פיק פנאומטי, להזריק פתרון ה- DNA (pCAG-Cre: GFP או pCAG-GFP 1-1.5 מיקרוגרם / מיליליטר עם 0.01% צבע צבע מאכל ירוק) לתוך החלל עד שהוא מלא לגמרי. לעוברי E7.5-E8.5, פתרון ה- DNA פחות מ -5 μl נדרש לעובר אחד. שימוש בצבע הירוק כמדד, להיזהר שלא פרץ את העובר.
- מקם בזהירות את העובר בין האלקטרודות ולהעביר את האלקטרודה הנימים למיקום המדויק שבו ה- DNA הוא להיות מועבר.
הערה: הכיוון של העובר תלוי באזור שבו ה- DNA הוא להיות electroporated. - Electropoלדרג את העובר באמצעות 200 וולט (V) ב 6 קטניות, כל אחד ממשך ms 50 עם מרווח 1 שניות בין דופק בכל.
- העבר את העובר מראש equilibrated בינוני תרבות מייד לאחר electroporation. אם תרצה, חזור על התהליך עבור העובר הבא.
הערה: הוסף את מדיום התרבות לתוך מיכל סטרילי ולשים אותו בחממת התרבות מראש לאזן הבינוני. - כדי לזהות תאי electroporated 2 שעות לאחר התרבות, להעביר את העוברים לצלחת פטרי 30 מ"מ נקי של מדיום M2 באמצעות pastette. תמונה עובר כמו בשלב 5.9 באמצעות תרכובת הקרינה מיקרוסקופ לנתח.
- מעבירים את העוברים חזרה לתרבות באמצעות pastette מייד לאחר הדמיה.
- כדי לזהות תאים מתים שנגרמו על ידי electroporation, להכתים את העוברים עם צבע אדום-רחוק תא קרום חדיר גרעיני (1: 200 במדיום תרבות עובר) בשעת 37 צלזיוס למשך 10 דקות 2 שעות לאחר electroporation (אופציונאלי)
- לספור את תאי electroporated, לתקן את אמברימערכת הפעלה בparaformaldehyde 4% (PFA) במשך 2-4 שעות על 4 מעלות, להכתים את הגרעין עם אולטרה סגול או counterstain הגרעיני ניאון מרחיק אדום ותמונה עובר באמצעות מיקרוסקופ confocal (אופציונאלי).
הערה: צמיחה העוברית מושפעת לרעה אם נותרו זמן רב מדי בPBS. לכן, ודא שהזמן שלוקח לelectroporate כל עובר ממוזער (<5 דקות לכל עובר).
תוצאות
הארכת
EpiSCs שכל מקום בגוף להביע EGFP (R04-GFP, נגזר מepiblast E6.5, וC2, נגזר במבחנה מmESCs) 4 היו שרוט באופן ידני ממנת התרבות ומורכבת לאתרים שונים של עוברי E7.5 (איור 2 א). העוברים היו בתרבית vivo לשעבר ונותחו לאחר 24 שעות. חלוקת תאי תורם הוערכה על ידי מיקרוסקופ פלואורסצנטי. אם תאי תורם התאגדו, הם התרבו ונגזרים שלהם מפוזרים בעוברי המארח (איור 2). זה נצפה כי שתלים המכילים 10-16 תאים התאגדו ביעילות בעוברי המארח (איור 2 א, ו -2), לעומת זאת, השתלת תאים נוספים לא תבאנה לchimaerism טוב יותר. במקום זאת, תאים מורכבים מיוצרים גושים מאוגדים (איור 2 ג ו 2 ד).
Electroporation
לssess את היעילות של מערכת electroporation שלנו, אנחנו נמסרו פלסמידים להביע GFP (pCAG-GFP וpCAG-Cre: GFP) לאתרים ספציפיים בעובר. עולה בקנה אחד עם מחקר קודם 11, תאי GFP + אותרו בעוברים 1-2 שעות לאחר electroporation (איור 2E ו2G). כאשר תאי epiblast דיסטלי בעובר בשלב מאוחר פס הפרימיטיבי היו electroporated, תאים שכותרתו תרמו להאאקטודרם העצבי לאחר 24 שעות בתרבות (איור 2E ו2F). תוצאה זו תואמת היטב מפות גורל ידועות של תאי epiblast בעוברים בgastrulation 17. באופן דומה, כאשר פלסמיד הביטוי של GFP היה electroporated בפס הפרימיטיבי בE8.5 (2-5 somites), GFP + תאים תרמו להמזודרם הפרקסיאלית (איור 2G ו2H), עולה בקנה אחד עם מפות גורל ידועות של הפס הפרימיטיבי מאוחר 18 . יתר על כן, אנו נצפו תרומה לכל שלוש שכבות הנבט מתאי electroporated (איור ט 2-K),טוען כי הליך electroporation אינו מתפשר התנהגות תא בגוף חי. עם זאת, אנחנו גם שמנו לב שתוך epiblast (E7.5) או תאי פס פרימיטיביים (E8.5) היו ממוקדים, כמה תאים האנדודרם היו גם electroporated (איור 3 ג ולוח 1).
אחד היתרונות הגדולים של שימוש באלקטרודה נימים הוא כי מספר תאי electroporated יכול להיות נשלט, פשוט על ידי שינוי הקוטר של פתיחתו. כדי לקבוע את מספר תאי electroporated, עוברים היו קבועים 2 שעות לאחר electroporation וצלמו בwholemount על מיקרוסקופ confocal. מספר תאי GFP + נספר באופן ידני בZ- ערימות confocal. טבלת 1 מראה כי, לשלב נתון, להגדיל את גודל הפתיחה של נימי זכוכית 20-30 מיקרומטר תוצאות בספיגת ה- DNA על ידי יותר תאים. כאשר גודל פתיחה אחת הושווה בין השלבים (E7.5 לעומת E8.5), יותר תאים נמצאו להיות electroporated בשלב האחרון. אפקט זה יכול להיות בגלל ריכוז גבוה יותר של הווה DNA בחלל מי השפיר בE8.5. כי פתרון ה- DNA היה מעורב עם צבע המאכל הירוק, אנו יכולים להשתמש בצבע הירוק כדי להעריך את ריכוז ה- DNA בחלל מי השפיר. במיקרוסקופ, ברור כי, בהשוואה לעוברי E8.5, הצבע הירוק לאחר הזרקת ה- DNA הוא הרבה יותר קל בחלל של עוברי E7.5. למרות שאותו הריכוז של פתרון ה- DNA שהוזרק לעוברי E7.5 וE8.5, יותר פתרון ה- DNA היה בחלל מי השפיר של עוברי E8.5 כדי למלא אותו לגמרי, כי הם גדולים יותר בגודל. לאחר נסיגת מחט הזריקה, תמיד יש מידה מסוימת של דליפה של פתרון ה- DNA מהחלל מי השפיר, ומאז החור לנקב גדול בהשוואה לגודל של החלל מי השפיר בעוברים קודם לכן, סביר להניח כי לא הייתה דליפה באופן יחסי יותר מE7.5 מעוברי E8.5, שמוביל לריכוז ה- DNA נמוך יותר. המספר שונה של transfectedתאים יכולים להיות גם בגלל בקטרים השונים או ספי מתח הטרנסממברני מושרה (ITV) של תאים בשלבים שונים.
חסרון של electroporation הוא המוות של התאים הקשורים. בדומה לזהב המסורתי מצופה או אלקטרודות בצורת מחט, electroporation באמצעות אלקטרודה נימים גם גורם למוות של התאים. לאחר electroporation אזור המיקוד הופיע בצבע כהה בהשוואה לאזורים הסמוכות (3A ואיור 3), מצביע על כך שמידה מסוימת של מוות של תאים חייבת חלו בתחום זה. כדי לקבוע את מספר התאים מתים הנגרמים על ידי הליך electroporation נוסף, עוברים היו מוכתמים בצבע קרום-חדיר תאי ניאון גרעיני. הגרעינים של תאים מתים תויגו עם צבע פלואורסצנטי מרחיק אדום קרום חדיר. הצביעה אישרה כי טכניקת electroporation נימים זה תוצאות רק במספר קטן של תאים מתים בסמוך לאתר electroporation (איור 3D ותאble 1).
שם לב שלמרות שתאים מתים מופיעים באתר electroporation, GFP תאים + ותאים מתים גם יוקרתיים ביותר מאחד לשני (איור 3E ו3F). יתר על כן, כאשר epiblast רוחב הזנב בE8.5 היה electroporated עם pCAG-GFP ופתיחת נימי זכוכית של 20μm, מספר גדול של תאי GFP + התגלה לאחר 48 שעות בתרבות (איור 3G ו3H). יחדיו, תוצאות אלה מרמזות ביותר GFP + התאים זוהו 2 שעות לאחר electroporation עדיין קיימא בתרבות נוספת.
אנחנו הבקענו את המספר של ה- GFP + תאים לאחר vivo לשעבר תרבות 24 שעות. שישה עוברים electroporated עם pCAG-GFP בE7.5, באמצעות פתיחת נימים של קוטר 20μm. 107 ± 31 (ממוצע ± SD) GFP + תאים / עובר התגלו. מכיוון שבתחילתה של תרבות (2 שעות), 9 תאים electroporated על עובר לממוצע ( טרונג> לוח 1), זה מצביע על כך שתאי electroporated עברו 3-4 חטיבות בתוך 2 שעות. התא הממוצע הכפלת זמן מE7.5 לעוברי E8.5 הוא סביב 6-7 שעות בכל מלבד אלה בצומת הגחון 19,20 התאים. הדבר מצביע על כך את הליך electroporation לא לעכב צמיחת תאים נורמלית.
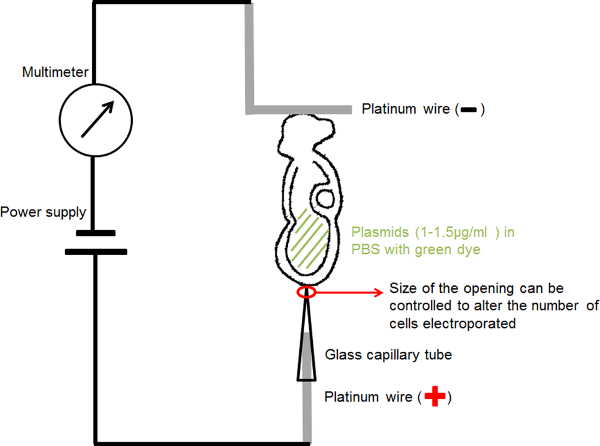
איור 1. תרשים המעגל מראה את התקנת electroporation. פתרון ה- DNA העובר המכיל בחלל מי השפיר שלה היה ממוקם בין שתי אלקטרודות. נוכחי בפרמטרים שנבחרו סופק על ידי גנרטור גל מרובע דופק (אספקת חשמל). מודד היה קשור בסדרה כדי לזהות את הזרם החשמלי שעובר העובר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
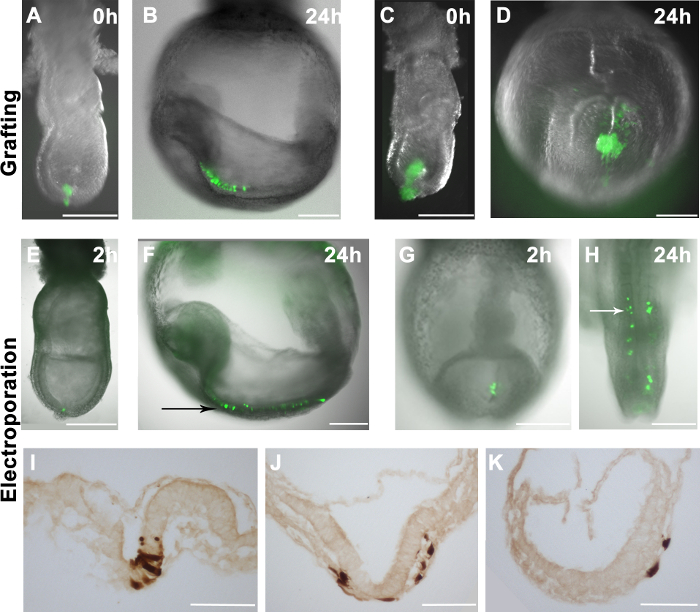
איור 2. חלוקת תאים מורכבים או electroporated בעוברי מארח. שכבות (AH) הקרינה GFP (ירוק) על תמונות brightfield של עוברי wholemount (גווני אפור) () 10-16 GFP + EpiSCs היו מורכבים לאזור הדיסטלי של סוף עובר -streak שלב. (ג) גוש גדול של ה- GFP + EpiSCs היה מורכבים לאזור הדיסטלי של עובר בשלב אמצע פס-. (B ו- D) חלוקת תאי EpiSCs נגזרו (ירוקה) בעוברי המארח (מוצגת ב ו- C) לאחר 24 שעות בתרבות. (תאי B) GFP + המפוזרים בעובר המארח, המצביעים על שילוב נכון של תאי התורם. (ד) השתלת גושי תאים גדולים יותר הביאו להיווצרות גוש מאוגדת בעובר המארח. (EK) pCAG-Cre: ele פלסמיד GFP ctroporated לאזורים ספציפיים של עוברי wildtype. Electroporating האזור הדיסטלי של עובר בשלב מוקדם ניצן (E) או הפס הפרימיטיבי של עובר שלב 2-5 somite (G) הביא GFP + תאים באזורים אלה 2 שעות לאחר ההליך. (F ו- H) ההפצה של ה- GFP + תאים בעוברי המארח לאחר 24 שעות בתרבות, שהראה כי תאי electroporated לתרום לneuroectoderm (החץ השחור) (F) והמזודרם הפרקסיאלית (חץ לבן) (H). (IK) immunostaining DAB לתאי GFP + מראים כי תאי electroporated יכולים להצמיח neuroectoderm (I), המזודרם (J) והאנדודרם (J ו- K) לאחר 24 שעות בתרבות. בר סולם (AH) = 250 מיקרומטר; סרגל קנה מידה (IK) = 100 מיקרומטר. הערה: איור 1 א ו -1 B הם נדפסו מהפרסום הקודם שלנו 4.href = היעד "https://www.jove.com/files/ftp_upload/53295/53295fig2large.jpg" = "_ blank"> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
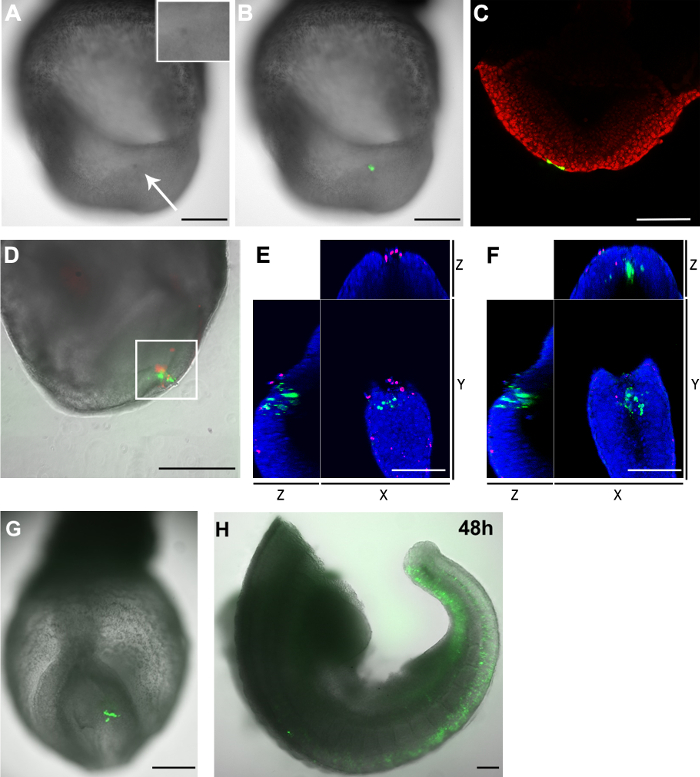
(AC) pCAG-Cre הפצת 3. איור של ה- GFP תאים + ותאים מתים בעוברים לאחר electroporation: (גודל פלסמיד GFP electroporated לתוך תאי epiblast רוחב הזנב של E8.5 (שלב somite 2-5) עובר נימי פתיחה. :. 20 מיקרומטר) () 2 שעות לאחר ההליך, אזור המיקוד הראה צבע כהה (חץ לבן) בהשוואה לחלקים אחרים של העובר. הבלעה מראה הגדלה של אזור electroporated. (ב) תמונת Brightfield (גווני אפור) ועליהן ערוץ הניאון הירוק מראים את תאי electroporated (הירוקה). (ג) confocal Z-הפרוסה מראה ששני תאים האנדודרם (ירוק) גם לקחו את פלסמיד כאשר תאי epiblast רוחב הזנב היו ממוקדים. גרעין התא מוצג באדום (DF) pCAG-Cre:. פלסמיד GFP היה electroporated בהיבט הזנב של הצומת של עובר E8.5 (גודל פתיחת נימים: 30 מיקרומטר). העובר היה בתרבית לשעה 2. תאי Electroporated מוצגים בתאים ירוקים ומתים באדום. (ד) אזור electroporated מכיל שני GFP + תאים, כמו גם תאים מתים. האזור בקופסא הלבנה נותח נוסף במיקרוסקופ confocal. ספירה ידנית של Z- המחסנית הראתה כי היו 33 GFP תאים + ו -23 תאים מתים באזור זה. רק שני תאים היו חיוביים עבור שני fluorophores. (E ו- F) יכול לצפות בXYZ של Z-פרוסת confocal מהאזור בארגזים הלבן בD מראה תאי GFP + הם נפרדים מהתאים המתים. הגרעינים מוצגים בכחול (G ו- H) pCAG-Cre:. פלסמיד GFP היה electroporated לכמה celLS בepiblast רוחב הזנב של עובר E8.5 (גודל פתיחת נימים: 20 מיקרומטר) וצלם לאחר שתי (G) ו 48 שעות (H) vivo לשעבר הערה תרבות: (H) העובר נותק בשני אחרי התרבות. אזורי הראש והלב הוסרו. בר סולם (A, B, D, G ו- H) = 250 מיקרומטר; סרגל קנה מידה (C, E ו- F) = 100 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| קוטר של פתיחת צינור הנימים | שלב עובר | יעילות electroporation: לא. עוברים המכילים GFP + תאים לאחר 2h / לא מוחלט. עוברים של electroporated (לא. GFP + עוברים שהתפתחו בדרך כלל לאחר 24 או תרבות 48h) | מספר הממוצע של ה- GFP + תאים לכל עובר ± SD (n = לא. של עוברים שנבדקו) | מס 'שלGFP + endodermal תאים לכל עובר ± SD (n = לא. של עוברים שנבדקו) |
| 20μm | E7.5 (LS-LB) | 7/9 (7) | 9 ± 3 (n = 4) | 4 ± 2 (n = 4) |
| 30μm | E7.5 (LS-LB) | 13/15 (12) | 17 ± 2 (n = 4) | 6 ± 1 (n = 4) |
| 20μm | E8.5 (2-5 somites) | 12/13 (10) | 21 ± 4 (n = 4) | 11 ± 4 (n = 4) |
| 30μm | E8.5 (2-5 somites) | 2/2 (2) | 33 ו -26 (n = 2) | 14 ו -16 (n = 2) |
טבלת 1. יעילות Electroporation של pCAG-Cre: פלסמיד GFP בעוברי עכברים.
קיצור: LS, שלב פס פרימיטיווי מאוחר; LB: שלב מאוחר ניצן. עוברים מבוימים פידאונס ו -12 דייויס
Discussion
הארכת
השלב הקריטי לניסויי השתלת תאים הוא החדרת מחרוזת עקבית של תאים באופן אידיאלי בפעולה אחת, כדי למנוע התפרקות של הגוש. טכניקה זו דורשת קצת תרגול בשליטה פיפטה הפה. אם תאי תורם לשלב גם במארח, הנגזרים שלהם יתפזרו בעובר. כדי לקבוע אם נוסף נגזר תאי התורם התפזר להבחין כראוי במארח, immunostaining יכול להתבצע על חלקי העובר. אם תאי תורם אינם תואמים לסביבת המארח, הם גם לא יכולים להיות מזוהים (כפי שהם גורשו מהעובר) או ליצור גושים מאוגדים בעוברים לאחר התרבות. אם שני תאים מפוזרים וגושי תא נצפו, זה עשוי להצביע על כך יותר מדי תאים היו מורכבים ותאי תורם מוגזמים שלא יכול לקיים אינטראקציה עם תאי מארח סביב הביאו היווצרות גוש. במקרה זה, שתלי נוספים המכיליםמספר קטן יותר של תאים יכול להתבצע.
המגבלה העיקרית של טכניקת השתלת תאים הוא שזה לא ניתן לקבוע את מלוא פוטנציאל in vivo של תאים מאז תרבות עכבר לשעבר vivo על פני תקופות ארוכות מ -48 שעות לא הושגו. עם זאת, אם בשילוב עם הזרקת תא מודרך אולטרסאונד, ייתכן שניתן להעביר תאים בתרבית לעוברים ברחם. לסיכום, ניסויי תא השתלה היו בשימוש נרחב בקבוצה שלנו ונתנו לנו רמזים חשובים על פוטנציאל in vivo של סוגי תאים שונים 4,21,22. זוהי טכניקה של שירות כללי להעריך את פוטנציאל in vivo של במבחנה תאים בתרבית בעוברי postimplantation המוקדמים.
Electroporation
למרות במחקר זה הראינו רק שזה יעיל להשתמש בטכניקת electroporation הנימים למקד epiblast, אנילא ניתן גם לכוון במכוון שכבות נבט אחרות כגון תאים האנדודרם. השלב הקריטי לטכניקת electroporation הנימים הוא למזער את הזמן שלוקח לelectroporate כל עובר (<5 דקות לכל עובר) מאז PBS הוא הכי מוצלח מאוד לעוברי עכברים מוקדם. הנתונים שלנו מעל הראו כי, ברוב האזורים בעוברים, electroporation אינו משפיע על צמיחת העובר. עם זאת, electroporation בצומת גרם התפתחות לא תקינה והביא למותו בטרם עת של העובר. זה עשוי בשל נזק או מוות של התאים היוצרים מרכזי איתות חשובים 23. לפיכך, אזור זה יצטרך להימנע עם טכניקה זו. אזהרה נוספת היא ש, כאמור בסעיף התוצאות, תוך epiblast או תאי פס פרימיטיביים היו ממוקדים, כמה תאים האנדודרם היו גם electroporated. זה יכול להיות בגלל DNA מגיע להאנדודרם דרך פערים באפיתל epiblast. האנדודרם מורכב מתאי אפיתל ובניסיון שלנו היש תאים ESE נטייה גבוהה יותר כדי לקחת את ה- DNA. לכן, בעת יישום טכניקה זו למיפוי גורל, חשוב להעריך שבו תאים בתחילה לקחת את ה- DNA.
צריך גם לציין שלמרות שpCAG-GFP וpCAG-Cre: פלסמידים GFP יכולים להיות מועברים בצורה יעילה באמצעות פרמטרי electroporation מוצגים במחקר זה, את היעילות של בונה DNA אחרת עשויה להיות שונה וצריך אופטימיזציה בודדת. שינויים בריכוז ה- DNA, מתח electroporation או מספר הפעימות יכולים להתבצע אם פלסמידים הם מצאו להיות קשה transfect.
לסיכום, מערכת electroporation שלנו מותאמת נימים יכולה ביעילות ובreproducibly לספק GFP או Cre: פלסמידים GFP למעט מאוד תאים בעובר עם מוות של תאים מוגבלים. מאחר ושיטה זו אינה דורשת ציוד יקר או מאוד מיוחד, זה יכול להיות תועלת רבה ללימודי מעקב תא או בבדיקת ההשפעה של ביטוי חוץ רחמי או o מחיקה המותנהגני F בעוברים מוקדמים, אם electroporation מבוצעים בעוברים שנשאו אללים מוטציה מותנים floxed. לכן, טכניקת electroporation זה מספקת כלי פונקציונלי שימושי להבנה על בסיס תא-ידי תאי התפקידים של גורמי תא פנימי בהקשר של סביבות עובריות wildtype המקומי.
Disclosures
The authors have no conflicts of financial or other interest to declare.
Acknowledgements
We thank Filip Wymeersch and Anestis Tsakiridis for comments on the manuscript, staff in the SCRM animal unit for help with animal maintenance and Prof. Stuart Forbes for immunohistochemistry reagents. This work was supported by MRC grant Mr/K011200/1 and the China Scholarship Council
Materials
| Name | Company | Catalog Number | Comments |
| Forceps | Dumostar | T5390 | |
| Dissecting stereomicroscope | Zeiss | Stemi 2000-C | |
| Stereomicroscope system with fluorescence | Nikon | AZ100 | |
| Inverted microscope with a digital camera | Olympus | Olympus BX61 | |
| Inverted confocal microscope | Leica Microsystems | Leica TCS SP8 | |
| Low melting point agarose | Life Technologies | 16520-050 | |
| Pasteur pipettes | Fisher Scientific | 11397863 | |
| 30mm Petri dishes | Fisher Scientific | 121V | |
| 4-well plates | Thermo scientific | 179820 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Phosphate Buffered Saline (PBS) | Life Technologies | 10010015 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | P6148 | |
| Pipettes | NICHIRYO | Nichipet | |
| tips | Greiner Bio One | 685280 | |
| Cell culture incubator | SANYO | MCO-17AIC | |
| Roller culture apparatus | BTC Engineering | ||
| Syringe filters 0.45µm, sterile | Sigma-Aldrich | 10462100 | |
| Glasgow Minimum Essential Medium (GMEM) | Sigma-Aldrich | G5154 | |
| non-essential amino acids (NEAA) | Life Technologies | 11140050 | |
| L-glutamine | Fisher Scientific | SH30549.01 | |
| Sodium pyruvate solution | Fisher Scientific | SH30239.01 | |
| Penicillin and Streptomycin 10.000UI/ml | Lonza | DE17-602E | |
| Gas Cartridge for Portable Meker Burner | COLEMAN | COLEMAN 250 | |
| Thin Wall Borosilicate Capillary Glass with Fillament, OD 1.0 mm, ID 0.78 mm | Harvard Apparatus | 640798 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma-Aldrich | A5177-5EA | |
| Flaming/Brown micropipette puller | Sutter Instrument Company | P-97 | |
| Microforge | De Fonbrune | BS030301 | |
| Pneumatic pico pump | World Precision Instruments | PV830 | |
| Microloader tips | Eppendorf | 5242956.003 | |
| ECM 830 square wave pulse generator | BTX | 45-0002 | |
| Green food coloring dye | Sigma-Aldrich | C.I. 42053 | |
| A far-red cell membrane-impermeable nuclear dye | Biotium | 40060-T | |
| pCAG-Cre:GFP | Addgene | #13776 | |
| pCAG-GFP | Addgene | #16664 | |
| Multimeter | Excel | XL830L | |
| Micromanipulators | Leitz | ||
| 0.2mm diameter platinum wire | Agar Scientific | E404-2 | |
| Anti-GFP antibody | Abcam | ab13970 | |
| Goat anti-Chicken IgY, HRP | Santa Cruz | sc-2428 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3467 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Life Technologies | D21490 | |
| A far-red fluorescence nuclear counterstain | Life Technologies | T3605 |
References
- O'Hagan, A. R., Morton, R., Eid, N. Loss of asthma control in pediatric patients after discontinuation of long-acting Beta-agonists. Pulmonary med. , 894063 (2012).
- Brons, I. G., et al. Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature. 448, 191-195 (2007).
- Tesar, P. J., et al. New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature. 448, 196-199 (2007).
- Huang, Y., Osorno, R., Tsakiridis, A., Wilson, V. In Vivo differentiation potential of epiblast stem cells revealed by chimeric embryo formation. Cell rep. 2, 1571-1578 (2012).
- Sadik, M. M., et al. Scaling relationship and optimization of double-pulse electroporation. Biophys. J. 106, 801-812 (2014).
- Kaestner, L., Scholz, A., Lipp, P. Conceptual and technical aspects of transfection and gene delivery. Bioorg. Med. Chem. Lett. , (2015).
- Soares, M. L., Torres-Padilla, M. E., Zernicka-Goetz, M. Bone morphogenetic protein 4 signaling regulates development of the anterior visceral endoderm in the mouse embryo. Dev. Growth Differ. 50, 615-621 (2008).
- Pierreux, C. E., Poll, A. V., Jacquemin, P., Lemaigre, F. P., Rousseau, G. G. Gene transfer into mouse prepancreatic endoderm by whole embryo electroporation. JOP. 6, 128-135 (2005).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7, 107 (2007).
- Davidson, B. P., Tsang, T. E., Khoo, P. L., Gad, J. M., Tam, P. P. Introduction of cell markers into germ layer tissues of the mouse gastrula by whole embryo electroporation. Genesis. 35, 57-62 (2003).
- Khoo, P. L., Franklin, V. J., Tam, P. P. Fate-Mapping Technique: Targeted Whole-Embryo Electroporation of DNA Constructs into the Germ Layers of Mouse Embryos 7-7.5 Days Post-coitum. CSH protocols. 2007. , pdb.prot4893 (2007).
- Tawk, M., Bianco, I. H., Clarke, J. D. Focal electroporation in zebrafish embryos and larvae. Methods Mol Biol. 546, 145-151 (2009).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70, 148-154 (2002).
- Nolkrantz, K., et al. Electroporation of single cells and tissues with an electrolyte-filled capillary. Anal. Chem. 73, 4469-4477 (2001).
- Mazari, E., et al. A microdevice to locally electroporate embryos with high efficiency and reduced cell damage. Development. 141, 2349-2359 (2014).
- Copp, A. J., Cockroft, D. L. . Postimplantation mammalian embryos : a practical approach. , (1990).
- Tam, P. P., Behringer, R. R. Mouse gastrulation: the formation of a mammalian body plan. Mech. Dev. 68, 3-25 (1997).
- Wilson, V., Beddington, R. S. Cell fate and morphogenetic movement in the late mouse primitive streak. Mech. Dev. 55, 79-89 (1996).
- Tzouanacou, E., Wegener, A., Wymeersch, F. J., Wilson, V., Nicolas, J. F. Redefining the progression of lineage segregations during mammalian embryogenesis by clonal analysis. Dev Cell. 17, 365-376 (2009).
- Bellomo, D., Lander, A., Harragan, I., Brown, N. A. Cell proliferation in mammalian gastrulation: the ventral node and notochord are relatively quiescent. Dev. Dynam. 205, 471-485 (1996).
- Tsakiridis, A., et al. Distinct Wnt-driven primitive streak-like populations reflect in vivo lineage precursors. Development. 141, 1209-1221 (2014).
- Gouti, M., et al. In vitro generation of neuromesodermal progenitors reveals distinct roles for wnt signalling in the specification of spinal cord and paraxial mesoderm identity. PLoS biology. 12, e1001937 (2014).
- Beddington, R. S. Induction of a second neural axis by the mouse node. Development. 120, 613-620 (1994).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved