Method Article
Erken Postimplantation Fare Embriyolar içine Hücreleri veya DNA Kesinlikle lokalize Transferi Yöntemleri
Bu Makalede
Özet
We demonstrate a method for grafting cultured cells into defined sites of early mouse embryos to determine their in vivo potential. We also introduce an optimized electroporation method that uses glass capillaries of known diameter, allowing the precise delivery of exogenous DNA into a few cells in the embryos.
Özet
Erken fare embriyo manipülasyonu ve kültür güçlü henüz büyük ölçüde altında kullanılan bu model sistemin değerini artıran teknoloji bir olduğunu. Bunun aksine, hücre kültürü yaygın gelişim biyolojisi çalışmalarında kullanılmıştır. Bununla birlikte, in vitro kültürlenmiş hücrelerin gerçekten in vivo hücre tiplerinde temsil olup olmadığını belirlemek için çok önemlidir. Gelişimi sırasında katkıları değerlendirilmesi ardından embriyolar içine hücreleri, aşılama in vitro kültür hücreleri potansiyelini belirlemek için yararlı bir yöntemdir. Bu çalışmada, ex vivo kültür ardından erken implantasyon sonrası fare embriyosu, tanımlanmış bir siteye hücreleri aşılama için bir yöntem tarif eder. Ayrıca, yüksek transfeksiyon verimlerine ve düşük hücre ölümü hem eksojen DNA'nın alınması hücrelerin sayısının hassas bir lokalizasyonu ve ayarlama sağlar bilinen bir çapa cam kılcal kullanan optimize edilmiş bir elektroporasyon yöntemi sunuyoruz. Herhangi bir sp gerekmez Bu teknikler,ecialized ekipman, gastrulasyon ve erken organogenezisin aşamalı fare embriyo mümkün deneysel manipülasyonlar, kültürlü hücre alt bağlılık ve hücre farklılaşmasında yerinde genetik manipülasyonlar etkisi sağlayan analizini vermekteyiz.
Giriş
Hücre kültürü yaygın gelişimsel biyoloji çalışmalarında kullanılmıştır. Fare Embriyonik kök hücreler (ESCs) ve epiblast kök hücreleri (EpiSCs), in vitro olarak her üç germ içine ayırt ve erken memeli embriyojenez hücre farklılaşması için faydalı bir model olarak olabilir. Bu hücre hatları türetilmesi in vitro manipülasyon ve erken embriyonik desenlendirme sırasında çalışan lokalize sinyal olaylar ve transkripsiyonel ağların ayrıntılı inceleme için bir fırsat açtı. Bununla birlikte, bu kültürde gerçekleştirilen herhangi bir manipülasyon in vivo belirlemek üzere önemli olmaya devam etmektedir. Preimplantasyon embriyo kaynaklı fare EKH in vivo potansiyel preimplantasyon embriyoları (morulları veya blastosist) 1 geri tanıtarak değerlendirilmiştir. Ancak, İmplantasyon embriyolar epiblast hücreleri temsil EpiSCs preimplantasyon embriyoları 2,3 verimli entegre olamaz. Bizim oncekiBize bulgular İmplantasyon embriyolar 4 içine aşılı zaman EpiSCs verimli kimeralar oluşturmak ve tüm germ katkıda bulunabileceğini göstermiştir. Bu nedenle, in vitro kültürlenmiş hücrelerin değerlendirilmesi için en iyi yol, in vivo olarak karşılık gelen temel alanlarına tanıtmaktır.
Elektroporasyon, in vivo ve in vitro deneylerde, hem hedef hücrelere ekzojen molekülleri salıvermek için yaygın olarak kullanılan bir yöntemdir. Elektrik enerjisi dışsal deoksiribonükleik asit (DNA) ya da hücrelere girmek için ribonükleik asit (RNA) sağlar hücre zarı, gözeneklerin sayıda oluşturabilir. Bu tekniğin en büyük zorluklardan biri yüksek electrotransfection verimlilik 5,6 ile optimum hücre canlılığını birleştirmektir. Embriyonik dokularda nükleik asitlerin elektroporasyon için, altın, geniş bir aralıkta mekansal 7-9 hücre hedefleme sağlayan, elektrotlar en sık kullanılmış olan kaplama. Daha loca elde etmek içinlized gen transferi, iğne şeklindeki elektrod fokal elektrik alanı 10,11 elde etmek için kullanılmıştır. Bu yöntemi kullanarak, yazarlar elektroporasyon sonra yaklaşık 30-60 hücre 11 DNA yapısının içine alınır gösterdi. Bununla birlikte, doğru elektroporate edilmiş hücrelerde sayısını ayarlayarak sabit genişlikli elektrot ile zor kalır gibi görünmektedir. Kılcal elektroporasyon tekniği tek hücre 12-14 kadar plazmidler teslim etmek için kullanılır olmuştur. Ancak, bu teknik ex vivo embriyolar için plasmidlerin electroporating uygulanan edilmemiştir. Daha yakın bir zamanda, erken mikrovasıta İmplantasyon Fare embriyolarında 15 lokal olarak electroporate birkaç uzak organ endoderm hücreleri (en az 4 hücreleri) olarak bildirilmiştir. Ancak bu cihaz verimli ektoderm hedef ve ex vivo mesodermi edip hala bilinmemektedir.
Bu çalışmada, erken sonrası hücresel ve gen fonksiyonunu değerlendirmek için iki yeni yöntemleri tarif-implantation embriyolar. Biz ilk in vivo potansiyelini değerlendirmek için erken fare embriyoları tanımlanan sitelerine in vitro kültür hücreleri greft nasıl gösterilmektedir. Aşılı hücreleri ve onların soyundan entegrasyonu, tüm genetik etiketi (örneğin, yeşil floresan protein (GFP) etiketli, ayrıca doku spesifik proteinlerin immün tarafından muayene edilebilir 4. İkincisi, biz tam DNA teslim geliştirilmiş bir yöntem tarif Bunun yerine, bir iğne şekilli elektrot kullanarak daha elektroporasyon ile embriyo lokalize sitelere., bir ince uçlu bir cam boru içinde ince bir tel yerleştirilir ve bu değişiklik, yüksek verimlilik ve sınırlı sayıda hücre az sayıda DNA teslim edebilir göstermek hücre ölümü. Ayrıca, biz farklı açılış boyutları ile cam kapilerleri kullanarak, biz Electroporated hücrelerinin sayısını kontrol olduğunu göstermektedir. Bu nedenle, o bu yöntem küçük sayılar içeren erken embriyonik desenlendirme incelemek için büyük bir kullanım olabilir inanıyorumf hücreler.
Protokol
Hayvanlar (Bilimsel Usul) 'de belirtilen tüm hayvan deneyleri Proje Lisans numarası 60/4435 altında İngiltere Home Office Yönetmeliği uyarınca (1986) Yasası gerçekleştirilmiştir. Belirli gelişim aşamalarında embriyolar toplamak için, zaman aşımına çiftleşmelerin O / N kuruldu. Vajinal fişi bulma günü Noon embriyonik gün (E) 0.5 belirlenmiştir.
1. Ex Vivo Kültür E7.5 veya E8.5 Postimplantation Embriyolar Kesme
- Servikal dislokasyon ile hamile kadın fareler kurban.
- Forseps ile tutarak, makas kullanarak rahim yalıtmak ve M2 ortamı ile dolu bir 30 mm çanak yerleştirin.
- Dikkatle ince forseps iki çift kullanarak myometriumu parçalıyorlar.
- Extraembryonic boşlukları delinme için dikkatli olmak, desidua uzakta soyun.
- Forseps ile sıkıştırdıktan ve yavaş yavaş embriyo ayrılarak Reichert membran kaldırmak.
- Diseksiyon altında embriyolar Kontrolstereomikroskopta yolk kesesi, amniyon ve ectoplacental koni bozulmamış olduğundan emin olmak için.
- Buz üzerinde 30 mm plastik Petri kabı kapağı üzerine ('buz platformu') kısmen soğuk embriyolar bir pipet ve yer kullanarak M2 temiz bir çanak embriyolar aktarın.
- Eğer gerekirse, fazla 1,5 saat boyunca bir buz platformu, örneğin., Ortam hazırlanması veya küçük gruplar halinde manipülasyonu sırasında M2 mağaza embriyolar ~ oda sıcaklığında 3-4 embriyolar.
Not: kurtarma ve kemirgen embriyoların diseksiyon önce 7,8,16 detaylı bir şekilde tarif edilmiştir.
2. Embriyo Kültürü Orta hazırlayın
- Taze ticari olarak temin edilebilen sıçan serumu, ya çözülme (özellikleri için Glanville Jones ve ark., 13 bakınız) ya da sıçan serum ısı 56 ° C'de 30 dakika süre ile inaktive edilmiş ve 1 ml donmuş Copp ve Cockroft 16 uyarınca in-house hazırlanmıştır -80 ° C'de tümbölenler
Not: Piyasada satılan sıçan serum kabul edilebilir Serum in-house hazırlanan rağmen 24-36 saat kültür dönemleri için, 48 saat kadar kültür dönemleri için üstün tecrübemizle, içinde. - Taze bir fazlalığı hazırlamak (ör., 10 mi) Glasgow Minimum Essential Medium (GMEM),% 1 esansiyel olmayan amino asitler (NEAA), 2mM L-glutamin, 1 mM sodyum piruvat içeren tanımlanmış takviyeleri.
- Kültüre olacak her aşamasının embriyo sayısına göre gerekli kültür ortamına hacmini hesaplayın (Bölüm 3). % 50 kültür ortamının telafi etmek için tanımlanmış takviyeleri ile sıçan serumu karıştırın (1: 1 (h / h) sıçan serum: tanımlanan katkı) ve / veya% 75 kültür ortamı (3: 1 (hacim / hacim) sıçan serum Tanımlanmamış takviyeleri).
- 0.45 um'lik bir filtreden embriyo kültür ortamı geçmek ve 10.000 IU / ml penisilin ve 10 ug / ml streptomisin ekleyin.
Not: Taze çözülmüş L-glutamin ve sodyum piruvat solüsyonu ex vivo kültür sırasında embriyonun gelişimi için çok önemlidir.
- 24 saat boyunca 37 ° C'de hava içinde% 5 CO2 ile birlikte, bir kuluçka makinesi içinde 4 oyuklu plakalar kullanılarak statik kültürü: E7.5 embriyolar için. 1 ml% 50 kültür ortamında oyuk başına iki embriyolar kültürü.
- E8.5 embriyo için: 24 saat (embriyo başına 1 mi,% 50 kültür ortamı) 37 ° C'da hava içinde% 5 ile CO2 sürekli gazlama içeren 35 devir / dakika ile dönen bir silindir, kültür cihazı 8 kullanın.
- E9.5 embriyolar için: 24 saat (1 ml 75% 'si kültür ortamı için 35 devirde 37 ° C'de,% 5 CO2,% 40 O 2% 55 N2 ile birlikte / dakika içeren gazlar döner bir silindir kültür cihazı kullanın embriyo).
Not: 3 saat içinde Kültür embriyoların olumsuz gelişimini etkileyen M2 uzun süreli olarak fareler euthanizing sonra. Ex vivo embriyo kültürü yöntemi COPP'un ve Cockroft 16 Bkz.
4. GraftinE7.5 veya E8.5 Fare embriyolara g Kültürlenmiş hücreler
- Fiziksel bir 20-200 ul pipet kullanarak 6-kuyu kültür plaka yayg GFP ifade EpiSCs, kazıma ve embriyoları içeren bir 30 mm çanak koyun
Not: embriyolarda hücre kümeleri eklemek için, hücreler fiziksel hurdaya yerine tripsinize edilmelidir. - Ağız pipet yapmak için aspiratör borusuna bir el çekti aşılama kılcal takın.
- Yavaşça aşılama kılcal içine boyutta bir veya daha fazla hücre kümeleri> 20 hücreleri çizmek için ağız pipet emmek.
- Yavaşça kısmen büyük öbekler dağıtmak için, hücrelerin dışarı üflemek.
- Kılcal açılması yakın tutarak, ~ 10-20 hücre içeren bir hücre yığın seçin ve tekrar aşılama kılcal içine emmek. Ve defalarca kılcal dışına hücre yığın taşımak için dikkatli olun, küçük parçalar halinde break-up önlemek için.
- Forseps bir çift ile yerine gevşek embriyo tutun ve aşılama eklemekilgi bölgeye kılcal bir açıklık oluşturmak için.
- Yavaşça embriyo ettiler 10-20 hücrelerinin kısa bir dize bırakarak, aşılama kılcal dışarı tutam sınırdışı.
- Embriyo istenilen sayıda aşılama işlemi tekrarlayın. Kolaylık için 3-4 embriyo parti büyüklüklerini kullanın.
- Aşırı ışık ve ısı embriyoların maruz kalmasını önlemek için minimumda görüntüleme süresi tutarak, M2 ortamı, görüntünün kamera ile mikroskop diseksiyon bir floresan bileşik kullanılarak aşılı embriyolar aynı çanak embriyolar bırakmak.
Not: Bu kamera ve bir mikroskop gibi florofor doğası ve floresan yoğunluğuna özelliklerine bağlıdır gibi deneysel görüntüleme kez saptayın. - M2 orta minimal hacimde bir pastette embriyo transfer kültür ortamı (Bölüm 3) hemen görüntüleme sonrası dengeye önceden etmek.
Not: dikkatlice aşılama sonrası embriyoların morfolojisini incelemek. Intac Sadece kültürt embriyolar.
5. El yapımı Elektroporasyon Malzemeler ve Cihazlar Kurulum (Elektroporasyon Deneylerin Advance ardından hazırlayın):
- DNA enjeksiyonu pipetler için: Yatay mikropipet çektirmenin kullanılarak DNA enjeksiyon pipetler çekin. Enjeksiyon pipetler embriyonik boşlukların içine DNA enjekte, doku hasarı önlemek için bir açıklık 10 um'den daha ile iyi bir uca sahip olmalıdır.
- Cam kılcal elektroporasyon için: 20 ya da 30 um ya da bir iç çapa DNA enjeksiyonu pipetler açılmasını kesmek için microforge kullanın. Kılcal elektroporasyon için embriyo ile temas halinde olduğu zaman hücresel hasar görmesini önlemek için, cam kapiller ucu temiz değil keskin, kırık kenarlar ihtiva kesmek gerekir.
- Yapımı kılcal elektrot (anot) (Şekil 1) için: seçecek odaklanmak için 20 ya da 30 um çaplı bir sabit bir açıklık ile bir elektroporasyon cam boru içine 0.2 mm çapında platin tel takmakGeçerli ric ve embriyo ilgi küçük bir bölgeye plazmid DNA teslim.
- Yapımı L-şeklinde elektrot (katot) (Şekil 1) için: "L" uzunluğu yaklaşık 1 mm yatay kısmı, bir "L" şekli oluşturan bir 0,2 mm çapında platin teli katlayın.
- İnce yalıtımlı tel her platin elektrot takın ve yalıtım bandı ile kaplı bir mikroenjeksiyon iğne tutucu takın.
- Standart mikromanipulasyon enstrüman sahipleri iğne tutucular monte edin.
- Şekil 1 'de gösterildiği gibi, devre bağlayın: güç kaynağı anoduna kapiler elektrot bağlamak; multimetre anoda L biçimli elektrot bağlamak; Güç kaynağının katot mulimeter katot bağlayın.
6. Elektroporasyon E7.5 veya E8.5 Fare Embriyolar
- Üst 1-2 mm içinde PBS ile elektroporasyon cam kapiller doldurun ve STRAI eklemekcam boru içine GHT platin elektrot (anot) bu kılcal dibine ulaşana kadar.
- PBS ile doldurulmuş bir 30 mm Petri kabı yüzeyine L-şekilli bir elektrodunu (katot) çapa.
- PBS dolu elektroporasyon çanak içine M2 ortamdan embriyo transfer.
- Embriyonun amniyon boşluğuna yanal epiblast iğne yerleştirin. Tamamen dolana kadar boşluğuna: Pnömatik piko pompası kullanılarak, DNA solüsyonu (GFP veya pCAG-GFP% 0,01, yeşil gıda boyası boya ile 1-1.5 mg / ml pCAG-Cre) enjekte edilir. E7.5-E8.5 embriyolar için, en az 5 ul DNA çözeltisi, bir embriyo için gereklidir. Bir göstergesi olarak, yeşil boya kullanarak, embriyo patlamaya dikkat edin.
- Dikkatle elektrotlar arasındaki embriyo konumlandırmak ve DNA teslim edilecek olan kesin yerlerine kılcal elektrodu taşımak.
Not: embriyo yönlenmesi DNA elektropore edilecek bölgeye bağlıdır. - ElectropoHer pals arasındaki 1 saniyelik bir aralık ile, 6 darbeleri 50 ms süre, her 200 volt (V) ile embriyo oranı.
- Embriyo transferi, elektroporasyon hemen sonra kültür ortamı önceden dengelenmiş. İsterseniz, bir sonraki embriyo için işlemi tekrarlayın.
Not: Steril bir kap içine kültür ortamı ekleyin ve orta ön dengelenmeye kültürü inkübatör koyun. - , Kültürden sonra electroporated hücreleri 2 saat tespit bir pastette kullanarak M2 ortamı temiz 30 mm Petri kabı embriyolar transfer etmek. Görüntü diseksiyon mikroskobu bir floresan bileşik kullanarak adım 5.9 olarak embriyolar.
- Görüntüleme hemen sonra pastette kullanarak kültürüne geri embriyolar transfer.
- Bir uzak-kırmızı hücre zan-geçirgen bir nükleer boya ile embriyolar leke, elektroporasyon ile neden olduğu ölü hücreleri saptamak için: elektroporasyon ile 10 dakika sonra 2 saat boyunca 37 ° C'de (1 embriyo kültür ortamı içinde 200) (isteğe bağlı)
- Embry düzeltmek, electroporated hücreleri saymak için4 ° C'de 2-4 saat süreyle% 4 paraformaldehid (PFA) os, bir ultraviyole ya da uzak-kırmızı floresan nükleer counterstain ve görüntünün bir konfokal mikroskop (İsteğe bağlı) kullanarak embriyolar ile çekirdeği leke.
Not: PBS içinde çok uzun süre bırakıldığında Embriyonik gelişme olumsuz yönde etkilenmektedir. Bu nedenle, her embriyo electroporate için harcanan zaman en aza indirecek (embriyo başına <5 dakika) emin olun.
Sonuçlar
Aşılama
Her yerde bulunan bir EGFP (mESCs in vitro türetilebilir E6.5 epiblast türetilen R04-GFP, ve C2), 4 ifade EpiSCs elle kültür kabı kazınır ve E7.5 embriyolar, farklı bölgelerde (Şekil 2A) aşılanmıştır. Embriyolar ex vivo kültive ve 24 saat sonra analiz edilmiştir. Donör hücrelerin dağılımı floresan mikroskobu ile değerlendirildi. Donör hücreleri dahil, bunlar çoğalmıştır ve bunların türevleri ana embriyoların (Şekil 2B) içinde dağıtılmış. Bu ana embriyoların (Şekil 2A, 2B ve) 'de etkili bir şekilde dahil 10-16 hücreleri ihtiva eden greftler, ancak, daha fazla hücre aşılama daha chimaerism neden olmadığı gözlenmiştir. Bunun yerine, aşılanmış hücreler adi kümeleri (Şekil 2C ve 2D) üretildi.
Elektroporasyon
Bir içinembriyo belirli sitelere: ssess bizim elektroporasyon sisteminin verimliliği, biz GFP ifade plazmidler (GFP pCAG-GFP ve pCAG-Cre) teslim etti. Bir önceki çalışmada 11 ile uyumlu olarak, GFP + hücreler embriyolar elektroporasyon (Şekil 2E ve 2G) sonra 1-2 saat tespit edildi. Geç ilkel çizgi sahne embriyo distal epiblast hücrelerinin elektropore edildiğinde, etiketli hücreler kültürde 24 saat (Şekil 2E ve 2F) sonra nöral ektoderm katkıda bulunmuştur. Bu sonuç gastrulasyon sahne embriyoların 17 epiblast hücrelerinin bilinen kaderi haritalarına iyi gelir. GFP ekspresyon plazmidi E8.5 (2-5 Somitlerin) ilkel çizgi elektroporasyona Benzer bir şekilde, GFP + hücreler geç Başlangıç çizgisinin 18 bilinen kaderi haritaları ile tutarlıdır paraksiyel mezoderm (Şekil 2G ve 2H), katkıda . Ayrıca, biz, Electroporated hücrelerden her üç germ (Şekil 2I-K) katkı gözlendielektroporasyon prosedürü, in vivo olarak, hücre davranışını ödün vermeyen düşündürmektedir. Ancak, biz de epiblast (E7.5) ya da ilkel çizgi hücreler (E8.5) hedeflenmiş iken, bazı endoderm hücreleri aynı zamanda (Şekil 3C ve Tablo 1) elektroporate fark ettim.
Bir kılcal elektrodu kullanılmasının önemli avantajlarından biri, elektroporate edilmiş hücrelerde sayısı sadece kendi açıklığın çapı değiştirilerek kontrol edilebilir olmasıdır. Elektroporasyona hücrelerin sayısını belirlemek için, embriyolar elektroporasyon sonra 2 saat sabit ve konfokal mikroskop wholemount olarak görüntülenmiştir. GFP + hücrelerinin sayısı el konfokal Z yığınlarının sayılmıştır. Tablo 1, bu daha fazla hücre DNA alımında 20 mikron ile 30 sonuçlardan cam kapiller açılış boyutunu artırarak belirli bir aşamaya, için. Tek bir açıklık boyutu (E8.5 karşı E7.5) aşamaları arasında karşılaştırıldığında, daha fazla hücre ikinci aşamada elektropore olduğu bulundu. Bu etki, E8.5 amniyotik boşluğunda bulunan DNA, daha yüksek bir konsantrasyona kadar bağlı olabilir. DNA solüsyonu yeşil gıda boyası ile karıştırılmış Çünkü, biz amniyotik boşluk DNA konsantrasyonu değerlendirmek için yeşil renk kullanabilirsiniz. Mikroskop, bu E8.5 embriyolar ile karşılaştırıldığında DNA enjeksiyonundan sonra yeşil renk E7.5 embriyoların boşluğu içinde daha hafif olduğunu, olduğu açıktır. DNA çözeltisi içinde aynı konsantrasyondaki E7.5 ve E8.5 embriyoların içine enjekte edildi, ancak daha fazla DNA çözüm, daha büyük boyutta olduğundan tamamen doldurmak için E8.5 embriyoların amniyotik boşluk içinde oldu. Enjeksiyon iğnesi geri çekilmesi sonrasında, her zaman amniyotik boşluk DNA çözeltisinin kaçak bir derece vardır ve delinme deliği önceki embriyolarda amniyotik kavite büyüklüğüne oranla daha büyük olduğundan, oransal olarak daha sızıntı olduğunu muhtemeldir daha düşük bir DNA konsantrasyonunun neden E8.5 embriyolar daha E7.5 gelen. Transfekte farklı sayıdaHücreler, farklı aşamalarda farklı hücre çap veya indüklenen transmembran voltajı (ITV) eşik nedeniyle olabilir.
Elektroporasyon bir dezavantajı, ilişkili hücre ölümüdür. Geleneksel altın benzer kaplama ya da iğne şekilli elektrotlar, bir kılcal elektrodu kullanılarak elektroporasyon hücre ölümüne neden olur. Elektroporasyondan sonra, hedeflenen bölgenin hücre ölümünün bir miktar, bu alanda oluşmuştur gerektiğini belirten, komşu bölgelerde (Şekil 3A ve 3B) ile karşılaştırıldığında daha koyu renkte ortaya çıktı. Daha da elektroporasyon prosedürü neden ölü hücrelerin sayısını belirlemek için, embriyolar bir flüoresan hücre zan-geçirgen bir nükleer boya ile boyanmıştır. Ölü hücrelerin çekirdekleri, bir zara-geçirmeyen uzak-kırmızı bir floresan boya ile etiketlenmiştir. Boyama Bu kılcal elektroporasyon tekniği sadece elektroporasyon alanının yakınında ölü hücreleri (Şekil 3D ve Ta az sayıda sonuçlanır doğruladıble 1).
Biz ölü hücreler elektroporasyon yerinde görünmesine rağmen, GFP + hücreler ve ölü hücreler de birbirlerine (Şekil 3E ve 3F'de) en seçkin olduğunu fark ettim. E8.5 kaudal yanal epiblast pCAG-GFP ve 20 um'den bir cam kılcal açıklık, GFP + hücreleri çok sayıda elektroporasyona Dahası, kültür içinde 48 saat (Şekil 3G ve 3H) sonra tespit edildi. Birlikte ele alındığında, bu sonuçlar en GFP + hücreler daha kültür sırasında hala canlı olan elektroporasyon sonra 2 saat tespit öneririz.
Biz 24 saat ex vivo kültürden sonra GFP + hücre sayısını attı. Altı embriyolar 20 um çaplı bir kapiler açıklığı kullanılarak, E7.5 de pCAG-GFP ile elektropore edildi. GFP + hücreler / embriyo tespit edildi 107 ± 31 (sd ortalama ±). Kültür (2 saat) başlangıcında bu yana, 9 hücreleri başına ortalama embriyo üzerinde elktroporatlandı ( trong> Tablo 1), bu hücreler, 2 saat elektroporasyona olan 3-4 bölümleri geçirmediğini ortaya koymaktadır. E8.5 embriyoların E7.5 saati iki katına ortalama hücre dışında ventral düğümde 19,20 olanlardan tüm hücrelerde 6-7 saattir. Bu elektroporasyon prosedürü normal hücre büyümesini engel olmadığını göstermektedir.
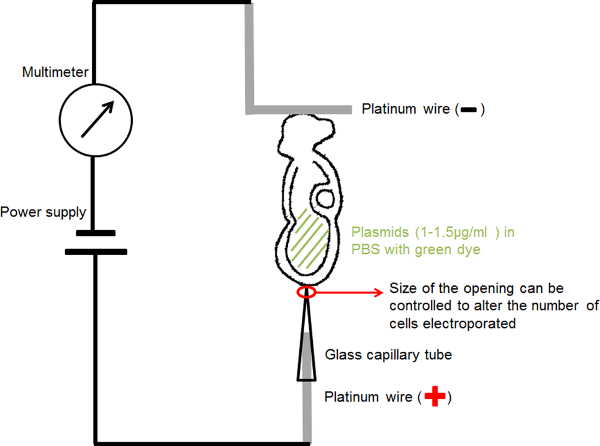
Elektroporasyon kurulumu gösteren Şekil 1. Devre şeması. Onun amniyotik boşluk içinde embriyo içeren DNA solüsyonu iki elektrot arasına yerleştirildi. Seçilen parametreler Cari bir kare dalga darbe jeneratörü (güç kaynağı) tarafından sağlandı. Bir multimetre embriyo geçen elektrik akımı algılamak için seri olarak bağlanmıştır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
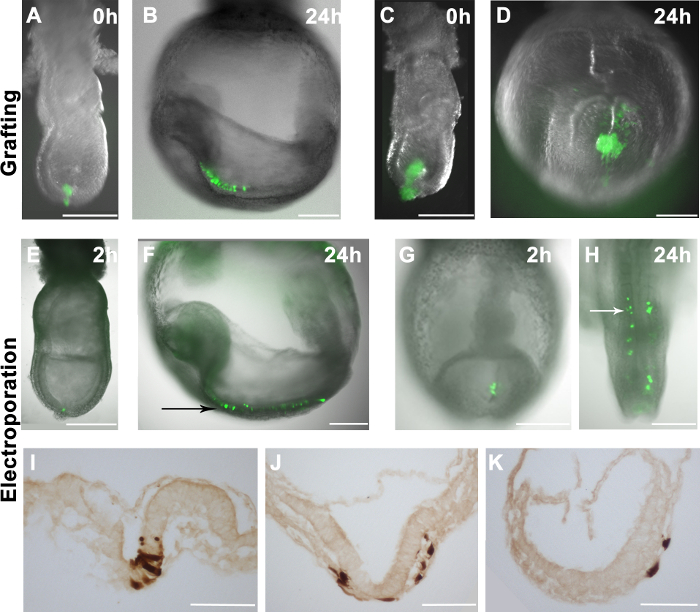
Şekil 2. konak embriyolar aşılı veya Electroporated hücrelerin dağılımı. Wholemount embriyoların (gri tonlama) (A) aydınlık görüntüleri (AH) GFP floresan bindirmeleri (yeşil) 10-16 GFP + EpiSCs geç distal bölgeye aşılanmış -streak aşamasındaki embriyo. (C), GFP + EpiSCs daha büyük bir tutam bir orta çizgi evresindeki embriyonun uzak bölgesi içine aşılanmıştır. (B ve D) 'de gösterilen bir ev sahibi embriyolar EpiSCs türetilmiş hücreler (yeşil) dağılımını ( A ve kültür 24 saat sonra C). donör hücrelerinin doğru entegrasyon öne konak embriyo içinde dağılmış (B) GFP + hücreleri. (D) Aşılama daha büyük hücre kümeleri ev sahibi embriyo adi topak oluşumu ile sonuçlandı. (EK) pCAG-Cre: GFP plazmid ele Yabanitip embriyoların belirli alanlara ctroporated. Bir erken tomurcuk aşamalı bir embriyoya (E) ya da hücre gruplarının 2-5 aşamalı bir embriyoya (G) Başlangıç çizgisinin uzak bölge electroporating 2 saat işlemden sonra, bu bölgelerde GFP + hücreleri sonuçlandı. (F ve H) kültür içinde 24 saat sonra ana embriyoların GFP + hücrelerinin dağılımı, Elektroporasyona tabi tutulan hücreler nöroektoderm (siyah ok) katkıda bulunduğunu gösteren (F) ve paraksiyel mezoderm (beyaz ok) (lH). (TK) Elektroporasyona tabi tutulan hücreler nöroektoderm (I) ortaya çıkmasına neden olabilir gösteren GFP + hücreleri için DAB imüno mezoderm (J) ve kültür 24 saat sonra endoderm (J ve K). Ölçek çubuğu (AH) = 250 mikron; Ölçek çubuğu (IK), 100 mikron =. Not: Şekil 1A ve 1B önceki yayının 4 yeniden basıldı edilir.= "https://www.jove.com/files/ftp_upload/53295/53295fig2large.jpg" target = "_ blank" href> bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
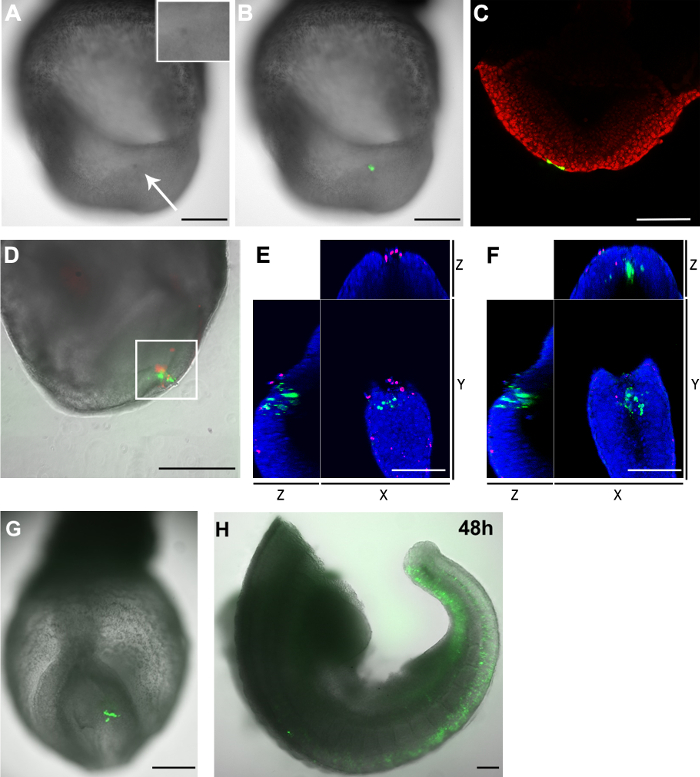
GFP + hücreleri ve elektroporasyon sonra embriyolar ölü hücrelerin Şekil 3. Dağılımı (AC) pCAG-Cre. GFP plazmidi, bir E8.5 kaudal yan epiblast hücrelerine elektroporasyon (2-5 hücre gruplarının aşama) embriyo (kapiler açıklık büyüklüğü :. 20 mikron) (A) 2 saat işleminden sonra, hedeflenen bölge embriyonun diğer bölgelerine kıyasla koyu renk (beyaz ok) gösterdi. Ankastre Elektroporasyona bölgenin büyütülmüş bir halini göstermektedir. (B) aydınlık görüntü (gri tonlama) içinde elektroporasyona tabi hücreler (yeşil) gösteren yeşil flüoresan kanalı ile kaplanmış. (C) konfokal z dilimli gösterenKuyruk yanal epiblast hücreleri hedef alındı, iki endoderm hücreleri (yeşil) da plazmid aldı. . Hücre çekirdekleri (DF) pCAG-Cre kırmızı ile gösterilmiştir: GFP plazmidi, bir E8.5 embriyo düğümün kaudal elektroporasyona (kapiler açıklık büyüklüğü: 30 um). Embriyo 2 saat kültürlendi. Elektroporasyona tabi tutulan hücreler, kırmızı ve yeşil ölü hücreleri gösterilmektedir. (D) içinde elektroporasyona tabi alanı GFP + hücrelerin yanı sıra ölü hücreleri hem de içerir. Beyaz kutu bölge ayrıca bir konfokal mikroskop analiz edilmiştir. Z-yığınının Manuel sayma 33 GFP + hücreler ve bu alanda 23 ölü hücreler olduğunu göstermiştir. Sadece iki hücre her iki fluorophores için olumlu hem de vardı. (E ve F) GFP + hücreler ölü hücreleri ayrıdır gösteren D beyaz kutulu bölgeden bir konfokal z-dilim XYZ görünümü. Çekirdekleri mavi gösterilmiştir (G ve H) pCAG-Cre. GFP plazmidi, bir kaç hücre içine elektropore edildiBir E8.5 embriyo kaudal yanal epiblast LS (kapiler açıklık büyüklüğü: 20 um) ve iki (G) ve 48 (H) saat ex vivo kültür Not sonra görüntülü: (H) embriyo kültürü sonra, iki kesildi. Baş ve kalp bölgeleri çıkarıldı. Ölçü bar (A, B, D, G ve H) = 250 um; Ölçek çubuğu (C, E ve F) = 100 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| Kılcal tüpün açıklığının çapı | Embriyo evresi | Elektroporasyon verimliliği: hayır. 2h / toplam sonra GFP + hücreleri içeren embriyolar. ve electroporated embriyolar (no. 24 veya 48 saat kültürden sonra normal gelişti + embriyolar GFP) | Sd ± embriyo başına GFP ortalama sayısı + hücreler (n = no. Incelenen embriyoların) | No.Sd ± her embriyo başına GFP + endodermal hücreleri (n = no. Incelenen embriyoların) |
| 20 um | E7.5 (LS-LB) | 7/9 (7) | 9 ± 3 (n = 4) | 4 ± 2 (n = 4) |
| 30 um | E7.5 (LS-LB) | / 15 (12) 13 | 17 ± 2 (n = 4) | 6 ± 1 (n = 4) |
| 20 um | E8.5 (2-5 Somitlerin) | / 13 (10) 12 | 21 ± 4 (n = 4) | 11 ± 4 (n = 4) |
| 30 um | E8.5 (2-5 Somitlerin) | 02/02 (2) | 33 ve 26 (n = 2) | 14 ve 16 (n = 2) |
PCAG-Cre Tablo 1. Elektroporasyon verimliliği: fare embriyoları GFP plazmid.
Kısaltma: LS geç ilkel çizgi sahne; LB: Geç tomurcuk sahne. Embriyolar göre sahnelenirÇıkışlar ve Davies 12
Tartışmalar
Aşılama
Hücre aşılama deneyleri için kritik bir adım küme parçalanmasına önlemek için, ideal olarak tek bir eylem hücrelerin tutarlı bir dize ekleme olduğunu. Bu teknik ağız pipet kontrol bazı pratik gerektirir. Donör hücreleri konak içinde de dahil ise, bunların türevleri, embriyodaki dağılacaktır. Daha dağılmış donör türetilen hücreleri konak içinde uygun bir şekilde ayırt olup olmadığını belirlemek için, imüno embriyo bölümleri üzerinde gerçekleştirilebilir. Donör hücreleri konak ortamı ile uyumlu değilse, onlar da tespit (onlar embriyo kovulan gibi) ya da kültürden sonra embriyolar adi öbekler şeklinde olamaz. Dağınık hücreler ve hücre kümeleri hem gözlendi, bu o çok hücre aşılandı gösterebilir ve çevresindeki konak hücreleri ile etkileşime olamaz aşırı donör hücreleri yığın oluşumuna neden olmuştur. Bu durumda, ek greft içerenhücrelerin daha küçük bir sayıda tekrar yapılabilir.
Hücre aşılama tekniğinin en önemli sınırlaması uzun 48 saat elde edilmemiştir dönemler üzerinde fare ex vivo kültür beri hücrelerin tam in vivo potansiyelini belirlemek mümkün olmadığıdır. Ultrason eşliğinde hücre enjeksiyonu ile birlikte, ancak, bu uterus embriyo kültürlenmiş hücreleri transferi mümkün olabilir. Hücre aşılama deneyleri yaygın grubumuza kullanılmıştır ve bize çeşitli hücre tipleri 4,21,22 in vivo potansiyeli hakkında değerli ipuçları verdik, Özetlemek gerekirse. Erken İmplantasyon embriyoların in vitro kültürlenmiş hücrelerin in vivo potansiyelinin değerlendirilmesi için genel yarar için bir tekniktir.
Elektroporasyon
Bu çalışmada biz sadece göstermiştir rağmen ben, epiblast hedef kılcal elektroporasyon tekniği kullanmak etkili olduğunut kasıtlı örneğin endoderm hücreleri gibi diğer germ hedeflemek de mümkündür. Kılcal elektroporasyon tekniği için kritik bir adım PBS erken fare embriyoları için çok yetersiz kaldığı bu yana her embriyo (embriyo başına <5 dakika) electroporate için harcanan zaman en aza indirmektir. Bizim verilerimiz Yukarıdaki embriyolar çoğu alanlarda, elektroporasyon embriyo gelişimini etkilemez göstermiştir. Ancak, düğüm elektroporasyon anormal gelişimi sebep ve embriyonun erken ölümüne yol açtı. Bu, önemli bir sinyal merkezleri 23 oluşturan hücrelerin hasarının ya da ölümünün muhtemeldir. Bu nedenle, bu bölge, bu teknik ile kaçınılması gerekir. Bir başka uyarı sonuçları bölümünde belirtildiği gibi epiblast veya ilkel çizgi hücreleri hedeflenen iken, bazı endoderm hücreleri de electroporated olmasıdır. DNA epiblast epitelin altında boşluklardan endoderm ulaşır, çünkü bu olabilir. Endoderm epitel hücrelerden oluşan ve inci bizim deneyim olduğunuese hücreler DNA'yı almak için daha yüksek bir eğilime sahip. Kader haritalama için bu tekniği uygularken, bu nedenle, başlangıçta DNA'yı aldığı hücrelerin değerlendirilmesi önemlidir.
GFP plazmidler verimli çalışmaya gösterilen elektroporasyon parametreleri kullanılarak teslim edilebilir, diğer DNA konstruktları etkinliği değişebilir ve tek tek optimizasyon gerekebilir: Ayrıca pCAG-GFP ve pCAG-Cre, ancak not edilmelidir. Plazmidler transfekte etmek zor olduğu tespit edilmesi halinde, DNA konsantrasyonu, elektroporasyon gerilim veya vurum sayısı değişiklikler yapılabilir.
Sınırlı hücre ölümü ile embriyo çok az hücre içine GFP plazmidler: Özetlemek gerekirse, bizim optimize kılcal elektroporasyon sistemi verimli ve tekrarlanabilir GFP veya Cre sunabilirsiniz. Bu yöntem pahalı ya da çok özel ekipman gerektirmez yana, hücre izleme çalışmaları için veya ektopik ifade veya koşullu silme o etkisini test büyük kullanım olabilirerken embriyolar f genler durumunda elektroporasyon floxed koşullu mutant alelleri taşıyan embriyolarda gerçekleştirilir. Bu nedenle, bu elektroporasyon tekniği lokalize yabani tip oluşum safhasındaki ortamları, bir hücre tarafından hücre bazında hücre iç faktörlerin rol anlamak için yararlı bir fonksiyonel bir araç sağlar.
Açıklamalar
The authors have no conflicts of financial or other interest to declare.
Teşekkürler
We thank Filip Wymeersch and Anestis Tsakiridis for comments on the manuscript, staff in the SCRM animal unit for help with animal maintenance and Prof. Stuart Forbes for immunohistochemistry reagents. This work was supported by MRC grant Mr/K011200/1 and the China Scholarship Council
Malzemeler
| Name | Company | Catalog Number | Comments |
| Forceps | Dumostar | T5390 | |
| Dissecting stereomicroscope | Zeiss | Stemi 2000-C | |
| Stereomicroscope system with fluorescence | Nikon | AZ100 | |
| Inverted microscope with a digital camera | Olympus | Olympus BX61 | |
| Inverted confocal microscope | Leica Microsystems | Leica TCS SP8 | |
| Low melting point agarose | Life Technologies | 16520-050 | |
| Pasteur pipettes | Fisher Scientific | 11397863 | |
| 30mm Petri dishes | Fisher Scientific | 121V | |
| 4-well plates | Thermo scientific | 179820 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Phosphate Buffered Saline (PBS) | Life Technologies | 10010015 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | P6148 | |
| Pipettes | NICHIRYO | Nichipet | |
| tips | Greiner Bio One | 685280 | |
| Cell culture incubator | SANYO | MCO-17AIC | |
| Roller culture apparatus | BTC Engineering | ||
| Syringe filters 0.45µm, sterile | Sigma-Aldrich | 10462100 | |
| Glasgow Minimum Essential Medium (GMEM) | Sigma-Aldrich | G5154 | |
| non-essential amino acids (NEAA) | Life Technologies | 11140050 | |
| L-glutamine | Fisher Scientific | SH30549.01 | |
| Sodium pyruvate solution | Fisher Scientific | SH30239.01 | |
| Penicillin and Streptomycin 10.000UI/ml | Lonza | DE17-602E | |
| Gas Cartridge for Portable Meker Burner | COLEMAN | COLEMAN 250 | |
| Thin Wall Borosilicate Capillary Glass with Fillament, OD 1.0 mm, ID 0.78 mm | Harvard Apparatus | 640798 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma-Aldrich | A5177-5EA | |
| Flaming/Brown micropipette puller | Sutter Instrument Company | P-97 | |
| Microforge | De Fonbrune | BS030301 | |
| Pneumatic pico pump | World Precision Instruments | PV830 | |
| Microloader tips | Eppendorf | 5242956.003 | |
| ECM 830 square wave pulse generator | BTX | 45-0002 | |
| Green food coloring dye | Sigma-Aldrich | C.I. 42053 | |
| A far-red cell membrane-impermeable nuclear dye | Biotium | 40060-T | |
| pCAG-Cre:GFP | Addgene | #13776 | |
| pCAG-GFP | Addgene | #16664 | |
| Multimeter | Excel | XL830L | |
| Micromanipulators | Leitz | ||
| 0.2mm diameter platinum wire | Agar Scientific | E404-2 | |
| Anti-GFP antibody | Abcam | ab13970 | |
| Goat anti-Chicken IgY, HRP | Santa Cruz | sc-2428 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3467 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Life Technologies | D21490 | |
| A far-red fluorescence nuclear counterstain | Life Technologies | T3605 |
Referanslar
- O'Hagan, A. R., Morton, R., Eid, N. Loss of asthma control in pediatric patients after discontinuation of long-acting Beta-agonists. Pulmonary med. , 894063 (2012).
- Brons, I. G., et al. Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature. 448, 191-195 (2007).
- Tesar, P. J., et al. New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature. 448, 196-199 (2007).
- Huang, Y., Osorno, R., Tsakiridis, A., Wilson, V. In Vivo differentiation potential of epiblast stem cells revealed by chimeric embryo formation. Cell rep. 2, 1571-1578 (2012).
- Sadik, M. M., et al. Scaling relationship and optimization of double-pulse electroporation. Biophys. J. 106, 801-812 (2014).
- Kaestner, L., Scholz, A., Lipp, P. Conceptual and technical aspects of transfection and gene delivery. Bioorg. Med. Chem. Lett. , (2015).
- Soares, M. L., Torres-Padilla, M. E., Zernicka-Goetz, M. Bone morphogenetic protein 4 signaling regulates development of the anterior visceral endoderm in the mouse embryo. Dev. Growth Differ. 50, 615-621 (2008).
- Pierreux, C. E., Poll, A. V., Jacquemin, P., Lemaigre, F. P., Rousseau, G. G. Gene transfer into mouse prepancreatic endoderm by whole embryo electroporation. JOP. 6, 128-135 (2005).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7, 107 (2007).
- Davidson, B. P., Tsang, T. E., Khoo, P. L., Gad, J. M., Tam, P. P. Introduction of cell markers into germ layer tissues of the mouse gastrula by whole embryo electroporation. Genesis. 35, 57-62 (2003).
- Khoo, P. L., Franklin, V. J., Tam, P. P. Fate-Mapping Technique: Targeted Whole-Embryo Electroporation of DNA Constructs into the Germ Layers of Mouse Embryos 7-7.5 Days Post-coitum. CSH protocols. 2007. , pdb.prot4893 (2007).
- Tawk, M., Bianco, I. H., Clarke, J. D. Focal electroporation in zebrafish embryos and larvae. Methods Mol Biol. 546, 145-151 (2009).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70, 148-154 (2002).
- Nolkrantz, K., et al. Electroporation of single cells and tissues with an electrolyte-filled capillary. Anal. Chem. 73, 4469-4477 (2001).
- Mazari, E., et al. A microdevice to locally electroporate embryos with high efficiency and reduced cell damage. Development. 141, 2349-2359 (2014).
- Copp, A. J., Cockroft, D. L. . Postimplantation mammalian embryos : a practical approach. , (1990).
- Tam, P. P., Behringer, R. R. Mouse gastrulation: the formation of a mammalian body plan. Mech. Dev. 68, 3-25 (1997).
- Wilson, V., Beddington, R. S. Cell fate and morphogenetic movement in the late mouse primitive streak. Mech. Dev. 55, 79-89 (1996).
- Tzouanacou, E., Wegener, A., Wymeersch, F. J., Wilson, V., Nicolas, J. F. Redefining the progression of lineage segregations during mammalian embryogenesis by clonal analysis. Dev Cell. 17, 365-376 (2009).
- Bellomo, D., Lander, A., Harragan, I., Brown, N. A. Cell proliferation in mammalian gastrulation: the ventral node and notochord are relatively quiescent. Dev. Dynam. 205, 471-485 (1996).
- Tsakiridis, A., et al. Distinct Wnt-driven primitive streak-like populations reflect in vivo lineage precursors. Development. 141, 1209-1221 (2014).
- Gouti, M., et al. In vitro generation of neuromesodermal progenitors reveals distinct roles for wnt signalling in the specification of spinal cord and paraxial mesoderm identity. PLoS biology. 12, e1001937 (2014).
- Beddington, R. S. Induction of a second neural axis by the mouse node. Development. 120, 613-620 (1994).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır