Method Article
Methoden für die genau zu lokalisieren Übertragung von Zellen oder DNA in frühen Postimplantations Maus Embryonen
In diesem Artikel
Zusammenfassung
We demonstrate a method for grafting cultured cells into defined sites of early mouse embryos to determine their in vivo potential. We also introduce an optimized electroporation method that uses glass capillaries of known diameter, allowing the precise delivery of exogenous DNA into a few cells in the embryos.
Zusammenfassung
Manipulation und Kultur der frühen Maus-Embryonen ist eine leistungsstarke und dennoch weitgehend ausgelastet Technologie Steigerung des Werts von diesem Modellsystem. Umgekehrt Zellkultur wurde in großem Umfang in der Entwicklungsbiologie Studien verwendet. Es ist jedoch wichtig, festzustellen, ob in vitro kultivierten Zellen wirklich in vivo Zelltypen zu repräsentieren. Pfropfen Zellen in Embryonen, gefolgt von einer Bewertung ihrer Beteiligung bei der Entwicklung ist eine nützliche Methode, um das Potential von in vitro kultivierten Zellen zu bestimmen. In dieser Studie beschreiben wir ein Verfahren zum Pfropfen von Zellen in einem definierten Ort der frühen Postimplantationsmausembryonen, gefolgt von der ex vivo-Kultur. Außerdem stellen wir einen optimierten Elektroporationsmethode, die Glaskapillaren verwendet bekanntem Durchmesser, die eine genaue Lokalisierung und Anpassung der Anzahl von Zellen Empfangen exogene DNA sowohl mit hohen Transfektionseffizienz und niedrige Zelltod. Diese Techniken, die keine sp erfordernecialized Geräte, übertragen experimentelle Manipulationen der Gastrulation und frühen Organogenese stufigen Mausembryo möglich, kann Analysen Einsatz in kultivierten Zellpopulationen und die Wirkung der genetischen Manipulationen in situ auf die Zelldifferenzierung.
Einleitung
Zellkultur wurde in großem Umfang in der Entwicklungsbiologie Studien verwendet. Embryonalen Stammzellen der Maus (WSR) und Epiblast-Stammzellen (EpiSCs) kann in alle drei Keimblätter in vitro zu differenzieren und sind ein nützliches Modell für die Zelldifferenzierung in der frühen Säugetierembryogenese. Die Ableitung dieser Zelllinien wurde eine Chance für in-vitro-Manipulation und detaillierte Untersuchung der lokalisierten Signalwege und Transkriptions Netzwerke, die während der frühen embryonalen Musterbildung eröffnet. Jedoch bleibt es wichtig, die in vivo Relevanz der Manipulationen in der Kultur durchgeführt bestimmen. Die In-vivo-Potenzial der Präimplantationsdiagnostik Embryonen gewonnenen Maus WSR hat durch die Einführung sie zurück in Präimplantationsembryonen (Morulae oder Blastozysten) 1 bewertet. Allerdings EpiSCs, die die Epiblastzellen in Postimplantationsembryonen darstellen kann nicht effizient in Präimplantationsembryonen 2,3 integrieren. Unsere previouns Erkenntnisse haben gezeigt, dass EpiSCs effizient zu erzeugen, Chimären und dazu beitragen, den Keimblättern, wenn sie in der Implantation Embryonen 4 gepfropft. Daher ist der beste Weg, um die in vitro gezüchtete Zellen zu bewerten, um sie in ihre entsprechenden Umgebung in vivo einzuführen.
Elektroporation ist ein weit verbreitetes Verfahren, um exogene Moleküle in Zielzellen sowohl in vivo und in vitro-Experimenten zu liefern. Elektrische Energie kann eine große Anzahl von Poren in der Zellmembran, die exogene Desoxyribonukleinsäure (DNA) oder Ribonukleinsäure (RNA), um die Zellen eintreten kann generieren. Eine der größten Herausforderungen für diese Technik ist es, eine optimale Lebensfähigkeit der Zellen mit hoher Effizienz Elektrotransfektion 5,6 kombinieren. Für die Elektroporation von Nukleinsäuren in embryonalem Gewebe, vergoldete Elektroden am häufigsten verwendet worden, so dass Targeting von Zellen in einem breiten Raumbereich 7-9. Um eine loca erreichenlized Gentransfer, eine nadelförmige Elektrode wurde verwendet, um eine Brenn elektrischen Feldes 10,11 zu erzielen. Unter Verwendung dieses Verfahrens zeigten die Autoren, dass nach der Elektroporation 30-60 Zellen hatte die DNA aufgenommen konstruieren 11. Dennoch scheint es, daß genau Anpassung der Anzahl der elektroporierten Zellen nach wie vor schwierig mit fester Breite Elektrode. Die Kapillare Elektroporation Technik wurde verwendet, um Plasmide zu einzelnen Zellen 12-14 zu liefern. Jedoch hat diese Technik nicht für die Elektroporation von Plasmiden, Embryonen ex vivo angewendet. In jüngerer Zeit hat eine Mikrovorrichtung lokal elektroporieren wenige distalen visceralen Entodermzellen (weniger als 4 Zellen) in der frühen Postimplantationsmausembryonen 15 gemeldet. Es ist jedoch noch nicht bekannt, ob dieses Gerät effizient Ziel Ektoderm und Mesoderm ex vivo.
In dieser Studie beschreiben wir zwei neue Verfahren zur zellulären und Gen-Funktion in der frühen Post bewerten-Implantation Embryonen. Wir zuerst zeigen, wie man in vitro kultivierten Zellen in definierten Stellen in der frühen Mausembryonen zu pfropfen, um ihre in-vivo-Potenzial zu bewerten. Die Integration der transplantierten Zellen und deren Nachkommen, die alle durch eine genetische Markierung (beispielsweise ein grün fluoreszierendes Protein (GFP) markiert sind, können durch Immunfärbung von Gewebe spezifische Proteine untersucht werden. 4 Zweitens beschreiben wir ein verbessertes Verfahren, um genau zu liefern DNA lokalisierte Stellen in den Embryo mittels Elektroporation. Anstatt eine nadelförmige Elektrode, legten wir einen dünnen Draht in einem spitzen Glaskapillare, und zeigen, dass diese Modifikation kann die DNA auf eine kleine Zahl von Zellen mit hoher Effizienz und begrenzte liefern Zelltod. Darüber hinaus zeigen wir, dass durch die Verwendung von Glaskapillaren mit unterschiedlichen Öffnungsgrößen, können wir die Anzahl der elektroporierten Zellen zu steuern. Deshalb glauben wir, diese Methode kann von großem Nutzen sein, um frühen embryonalen Musterbildung Studie mit kleinen Zahlen of Zellen.
Protokoll
Alle Tierversuche wurden in Übereinstimmung mit britischen Innenministeriums Ordnung unter Projektlizenznummer 60/4435 durchgeführt wie in den Animals (Scientific Procedures) festgelegten Gesetz (1986). Embryonen in bestimmten Entwicklungsstufen zu sammeln, wurden zeitlich Paarung bis O / N eingestellt. Uhr am Tag der Suche nach einer vaginalen Pfropfen wurde Embryonaltag (E) 0,5 bezeichnet.
1. Grundlagen zur Zeit E7.5 oder E8.5 Implantation Embryonen für die ex vivo Kultur
- Opfern die schwangere weibliche Mäuse durch Genickbruch.
- Isolieren Sie die Gebärmutter mit einer Schere, hielt sie mit einer Pinzette und legen Sie in einem 30 mm-Schale mit M2 Medium gefüllt ist.
- Vorsichtig zerreißen das Myometrium mit zwei Paaren von feinen Pinzette.
- Abziehen der Decidua, darauf achten, daß die extra Hohlräumen durchstechen.
- Entfernen Sie die Reichert-Membran durch Quetschen sie mit einer Pinzette und langsam trennt sie vom Embryo.
- Überprüfen Sie die Embryonen unter einem PräpariermikroskopStereomikroskop, um sicherzustellen, dass der Dottersack, Amnion und ectoplacental Konus intakt sind.
- Übertragen Sie die Embryonen auf eine saubere Schüssel M2 mit einer Pipette und auf ein 30 mm Kunststoff-Petrischale Deckel auf Eis (das "Eis-Plattform ') teilweise Chill Embryonen.
- Falls erforderlich, speichern Embryonen in M2 auf einem Eis-Plattform für bis zu 1,5 Stunden, z. B. während der Medienherstellung oder die Manipulation von Kleinserien von ~ 3-4 Embryonen bei RT.
Hinweis: Wiederherstellung und Dissektion der Nagetier-Embryonen im Detail zuvor 7,8,16 beschrieben.
2. Bereiten Sie die Embryokulturmedium
- Frisch tauen entweder im Handel erhältlichen Rattenserum (siehe Glanville-Jones et al. 13 für Daten) oder Rattenserum in-house nach Copp und Cockroft 16, die Wärme wurde für 30 min inaktiviert bei 56 C in 1 ml eingefroren vorbereitet Aliquots bei -80 ˚C
Hinweis: Im Handel erhältliches Rattenserum akzeptabel Kulturzeiten von 24-36 h, obwohl Serum in-house hergestellt ist, in unserer Erfahrung, eine überlegene Kultur für Zeiträume von bis zu 48 Stunden. - Frisch Vorbereitung eines Überschusses (z. B. 10 ml) von definierten Nahrungsergänzungsmittel, die aus Glasgow Minimum Essential Medium (GMEM), 1% nicht-essentiellen Aminosäuren (NEAA), 2 mM L-Glutamin und 1 mM Natriumpyruvat.
- Berechnen Sie das Volumen des Kulturmediums, die je nach der Anzahl der Embryonen von jeder Stufe, die gehen zu kultiviert werden, erforderlich ist (siehe Abschnitt 3). Mischen Sie die Rattenserum mit den definierten Ergänzungen machen 50% Kulturmedium (1: 1 (v / v) Rattenserum: definiert Ergänzungsmittel) und / oder 75% Kulturmedium (3: 1 (V / V) Rattenserum: definiert Ergänzungen).
- Übergeben Sie die Embryokulturmedium durch ein 0,45 um-Filter und fügen Sie 10.000 IE / ml Penicillin und 10 ug / ml Streptomycin.
Anmerkung: frisch aufgetauten L-Glutamin und Natriumpyruvat Lösung ist entscheidend für die Entwicklung des Embryos während der ex vivo-Kultur.
- Für E7.5 Embryonen: statische Kultur unter Verwendung von 4-Well-Platten in einem Inkubator mit 5% CO 2 in Luft bei 37 ° C für 24 h zugeführt. Kultur bis zu zwei Embryonen pro Vertiefung in 1 ml 50% Kulturmedium.
- Für E8.5 Embryonen: Verwenden Sie ein Rollergeräte 8 Drehen bei 35 U / min Einbeziehung kontinuierlichen Begasung mit 5% CO 2 in Luft bei 37 ° C während 24 Stunden (1 ml 50% Kulturmedium pro Embryo).
- Für E9.5 Embryonen: Verwenden Sie ein Rollergeräte bei 35 Umdrehungen Dreh mit 5% CO 2, 40% O 2 55% N 2 bei 37 ° C zugeführt / min Einbeziehung Gasen für 24 Stunden (1 ml von 75% Kulturmedium pro Embryo).
Hinweis: Kultur Embryonen innerhalb von 3 Stunden nach der euthanizing die Mäuse als längere Zeiträume in M2 Entwicklung nachteilig beeinflussen. Siehe Copp und Cockroft 16 für das Verfahren der ex vivo Embryokultur.
4. Grafting kultivierten Zellen in E7.5 oder E8.5 Maus Embryonen
- Körperlich kratzen EpiSCs, die ubiquitär GFP exprimieren, aus einer 6-Well-Kulturplatte mit einem 20-200 ul Pipettenspitze und legen Sie sie in einem 30 mm-Schale mit den Embryonen
Hinweis: Um Zellklumpen in den Embryonen einzusetzen, sollten die Zellen physikalisch statt verschrottet Trypsin behandelt werden. - Befestigen Sie eine handgezogen Pfropfen Kapillare zu dem Ansaugrohr, eine Mund-Pipette zu machen.
- Saugen Sie vorsichtig den Mund Pipette auf eine oder mehrere Zellklumpen von der Größe> 20 Zellen in den Pfropfen Kapillare zu ziehen.
- Vorsichtig ausblasen die Zellen, um große Klumpen teilweise zu dispergieren.
- Wählen Sie einen Zellklumpen enthält ~ 10-20 Zellen und saugen in die Pfropfen Kapillare wieder, indem sie es in der Nähe der Öffnung der Kapillare. Achten Sie darauf, um die Zellklumpen in die und aus der Kapillare wiederholt zu bewegen, Break-up in kleinere Stücke zu vermeiden.
- Halten Sie den Embryo lose an Ort und Stelle mit einer Pinzette und legen Sie die PfropfenKapillare in dem interessierenden Bereich eine Öffnung zu schaffen.
- Die Klumpen vorsichtig zu vertreiben aus dem Pfropfen Kapillare, so dass die kurze Kette von 10-20 Zellen im Embryo eingereicht.
- Wiederholen Transplantation Verfahren für die gewünschte Anzahl von Embryonen. Verwenden Chargengrößen von 3-4 Embryonen für die Bequemlichkeit.
- Verlassen Embryonen in der gleichen Gericht aus M2-Medium, Bild die veredelten Embryonen mit Hilfe eines Fluoreszenzverbindung Binokular mit Kamera, halten Abbildungszeit auf ein Minimum, um die Exposition der Embryonen zu hohe Licht und Hitze zu vermeiden.
Anmerkung: Bestimmen Aufnahmezeiten empirisch, da diese von den technischen Daten der Kamera und Mikroskop sowie der Art und der Fluoreszenzintensität des Fluorophors ab. - Übertragen des Embryos in einem pastette mit einem minimalen Volumen von M2-Medium auf voräquilibriert Kulturmedium (siehe Abschnitt 3) unmittelbar nach der Bilderzeugung.
Hinweis: die Morphologie der Embryonen Sorgfältig prüfen nach der Transplantation. Nur Kultur der INTACt Embryonen.
5. Handmade Elektroporation Materialien und Geräte-Setup (Bereiten Sie die folgenden im Vorfeld der Elektroporation Experimente):
- Für die DNA-Spritzen Pipetten: Ziehen DNA-Spritzen Pipetten unter Verwendung einer horizontalen Mikropipette Abzieher. Spritzen Pipetten sollten eine feine Spitze haben mit einer Öffnung von weniger als 10 & mgr; m zu Gewebeschäden bei der Injektion von DNA in den embryonalen Hohlräumen zu vermeiden.
- Für Glaskapillare Elektroporation: Verwenden Sie ein Mikroschmiede, um die Öffnung der DNA-Spritzen Pipetten zu einem Innendurchmesser von entweder 20 oder 30 & mgr; m geschnitten. Zellschäden zu vermeiden, wenn die Kapillare in Kontakt mit der Embryo zur Elektroporation, muss die Spitze der Glaskapillare sauber geschnitten und enthält scharfe Bruchkanten werden.
- Für handgemachte Kapillare Elektrode (Anode) (Abbildung 1): Legen Sie eine 0,2 mm Durchmesser Platindraht in eine Elektroporation Glaskapillare mit einer festen Öffnung 20 oder 30 & mgr; m Durchmesser, um die Auserwählten zu konzentrierenric Strom und liefern die Plasmid-DNA in einem kleinen Bereich von Interesse in dem Embryo.
- Für handgemachte L-förmigen Elektrode (Kathode) (Abbildung 1): biegen, eine 0,2 mm Durchmesser Platindraht Schaffung einer "L" -Form, mit dem horizontalen Teil des "L" in der Umgebung von 1 mm in der Länge.
- Befestigen Sie jede Platinelektrode mit einer dünnen isolierten Draht und fügen diesen in einer Mikroinjektionsnadelhalter durch Isolierband abgedeckt.
- Montieren Sie die Nadelhalter auf Standard-Mikromanipulation Instrumentenhalter.
- Der Stromkreis wird, wie in Abbildung 1 dargestellt: eine Verbindung der Kapillare Elektrode an die Anode der Stromversorgung; Verbinden der L-förmigen Elektrode an die Anode des Multimeters; verbinden die Kathode der mulimeter mit der Kathode der Stromversorgung.
6. Die Elektroporation E7.5 oder E8.5 Maus Embryonen
- Füllen Sie die Elektroporation Glaskapillare mit PBS in ca. 1-2 mm von oben und legen Sie die straiGHT Platinelektrode (Anode) in die Glaskapillare bis er den Boden der Kapillare erreicht.
- Anker die L-förmige Elektrode (Kathode), die auf der Oberfläche einer 30 mm Petrischale mit PBS gefüllt.
- Übertragen Sie den Embryo aus M2-Medium in das PBS-gefüllten Elektroporation Gericht.
- Legen Sie die Injektionsnadel aus seitlichen Epiblast in die Amnionhöhle des Embryos. Mit Hilfe eines pneumatischen pico Pumpe, injizieren DNA-Lösung (pCAG-Cre: GFP oder pCAG-GFP 1-1,5 ug / ml mit 0,01% grüne Lebensmittelfarbe Farbstoff) in den Hohlraum, bis er vollständig gefüllt ist. Für E7.5-E8.5-Embryonen, ist kleiner als 5 & mgr; l DNA-Lösung für einen Embryo erforderlich. Unter Verwendung der grünen Farbstoff als Indikator, achten Sie darauf, um den Embryo platzen.
- Vorsichtig Position des Embryos zwischen den Elektroden und bewegen Sie die Kapillare Elektrode an den genauen Ort, wo die DNA zu liefern ist.
Hinweis: Die Ausrichtung des Embryos ist abhängig von der Region, in der die DNA elektroporiert werden. - ElectropoBewerten des Embryos unter Verwendung von 200 Volt (V) in 6 Pulse, jeder von 50 ms Dauer mit einem 1 sec Intervall zwischen jedem Impuls.
- Übertragen Sie die Embryo voräquilibriert Kulturmedium unmittelbar nach der Elektroporation. Falls gewünscht, wiederholen Sie den Vorgang für die nächste Embryo.
Hinweis: Fügen Sie das Kulturmedium in einen sterilen Behälter und legen Sie sie in der Kulturbrutschrank vor, ins Gleichgewicht des Mediums. - Um nach der Kultur erkennen elektroporierten Zellen 2 h, übertragen Sie die Embryonen auf eine saubere 30 mm Petrischale von M2 Medium unter Verwendung eines pastette. Bild die Embryonen wie in Schritt 5.9 mit Hilfe eines Fluoreszenzverbindung Binokular.
- Übertragen Sie die Embryonen wieder in Kultur unter Verwendung eines pastette unmittelbar nach der Bildgebung.
- Um tote Zellen durch Elektroporation verursacht werden, färben die Embryonen mit einem weitErythrozytenMembran undurchlässig Kernfarbstoff (1: 200 in Embryokulturmedium) bei 37 ° C für 10 min 2 h nach der Elektroporation (Optional)
- Um die elektroporierten Zellen zu zählen, fixieren Sie die embryos in 4% Paraformaldehyd (PFA) für 2-4 h bei 4 ° C, zu Verschmutzung des Ringes mit einem ultravioletten oder fernen Rot fluoreszierende Kerngegenfärbung und Bild die Embryos unter Verwendung eines konfokalen Mikroskops (Optional).
Hinweis: Embryonale Wachstum wird beeinträchtigt, wenn zu lange in PBS. Daher sicherstellen, daß die Zeit, die jeder Embryo elektroporieren minimiert wird (<5 min pro Embryo).
Ergebnisse
Pfropfung
EpiSCs die ubiquitär exprimieren EGFP (r04-GFP aus E6.5 Ektoderm abgeleitet und C2, die in vitro aus mESCs abgeleitet) 4 manuell von der Kulturschale abgeschabt und in verschiedene Stellen von E7.5-Embryonen (2A) gepfropft. Die Embryonen wurden ex vivo kultiviert und nach 24 Stunden analysiert. Die Verteilung von Spenderzellen wurde durch Fluoreszenzmikroskopie beurteilt. Wenn Spenderzellen aufgenommen, vermehren sie und ihre Derivate innerhalb der Host-Embryonen (2B) dispergiert. Es wurde beobachtet, daß Transplantate enthalten 10-16 Zellen effizient in den Wirts Embryonen (2A und 2B) eingearbeitet, jedoch Pfropfung mehrere Zellen nicht in besseren chimaerism führen. Stattdessen erzeugt transplantierten Zellen unincorporated Klumpen (2C und 2D).
Elektroporation
Einssess die Effizienz unserer Elektroporationssystem lieferten wir GFP-exprimierenden Plasmiden (pCAG-GFP und pCAG-Cre: GFP) auf bestimmte Websites im Embryo. In Übereinstimmung mit einer früheren Studie 11 wurden GFP + Zellen in Embryonen nachgewiesen 1-2 Stunden nach der Elektroporation (2E und 2G). Wenn distalen Epiblastzellen am späten Primitivstreifen Stadium Embryos wurden durch Elektroporation, trugen markierten Zellen zu neuronalen Ektoderm nach 24 Stunden in Kultur (Abbildung 2E und 2F). Dieses Ergebnis entspricht auch den bekannten Schicksal Karten Epiblastzellen in Gastrulation Embryonen 17. Ähnlich wird, wenn das GFP-Expressionsplasmid wurde in Primitivstreifens an E8.5 (2-5 Somiten) elektroporiert, GFP + -Zellen zu paraxialen Mesoderms (2G und 2H), im Einklang mit bekannten Schicksal Karten der späten Primitivstreifens 18 beigetragen . Außerdem beobachteten wir, Beitrag zu allen drei Keimschichten aus elektroporierten Zellen (2I-K),was darauf hindeutet, dass die Elektroporation Verfahren nicht das Zellverhalten in vivo beeinträchtigen. Allerdings haben wir auch festgestellt, dass, während Epiblast (E7.5) oder Primitivstreifen Zellen (E8.5) wurden gezielte, einige Entodermzellen wurden elektroporiert (3C und Tabelle 1).
Einer der Hauptvorteile der Verwendung eines Kapillar-Elektrode ist, daß die Anzahl der elektroporierten Zellen gesteuert werden kann, einfach durch Ändern des Durchmessers der Öffnung aus. Um die Anzahl der elektroporierten Zellen zu bestimmen, wurden die Embryos 2 Stunden nach der Elektroporation fixiert und in Wholemount auf einem konfokalen Mikroskop abgebildet wird. Die Anzahl der GFP + -Zellen wurde manuell in den konfokalen z-Stapel gezählt. Tabelle 1 zeigt, dass für eine bestimmte Stufe, wodurch die Öffnungsgröße der Glaskapillare 20 bis 30 & mgr; m führt zu DNA-Aufnahme durch mehrere Zellen. Wenn eine einzelne Öffnungsgröße zwischen Stufen (E7.5 gegen E8.5) verglichen wird, wurden mehr Zellen gefunden, um in einer späteren Stufe der Elektroporation werden. Dieser Effekt kann durch eine höhere Konzentration an DNA, die in der Amnionhöhle zu E8.5 sein. Weil die DNA-Lösung wurde mit dem grünen Lebensmittelfarbstoff gemischt werden, kann man die grüne Farbe zu verwenden, um die DNA-Konzentration in der Amnionhöhle zu beurteilen. Im Mikroskop, ist es klar, dass, wenn sie mit E8.5-Embryonen verglichen wird, ist die grüne Farbe nach der DNA-Injektion in den Hohlraum des E7.5-Embryonen viel leichter. Obwohl die gleiche Konzentration an DNA-Lösung wurde in E7.5 und E8.5-Embryonen injiziert, war mehr DNA-Lösung in der Amnionhöhle von Embryos E8.5, um es vollständig zu füllen, weil sie in der Größe größer sind. Nach dem Zurückziehen der Injektionsnadel, gibt es immer eine gewisse Leckage der DNA-Lösung aus der Amnionhöhle und da das Einstichloch ist im Vergleich zu der Größe der Amnionhöhle früher Embryonen größer ist, ist es wahrscheinlich, dass es proportional mehr Leck von E7.5 als E8.5 Embryonen, die zu einem niedrigeren DNA-Konzentration. Die unterschiedliche Anzahl transfizierterZellen können auch durch die unterschiedlichen Durchmesser oder induzierten Transmembranspannung (ITV) Schwellen der Zellen in den verschiedenen Phasen ist.
Ein Nachteil der Elektroporation ist die zugehörige Zelltod. Ähnlich wie die traditionellen vergoldet oder nadelförmigen Elektroden, die Elektroporation unter Verwendung eines Kapillar-Elektrode veranlasst den Zelltod. Nach der Elektroporation erschien der Zielregion in der Farbe dunkler im Vergleich zu benachbarten Regionen (3A und 3B), was anzeigt, dass ein gewisser Grad des Zelltods ist in diesem Bereich aufgetreten ist. Die Anzahl der toten Zellen durch das Elektroporationsverfahren verursacht wird, weiter zu bestimmen, wurden die Embryos mit einem fluoreszierenden Zellmembran undurchlässige Kernfarbstoff gefärbt. Die Kerne der toten Zellen mit einer membran undurchlässigen fernen Rot-Fluoreszenz-Farbstoff markiert. Die Färbung bestätigt, dass diese Kapillare Elektroporationstechnik bewirkt nur eine kleine Anzahl von toten Zellen in der Nähe der Elektroporation Website (3D und Table 1).
Uns ist aufgefallen, dass, obwohl abgestorbenen Zellen an der Elektroporation Website erscheinen, sind auch GFP + -Zellen und toten Zellen exklusivsten voneinander (Abbildung 3E und 3F). Wenn darüber hinaus der Schwanzseiten Epiblasts bei E8.5 wurde mit pCAG-GFP und einer Glaskapillare Öffnung von 20 um, eine große Zahl von GFP + -Zellen elektroporiert wurde nach 48 Stunden in Kultur (Figur 3G und 3H) detektiert. Zusammengenommen legen diese Ergebnisse nahe am GFP + -Zellen nachgewiesen 2 h nach der Elektroporation sind noch lebensfähig bei der weiteren Kultur.
Wir hat die Anzahl der GFP + -Zellen nach 24 Stunden ex vivo Kultur. Sechs Embryos wurden mit pCAG-GFP bei E7.5 elektroporiert, mit einer Kapillaröffnung von 20 um Durchmesser. 107 ± 31 (Mittelwert ± Standardabweichung) GFP + Zellen / Embryos festgestellt wurden. Da zu Beginn der Kultur (2 h) wurden 9-Zellen im Durchschnitt pro Embryo elektroporiert ( trong> Tabelle 1), bedeutet dies, dass elektroporierten Zellen unter 3-4 Spaltungen innerhalb 2 Stunden. Der durchschnittliche Zellverdopplungszeit von E7.5 bis E8.5-Embryonen ist etwa 6-7 h in allen Zellen mit Ausnahme derjenigen, in der ventralen Knoten 19,20. Dies legt nahe, dass die Elektroporation Verfahren nicht das normale Zellwachstum zu behindern.
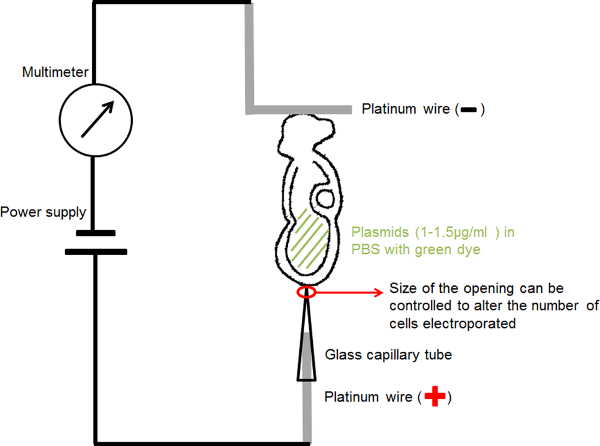
Abbildung 1. Schaltungsdiagramm der Elektroporation Setup. Der Embryo enthaltenden DNA-Lösung in ihrer Amnionhöhle wurde zwischen den beiden Elektroden angeordnet ist. Strom bei den gewählten Parametern wurde durch eine Rechteckimpulsgenerator (Netzteil) zur Verfügung gestellt. Ein Multimeter in Serie, um den elektrischen Strom, der den Embryo zu detektieren. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
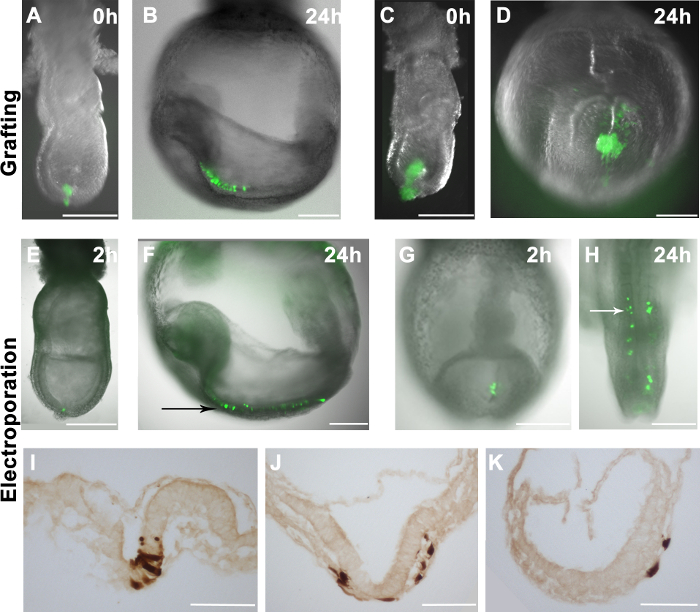
Abbildung 2. Die Verteilung der gepfropften oder elektroporierten Zellen in Wirts Embryonen. (AH) GFP-Fluoreszenz Overlays (grün) auf Hellfeld Bilder Wholemount Embryonen (Graustufen) (A) 10-16 GFP + EpiSCs wurden in den distalen Bereich einer späten gepfropften -streak Stadium Embryo. (C) Eine größere Klumpen von GFP + EpiSCs wurde in den distalen Bereich einer Halbserie Stadium Embryos gepfropft. (B und D) Die Verteilung der EpiSCs abgeleiteten Zellen (grün) in den Host-Embryonen (in gezeigt A und C) nach 24 Stunden in Kultur. (B) GFP + -Zellen in den Wirtsembryo dispergiert, was auf korrekte Integration der Spenderzellen. (D) Pfropfen größeren Zellklumpen in Folge nicht eingebauten Klumpenbildung in den Wirtsembryo. (EK) pCAG-Cre: GFP-Plasmid ele in bestimmten Bereichen des Wildtyp-Embryonen ctroporated. Elektroporation den distalen Bereich eines frühen Knospenstadium Embryo (E) oder des Primitivstreifens eines 2-5 Somiten Stadium Embryos (G) führte zu GFP + -Zellen in diesen Regionen zu 2 Stunden nach dem Eingriff. (F und H) die Verteilung von GFP + -Zellen in den Wirtsembryos nach 24 Stunden in Kultur und zeigt, daß elektroporierten Zellen tragen zur Neuroektoderm (schwarzer Pfeil) (F) und paraxialen Mesoderms (weißer Pfeil) (H). (IK) DAB Immunfärbung für die GFP + -Zellen zeigt, daß die elektroporierten Zellen Vorrücken in Neuroektoderm (I) geben kann, Mesoderm (J) und Endoderm (J und K) nach 24 Stunden in Kultur. Maßstabsbalken (AH) = 250 & mgr; m; Maßstabsbalken (IK) = 100 um. Hinweis: 1A und 1B aus unserer früheren Veröffentlichung 4 abgedruckt.href = "https://www.jove.com/files/ftp_upload/53295/53295fig2large.jpg" target = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
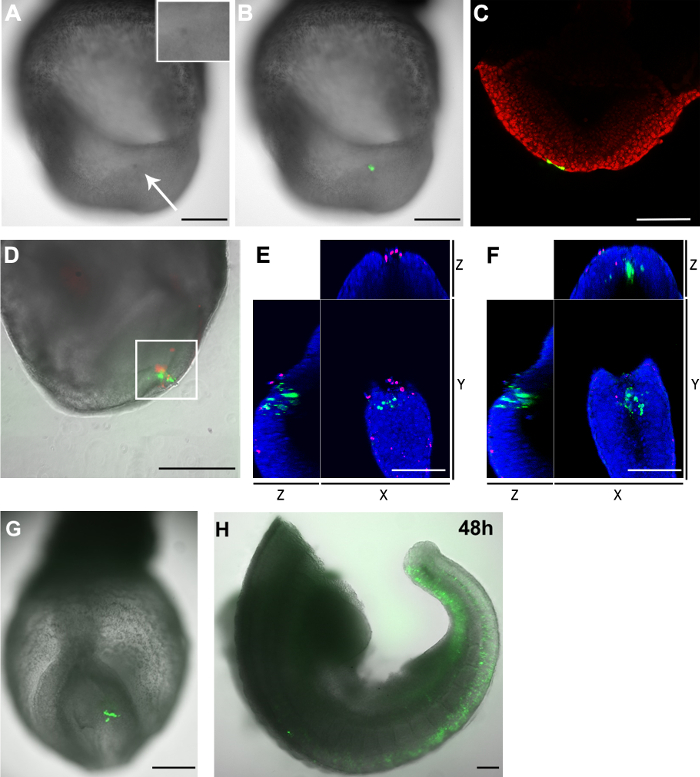
Abbildung 3. Verteilung der GFP + -Zellen und toten Zellen in den Embryonen nach der Elektroporation (AC) pCAG-Cre:. GFP-Plasmid in die Schwanzseiten Epiblastzellen eines E8.5 elektroporiert (2-5 Somiten-Stadium) Embryo (Kapillaröffnung Größe :. 20 um) (A) 2 h nach der Behandlung zeigte die Zielregion eine dunkle Farbe (weißer Pfeil) im Vergleich zu anderen Teilen des Embryos. Einschub zeigt eine Vergrößerung der Elektroporation Region. (B) Bildhellfeld (Graustufen) überlagert mit dem grün fluoreszierenden Kanal, der die elektroporierten Zellen (grün). (C) Ein konfokales z-Scheibe zeigt, dasszwei Entodermzellen (grün) nahm auch das Plasmid, wenn die Schwanzseiten Epiblastzellen wurden gezielt. . Die Zellkerne werden in Rot (DF) pCAG-Cre gezeigt: GFP-Plasmid wurde in der kaudalen Seite des Knotens eines E8.5 Embryo elektroporiert (Kapillaröffnung Größe: 30 um). Der Embryo wurde 2 Stunden lang kultiviert. Elektroporierten Zellen sind grün und tote Zellen rot dargestellt. (D) Die Elektroporation Bereich sowohl GFP + Zellen sowie tote Zellen enthält. Der Bereich, in dem weiße Box wurde in einem konfokalen Mikroskop analysiert. Manuelles Zählen der z-Stapel zeigte, dass es 33 GFP + -Zellen und 23 toten Zellen in diesem Bereich. Nur zwei Zellen waren sowohl für beide Fluorophore positiv. (E und F) XYZ Ansicht eines konfokalen z-Scheibe von der weißen Box Region D, welche GFP + -Zellen getrennt von den toten Zellen sind. Die Zellkerne sind blau dargestellt (G und H) pCAG-Cre:. GFP-Plasmid wurde in einigen cel elektroporiertls im kaudalen Seiten Epiblast eines E8.5 Embryonen (Kapillaröffnung: 20 & mgr; m) und abgebildet nach zwei (G) und 48 (H) Stunden ex vivo Kultur Hinweis: (H) Der Embryo wurde in zwei nach der Kultur getrennt. Kopf und Herz Regionen wurden entfernt. Maßstabsbalken (A, B, D, G und H) = 250 um; Maßstabsleiste (C, E und F) = 100 & mgr; m. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
| Durchmesser der Öffnung des Kapillarrohrs | Embryonalstadium | Elektroporation Effizienz: nein. Embryonen GFP + Zellen nach 2h / gesamte Anzahl enthält. der Elektroporation Embryonen (Nr. GFP + Embryonen, die in der Regel nach 24 oder 48 Stunden-Kultur entwickelt) | Durchschnittliche Anzahl der GFP + -Zellen pro Embryo ± Standardabweichung (n = Nr. Der untersuchten Embryonen) | Anzahl derGFP + endodermalen Zellen pro jedem Embryo ± Standardabweichung (n = Nr. Der untersuchten Embryonen) |
| 20 um | E7.5 (LS-LB) | 7/9 (7) | 9 ± 3 (n = 4) | 4 ± 2 (n = 4) |
| 30 um | E7.5 (LS-LB) | 13/15 (12) | 17 ± 2 (n = 4) | 6 ± 1 (n = 4) |
| 20 um | E8.5 (2-5 Somiten) | 12/13 (10) | 21 ± 4 (n = 4) | 11 ± 4 (n = 4) |
| 30 um | E8.5 (2-5 Somiten) | 2/2 (2) | 33 und 26 (n = 2) | 14 und 16 (n = 2) |
Tabelle 1 Electroporation Effizienz pCAG-Cre: GFP-Plasmid in Maus-Embryonen.
Abkürzung: LS, spät Primitivstreifen Stufe; LB: späten Knospenstadium. Die Embryonen werden nach inszeniertDowns und Davies 12
Diskussion
Pfropfung
Der entscheidende Schritt für die Zelltransplantation Experimenten ist das Einfügen eines zusammenhängenden Reihe von Zellen im Idealfall in einer einzigen Aktion, um Zerfall der Klumpen zu vermeiden. Diese Technik erfordert etwas Übung, bei der Kontrolle der Mundpipette. Wenn Spenderzellen übernehmen und in der Host, wird deren Derivate im Embryo zu zerstreuen. Um weiter zu bestimmen, ob die dispergierten Donor abgeleiteten Zellen differenzieren in geeigneter Weise in den Wirt können die Immunfärbung auf den Embryo Abschnitten durchgeführt werden. Wenn Spenderzellen nicht mit dem Host-Umgebung kompatibel ist, sie entweder nicht erkannt werden kann (wie sie aus dem Embryo ausgestoßen) oder bilden nicht eingebauten Klumpen in den Embryonen nach Kultur. Wenn beide dispergierten Zellen und Zellklumpen wurden beobachtet, kann dies darauf hinweisen, dass zu viele Zellen wurden gepfropft und übermäßige Spenderzellen, die nicht mit umgebenden Wirtszellen in Wechselwirkung treten können in Folge Klumpenbildung. In diesem Fall müssen zusätzliche Transplantate enthalteneine geringere Anzahl von Zellen durchgeführt werden.
Die Haupteinschränkung der Zellen Pfropftechnik ist, dass es nicht möglich ist, die vollständige in vivo Potential von Zellen, da Maus ex vivo Kultur über einen längeren Zeitraum als 48 Stunden nicht erreicht worden zu bestimmen. Wenn jedoch mit ultraschallgesteuerten Zellinjektion kombiniert wird, kann es möglich sein, kultivierten Zellen der Embryos in utero zu übertragen. Um zusammenzufassen, Zelltransplantation Experimente sind weit verbreitet in unserer Gruppe verwendet und haben uns wertvolle Hinweise auf die In-vivo-Potenzial der verschiedenen Zelltypen 4,21,22 gegeben. Es ist eine Technik allgemein anwendbar, um die in vivo Potential von in vitro gezüchteten Zellen in der frühen Postimplantationsembryonen beurteilen.
Elektroporation
Obwohl in dieser Studie haben wir nur gezeigt haben, dass es effizienter, die Kapillare Elektroporation Technik zu verwenden, um das Epiblast Ziel, it ist ebenfalls möglich, absichtlich Ziel anderen Keimschichten wie Entodermzellen. Der entscheidende Schritt für die Kapillare Elektroporation Technik ist es, die Zeit für jedes Embryos (<5 min pro Embryo) elektroporieren minimieren, da PBS ist sehr nachteilig für die frühe Mausembryonen. Obige hat unsere Daten zeigen, dass in den meisten Bereichen in der Embryonen, Elektroporation keinen Einfluss auf die Embryowachstum. Jedoch Elektroporation im Knoten verursachte abnormale Entwicklung und führte zum vorzeitigen Tod des Embryos. Dies ist aufgrund einer Beschädigung oder zum Tod der Zellen, die wichtige Signalstellen 23 bilden wahrscheinlich. Daher würden diese Region müssen bei dieser Technik vermieden werden. Ein weiterer Nachteil ist, dass, wie in der Ergebnisse Abschnitt erwähnt, während Epiblast oder Primitivstreifen Zellen wurden gezielt einige Entodermzellen wurden elektroporiert. Dies kann sein, weil DNA erreicht Endoderm durch Spalten unter dem Ektoderm Epithel. Endoderm aus Epithelzellen besteht und in unserer Erfahrung these Zellen haben eine höhere Neigung zur Aufnahme DNA. Deshalb wird, wenn die Anwendung dieser Technik zum Schicksal Mapping, ist es wichtig zu ermitteln, welche Zellen zunächst aufnehmen DNA.
Es sei auch bemerkt, dass, obwohl pCAG-GFP und pCAG-Cre werden: GFP Plasmide können effizient unter Verwendung der in dieser Studie gezeigt Elektroporationsparameter geliefert werden kann, kann die Effizienz anderer DNA-Konstrukte variieren kann und keine individuelle Optimierung. Veränderungen in der DNA-Konzentration, die Elektroporation Spannung oder der Anzahl von Impulsen kann gemacht werden, wenn Plasmide werden als schwierig zu transfizieren sind.
Zusammenfassend kann unsere verbesserte kapillare Elektroporation System effizient und reproduzierbar liefern GFP oder Cre: GFP Plasmide in sehr wenigen Zellen im Embryo mit begrenzter Zelltod. Da diese Methode nicht teuer oder hoch spezialisierte Ausrüstung erfordern, kann es von großem Nutzen für die Zell Tracking-Studien oder bei der Prüfung der Auswirkungen der ektopische Expression oder bedingte Löschen o seinf Gene in frühen Embryonen, wird, wenn die Elektroporation in Embryonen mit floxed bedingte mutierten Allelen durchgeführt. Daher bietet diese Elektroporationstechnik eine nützliche funktionelle Werkzeug für das Verständnis auf einer Zelle-für-Zelle-Basis die Rollen von zell intrinsischen Faktoren im Zusammenhang mit der Wildtyp-embryonalen lokalisierten Umgebungen.
Offenlegungen
The authors have no conflicts of financial or other interest to declare.
Danksagungen
We thank Filip Wymeersch and Anestis Tsakiridis for comments on the manuscript, staff in the SCRM animal unit for help with animal maintenance and Prof. Stuart Forbes for immunohistochemistry reagents. This work was supported by MRC grant Mr/K011200/1 and the China Scholarship Council
Materialien
| Name | Company | Catalog Number | Comments |
| Forceps | Dumostar | T5390 | |
| Dissecting stereomicroscope | Zeiss | Stemi 2000-C | |
| Stereomicroscope system with fluorescence | Nikon | AZ100 | |
| Inverted microscope with a digital camera | Olympus | Olympus BX61 | |
| Inverted confocal microscope | Leica Microsystems | Leica TCS SP8 | |
| Low melting point agarose | Life Technologies | 16520-050 | |
| Pasteur pipettes | Fisher Scientific | 11397863 | |
| 30mm Petri dishes | Fisher Scientific | 121V | |
| 4-well plates | Thermo scientific | 179820 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Phosphate Buffered Saline (PBS) | Life Technologies | 10010015 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | P6148 | |
| Pipettes | NICHIRYO | Nichipet | |
| tips | Greiner Bio One | 685280 | |
| Cell culture incubator | SANYO | MCO-17AIC | |
| Roller culture apparatus | BTC Engineering | ||
| Syringe filters 0.45µm, sterile | Sigma-Aldrich | 10462100 | |
| Glasgow Minimum Essential Medium (GMEM) | Sigma-Aldrich | G5154 | |
| non-essential amino acids (NEAA) | Life Technologies | 11140050 | |
| L-glutamine | Fisher Scientific | SH30549.01 | |
| Sodium pyruvate solution | Fisher Scientific | SH30239.01 | |
| Penicillin and Streptomycin 10.000UI/ml | Lonza | DE17-602E | |
| Gas Cartridge for Portable Meker Burner | COLEMAN | COLEMAN 250 | |
| Thin Wall Borosilicate Capillary Glass with Fillament, OD 1.0 mm, ID 0.78 mm | Harvard Apparatus | 640798 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma-Aldrich | A5177-5EA | |
| Flaming/Brown micropipette puller | Sutter Instrument Company | P-97 | |
| Microforge | De Fonbrune | BS030301 | |
| Pneumatic pico pump | World Precision Instruments | PV830 | |
| Microloader tips | Eppendorf | 5242956.003 | |
| ECM 830 square wave pulse generator | BTX | 45-0002 | |
| Green food coloring dye | Sigma-Aldrich | C.I. 42053 | |
| A far-red cell membrane-impermeable nuclear dye | Biotium | 40060-T | |
| pCAG-Cre:GFP | Addgene | #13776 | |
| pCAG-GFP | Addgene | #16664 | |
| Multimeter | Excel | XL830L | |
| Micromanipulators | Leitz | ||
| 0.2mm diameter platinum wire | Agar Scientific | E404-2 | |
| Anti-GFP antibody | Abcam | ab13970 | |
| Goat anti-Chicken IgY, HRP | Santa Cruz | sc-2428 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3467 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Life Technologies | D21490 | |
| A far-red fluorescence nuclear counterstain | Life Technologies | T3605 |
Referenzen
- O'Hagan, A. R., Morton, R., Eid, N. Loss of asthma control in pediatric patients after discontinuation of long-acting Beta-agonists. Pulmonary med. , 894063 (2012).
- Brons, I. G., et al. Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature. 448, 191-195 (2007).
- Tesar, P. J., et al. New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature. 448, 196-199 (2007).
- Huang, Y., Osorno, R., Tsakiridis, A., Wilson, V. In Vivo differentiation potential of epiblast stem cells revealed by chimeric embryo formation. Cell rep. 2, 1571-1578 (2012).
- Sadik, M. M., et al. Scaling relationship and optimization of double-pulse electroporation. Biophys. J. 106, 801-812 (2014).
- Kaestner, L., Scholz, A., Lipp, P. Conceptual and technical aspects of transfection and gene delivery. Bioorg. Med. Chem. Lett. , (2015).
- Soares, M. L., Torres-Padilla, M. E., Zernicka-Goetz, M. Bone morphogenetic protein 4 signaling regulates development of the anterior visceral endoderm in the mouse embryo. Dev. Growth Differ. 50, 615-621 (2008).
- Pierreux, C. E., Poll, A. V., Jacquemin, P., Lemaigre, F. P., Rousseau, G. G. Gene transfer into mouse prepancreatic endoderm by whole embryo electroporation. JOP. 6, 128-135 (2005).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7, 107 (2007).
- Davidson, B. P., Tsang, T. E., Khoo, P. L., Gad, J. M., Tam, P. P. Introduction of cell markers into germ layer tissues of the mouse gastrula by whole embryo electroporation. Genesis. 35, 57-62 (2003).
- Khoo, P. L., Franklin, V. J., Tam, P. P. Fate-Mapping Technique: Targeted Whole-Embryo Electroporation of DNA Constructs into the Germ Layers of Mouse Embryos 7-7.5 Days Post-coitum. CSH protocols. 2007. , pdb.prot4893 (2007).
- Tawk, M., Bianco, I. H., Clarke, J. D. Focal electroporation in zebrafish embryos and larvae. Methods Mol Biol. 546, 145-151 (2009).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70, 148-154 (2002).
- Nolkrantz, K., et al. Electroporation of single cells and tissues with an electrolyte-filled capillary. Anal. Chem. 73, 4469-4477 (2001).
- Mazari, E., et al. A microdevice to locally electroporate embryos with high efficiency and reduced cell damage. Development. 141, 2349-2359 (2014).
- Copp, A. J., Cockroft, D. L. . Postimplantation mammalian embryos : a practical approach. , (1990).
- Tam, P. P., Behringer, R. R. Mouse gastrulation: the formation of a mammalian body plan. Mech. Dev. 68, 3-25 (1997).
- Wilson, V., Beddington, R. S. Cell fate and morphogenetic movement in the late mouse primitive streak. Mech. Dev. 55, 79-89 (1996).
- Tzouanacou, E., Wegener, A., Wymeersch, F. J., Wilson, V., Nicolas, J. F. Redefining the progression of lineage segregations during mammalian embryogenesis by clonal analysis. Dev Cell. 17, 365-376 (2009).
- Bellomo, D., Lander, A., Harragan, I., Brown, N. A. Cell proliferation in mammalian gastrulation: the ventral node and notochord are relatively quiescent. Dev. Dynam. 205, 471-485 (1996).
- Tsakiridis, A., et al. Distinct Wnt-driven primitive streak-like populations reflect in vivo lineage precursors. Development. 141, 1209-1221 (2014).
- Gouti, M., et al. In vitro generation of neuromesodermal progenitors reveals distinct roles for wnt signalling in the specification of spinal cord and paraxial mesoderm identity. PLoS biology. 12, e1001937 (2014).
- Beddington, R. S. Induction of a second neural axis by the mouse node. Development. 120, 613-620 (1994).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten