A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصوير Ratiometric الرقم الهيدروجيني خارج الخلية في الأغشية الحيوية الأسنان
In This Article
Summary
ويستخدم صبغة ratiometric الحساسة درجة الحموضة في تركيبة مع متحد البؤر المجهر الليزر وتحليل الصور الرقمية لمراقبة درجة الحموضة خارج الخلية في الأغشية الحيوية الأسنان في الوقت الحقيقي.
Abstract
درجة الحموضة في الأغشية الحيوية البكتيرية على الأسنان ذات أهمية مركزية لتسوس الأسنان، وأمراض التي يتفشى في جميع أنحاء العالم. لا يتم توزيع المواد الغذائية ونواتج الأيض بالتساوي في الأغشية الحيوية الأسنان. وتفاعل معقد بين الامتصاص لوتفاعله مع المواد العضوية في بيوفيلم يقلل من طرق انتشار المواد المذابة ويخلق تدرجات حادة من الجزيئات المتفاعلة، بما في ذلك الأحماض العضوية، عبر بيوفيلم. طرق المجهرية الفلورسنت الكمية، مثل التصوير في الوقت حياة مضان أو ratiometry درجة الحموضة، ويمكن استخدامها لتصور درجة الحموضة في microenvironments مختلفة من الأغشية الحيوية الأسنان. درجة الحموضة ratiometry يستغل تحول تعتمد على درجة الحموضة في انبعاث الفلورسنت الأصباغ الحساسة درجة الحموضة. حساب نسبة الانبعاثات في اثنين من أطوال موجية مختلفة يسمح بتحديد درجة الحموضة المحلية في الصور المجهرية، بغض النظر عن تركيز الصبغة. وخلافا للالميكروية تقنية تتيح رصد كل التدرجات درجة الحموضة الرأسي والأفقي في الوقت الحقيقي معإزعاج من ميكانيكيا بيوفيلم. ومع ذلك، يجب الحرص على التفريق بدقة بين المقصورات من خارج وداخل الخلايا من بيوفيلم. هنا، وصبغ ratiometric، seminaphthorhodafluor-4F 5- (و6) حمض الكربوكسيلية (C-SNARF-4) يعمل على رصد الرقم الهيدروجيني خارج الخلية في الجسم الحي في الأغشية الحيوية الأسنان نمت من تكوين الأنواع غير معروف. عند التعرض إلى جلوكوز الصبغة متروك المركزة داخل كل الخلايا البكتيرية في الأغشية الحيوية. وبالتالي استخدامه على حد سواء باعتبارها وصمة عار البكتيرية العالمية وكعلامة من الرقم الهيدروجيني خارج الخلية. بعد متحد البؤر الحصول على الصور المجهرية، تتم إزالة الكتلة الحيوية البكتيرية من كل الصور باستخدام برمجيات تحليل الصور الرقمية، والذي يسمح لحساب حصرا الرقم الهيدروجيني خارج الخلية. درجة الحموضة ratiometry مع الصبغة ratiometric هي مناسبة تماما لدراسة درجة الحموضة خارج الخلية في الأغشية الحيوية رقيقة تصل إلى 75 ميكرون سمك، ولكن يقتصر على مجموعة ودرجة الحموضة بين 4.5 و 7.0.
Introduction
الطريقة الموصوفة هنا يسمح برصد الرقم الهيدروجيني خارج الخلية في الأغشية الحيوية الأسنان في نطاق بين 4.5 و 7، وذلك باستخدام الصبغة ratiometric seminaphthorhodafluor-4F 5- (و6) حمض الكربوكسيلية (C-SNARF-4) في تركيبة مع متحد البؤر المجهر الليزر و تحليل الصور الرقمية. صبغة الفلورسنت العاملين هو الرقم الهيدروجيني الحساسة ويعرض تحولا في الانبعاثات الفلورسنت اعتمادا على حالة بروتوناتيون. انبعاث الفلورسنت من قمم جزيء البروتونية في 580 نانومتر، وانبعاث جزيء deprotonated في 640 نانومتر 1. نسبة كثافة الانبعاثات الفلورسنت في إطارين الكشف تضم قمم الانبعاثات اثنين (576-608 نانومتر، و629-661 نانومتر) مما يعكس درجة الحموضة في الطور السائل، بغض النظر عن تركيز الصبغة. مع وPK من ~ 6.4 الصبغة هو مناسب لتصور درجة الحموضة في البيئات الحمضية باعتدال.
PH في الأغشية الحيوية البكتيرية له أهمية مركزية لجميع عمليات التمثيل الغذائي.في حالة الأغشية الحيوية الأسنان، ودرجة الحموضة في المصفوفة خارج الخلية هو عامل الفوعة رئيسيا لتطوير تسوس الأسنان. فترات طويلة مع انخفاض الرقم الهيدروجيني في واجهة الصدارة بيوفيلم الأسنان لإبطاء التنقية من المينا الأساسي 2. ويرجع ذلك إلى بنية ثلاثية الأبعاد معقدة من الأغشية الحيوية، الأيض، بما في ذلك الأحماض العضوية، ليست موزعة بشكل موحد في جميع أنحاء بيوفيلم. ويمكن الاطلاع على غاية وأقل microenvironments مولد الحموضة في القرب المكاني 3.
على مدى عقود، وسجلت التدرجات درجة الحموضة العمودية في الأغشية الحيوية بمساعدة الميكروية 4-6. في حين أنها توفر دقة مكانية جيدة نظرا لحجم رأس صغير، وأنها ليست مناسبة تماما لمراقبة التدرجات الأفقية. وعلاوة على ذلك، الإدراج من القطب يزعج بيوفيلم ميكانيكيا. الكمية التقنيات المجهرية الفلورسنت توفر ميزة تصور التغييرات درجة الحموضة في مناطق مختلفة من بيوفيلم دون الميكانيكية التدخلالامتحانات التنافسية الوطنية. الحقول المجهرية نظر مختلفة يمكن اختيار بحرية وتصوير مرارا وتكرارا على مدى فترات طويلة 1،7-9. ومع ذلك، عند تفسير الصور بيوفيلم المجهرية، فمن المهم أن نميز بين مضان المستمدة من الكتلة الحيوية الميكروبية ومضان المستمدة من الفضاء خارج الخلية. في الظروف الحمضية، ودرجة الحموضة داخل الخلايا البكتيرية مختلفة من درجة الحموضة في المصفوفة خارج الخلية، حيث أن البكتيريا نقل بنشاط البروتونات عبر غشاء الخلية على حساب من أدينوسين ثلاثي الفوسفات 10. في سياق تسوس الأسنان، وليس لديها درجة الحموضة البكتيرية بين الخلايا لها تأثير مباشر على المينا الكامنة في حين انخفاض الرقم الهيدروجيني خارج الخلية يؤدي إلى التنقيه. بلغ متوسط درجة الحموضة في الصور المجهرية التي تحتوي على كل مناطق خالية من البكتيريا والجراثيم يؤدي إلى نتائج خاطئة. استخدام بقع أخرى جنبا إلى جنب مع صبغة حساسة درجة الحموضة من أجل رؤية الكتلة الحيوية البكتيرية والتفريق بين المناطق الخارجة عن والخلايا يجلب أبمن خطر التلوث الفلورسنت من الفضاء خارج الخلية والقياسات الخاطئة 11.
لذا يصف المخطوطة الحالية على استخدام الصبغة ratiometric في وظيفة مزدوجة؛ على حد سواء باعتبارها علامة درجة الحموضة وباعتباره وصمة عار البكتيرية العالمية. كما أن الصبغة هي يصل تتركز في الخلايا البكتيرية، والجمع بين التصوير المجهري متحد البؤر وإجراء تحليل الصور الرقمية دقيق يسمح تحديد الرقم الهيدروجيني خارج الخلية في نطاق بين 4.5 و 7.0 في الأغشية الحيوية الأسنان رقيقة.
Protocol
تم استعراض البروتوكول التجريبي التي وافقت عليها لجنة الأخلاقيات من مقاطعة آرهوس (M-20100032).
1. متحد البؤر مجهرية معايرة Ratiometric صبغ
- لاقتناء الصور، استخدام مجهر مقلوب مبائر مجهزة حاضنة، هدفا الغمر بالماء فتحة 63X / 1.2 الرقمية، خط ليزر 543 نانومتر، وكاشف ميتا.
- إعداد HEPES العازلة الحلول الأسهم (50 ملي، بعد تعديلها لدرجة الحموضة 4،5-8،5 في خطوات وحدات 0.1 درجة الحموضة). ماصة 100 ميكرولتر من كل حل في آبار واضحة القاع لوحة 96-جيدا للفحص المجهري الفلورسنت.
- ارتداء قفازات النتريل عند التعامل مع الصبغة ratiometric C-SNARF-4. إعداد 1 ملم حل سهم الصبغة في سلفوكسيد ثنائي ميثيل. إضافة 5 ميكرولتر من محلول المخزون إلى كل بئر مع العازلة HEPES. وضع لوحة 96 جيدا على المجهر.
- تشغيل المجهر. فتح البرنامج المجهر. انقر على اللوحات التالية: الحصول → الليزر. الحصول → Micro. اكتساب التكوين →. الحصول → مسح. الحصول → المرحلة. الاحماء الحاضنة إلى 37 درجة مئوية.
- تشغيل خط ليزر 543 نانومتر من خلال النقر على الليزر نانومتر 543 و"على" زر في إطار "مكافحة الليزر". اختيار الهدف الغمر بالماء فتحة 63X / 1.2 الرقمية في إطار "مكافحة مجهر".
- تعيين كاشف ميتا لمراقبة مضان في وقت واحد داخل 576- إلى 608 نانومتر (الأخضر)، و629- 661 نانومتر (الأحمر) فترات ( "تحكم تكوين" → "كلية العلوم الصحية"). ضبط قوة الليزر ( "تحكم تكوين" → "الإثارة"). تعيين الثقب أن يؤديا إلى شريحة سمك البصرية من 1.6 ميكرون ( "التحكم تفحص" → "الثقب").
- الحصول على صورة من كل حل العازلة HEPES، 5 ميكرون فوق الجزء السفلي من الزجاج لوحة 96-جيدا. ملاحظة: بمجرد يقع الطائرة التركيز تحت أسفل الزجاج، لا ضوء الفلورسنت يمكن أن ينظر إليهعلى الشاشة. بعد كل صورة ثالثة، تعيين قوة الليزر إلى الصفر وأخذ صورة للخلفية الطرح.
- إجراء تجربة المعايرة في ثلاث نسخ (1،2-1،7).
- تحديد متوسط كثافة الفلورسنت والانحراف المعياري في جميع الصور الحمراء والخضراء.
- حساب نسبة R والخطأ المعياري للمتوسط، S R، عن كل صورة وفقا لمعادلات (1) و (2)
(1)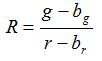
(2)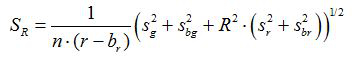
ز، ص، ق ز وق ص هي المتوسطات والانحرافات المعيارية في الصور الخضراء والحمراء منها. ب ز، ب ص، ق حرس الحدود وق ر هي القيم المقابلة للصور الخلفية. ن 2 هو عدد البكسل تصوير. - رسم نسب تحسب لكل قيمة الرقم الهيدروجيني من ثلاث تجارب تكرار المعايرة في رسم تخطيطي وبناء منحنى المجهزة من هذه السلسلة من نقاط البيانات (أي باستخدام برنامج SigmaPlot 13). جعل وظيفة رياضية من منحنى المجهزة التي يمكن تحويل نسب إلى قيم الرقم الهيدروجيني 10.
- حساب نسبة R والخطأ المعياري للمتوسط، S R، عن كل صورة وفقا لمعادلات (1) و (2)
2. جمع في الموقع نمت عينات بيوفيلم الأسنان
- اختيار المتطوعين التي تلبي معايير التضمين والاستثناء ذات الصلة لهذه الدراسة. جعل الانطباعات الجينات من قوس الأسنان العلوية والسفلية الخاصة بهم. جعل نماذج المدلى بها من هذه الانطباعات وتصنيع جبيرة الاكريليك في الفك السفلي. تصميم جبيرة مع الشفاه الاكريليك الشدق متصلة بواسطة سلك تقويم الأسنان اللغات التي تسمح للمتطوعين لدغة إلى انسداد الطبيعي 12.
- الركود الحفر في الشفاه الشدق من جبيرة الاكريليك (الشكل 1 ) مع مساعدة من الأزيز الاكريليك الأسنان للسماح بإدخال ألواح الزجاج لجمع بيوفيلم. يجب أن يكون عمق الركود لا يقل عن 1.5 ملم، في حين أن عرض وطول فترات الركود قد تختلف اعتمادا على عدد من ألواح الزجاج التي ستدرج لاحقا.
- لجمع بيوفيلم، استخدام ألواح مصنوعة خصيصا غير الفلورسنت الزجاج (4 × 4 × 1 مم 3) مع خشونة سطح حصى 1200 من أجل تقليد نمط الاستعمار على المينا الطبيعي 11.
- تعقيم ألواح الزجاج عن طريق التعقيم قبل التركيب. تركيب ألواح زجاجية مع الشمع لزجة في المنخفضات في الشفاه الشدق من كل جانب راحة قليلا على سطح سطح الاكريليك من أجل حماية بيوفيلم من قوى القص التي تنقل الخدين 11 المبذولة.
ملاحظة: قد تختلف عدد من ألواح الزجاج وضعت في حالة ركود بين 3 و 14، وهذا يتوقف على الهدف من هذه الدراسة. - إدراج الجهاز في الفم من المتطوعين. إرشاد volunطير إلى الإبقاء على الأجهزة داخل الفم طوال الفترة التجريبية. تكليف المتطوعين لتخزين الأجهزة في وعاء التجنيب تقويم الأسنان بقطعة من المناديل الورقية المبللة (لإبقائها رطبة) في درجة حرارة الغرفة خلال السواك وتناول الطعام والمشروبات غير الماء. تكليف المتطوعين لعدم لمس الشفاه الاكريليك الشدق مع ألواح الزجاج في حين وضع وإزالة الأجهزة.
ملاحظة: قد تختلف الفترة التجريبية حسب الهدف من هذه الدراسة (يوم واحد إلى عدة أسابيع). - بعناية إزالة ألواح الزجاج من الأجهزة في نهاية الفترة التجريبية. إزالة الشمع لزجة حول ألواح بسكين ونقلها مع زوج من ملاقط لحاوية مغلقة، بيوفيلم التي تواجه التصاعدي، وحتى التحليل المجهري. إبقاء الحاويات رطبة مع المناديل الورقية المبللة. أداء التصوير ودرجة الحموضة في غضون ساعات قليلة بعد جمع بيوفيلم.
3. بيوفيلم درجة الحموضة التصوير
- إعدادحل اللعاب عن طريق إضافة dithiothreitol إلى اللعاب التي تم جمعها وفقا لطريقة دي يونج وآخرون. 13. عاير الحل اللعابية لدرجة الحموضة 7.0 وإضافة الجلوكوز إلى تركيز 0.4٪ (وزن / المجلد). ماصة 100 ميكرولتر في بيوفيلم ليتم تحليلها في لوحة 96-جيدا الزجاج السفلي للفحص المجهري. إضافة 5 ميكرولتر من صبغ ratiometric لكل بئر.
- وضع لوحة 96 جيدا على المسرح المجهر. بدوره على المجهر وخط ليزر 543 نانومتر. الاحماء الحاضنة إلى 37 درجة مئوية. استخدام الإعدادات المجهر نفس لمعايرة الصبغة (انظر الخطوات 1،5-1،6). الانتظار لمدة 30 دقيقة، حتى وصلت الى لوحة 96-جيدا درجة حرارة العمل.
- اختيار واحد أو أكثر من ألواح الزجاج مع مجموعة ضئيلة من ملاقط ووضعها في الآبار المليئة اللعاب، لوح واحد لكل بئر، مع الأغشية الحيوية أسفل.
- الحصول على صور واحدة ( "التحكم تفحص" → "واحدة") أو ض مداخن ( "التحكم تفحص" → "بدء") spanniنانوغرام عمق الأغشية الحيوية في مختلف المجالات. للحصول على زي رزمة اختيار عدد من شرائح إلى أن تصوير ( "التحكم تفحص" → "Z إعدادات" → "شرائح ارقام") ومارك ض الموقف للمرة الأولى وشريحة مشاركة في البرنامج المجهر ( "السيطرة على المسح الضوئي "→" Z إعدادات "→" مارك أولا "،" مارك آخر ").
ملاحظة: Z-مداخن وعلى عمق يصل إلى 75 ميكرون يمكن الحصول عليها مع النقيض جيدة بين المناطق خارج الخلية والخلايا. - لمتابعة التغيرات ودرجة الحموضة في حقل المجهري للعرض على مر الزمن، بمناسبة موقف س ص في البرنامج المجهر ( "المرحلة وتركيز الرقابة" → "كافة نقاط البيع") وأخذ الصور المتكررة في نقاط زمنية متتالية ( "التحكم تفحص" → " وحيد"). بانتظام التقاط صور مع قوة الليزر تعيين إلى صفر لخلفية الطرح.
4. تحليل الصور الرقمية
- إلى المعرضغ الصور المجهرية كملفات TIF، واستخدام تصدير ملف دفعة من البرنامج المجهر ( "ماكرو" → "دفعة تصدير ملف"). بمناسبة الملفات المراد تصديرها وحفظ الصور القناة الحمراء والخضراء في مجلدات منفصلة كما TIF ملفات ( "ابدأ دفعة تصدير"). إعادة تسمية الملفات في كلا المجلدين منحهم أرقام تسلسلية.
- استيراد الحمراء والخضراء سلسلة صورة في صناعة البرمجيات مثل daime (تحليل الصور الرقمية في البيئة الميكروبية) 14. شريحة الصور قناة خضراء مع عتبات اختيار فردي سطوع (الجزء → التلقائية تجزئة → عتبة مخصص). اختيار عتبات سطوع بعناية (عادة ما بين 20 و 80)، بحيث، ولكن لن يتم تسجيل جميع البكتيريا (أكثر إشراقا من المصفوفة خارج الخلية) مصفوفة ككائنات خلال تجزئة. التحقق بصريا أن المناطق المعترف بها ككائنات تتوافق بشكل جيد مع الكتلة الحيوية البكتيرية.
- نقل طبقة الهدف من ز مجزأةصور reen قناة إلى صور القناة الحمراء المقابلة (الجزء → طبقة كائن نقل). استخدام الكائن وظيفة محرر لرفض وحذف كافة الكائنات في الصور القناة الحمراء والخضراء. الآن لم يبق سوى المصفوفة خارج الخلية في الصور بيوفيلم. تصدير صورة سلسلة معالجتها كملفات TIF.
- استيراد سلسلة الصورة في يماغيج (http://rsb.info.nih.gov/ij، v.1.47). تحديد متوسط كثافة مضان في خلفية الصور التي اتخذت مع الليزر إيقاف تشغيل (تحليل → الرسم البياني). طرح الخلفية المناسبة من الصور الحمراء والخضراء (عملية → الرياضيات → إطرح).
- لا يزال في ImageJ، تقسيم الصورة الخضراء سلسلة (G1) في حد ذاته (عملية → صورة آلة حاسبة). ثم ضرب سلسلة الصورة الناتجة (G2) مع سلسلة صورة خضراء (G1). هذا وسوف تسفر عن سلسلة صورة (G3)، حيث يتم تعيين نان لجميع بكسل ينتمون إلى المناطق التي تم الاعتراف بها الكائنات في daime. المضي قدما في تيانه بنفس الطريقة مع سلسلة صورة الحمراء (R1 / R1 = R2، R2 س R1 = R3).
ملاحظة: كما تم إزالة الكتلة الحيوية البكتيرية من الصور في خطوة 4.3، وشدة الفلورسنت 0 في هذه المجالات. خطوة 4.5 ضرورية لتحويل القيمة من 0 إلى نان، والذي يسمح لحساب النسبة في خطوة 4.6. - تطبيق "يعني" تصفية (عملية → مرشحات → المتوسط، نصف قطرها: 1 بكسل) للتعويض عن الضوضاء كاشف. تقسيم صورة سلسلة الخضراء سلسلة صورة الحمراء (عملية → صورة آلة حاسبة). وهذا يؤدي إلى نسبة / أحمر أخضر لكل بكسل المتبقية في الفضاء خارج الخلية من الصور. استخدام التلوين كاذبة عن التمثيل البياني للنسب في الصور (الجداول صورة → بحث). حساب نسبة متوسط لكل صورة (تحليل → الرسم البياني).
- تحويل نسب خضراء / حمراء للقيم الرقم الهيدروجيني وفقا للوظيفة تركيبها تحت 1.9.2). ملاحظة: يمكن رؤية مثال لبيانات المعايرة ومنحنى المجهزة في Schlafer وآخرونآل، 2015 11.
النتائج
يسمح الطريقة المعروضة مراقبة خارج الخلية درجة الحموضة قطرات في microenvironments مختلفة من الأغشية الحيوية الأسنان في نطاق درجة الحموضة 4،5-7 في الوقت الحقيقي. إذا تم اختيار الظروف التجريبية كما هو موضح أعلاه، يبدأ الرقم الهيدروجيني إلى إسقاط في جميع المجال...
Discussion
مراقبة مجهرية من درجة الحموضة بيوفيلم يوفر العديد من المزايا، بالمقارنة مع القطب أو مسرى مكروي القياسات 4-6. تسمح التقنيات المجهرية لتحديد درجة الحموضة مع دقة مكانية عالية والسماح التقاط التدرجات درجة الحموضة أفقيا ورأسيا في الأغشية الحيوية من دون إزعاج بيوفي?...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
فإن الكتاب أود أن أشكر خافيير غارسيا هاء ولين جرونكيار لتقديم المساعدة التقنية وMerete ك Raarup لإجراء مناقشات مثمرة. وقد تم تمويل هذا العمل من قبل مؤسسة أبحاث جامعة آرهوس وسيمون جواسيس مؤسسة.
Materials
| Name | Company | Catalog Number | Comments |
| Zeiss LSM 510 META | Zeiss | N/A | |
| C-Apochromat 63X water immersion objective | Zeiss | N/A | |
| XL Incubator | PeCON | N/A | |
| SNARF-4F 5-(and-6)-Carboxylic Acid | Life Technologies | S23920 | |
| Dimethyl sulfoxide | Life Technologies | D12345 | |
| HEPES | Life Technologies | 11344-041 | |
| Costar 96-well black clear-bottom plate | Fisher Scientific | 07-200-567 | |
| Custom-made glass slabs (4 x 4 x 1 mm3; 1,200 grit) | Menzel | N/A | |
| Alginate impression material | GC Corporation | N/A | |
| Acrylic Adjusting Logic Sets/set of acrylic dental burs | Axis Dental | LS-906 | |
| Orthodontic retainer containers | Spark Medical Equipment Co., Ltd | SK-WDTC01 | |
| Sticky wax | Dentsply | N/A | |
| Chewing paraffin wax | Ivoclar Vivadent AG | N/A | |
| Dithiothreitol | Sigma Aldrich | D0632 | Used during preparation of salivary solution |
| 0.45 µm and 0.2 µm syringe filters | Sigma Aldrich | CLS431220; CLS431219 | |
| daime | University of Vienna, Austria | http://dome.csb.univie.ac.at/daime | |
| ImageJ | NIH, Bethesda, Maryland, USA | http://imagej.nih.gov/ij/ |
References
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl. Environ. Microbiol. 71 (5), 2501-2510 (2005).
- Takahashi, N., Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42 (6), 409-418 (2008).
- Schlafer, S., et al. pH landscapes in a novel five-species model of early dental biofilm. PLoS. One. 6 (9), e25299 (2011).
- von Ohle, O. C., et al. Real-time microsensor measurement of local metabolic activities in ex vivo dental biofilms exposed to sucrose and treated with chlorhexidine. Appl. Environ. Microbiol. 76 (7), 2326-2334 (2010).
- Revsbech, N. P. Analysis of microbial communities with electrochemical microsensors and microscale biosensors. Methods Enzymol. 397, 147-166 (2005).
- Vanhoudt, P., Lewandowski, Z., Little, B. Iridium oxide pH microelectrode. Biotechnol. Bioeng. 40 (5), 601-608 (1992).
- Franks, A. E., et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energy & Environmental Science. 2 (1), 113-119 (2009).
- Hidalgo, G., et al. Functional tomographic fluorescence imaging of pH microenvironments in microbial biofilms by use of silica nanoparticle sensors. Appl. Environ. Microbiol. 75 (23), 7426-7435 (2009).
- Vroom, J. M., et al. Depth penetration and detection of pH gradients in biofilms by two-photon excitation microscopy. Appl. Environ. Microbiol. 65 (8), 3502-3511 (1999).
- Bender, G. R., Sutton, S. V., Marquis, R. E. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci. Infect. Immun. 53 (2), 331-338 (1986).
- Schlafer, S., et al. Ratiometric imaging of extracellular pH in bacterial biofilms using C-SNARF-4. Appl. Environ. Microbiol. 81 (4), 1267-1273 (2015).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J Oral Sci. 115 (6), 459-467 (2007).
- de Jong, M. H., van der Hoeven, J. S., van OS, J. H., Olijve, J. H. Growth of oral Streptococcus species and Actinomyces viscosus in human saliva. Appl. Environ. Microbiol. 47 (5), 901-904 (1984).
- Daims, H., Lucker, S., Wagner, M. daime, a novel image analysis program for microbial ecology and biofilm research. Environ. Microbiol. 8 (2), 200-213 (2006).
- Liu, Y. L., Nascimento, M., Burne, R. A. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int. J Oral Sci. 4 (3), 135-140 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved