Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie Ratiométrique du pH extracellulaire dans biofilms dentaires
Dans cet article
Résumé
Un colorant ratiométrique sensible au pH est utilisé en combinaison avec la microscopie confocale à balayage laser et l'analyse d'image numérique pour contrôler le pH extracellulaire dans les biofilms dentaires en temps réel.
Résumé
Le pH dans les biofilms bactériens sur les dents est d'une importance centrale pour la carie dentaire, une maladie avec une prévalence mondiale élevée. Les nutriments et métabolites ne sont pas répartis uniformément dans les biofilms dentaires. Une interaction complexe de sorption à et de la réaction avec la matière organique dans le biofilm réduit les chemins de diffusion de solutés et crée des pentes raides de molécules réactives, y compris les acides organiques, à travers le biofilm. méthodes microscopiques fluorescentes quantitatives, comme la vie de l'imagerie de fluorescence de temps ou pH ratiometry, peuvent être utilisés pour visualiser le pH dans différents microenvironnements de biofilms dentaires. pH ratiometry exploite un décalage dépendant du pH dans l'émission de fluorescence des colorants sensibles au pH. Calcul du rapport d'émission à deux longueurs d'onde différentes permet de déterminer le pH local dans les images microscopiques, quelle que soit la concentration du colorant. Contrairement à microélectrodes la technique permet de surveiller les deux gradients verticaux et horizontaux pH en temps réel avecperturber mécaniquement le biofilm. Cependant, il faut prendre soin de différencier précisément entre les compartiments extra- et intracellulaires du biofilm. Ici, le colorant ratiométrique, seminaphthorhodafluor-4F 5- (et-6) acide carboxylique (C-SNARF-4) est utilisé pour contrôler le pH extracellulaire in vivo biofilms dentaires cultivés de la composition des espèces inconnues. Lors de l'exposition au glucose est le colorant jusqu'à concentré à l'intérieur de toutes les cellules bactériennes dans les biofilms; elle est donc utilisée à la fois comme une tache bactérienne universelle et comme marqueur du pH extracellulaire. Après l'acquisition de l'image microscopique confocale, la biomasse bactérienne est retiré de toutes les images en utilisant le logiciel d'analyse d'image numérique, qui permet de calculer exclusivement pH extracellulaire. pH ratiometry avec le colorant ratiométrique est bien adapté pour étudier le pH extracellulaire dans minces biofilms allant jusqu'à 75 um d'épaisseur, mais est limitée à la plage de pH entre 4,5 et 7,0.
Introduction
Le procédé décrit ici permet de surveiller le pH extracellulaire dans les biofilms dentaires dans la plage comprise entre 4,5 et 7, en utilisant le colorant ratiométrique seminaphthorhodafluor-4F 5- (et-6), acide carboxylique (C-SNARF-4) en combinaison avec la microscopie confocale à balayage laser et l'analyse d'image numérique. Le colorant fluorescent utilisé est sensible au pH et affiche un changement dans son émission de fluorescence en fonction de l'état de protonation. L'émission de fluorescence des pics moléculaires protonés à 580 nm et l'émission de la molécule déprotonée 1 à 640 nm. Le rapport des intensités d'émission de fluorescence dans deux fenêtres de détection comprenant deux pics d'émission (576-608 nm et 629-661 nm) reflète ainsi le pH dans la phase liquide, quelle que soit la concentration de colorant. Avec un pKa de 6,4 ~ le colorant est adapté pour visualiser le pH dans un environnement modérément acides.
PH dans les biofilms bactériens est d'une importance capitale pour tous les processus métaboliques.Dans le cas des biofilms dentaires, le pH dans la matrice extracellulaire est le facteur de virulence essentiel pour le développement des caries dentaires. Des périodes prolongées de faible pH à l'interface biofilm-dent conduit à ralentir la déminéralisation de l'émail sous - jacent 2. Grâce à l'architecture tridimensionnelle complexe de biofilms, des métabolites, y compris les acides organiques, ne sont pas répartis uniformément à travers le biofilm. Hautement et moins microenvironnements acidogènes se trouvent dans la proximité spatiale étroite 3.
Depuis des décennies, des gradients de pH verticaux dans les biofilms ont été enregistrées à l'aide de micro - électrodes 4-6. Bien qu'ils offrent une bonne résolution spatiale en raison de leur petite taille de la pointe, ils ne sont pas bien adaptés pour surveiller les gradients horizontaux. En outre, l'insertion de l'électrode perturbe le biofilm mécaniquement. techniques microscopiques fluorescentes quantitatives offrent l'avantage de visualiser les changements de pH dans différentes zones d'un biofilm sans interférer mécaniquence. Champs microscopiques de vue différents peuvent être choisis librement et imagées de manière répétée sur des périodes prolongées 1,7-9. Cependant, lors de l'interprétation des images microscopiques biofilm, il est important de faire la distinction entre la fluorescence provenant de la biomasse microbienne et de la fluorescence provenant de l'espace extracellulaire. Dans des conditions acides, le pH à l' intérieur des cellules bactériennes est différent du pH dans la matrice extracellulaire, comme les bactéries transportent activement des protons à travers la membrane cellulaire , au détriment de l' adénosine triphosphate 10. Dans le contexte de la carie dentaire, le pH intracellulaire des bactéries n'a pas un impact direct sur l'émail sous-jacent alors qu'une faible pH extracellulaire conduit à la déminéralisation. Étalement pH dans des images microscopiques qui contiennent à la fois des zones exemptes de bactéries et les bactéries conduit à des résultats erronés. L'utilisation d'autres tâches ainsi que le colorant sensible au pH pour visualiser la biomasse bactérienne et de différencier entre les régions extra- et intracellulaires apporte able risque de contamination fluorescente de l'espace extracellulaire et des erreurs de mesure 11.
Le présent manuscrit décrit donc l'utilisation du colorant ratiométrique dans une double fonction; à la fois en tant que marqueur de pH et comme une tache bactérienne universelle. Comme le colorant est mis concentré dans des cellules bactériennes, la combinaison d'imagerie microscopique confocale et une procédure d'analyse d'image numérique précis permet la détermination du pH extracellulaire dans la plage comprise entre 4,5 et 7,0 dans les biofilms minces dentaires.
Protocole
Le protocole expérimental a été examiné et approuvé par le Comité d'éthique du comté d'Aarhus (M-20100032).
1. confocale Microscopique Calibration du Ratiométrique Dye
- Pour l'acquisition d'image, utiliser un microscope inversé confocal équipé d'un incubateur, un objectif d'immersion dans l'eau d'ouverture 63X / 1.2-numérique, une ligne de laser 543 nm et un détecteur META.
- Préparer tampon HEPES solutions mères (50 mM, ajusté à un pH de 4,5 à 8,5 par incréments de 0,1 unités de pH). Pipeter 100 ul de chaque solution dans les puits d'une plaque de 96 puits à fond transparent pour la microscopie fluorescente.
- Porter des gants en nitrile pour manipuler le colorant ratiométrique C-SNARF-4. Préparer une solution mère 1 mM du colorant dans le diméthylsulfoxyde. Ajouter 5 ul de la solution mère à chaque puits avec du tampon HEPES. Placer la plaque de 96 puits au microscope.
- Allumez le microscope. Ouvrez le logiciel de microscope. Cliquez sur les panneaux suivants: Acquérir → Laser; Acquérir → Micro; Acquérir → Config; Acquérir → Numériser; Acquérir → scène. Réchauffez l'incubateur à 37 ° C.
- Tournez sur la ligne de laser 543 nm en cliquant sur le laser de 543 nm et le bouton "On" dans la fenêtre "Contrôle Laser". Choisissez l'objectif d'immersion dans l'eau d'ouverture 63X / 1.2-numérique dans la fenêtre "Contrôle Microscope".
- Réglez le détecteur de META pour surveiller simultanément la fluorescence au sein de 576- à 608 nm (vert) et 629- à 661 nm (rouge) des intervalles ( «contrôle de la configuration" → "ChS"). Réglez la puissance du laser ( "Configuration Control" → "Excitation"). Réglez le sténopé pour donner une épaisseur de coupe optique de 1,6 um ( "Scan Control" → "sténopé").
- Acquérir une image de chaque solution tampon HEPES, 5 um au-dessus du fond de verre de la plaque à 96 puits. Remarque: Dès que le plan de mise au point est situé en dessous du fond du verre, pas de lumière fluorescente peut être vusur l'écran. Après chaque troisième image, réglez la puissance du laser à zéro et prendre une image pour soustraction de fond.
- Effectuer l'expérience d'étalonnage en triple exemplaire (1,2-1,7).
- Déterminer l'intensité de fluorescence moyenne et l'écart type dans toutes les images rouges et vertes.
- Calculer le rapport R et de l' erreur standard de la moyenne, S R, pour chaque image selon les équations (1) et (2)
(1)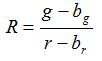
(2)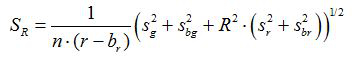
g, r, s et g s r sont les moyennes et les écarts - types dans les images vertes et rouges respectives. b g, b r, s bg et s br sont les valeurs correspondantes pour les images d'arrière - plan. n 2 est le nombre de pixels imagées. - Tracer les rapports calculés pour chaque valeur du pH à partir des trois expériences d'étalonnage répliquée dans un diagramme et la construction d' une courbe ajustée de cette série de points de données ( par exemple à l' aide du logiciel SigmaPlot 13). Faire une fonction mathématique de la courbe ajustée qui permet de convertir des rapports en valeurs de pH 10.
- Calculer le rapport R et de l' erreur standard de la moyenne, S R, pour chaque image selon les équations (1) et (2)
2. Collection de In Situ Grown échantillons dentaires biofilm
- Sélectionnez les bénévoles qui remplissent inclusion et d'exclusion des critères pertinents pour l'étude. Faire impressions alginate de leur arcade dentaire supérieure et inférieure. Faire des modèles coulés à partir de ces impressions et fabriquer une attelle acrylique dans la mâchoire inférieure. Concevoir l'attelle avec des brides acryliques buccales reliés par un fil orthodontique lingual qui permet au volontaire de mordre en occlusion normale 12.
- Récessions des trous dans les ailes buccales de l'attelle acrylique (Figure 1 ) À l'aide de fraises dentaires acryliques pour permettre l'insertion de plaques de verre pour la collecte du biofilm. La profondeur de la récession devrait être d'au moins 1,5 mm, tandis que la largeur et la longueur de la récession peuvent varier en fonction du nombre de plaques de verre doit être inséré.
- Pour la collecte de biofilm, utiliser des dalles sur mesure non fluorescentes verre (4 x 4 x 1 mm 3) avec une rugosité de surface des grains de 1200 afin d'imiter le modèle de la colonisation sur l' émail naturel 11.
- Stériliser les dalles de verre par autoclavage avant le montage. Monter les plaques de verre avec de la cire collante dans les dépressions dans les brides de chaque côté buccal légèrement en creux à la surface de la surface acrylique afin de protéger le biofilm des forces de cisaillement exercées par le mouvement des joues 11.
Note: Le nombre de plaques de verre placées dans une récession peut varier entre 3 et 14, en fonction du but de l'étude. - Insérez l'appareil dans la bouche du volontaire. Instruire la volonteer pour retenir l'appareil intra-oral pendant toute la période expérimentale. Demandez au volontaire de ranger l'appareil dans un récipient de retenue orthodontique avec un morceau de tissu de papier humide (pour le garder humide) à la température ambiante pendant le brossage des dents et l'apport de nourriture et de boissons autres que l'eau. Instruire le volontaire de ne pas toucher les ailes acryliques buccales avec les dalles de verre tout en plaçant et en enlevant l'appareil.
Remarque: La période expérimentale peut varier en fonction du but de l'étude (un jour à plusieurs semaines). - enlever soigneusement les plaques de verre de l'appareil à la fin de la période expérimentale. Retirez la cire collante autour des dalles avec un couteau et les transférer avec une paire de pinces pour un récipient fermé, le biofilm vers le haut, jusqu'à ce que l'analyse microscopique. Conserver le récipient humide avec du papier mouillé. Effectuer l'imagerie du pH dans les quelques heures après la collecte de biofilm.
3. biofilm pH Imaging
- Préparersalivaire solution par addition de dithiothréitol à la salive recueillie selon le procédé de Jong et al. , 13. Titrer la solution à un pH de 7,0 salivaire et ajoute du glucose à une concentration de 0,4% (poids / volume). Distribuer 100 ul par biofilm à analyser dans une plaque à 96 puits à fond de verre pour la microscopie. Ajouter 5 ul du colorant ratiométrique par puits.
- Placer la plaque de 96 puits sur la platine du microscope. Allumez le microscope et la ligne laser 543 nm. Réchauffez l'incubateur à 37 ° C. Utilisez les mêmes paramètres de microscope que pour l'étalonnage du colorant (voir les étapes 1,5-1,6). Attendre 30 min, jusqu'à ce que la plaque de 96 puits a atteint la température de travail.
- Ramasser un ou plusieurs dalles de verre avec un ensemble mince de pinces et les placer dans les puits de salive remplie, une dalle par puits, avec les biofilms vers le bas.
- Acquérir des images individuelles ( "Scan Control" → "simples") ou z-piles ( "Scan Control" → "Start") spanning la profondeur des biofilms dans différents domaines. Pour acquérir z-piles choisir le nombre de tranches à imager ( "Scan Control" → "Z Paramètres" → "Num Slices") et marquer la position z pour la première et la dernière tranche dans le logiciel de microscope ( "Scan Control "→" Z Paramètres "→" Mark First ";" Mark Last ").
Note: Z-piles avec une profondeur allant jusqu'à 75 um peuvent être acquises avec un bon contraste entre les zones extracellulaires et intracellulaires. - Pour suivre les changements de pH dans un champ de vision microscopique au fil du temps, marquer le xy-position dans le logiciel de microscope ( "Stage et Focus Control" → "Mark Pos") et prendre des images répétées à des points de temps consécutifs ( "Scan Control" → " Unique"). prendre régulièrement des images avec la puissance du laser à zéro pour soustraction de fond.
4. Analyse d'image numérique
- Pour export les images microscopiques sous forme de fichiers TIF, utilisent l'exportation du logiciel de microscope ( "Macro" → "Batch File Export") fichier batch. Marquez les fichiers à exporter et enregistrer des images de canal rouge et vert dans des dossiers séparés comme TIF fichiers ( "Démarrer Batch Export"). Renommez les fichiers dans les deux dossiers en leur donnant des numéros séquentiels.
- Importez la série d'images rouge et vert dans des logiciels tels que daime (analyse d'image numérique en écologie microbienne) 14. Segment des images de canal vert avec des seuils choisis individuellement la luminosité (Segment → segmentation → seuil personnalisée automatique). Des seuils de luminosité avec soin (habituellement entre 20 et 80), de sorte que toutes les bactéries (plus brillante que la matrice extracellulaire), mais pas la matrice seront reconnus comme étant des objets au cours de la segmentation. Vérifiez visuellement que les zones reconnues comme des objets correspondent bien à la biomasse bactérienne.
- Transférer la couche d'objet de la g segmentéimages reen de canal vers les images de canal rouge correspondant (Segment de la couche d'objet de transfert →). Utilisez la fonction de l'éditeur d'objet à rejeter et à supprimer tous les objets dans les images des canaux rouge et vert. Maintenant que la matrice extracellulaire est laissée dans les images de biofilm. Export de la série d'images traitées sous forme de fichiers TIF.
- Importez la série d'images dans ImageJ (http://rsb.info.nih.gov/ij; v.1.47). Déterminer l'intensité de fluorescence moyenne dans les images de fond prises avec le laser désactivé (Analyser → Histogramme). Soustraire l'arrière-plan approprié à partir des images rouges et vertes (Processus → Math → Soustraire).
- Toujours dans ImageJ, diviser la série d'images verte (G1) par lui-même (processus → calculateur d'image). Puis, multiplier la série résultant de l'image (G2) avec la série d'image verte (G1). Cela donnera une série d'images (G3), où NaN est affecté à tous les pixels appartenant à des zones qui ont été reconnus comme des objets dans daime. Procéder til de même avec la série d'images rouge (R1 / R1 = R2; R2 x R1 = R3).
Remarque: Comme la biomasse bactérienne a été éliminée à partir des images à l'étape 4.3, l'intensité de fluorescence est égal à 0 dans ces zones. Étape 4.5 est nécessaire pour convertir la valeur 0 à NaN, qui permet le calcul de rapport à l'étape 4.6. - Appliquer le filtre 'Mean' (Process → Filtres → moyenne; rayon: 1 pixel) pour compenser le bruit du détecteur. Divisez le vert série d'images par la série d'image rouge (Processus → Calculatrice d'image). Il en résulte un rapport vert / rouge pour chaque pixel restant dans l'espace extracellulaire des images. Utilisez fausses couleurs pour la représentation graphique des ratios dans les images (tableaux image → Lookup). Calculer le rapport moyen pour chaque image (Analyser → Histogramme).
- Convertir les rapports vert / rouge pour des valeurs de pH en fonction de la fonction ajustée sous 1.9.2). Remarque: Un exemple pour les données d'étalonnage et courbe ajustée peut être vu dans Schlafer etal 2015 11.
Résultats
La méthode présentée permet extracellulaire de surveillance pH chute dans différents microenvironnements de biofilms dentaires dans la gamme de pH de 4,5 à 7 en temps réel. Si les conditions expérimentales sont choisies comme décrit ci-dessus, le pH commence à chuter dans tous les domaines des biofilms peu après l'exposition au glucose.
Lorsque le pH diminue dans un biofilm, les cellules bactériennes deviennent ...
Discussion
La surveillance microscopique du biofilm pH offre plusieurs avantages par rapport à l' électrode ou microélectrode mesures 4-6. techniques microscopiques permettent de déterminer le pH avec une haute résolution spatiale et permettre la capture des gradients de pH à la fois horizontale et verticale dans les biofilms sans perturber le biofilm mécaniquement. Les tentatives précédentes de surveillance du pH microscopique, cependant, omis de faire la différence entre le pH extracellulaire et intracel...
Déclarations de divulgation
Les auteurs ont rien à révéler.
Remerciements
Les auteurs tiennent à remercier Javier E. Garcia et Lene Grønkjær d'assistance technique et Merete K. Raarup pour des discussions fructueuses. Ce travail a été financé par la Fondation de recherche de l'Université d'Aarhus et de la Simon Spies Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| Zeiss LSM 510 META | Zeiss | N/A | |
| C-Apochromat 63X water immersion objective | Zeiss | N/A | |
| XL Incubator | PeCON | N/A | |
| SNARF-4F 5-(and-6)-Carboxylic Acid | Life Technologies | S23920 | |
| Dimethyl sulfoxide | Life Technologies | D12345 | |
| HEPES | Life Technologies | 11344-041 | |
| Costar 96-well black clear-bottom plate | Fisher Scientific | 07-200-567 | |
| Custom-made glass slabs (4 x 4 x 1 mm3; 1,200 grit) | Menzel | N/A | |
| Alginate impression material | GC Corporation | N/A | |
| Acrylic Adjusting Logic Sets/set of acrylic dental burs | Axis Dental | LS-906 | |
| Orthodontic retainer containers | Spark Medical Equipment Co., Ltd | SK-WDTC01 | |
| Sticky wax | Dentsply | N/A | |
| Chewing paraffin wax | Ivoclar Vivadent AG | N/A | |
| Dithiothreitol | Sigma Aldrich | D0632 | Used during preparation of salivary solution |
| 0.45 µm and 0.2 µm syringe filters | Sigma Aldrich | CLS431220; CLS431219 | |
| daime | University of Vienna, Austria | http://dome.csb.univie.ac.at/daime | |
| ImageJ | NIH, Bethesda, Maryland, USA | http://imagej.nih.gov/ij/ |
Références
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl. Environ. Microbiol. 71 (5), 2501-2510 (2005).
- Takahashi, N., Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42 (6), 409-418 (2008).
- Schlafer, S., et al. pH landscapes in a novel five-species model of early dental biofilm. PLoS. One. 6 (9), e25299 (2011).
- von Ohle, O. C., et al. Real-time microsensor measurement of local metabolic activities in ex vivo dental biofilms exposed to sucrose and treated with chlorhexidine. Appl. Environ. Microbiol. 76 (7), 2326-2334 (2010).
- Revsbech, N. P. Analysis of microbial communities with electrochemical microsensors and microscale biosensors. Methods Enzymol. 397, 147-166 (2005).
- Vanhoudt, P., Lewandowski, Z., Little, B. Iridium oxide pH microelectrode. Biotechnol. Bioeng. 40 (5), 601-608 (1992).
- Franks, A. E., et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energy & Environmental Science. 2 (1), 113-119 (2009).
- Hidalgo, G., et al. Functional tomographic fluorescence imaging of pH microenvironments in microbial biofilms by use of silica nanoparticle sensors. Appl. Environ. Microbiol. 75 (23), 7426-7435 (2009).
- Vroom, J. M., et al. Depth penetration and detection of pH gradients in biofilms by two-photon excitation microscopy. Appl. Environ. Microbiol. 65 (8), 3502-3511 (1999).
- Bender, G. R., Sutton, S. V., Marquis, R. E. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci. Infect. Immun. 53 (2), 331-338 (1986).
- Schlafer, S., et al. Ratiometric imaging of extracellular pH in bacterial biofilms using C-SNARF-4. Appl. Environ. Microbiol. 81 (4), 1267-1273 (2015).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J Oral Sci. 115 (6), 459-467 (2007).
- de Jong, M. H., van der Hoeven, J. S., van OS, J. H., Olijve, J. H. Growth of oral Streptococcus species and Actinomyces viscosus in human saliva. Appl. Environ. Microbiol. 47 (5), 901-904 (1984).
- Daims, H., Lucker, S., Wagner, M. daime, a novel image analysis program for microbial ecology and biofilm research. Environ. Microbiol. 8 (2), 200-213 (2006).
- Liu, Y. L., Nascimento, M., Burne, R. A. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int. J Oral Sci. 4 (3), 135-140 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon