このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
歯科バイオフィルムにおける細胞外のpHのレシオメトリックイメージング
要約
pH感受性レシオメトリック色素は、リアルタイムでの歯科バイオフィルム中の細胞外のpHを監視するために、共焦点レーザー走査顕微鏡とデジタル画像解析と組み合わせて使用されます。
要約
歯に細菌のバイオフィルム中のpHは、虫歯のための中心的な重要性の高い世界的な罹患率と疾患です。栄養素および代謝物は、歯科用バイオフィルム中に均一に分散されていません。バイオフィルム中の有機物との吸着、反応の複雑な相互作用は、溶質の拡散経路が減少し、バイオフィルムを横切って、有機酸を含む反応性分子の急な勾配を、作成します。このような蛍光寿命イメージングまたはpH ratiometryとして定量的な蛍光顕微鏡法は、歯のバイオフィルムの異なる微小環境のpHを可視化するために使用することができます。 pH ratiometryは、pH感受性色素の蛍光発光におけるpH依存性のシフトを利用します。二つの異なる波長での発光比率の計算は関係なく、染料の濃度の、顕微鏡像で局所的なpHを決定することができます。技術の微小電極に反して、リアルタイムに垂直と水平の両方のpH勾配を監視することができうち機械的にバイオフィルムを乱します。しかし、ケアは、バイオフィルムの細胞外および細胞内区画の間を正確に区別するために注意しなければなりません。ここでは、レシオメトリック色素、seminaphthorhodafluor-4F 5-(および-6)カルボン酸(C-SNARF-4)は、未知の種組成の歯のバイオフィルム成長のin vivoでの細胞外のpHを監視するために使用されます。染料をグルコースに暴露されるまで濃縮したバイオフィルム内のすべての細菌細胞の内部にあります。したがって、ユニバーサル細菌染色ように外pHのマーカーとしても使用されます。共焦点顕微鏡画像を取得した後、細菌バイオマスは専ら外pHを計算することを可能にするデジタル画像解析ソフトウェアを使用して、すべての画像から除去されます。レシオメトリック色素とのpH ratiometryは、最大75ミクロンの厚さの薄いバイオフィルムで外pHを研究するためによく適しているが、4.5と7.0の間のpH範囲に限定されています。
概要
ここに記載された方法は、共焦点レーザー走査顕微鏡と組み合わせて、レシオメトリック色素seminaphthorhodafluor-4F 5-(および6)を使用して、4.5と7の間の範囲内の歯科バイオフィルム中のカルボン酸(C-SNARF-4)の細胞外のpHをモニターし、できデジタル画像解析。採用蛍光色素はpH感受性であり、プロトン化の状態に応じて、その蛍光発光の変化を表示します。 580 nmでのプロトン化分子のピークの蛍光発光、及び640nmの1での脱プロトン化分子の発光。 2つの発光ピークを含む二つの検出窓における蛍光発光強度の比は、(576 - 608 nmで629 - 661 nm)はこのようにかかわらず、染料濃度の、液相のpHを反映します。 〜6.4 のpKaを有する色素が適度に酸性の環境のpHを視覚化するのに適しています。
細菌バイオフィルム中のPHは、すべての代謝プロセスのための中心的な重要性です。歯のバイオフィルムの場合には、細胞外マトリックス中のpHは、虫歯の開発のための重要な病原性因子です。バイオフィルム歯インタフェースリードでの低pHの拡張期間が根底にあるエナメル質2の脱灰を遅らせることを意味します。有機酸を含むバイオフィルム、代謝産物の複雑な3次元構造に、均一にバイオフィルム全体に分散されていません。非常に少ない酸産生微小環境は、空間的に近接3に見出すことができます。
何十年もの間、バイオフィルムの縦pH勾配は、微小電極4-6の助けを借りて記録しました。彼らは、小さなチップサイズのための良好な空間分解能を提供していますが、彼らは水平勾配を監視する非常に適していません。また、電極の挿入は、機械的に、バイオフィルムを乱します。定量的蛍光顕微鏡技術は、機械的な干渉なしに、バイオフィルムの異なる領域におけるpH変化を可視化するという利点を提供しますNCE。ビューの異なる顕微鏡視野を自由に選択し、長期間1,7-9にわたって繰り返し撮像することができます。顕微鏡バイオフィルムの画像を解釈するときしかし、細胞外空間から派生微生物バイオマス及び蛍光に由来する蛍光を区別することが重要です。細菌が活発にアデノシン三リン酸10を犠牲にし、それらの細胞膜を横切ってプロトンを輸送するように酸性条件下では、細菌細胞内部のpHは、細胞外マトリックス中のpHと異なっています。低細胞外pHは脱灰につながる一方、虫歯の文脈において、細胞内細菌のpHが根底にあるエナメル質に直接影響を持っていません。細菌フリーエリアと細菌の両方を含む顕微鏡画像で平均化pHは、誤った結果につながります。細菌バイオマスを視覚化し、細胞外および細胞内領域を区別するために、pH感受性色素と一緒に他の汚れの使用は、ABをもたらします11外空間と偽の測定値の蛍光汚染のリスクアウト。
本原稿は、したがって、二重の機能でレシオメトリック色素の使用を記載します。 pHをマーカーとしておよびユニバーサル細菌染色の両方。染料は、細菌細胞中に濃縮ように、共焦点顕微鏡画像で正確なデジタル画像分析手順の組み合わせは4.5と細い歯科用バイオフィルムにおける7.0の範囲の外のpHを測定することができます。
プロトコル
実験プロトコルを見直し、オーフス県(M-20100032)の倫理委員会によって承認されました。
レシオメトリック色素の1共焦点顕微鏡の校正
- 画像取得のために、インキュベーター、63X / 1.2-開口数水浸対物レンズ、543 nmのレーザーラインとMETA検出器を備えた倒立型共焦点顕微鏡を使用しています。
- 準備HEPES緩衝原液(0.1 pH単位のステップでpHを4.5から8.5に調整した50mMの、)。蛍光顕微鏡用の透明底96ウェルプレートのウェルに各溶液100μlをピペット。
- レシオメトリック色素C-SNARF-4を取り扱う際ニトリル手袋を着用してください。ジメチルスルホキシド中の染料の1 mMストック溶液を調製します。 HEPES緩衝液で各ウェルにストック溶液5μlを加えます。顕微鏡上で96ウェルプレートを置きます。
- 顕微鏡の電源をオンにします。顕微鏡ソフトウェアを開きます。次のパネルをクリックします。→レーザーを取得。 →Mを買収icro; →Config]を取得します。 →スキャンを買収。 →ステージを取得します。 37°Cまでインキュベーターをウォームアップ。
- 543 nmレーザーと「レーザー制御」画面でボタンを「オン」をクリックすることで、543 nmのレーザーラインをオンにします。 「顕微鏡制御」画面で63X / 1.2-開口数水浸対物レンズを選択してください。
- 661 nmの(赤)の間隔(「構成管理」→「CHS」)へのMETA同時に608-nmの576-内の蛍光を監視するための検出器(緑)、629-を設定します。レーザパワー(「構成管理」→「励起」)を調整します。 1.6ミクロン(「スキャン制御」→「ピンホール」)の光学的スライス厚を得るためのピンホールを設定します。
- 5μmの96ウェルプレートのガラス底の上に、それぞれのHEPES緩衝液の画像を取得します。注:焦点面がガラス底の下に位置されるとすぐに、何の蛍光が見られません画面上に。すべての第三の画像の後、ゼロにレーザパワーを設定し、背景差分画像を取ります。
- 三重での校正実験(1.2から1.7)を実行します。
- すべての赤と緑の画像の平均蛍光強度と標準偏差を決定します。
- 式に従って各画像について、比率Rおよび平均値の標準誤差、S Rを計算する (1)及び(2)
(1)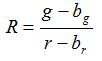
(2)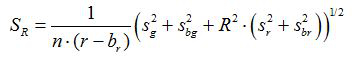
G、R、S GおよびS rは 、それぞれ緑色および赤色の画像における平均値と標準偏差。Bの G、B rは 、BGとの BRは、背景画像の対応する値は、N。れている。■あります 2は、撮像されたピクセルの数です。 - 図中の3つの複製の校正実験から各pH値の計算された比率をプロットし、データポイント( すなわちソフトウェアSigmaPlotの13を使用して)この一連の近似曲線を構築します。 pH値10に比率を変換することができ近似曲線から数学関数を作成します。
- 式に従って各画像について、比率Rおよび平均値の標準誤差、S Rを計算する (1)及び(2)
でその場グロウン歯科バイオフィルムサンプルの2コレクション
- 研究に関連する基準及び除外基準を満たすボランティアを選択します。その上下の歯列弓のアルギン酸塩印象を作ります。これらの感想からキャストモデルを作成し、下顎にアクリルスプリントを製造しています。ボランティアは正常咬合12に食い込むことができます舌側歯科矯正ワイヤーで接続された頬アクリルフランジとスプリントを設計します。
- アクリルスプリントの頬フランジにおけるドリル景気後退( 図1 )、歯科用アクリルバリの助けを借りて、バイオフィルムコレクション用ガラススラブの挿入を可能にします。凹部の幅と長さが挿入されるガラススラブの数に応じて変化し得るが凹部の深さは、1.5mm以上であるべきです。
- バイオフィルムの収集のために、自然のエナメル質11上のコロニー形成パターンを模倣するためにグリット1200の表面粗さを持つカスタムメイドの非蛍光ガラススラブ(4×4×1ミリメートル3)を使用します。
- 取り付けの前にオートクレーブ処理によりガラススラブを滅菌します。少し頬11の移動によって及ぼされる剪断力からバイオフィルムを保護するためにアクリル面の表面に凹状各側の頬フランジにおける窪みに粘着性ワックスでガラススラブをマウントします。
注:不況に配置されたガラススラブの数は、研究の目的に応じて、3と14の間で変化してもよいです。 - ボランティアの口の中に器具を挿入します。 volunに指示TEERは、実験期間を通して口腔内のアプライアンスを保持します。湿った紙組織片と歯列矯正リテーナー容器内のアプライアンスを格納するためのボランティアを指示歯磨きや食料や水以外の飲料の摂取時に室温で(多湿それを維持するため)。アプライアンスを配置し、除去しながらガラススラブと頬アクリルフランジに触れないようにボランティアを指示します。
注意:実験期間は、研究(数週間に1日)の目的に応じて変えることができます。 - 慎重に実験期間の終了時にアプライアンスからガラススラブを削除します。ナイフでスラブの周囲に粘着性のワックスを削除し、顕微鏡分析まで、密閉容器、上向きにバイオフィルムをピンセットでそれらを転送します。湿った紙組織と湿度の高い容器を保管してください。バイオフィルムの収集後数時間内のpHの撮影を行います。
3.バイオフィルムのpHイメージング
- 準備しますデ・ヨングらの方法に従って収集唾液にジチオスレイトールを添加することにより唾液ソリューション。13。 pHを7.0に唾液液を滴定し、0.4%(重量/容量)の濃度にグルコースを追加します。バイオフィルムあたりピペットで100μlを顕微鏡用ガラス底96ウェルプレートに分析されます。ウェルあたりレシオメトリック色素の5μlを添加します。
- 顕微鏡ステージ上の96ウェルプレートを置きます。顕微鏡および543 nmレーザーラインをオンにします。 37°Cまでインキュベーターをウォームアップ。染料のキャリブレーションと同じ顕微鏡の設定を使用します(手順1.5から1.6を参照)。 96ウェルプレートが作動温度に達するまで、30分間待ちます。
- ピンセットのスリムなセットで一つ以上のガラススラブをピックアップし、唾液で満たされたウェルに配置し、ウェルあたり1スラブ、下向きにバイオフィルム付き。
- 単一の画像を取得する(「スキャン制御」→「シングル」)またはz-スタック(「スキャン制御」→「スタート」)spanniさまざまな分野でのバイオフィルムの深さをngの。 zスタックを取得するには(「スキャン制御」→「Z設定」→「民スライス」)スライス数が撮像されることを選択し、顕微鏡ソフトウェア(「スキャンコントロール内の最初と最後のスライスのz位置をマーク"→" Z設定」→「マーク・ファースト ";"マークラスト」)。
注:最高75ミクロンの深さZ-スタックは、細胞外および細胞内領域との間の良好なコントラストで取得することができます。 - (「スキャン制御」→ "を顕微鏡ソフトウェア(「ステージとフォーカス制御」→「マーク順位」)でのxy位置をマークし、時間をかけて見るの顕微鏡視野内のpHの変化に追従し、連続した時点で繰り返し画像を撮影するために、シングル")。定期的にバックグラウンド減算のためにゼロに設定レーザパワーで画像を撮影します。
4.デジタル画像解析
- 万博へRT TIFファイルとして顕微鏡画像は、顕微鏡ソフトウェア(「マクロ」→「ファイルの一括エクスポート」)のファイルの一括エクスポートを使用します。マーク・エクスポートおよびTIF-ファイルなどの別のフォルダにある赤と緑のチャンネル画像を保存するファイルが(「バッチエクスポートを開始します」)。彼らに連続番号を与える両方のフォルダ内のファイルの名前を変更します。
- このようなdaime(微生物生態学におけるデジタル画像解析)14などのソフトウェアに赤と緑の画像シリーズをインポートします。セグメント個別に選択した明るさの閾値と緑のチャネル画像(自動セグメンテーション→カスタムしきい値→セグメント)。すべての細菌が(細胞外マトリックスよりも明るい)ではなく、マトリックスは、セグメンテーション中のオブジェクトとして認識されるように、ケア(一般的に20と80の間)で明るさのしきい値を選択します。オブジェクトとして認識された領域は、細菌バイオマスによく対応していることを視覚的に確認してください。
- セグメント化されたグラムのオブジェクト層を移し対応する赤チャンネルの画像にREENチャネル画像(セグメント→転送オブジェクト層)。赤と緑のチャネル画像内のすべてのオブジェクトを拒否し、削除するには、オブジェクトエディタ機能を使用してください。今だけ、細胞外マトリックスは、バイオフィルムの画像に残されています。 TIFファイルとして処理された画像シリーズをエクスポートします。
- (; v.1.47 http://rsb.info.nih.gov/ij)のImageJに画像シリーズをインポートします。レーザーで撮影した背景画像の平均蛍光強度を決定する(→ヒストグラムを分析)オフ。赤と緑の画像(数学→減算→プロセス)から適切なバックグラウンドを減算します。
- それでもImageJの中で、それ自体で緑の画像シリーズ(G1)(プロセス→イメージ計算)を分割します。そして、緑の画像シリーズ(G1)で得られた画像シリーズ(G2)を掛けます。これはNaNにはdaimeにオブジェクトとして認識された領域に属する全ての画素に割り当てられている画像シリーズ(G3)を、得られます。トンに進んでください彼赤の画像シリーズと同じように(R1 / R1 = R2、R2、X、R1 = R3)。
注:細菌バイオマスは、ステップ4.3の画像から削除されたように、蛍光強度は、これらの領域で0です。ステップ4.5は、ステップ4.6で比率計算を可能にするのNaNに値0を変換する必要があります。 - 検出器ノイズを補償するために、:; '平均'フィルタ(1ピクセル半径の平均→プロセス→フィルター)を適用します。赤の画像シリーズ(プロセス→画像計算)によって緑色映像シリーズを分割します。これは画像の外空間内のすべての残りのピクセルの緑/赤比になります。画像(イメージ→ルックアップテーブル)における比率のグラフ表示のための偽のカラーリングを使用してください。各画像の平均比率を計算する(ヒストグラム→分析)。
- 緑/赤比)は1.9.2の下に取り付けられた機能に応じてpH値に変換します。注:キャリブレーションデータと近似曲線の例はSchlafer らに見ることができますら、2015年11。
結果
提示された方法は、細胞外pHがリアルタイムで4.5〜7のpH範囲で歯科バイオフィルムの異なる微小環境に低下監視できます。上記のように実験条件が選択されている場合は、pHがまもなくグルコースに暴露した後のバイオフィルムのすべての分野で低下し始めます。
バイオフィルム内のpHが低下するとレシオメトリック色素?...
ディスカッション
バイオフィルムのpHの微小モニタリング電極又は微小電極の測定4-6と比較して、いくつかの利点を提供します。顕微鏡技術は、高い空間分解能でpHを決定し、機械的にバイオフィルムを乱すことなく、バイオフィルムの両方の水平および垂直のpH勾配を捕捉できるように許可します。微視的なpHモニタリングのこれまでの試みは、しかし、バイオフィルム1,7,9に外および細胞内pH...
開示事項
著者らは、開示することは何もありません。
謝辞
著者は、実りある議論のための技術支援とMerete K. Raarupためのハビエル・E.ガルシアとレネGrønkjærに感謝したいと思います。この作品は、オーフス大学研究財団によって資金を供給されたとサイモンは、財団をスパイ。
資料
| Name | Company | Catalog Number | Comments |
| Zeiss LSM 510 META | Zeiss | N/A | |
| C-Apochromat 63X water immersion objective | Zeiss | N/A | |
| XL Incubator | PeCON | N/A | |
| SNARF-4F 5-(and-6)-Carboxylic Acid | Life Technologies | S23920 | |
| Dimethyl sulfoxide | Life Technologies | D12345 | |
| HEPES | Life Technologies | 11344-041 | |
| Costar 96-well black clear-bottom plate | Fisher Scientific | 07-200-567 | |
| Custom-made glass slabs (4 x 4 x 1 mm3; 1,200 grit) | Menzel | N/A | |
| Alginate impression material | GC Corporation | N/A | |
| Acrylic Adjusting Logic Sets/set of acrylic dental burs | Axis Dental | LS-906 | |
| Orthodontic retainer containers | Spark Medical Equipment Co., Ltd | SK-WDTC01 | |
| Sticky wax | Dentsply | N/A | |
| Chewing paraffin wax | Ivoclar Vivadent AG | N/A | |
| Dithiothreitol | Sigma Aldrich | D0632 | Used during preparation of salivary solution |
| 0.45 µm and 0.2 µm syringe filters | Sigma Aldrich | CLS431220; CLS431219 | |
| daime | University of Vienna, Austria | http://dome.csb.univie.ac.at/daime | |
| ImageJ | NIH, Bethesda, Maryland, USA | http://imagej.nih.gov/ij/ |
参考文献
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl. Environ. Microbiol. 71 (5), 2501-2510 (2005).
- Takahashi, N., Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42 (6), 409-418 (2008).
- Schlafer, S., et al. pH landscapes in a novel five-species model of early dental biofilm. PLoS. One. 6 (9), e25299 (2011).
- von Ohle, O. C., et al. Real-time microsensor measurement of local metabolic activities in ex vivo dental biofilms exposed to sucrose and treated with chlorhexidine. Appl. Environ. Microbiol. 76 (7), 2326-2334 (2010).
- Revsbech, N. P. Analysis of microbial communities with electrochemical microsensors and microscale biosensors. Methods Enzymol. 397, 147-166 (2005).
- Vanhoudt, P., Lewandowski, Z., Little, B. Iridium oxide pH microelectrode. Biotechnol. Bioeng. 40 (5), 601-608 (1992).
- Franks, A. E., et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energy & Environmental Science. 2 (1), 113-119 (2009).
- Hidalgo, G., et al. Functional tomographic fluorescence imaging of pH microenvironments in microbial biofilms by use of silica nanoparticle sensors. Appl. Environ. Microbiol. 75 (23), 7426-7435 (2009).
- Vroom, J. M., et al. Depth penetration and detection of pH gradients in biofilms by two-photon excitation microscopy. Appl. Environ. Microbiol. 65 (8), 3502-3511 (1999).
- Bender, G. R., Sutton, S. V., Marquis, R. E. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci. Infect. Immun. 53 (2), 331-338 (1986).
- Schlafer, S., et al. Ratiometric imaging of extracellular pH in bacterial biofilms using C-SNARF-4. Appl. Environ. Microbiol. 81 (4), 1267-1273 (2015).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J Oral Sci. 115 (6), 459-467 (2007).
- de Jong, M. H., van der Hoeven, J. S., van OS, J. H., Olijve, J. H. Growth of oral Streptococcus species and Actinomyces viscosus in human saliva. Appl. Environ. Microbiol. 47 (5), 901-904 (1984).
- Daims, H., Lucker, S., Wagner, M. daime, a novel image analysis program for microbial ecology and biofilm research. Environ. Microbiol. 8 (2), 200-213 (2006).
- Liu, Y. L., Nascimento, M., Burne, R. A. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int. J Oral Sci. 4 (3), 135-140 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved