Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ratiometrisch Imaging von extrazellulären pH in Dental Biofilme
In diesem Artikel
Zusammenfassung
Ein pH-sensitive ratiometrisch Farbstoff wird in Kombination mit konfokaler Laser-Scanning-Mikroskopie und digitale Bildanalyse zur Überwachung der extrazellulären pH in der dentalen Biofilme in Echtzeit verwendet.
Zusammenfassung
Der pH-Wert in der bakteriellen Biofilmen auf den Zähnen ist von zentraler Bedeutung für die Zahnkaries, eine Krankheit mit einer hohen Prävalenz weltweit. Nährstoffe und Metaboliten sind nicht gleichmäßig in der dentalen Biofilm verteilt. Ein komplexes Zusammenspiel von Sorption und Reaktion mit organischen Stoffen im Biofilm reduziert die Diffusionswege von gelösten Stoffen und schafft Steigungen von reaktiven Molekülen, einschließlich organische Säuren, über den Biofilm. Quantitative Fluoreszenz mikroskopische Methoden, wie Fluoreszenzlebenszeit-Bildgebung oder pH ratiometrischen können pH in unterschiedlichen Mikroumgebungen von dentalen Biofilmen zu visualisieren eingesetzt werden. pH ratiometrischen nutzt eine pH-abhängige Verschiebung in der Fluoreszenzemission von pH-empfindlichen Farbstoffen. Berechnung des Emissionsverhältnis bei zwei unterschiedlichen Wellenlängen erlaubt die Bestimmung lokaler pH in mikroskopischen Bildern, unabhängig von der Konzentration des Farbstoffes. Im Gegensatz zu der Technik Mikroelektroden erlaubt sowohl vertikale als auch horizontale pH-Gradienten in Echtzeit-Überwachung mitaus mechanisch stören den Biofilm. Allerdings muss darauf geachtet werden genau zwischen extra- und intrazellulären Kompartimenten des Biofilms zu unterscheiden genommen werden. Hier ist die ratiometrisches Farbstoff, seminaphthorhodafluor-4F 5- (und-6) Carbonsäure (C-SNARF-4) verwendet wird , extrazellulären pH - Wert in in vivo gewachsen dentaler Biofilme unbekannter Artenzusammensetzung zu überwachen. Bei der Belichtung des Farbstoffes auf Glucose ist up-konzentriert innerhalb aller Bakterienzellen in den Biofilmen; Es ist somit sowohl als universelle bakterielle Flecken und als Marker des extrazellulären pH verwendet wird. Nach konfokalen mikroskopischen Bildaufnahme wird der Bakterienbiomasse aus allen Bildern mittels digitaler Bildanalyse-Software, entfernt, die extrazelluläre pH ausschließlich berechnen es erlaubt. pH ratiometrischen mit dem ratiometrisch Farbstoff ist gut geeignet extrazellulären pH in dünnen Biofilms von bis zu 75 & mgr; m Dicke zu untersuchen, wird jedoch auf den pH-Bereich zwischen 4,5 und 7,0 begrenzt.
Einleitung
Das hier beschriebene Verfahren ermöglicht im Bereich zwischen 4,5 und 7, mit der ratiometrisches Farbstoff in Kombination seminaphthorhodafluor-4F 5- (und-6) Carbonsäure (C-SNARF-4) in der dentalen Biofilm extrazellulären pH-Überwachung mit der konfokalen Laser-Scanning-Mikroskopie und Digitalbildanalyse. Der verwendete Fluoreszenzfarbstoff ist pH-empfindlich und zeigt eine Verschiebung in der Fluoreszenzemission über den Stand der Protonierung abhängig. Die Fluoreszenzemission der protonierten Molekül - Peaks bei 580 nm und die Emission des deprotonierten Moleküls bei 640 nm 1. Das Verhältnis der Fluoreszenzemissionsintensitäten in zwei Detektionsfenster aus den beiden Emissionsspitzen (576-608 nm und 629-661 nm) reflektiert somit pH in der flüssigen Phase, und zwar unabhängig von der Farbstoffkonzentration. Mit einem pK a von ~ 6,4 ist der Farbstoff geeignete pH in mäßig sauren Umgebungen zu visualisieren.
PH in bakterielle Biofilme ist von zentraler Bedeutung für alle Stoffwechselprozesse.Im Falle von Zahn Biofilmen, pH in der extrazellulären Matrix ist der Schlüssel Virulenzfaktor für die Entwicklung von Zahnkaries. Verlängerte mit niedrigem pH - Wert an der Biofilm-Zahn - Schnittstelle führen zu verlangsamen Entmineralisierung des zugrunde liegenden Schmelz 2. Aufgrund der komplexen dreidimensionalen Architektur von Biofilmen, Metaboliten, einschließlich organische Säuren, sind nicht gleichmäßig über den Biofilm verteilt. Hoch und weniger acidogene Mikroumgebungen kann 3 in enger räumlicher Nähe zu finden.
Seit Jahrzehnten vertikale pH - Gradienten in Biofilme wurden mit Hilfe von Mikroelektroden 4-6 aufgezeichnet. Während sie eine gute räumliche Auflösung aufgrund ihrer geringen Größe Spitze bieten, sind sie nicht gut geeignet horizontalen Gradienten zu überwachen. Außerdem Einführen der Elektrode stört die mechanisch Biofilm. Quantitative Fluoreszenz mikroskopischer Techniken bieten den Vorteil der pH-Änderungen in verschiedenen Bereichen eines Biofilms Visualisierung ohne mechanische interferierennce. Verschiedene mikroskopische Sichtfelder können frei gewählt werden und immer wieder über längere Zeiträume 1,7-9 abgebildet. Wenn jedoch mikroskopische Biofilm Bilder interpretieren, ist es wichtig, zwischen Fluoreszenz zu unterscheiden von der mikrobiellen Biomasse und Fluoreszenz aus dem extrazellulären Raum Ableitung abzuleiten. Unter sauren Bedingungen, pH innerhalb Bakterienzellen unterscheidet sich von pH in der extrazellulären Matrix, wie die Bakterien aktiv 10 Protonen über die Zellmembran auf Kosten von Adenosintriphosphat transportieren. Im Zusammenhang mit der Zahnkaries, intrazelluläre bakterielle pH-Wert hat keinen direkten Einfluss auf die zugrunde liegenden Schmelz während niedrige extrazellulären pH-Wert auf Entmineralisierung führt. Averaging pH-Wert in mikroskopischen Bildern, die sowohl bakterienfreie Zonen und Bakterien enthalten führt zu falschen Ergebnissen. Die Verwendung anderer Flecken zusammen mit dem pH-empfindlichen Farbstoff, um die bakterielle Biomasse und differenzieren zwischen extra- und intrazellulären Bereiche bringt ab zu visualisierenaus dem Risiko einer fluoreszierenden Kontamination des extrazellulären Raum und falsche Messungen 11.
Die vorliegende Manuskript beschreibt daher die Verwendung des ratiometrisches Farbstoff in einer Doppelfunktion; sowohl als pH-Marker und als universelle bakterielle Fleck. Da der Farbstoff up konzentrierter in Bakterienzellen ist, erlaubt die Kombination von konfokalen mikroskopischen Abbildungs und ein genaues digitales Bildanalyseverfahren die Bestimmung der extrazellulären pH-Wert im Bereich zwischen 4,5 und 7,0 in dünnen dental Biofilmen.
Protokoll
Das experimentelle Protokoll wurde von der Ethikkommission der Aarhus County (M-20100032) überprüft und genehmigt.
1. Konfokalmikroskopische Kalibrierung des Ratiometrisch Dye
- Für die Bildaufnahme, ein umgekehrtes konfokalen Mikroskop mit einem Inkubator, eine 63X / 1.2-numerische Apertur Wassertauchziel, eine 543 nm Laserlinie und ein META-Detektor ausgestattet verwenden.
- Bereiten Sie HEPES-Puffer-Stammlösungen (50 mM, eingestellt auf pH 4,5 bis 8,5 in Schritten von 0,1 pH-Einheiten). Je 100 & mgr; l jeder Lösung in die Vertiefungen einer klaren Boden 96-Well-Platte für Fluoreszenzmikroskopie.
- Tragen Sie Handschuhe aus Nitril, wenn die ratiometrisch Farbstoff Handhabung C-SNARF-4. Bereiten Sie eine 1 mM Stammlösung des Farbstoffs in Dimethylsulfoxid. In 5 ul der Stammlösung in jede Vertiefung mit HEPES-Puffer. Legen Sie die 96-Well-Platte auf dem Mikroskop.
- Schalten Sie das Mikroskop. Öffnen Sie die Mikroskop-Software. Klicken Sie auf die folgenden Panels: Erfassung → Laser; Erwerben → Micro; Erwerben → Config; Erwerben → Scannen; Erwerben → Bühne. Warm up den Inkubator auf 37 ° C.
- Schalten Sie den 543-nm-Laserlinie durch Klicken auf die 543-nm-Laser und dem "On" Taste in der "Laser Control" Fenster. Wählen Sie das 63X / 1.2-numerische Apertur Wassertauchziel in der "Microscope Control" Fenster.
- Stellen Sie den META-Detektor gleichzeitig überwachen Fluoreszenz innerhalb 576- bis 608-nm (grün) und 629- bis 661 nm (rot) Intervalle ( "Configuration Control" → "ChS"). Stellen Sie die Laserleistung ( "Configuration Control" → "Anregung"). Stellen Sie die Pinhole eine optische Schichtdicke von 1,6 um ( "Scan Control" → "Pinhole") zu erhalten.
- Erwerben Sie ein Bild jedes HEPES-Pufferlösung, 5 & mgr; m über dem Glasboden der 96-Well-Platte. Hinweis: Sobald der Fokusebene unter dem Glasboden gelegen ist, kann kein Fluoreszenzlicht zu sehenauf dem Bildschirm. Nach jedem dritten Bild, stellen Sie die Laserleistung ein Bild für Untergrundsubtraktion auf Null und nehmen.
- Führen Sie die Kalibrierung Experiment in dreifacher Ausfertigung (1,2-1,7).
- Bestimmen Sie die mittlere Fluoreszenzintensität und Standardabweichung in allen roten und grünen Bilder.
- Berechnen des Verhältnisses R und Standardfehler des Mittelwerts, S R, für jedes Bild entsprechend den Gleichungen (1) und (2)
(1)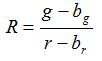
(2)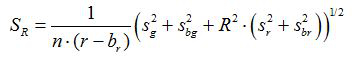
g, r, s und s g r sind die Mittelwerte und Standardabweichungen in den jeweiligen grünen und roten Bilder. b g, b r, s und s br bg die entsprechenden Werte für den Hintergrundbildern werden. n 2 ist die Anzahl der Bildpunkte abgebildet werden . - Plotten die berechneten Verhältnisse für jeden pH - Wert aus den drei Wiederholungskalibrierungsexperimente in einem Diagramm und bauen eine angepasste Kurve aus dieser Serie von Datenpunkten (dh unter Verwendung der Software SigmaPlot 13). Machen Sie eine mathematische Funktion aus der angepassten Kurve , die Verhältnisse in pH - Werten 10 umwandeln kann.
- Berechnen des Verhältnisses R und Standardfehler des Mittelwerts, S R, für jedes Bild entsprechend den Gleichungen (1) und (2)
2. Sammlung von In Situ Grown Dental Biofilm Proben
- Wählen Freiwilligen, die Ein- und Ausschlusskriterien für die Studie relevante erfüllen. Machen Sie Alginatabdrücke ihrer oberen und unteren Zahnbogen. Machen Sie Gussmodelle aus diesen Eindrücken und Produktion eines Acryl Schiene im Unterkiefer. Gestalten Sie die Schiene mit Wangen Acryl-Flansche durch eine linguale orthodontischen Draht verbunden , dass die Freiwilligen 12 beißen in die normale Okklusion ermöglicht.
- Drill Rezessionen in den bukkalen Flansche der Acryl-Schiene (Abbildung 1 ) Mit Hilfe von Zahnbohrern Acryl Insertion von Glasplatten für Biofilm Sammlung zu ermöglichen. Die Tiefe der Vertiefungen sollte mindestens 1,5 mm betragen, während die Breite und Länge der Vertiefungen in Abhängigkeit von der Anzahl von Glasplatten variieren können eingesetzt werden.
- Für Biofilm Sammlung verwenden maßgeschneiderte nicht fluoreszierenden Glasplatten (4 x 4 x 1 mm 3) mit einer Oberflächenrauheit von Körnung 1200 , um 11 , um die Kolonisierung Muster auf natürlichen Zahnschmelz zu imitieren.
- Sterilisieren der Glasplatten durch Autoklavieren vor der Montage. Montieren Sie die Glasplatten mit Klebewachs in den Vertiefungen in den bukkalen Flansche jeder Seite leicht auf der Oberfläche der Acryloberfläche vertieft , um den Biofilm von Scherkräften durch die Bewegung der Wangen 11 ausgeübt zu schützen.
Anmerkung: Die Zahl der Glasplatten in eine Rezession gestellt wird, kann zwischen 3 und 14, je nach dem Ziel der Studie variieren. - Stecken Sie das Gerät in den Mund des Freiwilligen. Weisen Sie den ehrenteer das Gerät intraoral über den Versuchszeitraum zu behalten. Weisen Sie den Freiwilligen das Gerät in einer orthodontischen Haltebehälter zu speichern, mit einem Stück feuchten Papiertuch (zu halten es feucht) bei Raumtemperatur während des Zähneputzens und Aufnahme von Nahrung und Getränken, ausgenommen Wasser. Weisen Sie den Freiwilligen nicht die Mund Acryl-Flansche mit den Glasplatten berühren beim Platzieren und das Gerät zu entfernen.
Hinweis: Die Versuchsdauer kann je nach dem Ziel der Studie (ein Tag bis zu mehreren Wochen). - die Glasplatten aus dem Gerät am Ende des Versuchszeitraums sorgfältig entfernen. Entfernen Sie die Klebewachs um die Platten mit einem Messer und übertragen sie mit einer Pinzette in einen geschlossenen Behälter, der Biofilm nach oben zeigt, bis mikroskopische Analyse. Halten Sie den Behälter mit nassen Papiertuch feucht. Führen pH-Bildgebung innerhalb von wenigen Stunden nach der Biofilm-Sammlung.
3. Biofilm pH Imaging
- BereitenSpeichel Lösung von Dithiothreitol zu gesammelten Speichel nach der Methode von de Jong et al Zugabe. 13. Titrieren der Speichellösung auf pH 7,0 und Zugeben von Glukose zu einer Konzentration von 0,4% (wt / vol). Je 100 & mgr; l pro Biofilm für die Mikroskopie in einem Glasboden-96-Well-Platte analysiert werden. In 5 ul des ratiometrischem Farbstoff pro Vertiefung.
- Legen Sie die 96-Well-Platte auf dem Mikroskoptisch. Schalten Sie das Mikroskop und die 543-nm-Laserlinie. Warm up den Inkubator auf 37 ° C. Verwenden Sie die gleichen Mikroskopeinstellungen wie für die Kalibrierung des Farbstoffs (siehe Schritte 1,5-1,6). Warten für 30 Minuten, bis die 96-Well-Platte Arbeitstemperatur erreicht hat.
- Pick-up eine oder mehrere Glasplatten mit einem dünnen Satz von Pinzette und legen Sie sie in den Speichel gefüllten Brunnen, eine Platte pro Vertiefung mit den Biofilmen nach unten zeigt.
- Erwerben Sie einzelne Bilder ( "Scan Control" → "Single") oder z-Stapel ( "Scan Control" → "Start") spanning die Tiefe der Biofilme in verschiedenen Bereichen. z-Stapel wählen die Anzahl der Scheiben zu erwerben abgebildet werden soll ( "Scan Control" → "Z Einstellungen" → "Num Slices") und markieren Sie die z-Position für die erste und die letzte Schicht in der Mikroskop-Software ( "Scan Control "→" Z Einstellungen "→" Mark First "," Mark Last ").
Anmerkung: Z-Stapel mit einer Tiefe von bis zu 75 & mgr; m können mit gutem Kontrast zwischen extra- und intrazellulären Bereichen erworben werden. - Zur pH-Änderungen in einem mikroskopischen Sichtfeld im Laufe der Zeit, markieren Sie die xy-Position in der Mikroskop-Software ( "Stage und Fokussteuerung" → "Mark Pos") und nehmen Sie wiederholt Bilder zu aufeinanderfolgenden Zeitpunkten ( "Scan Control" → "folgen Single"). nehmen Sie regelmäßig Bilder mit der Laserleistung auf Null für Untergrundsubtraktion gesetzt.
4. Digitale Bildanalyse
- Um export die mikroskopischen Bilder als TIF-Dateien, indem Sie die Datei Batch-Export des Mikroskop-Software ( "Macro" → "Datei-Export"). Markieren Sie die Dateien exportiert werden und speichern roten und grünen Kanal Bilder in separaten Ordnern als TIF-Dateien ( "Start-Export"). Benennen Sie die Dateien in beiden Ordnern ihnen fortlaufenden Nummern geben.
- Importieren Sie die roten und grünen Bildserien in Software wie Daime (digitale Bildanalyse in der mikrobiellen Ökologie) 14. Segment die grünen Kanalbilder mit individuell ausgewählten Helligkeitsschwellen (Segment → Automatische Segmentierung → Benutzerdefinierte Schwelle). Wählen, um die Helligkeitsschwellen vorsichtig (in der Regel zwischen 20 und 80), so dass alle Bakterien (heller als die extrazelluläre Matrix), nicht aber die Matrix wird als Objekte bei der Segmentierung erkannt werden. Überprüfen Sie visuell, dass die Bereiche als Objekte erkannt entsprechen gut auf die bakterielle Biomasse.
- Übertragen Sie die Objektschicht des segmentierten green Kanalbilder mit den entsprechenden roten Kanal Bilder (Segment → Übertragung Objektschicht). Verwenden Sie den Objekt-Editor-Funktion zu verwerfen und alle Objekte in den roten und grünen Kanal Bilder zu löschen. Jetzt nur die extrazelluläre Matrix wird in der Biofilm Bilder gelassen. Exportieren Sie die verarbeiteten Bildserie als TIF-Dateien.
- Importieren Sie die Bilderserie in ImageJ (http://rsb.info.nih.gov/ij; v.1.47). Bestimmen Sie die durchschnittliche Fluoreszenzintensität in den Hintergrundbildern mit dem Laser genommen ausgeschaltet (Analyse → Histogramm). Ziehen Sie den entsprechenden Hintergrund von den roten und grünen Bilder (Process → Math → subtrahieren).
- Noch in ImageJ, teilen Sie die grüne Bilderserie (G1) mit sich selbst (Bild Rechner Prozess →). Dann multiplizieren Sie das resultierende Bild-Serie (G2) mit dem grünen Bild-Serie (G1). Dies wird eine Bildserie (G3) ergeben, wobei NaN allen Pixeln zugewiesen gehört zu den Bereichen, die als Objekte in daime erkannt wurden. Gehen Sie in ter dieselbe Weise mit der roten Bildreihe (R1 / R1 = R2; R2 x R1 = R3).
Hinweis: Da die bakterielle Biomasse aus den Bildern in Schritt 4.3, die Fluoreszenzintensität 0 ist in diesen Bereichen entfernt wurde. Schritt 4.5 ist notwendig, den Wert 0 bis NaN zu konvertieren, die in Schritt 4.6 für Verhältnisberechnung ermöglicht. - Übernehmen Sie die 'mean' Filter (Process → Filter → Mittelwert; Radius: 1 Pixel) für Detektorrauschen zu kompensieren. Teilen Sie die grüne Bild Serie durch die rote Bildserien (Prozess → Bildrechner). Dies führt zu einer Grün / Rot-Verhältnis für jeden verbleibenden Pixel in den extrazellulären Raum der Bilder. Verwenden Sie falsche Farbgebung für die grafische Darstellung der Verhältnisse in den Bildern (Bild → Lookup-Tabellen). Berechnen Sie die mittlere Verhältnis für jedes Bild (Analyse → Histogramm).
- Konvertieren Sie die grün / rot-Verhältnisse auf pH-Werte entsprechend der Funktion unter 1.9.2 eingebaut). Hinweis: Ein Beispiel für die Kalibrierungsdaten und angepassten Kurve in Schlafer et gesehen werdenal, 2015 11.
Ergebnisse
Das vorgestellte Verfahren ermöglicht die Überwachung der extrazellulären pH-Wert fällt in unterschiedlichen Mikroumgebungen von dentalen Biofilmen im pH-Bereich von 4,5 bis 7 in real-time. Wenn die Versuchsbedingungen gewählt werden, wie oben beschrieben, beginnt pH kurz in allen Bereichen der Biofilme zu fallen nach Exposition gegenüber Glucose.
Wenn der pH in einem Biofilm abfällt, werden Bakterienzellen sichtbar inn...
Diskussion
Mikroskopischen Überwachung von Biofilm pH bietet mehrere Vorteile, wie 4-6 Elektrode oder Mikroelektroden - Messungen verglichen. Die mikroskopische Techniken erlauben pH-Wert mit einer hohen räumlichen Auflösung zu bestimmen und ermöglichen sowohl horizontale als auch vertikale pH-Gradienten in Biofilmen Erfassung ohne den Biofilm mechanisch zu stören. Frühere Versuche von mikroskopisch kleinen pH - Überwachung gelang es jedoch nicht , zwischen extra- und intrazellulären pH - Wert in den Biofilmen <...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren möchten Javier E. Garcia und Lene Grønkjær für die technische Unterstützung und Merete K. Raarup für fruchtbare Diskussionen. Diese Arbeit wurde von Aarhus University Research Foundation finanziert und die Simon Spies-Stiftung.
Materialien
| Name | Company | Catalog Number | Comments |
| Zeiss LSM 510 META | Zeiss | N/A | |
| C-Apochromat 63X water immersion objective | Zeiss | N/A | |
| XL Incubator | PeCON | N/A | |
| SNARF-4F 5-(and-6)-Carboxylic Acid | Life Technologies | S23920 | |
| Dimethyl sulfoxide | Life Technologies | D12345 | |
| HEPES | Life Technologies | 11344-041 | |
| Costar 96-well black clear-bottom plate | Fisher Scientific | 07-200-567 | |
| Custom-made glass slabs (4 x 4 x 1 mm3; 1,200 grit) | Menzel | N/A | |
| Alginate impression material | GC Corporation | N/A | |
| Acrylic Adjusting Logic Sets/set of acrylic dental burs | Axis Dental | LS-906 | |
| Orthodontic retainer containers | Spark Medical Equipment Co., Ltd | SK-WDTC01 | |
| Sticky wax | Dentsply | N/A | |
| Chewing paraffin wax | Ivoclar Vivadent AG | N/A | |
| Dithiothreitol | Sigma Aldrich | D0632 | Used during preparation of salivary solution |
| 0.45 µm and 0.2 µm syringe filters | Sigma Aldrich | CLS431220; CLS431219 | |
| daime | University of Vienna, Austria | http://dome.csb.univie.ac.at/daime | |
| ImageJ | NIH, Bethesda, Maryland, USA | http://imagej.nih.gov/ij/ |
Referenzen
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl. Environ. Microbiol. 71 (5), 2501-2510 (2005).
- Takahashi, N., Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42 (6), 409-418 (2008).
- Schlafer, S., et al. pH landscapes in a novel five-species model of early dental biofilm. PLoS. One. 6 (9), e25299 (2011).
- von Ohle, O. C., et al. Real-time microsensor measurement of local metabolic activities in ex vivo dental biofilms exposed to sucrose and treated with chlorhexidine. Appl. Environ. Microbiol. 76 (7), 2326-2334 (2010).
- Revsbech, N. P. Analysis of microbial communities with electrochemical microsensors and microscale biosensors. Methods Enzymol. 397, 147-166 (2005).
- Vanhoudt, P., Lewandowski, Z., Little, B. Iridium oxide pH microelectrode. Biotechnol. Bioeng. 40 (5), 601-608 (1992).
- Franks, A. E., et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energy & Environmental Science. 2 (1), 113-119 (2009).
- Hidalgo, G., et al. Functional tomographic fluorescence imaging of pH microenvironments in microbial biofilms by use of silica nanoparticle sensors. Appl. Environ. Microbiol. 75 (23), 7426-7435 (2009).
- Vroom, J. M., et al. Depth penetration and detection of pH gradients in biofilms by two-photon excitation microscopy. Appl. Environ. Microbiol. 65 (8), 3502-3511 (1999).
- Bender, G. R., Sutton, S. V., Marquis, R. E. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci. Infect. Immun. 53 (2), 331-338 (1986).
- Schlafer, S., et al. Ratiometric imaging of extracellular pH in bacterial biofilms using C-SNARF-4. Appl. Environ. Microbiol. 81 (4), 1267-1273 (2015).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J Oral Sci. 115 (6), 459-467 (2007).
- de Jong, M. H., van der Hoeven, J. S., van OS, J. H., Olijve, J. H. Growth of oral Streptococcus species and Actinomyces viscosus in human saliva. Appl. Environ. Microbiol. 47 (5), 901-904 (1984).
- Daims, H., Lucker, S., Wagner, M. daime, a novel image analysis program for microbial ecology and biofilm research. Environ. Microbiol. 8 (2), 200-213 (2006).
- Liu, Y. L., Nascimento, M., Burne, R. A. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int. J Oral Sci. 4 (3), 135-140 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten