Method Article
تسجيل درجة الحرارة التي يسببها العصبية آخر من خلال مراقبة التغيرات الكالسيوم في البصلة الشمية من
* These authors contributed equally
In This Article
Summary
Here we describe a protocol for measuring and analyzing temperature responses in the olfactory bulb of Xenopus laevis. Olfactory receptor neurons and mitral cells are differentially stained, after which calcium changes are recorded, reflecting a sensitivity of some neural networks in the bulb to temperature drops induced at the nose.
Abstract
The olfactory system, specialized in the detection, integration and processing of chemical molecules is likely the most thoroughly studied sensory system. However, there is piling evidence that olfaction is not solely limited to chemical sensitivity, but also includes temperature sensitivity. Premetamorphic Xenopus laevis are translucent animals, with protruding nasal cavities deprived of the cribriform plate separating the nose and the olfactory bulb. These characteristics make them well suited for studying olfaction, and particularly thermosensitivity. The present article describes the complete procedure for measuring temperature responses in the olfactory bulb of X. laevis larvae. Firstly, the electroporation of olfactory receptor neurons (ORNs) is performed with spectrally distinct dyes loaded into the nasal cavities in order to stain their axon terminals in the bulbar neuropil. The differential staining between left and right receptor neurons serves to identify the γ-glomerulus as the only structure innervated by contralateral presynaptic afferents. Secondly, the electroporation is combined with focal bolus loading in the olfactory bulb in order to stain mitral cells and their dendrites. The 3D brain volume is then scanned under line-illumination microscopy for the acquisition of fast calcium imaging data while small temperature drops are induced at the olfactory epithelium. Lastly, the post-acquisition analysis allows the morphological reconstruction of the thermosensitive network comprising the γ-glomerulus and its innervating mitral cells, based on specific temperature-induced Ca2+ traces. Using chemical odorants as stimuli in addition to temperature jumps enables the comparison between thermosensitive and chemosensitive networks in the olfactory bulb.
Introduction
Over the last years, temperature sensitivity has no longer been described as a somesthetic sense only, but also as a physiological function relevant for the olfactory system. In rodents, the main olfactory bulb receives input from the Grueneberg ganglion (GG), an organ in the nasal cavity, consisting of thermosensitive neurons. GG neurons respond to cool temperatures1 as well as to chemical stimuli, and their chemosensitivity is modulated by temperature fluctuations2. These observations suggest that the olfactory bulb may integrate chemical and temperature information collected at the nose. In order to explore this hypothesis, we present here a set of experiments enabling the detection of temperature responses in the olfactory bulb of non-transgenic animals, using the Xenopus laevis larva as a model. The organization of the olfactory system in these animals closely resembles that of mammals. The olfactory receptor neurons of premetamorphic X. laevis terminate in tufts, and make synaptic contacts with the dendrites of second-order neurons, the mitral cells. Pre- and postsynaptic fibers intermingle and form skein-like neuropil structures called glomeruli3. The abundant synapses of the glomerular layer represent the first processing center of olfactory information. Mitral cells further integrate the sensory input and convey it to higher olfactory areas.
We have developed a protocol combining electroporation of olfactory receptor neurons (ORNs) with calcium-sensitive and non-sensitive dyes followed by bolus loading of the postsynaptic network of glomeruli and mitral cells. The staining by electroporation of two spectrally distinct dyes loaded in the nasal cavities serves to single out the γ-glomerulus3 through its bilateral innervation by ORNs from both olfactory epithelia. Thus, the location of the γ-glomerulus is identified prior to further measurements. Subsequently, bolus loading4 with Fluo-8 acetoxymethyl (Fluo-8 AM) is carried out in a volume comprising the γ-glomerulus. Imaging calcium changes with fast confocal microscopy allows the visualization of temperature responses in the 3D neuropil surrounding the γ-glomerulus, a unique temperature-sensitive glomerulus in this system5. Mitral cells innervating this specific structure can also be identified by their Ca2+ signals responsive to induced temperature drops. Next, activity correlation imaging6 uses the specific Ca2+ traces of these cells to reveal the dendritic morphology of thermosensitive mitral cells. Alternating repeated applications of cold Ringer solution and chemical odorants in one measurement can be used to visualize the mitral cell networks for odor and temperature processing surrounding the γ-glomerulus and identify potential overlaps. To unambiguously assign the responses to either the chemical or the temperature stimulus, we constantly monitor temperature at the olfactory epithelium.
Protocol
تم إجراء جميع التجارب مع الضفادع الصغيرة المورق القيطم فقا للمبادئ التوجيهية التي وافقت عليها لجنة جامعة غوتنغن من الأخلاق في التجارب على الحيوانات.
1. Electroporation لل
- اختيار الحيوانات من مراحل 49-54 وفقا لNieuwkoop وفابر 7.
- تأكد من أن الإعداد تسجيل يتكون من مجهر تشريحي مع مسافة عمل كبيرة وجهاز Electroporation للوالتي يمكن تطبيقها نبضات الجهد من 20 فولت لمدة 20 ميللي ثانية بتردد لا يقل عن 2 هرتز. تطبيق نبضات الجهد عن طريق اثنين من أقطاب البلاتين مع قطر الخام من 200 ميكرون بحيث يمكن إدراجها في الخياشيم الضفادع الصغيرة من دون التسبب في اضرار.
- إعداد بلورات من صبغ مترافق ديكستران (على سبيل المثال، الكالسيوم الأخضر 10 كيلو دالتون ديكستران، أو فلور اليكسا 647 10 كيلو دالتون ديكستران) عن طريق إذابة كمية عادة تسليم من 5 ملغ في حوالي 100 ميكرولتر من الماء المقطر وترك قطرات صغيرة من2 ميكرولتر الجافة على ورقة من بارافيلم.
ملاحظة: البلورات الجافة في أقل من يوم واحد ويمكن تخزينها بعد ذلك في -18 درجة مئوية في الفريزر لمدة أكثر من عام. - تخدير الحيوانات عن طريق وضعها فى ماء الصنبور التي تحتوي على 3٪ تريكين الميثان سلفونات لمدة 1-2 دقيقة حتى تصل إلى حالة التخدير الجراحي تتميز انخفض معدل ضربات القلب، وفقدان جميع الحركات وعدم الاستجابة للمؤثرات الميكانيكية.
- تزج الحيوان تخدير لمدة 10 ثانية في مياه الحنفية النقي.
- وضع الحيوان على وسادة هلام واصلاحها عن طريق وضع الإبر حوله دون الاضرار بها.
ملاحظة: لا إصلاح الحيوانية بدس الإبر من خلال جلدها. - يجف بلطف المنطقة المحيطة الخياشيم بمنديل ورقي.
- وضع الحيوان تحت مجهر تشريحي والتركيز على فتحتي الأنف.
- استخدام ملقط لاختيار الكريستال صبغ من حجم مطابقة ثقب المنخر، وضعه في واحدة من الجيوب الأنفية والانتظار حتى يذوب تماما، ثهيك يستغرق أقل من 1 دقيقة. إذا البلورات هي أصغر، إضافة 2 أو 3 في كل تجويف حتى أنها تنتج حلا تتركز عالية غير شفافة.
- وضع القطب السالب على الجلد من الشرغوف والأنود في واحدة من الخياشيم.
ملاحظة: ينطبق هذا الإعداد خاص لالأصباغ استشهد في الخطوة 1.3. للاصباغ مع قطبية مختلفة، يمكن تحسين نتائج تلطيخ عن طريق وضع الكاثود في فتحتي الأنف. إذا لم تكن متأكدا حول قطبية من الصبغة، كل من الأقطاب الكهربائية يمكن وضعها في وقت واحد في فتحتي الأنف (واحد لكل الأنف)، والأقطاب تناوبت بين نبضات الجهد واحدة. - تطبيق ستة البقول من 20 V و 20 ميللي ثانية مع ما يقرب من 0.5 ثانية من فترة التحفيز.
ملاحظة: يجب أن تظهر الفقاعات الصغيرة حول القطب في الأنف خلال Electroporation للشريطة أن الأقطاب الكهربائية على تماس مع الجلد والحل في الأنف. إذا لم يكن هناك فقاعات واضحة تحقق من الكابلات التي تربط وتأكد من ديفيتش electroporatingه يتم تسليم نبض الجهد المطلوب. - كرر الإجراء (1،9 حتي 1،11) للمنخر الثاني.
- نقل الشرغوف electroporated في كأس مملوءة ماء الصنبور في درجة حرارة الغرفة. انتظر 5 إلى 10 دقيقة حتى الحيوان يستعيد وعيه ويستأنف السباحة. يطعمه والسماح لها استعادة ل1 في اليوم على الاقل خلالها يتم نقل الصبغة على طول العصب الشمي إلى البصلة الشمية.
- استخدام الحيوانات electroporated في غضون 1-7 أيام بعد Electroporation للحصول على أفضل النتائج التصوير. منح لا يقل عن 24 مرة في الساعة لنقل صبغ والانتعاش قبل التصوير.
2. جبل إعداد الجامع
- تخدير الحيوان في مياه الحنفية تحتوي على 3٪ تريكين الميثان سلفونات حتى توقفت جميع الحركات وأنه لم يعد يستجيب لبالتحفيز الميكانيكي.
- نقل الشرغوف على وسادة هلام تحت مجهر تشريحي واصلاحها بإحكام من قبل بدس الإبر عن طريق الجلد على كل جانب من FOrebrain.
- التضحية الشرغوف بقطع الحبل الشوكي لها.
- استخدام مشرط لتشريح خارج كتلة من الأنسجة التي تحتوي على كل الجيوب الأنفية، والأعصاب الشمية وبصيلات الشم (الشكل 1A). جعل شق الأولى بالقرب من الأيسر الأنف من دون لمسها ونقل شفرة القطع إلى الأمام جنبا إلى جنب مع العصب الشمي الأيسر ولمبة حتى الحدود بين الدماغ الانتهائي الدماغ البيني. تحذو حذوها على الجانب الأيمن. عزل إعداد من بقية الجهاز العصبي عن طريق خفض الخلفي النهائية إلى الدماغ الانتهائي.
- تخلص الجسم من الشرغوف والوجه بعناية كتلة الأنسجة رأسا على عقب بحيث الجانب البطني من إعداد الدماغ يواجه صعودا.
- دبوس كتلة الأنسجة مرة أخرى عن طريق إدخال إبرتين بين الأعصاب الشمية.
- وضع قطرة من حل الضفدع قارع الأجراس (98 ملي كلوريد الصوديوم، 2 مم بوكل، 1 ملم CaCl 2، 2 مم MgCl 2، 5 ملي الجلوكوز، 5 ملي نا البيروفات، 10 ملي HEPES، تعديلها لدرجة الحموضة 7.8، osmolaاألمن من 230 mOsmol / L) على الأنسجة.
- إزالة السحايا تغطي منطقة الفرز محور عصبي وبصيلات الشم من خلال جعل ثلاثة شقوق باستخدام مقص غرامة. بدءا من الحافة الخلفية للكتلة الأنسجة، وقطع caudorostrally عن كثب على طول البصلة الشمية اليسار حتى نقطة الدخول للأعصاب الشم في المصابيح (الفرز منطقة محور عصبي).
- كرر الخطوة 2.8 لالنصف الأيمن.
- رفع السحايا مع ملقط وجعل خفض الثالث، عمودي على سابقاتها في منطقة الفرز محور عصبي.
ملاحظة: الجانب البطني من البصلة الشمية أصبح متاحا الآن للتصوير والبلعة التحميل. - لتحسين جودة الصورة في الصورة الخفيفة التي تنتقل، كرر الإجراء بالنسبة للجانب الظهرية. ويمكن لهذه الخطوات الإضافية تسهيل التنقل من micropipette لبلعة تحميل، ولكنها ليست ضرورية للغاية.
- نقل العينة إلى غرفة تسجيل مليئة الضفدع قارع الأجراس لمزيد من المعالجة والتصوير. جعل الصورةلدى عودتهم أن الجانب البطني يواجه صعودا وتأمين عينة مع شبكة من الألياف النايلون امتدت على مدى إطار البلاتين صغير.
- لتطبيق أسهل من المحفزات وضع الجيوب الأنفية على رأس واحدة من ألياف النايلون.
3. بولس تحميل
- حل 50 ميكروغرام من الكالسيوم AM صبغ (على سبيل المثال، فلوو-08:00) في 20 ميكرولتر من سلفوكسيد ثنائي ميثيل ([دمس]) التي تحتوي على 20٪ من Pluronic F-127 (ث / ت) لإعداد محلول المخزون صباحا صبغ. تجميد الحلول الأسهم في قسامات صغيرة من 1-2 حجم ميكرولتر. الحل الأسهم مستقرة لمدة سنة ونصف على الأقل ولكن تجنب تجميد أذاب دورات.
- استخدام مجتذب micropipette وسحب الماصات مع المقاومة من 5-8 MΩ وقطرها غيض من 1-2 ميكرومتر.
- حل حل الأوراق المالية على استعداد للصباغة في حل الضفدع رينغر بتركيز 250-500 ميكرومتر.
- إضافة MK571 للوصول إلى تركيز 500 ميكرومتر لمنع نقل المقاومة للأدوية المتعددة.
- ملء micropipette مع 10 ميكرولتر من الحل باستخدام طرف ماصة ممدود وإزالة جميع فقاعات الهواء عن طريق عبها micropipette.
- جبل micropipette في حامل ماصة وتأكد من أن الضغط يمكن تطبيقها إما يدويا مع حقنة أو هوائي جهاز طرد المخدرات ومراقبة الضغوط التي مورست مع مقياس.
- إذا كان ذلك ممكنا، واستخدام الإعداد المجهر مع القدرة على إثارة صبغ حقن بحيث تدفق من طرف micropipette يمكن تصور وتعديلها. من الناحية المثالية، استخدم الإعداد والتصوير متحد البؤر. استخدام المجهر تستقيم مع الهدف الغمر بحيث يمكن الوصول إلى الأنسجة مع micropipette.
- ضع إعداد جبل كله تحت المجهر، اتبع العصب الشمي حتى لمبة والتركيز على مجال الاهتمام في البصلة الشمية.
- يروي حل قارع الأجراس جديدة من خلال غرفة تسجيل من أجل زيادة قابلية إعداد وتغسل تسريب صبغمن طرف micropipette.
- انخفاض ماصة على سطح البصلة الشمية، مع تلميح يشير إلى الاتجاه منقاري من التحضير.
- تطبيق الضغط الايجابي المستمر الصغيرة و(~ 25 هكتوبسكال) إلى micropipette لمنع انسداد ماصة بلطف وأدخله في الأنسجة.
- مرة واحدة ماصة قد أخلت طبقات الأنسجة الخارجية، وتحريكه في اتجاه rostro الظهري في طبقة الخلايا التاجية. (لاحظ أن تلطيخ مكافحة الخلايا العصبية مستقبلات حاسة الشم التي كتبها Electroporation للمفيد لضبط موقف micropipette ل.) ومن الناحية المثالية، ضع طرف ماصة على مسافة 50-100 ميكرون من موقع تسجيل المرجوة.
- لتلطيخ γ-الكبيبة حساسة للحرارة، استهداف مساحتها حوالي 50 ميكرون rostrally من موقف neuropil قبل المشبكي من γ-الكبيبة.
- تطبيق الضغط الايجابي في نطاق 100-200 هكتوبسكال. ضبط قوة الضغط اعتمادا على حجمغيض micropipette. تأكيد تدفق من ماصة من خلال مشاهدة لحركات الأنسجة طفيفة مرئية تحت إضاءة brightlight عندما يتم تطبيق الضغط لأول مرة.
- الحفاظ على الضغط المستمر لمدة 10 دقيقة في حين لا يزال micropipette في الأنسجة. إذا كان ذلك ممكنا، والتحقق من neuropil في هذه الأثناء لتحميل خلية تحت إضاءة الفلورسنت كما تحميل ناجحة سيؤدي إلى تلطيخ مرئية خلية somata مع زيادة شدة مع مرور الوقت.
ملاحظة: غالبا ما يكون السبب لتحميل ناجحة هو ماصة انسداد بسبب الأنسجة دخول طرف أو مجموعات صبغ تجميعها. ومن الممكن في بعض الأحيان لانقاذ ماصة عن طريق كسر بلطف طرفها ضد السطح السفلي من غرفة تسجيل. ومع ذلك، لا ينبغي أن يتجاوز طرف ماصة بضعة ميكرومتر. تعويض فتحات ماصة أكبر عن طريق الضغط أقل خلال البلعة التحميل. - بعد 10 دقيقة من التحميل، والحد من الضغوط التي مورست على الصفر والتحقق من تلطيخ.
ملاحظة: حجم منطقة الملون يختلف اختلافا كبيرا ويعتمد على عدة معايير مثل كمية من الصبغة وحقن مكان موقع قذف. وتلطيخ جيد ويغطي مساحة قدرها حوالي 100 ميكرون × 100 ميكرون. - إذا كانت المنطقة الملون صغيرة جدا أو لا تغطي الموقع تسجيل المطلوبة، كرر الخطوات 3،10-3،13. استخدام نفس micropipette لحقن القادم إذا لم انسداد بعد.
- انتظر 30 دقيقة على الأقل بعد حقن الماضي قبل البدء في أي تجارب للسماح امتصاص الصبغة وdeesterification. تواصل يروي غرفة تسجيل مع حل قارع الأجراس العذبة في جميع الأوقات.
4. إعدادات القياس
- تأكد من أن الإعداد قياس يتكون من المجهر متحد البؤر بالسرعة الكافية لتسجيل ثلاثة مجلدات الأبعاد. اختيار معدل الاستحواذ على الأقل 1 هرتز في كومة.
ملاحظة: تشمل الاجهزة مناسبة على سبيل المثال المجاهر خط إضاءة مسح عينة خط الحكمة بدلا من النقطة صoint. وتحقيق بسيط مثل هذا الإعداد وقد وصفت سابقا 6. خيارات أخرى هي الغزل المجاهر القرص. إذا لم يكن هناك مثل هذا الإعداد هو متاح، فإنه لا يزال من الممكن قياس مساحات أصغر مع إعداد نقطة المسح العادي. - تعيين المعلمات قياس بحيث يمكن تغطية حجم كبير بما يكفي لتناسب حجم الكبيبة.
ملاحظة: سمك نموذجي من حجم تسجيل في نطاق من 20 ميكرون التي ينبغي أن يشملها لا يقل عن 5 طبقات. - تحقق من كل القياسات قبل المشبكي للتبييض. ضبط قوة الليزر حتى لا ينخفض متوسط كثافة مضان من الصور المسجلة على مدار الساعة للتسجيل.
- يحدد الوقت القياس ومنطقة للتسجيلات على الجانب بعد المشبكي لتجنب التبييض قدر الإمكان، على الرغم من القياسات تتجاوز 20-30 ثانية تبيض ومن المرجح أن يحدث.
5. التطبيق الرائحة والتجارب درجة الحرارة
- صب 25مل من محلول رينجر جديدة (المخزنة مسبقا في 4 درجات مئوية) في أنبوب 50 مل. وضع أنبوب في دلو الجليد.
- رصد درجات الحرارة من قارع الأجراس تبريد عن طريق إدخال مسبار نظيفة من ميزان حرارة داخل الأنبوب. الانتظار حتى تنخفض درجة الحرارة أقل من 1 درجة مئوية قبل البدء في التجربة.
- تجهيز 50 مل من L-الحامض الاميني الذائبة في حل قارع الأجراس عند تركيز من 10 ميكرومتر.
- استخدام قضيب قمع 8 أو تطبيق نظم مماثلة السماح تسليم التحفيز بصورة متزامنة إلى قارع الأجراس perfusing بحيث يبقى تدفق الماء في الغرفة مستمر ودون انقطاع خلال الافراج عن حل التحفيز. ضع قمع في مثل هذه الطريقة أن منفذ البعيدة أقل من 1 ملم بعيدا عن الظهارة الشمية.
- وضع جهاز استشعار درجة الحرارة NiCr ني متصلة على مقربة ميزان الحرارة الرقمي للظهارة ومنفذ للقضيب قمع. سلك منفذ إخراج الحرارة إلى جهاز كمبيوتر لتسجيل وديس بصرياتلعب التغيرات الجهد تعكس التقلبات في درجات الحرارة الصغيرة.
- قبل بدء التجربة، ربط thermosensor آخر لميزان حرارة قياسية لإنشاء عامل مقياس التيار الكهربائي إلى درجة الحرارة.
- مسح درجة حرارة الحمام في غرفة تسجيل والتأكد من أنها لا تتجاوز 22 درجة مئوية.
- بدء الحصول على الصور وتطبيق بالتتابع 200-400 ميكرولتر من قارع الأجراس البارد، L-الحامض الاميني وقارع الأجراس درجة حرارة الغرفة (20-22 درجة مئوية) عن طريق ماصة الإلكترونية مع فاصل زمني interstimulus من 20-30 ثانية. لتحسين السيطرة على تطبيق التحفيز، والإفراج عن التحفيز مع إشارة الزناد المرسلة من الإعداد والتصوير اختارت ماصة إن أمكن. كرر بروتوكول التطبيق للحصول على نتائج قابلة للتكرار.
- اتخاذ مجموعة من التسجيلات أطول مع عدة جولات من التحفيز لأنها الأفضل لتحليل ما بعد التصوير مع التصوير النشاط الارتباط.
ملاحظة: حلا وسطا بين وقت التسجيل والجدوى شريحة لديهاللعثور عليه. القياسات من كاليفورنيا. 2 دقيقة تغطي 6 تطبيقات التحفيز توفر النشاط الكافي لإعادة الإعمار الجيد للشبكة.
6. معالجة الصور عن طريق آخر الارتباط تصوير (ACI)
- معالجة الصور من التسجيلات قبل متشابك
- في التسجيلات مع التحفيز عن طريق حل قارع الأجراس البارد والحامض الاميني، تمييز حساسة للحرارة γ-neuropil من الكبيبة الحساسة الحامض الاميني المجاورة التي كتبها ملامح استجابة مختلفة (انظر Kludt وآخرون. 5).
- إنشاء الحد الأقصى لإسقاط كثافة في الاتجاه المحوري من تسجيلات لإعداد الدماغ التي تم electroporated ORNs مع اثنين من الأصباغ المختلفة لتصور تعصيب الثنائي من γ-الكبيبة.
- معالجة الصور من تسجيلات بعد متشابك عن طريق آخر الارتباط تصوير (ACI)
- اختر التسجيلات مع نقاط زمنية كافية (أكثر من 100 إطارات) ومبلغ محترم من النشاط (اثنين على الأقل من الأحداث).
ملاحظة: هذا النشاط يمكن أن تكون إما من تلقاء أنفسهم للكشف عن عمليات الخلايا التاجية واحدة أو الناجمة عن العديد من التطبيقات من المحفزات خلال نفس تسجيل للكشف عن الشبكات الخلوية تفعيلها من خلال محفزات حاسة الشم. - اختيار التسجيلات حيث تتحرك الهياكل قياس ما لا يزيد عن 2-3 بكسل على مدار الساعة للتسجيل.
ملاحظة: تسجيلات مع الكثير من الحركة ويمكن انقاذ من خلال تطبيق إجراء تصحيح التحول هو موضح في Kludt آخرون 5. - تحقق ما إذا كان التسجيلات تعاني من التبييض. إذا كان متوسط كثافة الصورة كاملة قطرات على مدار الساعة للتسجيل، وتصحيح التبييض ضروري، وإلا تخطي الخطوتين التاليتين.
- حساب الاتجاه الخطي لتتبع الوقت من كل بكسل من خلال إجراء الانحدار الخطي.
- طرح النتيجة من كل بكسل على حدة للقضاء على componen الخطير من التبييض.
ملاحظة: كما يمكن استخدام ليجيندر تركيب بديل كما وصفها باو وشيلد 9. - تحميل البرنامج النصي MATLAB جاهزة للاستخدام مع دليل خطوة بخطوة للتصوير النشاط الارتباط (ACI) كما وصفها Junek وآخرون. 6
ملاحظة: اتبع الخطوات الموضحة في Junek وآخرون 6 كبديل لاستخدام البرنامج النصي MATLAB المقدمة. - نقل الملفات "aci.m '،' matVis.m" و "aci_roiSelector.m" من الحاوية تحميلها على مسار MATLAB من النظام المستخدم لتقييم البيانات.
- تحميل البيانات الخام المكتسبة في الخطوة 5.8 كمتغير لمساحة العمل المستعمل MATLAB لكما نظمت -matrix [س، ص، ع، ر] مع x و y يشير إلى أبعاد الجانبية، ض، الاتجاه المحوري ور، وبالطبع الوقت .
- دعوة "المجلس الدولي للمطارات" من سطر الأوامر MATLAB.
- في واجهة المستخدم (UI)الذي يظهر، حدد "إعداد البيانات"، ثم حدد المتغير الذي يحتوي على البيانات والدليل الذي سيتم حفظ النتائج.
ملاحظة: للحصول على وصف كامل من واجهة المستخدم رؤية دليل يرافق النصي دموع. - انتقل من خلال Z-طبقات قياسها عن طريق تحريك شريط التمرير المقابلة في واجهة المستخدم للحصول على لمحة عامة عن خريطة التباين المعروضة.
- أدخل حجم المنطقة ذات الاهتمام (ROI) في واجهة المستخدم. لسوما الخلية تاجي ضبط العائد على الاستثمار لتشمل ما يقرب من 10 ميكرون في الوحشي و5 ميكرون في الاتجاه المحوري. لالكبيبة، وقيم أعلى قليلا من 20 ميكرون أفقيا و 10 ميكرون محوريا مناسبة.
ملاحظة: حجم العائد على الاستثمار لابد من إدخالها إلى عدد من بكسل، والذي يعتمد على القياس بكسل المختار للتسجيل. - تحديد العائد على الاستثمار تحتوي على γ-الكبيبة ومناطق إضافية لكل سوما المرئي من الخلايا التاجية المحيطة عن طريق النقر على زر الماوس الأوسط على مرشدونص الخلية / الكبيبة.
- إغلاق واجهة المستخدم الرئيسي الذي يطلق حساب علاقة خرائط لجميع آثار المرجعية. يتم حفظ النتيجة تلقائيا وعرضها.
- اختر التسجيلات مع نقاط زمنية كافية (أكثر من 100 إطارات) ومبلغ محترم من النشاط (اثنين على الأقل من الأحداث).
النتائج
وقد حقق Electroporation للمن الخلايا العصبية مستقبلات الشم (ORNs) مع الأصباغ اليكسا فلور أو مؤشرات الكالسيوم مترافق مع جزيئات ديكستران لوصفها تقدمي عن طريق نقل محور عصبي نشط. بينما توفر الأصباغ السابقة تلطيخ مشرق من الخلايا العصبية الحسية ومحطات محوار بهم المتفرعة في طبقة الكبيبي لمبة، تسمح هذه الأخيرة قياس نشاط الخلايا العصبية في هذه الخلايا (الشكلان 1 و 2). أولا، كان تصور موقف حساس للحرارة γ-الكبيبة ونمط تعصيب من قبل electroporating فلور اليكسا 647 ديكستران وفلور اليكسا 546 ديكستران في الظهارة الشمية اليسار واليمين، على التوالي (الشكل 1A). أربع وعشرين ساعة بعد العملية، كان ORNs في فتحتي الأنف، وهما عصب شمي والكبيبات في كل من نصفي الكرة الأرضية مرئية تحت المجهر الفلورسنت. وكانت مجموعات الكبيبي مختلفة identifiaبلي من مواقفها، ولا سيما مجموعة صغيرة تضم γ-الكبيبة (الشكل 1B). ركض وهناك عدد قليل من الألياف حاسة الشم المقابل من خلال البصلة الشمية المقابل، عبرت الصوار الأمامي وإنهاء في المماثل γ-الكبيبة (الشكل 2A).
من أجل تسجيل استجابات الكالسيوم من ألياف قبل المشبكي من γ-الكبيبة، وelectroporated الكالسيوم الخضراء ديكستران في ORNs، وفقا لنفس الإجراء. وقد حثت يقفز درجة الحرارة السلبية في الأنف عن طريق إطلاق رقابة من حل قارع الأجراس المثلج (0-1 درجة مئوية). تم تصوير وحدة تخزين 3D تضم γ-الكبيبة تحت سريع خط إضاءة متحد البؤر المجهر. كانت ΔTs -1 ° C كافية لتحريك ردود الباردة في γ-الكبيبة وafferents لها، يعترف بأنها قمم عكسها في آثار ΔF / F الكالسيوم 2+ (الشكل 2B </ قوي>، C).
ونفذت الخطوات التجريبية مزيد من قياس النشاط الباردة التي يسببها في خلايا تاجي متصلة γ-الكبيبة عبر النهايات شجيري متشعبة بهم. بعد الملون هذه الألياف بعد المشبكي وneuropil المحيطة بشكل فعال عن طريق تحميل البلعة من الصبغة الكالسيوم الحساسة فلوو-08:00، قام بضعة أيام اليكسا 647 ديكستران تم electroporated إلى ORNs (الشكل 3A، B). امتلأت خلايا تاجي مع فلوو-08:00، وكان حافزا الظهارة الشمية مرتين وفقا لصيغة التالية: قارع الأجراس البارد، الحامض الاميني (10 ميكرومتر) ودرجة حرارة الغرفة قارع الأجراس، تطبيق في وقت لاحق. أخذت اثنين من آثار إشارة من المناطق ذات الاهتمام في الحجم المسجل، واحد الاستجابة بشكل حصري إلى انخفاض درجة الحرارة، والآخر، إلى الحامض الأميني فقط. آخر ارتباط التصوير (ACI) 6 تم حساب على أساس المرجعية المختارةيتتبع إلى تصور مع التباين العالي التشكل شجيري من الشبكات بعد المشبكي المقابلة إما لدرجة الحرارة أو الحامض الاميني استجابة الكالسيوم 2+ إشارة (الشكل 3C، D). وأخيرا، كانت للحرارة وحساس للكيماويات خرائط مرمزة ومضافين على رأس كل منهما الآخر، والتي تبين كيفية توصيل الحرارة والمعلومات الكيميائية من الكبيبات الفردية إلى الخلايا العصبية من الدرجة الثانية حاسة الشم (الشكل 3E). للحصول على وصف من التكامل ومعالجة كل أنواع المعلومات في الشبكات حاسة الشم المشتركة، انظر Kludt وآخرون. 5
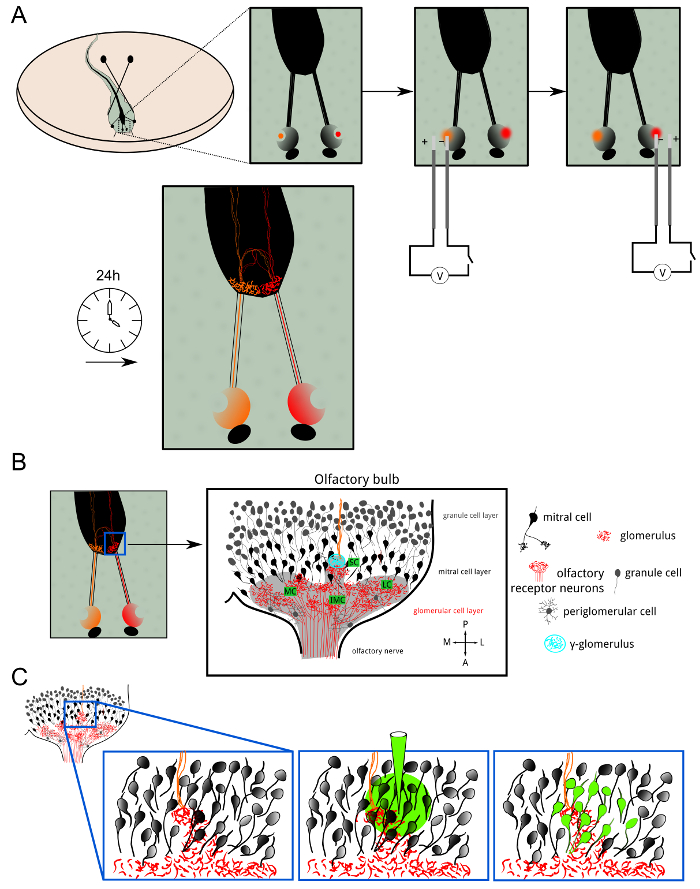
الشكل 1: نظرة عامة على Electroporation للORN والبلعة تحميل (A) الخلايا العصبية مستقبلات الشم في كل الجيوب الأنفية من اكس. تم electroporated المورق اليرقات مع الأصباغ اليكسا أو calciuالأصباغ الحساسة للم بالإضافة إلى جزيئات ديكستران. تم نقل مؤشرات الفلورسنت anterogradely حتى تشجر محور عصبي الطرفية. 24 ساعة بعد Electroporation للوأظهرت طبقة الكبيبي في كل من نصفي الكرة الأرضية تلطيخ الفلورسنت. (ب) رسم تخطيطي للمنظمة الخلوية من البصلة الشمية في نصف الكرة الأرضية واحد. طبقة الكبيبي تمتد لمبة في مجموعات: الكتل سطي، الصغيرة والمتوسطة والجانبية. يتم نقل المعلومات حاسة الشم من الخلايا العصبية المستقبلة لالتاجي الخلايا عبر نقاط الاشتباك العصبي مثير في الكبيبات. خلايا Periglomerular والخلايا الحبيبية هي الخلايا العصبية المثبطة تحوير معالجة حاسة الشم والترميز. وقد حددت-الكبيبة γ (السماوي) بسهولة كما neuropil صغير حيث المماثل (الحمراء)، والمقابل (البرتقال) الألياف الشمية دمج. وقد تحقق (C) تحميل بولس في محيط γ-الكبيبة وصمة عار على neuropil بعد متشابك التي تتكون أساسا من الخلايا التاجية وdendri بهمأشجار التشنج المتفرعة إلى حد كبير في طبقة الكبيبي. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
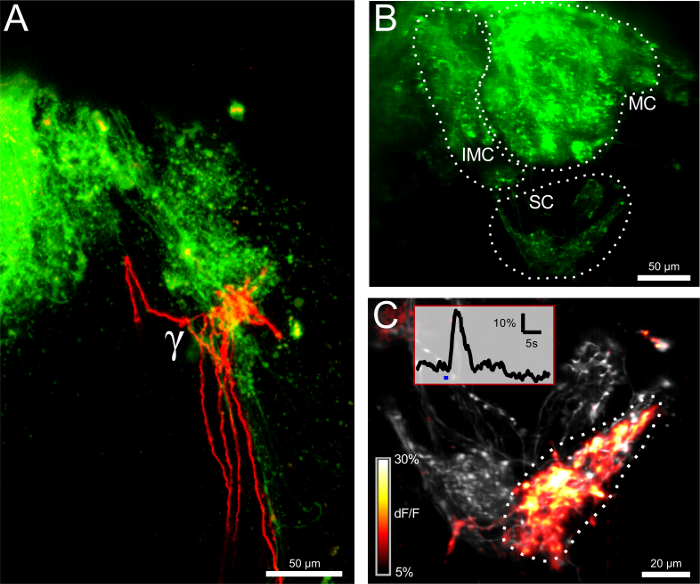
الشكل 2: Electroporation للمن ORNs يكشف الربط الهيكلي والوظيفي (A) تعصيب الثنائي من γ-الكبيبة من قبل المماثل (الخضراء) والمقابل (الحمراء) الخلايا العصبية مستقبلات الشم (ORNs). شريط النطاق = 50 ميكرون. (ب) البصلة الشمية بعد Electroporation للمع الكالسيوم الحساسة صبغ الكالسيوم الخضراء ديكستران. وintermedial (IMC)، وسطي (MC)، ومجموعة صغيرة (SC) مرئية. الصورة هي إسقاط الحد الأقصى لحجم 100 قياس ميكرون سميكة. شريط النطاق = 50 ميكرون. (C) عن قرب نظرا لمجموعة صغيرة. الحجم المسجل (12 ميكرون) هوممثلة في إسقاط القصوى. الصورة يصور مستوى الفلورسنت القاعدية في خريطة الرمادية وΔF مرمزة / F كما تراكب. يتم رسم الحد الأقصى ردا على التحفيز مع حل قارع الأجراس البارد. وكان رد فعل-الكبيبة γ بقوة في حين لا تزال اثنين من الكبيبات المجاورة الصامتة. يظهر أقحم التتبع ΔF / F لγ-الكبيبة الموافق المنطقة المشار إليها من الفائدة. ويمثل الشريط الأزرق تطبيق التحفيز. شريط النطاق = 20 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
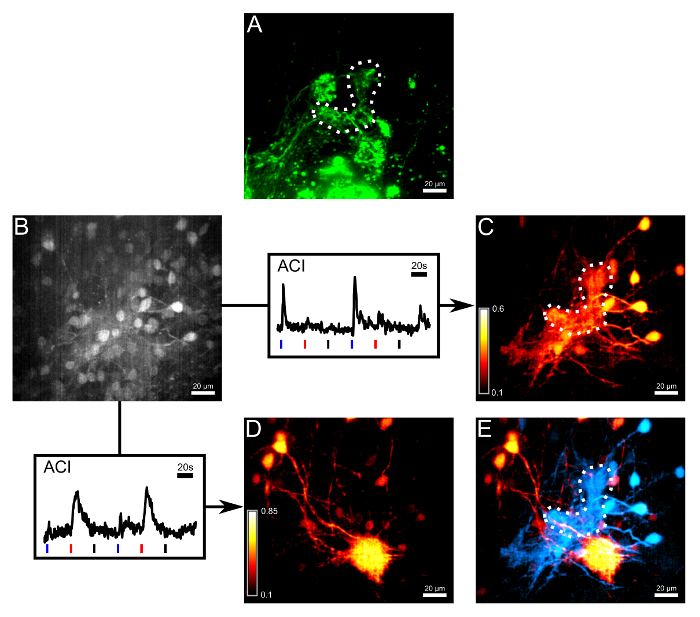
كانت ملطخة بولس التحميل وACI تنأى للحرارة والشبكات حساس للكيماويات (A) محاور عصبية من ORNs تنتهي في مجموعة صغيرة من Electroporation للمع عدم كالسي: الرقم 3.أم صبغة حساسة اليكسا 647 ديكستران. يحدد خط منقط وγ-الكبيبة. (ب) صورة من نفس المنطقة كما في الفقرة (أ) في القناة القياس الثانية بعد تحميل بلعة مع الصبغة الكالسيوم الحساسة فلوو-08:00. وكانت بعض somata خلية التاجي مرئية ولكن على النقيض محدودة. بعد السهام، تم التخطيط اثنين من آثار استجابة، والتي كانت تستخدم للتصوير النشاط الارتباط (ACI). الأزرق، وأشرطة حمراء وسوداء تحت آثار تصور بداية تطبيق قارع الأجراس البارد، الحامض الاميني (10 ميكرومتر) ودرجة حرارة الغرفة قارع الأجراس سيطرة سلبية، على التوالي. أخذت آثار كا اثنين 2+ من مناطق مختلفة من الاهتمام من حجم قياس. (C) والمجلس الدولي للمطارات نتيجة التتبع في الفقرة (ب) تسليط الضوء على مجالات الاستجابة في الغالب إلى قارع الأجراس البارد. (D) والمجلس الدولي للمطارات نتيجة التتبع في الفقرة (ب) تسليط الضوء على مجالات الاستجابة في الغالب إلى الحامض الاميني. (E) تراكب من الخرائط ACI اثنين. خلايا تاجي الاستجابة إلى hكانت istidine والكبيبة معصب (الأحمر) يمكن تمييزها بسهولة من خلايا تاجي للحرارة وγ-الكبيبة (السماوي). جميع الصور من هذا الرقم هي أقصى التوقعات كثافة من حجم 28 ميكرون سميكة. شريط النطاق = 20 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الأساليب المقدمة هنا تهدف إلى معالجة درجة حرارة تسجيل في البصلة الشمية من القيطم المورق الضفادع الصغيرة. البقع البروتوكول الأول والخلايا العصبية من الدرجة الثانية في البصلة الشمية ويوفر إعداد عينة التي لا يزال النظام الشمي سليمة أساسا. وهكذا، فإن تفعيل γ-الكبيبة حساسة للحرارة يمكن رصدها ومقارنة مع الكبيبات جيرانها الحساسة للعلاج الكيميائي. هو تصور تعصيب الثنائي الفريد لهذه الكبيبة من Electroporation للخلية مع الأصباغ المختلفة طيفيا. وعلاوة على ذلك، البلعة تحميل يسمح لتلطيخ الخلايا التاجية التي تغطي حجم كبير داخل البصلة الشمية. وكشف عن الإشارات التي يسببها درجة حرارة تجهيز شبكة الخلايا العصبية عن طريق أخذ القياسات الكالسيوم مع تطبيقات التحفيز المتكرر وبعد ذلك تحليل البيانات مع التصوير النشاط الارتباط.
بروتوكول يسلط الضوء على اثنين متطورة تلطيخ صناعة تج اإلجراءات، وكلاهما يتطلب التلاعب وممارسة الحذر من أجل تحقيق نتائج مرضية وقابلة للتكرار. خلال Electroporation لللابد من تجنب أي ضرر من الحيوانات، خصوصا عند وضع الأقطاب في فتحتي الأنف. على النحو الأمثل، ينبغي أن يحدث أي اتصال مع الظهارة الشمية. لاحظ أن الحيوانات لا تزال تعيش بعد إجراء Electroporation للويجب أن تؤخذ وقت الانتعاش في الاعتبار. إذا بقي تلطيخ ضعيفة للغاية بعد جولة واحدة من Electroporation لل، الذي يمكن أن يحدث تبعا لأنواع من الأصباغ المستخدمة، شدته يمكن أن تتعزز من خلال زيادة تركيز الصبغة في الخياشيم. منذ يتم نقل جزيئات جانب ديكستران عبر عدة آليات بما في ذلك النقل محور عصبي بطيء (بسرعة من 1-2 ملم / يوم 10) والانتشار السلبي، بديل آخر هو الانتظار لمدة 48 ساعة بعد Electroporation للأمام التضحية الحيوانات. بدلا من ذلك، قد يتم تكرار Electroporation للبعد يوم واحد من الانتعاش.
jove_content "> بولس التحميل هو خطوة حاسمة منذ كمية من الصبغة دخول الخلايا التاجية من الصعب تنظيم ويعتمد على معايير مختلفة مثل حجم ماصة ومكان التطبيق. مراقبة اجراءات تحت المجهر مضان متحد البؤر يبرهن على أن تكون مفيدة ل تعديل مدة تطبيق الصبغة، وبالتالي تحقيق نتائج تلطيخ مماثلة في أنحاء الاستعدادات. وعلاوة على ذلك، ينبغي أن تستخدم الضفادع الصغيرة electroporated سابقا لتحديد أفضل موقف لتطبيق الصبغة عن طريق تحديد موقف الكتلة الصغيرة (التي تضم γ-الكبيبة). والأكثر خطوة حاسمة خلال القياسات هي لتجنب كلا التحول وتبيض من العينة. هذا التحول يمكن تجنبها عن طريق وضع بعناية تدفق قارع الأجراس تحت المجهر. أما بالنسبة للحد من تبييض مجال الاهتمام، ينبغي خفض وقت القياس إلى ما هو جوهري .البلعة تلطيخ تحميل مع الأصباغ الكالسيوم الحساسة يوفر سوى جدامحدود النقيض منذ الخلايا السليمة عموما مستويات الكالسيوم منخفضة، وبالتالي تظهر ضعف مضان القاعدية. تطبيق التصوير النشاط ارتباط تلتف هذا الحد عن طريق توليد المقابل تقوم على الهياكل النشاط ويسلط الضوء على إشارات الكالسيوم مماثلة. هذا أسلوب التحليل بعد الحيازة يحسب عامل ارتباط بين إشارة الكالسيوم من منطقة مختارة من الفائدة (تتبع مرجعية) وذلك لكل بكسل الفردية في حجم 3D. ولذلك، فإن النتائج التي تم الحصول عليها بقوة تعتمد على نمط النشاط المحدد كما أثر المرجعية. إذا كان التركيز الرئيسي هو تصور أنماط الخلية تعصيب التاجية، ويفضل إشارة مرجعية مستمدة من نشاط الخلايا العصبية عفوية، واختيار الخلايا التاجية الأكثر نشاطا سوف تنتج أفضل النتائج. للكشف عن شبكات chemo- أو الحرارية الحساسة الخلايا التاجية، وآثار إشارة لا يحتوي إلا على الردود على أي الحامض الاميني أو قارع الأجراس البارد يجب أن يكون محددا. اختيار من الكبيبة س بأكملهص سوما الخلية التاجي والمنطقة من الفائدة قد لا توفر دائما تتبع مرجعية واضحة، خاصة إذا كانت الهياكل الاستجابة لاثنين من المحفزات المختلفة يكذبون على رأس كل منهما الآخر. في مثل هذه الحالة، غالبا ما يكون مفيدا لتحديد منطقة أصغر من الكبيبة أو خلايا الجسم والمنطقة من الفائدة.
في العقود الأخيرة، وقد وصفت Electroporation للكطريقة فعالة لصبغ الخلايا وحيدة أو متعددة 11،12. هنا يتم استخدامه لتسمية تحديدا الخلايا العصبية مستقبلات الشم. جزيئات ديكستران مترافق تعطي أعلى كفاءة، والأصباغ الحساسة غير الكالسيوم، ومجموعة من اختيار واسع وتغطي الطيف الكامل تستخدم عادة في مضان المجهر 13. ومع ذلك، والأصباغ الكالسيوم الحساسة التي electroporated بنجاح في الخلايا العصبية مستقبلات حاسة الشم هي في الوقت الراهن يقتصر على ديكستران الكالسيوم الأخضر، وفلوو-4 ديكستران إذا كانت لا تزال متاحة تجاريا. الى جانب ذلك، التسجيلات تستهدف في المقام الأول superficiaطبقات لتر على السطح البطني من البصلة الشمية فقط، لأن عمق تغلغل تقنيات قياس سرعة محدودة. التصوير ثنائي الفوتون يمكن التغلب جزئيا هذا الحد ولكن غالبا ما تفتقر إلى السرعة ويحد من كمية الأصباغ الكالسيوم الحساسة اختيار أكثر من ذلك.
وصفنا هنا بروتوكولا لقياس النشاط الناجم عن درجة الحرارة في البصلة الشمية. يتم فحص neuropil الدماغ كوحدة تخزين ثلاثي الأبعاد لتصور الشبكات الخلوية المعقدة التي تنطوي عليها معالجة حاسة الشم من درجة الحرارة. قياس النشاط الناجم عن درجة الحرارة في البصلة الشمية تم الإبلاغ مؤخرا جدا 5 ويتطلب إجراء تفصيلها خصيصا الجمع بين التقنيات المختلفة. ومكسبا كبيرا من التقنيات المعروضة أعلاه هو أن يتم تصوير مئات من الخلايا في ثلاثة أبعاد في إعداد الاكبر من حيث نظام حاسة الشم لا يزال سليما. هذه المزايا على مطالب عالية على تقنيات التلوين فضلا ع المخالتعويض والتصوير. على سبيل المثال، Electroporation للخلية والبلعة تحميل ضرب كميات كبيرة من الخلايا في الظهارة الشمية ومصباح، وبالتالي تمكين التصور الشبكات الخلوية كاملة. وعلاوة على ذلك، وتسليم المؤشرات الكيميائية عن طريق تحميل بلعة بدلا من fluorophores المرمزة وراثيا تمكن القياسات في مجموعة يحتمل أن تكون أكبر من الأنواع. بدائل أخرى مثل حضانة حمام مع AM الأصباغ تعمل في المقام الأول في شرائح التي تضر البصلة الشمية بشدة، ولم يتبق سوى بضع مئات من ميكرومتر من أنسجة سليمة. في المقارنة، وإعداد جبل كامل المستخدمة في بروتوكول لدينا يضمن على سبيل المثال أن تعصيب الثنائي من γ-الكبيبة لا يزال سليما، وبالتالي فهي تؤخذ التسجيلات في نظام لا يزال المنطوق. وأخيرا، ويتم التصوير في حد ذاته سطرا إضاءة المجهر السماح باقتناء كميات 3D. خط إضاءة المجهر هي واحدة من تقنيات مبائر توفير أعلى معدلات الاستحواذ المحتملة 6 </ سوب> والتي هي ضرورية لتغطية جزء كبير من البصلة الشمية. ويمكن استخدام نظم جمع أبطأ ولكن لديها عيب أن حجم الحجم المسجل يجب تخفيض. في السنوات الأخيرة، وقد وضعت أساليب أخرى لالتقاط صور سريع ويمكن استخدامها كبدائل 14،15. ومع ذلك، لا يزال خط إضاءة المجهر واحدة من أسهل الطرق لكسب كل من السرعة والدقة الكافية. وفي ما يلي بعض المعلومات عن المبادئ التوجيهية لاختيار الاجهزة التصوير المناسبة. منذ يتم التصوير الكالسيوم داخل من الاستعدادات الدماغ سميكة، يجب الإعداد توفر confocality لائق ويجب أن يكون لأهداف فتحة العدسة من 1.0 أو أعلى. لنقطة مرجعية، والتسجيلات التي اتخذت مع خط إضاءة المجهر تتوافق مع الصور التي التقطت مع معيار مجهر المسح الضوئي ليزر مع حجم الثقب من 0.5-1 وحدة متجدد الهواء. سريع سرعة اكتساب أمر مرغوب فيه. وحدة تخزين مع سمك 20 ميكرون مشمولة لا يقل عن 5 لترايرز، حقل الجانبي نظر 100 ميكرون × 100 ميكرون وحجم بكسل 0.5 ميكرون أو أصغر يجب أن تفحص بسرعة لا تقل عن 1 هرتز في كومة. يمكن الحد من confocality زيادة كمية الفوتونات تحصى، وبالتالي يسمح لعمليات استحواذ أسرع إذا لزم الأمر، ولكن لديه عيب وتسجيل المزيد من الضوء خارج نطاق التركيز. ومع ذلك، نظرا لأن هذا النهج يزيد من سمك الشرائح الضوئية، يمكن أن تسهل فعلا تعقب التشعبات من خلال مختلف ض الطائرات بعد تطبيق ACI 6.
الأدوات اللازمة للدراسة على نطاق واسع تجهيز درجة الحرارة في شبكات البصلة الشمية يتم عرض هذه الوثيقة. يتم تسجيل النشاط الناجم عن درجة الحرارة في الأولى والثانية الخلايا العصبية النظام عن طريق الأصباغ وإشارات على حد سواء القادمين والمغادرين من γ-الكبيبة الكالسيوم الحساسة. وعلاوة على ذلك، إلى أي مدى تجهيز خلايا تاجي الفردية يمكن تقييم كل من المعلومات الكيميائية ودرجة الحرارة. منذ ليا إعدادفيس البصلة الشمية سليمة، ودور تعصيب الثنائي في تجهيز حاسة الشم يمكن لمزيد من الدراسة. الإجراء مفيد أيضا للكشف عن مدى وكيفية حراري وchemoinformation يتم ترميز في تداخل شبكات حاسة الشم 5. وأخيرا، فإن التقنيات المذكورة أعلاه لا تقتصر على دراسة الردود درجة الحرارة في البصلة الشمية ولكن يمكن تطبيقها لتقييم أعم من نظام حاسة الشم، وخاصة شبكات المعالجة الخلوية في ثلاثة مجلدات كبيرة الأبعاد. البلعة التحميل والتصوير النشاط الارتباط هي أدوات قوية لمراقبة ومقارنة النشاط العشرات من الخلايا العصبية، مما يجعلها قابلة للتطبيق على شبكات الدماغ المختلفة (16).
Disclosures
The authors have nothing to disclose.
Acknowledgements
This project was funded by the DFG Excellence Cluster 171, the Center for Nanoscale Microscopy and Molecular Physiology of the Brain, the Bernstein Center for Computational Neuroscience and the ENC-Network, an Erasmus Mundus Joint Doctoral Program. The authors thank Stephan Junek, Mihai Alevra and Guobin Bao for providing MATLAB codes and custom-written programs for image evaluation and data analysis.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Sodium chloride | Merck Millipore | 1064040500 | |
| Potassium chloride | Merck Millipore | 1049360250 | |
| Calcium chloride dihydrate | Merck Millipore | 1023820250 | |
| Magnesium chloride hexahydrate | Merck Millipore | 1058330250 | |
| D(+)-Glucose | Merck Millipore | 1083371000 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| HEPES | Merck Millipore | 1101100250 | |
| Calcium Green 10 kDa Dextran | Thermo Fisher Scientific | C-3713 | |
| Dextran, Alexa Fluor 647 | Thermo Fisher Scientific | D-22914 | |
| Dextran, Alexa Fluor 546 | Thermo Fisher Scientific | D-22911 | |
| Fluo-8 AM | TEFlabs | 203 | |
| MK571 | Alexis Biochemicals | 340-021-M005 | |
| MS-222 | Sigma-Aldrich | E10521 | |
| Pluronic acid F-127 | Sigma-Aldrich | P2443 | powder |
| L-Histidine monohydrochloride monohydrate | Sigma-Aldrich | 53370 | |
| DMSO | Merck Millipore | 1029522500 | |
| Equipment | |||
| Electronic pipette | BrandTech | HandyStep Electronic Repeating Pipette | |
| NiCr-Ni thermocouple | Greisinger Elektronik | GTF 300 | |
| Micropipette puller | Narishige | Model PC-10 | two-step puller |
| Funnel applicator | (Custom-made) | ||
| Line-illumination microscope | (Custom-made) | otherwise, a commercially available spinning disk microscope | |
| Objective W Plan-Apochromat 63X/1.0 | Zeiss | 441470-9900-000 | |
| Objective W Plan-Apochromat 40X/1.0 DIC | Zeiss | 441452-9900-000 | |
| Software | |||
| MATLAB | The MathWorks | from R2010b upwards |
References
- Mamasuew, K., Breer, H., Fleischer, J. Grueneberg ganglion neurons respond to cool ambient temperatures. Eur J Neurosci. 28 (9), 1775-1785 (2008).
- Brechbühl, J., Moine, F., Broillet, M. -C. Mouse Grueneberg ganglion neurons share molecular and functional features with C. elegans amphid neurons. Front. Behav. Neurosci. 7 (193), (2013).
- Gaudin, A., Gascuel, J. 3D atlas describing the ontogenic evolution of the primary olfactory projections in the olfactory bulb of Xenopus laevis. J Comp Neurol. 489 (4), 403-424 (2005).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc Natl Acad Sci U S A. 100 (12), 7319-7324 (2003).
- Kludt, E., Okom, C., Brinkmann, A., Schild, D. Integrating temperature with odor processing in the olfactory bulb. J Neurosci. 35 (20), 7892-7902 (2015).
- Junek, S., Chen, T. W., Alevra, M., Schild, D. Activity correlation imaging: visualizing function and structure of neuronal populations. Biophys J. 96 (9), 3801-3809 (2009).
- Nieuwkoop, P. D., Faber, J. Normal Table of Xenopus laevis. , Garland Publishing Inc. New York. (1994).
- Schild, D. A computer-controlled device for the application of odors to aquatic animals. J Electrophysiol Tec. 12 (2), 71-79 (1985).
- Bao, G., Schild, D. Fast and Accurate Fitting and Filtering of Noisy Exponentials in Legendre Space. PLoSONE. 9 (3), (2014).
- Terasaki, M., Schmidek, A., Galbraith, J. A., Gallant, P. E., Reese, T. S. Transport of cytoskeletal elements in the squid giant axon. Proc Natl Acad Sci U S A. 92 (25), 11500-11503 (1995).
- Haas, K., Sin, W. C., Javaherian, A., Li, Z., Cline, H. T. Single-Cell Electroporationfor Gene Transfer In Vivo. Neuron. 29 (3), 583-591 (2001).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo-from single cells to the entire brain. Differentiation. 70 (4-5), 148-154 (2002).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Lechleiter, J. D. Chemical Calcium Indicators. Methods. 46 (3), 143-151 (2008).
- Salome, R., et al. Ultrafast random-access scanning in two-photon microscopy using acousto-optic deflectors. J Neurosci Methods. 154 (1), 161-174 (2006).
- Keller, P. J., Ahrens, M. B., Freeman, J. Light-sheet imaging for systems neuroscience. Nature Methods. 12 (1), 27-29 (2015).
- Hjorth, J. J., et al. Detection of silent cells, synchronization and modulatory activity in developing cellular networks. Dev Neurobiol. , (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved