Method Article
في الموقع وصفها من الحمض النووي النسخ المتماثل في ذبابة الفاكهة الكبار المبايض عن طريق ايدو تلطيخ
In This Article
Summary
Drosophila oogenesis continues to be exceptionally useful in the study of mitochondrial proliferation and inheritance. This manuscript describes a detailed protocol used to label the replicating mitochondrial DNA (mtDNA) in Drosophila adult ovaries with 5-ethynyl-2´-deoxyuridine (EdU), which facilitates uncovering mechanisms associated with mitochondrial inheritance that were previously debatable.
Abstract
The mitochondrial genome is inherited exclusively through the maternal line. Understanding of how the mitochondrion and its genome are proliferated and transmitted from one generation to the next through the female oocyte is of fundamental importance. Because of the genetic tractability, and the elegant, ordered simplicity by which oocyte development proceeds, Drosophila oogenesis has become an invaluable system for mitochondrial study. An EdU (5-ethynyl-2´-deoxyuridine) labeling method was utilized to detect mitochondrial DNA (mtDNA) replication in Drosophila ovaries. This method is superior to the BrdU (5-bromo-2'-deoxyuridine) labeling method in that it allows for good structural preservation and efficient fluorescent dye penetration of whole-mount tissues.
Here we describe a detailed protocol for labeling replicating mitochondrial DNA in Drosophila adult ovaries with EdU. Some technical solutions are offered to improve the viability of the ovaries, maintain their health during preparation, and ensure high-quality imaging. Visualization of newly synthesized mtDNA in the ovaries not only reveals the striking temporal and spatial pattern of mtDNA replication through oogenesis, but also allows for simple quantification of mtDNA replication under various genetic and pharmacological perturbations.
Introduction
إلى جانب الجينوم النووي، ويحتوي على كل خلية حقيقية النواة أيضا الآلاف من النسخ من الحمض النووي دائرية صغيرة في المصفوفة الميتوكوندريا. بينما الحمض النووي (و mtDNA) بترميز مفارز الأساسية من سلسلة نقل الإلكترون، يتم ترميز غالبية بروتيوم الميتوكوندريا، بما في ذلك جميع العوامل لتكرار ونسخ الحمض النووي الميتوكوندري من الجينوم النووي. وعلى النقيض من الجينوم النووي الذي يتبع قوانين مندل للالميراث، ورثت جينوم الميتوكوندريا الحيوان حصريا من خلال النسب الأمومي. ولذلك، فهم كيف انتشرت و mtDNA والتي تنتقل من جيل إلى جيل من خلال البويضة الأنثوية من المهم بشكل أساسي. ومع ذلك، هناك استمرار الجدل حول كيفية تنظيم النسخ و mtDNA في سلالة الجرثومية الإناث. بالإضافة إلى ذلك، فإن نظرية عنق الزجاجة و mtDNA مقبولة على نطاق واسع لنقل و mtDNA تشير إلى أن عدد سكان و mtDNA في الخلايا الجرثومية البدائية وsubsampled على عدد صغير نسبيا الزيتوتطوير ز 1 2. فإنه يعني أيضا أن مستوى الميتوكوندريا النسخ المتماثل زمانيا ومكانيا منظم خلال مراحل تكوين البويضات. وبالتالي، فإن في الموقع كشف النسخ المتماثل و mtDNA خلال تطوير سلالة الجرثومية تسهيل فهم آلية الميراث و mtDNA.
يوفر ذبابة الفاكهة مراحل تكوين البويضات نظام لين العريكة وراثيا لدراسة النسخ و mtDNA وانتقال العدوى. في كل من البلدين المبايض ذبابة الفاكهة، وهناك 16-20 سلاسل مستقلة من غرف البيض دعا ovarioles 3، والتي هي وحدات وظيفية لإنتاج البيض (انظر الشكل 1A). يحتوي كل ovariole منظمة الخطي التدريجي للمراحل تكوين البويضات، حيث يتكون الطرف الأمامي من بنية تسمى germarium. وينقسم germarium إلى أربع مناطق التي تحتوي على الخلايا الجرثومية في مراحل تنموية مختلفة. في منطقة 1، والخلايا الجذعية سلالة الجرثومية تذهب من خلال تقسيم غير المتماثلة لإنتاج الخلايا الوليدة المعروفة باسم جystoblasts. المنطقة 2A يحتوي على cystoblasts التي استكملت تقسيم النهائي. Cystoblasts الخضوع لأربع جولات من إنتاج الفرقة مجموعة 16 خلية. تبقى الخلايا 16 متصلة مع بعضها البعض عن طريق جسور حشوية تسمى القنوات الحلبة. واحدة من الخلايا فقط تلتزم التمايز كما البويضة، في حين وضع 15 آخرين على شكل خلايا الممرضة المتعددة الصبغيات. هيكل حشوية أساسي، والمعروفة باسم fusome، ويقترح لتسهيل مهمة تشكيل قنوات حلقة، وتحديد قطبية الكيس والممرضة التفاعلات خلية بويضة 4،5. كما تتحرك الخراجات نحو المنطقة 2B، الهياكل كيس تمتد على كامل عرض germarium، وتصبح أكثر المرتبطة خلايا بصيلات. الهياكل germarium تنتهي مع المنطقة 3 التي تحتوي على أول مهدها غرفة البيض. وفي وقت لاحق، يتم تجميع الدوائر البيض في نهاية الخلفية لgermarium، التي تقدم من خلال ovariole في 14 مراحل متميزة شكليا. نمو البويضة يعتمد على خلايا ممرضة، ذوي الخوذات البيضاءبروتينات النقل التراث الثقافي غير المادي، مرنا والهياكل endomembrane (على سبيل المثال، جولجي) عبر القنوات حلقة في البويضة. خلال ذبابة الفاكهة مراحل تكوين البويضات، تبين أن جزءا من الميتوكوندريا داخل كل كيس 16 خلية ارتبطت مع fusome، انتقل من خلال القنوات عصابة وتم تسليمها إلى البويضة واحدة في كتلة كبيرة تسمى بالبياني الجسم 6. واقترح هذه الظاهرة إلى المساهمة في مراقبة الجودة من الميراث الميتوكوندريا من خلال المبايض الأنثوية.
الكشف عن تركيب الحمض النووي الميتوكوندري يعتمد على إدراج السلائف الحمض النووي المسمى في الحمض النووي الخلوي. تقليديا، تم استخدام التناظرية نيكليوزيد من الثيميدين 5-برومو-2'-deoxyuridine (BrdU) لتسمية النسخ و mtDNA في الخلايا زراعة الأنسجة 7،8. ومع ذلك، فإن BrdU وضع العلامات على الأضداد يسلك العديد من القيود، وخاصة بالنسبة للتلوين الأنسجة كله جبل. عيب واحد كبير من BrdU وضع العلامات هو أنه يتطلب تمسخ الحمض النووي للكشف عنحاتمة BrdU، بحيث يمكن الكشف عنها من قبل الأجسام المضادة لمكافحة BrdU. لابد من التعامل مع العينة في ظل ظروف تغيير طبيعة قاسية مثل المواد الكيميائية (مثل حمض الهيدروكلوريك أو خليط من الميثانول وحمض الخليك)، والحرارة، أو الهضم مع الدناز، والتي قد تعطل بنية العينة وتعقيد إجراءات تلطيخ التالية 9، 10.
هنا، يتم استخدام بديلة الثيميدين التناظرية 5 إيثينيل-2'-deoxyuridine (EDU) لتسمية الحمض النووي تكرار في المبايض الكبار ذبابة الفاكهة. هذا الأسلوب هو أسرع وحساسة للغاية. أدرج EDU بسهولة في الحمض النووي الخلوي خلال تكرار الحمض النووي. ويستند الكشف التالية على رد فعل "فوق"، والنحاس (I) -catalyzed رد فعل التساهمية بين مجموعة آلكاين محطة وأزيد الفلورسنت 10. لأن رد الفعل لا يتطلب تمسخ من العينة، لأنها تتيح الحفاظ على هيكلية جيدة. وعلاوة على ذلك، فإن حجم الصبغة لzide هو فقط 1/500 من أن لجزيء الضد 10، والتي تمكن اختراق سريع وفعال من الأنسجة كله جبل. وقد استخدمنا هذه الطريقة للكشف عن النسخ و mtDNA خلال ذبابة الفاكهة مراحل تكوين البويضات وجدت النمط المكاني لافتة في المنطقة germarium من ذبابة الفاكهة المبيض 11، التي تؤدي بنا إلى اقتراح و mtDNA آلية الميراث انتقائية تعتمد على النسخ المتماثل. نقدم هنا بروتوكول مفصل عن EDU الوسم النسخ المتماثل و mtDNA في المبايض ذبابة الفاكهة. للتدليل على تطبيق البروتوكول، ونحن أيضا باختبار النسخ و mtDNA في مستوى الميتوكوندريا متحولة ذبابة الفاكهة (طن متري: هيئة النزاهة T300I) 11، وكذلك مع العلاج متنوعة من uncouplers الميتوكوندريا، مما تبديد غشاء الميتوكوندريا المحتملة، وربما تعطيل النسخ و mtDNA.
Protocol
1. نسيج جمع وتشريح
- في كل قارورة تحتوي على الخميرة الجافة والثقافة 10 الكبار أنثى الذباب مع 10 من الذكور لمدة 2-3 أيام.
ملاحظة: سيتم الحفاظ على الذباب الإناث تغذية جيدة تحسين الجودة الشاملة والعائد من إنتاج المبيض وتسهيل تشريح. - تخدير الأنثى الذباب على ثاني أكسيد الكربون (CO 2) يطير وسادة.
- تحت المجسام، ضع عدة قطرات من RT المتوسطة (متوسطة ذبابة الفاكهة شنايدر تستكمل مع المصل 10٪ بقري جنيني (FBS)) على لوحة تشريح. إجراء كافة الإجراءات تشريح في المتوسط للحفاظ على الأنسجة على قيد الحياة وبصحة جيدة.
- الاستيلاء على الأنثى مسمن تطير مع ملقط حاد غرامة الانف في انخفاض الصدر لها. استخدام مجموعة أخرى من الملقط لعبة شد الحبل بلطف في الخلفية القصوى من ذبابة حتى تتعرض الأنسجة في البطن. فصل اثنين من المبيضين من الأنسجة الأخرى (مثل الشجاعة).
ملاحظة: كل يعرض المبيض هيكل مبهمة الذي يؤلفد من 16-20 ovarioles المرفقة. - لتعزيز تغلغل الكواشف، فتح المبايض عن طريق سحب بينهما واجتياز نصائح من ملقط بين كل ovariole بضع مرات. الحفاظ على ovarioles اتصال داخل المبيض لتقليل الخسائر في الأنسجة خلال الإجراءات التالية.
- نقل المبايض على الفور إلى أنبوب microcentrifuge 1.5 مل تحتوي على 500 ميكرولتر من المتوسط ذبابة الفاكهة شنايدر مع FBS 10٪.
- كرر تشريح وجمع 10-15 المبيضين في كل أنبوب microcentrifuge.
2. ايدو وصفها
- نضح في المتوسط في كل أنبوب، واستبدالها مع 500 ميكرولتر من المتوسط ذبابة الفاكهة شنايدر مع 10٪ FBS تحتوي على 7 ميكرومتر aphidicolin.
ملاحظة: يستخدم Aphidicolin لمنع تركيب الحمض النووي النووي عن طريق تثبيط الحمض النووي بوليميريز α دون أن يؤثر تكرار الحمض النووي الميتوكوندري 7 و 12. فمن الممكن لزيادة تركيز aphidicolin لغاية70 ميكرومتر لتحقيق تثبيط أفضل. الحل الأسهم من 3-30 ملم aphidicolin في DMSO يمكن تخزينها في الظلام عند درجة حرارة -20 درجة مئوية لمدة تصل إلى 6 أسابيع. - للحفاظ على المبايض صحية، وضمان مغمورة هم تحت الحلول أثناء تغيير المتوسطة. استخدام المتوسطة ذبابة الفاكهة شنايدر مع FBS 10٪ من خلال خطوة 2.6.
- احتضان المبايض لمدة 3 ساعة على RT على الكرسي الهزاز المقعد العلوي مع دوران طيف.
- للعلاج من المخدرات، على سبيل المثال، الميتوكوندريا الكربونيل uncoupler السيانيد 4 trifluoromethoxy فينيل هيدرازون (FCCP)، إضافة التركيز المناسب من المخدرات (على سبيل المثال، 10 ميكرومتر FCCP) في المتوسط بعد 2 ساعة من العلاج aphidicolin. مواصلة احتضان لمدة 1 ساعة أخرى.
- إزالة المتوسطة التي تحتوي على aphidicolin مع أو بدون دواء. لفترة وجيزة شطف المبايض مع المتوسط (aphidicolin ليس من الضروري) مرتين.
- إضافة 1 مل المتوسطة التي تحتوي على 10 ميكرومتر ايدو و 7 ميكرومتر aphidicolin ومواصلة incubatinز في RT لمدة 2 ساعة. تخزين حل 10 ملم EDU الأسهم (في DMSO) عند درجة حرارة -20 درجة مئوية.
- إزالة المتوسطة التي تحتوي على ايدو وaphidicolin. يغسل مع متوسط (بدون aphidicolin) مرتين لمدة 3 دقائق لكل منهما.
3. الأنسجة التثبيت وPermeabilization
- يعد حل بارافورمالدهيد 4٪ في الفوسفات مخزنة المالحة (PBS، ودرجة الحموضة 7.4).
ملاحظة: استخدمنا امتصاص العرق المتاحة التجاري المخزنة في أمبولات سجل مسبقا. فتح أمبولة جديد وتمييع إلى 4٪ قبل الاستخدام.
تنبيه: الفورمالديهايد السامة. يجب أن يتم التعامل معها في غطاء الدخان مع الجلد وحماية العين. - إصلاح المبايض مع بارافورمالدهيد 4٪ لمدة 20 دقيقة في RT مع دوران طيف.
- إزالة تثبيتي، وغسل المبيض مرتين في 1 مل من 3٪ BSA في برنامج تلفزيوني لمدة 5 دقائق في كل مرة.
- لpermeabilize الأنسجة، وإزالة محلول الغسيل وإضافة 1 مل من 0.5٪ تريتون X-100 في برنامج تلفزيوني. في احتضان RT لمدة 20 دقيقة.
- إزالة حل permeabilization ويغسل مرتين في 1 ملمن 3٪ BSA في برنامج تلفزيوني.
4. كشف EDU
ملاحظة: يستند EDU كشف عن الكيمياء "فوق"، والنحاس (I) -catalyzed [3 + 2] cycloaddition 13، وهو ما يضيف أزيدات الفلورسنت إلى مجموعة آلكاين النهائية من ايدو، ويخضع جزيء فلوري إلى الكشف لاحقا. منذ النحاس (I)، والذي يتأكسد بسهولة إلى غير الحفازة أنواع النحاس (II)، وذلك لتحفيز رد الفعل، فمن المستحسن للحد من النحاس (II) كبريتات في الموقع للحصول على النحاس (I). وهذا هو، ويستخدم النحاس (II) كبريتات في وجود اختزال مثل حمض الاسكوربيك (هنا في "المنطقة العازلة المضافة") لتوليد النحاس (I).
- قبل التجربة، وإعداد حل عمل أزيد اليكسا فلور (فلور اليكسا 488 أزيد، اليكسا فلور 555 أزيد أو غيرها، اعتمادا على fluorophore المفضل، التي يطلق عليه اسم "صبغ أزيد" فيما بعد)، ايدو رد فعل العازلة وعازلة EDU المضافة وفقا لالصانعتعليمات.
- إعادة تشكيل أزيد الصبغة في 70 DMSO ميكرولتر. تخزين حل الفريق في -20 درجة مئوية لمدة تصل إلى 1 سنة.
- إعداد رد فعل العازلة ايدو جديدة من تمييع EDU عازلة 10X رد فعل مع الماء منزوع الأيونات.
ملاحظة: بعد استخدام وتخزين أي حل 1X المتبقية في 4 درجات مئوية. الحل 1X مستقرة لمدة تصل إلى 6 أشهر. - جعل حل 10X الأسهم المخزن المؤقت مضافة EDU عن طريق إذابة تماما المسحوق في 2 مل من الماء منزوع الأيونات.
ملاحظة: هذا الحل الأسهم مستقرة لمدة تصل إلى 1 سنة في -20 درجة مئوية. إذا كان هذا الحل يتطور لون بني، قد تدهورت، وينبغي أن يتم التخلص منها.
- إعداد رد فعل كوكتيل ايدو جديدة في كل مرة، واستخدام خلال 15 دقيقة من التحضير. لتحقيق نتائج قابلة للتكرار، تأكد من الحفاظ على مكونات رد فعل في نفس النسب.
- جعل الطازجة 1X EDU العازلة مضافة حل عن طريق تمييع الحل 10X الأسهم (المعد في الخطوة 4.1.3) 01:10 في الماء منزوع الأيونات. استخدام هذا قolution في نفس اليوم.
- إعداد 1 مل من ايدو رد فعل كوكتيل من خلال الجمع بين المكونات التالية بالترتيب: 860 ميكرولتر 1X EDU عازلة رد فعل، 40 ميكرولتر كبريتات النحاس 4، 2.5 ميكرولتر صبغة أزيد، و 100 ميكرولتر 1X EDU عازلة مضافة.
ملاحظة: من المهم أن يتم إضافة المكونات من أجل ضمان الأداء الأمثل.
- إزالة برنامج تلفزيوني مع 3٪ BSA وإضافة 0.5 مل من رد فعل كوكتيل EDU إلى كل أنبوب. في احتضان RT لمدة 30 دقيقة مع دوران طيف. الحفاظ على عينات محمية من الضوء.
- إزالة رد فعل كوكتيل ايدو ويغسل مرة واحدة مع 1 مل من 3٪ BSA في برنامج تلفزيوني.
- غسل العينات مرة واحدة مع 1 مل من برنامج تلفزيوني.
5. الجسم المضاد وصفها
ملاحظة: إجراء الأجسام المضادة العلامات بعد ايدو تلطيخ. إذا كان المطلوب لا تلطيخ إضافية، يمكن للمرء أن الشروع في تصاعد والتصوير مباشرة. من المهم أن العينات تكون محمية من الضوء في كافة الإجراءات التالية.
- إزالة محلول الغسيل. منع المبيضين في 1 مل من عرقلة الحل تحتوي على 0.2٪ BSA و 0.1٪ تريتون X-100 في برنامج تلفزيوني لمدة 30 دقيقة.
- إزالة عرقلة الحل واستبدالها مع الأجسام المضادة الأولية مخففة في عرقلة الحل (مثل ATP الماوس سينسيز فرعية α الأجسام المضادة، 1: 1000 تمييع). احتضان في الظلام في 4 درجات CO / N.
- غسل العينات مع 1 مل من عرقلة الحل 3 مرات، و 10 دقيقة في كل مرة. للحد من الخلفية، ويغسل مرتين أكثر لمدة 30 دقيقة لكل منهما. إزالة عرقلة الحل.
- احتضان مع الأجسام المضادة الثانوية المخفف في عرقلة الحل (مثل الماعز لمكافحة فأر اليكسا فلور 568 الضد الثانوية، 1: 200 تمييع) لمدة 2 ساعة على RT.
ملاحظة: استخدام لون مختلف من واحد إلى جانب لايدو. - كرر الخطوات غسل يؤديها في الخطوة 5.3.
- شطف مع 1 مل من برنامج تلفزيوني مرة واحدة لإزالة المنظفات.
6. تركيب والتصوير
- إزالة بعناية كل برنامج تلفزيوني وIMMتغطية ediately المبايض مع 50 ميكرولتر المتوسطة المتزايدة (مع أو بدون دابي).
ملاحظة: يجب استخدام وسيلة متزايدة على أن لا تتصلب في حين يتم فصل ovarioles عن بعضها البعض. المبايض يمكن تخزينها في المتوسطة المتزايدة في 4 درجة مئوية لمدة تصل إلى أسبوع. - قطع نهاية طرف ماصة واستخدامه لنقل المبايض بعناية على شريحة المجهر.
- منفصل تماما كل ovariole مع ملقط حاد غرامة الانف تحت مجهر تشريحي. إزالة الأنسجة التي تربط في نهاية الخلفي ومرحلة 14 أو غرف بيضة ناضجة. غرف البيض الشابة هي في نهاية الأمامي وشفافة.
- محاذاة غرف البيض مع ملقط بحيث لا تتداخل مع بعضها البعض.
- خفض ببطء ساترة الزجاج # 1.5 على أعلى من العينات. تسمح وسيلة متزايدة لتتبلمر لعدة ساعات في RT. ختم بطلاء الأظافر الشفاف.
- صورة الشرائح في اليوم التالي، أو تخزينها في 4 درجة مئوية قبل التصوير.
- تصور تحت ميل متحد البؤرcroscope مع هدف النفط الغمر 63X. القبض على ثلاثة الأبعاد ض أكوام الصور.
ملاحظة: هناك قوي EDU إشارة في غرف البيض في وقت لاحق المرحلة ومضان الخلفية في غمد الظهارية. عند فحص العلامات ايدو في germarium معين، ينبغي للمرء تجنب germariums التي تتداخل أو بالقرب من الأنسجة الأخرى أو غرف البيض في وقت لاحق المرحلة.
النتائج
يسمح البروتوكول أعلاه التصور من الهياكل منقط المرتبطة الميتوكوندريا (الشكل 1B-C)، والتي تشير إلى تكرار الحمض النووي خلال ذبابة الفاكهة مراحل تكوين البويضات. ونقاط وايدو المحلية مع الميتوكوندريا تميزت تلطيخ لاعبي التنس المحترفين سينسيز ألفا فرعية (الشكل 2). وكانت إشارات لوحظ تغيب في المبايض تعامل مع بروميد إيثيديوم 11، مثبط للنسخ المتماثل و mtDNA 14، وهو ما يؤكد هذه الحقيقة نقاط وتسمية تكرار استخدمت mtDNA.Aphidicolin لمنع تلطيخ DNA النووي دون أن يؤثر تكرار و mtDNA (الشكل 2). من دون علاج aphidicolin، الإشارات EDU مكثفة تسمية نوى، وتم الكشف عن الحمض النووي الميتوكوندري نقاط وبالكاد (الشكل 3). ومع ذلك، في ظل وجود aphidicolin، وخفضت بشكل كبير التأسيس النووي ولوحظت العديد من نقاط والمرتبطة الميتوكوندريا.
الحمار = "jove_content" FO: المحافظة على together.within الصفحات = "1"> هناك مستوى عال من النسخ و mtDNA في غرف البيض بعد germarium (الشكل 1B). ومع ذلك، لا سيما، عرض و mtDNA تكرار نمط المكاني في germarium. كما يدل على ذلك عدد من ايدو نقاط و، هناك مستوى معتدل من تكرار الحمض النووي الميتوكوندري في المنطقة 1 من germarium، ولكن يكاد لا يوجد التأسيس ايدو في المنطقة 2A (الشكل 1C). بعد أن تحرك الكيس وصولا الى منطقة 2B في germarium، استأنف و mtDNA تكرار وكان عدد من نقاط وايدو في الكيس الخلفي من منطقة 2B أعلى من ذلك بكثير في المنطقة 2A (الشكل 1C). على وجه التحديد، وتركزت التأسيس EDU مكثفة حول الترع حلقة والهياكل fusome، كما الملون من هو لي تاي شاو (HTS) البروتين. و mtDNA أبقى تكرار على مستوى عال في المنطقة 3 من germarium (الشكل 1C)
للتدليل على جمعية specifالجينات أو العلاج مع انتشار و mtDNA جيم، يمكن أن يتعرض المبيض ذبابة الفاكهة للتلاعب الجيني أو العلاج من تعاطي المخدرات. كنا نعامل والمبايض مع تركيزات مختلفة من FCCP، وprotonophore الميتوكوندريا الكلاسيكية، التي تبدد إمكانات غشاء الميتوكوندريا. كعنصر تحكم، وكان DMSO أي تأثير على النسخ المتماثل و mtDNA (الشكل 4A). جرعات عالية من FCCP (10 ميكرومتر) استنفدت تقريبا تكرار الحمض النووي الميتوكوندري تماما في جميع أنحاء germarium (الشكل 4D). ومع ذلك، كان أقل تركيز من FCCP (2 أو 5 ميكرومتر) تأثير طفيف على النسخ المتماثل و mtDNA في المنطقة 1 ولكن تكرار تحول دون في المناطق 2B و 3 (الشكل 4B-C)، مما يشير إلى المناطق 2B و 3 أكثر حساسية للاضطراب الميتوكوندريا، أو أنها تحافظ على النسبية حركية تكرار أبطأ. وأشارت النتائج المذكورة أعلاه النسخ المتماثل و mtDNA يرتبط النشاط الميتوكوندريا. بشكل خاص، مناطق مختلفة من germarium استجابت بشكل مختلف لعفريت الميتوكوندرياairment.
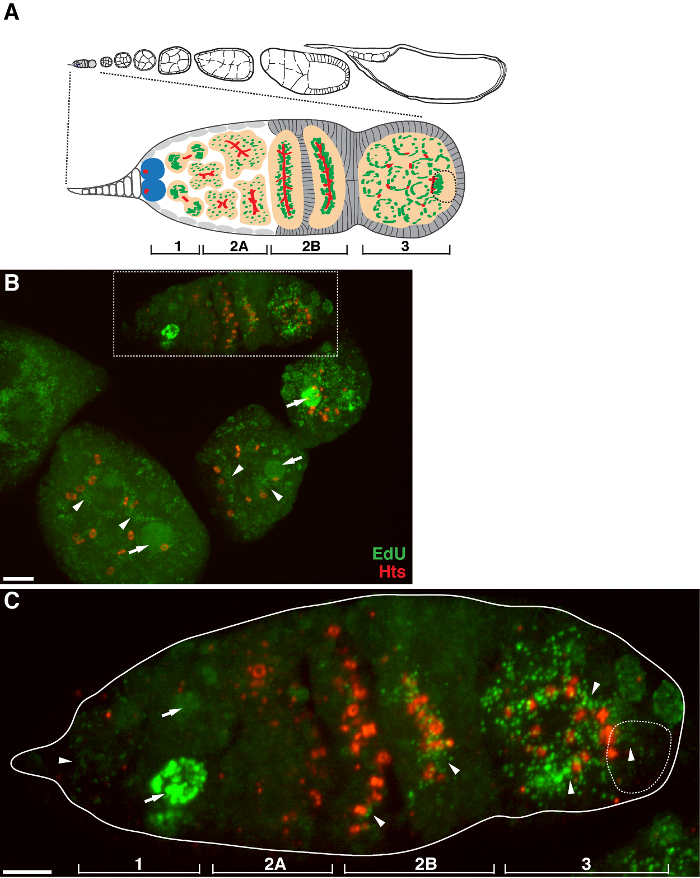
الرقم تكرار 1. و mtDNA خلال ذبابة الفاكهة مراحل تكوين البويضات. (A) رسم تخطيطي لovariole ذبابة الفاكهة وجهة نظر المكبرة من germarium. يوضح ovariole من اليسار إلى اليمين، الأمامي إلى الخلفي، مراحل النمو المتعاقبة من غرف البيض. في germarium، يتم عرض fusome (الحمراء)، والخلايا الجذعية سلالة الجرثومية (الأزرق)، الميتوكوندريا (الأخضر)، وبويضة في المستقبل (خط كسر، معترف بها من قبل المواقع، بنية fusome ومجموعات الميتوكوندريا)، وتطوير الخراجات (الخوخ) وأربع مناطق التنموية . (ب) الممثل ض المكدس الإسقاط من ovariole من النوع البري وصفت من قبل ايدو والأجسام المضادة ضد HTS-RC، علامة للقنوات حلقة وfusome. في ظل وجود aphidicolin، تأسست في ايدو في مستوى الميتوكوندريا (السهام) ونوى (السهام). شريط النطاق، 10 ميكرون.(C) عرض تضخيم germaria المبينة في المنطقة محاصر في (ب). يشار إلى أن المناطق التنموية الأربعة. شريط النطاق، 5 ميكرون 11. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
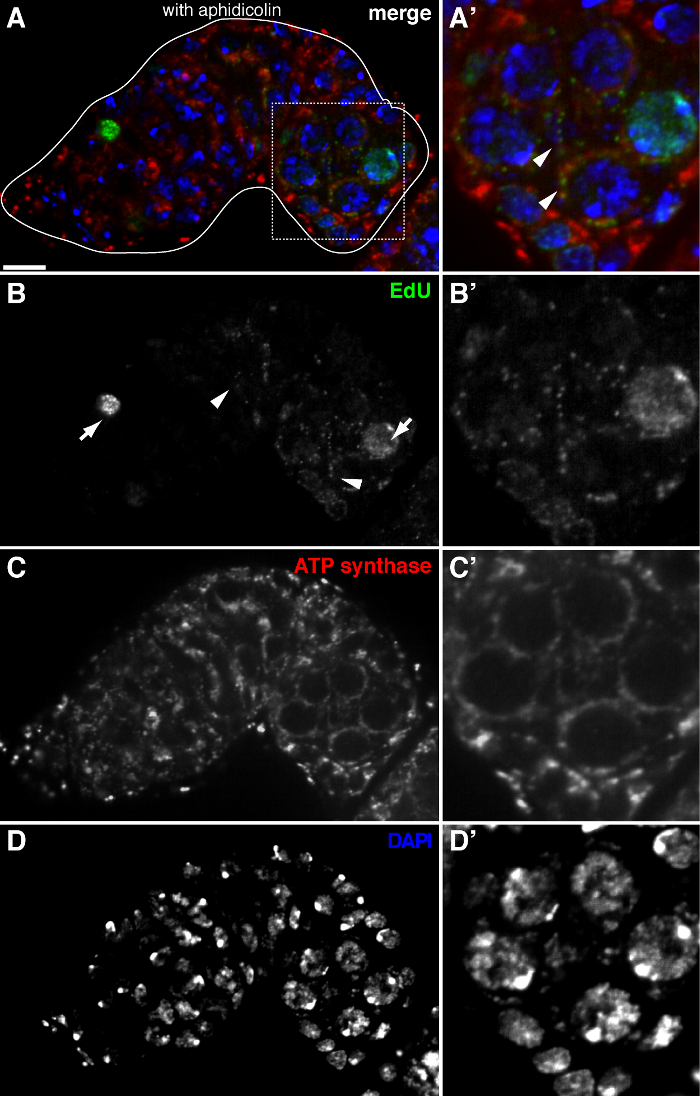
الشكل 2. تكرار الحمض النووي الميتوكوندري في germarium ذبابة الفاكهة التي تصور التأسيس ايدو مع العلاج aphidicolin (أ) - (D) القسم متحد البؤر الممثل من نوع germarium البرية تظهر ايدو التأسيس (الأخضر، ب)، الميتوكوندريا، التي تميزت ATP سينسيز ألفا فرعية تلطيخ (أحمر، C)، ونوى، وصفت مع تلوين دابي (الأزرق، D) مع ما قبل الحضانة مع aphidicolin الحمض النووي بوليميريز-α المانع. (A &# 39 ؛-D ') صورة مكبرة للمنطقة محاصر في الفقرة (أ) تظهر ايدو التأسيس (B)، الميتوكوندريا (C') ونوى (D '). في ظل وجود aphidicolin، يتم تخفيض التأسيس النووي (الأسهم) وكانت محلية العديد من نقاط وضمن الميتوكوندريا (السهام). الحانات نطاق 10 ميكرون. تم تعديل الرقم من 11. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
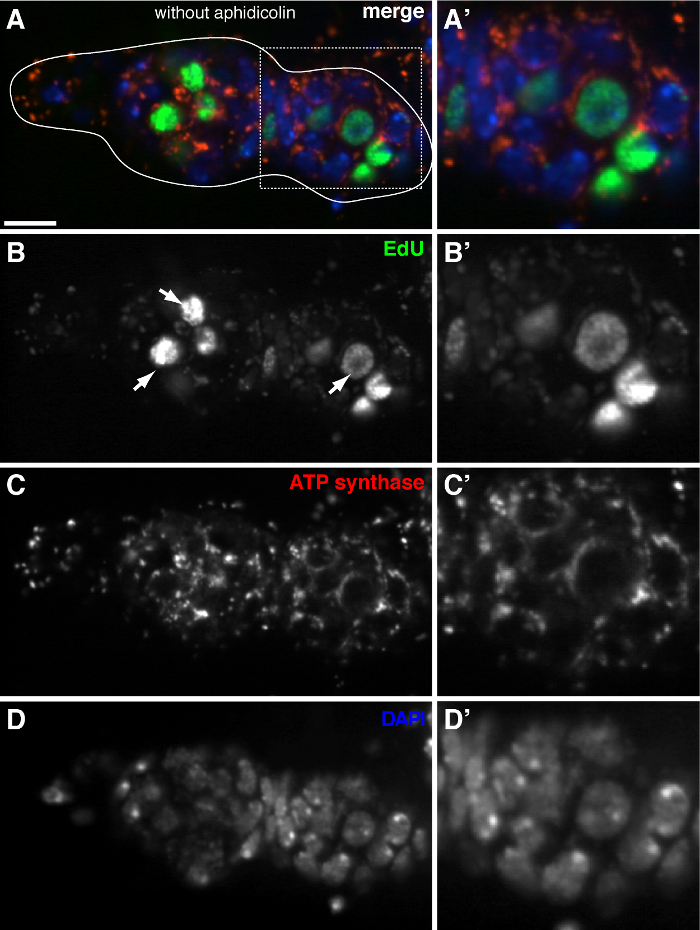
تم الكشف عن شخصية تكرار 3. و mtDNA بالكاد في germarium ذبابة الفاكهة دون علاج aphidicolin (أ) - (D) القسم متحد البؤر الممثل من نوع germarium البرية تظهر ايدو التأسيس (الأخضر)، والميتوكوندريا، التي تميزتATP سينسيز ألفا فرعية تلطيخ (الحمراء)، ونوى، وصفت مع تلوين دابي (الأزرق) في غياب aphidicolin الحمض النووي بوليميريز-α المانع. "صورة وتكبيرها في المنطقة محاصر في الفقرة (أ) تظهر ايدو التأسيس (B (A'-D))، الميتوكوندريا (C ') ونوى (D'). دون aphidicolin، تم الكشف عن الإشارات EDU مكثفة التسمية نوى (الأسهم)، وو mtDNA نقاط وبالكاد. الحانات نطاق 10 ميكرون. تم تعديل الرقم من 11. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
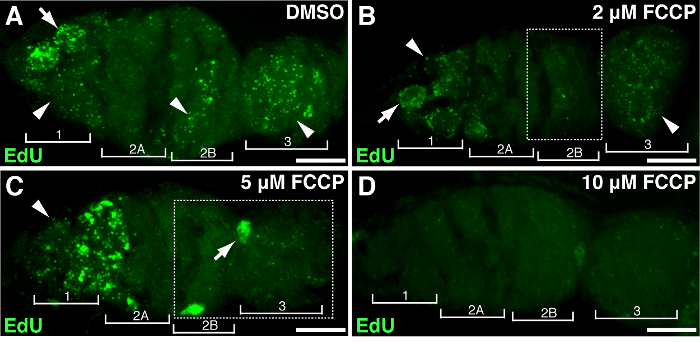
الشكل 4. الميتوكوندريا uncoupler تعطل تكرار الحمض النووي الميتوكوندري. مشاريع ض المكدس الممثل تظهر من النوع البري germarium تعامل مع DMSO(A) أو FCCP uncoupler الميتوكوندريا في تركيزات من 2 ميكرومتر (ب)، و 5 ميكرومتر (C)، و 10 ميكرومتر (D) خلال EDU التأسيس. لاحظ ضعف وضع العلامات ايدو في منطقة 2B تعامل مع 2 ميكرومتر FCCP (B)، وفي كل 2B المنطقة و3 تعامل مع 5 ميكرومتر FCCP (المبينة في مربعات). وتظهر أربع مناطق تنموية. السهام، والحامض النووي. النصال، و mtDNA. شريط النطاق، 10 ميكرون. تم تعديل الرقم من 11. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Discussion
EDU الوسم هو رواية وكفاءة طريقة للكشف عن الحمض النووي في الخلايا المتكاثرة، التي تقوم على دمج وتلطيخ للمتناظرة nucleoside في الحمض النووي توليفها حديثا. هذا الأسلوب هو أفضل من الطريقة BrdU وضع العلامات في أنه من أسرع وحساسة للغاية. الأهم من ذلك، أنها تتيح للحفاظ الهيكلي جيد وفعال اختراق EDU-صبغ كامل جبل الأنسجة 9 و 10. ومن الناحية التاريخية، باعتباره بديلا ممتازا لوضع العلامات BrdU، وكان يستخدم ايدو وضع العلامات لدراسة تكرار الحمض النووي النووي خلال S-مرحلة من مراحل دورة الخلية. Aphidicolin هو المانع من α البلمرة DNA، وهو البلمرة الرئيسي لتكرار الحمض النووي النووي في S-المرحلة 12 15. ويتم تكرار الحمض النووي الميتوكوندري بها γ البلمرة DNA، وهو غير حساس لaphidicolin العلاج. وبالتالي، والمعاملة مع aphidicolin قبل وأثناء حضانة EDU مستعمل بشكل كبير EDU إدماجها في الحامض النووي. أنه ينبغيتجدر الإشارة إلى أن aphidicolin قد تكون مستقرة لعدة أسابيع إذا تخزينها بشكل مناسب، وكان فعالية aphidicolin في تثبيط تكرار الحمض النووي النووي متغير في أيدينا. يجب استبعاد ovarioles أو غرف البيض مع قوي وسم الحامض النووي من تحليلات المزيد من البيانات.
النسخ و mtDNA يمكن تصور بسهولة كما نقاط وفي السيتوبلازم، الذي يتيح أيضا وسيلة واضحة لتحديد مستوى النسخ المتماثل و mtDNA عن طريق حساب عدد من ايدو نقاط و، تطبيع إلى إجمالي حجم السيتوبلازم. برامج التصوير يمكن تطبيقها لتحديد EDU نقاط وتلقائيا في الصور المجهرية، والتي هي مفيدة بشكل خاص للتحاليل الحسابية مجموعات كبيرة من البيانات. ومع ذلك، ينبغي أن تؤخذ الاحتياطات، لأن تثبيط غير مكتملة من تكرار الحمض النووي النووي يمكن أن يؤدي إلى إدماج ايدو في مواضع واضح على كروموسوم وعرض كما نقاط وداخل النواة. أيضا في حالات أخرى، لشدة EDU إدماجها repliقد يكون cating و mtDNA ضعيفة، في حين أن خلفية والضوضاء يمكن أن تكون مرتفعة. ولذلك، فإن المعلمات الفردية لتحليل التلقائي للصورة يجب أن تحدد بعناية. ويوصى أيضا أن الصور يجب فحص بعيون مدربة للتأكد من أن يتم تحديد المناسبة EDU نقاط و.
التصور و mtDNA تصنيعه حديثا خلال ذبابة الفاكهة مراحل تكوين البويضات يوفر فرصة لمعرفة كيف يتم تنظيم النسخ و mtDNA في ظل ظروف فيزيولوجية أو مرضية، من خلال تنفيذ التجربة في الذباب يتعرض لمجموعة متنوعة من الاضطرابات الدوائية أو وراثية. في دراسة سابقة، أجريت EDU التأسيس فحص في مستوى الميتوكوندريا متحولة ذبابة الفاكهة طن متري: هيئة النزاهة T300I 11. وعلاوة على ذلك، لتعطيل إمكانات غشاء الميتوكوندريا، تم علاج المبيض مع تركيزات مختلفة من FCCP uncoupler الميتوكوندريا أو 2،4-نيتروفينول (إدارة التخطيط الوطني) قبل ايدو التأسيس. تبعا لأغراض تجريبيةوخصائص الدواء، يمكن اعتماد أساليب مختلفة للتسليم الفعلي. لالذباب الكبار، ويمكن عرض المخدرات في شكل بخار (على سبيل المثال، والإيثانول والكوكايين) 16،17 أو يمكن حقن المخدرات في البطن، حيث ينتشر بسرعة في جميع أنحاء الجسم 18. الممارسة الأكثر شيوعا هو أن الأدوية التي تضاف إلى الطعام ذبابة أو / ورقة مرشح مشبعة المخدرات السكروز. على سبيل المثال، والمانع من الجمعية أنيبيب، الكولشيسين، لتغذية الذباب لمدة 2-3 أيام قبل تشريح المبيض 19. وبالتالي، فمن المهم تقييم طريقة إيصال الدواء واختيار تركيزات مناسبة.
لضمان التصوير الناجح لتكرار الحمض النووي الميتوكوندري في المبايض ذبابة الفاكهة، يجب أن يتم تنفيذ بعناية العديد من الخطوات الهامة. قبل كل شيء، والحفاظ على سلامة وصحة المبيضين أثناء تشريح وايدو التأسيس ضروري (الخطوات 1 و 2). متوسطة ذبابة الفاكهة وشنايدر مع FBS يحتاج إلى أن تكون درجة حرارة لRTقبل الاستعمال. ينبغي للمرء أن تقليل الاتصال المباشر بين الدوائر البيض وأدوات تشريح أو نصائح ماصة. يجب أن تكون مغمورة المبايض تحت حلول جميع الأوقات لتجنب الجفاف. سوء الأنسجة يمكن أن يؤدي بسهولة إلى الاغماء أو أي إشارات الفلورسنت. خلال الخطوة الأنسجة المتصاعدة، يجب فصل ovarioles من بعضها البعض، وانتشرت على شريحة المجهر. تأكد من عدم مكدسة الدوائر البيض على رأس كل منهما الآخر. لاحظنا أن الدوائر البيض وراء مرحلة 14 عرض القليل من ايدو التأسيس. بالإضافة إلى ذلك، لأن من الحجم الكبير، وغالبا ما تسبب غرف بيضة المرحلة المتأخرة المجاورة غرف البيض الشابة لتكون بعيدة عن التركيز. وبالتالي فمن المستحسن أن يتم تجاهل غرف مرحلة متأخرة البيض.
نحن هنا نقدم بروتوكول مفصل لوضع العلامات تكرار الحمض النووي الميتوكوندري في المبايض الكبار ذبابة الفاكهة. وتسمح هذه الطريقة لتقدير بسيط من النسخ و mtDNA تحت مختلف الاضطرابات الوراثية والدوائية،وسوف تكون مفيدة لتشريح الآليات الكامنة وراء نشوء حيوي الميتوكوندريا التنموي والميراث و mtDNA.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank K. Delaney for comments on the manuscript. This work was supported by the National, Heart, Lung, and Blood Institute (NHLBI) Intramural Program.
Materials
| Name | Company | Catalog Number | Comments |
| Schneider’s Drosophila medium | Invitrogen | 21720-024 | |
| FBS | Invitrogen | 10100-147 | |
| Pair of Dumont #5 Forceps | Fine Science Tools | 11252-20 | |
| Aphidicolin | Sigma | A0781 | Aliquot after dissolving in DMSO. Avoid repetitive thawing and freezing. Protect from light. May be used within 6 weeks after dissolving. |
| FCCP | Sigma | C2920 | |
| DMSO | Sigma | D2650 | |
| Paraformaldehyde, 16% EM grade | Electron Microscopy Sciences | 15710 | Formaldehyde is toxic; it should be handled in a fume hood with skin and eye protection. |
| PBS | KD Medical | RGF-3190 | |
| BSA | Sigma | A7030 | |
| Triton X-100 | Sigma | T9284 | |
| Click-iT EdU Alexa Fluor 488 Imaging Kit | Invitrogen | C10337 | EdU, CuSO4, Alexa Fluor 488 azide, EdU reaction buffer and Edu buffer additive are included |
| Mouse ATP synthase subunit α antibody, (15H4C4) | MitoSciences | Ab14748 | 1:1,000 dilution |
| Mouse Hts antibody (clone RC) | Developmental Studies Hybridoma Bank (DSHB) | hts RC | 1:1,000 dilution |
| Goat anti-mouse Alexa Fluor 568 secondary antibody | Invitrogen | A-11004 | 1:200 dilution |
| Vectashield mounting medium with DAPI | Vector Laboratories | H-1500 | |
| Glass coverslips, #1.5 22 mm x 22 mm | Fisher Scientific | 12-541-B | |
| Microscope slide | Fisher Scientific | 22-038-103 | |
| Nail polish | Elf | Many of the pigments used in nail polishes are fluorescent and leach into specimens. Only clear nail polish should be used. |
References
- Taylor, R. W., Turnbull, D. M. Mitochondrial DNA mutations in human disease. Nat Rev Genet. 6 (5), 389-402 (2005).
- Wallace, D. C., Chalkia, D. Mitochondrial DNA genetics and the heteroplasmy conundrum in evolution and disease. Cold Spring Harb Perspect Biol. 5 (11), a021220(2013).
- Spradling, A. C. The development of Drosophila melanogaster. , Cold Spring Harbor Lab. Press. (1993).
- Riechmann, V., Ephrussi, A. Axis formation during Drosophila oogenesis. Curr Opin Genet Dev. 11 (4), 374-383 (2001).
- Lin, H., Yue, L., Spradling, A. C. The Drosophila fusome, a germline-specific organelle, contains membrane skeletal proteins and functions in cyst formation. Development. 120 (4), 947-956 (1994).
- Cox, R. T., Spradling, A. C. A Balbiani body and the fusome mediate mitochondrial inheritance during Drosophila oogenesis. Development. 130 (8), 1579-1590 (2003).
- Davis, A. F., Clayton, D. A. In situ localization of mitochondrial DNA replication in intact mammalian cells. J Cell Biol. 135 (4), 883-893 (1996).
- Iborra, F. J., Kimura, H., Cook, P. R. The functional organization of mitochondrial genomes in human cells. BMC Biol. 2, (2004).
- Rakic, P. Neurogenesis in adult primate neocortex: an evaluation of the evidence. Nat Rev Neurosci. 3 (1), 65-71 (2002).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc Natl Acad Sci U S A. 105 (7), 2415-2420 (2008).
- Hill, J. H., Chen, Z., Xu, H. Selective propagation of functional mitochondrial DNA during oogenesis restricts the transmission of a deleterious mitochondrial variant. Nat Genet. 46 (4), 389-392 (2014).
- Lentz, S. I., et al. Mitochondrial DNA (mtDNA) Biogenesis: Visualization and Duel Incorporation of BrdU and EdU Into Newly Synthesized mtDNA In Vitro. Journal of Histochemistry & Cytochemistry. 58 (2), 207-218 (2010).
- Tornoe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(i)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J Org Chem. 67 (9), 3057-3064 (2002).
- Horwitz, H. B., Holt, C. E. Specific inhibition by ethidium bromide of mitochondrial DNA synthesis in physarum polycephalum. J. Cell Biol. 49, 546-553 (1971).
- Huberman, J. A. New views of the biochemistry of eucaryotic DNA replication revealed by aphidicolin, an unusual inhibitor of DNA polymerase alpha. Cell. 23 (3), 647-648 (1981).
- McClung, C., Hirsh, J. Stereotypic behavioral responses to free-base cocaine and the development of behavioral sensitization in Drosophila. Curr Biol. 8 (2), 109-112 (1998).
- Moore, M. S., et al. Ethanol intoxication in Drosophila: Genetic and pharmacological evidence for regulation by the cAMP signaling pathway. Cell. 93 (6), 997-1007 (1998).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Gamma-aminobutyric acid B receptor 1 mediates behavior-impairing actions of alcohol in Drosophila: adult RNA interference and pharmacological evidence. Proc Natl Acad Sci U S A. 100 (9), 5485-5490 (2003).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell Tissue Res. 228 (1), 21-32 (1983).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved