Method Article
באתרו תיוג של דנ"א מיטוכונדריאלי שכפול תסיסנית למבוגרים השחלות ידי edu מכתים
In This Article
Summary
Drosophila oogenesis continues to be exceptionally useful in the study of mitochondrial proliferation and inheritance. This manuscript describes a detailed protocol used to label the replicating mitochondrial DNA (mtDNA) in Drosophila adult ovaries with 5-ethynyl-2´-deoxyuridine (EdU), which facilitates uncovering mechanisms associated with mitochondrial inheritance that were previously debatable.
Abstract
The mitochondrial genome is inherited exclusively through the maternal line. Understanding of how the mitochondrion and its genome are proliferated and transmitted from one generation to the next through the female oocyte is of fundamental importance. Because of the genetic tractability, and the elegant, ordered simplicity by which oocyte development proceeds, Drosophila oogenesis has become an invaluable system for mitochondrial study. An EdU (5-ethynyl-2´-deoxyuridine) labeling method was utilized to detect mitochondrial DNA (mtDNA) replication in Drosophila ovaries. This method is superior to the BrdU (5-bromo-2'-deoxyuridine) labeling method in that it allows for good structural preservation and efficient fluorescent dye penetration of whole-mount tissues.
Here we describe a detailed protocol for labeling replicating mitochondrial DNA in Drosophila adult ovaries with EdU. Some technical solutions are offered to improve the viability of the ovaries, maintain their health during preparation, and ensure high-quality imaging. Visualization of newly synthesized mtDNA in the ovaries not only reveals the striking temporal and spatial pattern of mtDNA replication through oogenesis, but also allows for simple quantification of mtDNA replication under various genetic and pharmacological perturbations.
Introduction
מלבד גנום הגרעין, בכל תא האיקריוטים גם מכיל אלף עותקים של דנ"א מעגלית קטנה במטריצה המיטוכונדריה. בעוד ה- DNA המיטוכונדריאלי (mtDNA) מקודד יחידות משנה חיוניות של שרשרת העברת אלקטרונים, הרוב של proteome המיטוכונדריה, כולל כל הגורמים שכפולים שעתוק של mtDNA מקודד על ידי הגנום הגרעיני. בניגוד הגנום הגרעיני העוקב לחוקי מנדל ירושה, הגנום המיטוכונדרי החיה עובר בירושה באופן בלעדי דרך השושלת האימהית. לכן, ההבנה כיצד mtDNA הוא התרבו מדור אחד למשנהו דרך ביצית האישה חשוב ביסודו. עם זאת, יש המשך דיון בשאלה כיצד שכפול mtDNA מוסדר germline הנשי. בנוסף, התיאוריה צוואר הבקבוק mtDNA מקובל לשידור mtDNA עולה כי אוכלוסיית mtDNA בתאי הנבט בראשיתי הוא subsampled למספר קטן יחסית דוריןפיתוח גרם 1 2. זה גם מרמז כי שכפול mtDNA הוא זמני ומוסדר מרחבית במהלך oogenesis. לפיכך, גילוי באתרו של שכפול mtDNA במהלך ההתפתחות germline יקל על הבנת המנגנון של ירושה mtDNA.
תסיסנית oogenesis מספק מערכת צייתן גנטית ללמוד שכפול mtDNA ושידור. בכל אחד משתי השחלות תסיסנית, יש 16-20 מחרוזות עצמאיות של תאי ביצה בשם ovarioles 3, שהן היחידות התפקודיות של ייצור ביצים (ראה איור 1 א). כל ovariole מכיל ארגון ליניארי מתקדם של oogenesis, שם הקצה הקדמי מורכב מבנה הנקרא germarium. Germarium הוא חולק לארבעה אזורים המכילים תאי נבט בשלבים התפתחותיים שונים. באזור 1, תאי גזע germline לעבור חלוקה סימטרית לייצר תאי בת המכונים גystoblasts. 2a האזור המכיל את cystoblasts שסיים החלוקה הסופית שלהם. Cystoblasts לעבור ארבעה סיבובים של חלוקה לייצר קבוצות 16 תאים. 16 התאים נשארים מחוברים זה לזה בגשרים ציטופלסמית שנקראים תעלות טבעת. רק באחד התאים מתחייב בידול כמו הביצית, ואילו 15 אחרים לפתח כתאי אחות polyploid. מבנה ציטופלסמית חיוני, המכונה fusome, מוצע להקל עם הקמתה של תעלות טבעת, לקבוע את קוטביות ציסטה ואחות אינטראקציות תא-ביצית 4,5. כמו ציסטות לנוע לעבר 2b באזור, המבנים ציסטה בדיוק לרוחבה כולו של germarium, ולהפוך להיות מזוהה יותר עם תאי זקיק. מבני germarium מסתיימים באזור 3 המכיל את תא ביצת הניצנים הראשון. בהמשך לכך, תאי הביצה הם התאספו בקצה האחורי של germarium, אשר התקדמותך ovariole ב 14 שלבים ברורים מורפולוגית. הגידול של ביצית תלוי תאי האחות, WHחלבונים תחבורה ich, mRNA ומבנים endomembrane (למשל, Golgi) דרך תעלות הטבעת לתוך הביצית. במהלך תסיסנית oogenesis, נמצא כי חלק מן המיטוכונדריה בתוך כל ציסטה 16 תאים היו קשורים עם fusome, עבר דרך תעלות הטבעת נמסרו לביצית אחת מסה גדולה בשם Balbiani הגוף 6. תופעה זו הוצעה לתרום בקרת האיכות של ירושת המיטוכונדריה דרך שחלות נשיות.
איתור של סינתזה mtDNA מסתמך על שילוב של מבשרי DNA שכותרתו לתוך ה- DNA התאי. באופן מסורתי, אנלוגי nucleoside של thymidine 5-bromo-2'-deoxyuridine (BrdU) שימש לתייג את שכפול mtDNA בתאים בתרבית רקמה 7,8. עם זאת, תיוג BrdU מבוסס הנוגדנים מפגין מספר מגבלות, בעיקר עבור מכתים רקמות כל ההר. חסרון עיקרי אחד תיוג BrdU הוא שהיא דורשת denaturation DNA לחשוףאת epitope BrdU, כך ניתן לאתר אותו על ידי נוגדן אנטי BrdU. הדגימה צריכה להיות מטופלים בתנאי denaturing קשים כגון כימיקלים (למשל, חומצה הידרוכלורית או תערובות של מתנול וחומצה אצטית), חום, או עיכול עם DNase, אשר יכול לשבש את המבנה של הדגימה ו לסבך את ההליך המכתים הבא 9, 10.
הנה, אלטרנטיבה thymidine אנלוגי 5 ethynyl-2'-deoxyuridine (EDU) משמש לתייג את הדנ"א המיטוכונדרי שכפול השחלות מבוגר תסיסנית. שיטה זו היא מהירה מאוד רגיש. Edu הוא לשלב בקלות לתוך ה- DNA הסלולר במהלך שכפול הדנ"א. הגילוי הבא מבוסס על תגובת "לחץ", Cu (I) -catalyzed התגובה קוולנטיים בין קבוצת מסוף אלקין וכן אזיד פלורסנט 10. בגלל התגובה אינה מחייבת את denaturation של הדגימה, היא מאפשרת שימור מבני טוב. יתר על כן, בגודל של צבעzide הוא רק 1/500 מזו של מולקולת נוגדן 10, המאפשר חדירה מהיר ויעיל של רקמות כל הר. השתמשנו בשיטה זו כדי לזהות שכפול mtDNA במהלך oogenesis תסיסנית ומוצא דפוס מרחבית מרשים באזור germarium של שחלה תסיסנית 11, דבר שמוביל אותנו להציע מנגנון ירושה סלקטיבית שכפול תלויה mtDNA. אנו מציגים כאן פרוטוקול מפורט על תיוג edu של שכפול mtDNA בשחלות תסיסנית. כדי להדגים את היישום של הפרוטוקול, גם בדקנו את שכפול mtDNA בתוך תסיסנית מוטציה mtDNA (mt: T300I COI) 11, וכן עם טיפול מגוונות של uncouplers המיטוכונדריה, אשר להפיג את קרום המיטוכונדריה פוטנציאל ואפשרות לשבש שכפול mtDNA.
Protocol
רקמות 1. איסוף Dissection
- בכל בקבוקון המכיל שמרים יבשים, נקבה בוגרת תרבות 10 טס עם 10 גברים במשך 2-3 ימים.
הערה: שמירה על נקבות זבוב שייזון גם תשפר את האיכות ואת התשואה הכוללת של ייצור שחלה ולהקל לנתיחה. - להרדים את הנקבה זבובים על פחמן דו חמצני (CO 2) לטוס כרית.
- תחת stereoscope, למקם מספר טיפות של מדיום RT (בינוני תסיסנית של שניידר בתוספת 10% בסרום שור העובר (FBS)) על משטח לנתח. לנהל את כל ההליכים לנתיחה במדיום כדי לשמור על הרקמות חיות ובריא.
- תפוס נקבה מפוטמת לטוס עם מלקחיים בסדר חוטם חדת החזה תחתון. השתמש קבוצה נוספת של מלקחיים למשוך בעדינות האחורית הקיצונית של הזבוב עד הרקמות בבטן חשופות. ניתוק שני השחלות מרקמות אחרות (אומץ למשל).
הערה: כל מציג השחלת מבנה אטום כי הוא להלחיןד של 16-20 ovarioles המצורפת. - כדי לשפר את חדירת חומרים כימיים, לפתוח את השחלות על ידי משיכת אותם בנפרד ולהעביר את קצות המלקחיים בין כל ovariole כמה פעמים. שמור את ovarioles מחובר בתוך השחלה כדי להקטין את איבוד של רקמות במהלך ההליכים הבאים.
- מעבירים את השחלות לאלתר על צינור 1.5 מ"ל microcentrifuge המכיל 500 μl של המדיום תסיסנית של שניידר עם 10% FBS.
- חזור על לנתיחה ולאסוף 10-15 השחלות בצינור אחד microcentrifuge.
2. תיוג edu
- לשאוב את המדיום בצינור אחד, ולהחליף עם 500 μl של המדיום תסיסנית של שניידר עם FBS 10% המכיל 7 מיקרומטר aphidicolin.
הערה: Aphidicolin משמש לחסום סינתזה של DNA גרעיני על ידי עיכוב α DNA פולימרז מבלי להשפיע mtDNA שכפול 7, 12. אפשר להעלות את ריכוז aphidicolin לעדעד 70 מיקרומטר להשיג עיכוב טוב יותר. פתרון המניות של aphidicolin 3-30 מ"מ DMSO ניתן לאחסן בחושך ב -20 ° C עד 6 שבועות. - כדי לשמור על ההשחלות בריאות, להבטיח כי הם שקועים מתחת פתרונות תוך שינוי המדיום. השתמש בינוני תסיסנית של שניידר עם 10% FBS עד שלב 2.6.
- דגירה השחלות עבור 3 שעות ב RT על כיסא נדנדה הספסל העליון עם סיבוב עדין.
- לקבלת טיפול תרופתי, למשל, הציאניד קרבוניל uncoupler המיטוכונדריה 4-trifluoromethoxy phenylhydrazone (FCCP), להוסיף את הריכוז המתאים של התרופה (למשל, 10 מיקרומטר FCCP) לתוך המדיום לאחר 2 שעות של טיפול aphidicolin. המשך דוגרים במשך 1 אחר hr.
- הסר את aphidicolin המכיל הבינוני עם או בלי סמים. בקצרה לשטוף את השחלות עם המדיום (aphidicolin אין צורך) פעמיים.
- הוסף 1 מ"ל המכיל בינוני 10 מיקרומטר edu ו -7 מיקרומטר aphidicolin ולהמשיך incubating ב RT עבור שעה 2. אחסן את הפתרון המניה 10 מ"מ edu (DMSO) ב -20 ° C.
- הסר את הבינוני המכיל edu ו aphidicolin. לשטוף עם המדיום (ללא aphidicolin) פעמיים עבור 3 דקות כל אחד.
רקמות 3. קיבוע Permeabilization
- כן פתרון paraformaldehyde 4% ב בופר פוספט (PBS, pH 7.4).
הערה: השתמשנו paraformaldehyde המסחרי הזמין מאוחסן אמפולות מראש בקיע. פתח אמפולה חדש לדלל עד 4% לפני השימוש.
זהירות: פורמלדהיד הוא רעיל; צריך להיות מטופלים זה במנדף עם עור ומשקפי מגן. - תקן השחלות עם 4% paraformaldehyde במשך 20 דקות ב RT עם סיבוב עדין.
- הסר מקבע ולשטוף השחלות פעמיים 1 מ"ל של BSA 3% ב PBS במשך 5 דקות בכל פעם.
- כדי permeabilize הרקמות, להסיר את הפתרון לשטוף ולהוסיף 1 מ"ל של 0.5% Triton X-100 ב PBS. לדגור על RT במשך 20 דקות.
- הסר את הפתרון permeabilization ולשטוף פעמיים ב 1 מ"לשל 3% BSA ב PBS.
4. איתור edu
הערה: זיהוי edu מבוסס על "לחץ" כימיה, Cu (I) -catalyzed [3 + 2] cycloaddition 13, אשר מוסיפה azides פלורסנט לקבוצת אלקין הטרמינל של EDU, לבין מולקולה ניאון הוא נתון זיהוי שלאחר מכן. מאז Cu (I), אשר מתחמצן בקלות למין Cu (II) אי-קטליטי, נדרש לזרז את התגובה, מומלץ להפחית את Cu (II) סולפט באתרו להשיג Cu (I). כלומר, Cu (II) סולפט משמש בנוכחות של reductant כגון חומצה אסקורבית (להלן את "כתוסף חיץ") כדי ליצור נחושת (I).
- לפני הניסוי, להכין הפתרון עובד של יזיד Alexa פלואוריד (Alexa פלואוריד 488 יזיד, Alexa פלואוריד 555 יזיד או אחר, תלוי fluorophore המועדף, אשר כפי ששם להלן "לצבוע יזיד"), מאגר תגובת edu ו EDU חיץ כתוסף על פי היצרן שלהוראות.
- מחדש את אזיד לצבוע 70 μl DMSO. אחסן את הפתרון עובד ב -20 ° C עד 1 שנה.
- הכין חיץ תגובת edu טרי ידי דילול 10x למאגר תגובת edu עם מים ללא יונים.
הערה: לאחר שימוש, לאחסן כל פתרון 1x הנותר על 4 מעלות צלזיוס. הפתרון 1x יציב למשך עד 6 חודשים. - כן פתרון מניות 10x של תוסף חיץ edu ידי המסת האבקה מלאה ב 2 מיליליטר מי deionized.
הערה: פתרון המניות זהו יציב במשך עד שנה 1 ב -20 ° C. אם הפתרון מפתח בצבע חום, היא מושפלת אמורה להיות מושלכת.
- הכן את קוקטייל תגובת edu טרי בכל פעם, ולהשתמש תוך 15 דקות של הכנה. כדי להשיג תוצאות לשחזור, לוודא את מרכיבי התגובה נשמרים באותו היחס.
- הפוך edu 1x הטרי חיץ כתוסף פתרון על ידי דילול פתרון 10x המלאה (המוכנים בשלב 4.1.3) 1:10 ב מים ללא יונים. השתמש באפשרות זו solution באותו היום.
- הכן 1 מ"ל של קוקטייל התגובה edu על ידי שילוב של המרכיבים הבאים לפי הסדר: 860 μl חיץ התגובה 1x edu, 40 μl CuSO 4, 2.5 אזיד לצבוע μl, 100 μl כתוסף חיץ 1x edu.
הערה: חשוב כי החומרים מתווספים על מנת להבטיח ביצועים מיטביים.
- הסר את PBS עם 3% BSA ולהוסיף 0.5 מ"ל של קוקטייל התגובה edu על צינור אחד. לדגור על RT במשך 30 דקות עם סיבוב עדין. שמור את הדגימות מוגנות מפני אור.
- הסר את קוקטייל התגובה edu ולשטוף פעם עם 1 מ"ל של BSA 3% ב PBS.
- שטפו את דגימות פעם עם 1 מ"ל של PBS.
5. תיוג נוגדן
הערה: בצע תיוג נוגדן לאחר מכתים edu. אם לא מכתים נוסף הוא רצוי, אפשר להמשיך הרכבה והדמיה ישירות. חשוב כי הדגימות להיות מוגנות מפני אור בכל ההליכים הבאים.
- הסר את הפתרון לשטוף. חסום את השחלות 1 מ"ל של תמיסת חסימת המכיל BSA 0.2% ו -0.1% Triton X-100 ב PBS למשך 30 דקות.
- הסר את פתרון חסימת להחליף עם נוגדן ראשוני מדולל חסימת פתרון (למשל, למקטע synthase העכבר ATP α נוגדנים, 1: 1,000 דילול). דגירה בחושך ב 4 ° CO / N.
- שטפו את דגימות עם 1 מ"ל של חסימת פתרון 3 פעמים, 10 דקות בכל פעם. כדי למזער את הרקע, לשטוף פעמיים נוספות במשך 30 דקות כל אחד. הסר את הפתרון החוסם.
- דגירה עם נוגדנים משני מדולל חסימת פתרון (למשל, נוגדנים משני אנטי עכבר עז אלקסה פלואוריד 568, 1: 200 דילול) עבור שעה 2 ב RT.
הערה: השתמש בצבע שונה מזו מצמידה edu. - חזור על השלבים לשטוף ביצע בשלב 5.3.
- לשטוף עם 1 מ"ל של PBS פעם כדי להסיר את נוזל הכלים.
שמה והדמיה 6.
- מוציאים בזהירות את כל PBS ו IMMediately לכסות השחלות עם 50 μl הרכבה בינונית (עם או בלי DAPI).
הערה: השתמש הרכבה בינונית שאינה להקשיח בעוד ovarioles שמתבצע מופרדים אחד מהשני. השחלות ניתן לאחסן הרכבה בינונית על 4 מעלות צלזיוס למשך עד שבוע. - חותכים את הקצה של קצה פיפטה ולהשתמש בו כדי להעביר השחלות בזהירות לשקופית מיקרוסקופ.
- לגמרי פרד ovariole עם מלקחיים בסדר חוטם חד מתחת סטראו. הסר את רקמות חיבור בקצה האחורי ושלב 14 או תאי ביצית בשלה. תאי הביצה הצעירים הם בקצה הקדמי והשקוף.
- יישר את תאי ביצה עם מלקחיים, כך שהם אינם חופפים זה לזה.
- לאט לאט להוריד coverslip זכוכית 1.5 # על גבי הדגימות. אפשר המדיום גובר לפלמר במשך כמה שעות ב RT. חותם עם לק שקוף.
- תמונת שקופיות למחרת, או בחנות ב 4 ° C לפני ההדמיה.
- דמיינו תחת מיל confocalcroscope עם מטרת נפט טבילה 63X. צלמו תמונות תלת ממדי Z- ערימות.
הערה: יש חזקת edu לאותת בתאי ביצה הנמצאים בשלבים קרינת רקע נדן אפיתל. כאשר בוחנים תיוג edu בתוך germarium בפרט, יש להימנע germariums שאינם חופפים ידי או קרובה לרקמות אחרות או הנמצאים בשלבים תאי ביצה.
תוצאות
בפרוטוקול לעיל מאפשר הדמיה של מבנים punctate הקשורים המיטוכונדריה (איור 1 ב- C), אשר מצביעים על שכפול הדנ"א המיטוכונדרי במהלך oogenesis תסיסנית. Puncta edu מקומי עם המיטוכונדריה התאפיינה מכתים עבור למקטע אלפא synthase ATP (איור 2). האותות נצפו נעדרו השחלות שטופלו ברומיד ethidium 11, מעכב עבור שכפול mtDNA 14, אימות כי puncta אלה התווית אכן משכפלים mtDNA.Aphidicolin שימש לעכב מכתים DNA גרעיני מבלי להשפיע שכפול mtDNA (איור 2). ללא טיפול aphidicolin, אותות edu אינטנסיביים לתייג את הגרעינים, ו puncta mtDNA אותר בקושי (איור 3). עם זאת, בנוכחות aphidicolin, התאגדות גרעינית חלה צמצום משמעותי ורבי puncta קשור המיטוכונדריה נצפה.
התחת = "jove_content" FO: keep-together.within-page = "1"> יש רמה גבוהה של שכפול mtDNA בתאי ביצה שלאחר germarium (איור 1B). עם זאת, יש לציין, שכפול mtDNA מוצג דפוס המרחבית germarium. כפי שצוין על ידי מספר puncta edu, יש רמה מתונה של שכפול mtDNA באזור 1 של germarium, אבל כמעט אף ההתאגדות edu ב 2A באזור (איור 1 ג). כמו ציסטה נע כלפי מטה כדי 2B האזור germarium, שכפול mtDNA חידש ומספר edu puncta ב ציסטה האחורי של 2B באזור היה גבוה הרבה יותר מזה באזור 2A (תרשים 1C). באופן ספציפי, שילוב edu אינטנסיבי התרכז סביב תעלות הטבעת ואת מבני fusome, כמו מוכתם על ידי שאו טאי הו li (HTS) החלבון. mtDNA כל זמן משכפל ברמה גבוהה באזור 3 של germarium (תרשים 1C)
כדי להדגים את הקשר בין specifגנים או טיפול ic עם התפשטות mtDNA, השחלות תסיסנית יכול להיות חשוף מניפולציה גן או טיפול תרופתי. התייחסנו השחלות עם ריכוזים שונים של FCCP, protonophore המיטוכונדריה הקלאסי, אשר מתפוגג פוטנציאל הממברנה של המיטוכונדריה. כביקורת, היה DMSO אין כל השפעה על שכפול mtDNA (איור 4 א). מינונים גבוהים של FCCP (10 מיקרומטר) מדולדל כמעט שכפול mtDNA לחלוטין ברחבי germarium (4D איור). עם זאת, ריכוז נמוך יותר של FCCP (2 או 5 מיקרומטר) הייתה השפעה מינורית על שכפול mtDNA באזור 1 אבל שכפול עכבות באזורים 2B ו -3 (איור 4 ב-ג), דבר המצביע על אזורים 2B ו -3 רגישים יותר שיבוש המיטוכונדריה, או הם שומרים על קינטיקה שכפול יחסית איטי. התוצאות לעיל עולה כי שכפול mtDNA קשורה פעילות המיטוכונדריה. במיוחד, באזורים שונים של germarium הגיבו באופן שונה שד המיטוכונדריהairment.
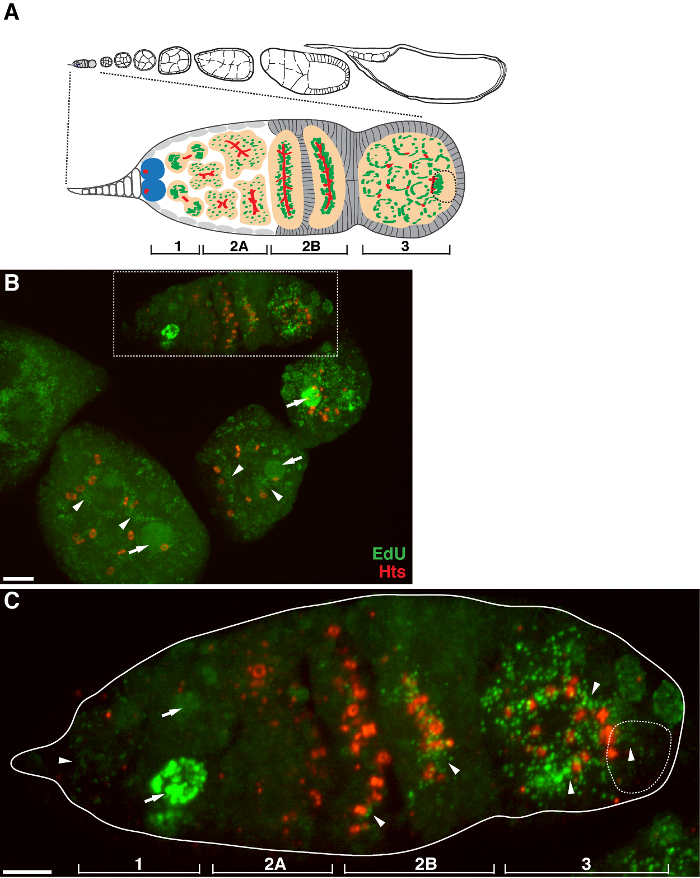
איור 1. שכפול mtDNA במהלך תסיסנית oogenesis. (א) תרשים של ovariole תסיסנית תצוגה מוגדלת של germarium. Ovariole ממחיש משמאל לימין, קדמי אל אחורי, שלבי התפתחות רצופים של תאי ביצה. בשנות ה germarium, את fusome (אדום), תאי גזע germline (כחול), המיטוכונדריה (ירוק), הביצית בעתיד (קו שבור, מוכר על ידי מיצוב, מבנה fusome ואשכולות המיטוכונדריה), פיתוח ציסטות (אפרסק) וארבעה אזורים התפתחותי מוצגים . (ב) היטל Z- מחסנית נציג של ovariole wild-type שכותרתו ידי edu נוגדנים נגד HTS-RC, סמן תעלות הטבעת fusome. בנוכחות aphidicolin, את edu שולב mtDNA (ראשי חץ) גרעינים (חיצים). סרגל קנה מידה, 10 מיקרומטר.(C) יתגדל לאור germaria התווה באזור התאגרף B. ארבעת האזורים התפתחותי מסומנים. סרגל קנה מידה, 5 מיקרומטר 11. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
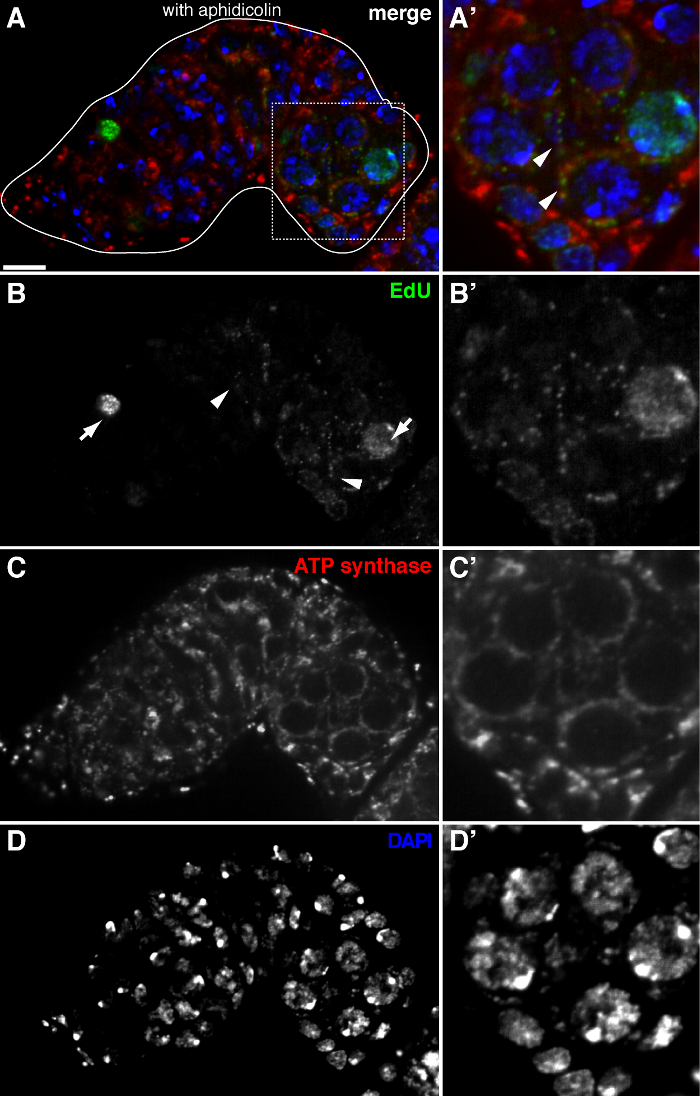
שכפול mtDNA איור 2. ב germarium תסיסנית דמיינו ידי ההתאגדות edu עם טיפול aphidicolin (א) -. (ד) בסעיף confocal נציג של germarium סוג בר מראה ההתאגדות edu (ירוק, ב), המיטוכונדריה, בסימן מכתים למקטע אלפא synthase ATP (אדום, C), גרעינים, שכותרתו עם מכתים DAPI (כחול, D) עם הדגירה מראש עם aphidicolin מעכב DNA פולימראז-α. (A &# 39 ;-D ') תמונה מוגדלת של אזור התאגרף ב (א) מראה ההתאגדות edu (ב'), המיטוכונדריה (ג ') גרעינים (ד'). בנוכחות aphidicolin, התאגדות גרעינית (חיצים) מצטמצמת ורבי puncta היו נקודות בתוך המיטוכונדריה (ראשי חץ). ברי סולם, 10 מיקרומטר. הדמות שונתה מ -11. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
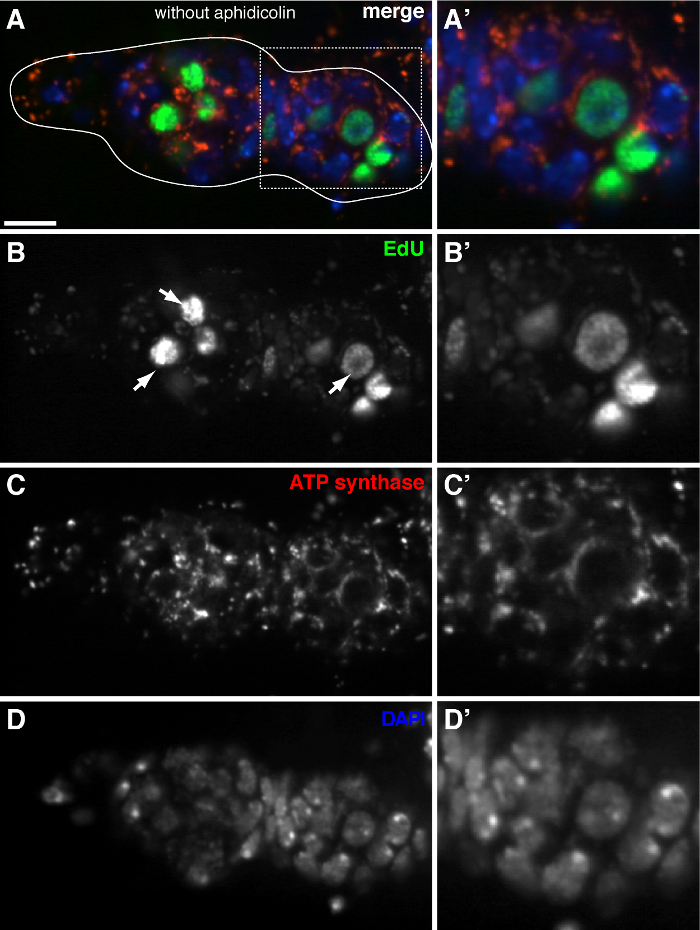
שכפול mtDNA איור 3. מזוהה בקושי germarium תסיסנית ללא טיפול aphidicolin (א) -. (ד) בסעיף confocal נציג של germarium סוג בר מראה ההתאגדות edu (ירוק), המיטוכונדריה, בסימןמכתים למקטע אלפא synthase ATP (אדום), גרעינים, שכותרתו עם מכתים DAPI (כחול) בהעדר של aphidicolin מעכב-α DNA פולימרז. (A'-ד ') תמונה מוגדלת של אזור התאגרף ב (א) מראה ההתאגדות edu (ב'), המיטוכונדריה (ג ') גרעינים (ד'). ללא aphidicolin, גרעיני התווית אותות edu אינטנסיביים (חיצים), ו puncta mtDNA אותרו בקושי. ברי סולם, 10 מיקרומטר. הדמות שונתה מ -11. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
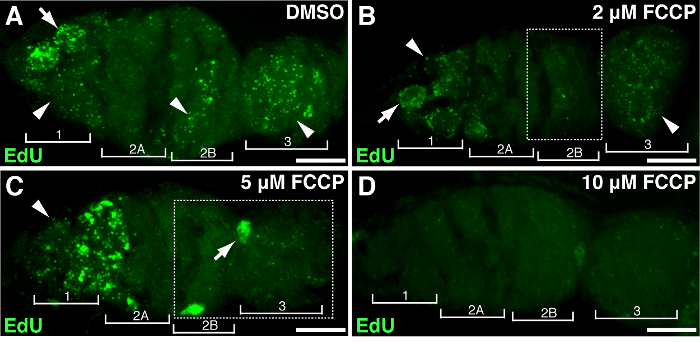
איור 4. מיטוכונדריאלי uncoupler פוגמת שכפול mtDNA. פרויקטים נציג Z- מחסנית מראה germarium wild-type שטופלו DMSO(א) או FCCP uncoupler המיטוכונדריה בריכוזים של 2 מיקרומטר (ב), 5 מיקרומטר (C), 10 מיקרומטר (D) במהלך ההתאגדות edu. שים לב תיוג edu הלקוי באזור 2B שטופל 2 מיקרומטר FCCP (B), ובשני 2B באזור ו -3 מטופלים עם 5 FCCP מיקרומטר (המפורטים תיבות). ארבעה אזורים התפתחותי מוצגים. חצים, DNA גרעיני; ראשי חץ, mtDNA. סרגל קנה מידה, 10 מיקרומטר. הדמות שונתה מ -11. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
תיוג EDU הוא שיטה חדשה ויעילה לגילוי סינתזה של DNA בתאים מתרבים, אשר מבוססת על שילוב וצביעת אנלוגים nucleoside בדנ"א מסונתז החדש. שיטה זו עדיפה על שיטת תיוג BrdU ב שזה מהר מאוד רגיש. יתרה מכך, היא מאפשרת שימור מבני טוב וחדירת EDU-צבען יעיל של כל הר רקמות 9, 10. מבחינה הסטורית, כחלופה עדיפה על תיוג BrdU, תיוג edu שמש ללימוד שכפול הדנ"א גרעיני במהלך S-השלב של מחזור התא. Aphidicolin הוא מעכב של α DNA פולימרז, המהווה את פולימראז העיקרית שכפול הדנ"א הגרעיני S-שלב 12 15. שכפול mtDNA מתבצע על ידי γ DNA פולימרז, שאינו רגיש aphidicolin טיפול. לפיכך, טיפול עם aphidicolin לפני ובמהלך דגירת edu בלמה באופן משמעותי התאגדות edu לתוך ה- DNA הגרעיני. זה אמורלציין כי aphidicolin עשוי להיות יציב במשך כמה שבועות אם מאוחסן כראוי, ואת היעילות של aphidicolin בבלימת שכפול הדנ"א גרעיני הייתה משתנית בידינו. Ovarioles או תאי ביצה עם תיוג DNA הגרעיני החזק צריך להיות מחוץ נתונים נוספים מנתח.
שכפול mtDNA ניתן דמיינו בקלות כמו puncta בציטופלסמה, מקנה גם דרך פשוטה לכמת את רמת שכפול mtDNA ידי ספירת מספר puncta edu, מנורמל את הנפח הכולל של הציטופלסמה. ניתן ליישם תוכנת הדמיה לזהות edu puncta אוטומטית תמונות מיקרוסקופיות, וזה שימושי במיוחד עבור ניתוחים חישובית של ערכות נתונים גדולות. עם זאת, יש לנקוט אמצעי זהירות, כי העיכוב השלם של שכפול ה- DNA הגרעיני יכול להוביל שילוב edu ב לוקוסים ברורים על כרומוזום ולהציג כמו puncta בתוך הגרעין. גם במקרים אחרים, עוצמת edu שילובם repliCating mtDNA יכול להיות חלש, בעוד הרקע והרעש יכולים להיות גבוהים. לכן, הפרמטרים הבודדים עבור ניתוחי תמונה אוטומטיים צריכים להיות מוגדרים היטב. מומלץ גם כי תמונות יש לבחון בעיניים מאומנות לוודא כי puncta הראוי edu מזוהה.
ויזואליזציה של mtDNA החדש המסונתז במהלך תסיסנית oogenesis מספקת הזדמנות לחקור כיצד שכפול mtDNA מוסדר בתנאים פיסיולוגיים ופתולוגיים, על ידי ביצוע הניסוי בזבובי נתון למגוון של הפרעות תרופתיות או גנטיות. במחקר קודם, assay ההתאגדות edu בוצעה בתוך הר תסיסנית מוטציה mtDNA: COI T300I 11. יתר על כן, לשבש את פוטנציאל הממברנה של המיטוכונדריה, השחלות טופלו בריכוזים שונים של FCCP uncoupler המיטוכונדריה או 2,4-dinitrophenol (DNP) לפני edu ההתאגדות. בהתאם למטרות ניסוייםומאפייני סמים, עשויים להיות מאומצות שיטות שונות עבור משלוח יעיל. עבור זבובים בוגרים, ניתן להציג תרופות כמו אדי (למשל, אתנול וקוקאין) 16,17 או תרופות ניתן להזריק לתוך הבטן, שם הוא מתמוסס במהירות בכל הגוף 18. הנוהג הנפוץ ביותר הוא שהתרופות מתווספות האוכל לטוס או נייר סינון סוכרוז / סמים רוויים. לדוגמא, המעכב של הרכבת microtubule, קולכיצין, היה נמאס זבובים במשך 2-3 ימים לפני לנתיחת שחלת 19. לפיכך, חשוב להעריך את שיטת משלוח סמים ולבחור ריכוזים מתאימים.
כדי להבטיח את ההדמיה המוצלחת של שכפול mtDNA בשחלות תסיסנית, מספר שלבים קריטיים חייבות להתבצע בזהירות. בראש ובראשונה, תוך שמירה על כדאיות ובריאות של השחלות במהלך דיסקציה ההתאגדות edu חיוני (שלבים 1 ו -2). המדיום תסיסנית של שניידר עם FBS צריך להיות מחומם ל RTלפני השימוש. אחד צריך לצמצם מגע ישיר בין תאי הביצה והכלים לנתח או טיפים פיפטה. השחלות צריכות להיות שקועות מתחת פתרונות בכל העת כדי למנוע התייבשות. טיפול לא נכון הרקמות יכולות להוביל להתעלף או לא אותות ניאון בקלות. במהלך שלב הרכבת הרקמות, יש להפריד ovarioles אחד מהשני והפרש בשקופית מיקרוסקופ. ודא תאי הביצה אינם מוערמים על גבי אחד את השני. שמנו לב כי תאי הביצה מעבר לשלב 14 מוצגים מעט התאגדות edu. בנוסף, בגלל הגודל הגדול, תאי הביצה בשלב מאוחר לעתים קרובות לגרום לתאי ביצת הצעיר השכנים להיות מחוץ לפוקוס. לכן מומלץ כי תאי ביצה בשלב מאוחר להיות מושלכים.
כאן אנו מספקים פרוטוקול מפורט תיוג משכפלים mtDNA בשחלות מבוגר תסיסנית. שיטה זו מאפשרת כימות פשוטה של שכפול mtDNA תחת הפרעות גנטיות תרופתיות שונות,ויהיה שימושי עבור לנתח מנגנוני biogenesis התפתחותי המיטוכונדריה וירושת mtDNA.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank K. Delaney for comments on the manuscript. This work was supported by the National, Heart, Lung, and Blood Institute (NHLBI) Intramural Program.
Materials
| Name | Company | Catalog Number | Comments |
| Schneider’s Drosophila medium | Invitrogen | 21720-024 | |
| FBS | Invitrogen | 10100-147 | |
| Pair of Dumont #5 Forceps | Fine Science Tools | 11252-20 | |
| Aphidicolin | Sigma | A0781 | Aliquot after dissolving in DMSO. Avoid repetitive thawing and freezing. Protect from light. May be used within 6 weeks after dissolving. |
| FCCP | Sigma | C2920 | |
| DMSO | Sigma | D2650 | |
| Paraformaldehyde, 16% EM grade | Electron Microscopy Sciences | 15710 | Formaldehyde is toxic; it should be handled in a fume hood with skin and eye protection. |
| PBS | KD Medical | RGF-3190 | |
| BSA | Sigma | A7030 | |
| Triton X-100 | Sigma | T9284 | |
| Click-iT EdU Alexa Fluor 488 Imaging Kit | Invitrogen | C10337 | EdU, CuSO4, Alexa Fluor 488 azide, EdU reaction buffer and Edu buffer additive are included |
| Mouse ATP synthase subunit α antibody, (15H4C4) | MitoSciences | Ab14748 | 1:1,000 dilution |
| Mouse Hts antibody (clone RC) | Developmental Studies Hybridoma Bank (DSHB) | hts RC | 1:1,000 dilution |
| Goat anti-mouse Alexa Fluor 568 secondary antibody | Invitrogen | A-11004 | 1:200 dilution |
| Vectashield mounting medium with DAPI | Vector Laboratories | H-1500 | |
| Glass coverslips, #1.5 22 mm x 22 mm | Fisher Scientific | 12-541-B | |
| Microscope slide | Fisher Scientific | 22-038-103 | |
| Nail polish | Elf | Many of the pigments used in nail polishes are fluorescent and leach into specimens. Only clear nail polish should be used. |
References
- Taylor, R. W., Turnbull, D. M. Mitochondrial DNA mutations in human disease. Nat Rev Genet. 6 (5), 389-402 (2005).
- Wallace, D. C., Chalkia, D. Mitochondrial DNA genetics and the heteroplasmy conundrum in evolution and disease. Cold Spring Harb Perspect Biol. 5 (11), a021220(2013).
- Spradling, A. C. The development of Drosophila melanogaster. , Cold Spring Harbor Lab. Press. (1993).
- Riechmann, V., Ephrussi, A. Axis formation during Drosophila oogenesis. Curr Opin Genet Dev. 11 (4), 374-383 (2001).
- Lin, H., Yue, L., Spradling, A. C. The Drosophila fusome, a germline-specific organelle, contains membrane skeletal proteins and functions in cyst formation. Development. 120 (4), 947-956 (1994).
- Cox, R. T., Spradling, A. C. A Balbiani body and the fusome mediate mitochondrial inheritance during Drosophila oogenesis. Development. 130 (8), 1579-1590 (2003).
- Davis, A. F., Clayton, D. A. In situ localization of mitochondrial DNA replication in intact mammalian cells. J Cell Biol. 135 (4), 883-893 (1996).
- Iborra, F. J., Kimura, H., Cook, P. R. The functional organization of mitochondrial genomes in human cells. BMC Biol. 2, (2004).
- Rakic, P. Neurogenesis in adult primate neocortex: an evaluation of the evidence. Nat Rev Neurosci. 3 (1), 65-71 (2002).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proc Natl Acad Sci U S A. 105 (7), 2415-2420 (2008).
- Hill, J. H., Chen, Z., Xu, H. Selective propagation of functional mitochondrial DNA during oogenesis restricts the transmission of a deleterious mitochondrial variant. Nat Genet. 46 (4), 389-392 (2014).
- Lentz, S. I., et al. Mitochondrial DNA (mtDNA) Biogenesis: Visualization and Duel Incorporation of BrdU and EdU Into Newly Synthesized mtDNA In Vitro. Journal of Histochemistry & Cytochemistry. 58 (2), 207-218 (2010).
- Tornoe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(i)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J Org Chem. 67 (9), 3057-3064 (2002).
- Horwitz, H. B., Holt, C. E. Specific inhibition by ethidium bromide of mitochondrial DNA synthesis in physarum polycephalum. J. Cell Biol. 49, 546-553 (1971).
- Huberman, J. A. New views of the biochemistry of eucaryotic DNA replication revealed by aphidicolin, an unusual inhibitor of DNA polymerase alpha. Cell. 23 (3), 647-648 (1981).
- McClung, C., Hirsh, J. Stereotypic behavioral responses to free-base cocaine and the development of behavioral sensitization in Drosophila. Curr Biol. 8 (2), 109-112 (1998).
- Moore, M. S., et al. Ethanol intoxication in Drosophila: Genetic and pharmacological evidence for regulation by the cAMP signaling pathway. Cell. 93 (6), 997-1007 (1998).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Gamma-aminobutyric acid B receptor 1 mediates behavior-impairing actions of alcohol in Drosophila: adult RNA interference and pharmacological evidence. Proc Natl Acad Sci U S A. 100 (9), 5485-5490 (2003).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell Tissue Res. 228 (1), 21-32 (1983).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved