A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تطبيقات تصنيع وتسليم المخدرات من النانوية الحرير
In This Article
Summary
النانوية ونظم تسليم المخدرات بأنها واعدة في الظهور لمجموعة واسعة من المؤشرات. هنا، نحن تصف طريقة بسيطة لكنها قوية لتصنيع الجسيمات النانوية الحرير باستخدام الهندسة العكسية الحرير دودة القز. هذه الجسيمات النانوية الحرير يمكن تحميلها بسهولة مع حمولة العلاجية واستكشاف في وقت لاحق لتطبيقات تسليم المخدرات.
Abstract
الحرير هو البوليمر الحيوي الواعد للتطبيقات الطبية والأدوية بسبب المتميز الميكانيكية خصائص، توافق مع الحياة والتحلل البيولوجي، وكذلك قدرتها على حماية وبعد الإفراج حمولتها ردا على الزناد. في حين الحرير يمكن صياغتها في أشكال مختلفة المادية، الجسيمات النانوية الحرير ونظم تسليم المخدرات بأنها واعدة في الظهور. لذلك، تغطي هذه المقالة الإجراءات لعكس شرانق الحرير الهندسة أن تسفر عن حل الحرير مجدد التي يمكن استخدامها لتوليد الجسيمات النانوية الحرير مستقرة. وتتميز هذه الجسيمات النانوية في وقت لاحق، المخدرات تحميل واستكشاف كنظام مضاد للسرطان تسليم المخدرات المحتملين. لفترة وجيزة، وعكس هندستها شرانق الحرير لأول مرة عن طريق إزالة الصمغ الشرانق، يليه حل الحرير، وتنظيف، لتسفر عن حل الحرير المائي. بعد ذلك، يتعرض الحل الحرير مجدد لnanoprecipitation لانتاج النانوية الحرير - طريقة بسيطة ولكنها قويةالذي يولد النانوية موحدة. تتميز النانوية الحرير وفقا لحجمها، وإمكانات زيتا، مورفولوجيا والاستقرار في الأوساط المائية، فضلا عن قدرتها على إيقاع حمولة العلاج الكيميائي وقتل خلايا سرطان الثدي البشرية. وعموما، فإن المنهجية المبينة غلة النانوية الحرير موحدة التي يمكن استكشافها بسهولة لعدد لا يحصى من التطبيقات، بما في ذلك استخدامهم لالنانوي المحتملين.
Introduction
وغالبا ما تستخدم أنظمة توصيل الدواء نانو الحجم للسيطرة على الافراج عن المخدرات وتقديم مجموعة متنوعة من الحمولات العلاجية - على سبيل المثال، والبروتينات، والببتيدات والصغيرة المخدرات الوزن الجزيئي - لاستهداف الخلايا والأنسجة. وغالبا ما يتم تضمين هذه الحمولات العلاجية في مختلف شركات الدواء الجزيئات، مثل الجسيمات الشحمية، والبوليمرات للذوبان في الماء (بما في ذلك dendrimers)، والمتناهية الصغر والنانوية 1. ويجري استكشاف النانوية (عادة في نطاق حجم 1 نانومتر إلى 1000 نانومتر) على نطاق واسع ناقلات المخدرات المحتملة، ولا سيما بالنسبة للسرطان تسليم المخدرات 2. وقد حفزت تطبيق ناجح لAbraxane (120 النانوية على أساس الزلال الحجم نانومتر محملة باكليتاكسيل) في الممارسة السريرية الروتينية 3 الميدان، بحيث العديد من الجسيمات النانوية لتسليم المخدرات تدخل الآن التجارب السريرية 4. تظهر الأورام الصلبة عموما الفقراء التصريف اللمفاوي ويكون الأوعية الدموية الراشحة وهو ما يعني أن نanoparticles تصل إلى 200 نانومتر سوف تكون مستهدفة بشكل سلبي لهذه الأورام بعد الحقن الوريدي. وتسمى هذه الظاهرة التي تستهدف السلبي نفاذية تعزيز والاستبقاء (EPR) تأثير وذكرت لأول مرة في عام 1986 5. تأثير EPR يمكن أن يؤدي إلى زيادة 50- إلى 100 أضعاف في تركيزات المخدرات داخل المكروية ورم لجرعة دواء معين عندما يتم تسليم حمولة المخدرات باستخدام نهج الناقل المخدرات الجزيئات وليس خال من المخدرات دون الناقل. النانوية محملة المخدرات المصممة للسرطان تسليم المخدرات لديهم للوصول إلى المكروية الورم وغالبا ما يجب أن تدخل حجرة داخل الخلايا المحددة، عادة عن طريق امتصاص التقامي، لالمخدرات لتحقيق التأثير العلاجي المطلوب في 3. النانوية المصممة لتسليم المخدرات داخل الخلايا تستغل الإلتقام كبوابة إلى الخلية وكذلك طريقا للتغلب على آليات المقاومة للأدوية. وغالبا ما تكون مصممة الافراج المخدرات من الجسيمات النانوية خصيصا لسccur في الجسيمات الحالة (أي lysosomotropic تسليم المخدرات) 6 حيث استجابة درجة الحموضة الناقل جسيمات متناهية الصغر (الليزوزومية الرقم الهيدروجيني حوالي 4.5) يمكن أن تكون بمثابة الزناد لإطلاق سراح المخدرات أو الليزوزومية الانزيمات التي تحرير حمولة من الناقل 7.
العديد من فئات مختلفة من المواد يمكن استخدامها لتوليد الجسيمات النانوية (على سبيل المثال، والمعادن والعديد من المواد العضوية وغير العضوية). ومع ذلك، البوليمرات الحيوية ومواد جذابة كما لما لها من توافق مع الحياة المعروفة، التحلل البيولوجي وسمية منخفضة 8 في الظهور. ويجري استكشاف العديد من البوليمرات الحيوية، بما في ذلك الزلال، الجينات، الشيتوزان والحرير. من هذه، برزت الحرير كمنافس واعدة للتنمية في نظم تسليم المخدرات 9. ويتم إنتاج الحرير من أنواع مختلفة من قبل عدد من المفصليات، بما في ذلك العناكب (على سبيل المثال، clavipes Nephila) ودودة القز (على سبيل المثال، دودة القز). ويستخدم الحرير دودة القز أكثر بكثير EXTENsively من حرير العنكبوت لدودة القز والمستأنسة تماما، وبالتالي الحرير لها يمثل مادة انطلاق استنساخه. دودة القز الحرير هو إدارة الغذاء والدواء (FDA) وافقت المواد للاستخدام البشري، وخاصة كمادة خياطة. أنه يحتوي على سجل السلامة قوية في البشر وكما هو معروف أن تتحلل في الجسم الحي 10. الملف الشخصى تدهور الحرير يمكن أن يكون ضبطها بما يتراوح بين ساعة (انخفاض البلورية الحرير) لمدة 12 شهرا أو أكثر (عالية البلورية الحرير). نواتج تحلل الحرير غير سامة واستقلاب في الجسم 10. هيكل الحرير يضفي القدرة على ربط الصغيرة المركبات ذات الوزن الجزيئي والأدوية البروتينية الجزيئات 11، مما يجعلها مادة جيدة لإطلاق سراح المخدرات التي تسيطر عليها. الأدوية البروتينية (على سبيل المثال، والأجسام المضادة) عرضة لتمسخ، والتجميع، انشقاق بروتين وتطهير من قبل النظام المناعي. ومع ذلك، والحرير استقرار البروتينات العلاجية ويرجع ذلك إلى قدرة التخزين المؤقت لإعادة nanocrystalline لهااملناطق وقدرته على تكييف محتوى الماء في المقياس النانوي 11. هذه الميزات الفريدة توفر الحماية المادية والحد من التنقل حمولة 11 وعادة لا ينظر مع البوليمرات (الحيوية) الأخرى. العديد من أجهزة التوصيل المضادة للسرطان المخدرات، على سبيل المثال الهلاميات المائية القائمة على الحرير 12 والأفلام 13-15 والجسيمات النانوية 16،17، والآن وضعت لاستغلال هذه الميزات (إعادة النظر في المراجع 18،19)
هنا، تميزت النانوية الحرير من خلال تحديد حجمها ورسوم على إطار زمني ممتد. دوكسوروبيسين، وهو دواء مضاد للسرطان ذات الصلة سريريا، وكان يستخدم كدواء نموذج للدراسات تحميل المخدرات والسمية الخلوية في الخلايا السلبية ثلاثية الثدي البشري السرطان الذين يعالجون النانوية الحرير محملة المخدرات.
Protocol
1. إعداد الحل الحرير هندستها العكسية من دودة القز الشرانق
ملاحظة: تعتمد هذه المنهجية على البروتوكولات المذكورة في أماكن أخرى 12،27.
- قطع 5 غرام من الشرانق المجففة مع مقص إلى 5 مم × 5 مم قطعة. إزالة أي طبقات المتسخة.
- وزن من 4.24 غرام من كربونات الصوديوم وإضافة هذا بعناية إلى 2 لتر من الماء المغلي المقطر.
ملاحظة: هذا ينتج حلا كربونات الصوديوم 0.02 M. - تضاف قطع قطع شرنقة إلى الغليان حل كربونات الصوديوم وتغلى لمدة 60 دقيقة إلى degum ألياف الحرير. تحريك الحرير في بعض الأحيان لضمان تجهيز العينات متجانسة.
- إزالة الحرير degummed وتغسل مع 1 لتر من الماء المقطر لمدة 20 دقيقة. كرر الخطوة الغسيل 3 مرات على الأقل.
- إزالة الحرير غسلها والضغط عليها بشكل جيد لإزالة السائل الزائد ثم فك / سحب الحرير باليد. وضع الحرير غير مقيدة في غطاء الدخان في الهواء بين عشية وضحاها الجافة. هذا ينتج عادة 3.6 غرام من الصورة degummedالألياف أمثاله.
- في اليوم التالي، تزن من 5 غرام ألياف الحرير degummed المجفف في الهواء وحزمة الحرير بإحكام في الجزء السفلي من دورق 50 مل.
- إعداد 9.3 حل M LiBr جديدة. حل ألياف الحرير في LiBr باستخدام 1 غرام الحرير إلى نسبة 4 مل LiBr. تغطية عينة LiBr الحرير مع رقائق الألومنيوم لمنع التبخر والسماح الحرير لتذوب تماما عند 60 درجة مئوية. هذه الخطوة يستغرق فترة تصل إلى 4 ساعات، وساعدت من قبل التحريك من حين لآخر.
- الرطب كاسيت غسيل الكلى (الوزن الجزيئي قطع من 3500 دا) في الماء لمدة 5 دقائق. ضخ 15 مل الحل LiBr الحرير في غسيل الكلى كاسيت 15 مل واستخدام إبرة وحقنة لإزالة أي فقاعات الهواء.
- Dialyze ضد 1 لتر من الماء المقطر وتغيير الماء في 1 و 3 و 6 ساعات (أي 3 تغييرات في اليوم الأول) ومرة أخرى في صباح اليوم التالي والمساء (أي 2 التغيرات في اليوم الثاني)، ومرة أخرى في في صباح اليوم التالي (أي 1 التغير في اليوم الثالث).
- جمع soluti الحريرعلى من كاسيت لغسيل الكلى وأجهزة الطرد المركزي الحل لمدة 20 دقيقة في 5 درجة مئوية في 9500 ز س. استرداد طاف وتكرار هذه العملية مرتين الطرد المركزي أكثر.
- تحديد وزن زورق وزنها فارغة (W1) وإضافة 1 مل من محلول الحرير. تسجيل الوزن مرة أخرى (W2) ثم تجف العينة من خلال ترك القارب وزنها في 60 درجة مئوية خلال الليل. المقبل، وتحديد مجموع الوزن الجاف (W3) (الحرير المجفف وزنها قارب). تركيز على حل الحرير (ث / ت) هو:٪ = (W3-W1 / W2-W1) × 100.
2. إعداد النانوية الحرير من الحل الحرير عكس الهندسة
- إضافة 5٪ (ث / ت) حل الحرير قطرة قطرة إلى الأسيتون مع الحفاظ على> 75٪ (ت / ت) حل الأسيتون. على سبيل المثال، إضافة 9 مل من 5٪ (ث / ت) قطرة قطرة حل الحرير (10 ميكرولتر / انخفاض بمعدل 50 قطرات / دقيقة) إلى 34 مل الأسيتون.
- أجهزة الطرد المركزي يعجل في 48000 x ج لمدة 2 ساعة في 4 درجات مئوية.
- نضح طاف و resuspend بيليتي في الماء المقطر عن طريق طرد أولا بيليه مع ملعقة ثم إضافة 20 مل من الماء المقطر. استخدام نصائح الماصة لإزالة بيليه من الملعقة. بعد vortexing لمدة 20 ثانية تليها دورتين صوتنة باستخدام مسبار الموجات فوق الصوتية بنسبة 30٪ السعة لمدة 30 ثانية، أعلى حتى أنبوب الطرد المركزي لقدرة بالماء المقطر.
- كرر الطرد المركزي وخطوة إعادة تعليق مرتين على الأقل.
- Resuspend وبيليه في 6 مل من الماء المقطر، كما هو مفصل في 2.3 وتخزينها في 4 درجات مئوية حتى الاستخدام. لدراسات زراعة الخلايا، يمكن أن الأسهم جسيمات متناهية الصغر الحرير يكون غاما المشع 17.
3. تحديد الحرير الجسيمات النانوية تركيز
- النانوية الحرير أجهزة الطرد المركزي في 48000 x ج لمدة 2 ساعة في 4 درجات مئوية.
- جمع كل الجسيمات النانوية في 3 مل من الماء المقطر، تليها دورتين صوتنة بنسبة 30٪ السعة لمدة 30 ثانية.
- تقسيم الأسهم 3 مل من الجسيمات النانوية الحرير إلى 2 مل و 1 مل الكثير ونقل إلى العلاقات العامةالبريد الإلكتروني وزن 2 مل أنابيب. تسجيل الوزن الكلي للعينة 2 مل. تخزين 1 مل الكثير في 4 درجات مئوية حتى الاستخدام. وسوف تستخدم هذه العينة 1 مل لتوليد منحنى المعايرة.
- التقط تجميد ثم يجفد 2 مل جسيمات متناهية الصغر الحرير الكثير في مجفف تجميد بين عشية وضحاها. بعد تجميد التجفيف، reweigh أنبوب مل 2 وحساب كمية من الجسيمات النانوية الحرير (ملغ) التي كانت موجودة أصلا في العينة 2 مل.
- تمييع 1 مل الأسهم جسيمات متناهية الصغر الحرير مع الماء المقطر لتوليد منحنى المعايرة 5 نقاط (،04-7 ملغ / مل). تأكد من أن عينات لا يتجاوز الحد الأقصى الامتصاصية.
- تحديد الامتصاصية من كل تخفيف قياسي عند 600 نانومتر. من الأفضل القيام بذلك باستخدام الإعداد لوحة 96-جيدا. مؤامرة الامتصاصية مقابل التركيز (ملغ / مل) لمنحنى القياسية. ثم استخدام هذا المنحنى القياسي بشكل روتيني لتحديد تركيز الجسيمات النانوية الحرير في التعليق.
4. إعداد النانوية الحرير تحميل دوكسوروبيسين-
- إعداد الحل دوكسوروبيسين
- حل 1.2 ملغ من حمض الهيدروكلوريك دوكسوروبيسين في 8 مل من الماء المقطر.
- ما يصل إلى 10 مل بالماء المقطر لانتاج مخزون العمل من 116 ميكروغرام / مل (0.2 مكرومول / مل).
- إعداد النانوية الحرير تحميل دوكسوروبيسين-
- مزيج 2 مل من 0.2 مكرومول / حل دوكسوروبيسين مل مع 200 ميكرولتر من 10، 30 أو 50 ملغ / مل من الجسيمات النانوية الحرير في أنبوب 2 مل.
- احتضان تعليق الحرير دوكسوروبيسين في درجة حرارة الغرفة (25 درجة مئوية) بين عشية وضحاها على خلاط الدورية.
- بعد ذلك، أجهزة الطرد المركزي تعليق الحرير دوكسوروبيسين في 194000 x ج لمدة 30 دقيقة. غسل النانوية الحرير محملة دوكسوروبيسين مع الماء المقطر وكرر هذا الإجراء مرتين أكثر.
- تجمع طاف ولاحظ الحجم الكلي (يتم استخدام هذه العينة لتحديد كفاءة التغليف).
- Resuspend والجسيمات النانوية الحرير محملة دوكسوروبيسين في الماء المقطر، بعيدا عن الضوء وتخزينها في 4 درجة مئوية الامم المتحدةسمسم الاستخدام.
- تقرير من الكفاءة تغليف وتحميل المخدرات
- الماصة 200 ميكرولتر من طاف من الخطوة 4.2.4 الى وحة microtiter السوداء.
- استخدام قارئ صفيحة مضان لقياس مضان المرتبطة دوكسوروبيسين في وضع مضخم ثابت.
- تعيين الطول الموجي الإثارة إلى 485 الطول الموجي نانومتر، والانبعاثات إلى 590 نانومتر، وتسجيل القيم مضان.
- توليد منحنى دوكسوروبيسين المعايرة. يتم الحصول على ضمان قياسات مع إعدادات مماثلة أداة (أي مع وضع مضخم الثابتة). باستخدام منحنى المعايرة، وحساب تركيز دوكسوروبيسين في طاف جنبا إلى جنب. كرر هذا القياس في ثلاث تجارب مستقلة.
- استخدام المعادلة (1) لتحديد كفاءة التغليف:
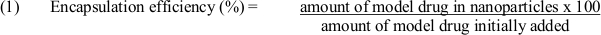
5. توصيف نانو الحريرالجسيمات
- تقييم حجم وزيتا إمكانات طازجة ومخزنة النانوية الحرير.
- النانوية الحرير مخزن في الماء المقطر عند 4 درجة مئوية و 25 درجة مئوية.
- قياس حجم وزيتا إمكانات النانوية الحرير في أيام 0، 14 و 28 باستخدام ديناميكية تشتت الضوء (DLS). تعيين معاملات الانكسار إلى 1.33 لالماء المقطر و1.60 للبروتين 17. حساب أحجام الجسيمات مع برنامج واجهة المستخدم.
- تقييم المورفولوجية من النانوية الحرير من قبل المجهر الإلكتروني (SEM).
- وضع قرص لاصق الكربون على لكعب ووزارة شؤون المرأة وفي وقت لاحق إرفاق رقاقة السيليكون.
- تمييع النانوية الحرير إلى تركيز 1 ملغ / مل. ماصة 10 ميكرولتر من العينة على رقاقة السيليكون، وتجميد العينة في -80 درجة مئوية، ويجفد بين عشية وضحاها باستخدام نظام التجميد والتجفيف وفقا لتعليمات الشركة الصانعة.
- معطف العينة مع الذهب طبقة تصل إلى 20 نانومتر سميكةباستخدام منخفضة فراغ تفل المغطى.
ملاحظة: تختلف إعدادات صك بين النماذج. النموذج المستخدم هنا هو مؤتمتة بالكامل وتعمل عن طريق سمك فقط. - عينات صورة مع الميكروسكوب الالكتروني في 5 كيلو فولت والتكبير 40،000 أضعاف.
6. في المختبر السمسة السيطرة وتحميل دوكسوروبيسين-النانوية الحرير
- بقاء الخلية بعد التعرض لالنانوية الحرير.
- ثقافة MDA-MB-231 الخلايا في RPMI 1640 مع 10٪ ت / ت FBS. لوحة الخلايا في نسيج الثقافة تعامل البوليسترين واحتضان في ترطيب 5٪ CO 2 الغلاف الجوي عند 37 درجة مئوية. ثقافة فرعية بشكل روتيني في 80٪ التقاء كل 2-3 أيام.
- لوحة MDA-MB-231 الخلايا في مناطق ذات كثافة من 2 × 10 4 خلية / سم 2 في لوحات 96-جيدا. السماح للخلايا لاسترداد بين عشية وضحاها.
- إضافة (ط) 0،001-1 ميكروغرام دوكسوروبيسين إنتشاري بحرية، (ب) 0،001-0،5 النانوية الحرير ملغ و 0.1 ملغ النانوية الحريرمحملة 0،001-1 دوكسوروبيسين ميكروغرام في لوحات 96-جيدا (الحجم النهائي 100 ميكرولتر لكل بئر).
- تحديد بقاء الخلية والنصف أقصى تركيز مثبط (IC 50) بإضافة (3- (4،5-dimethylthiazol-2-YL) بروميد -2،5-diphenyltetrazolium (MTT 5 ملغ / مل في برنامج تلفزيوني) في 72 ساعة. احتضان لمدة 5 ساعة، واستنزاف بعناية الآبار مع ماصة وحل formazan مع 100 ميكرولتر من ثنائي ميثيل سلفوكسيد. قياس الامتصاصية في 560 نانومتر. كرر هذا القياس في ثلاث تجارب مستقلة.
ملاحظة: القيم الامتصاصية الضوابط غير المعالجة بمثابة القيمة المرجعية لبقاء الخلية 100٪.
- SEM من الخلايا المعرضة لالنانوية الحرير.
- البذور MDA-MB-231 الخلايا على coverslips الزجاج معقمة في مناطق ذات كثافة من 2 × 10 4 خلية / سم 2. السماح للخلايا لاسترداد بين عشية وضحاها. كشف الخلايا لظروف العلاج المطلوب لمدة 72 ساعة.
- إصلاح الخلايا مع 2٪ غلوتارالدهيد ت / ت في برنامج تلفزيوني لمدة 30 دقيقة، ويغسل مع ديالمياه هدأ مرتين، يذوى مع سلسلة الإيثانول، والنقطة الحرجة تجفيف العينات، كما هو مفصل في أماكن أخرى 28.
- تفل معطف العينات مع الذهب طبقة تصل إلى 20 نانومتر سميكة باستخدام منخفضة فراغ تفل المغطى.
ملاحظة: تختلف إعدادات صك بين النماذج. النموذج المستخدم هنا هو مؤتمتة بالكامل وتعمل عن طريق سمك فقط. - صورة العينات بواسطة SEM باستخدام تسارع الإلكترون من 5 كيلو فولت والتكبير 700 أضعاف.
النتائج
وقد تم تحليل البيانات إحصائيا كما هو موضح سابقا (17). تم استخدام اختبار t للتلاميذ العينة أزواج وتحليل التباين الأحادي (ANOVA)، يليه مقارنة بونفيروني ومتعددة اللاحق اختبار لعينات متعددة. علامة النجمة يدل دلالة إحصائية على النحو التالي: * P <0.05 و** P &...
Discussion
هي الأساليب المختلفة المتاحة لإنتاج الجسيمات النانوية الحرير، بما في ذلك الكحول البولي فينيل مزج 20، رذاذ تجفيف 21، التمليح من 22، microdot الشعرية طباعة 23، CO فوق الحرجة 2 هطول الأمطار 24 و nanoprecipitation 16،25 (إعادة النظر في المرجع 26).
Disclosures
The authors have nothing to disclose.
Acknowledgements
This research was supported by a Marie Curie FP7 Career Integration Grant 334134 within the seventh European Union Framework Program.
Materials
| Name | Company | Catalog Number | Comments |
| Acetone | VWR International, Radnor, PA, USA | 20066.33 | |
| Automated Critical Point Dryer | Leica Microsystems, Wetzlar, Germany | EM CPD300 | |
| Balancing | Mettler Toledo, Greifensee, Switzerland | NewClassic MS | |
| Black polystyrene microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3991 | |
| Capillary cell (DTS 1070) | Malvern Instrument, Worcestershire, UK | DTS107 | |
| Carbon adhesive disc | Agar Scientific, Essex, UK | G3347N | |
| Centrifuge | Hermle Labortechnik, Wehingen, Germany | Z323K | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Avanti J-E, Rotor: J20 | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Optima L-70K, Rotor: 50.2 Ti, Adaptor 303392 | |
| Coater, low vacuum | Leica Microsystems, Wetzlar, Germany | EM ACE200 | |
| Cuvettes, polystyrene, disposable | Fisher Scientific, Waltham, MA, USA | FB55147 | |
| Doxorubixin | LC Laboratories, Boston, MA, USA | D4000 | |
| Electronic pipetting, Easypet | Eppendorf, Hamburg, Germany | N/A | |
| FE-SEM | Hitachi High-Technologies, Krefeld, Germany | SU6600 | |
| Fetal Bovine Serum | Thermo Scientific, Waltham, MA, USA | 16000-044 | |
| Freeze dryer | Martin Christ, Osterode, Germany | Epsilon 2-4 | |
| Heat inactivated Bombyx mori silk cocoons | Tajima Shoji, Kanagawa, Japan | N/A | |
| Hotplate with Stirrer | Bibby Scientific, Stanffordshire, UK | US 152 | |
| Incubator | Memmert, Schwabach, Germany | INB 200 | |
| Insulin, human recombinant, zinc solution | Thermo Scientific, Waltham, MA, USA | 12585-014 | |
| Lithium bromide | Acros Organics, Geel, Belgium | AC199870025 | |
| MDA-MB-231 | ATCC, Manassas, VA, U.S.A | N/A | |
| Micropipette and tips | Eppendorf, Hamburg, Germany | N/A | |
| Microplate Reader | Molecular devices, Sunnyvale, CA, USA | SpectraMax M5 | |
| Oak Ridge High-Speed Centrifuge Tubes, 50 ml | Thermo Scientific, Waltham, MA, USA | N/A | |
| Open-Top Thickwall Polycarbonate tube, 4 ml | Beckman Coulter, Brea, CA, USA | 355645 | |
| Penicilin/streptomycin | Thermo Scientific, Waltham, MA, USA | 15140-122 | |
| RPMI medium | Thermo Scientific, Waltham, MA, USA | 11875-093 | |
| Serological pipettes, 5 ml | Sigma-Aldrich, St. Louis, MO, USA | ||
| Silicon wafers | Agar Scientific, Essex, UK | G3391 | |
| Slide-A-Lyzer Dialysis cassettes, 3.5K MWCO, 15 ml | Thermo Scientific, Waltham, MA, USA | 87724 | |
| Sodium carbonate anhydrous | Fisher Scientific, Waltham, MA, USA | S/2840/62 | |
| Specimen stubs for SEM | Agar Scientific, Essex, UK | G301 | |
| Ultrasonic homogenizer | Bandelin, Berlin, Germany | Sonoplus HD 2070 | |
| UV transparent microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3635 | |
| Vortex | IKA, Staufen, Germany | Genius 3 | |
| Zetasizer | Malvern Instrument, Worcestershire, UK | Nano ZS | |
| Zetasizer Software version 7.11 | DLS software | ||
| Micro Modulyo | Thermo Fisher | 230 | Freeze drying system |
References
- Haley, B., Frenkel, E. Nanoparticles for drug delivery in cancer treatment. Urol. Oncol. 26 (1), 57-64 (2008).
- Sun, T., Zhang, Y. S., Pang, B., Hyun, D. C., Yang, M., Xia, Y. Engineered nanoparticles for drug delivery in cancer therapy. Angew. Chem. Int. Ed. 53 (46), 12320-12364 (2014).
- Davis, M. E., Chen, Z. G., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nat. Rev. Drug Discov. 7 (9), 771-782 (2008).
- Sheridan, C. Proof of concept for next-generation nanoparticle drugs in humans. Nature Biotechnol. 30 (6), 471-473 (2012).
- Matsumura, Y., Hitoshi, M. A New Concept for Macromolecular Therapeutics in Cancer Chemotherapy: Mechanism of Tumoritropic Accumulation of Proteins and the Antitumor Agent Smancs. Cancer Res. 46, 6387 (1986).
- De Duve, C., De Barsy, T., Poole, B., Trouet, A., Tulkens, P., Van Hoof, F. Lysosomotropic agents. Biochem. Pharmacol. 23 (18), 2495-2531 (1974).
- Duncan, R., Richardson, S. C. W. Endocytosis and intracellular trafficking as gateways for nanomedicine delivery: opportunities and challenges. Mol. Pharm. 9 (9), 2380-2402 (2012).
- Vishakha, K., Kishor, B., Sudha, R. Natural Polymers - A Comprehensive Review. Int. J. Pharm. Biomed. Res. 3 (4), 1597-1613 (2012).
- Pritchard, E. M., Kaplan, D. L. Silk fibroin biomaterials for controlled release drug delivery. Expert. Opin. Drug Del. 8 (6), 797-811 (2011).
- Thurber, A. E., Omenetto, F. G., Kaplan, D. L. In vivo bioresponses to silk proteins. Biomaterials. 71, 145-157 (2015).
- Pritchard, E. M., Dennis, P. B., Omenetto, F., Naik, R. R., Kaplan, D. L. Physical and chemical aspects of stabilization of compounds in silk. Biopolymers. 97 (6), 479-498 (2012).
- Seib, F. P., Pritchard, E. M., Kaplan, D. L. Self-Assembling Doxorubicin Silk Hydrogels for the Focal Treatment of Primary Breast. Adv. Funct. Mater. 23 (1), 58-65 (2013).
- Seib, F. P., Kaplan, D. L. Doxorubicin-loaded silk films: drug-silk interactions and in vivo performance in human orthotopic breast cancer. Biomaterials. 33 (33), 8442-8450 (2012).
- Seib, F. P., Coburn, J., et al. Focal therapy of neuroblastoma using silk films to deliver kinase and chemotherapeutic agents in vivo. Acta. Biomater. 20, 32-38 (2015).
- Coburn, J. M., Na, E., Kaplan, D. L. Modulation of vincristine and doxorubicin binding and release from silk films. J. Control. Release. 220, 229-238 (2015).
- Seib, F. P., Jones, G. T., Rnjak-Kovacina, J., Lin, Y., Kaplan, D. L. pH-dependent anticancer drug release from silk nanoparticles. Adv. Healthc. Mater. 2 (12), 1606-1611 (2013).
- Wongpinyochit, T., Uhlmann, P., Urquhart, A. J., Seib, F. P. PEGylated Silk Nanoparticles for Anticancer Drug Delivery. Biomacromolecules. 16 (11), 3712-3722 (2015).
- Seib, F. P., Kaplan, D. L. Silk for Drug Delivery Applications: Opportunities and Challenges. Isr. J. Chem. 53 (9-10), 1-12 (2013).
- Yucel, T., Lovett, M. L., Kaplan, D. L. Silk-based biomaterials for sustained drug delivery. J. Control. Release. 190, 381-397 (2014).
- Wang, X., Yucel, T., Lu, Q., Hu, X., Kaplan, D. L. Silk nanospheres and microspheres from silk/pva blend films for drug delivery. Biomaterials. 31 (6), 1025-1035 (2010).
- Qu, J., Wang, L., Hu, Y., You, R., Li, M. Preparation of Silk Fibroin Microspheres and Its Cytocompatibility. J. Biomater. Nanobiotechnol. 4, 84-90 (2013).
- Lammel, A., Hu, X., Park, S., Kaplan, D., Scheibel, T. Controlling silk fibroin particle features for drug delivery. Biomaterials. 31 (16), 4583-4591 (2010).
- Gupta, V., Aseh, A., Rìos, C. N., Aggarwal, B. B., Mathur, A. B. Fabrication and characterization of silk fibroin-derived curcumin nanoparticles for cancer therapy. Int. J. Nanomedicine. 4, 115-122 (2009).
- Zhao, Z., et al. Generation of silk fibroin nanoparticles via solution-enhanced dispersion by supercritical CO2. Ind. Eng. Chem. Res. 52 (10), 3752-3761 (2013).
- Tudora, M., Zaharia, C., Stancu, I. Natural silk Fibroin micro-and nanoparticles with potential uses in drug delivery systems. U.P.B. Sci. Bull., Series B. 75 (1), 43-52 (2013).
- Zhao, Z., Li, Y., Xie, M. B. Silk Fibroin-Based Nanoparticles for Drug Delivery. Int. J. Mol. Sci. 16 (3), 4880-4903 (2015).
- Rockwood, D., Preda, R., Yücel, T. Materials fabrication from Bombyx mori silk fibroin. Nat. Protoc. 6 (10), 1-43 (2011).
- Seib, F. P., Müller, K., Franke, M., Grimmer, M., Bornhäuser, M., Werner, C. Engineered extracellular matrices modulate the expression profile and feeder properties of bone marrow-derived human multipotent mesenchymal stromal cells. Tissue. Eng. Part A. 15 (10), 3161-3171 (2009).
- Lai, P., Daear, W., Löbenberg, R., Prenner, E. J. Overview of the preparation of organic polymeric nanoparticles for drug delivery based on gelatine, chitosan, poly(d,l-lactide-co-glycolic acid) and polyalkylcyanoacrylate. Colloids Surf., B, Biointerfaces. 118, 154-163 (2014).
- Subia, B., Kundu, S. C. Drug loading and release on tumor cells using silk fibroin-albumin nanoparticles as carriers. Nanotechnology. 24 (3), 035103 (2013).
- Zhang, Y. Q., Shen, W. D., Xiang, R. L., Zhuge, L. J., Gao, W. J., Wang, W. B. Formation of silk fibroin nanoparticles in water-miscible organic solvent and their characterization. J. Nanopart. Res. 9 (5), 885-900 (2006).
- Jin, H. J., Kaplan, D. L. Mechanism of silk processing in insects and spiders. Nature. 424 (6952), 1057-1061 (2003).
- Yhr Bae, ., Park, K. Targeted drug delivery to tumors: myths, reality and possibility. J. Control. Release. 153 (3), 198-205 (2011).
- Lammel, A., Schwab, M., Hofer, M., Winter, G., Scheibel, T. Recombinant spider silk particles as drug delivery vehicles. Biomaterials. 32 (8), 2233-2240 (2011).
- Holliday, D. L., Speirs, V. Choosing the right cell line for breast cancer research. Breast. Cancer. Res. 13, 215 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved