Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İpek Nanopartiküller imalatı ve İlaç Dağıtım Uygulamaları
Bu Makalede
Özet
Nanopartiküller endikasyonlar geniş bir aralığı için ümit vaadeden bir ilaç sağlama sistemlerini ortaya çıkmaktadır. Burada, ters mühendislik ipek böceği ipek kullanılarak ipek nanopartiküller üretmek için basit ama güçlü bir yöntem açıklanmaktadır. Bu ipek nanopartiküller terapötik bir yük ile yüklenen ve daha sonra ilaç dağıtım uygulamaları için keşfedilebilir.
Özet
İpek nedeniyle üstün mekanik özellikleri, biyouyumluluk ve biyobozunurluk yanı sıra bir tetikleyici cevaben korumak ve daha sonra onun yükü bırakmak için yeteneği biyomedikal ve ilaç uygulamaları için umut verici bir biyopolimerdir. İpek çeşitli malzeme biçimleri halinde formüle edilebilir olsa da, ipek nanopartiküller olarak ümit vaadeden bir ilaç sağlama sistemlerini ortaya çıkmaktadır. Bu nedenle, bu makale, stabil ipek nano-tanecikleri oluşturmak için kullanılabilen bir yeniden ipek bir solüsyon elde ters mühendislik Koza işlemleri kapsar. Bu nanopartiküller, daha sonra karakterize edilir, ilaç yüklü ve potansiyel bir anti-kanser ilaç verme sistemi olarak incelenmiştir. Kısaca, ipek kozası ters, koza gam giderme ilk tasarlanmış ipek çözülme takip ve sulu ipek solüsyon elde, temizlemek edilir. Sonraki, rejenere ipek çözüm ipek nanopartiküller elde etmek nanoprecipitation tabi tutulur - basit ama güçlü bir yöntemBu üniforma nanopartiküller üretir. İpek nanopartiküller, boyut, zeta potansiyeli, sulu ortam içinde morfolojisi ve dayanıklılığı gibi bir kemoterapötik yükü tuttuğu ve insan göğüs kanser hücrelerini öldürmek için kabiliyetlerine göre karakterize edilir. Genel olarak, açıklanan metodoloji potansiyel nanotıpta olarak kullanımları da dahil olmak üzere kolayca uygulamalar sayısız için keşfedilmeyi olabilir üniforma ipek nanopartiküller, verir.
Giriş
örneğin proteinler, peptidler ve küçük molekül ağırlıklı ilaçların - - hücreleri ve dokuları hedef nano-boyutlu ilaç verme sistemleri genellikle ilaç salımını kontrol etmek ve tedavi yükleri çeşitli bir dizi elde etmek için kullanılabilir. Bu terapötik yükleri genellikle lipozomlar, (dendrimerler de dahil olmak üzere) suda çözülebilen polimerler, mikro ve nanopartiküller 1 gibi çeşitli makromoleküler ilaç taşıyıcıları içine dahil edilmiştir. (Tipik olarak 1 nm ile 1000 arasında bir boyut aralığında) Nanopartiküller yaygın olarak, özellikle anti-kanser ilaç verme 2, potansiyel ilaç taşıyıcıları olarak araştırılmaktadır. Ilaç dağıtım için çok daha fazla nanopartiküller artık klinik denemeler 4 giriyoruz böylece rutin klinik uygulamaya 3 içine Abraxane başarılı tanıtım (120 nm büyüklüğünde albümin tabanlı nanopartiküller paklitaksel ile yüklü), alan katalize etmiştir. Solid tümörler genellikle o n anlamına gelir kötü lenfatik drenajı göstermek ve sızan kan damarları var200 nm ye kadar anoparticles pasif intravenöz uygulamayı takiben bu tümörler hedeflenecektir. Bu pasif hedef olay gelişmiş geçirgenlik ve tutma (EPR) etkisi olarak adlandırılır ve ilk olarak 1986 5 bildirilmiştir. EPR etkisi, belirli bir ilaç dozu için ne zaman tümör mikro olan ilaç konsantrasyonlarında bir 50- ila 100-kat artışa yol açabilir ilaç yük taşıyıcı olmadan bir makromoleküler ilaç taşıyıcı yaklaşımı yerine ücretsiz ilaç kullanılarak teslim edilir. Anti-kanser ilaç verilmesi için tasarlanan ilaç yüklü nano parçacıklar tümör mikro ulaşmak ve ilacın arzu edilen terapötik etkiyi elde etmek için 3 Çoğu zaman, genellikle, endositik alımı ile, belirli bir hücre içi bölüm girmelidir. hücre içi ilaç verilmesi için tasarlanmış nanopartiküller hücre içine ağ geçidi yanı sıra ilaç direnç mekanizmalarını aşmak için bir yol olarak endositoz istifade eder. nanopartiküller gelen ilaç salım sık sık özellikle o şekilde tasarlanmıştırnanoparçacık taşıyıcı pH yanıt (lizozomal pH yaklaşık 4.5) taşıyıcı 7'den yükü kurtarmak ilaç salım veya lizozomal enzimler için tetikleyici olarak hizmet verebilir lizozomlarında CCur (yani, lysosomotropic ilaç dağıtım) 6.
Malzemelerinin çoğu farklı sınıflar nano-tanecikleri (örneğin, metal ve bir çok organik ve inorganik maddelerin) oluşturmak için kullanılabilir. Ancak, biopolimerler nedeniyle bilinen biyouyumluluk, biyobozunurluk ve düşük toksisite 8 çekici malzemeler ortaya çıkmaktadır. Birçok biyopolimerler albümin, aljinat, kitosan ve ipek gibi araştırılmaktadır. Bunlardan, ipek ilaç verme sistemleri 9'a gelişmesi için ümit veren bir rakip olarak ortaya çıkmıştır. Çeşitli ipek (örneğin, Bombyx mori) (ör Nephila clavipes) örümcekler ve ipek böcekleri içeren eklembacaklılara, bir dizi ile üretilir. Ipek böceği ipek çok daha ilavelere kullanılanğı örümcek ipekten daha ipekböceği tamamen evcilleştirilmiş çünkü ve ipek böylece tekrarlanabilir başlangıç malzemesinin temsil eder. İpekböceği ipek bir Gıda ve İlaç Dairesi (FDA) özellikle dikiş malzemesi olarak beşeri, için malzeme onaylanmıştır; İnsanlarda, bir güvenlik kaydı olduğunu ve in vivo 10 degrade olduğu bilinmektedir. ipek bozulması profili 12 ay ya da daha fazla (yüksek kristal ipek) saat (düşük kristalli ipek) aralığında ince ayarlanmış olabilir. İpek parçalanma ürünleri toksik olmayan ve vücutta 10 metabolize edilir. Ipek yapısı kontrollü ilaç serbest bırakılması için iyi bir malzeme yapma, düşük moleküler ağırlıklı bileşikler ve makromoleküler protein ilaçları 11 bağlanma yeteneğini kazandırır. Protein ilaçlar (örneğin, antikorlar) bağışıklık sistemi tarafından denatürasyon, toplama, proteolitik bölünme ve temizlik duyarlıdırlar. Ancak, ipek dolayı nanokristal yeniden tamponlama kapasitesine terapötik proteinler stabilizegions ve nano ölçekte 11 su içeriğine terzi yeteneği. Bu benzersiz özellikleri, fiziksel koruma sağlar ve yük hareketliliği 11 azaltmak ve genellikle diğer (biyo) polimerler ile görülmez. Örnek ipek tabanlı hidrojellerin 12, filmler 13-15 ve nanopartiküller 16,17 Birçok antikanser ilaç taşıyıcı sistemler, şimdi (18,19 referanslar gözden) bu özellikleri yararlanmak için geliştirilmiştir
Burada, ipek nanopartiküller, uzun bir zaman dilimi içinde boyut ve yükleri belirlenmesi ile karakterize edilmiştir. Doksorubisin, klinik olarak anlamlı bir anti-kanser ilaç, ilaç yüklü ipek nanopartiküller ile tedavi edilen üç negatif insan meme kanseri hücrelerindeki ilacın yükleme ve sitotoksisite çalışmaları için model bir ilaç olarak kullanılmıştır.
Protokol
Ipek böceği Koza Bir Ters-mühendislik İpek Çözüm 1. Hazırlık
NOT: Bu yöntem başka bir yerde 12,27 açıklanan protokollere dayanmaktadır.
- 5 mm x 5 mm parçalar halinde makasla kurutulmuş koza 5 g kesin. herhangi bir kirli katmanları kaldırın.
- sodyum karbonat 4.24 g tartılır ve damıtılmış su kaynar 2 L dikkatlice ilave edin.
Not: Bu, 0.02 M sodyum karbonat çözeltisi elde edilir. - kaynar sodyum karbonat çözeltisi ile kesme koza parçaları ekleyin ve 60 dakika ipek lifleri DEGUM için kaynatın. homojen numune işlenmesini sağlamak için bazen ipek karıştırın.
- gamı giderilmiş ipek çıkarın ve 20 dakika için damıtılmış su, 1 L ile yıkayın; yıkama aşaması, en azından 3 kez tekrarlayın.
- yıkanmış ipek çıkarın ve aşırı sıvı kaldırmak ve sonra çöz / elle ipek çekmek için iyice sıkıp. Kuru gecede havalandırmak için bir davlumbaz çözdü ipek yerleştirin. Bu, tipik olarak viskozitesi giderilmiş s 3.6 g elde edilirilk elyaf.
- Sonraki gün, 5 g hava ile kurutulmuş gamı giderilmiş iplikleri tartılarak 50 ml'lik bir cam kaba alt kısmına sıkıca ipek paketi.
- taze bir 9.3 M LiBr çözeltisi hazırlayın. 4 ml LiBr oranı 1 gr ipek kullanılarak LiBr ipek lifleri eritin. buharlaşmasını önlemek ve ipek tam 60 ° C çözünmesi için alüminyum folyo ile ipek LiBr örnek kapak. Bu adım 4 saat kadar sürer ve ara sıra karıştırarak destekli olduğunu.
- 5 dakika boyunca su içinde bir diyaliz kaseti (3500 Da molekül ağırlıklı bir kesim) ıslatın. 15 enjekte ml, 15 ml diyaliz kaset içine ipek LiBr çözümü ve herhangi bir hava kabarcıklarını çıkarmak için bir iğne ve şırınga kullanın.
- Damıtılmış su, 1 L karşı diyaliz ve (örneğin, ilk gününde 3 değişiklikleri) ve daha sonraki sabah ve akşam (yani, 2, ikinci gün değişiklik) ve tekrar 1, 3 ve 6 saat sonra su değiştirmek Ertesi sabah (üçüncü gün, yani 1 değişim).
- ipek soluti toplayındiyaliz kaseti ve santrifüj 9,500 x g'de, 5 ° C'de 20 dakika süre ile çözelti itibaren. süpernatant kurtarmak ve iki kez daha bu santrifüj işlemi tekrarlayın.
- Boş tartı tekne (W1) ağırlığını belirlemek ve ipek solüsyonu 1 ml ekleyin. Tekrar (W2) ağırlığı kaydetmek ve daha sonra gece boyunca 60 ºC'de tartı tekne bırakarak örnek kurutun. Sonraki, toplam kuru ağırlığı (W3) (kurutulmuş ipek ve tartı tekne) belirler. İpek çözeltisinin konsantrasyonu (ağırlık / hacim) 'dir:% = (W3-W1 / W2-W1) x 100.
Ters-mühendislik İpek Çözüm İpek Nanopartiküller 2. Hazırlık
- a>% 75 (h / h) aseton çözeltisi korurken ipek çözeltisi damla damla (w / v) aseton% 5 ekleyin. Örneğin, bir% 5 9 ml ekleyin (a / h), ipek çözeltisi damla damla 34 mL aseton (50 damla / dakika hızda 10 ul / damla).
- 4 ° C'de 2 saat süre ile 48.000 x g'de çökelti santrifüjleyin.
- Süpernatantı aspire ve Pelle tekrar süspansiyonilk olarak bir spatula ile pelet yerinden ayrılmasını ve daha sonra 20 ml distile suya eklenerek damıtık su içinde t. spatula gelen pelet kaldırmak için pipet ipuçlarını kullanın. , 30 saniye için% 30 genliğinde bir ultrasonik sonda kullanılarak iki sonikasyon döngü izledi 20 sn için damıtılmış su ile kapasitesine santrifüj tüpü üstünü vorteks sonra.
- en az iki kez santrifüj ve tabanda adımı yineleyin.
- kullanılana kadar 4 ° C 'de 2.3 ile deposu ayrıntılı olarak, damıtılmış su 6 ml pelletini. Hücre kültürü çalışmaları için, ipek nanoparçacık stokları gama 17 ışınlanmış olabilir.
İpek Nanopartikül Konsantrasyon 3. Belirlenmesi
- 4 ° C'de 2 saat süre ile 48.000 x g santrifüj ipek nanopartiküller.
- 30 saniye için% 30 genlik iki sonikasyon döngü izledi damıtılmış su, 3 ml, tüm nano-tanecikleri toplamak.
- 2 ml ve 1 ml sürü içine ipek nanopartiküller 3 ml stok bölün ve pr aktarmak2 ml tüpler e tartılmış. 2 mi numunenin toplam ağırlığı kaydedilir. kullanılana kadar 4 ° C 'de, 1 ml çok saklayın; Bu 1 ml örnek bir kalibrasyon eğrisi oluşturmak için kullanılır.
- Daha sonra Yapış dondurma ve bir gecede bir dondurarak kurutma 2 ml ipek nanopartikül çok liyofilize. dondurularak kurutulduktan sonra, 2 mi tüp tekrar tartılır ve 2 ml numune içinde orijinal olarak mevcut olan ipek nanopartiküller (mg) miktarını hesaplayın.
- 5-noktalı bir kalibrasyon eğrisi (0,04-7 mg / ml) üretmek için damıtılmış su ile 1 mi ipek nanopartikül stokunu. Numuneler absorbans maksimum aşmamasına dikkat edin.
- 600 nm'de her bir standart dilüsyon absorbansı belirler. Bu en iyi, 96 oyuklu bir plaka ortamında kullanılarak yapılır. Standart eğri için konsantrasyonu (mg / ml) karşı Parsel emme. Daha sonra süspansiyon ipek nanopartiküllerin konsantrasyonunu belirlemek için rutin olarak, bu standart eğri kullanımı.
Doksorubisin yüklü İpek Nanopartiküller 4. hazırlanması
- Doksorubisin Çözüm hazırlanması
- damıtılmış su, 8 ml doksorubisin HCl 1.2 mg çözülür.
- 116 ug / ml (0.2 umol / ml) oluşan bir çalışma stokları elde etmek için distile su ile 10 ml'ye tamamlanır.
- Doksorubisin yüklü İpek nano partiküllerin hazırlanması
- 10, 30 ya da 50 mg / 2 ml tüp ipek nanopartiküllerinin ml 200 ul 0.2 umol / ml doksorubisin çözeltisi 2 ml karıştırın.
- döner bir karıştırıcıda (25 ° C), gece boyunca, oda sıcaklığında, ipek-doksorubisin süspansiyon inkübe edin.
- Daha sonra, 30 dakika süre ile 194.000 x g'de, ipek-doksorubisin süspansiyon santrifüj. damıtılmış suyla doksorubisin yüklü ipek nanopartiküller yıkayın ve iki kez daha bu işlemi tekrarlayın.
- (Bu örnek kapsülleme etkinliğini belirlemek için kullanıldı) süpernatant Havuz ve toplam hacmin not edin.
- , Distile su ile doksorubisin yüklü ipek nanopartiküller yeniden süspanse 4 ºC un ışık ve mağaza korumakKullanım til.
- Kapsülleme Verimliliği ve İlaç Yükleniyor Belirlenmesi
- Pipet siyah mikrotiter plakası içine adım 4.2.4 Çökelti 200 ul.
- Sabit photomultiplier ayarında doksorubisin ile ilişkili floresan ölçmek için bir floresan mikroplaka okuyucu kullanın.
- 590 nm 485 nm ve emisyon dalga boyu dalgaboyu ayarlayın ve floresan değerleri kaydedin.
- Bir doksorubisin kalibrasyon eğrisi oluşturun. Emin olun ölçümler (sabit photomultiplier ayarıyla yani) aynı enstrüman ayarları ile elde edilir. Kalibrasyon eğrisi kullanılarak birleştirildi süpernatan içinde doksorubisin konsantrasyonunun hesaplanması. Üç bağımsız deney bu ölçümü tekrarlanır.
- kapsülleme etkinliğini belirlemek için denklem (1) kullanın:
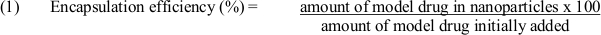
İpek Nano 5. Karakterizasyonuparçacıklar
- Taze hazırlanmış ve saklı İpek Nanopartiküller boyutu ve Zeta Potansiyelinin Belirlenmesi.
- 4 ° C ve 25 ° C sıcaklıkta bulunan damıtılmış suyun saklayın ipek nanopartiküller.
- dinamik ışık saçılımı (DLS) ile 0, 14 ve 28. ipek nanopartiküllerin büyüklüğü ve zeta potansiyeli ölçülür. Protein 17 distile su ve 1.33 1.60 kırılma indisine ayarlayın. Kullanıcı arayüzü yazılımı ile partikül boyutlarını hesaplamak.
- Taramalı Elektron Mikroskobu İpek Nanopartiküller Morfolojik Değerlendirmesi (SEM).
- bir SEM kütüğü üzerine bir karbon yapışkan disk yerleştirilir ve sonra bir silikon gofret ekleyin.
- 1 mg / ml'lik bir konsantrasyona ipek nano-tanecikleri ile seyreltilir. Pipet silikon göbeğin üzerine örnek 10 ul, -80 ° C'de örnek dondurma ve gece boyunca üretici talimatlarına göre bir dondurarak kurutma sistemi kullanılarak liyofilize edin.
- Coat bir altın numune 20 nm kalınlığında kadar katmandüşük vakum püskürtmeli kaplayıcı kullanılarak.
NOT: Cihaz ayarları modelleri arasında değişir. Burada kullanılan model, tam otomatik ve sadece kalınlığı ile çalışır. - 5 kV taramalı elektron mikroskobu ve 40.000 kat büyütme ile görüntü örnekleri.
Kontrol vitro ve Doksorubisin yüklü İpek Nanopartiküller 6.
- İpek Nanopartiküller Maruz ardından Hücre Canlılık.
- % 10 h / h FBS ile RPMI 1640 kültür MDA-MB-231 hücreleri. Doku kültürü plakası hücreleri polistiren işlemden geçirildi ve 37 ° C'de nemlendirilmiş bir% 5 CO2 atmosferinde inkübe edin. Rutin 2-3 günde% 80 izdiham altkültürü.
- 96 oyuklu plakalar içinde 2 x 10 4 hücre / cm2 yoğunluğunda, MDA-MB-231 hücreleri Plate. Hücreler bir gecede kurtarmak için izin verin.
- ug serbest yayılabilir doksorubisin 0.001-1: (i) ekleyin, (ii) 0,001-0,5 mg ipek nanopartiküller ve 0,1 mg ipek nanopartiküller96 oyuklu plakalar (Nihai hacmi, oyuk başına 100 ul) içerisine ug doksorubisin 0.001-1 ile yüklendi.
- Hücre canlılığı ve (3- (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazolyum bromid, PBS içinde (MTT 5 mg / ml) 72 saat ilave yarım maksimal inhibisyon konsantrasyonunu (IC50) hesaplanır. Inkübe 5 saat için, dikkatli bir şekilde bir pipet ile kuyu boşaltın ve dimetilsülfoksit 100 uL formazanın eritilmesi. 560 nm'de absorbansı ölçülür., üç bağımsız deneyin bu ölçümü tekrarlanır.
NOT: muamele edilmemiş kontrollerin absorbans değerleri% 100 hücre canlılığı için bir referans değeri olarak kullanılır.
- İpek Nanopartiküller Maruz Hücreler SEM.
- 2 x 10 4 hücre / cm2 yoğunluğunda, steril cam lameller üzerine Tohum MDA-MB-231 hücreleri. Hücreler bir gecede kurtarmak için izin verin. 72 saat süre ile, istenen tedavi koşullarına hücreleri Açığa.
- di ile yıkayın, 30 dakika boyunca PBS içinde% 2 h / h glutaraldehid ile hücreleri saptamakstilled su iki kez, bir etanol serisi ile kurutmak, ve başka bir yerde 28 açıklandığı gibi kritik nokta, örnekleri kurulayın.
- Bir altın numuneler kalınlığında düşük vakum püskürtmeli kaplayıcı kullanılarak 20 nm'ye kadar katman ceket sputter.
NOT: Cihaz ayarları modelleri arasında değişir. Burada kullanılan model, tam otomatik ve sadece kalınlığı ile çalışır. - Resim 5 kV ve 700 kat büyütme bir elektron ivme kullanarak SEM ile örnekler.
Sonuçlar
Daha önce 17 ayrıntılı olarak Veriler istatistiksel olarak analiz edildi. Student t-testi, çok sayıda numune için Bonferroni çoklu karşılaştırma post-hoc testi ile takip örnek çiftleri ve varyans analizi (ANOVA) Tek yönlü analizi için kullanıldı. aşağıdaki gibi bir yıldız istatistiksel anlamlılık gösterir: * p <0.05 ve ** p <0.001. Tüm veriler, bağımsız deney sayısını belirtir, standart sapma (SD) ve parantez içinde sayılar ± ortalama...
Tartışmalar
Çeşitli yöntemler, süperkritik CO, 21 kurutma, kılcal microdot 23 baskı 22 dışarı tuzlama sprey, 20 karıştırma polivinil alkol de dahil olmak üzere ipek nanopartiküller üretmek için kullanılabilir 2 yağış 24 ve nanoprecipitation 16,25 (referans 26 gözden). Ancak, nanoprecipitation nedeniyle genel basitliği, ipek nanopartiküller üretmek için en popüler tekniktir. Bu nedenle, bu çalışmanın amacı nanopreci...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This research was supported by a Marie Curie FP7 Career Integration Grant 334134 within the seventh European Union Framework Program.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetone | VWR International, Radnor, PA, USA | 20066.33 | |
| Automated Critical Point Dryer | Leica Microsystems, Wetzlar, Germany | EM CPD300 | |
| Balancing | Mettler Toledo, Greifensee, Switzerland | NewClassic MS | |
| Black polystyrene microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3991 | |
| Capillary cell (DTS 1070) | Malvern Instrument, Worcestershire, UK | DTS107 | |
| Carbon adhesive disc | Agar Scientific, Essex, UK | G3347N | |
| Centrifuge | Hermle Labortechnik, Wehingen, Germany | Z323K | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Avanti J-E, Rotor: J20 | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Optima L-70K, Rotor: 50.2 Ti, Adaptor 303392 | |
| Coater, low vacuum | Leica Microsystems, Wetzlar, Germany | EM ACE200 | |
| Cuvettes, polystyrene, disposable | Fisher Scientific, Waltham, MA, USA | FB55147 | |
| Doxorubixin | LC Laboratories, Boston, MA, USA | D4000 | |
| Electronic pipetting, Easypet | Eppendorf, Hamburg, Germany | N/A | |
| FE-SEM | Hitachi High-Technologies, Krefeld, Germany | SU6600 | |
| Fetal Bovine Serum | Thermo Scientific, Waltham, MA, USA | 16000-044 | |
| Freeze dryer | Martin Christ, Osterode, Germany | Epsilon 2-4 | |
| Heat inactivated Bombyx mori silk cocoons | Tajima Shoji, Kanagawa, Japan | N/A | |
| Hotplate with Stirrer | Bibby Scientific, Stanffordshire, UK | US 152 | |
| Incubator | Memmert, Schwabach, Germany | INB 200 | |
| Insulin, human recombinant, zinc solution | Thermo Scientific, Waltham, MA, USA | 12585-014 | |
| Lithium bromide | Acros Organics, Geel, Belgium | AC199870025 | |
| MDA-MB-231 | ATCC, Manassas, VA, U.S.A | N/A | |
| Micropipette and tips | Eppendorf, Hamburg, Germany | N/A | |
| Microplate Reader | Molecular devices, Sunnyvale, CA, USA | SpectraMax M5 | |
| Oak Ridge High-Speed Centrifuge Tubes, 50 ml | Thermo Scientific, Waltham, MA, USA | N/A | |
| Open-Top Thickwall Polycarbonate tube, 4 ml | Beckman Coulter, Brea, CA, USA | 355645 | |
| Penicilin/streptomycin | Thermo Scientific, Waltham, MA, USA | 15140-122 | |
| RPMI medium | Thermo Scientific, Waltham, MA, USA | 11875-093 | |
| Serological pipettes, 5 ml | Sigma-Aldrich, St. Louis, MO, USA | ||
| Silicon wafers | Agar Scientific, Essex, UK | G3391 | |
| Slide-A-Lyzer Dialysis cassettes, 3.5K MWCO, 15 ml | Thermo Scientific, Waltham, MA, USA | 87724 | |
| Sodium carbonate anhydrous | Fisher Scientific, Waltham, MA, USA | S/2840/62 | |
| Specimen stubs for SEM | Agar Scientific, Essex, UK | G301 | |
| Ultrasonic homogenizer | Bandelin, Berlin, Germany | Sonoplus HD 2070 | |
| UV transparent microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3635 | |
| Vortex | IKA, Staufen, Germany | Genius 3 | |
| Zetasizer | Malvern Instrument, Worcestershire, UK | Nano ZS | |
| Zetasizer Software version 7.11 | DLS software | ||
| Micro Modulyo | Thermo Fisher | 230 | Freeze drying system |
Referanslar
- Haley, B., Frenkel, E. Nanoparticles for drug delivery in cancer treatment. Urol. Oncol. 26 (1), 57-64 (2008).
- Sun, T., Zhang, Y. S., Pang, B., Hyun, D. C., Yang, M., Xia, Y. Engineered nanoparticles for drug delivery in cancer therapy. Angew. Chem. Int. Ed. 53 (46), 12320-12364 (2014).
- Davis, M. E., Chen, Z. G., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nat. Rev. Drug Discov. 7 (9), 771-782 (2008).
- Sheridan, C. Proof of concept for next-generation nanoparticle drugs in humans. Nature Biotechnol. 30 (6), 471-473 (2012).
- Matsumura, Y., Hitoshi, M. A New Concept for Macromolecular Therapeutics in Cancer Chemotherapy: Mechanism of Tumoritropic Accumulation of Proteins and the Antitumor Agent Smancs. Cancer Res. 46, 6387 (1986).
- De Duve, C., De Barsy, T., Poole, B., Trouet, A., Tulkens, P., Van Hoof, F. Lysosomotropic agents. Biochem. Pharmacol. 23 (18), 2495-2531 (1974).
- Duncan, R., Richardson, S. C. W. Endocytosis and intracellular trafficking as gateways for nanomedicine delivery: opportunities and challenges. Mol. Pharm. 9 (9), 2380-2402 (2012).
- Vishakha, K., Kishor, B., Sudha, R. Natural Polymers - A Comprehensive Review. Int. J. Pharm. Biomed. Res. 3 (4), 1597-1613 (2012).
- Pritchard, E. M., Kaplan, D. L. Silk fibroin biomaterials for controlled release drug delivery. Expert. Opin. Drug Del. 8 (6), 797-811 (2011).
- Thurber, A. E., Omenetto, F. G., Kaplan, D. L. In vivo bioresponses to silk proteins. Biomaterials. 71, 145-157 (2015).
- Pritchard, E. M., Dennis, P. B., Omenetto, F., Naik, R. R., Kaplan, D. L. Physical and chemical aspects of stabilization of compounds in silk. Biopolymers. 97 (6), 479-498 (2012).
- Seib, F. P., Pritchard, E. M., Kaplan, D. L. Self-Assembling Doxorubicin Silk Hydrogels for the Focal Treatment of Primary Breast. Adv. Funct. Mater. 23 (1), 58-65 (2013).
- Seib, F. P., Kaplan, D. L. Doxorubicin-loaded silk films: drug-silk interactions and in vivo performance in human orthotopic breast cancer. Biomaterials. 33 (33), 8442-8450 (2012).
- Seib, F. P., Coburn, J., et al. Focal therapy of neuroblastoma using silk films to deliver kinase and chemotherapeutic agents in vivo. Acta. Biomater. 20, 32-38 (2015).
- Coburn, J. M., Na, E., Kaplan, D. L. Modulation of vincristine and doxorubicin binding and release from silk films. J. Control. Release. 220, 229-238 (2015).
- Seib, F. P., Jones, G. T., Rnjak-Kovacina, J., Lin, Y., Kaplan, D. L. pH-dependent anticancer drug release from silk nanoparticles. Adv. Healthc. Mater. 2 (12), 1606-1611 (2013).
- Wongpinyochit, T., Uhlmann, P., Urquhart, A. J., Seib, F. P. PEGylated Silk Nanoparticles for Anticancer Drug Delivery. Biomacromolecules. 16 (11), 3712-3722 (2015).
- Seib, F. P., Kaplan, D. L. Silk for Drug Delivery Applications: Opportunities and Challenges. Isr. J. Chem. 53 (9-10), 1-12 (2013).
- Yucel, T., Lovett, M. L., Kaplan, D. L. Silk-based biomaterials for sustained drug delivery. J. Control. Release. 190, 381-397 (2014).
- Wang, X., Yucel, T., Lu, Q., Hu, X., Kaplan, D. L. Silk nanospheres and microspheres from silk/pva blend films for drug delivery. Biomaterials. 31 (6), 1025-1035 (2010).
- Qu, J., Wang, L., Hu, Y., You, R., Li, M. Preparation of Silk Fibroin Microspheres and Its Cytocompatibility. J. Biomater. Nanobiotechnol. 4, 84-90 (2013).
- Lammel, A., Hu, X., Park, S., Kaplan, D., Scheibel, T. Controlling silk fibroin particle features for drug delivery. Biomaterials. 31 (16), 4583-4591 (2010).
- Gupta, V., Aseh, A., Rìos, C. N., Aggarwal, B. B., Mathur, A. B. Fabrication and characterization of silk fibroin-derived curcumin nanoparticles for cancer therapy. Int. J. Nanomedicine. 4, 115-122 (2009).
- Zhao, Z., et al. Generation of silk fibroin nanoparticles via solution-enhanced dispersion by supercritical CO2. Ind. Eng. Chem. Res. 52 (10), 3752-3761 (2013).
- Tudora, M., Zaharia, C., Stancu, I. Natural silk Fibroin micro-and nanoparticles with potential uses in drug delivery systems. U.P.B. Sci. Bull., Series B. 75 (1), 43-52 (2013).
- Zhao, Z., Li, Y., Xie, M. B. Silk Fibroin-Based Nanoparticles for Drug Delivery. Int. J. Mol. Sci. 16 (3), 4880-4903 (2015).
- Rockwood, D., Preda, R., Yücel, T. Materials fabrication from Bombyx mori silk fibroin. Nat. Protoc. 6 (10), 1-43 (2011).
- Seib, F. P., Müller, K., Franke, M., Grimmer, M., Bornhäuser, M., Werner, C. Engineered extracellular matrices modulate the expression profile and feeder properties of bone marrow-derived human multipotent mesenchymal stromal cells. Tissue. Eng. Part A. 15 (10), 3161-3171 (2009).
- Lai, P., Daear, W., Löbenberg, R., Prenner, E. J. Overview of the preparation of organic polymeric nanoparticles for drug delivery based on gelatine, chitosan, poly(d,l-lactide-co-glycolic acid) and polyalkylcyanoacrylate. Colloids Surf., B, Biointerfaces. 118, 154-163 (2014).
- Subia, B., Kundu, S. C. Drug loading and release on tumor cells using silk fibroin-albumin nanoparticles as carriers. Nanotechnology. 24 (3), 035103 (2013).
- Zhang, Y. Q., Shen, W. D., Xiang, R. L., Zhuge, L. J., Gao, W. J., Wang, W. B. Formation of silk fibroin nanoparticles in water-miscible organic solvent and their characterization. J. Nanopart. Res. 9 (5), 885-900 (2006).
- Jin, H. J., Kaplan, D. L. Mechanism of silk processing in insects and spiders. Nature. 424 (6952), 1057-1061 (2003).
- Yhr Bae, ., Park, K. Targeted drug delivery to tumors: myths, reality and possibility. J. Control. Release. 153 (3), 198-205 (2011).
- Lammel, A., Schwab, M., Hofer, M., Winter, G., Scheibel, T. Recombinant spider silk particles as drug delivery vehicles. Biomaterials. 32 (8), 2233-2240 (2011).
- Holliday, D. L., Speirs, V. Choosing the right cell line for breast cancer research. Breast. Cancer. Res. 13, 215 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır