A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יישומי ייצור משלוח סמים של חלקיקי משי
In This Article
Summary
חלקיקים הם מתעוררים למערכות אספקת תרופות מבטיחות כמו עבור מגוון רחב של אינדיקציות. כאן אנו מתארים שיטה פשוטה אך רבת עצמה כדי לייצר חלקיקי משי באמצעות משי טוואי משי מהונדס הפוך. חלקיקי משי אלה ניתן לטעון בקלות עם מטען טיפולי ובוחנים מכן עבור יישומי משלוח סמים.
Abstract
משי הוא biopolymer מבטיח עבור יישומים ביו תרופות בשל תכונות מכאני החוב שלה, התאמה ביולוגי פריקות ביולוגיות, כמו גם את יכולתה להגן ולאחר מכן לשחרר המטען שלה בתגובת הדק. בעוד משי אפשר לנסח לתוך פורמטים שונים חומר, חלקיקי משי הם מתעוררים למערכות אספקת תרופות מבטיחות כמו. לכן, במאמר זה מכסה את הליכי פקעות משי הנדסה לאחור להניב פתרון ממשי מחדש, שניתן להשתמש בם כדי ליצור חלקיקי משי יציבים. חלקיקים אלה ובהמשך מאופיין, סמים טעונים ובחנו כמערכת משלוח התרופה נגד הסרטן פוטנציאלית. בקצרה, פקעות משי מתוכננות הפוך לראשונה על ידי degumming הפקעות, ואחריו פירוק משי ולנקות, להניב פתרון ממשי מימי. לאחר מכן, הפתרון משי מחדש נתונה nanoprecipitation להניב חלקיקים משי - שיטה פשוטה אך רבת עוצמהשיוצר חלקיקים אחידים. חלקיקי המשי מאופיינים על פי גודלם, פוטנציאל זטה, מורפולוגיה ויציבות תקשורת מימית, כמו גם יכל ללכוד מטען כימותרפיות ולהרוג תאים סרטניים בשד אנושי. בסך הכל, המתודולוגיה המתוארת מניב חלקיקי משי אחידים שניתן לחקור בקלות עבור מספר עצום של יישומים, לרבות השימוש בם כמו ננו-רפואה פוטנציאלית.
Introduction
בגודל ננו למערכות אספקת תרופות משמשות לעתים קרובות כדי לשלוט שחרור תרופה ולספק קבוצה מגוונת של מטענים טיפוליים - למשל, חלבונים, פפטידים וסמי משקל מולקולריים קטנים - כדי למקד תאים ורקמות. מטענים טיפוליים אלה משולבים לעתים קרובות לתוך ספקי סמים שונים macromolecular, כגון ליפוזומים, פולימרים מסיסים במים (כולל dendrimers), ו מייקרו חלקיקים 1. חלקיקים (בדרך כלל בטווח גודל של 1 ננומטר 1,000 ננומטר) הם נבדקים נרחב כנישאי תרופה פוטנציאליים, במיוחד למסירת התרופה נגד סרטן 2. המבוא המוצלח של Abraxane (120 חלקיקים מבוססים אלבומין בגודל ננומטר עמוסים paclitaxel) לפועל קליני שיגרתי 3 יש catalyzed בתחום, כך חלקיקים רבים יותר עבור משלוח סמים נכנסים כעת 4 ניסויים קליניים. גידולים מוצקים להראות בדרך כלל ניקוז עניים הלימפה וכלי הדם שלהם דולף כלומר nanoparticles של עד 200 ננומטר יהיה ממוקד באופן פסיבי לגידולים אלה הבאים עירוי לוריד. תופעה סבילה מיקוד זה נקרא חדירות משופרת ושימור (EPR) אפקט דווח לראשונה בשנת 1986 5. ההשפעה EPR יכול להביא לעלייה 50 עד פי 100 בריכוזים התרופה במיקרו-סביבה של הגידול עבור מנה תרופה אשר ניתנת כאשר מטען התרופה מועבר באמצעות גישה מובילה תרופת macromolecular ולא תרופה חינם ללא ההספק. חלקיקים טעונים והתרופות שנועדו למסירה תרופה נגד סרטן צריך להגיע במיקרו-סביבה של הגידול ולעיתים קרובות יש להזין תא תאיים ספציפיים, בדרך כלל על ידי ספיגת endocytic עבור התרופה כדי להשיג השפעה טיפולית הרצוי שלה 3. חלקיקים נועדו עבור משלוח סמים תאי לנצל אנדוציטוזה כשער אל תוך התא, כמו גם מסלול להתגבר מנגנוני עמידות לתרופות. שחרור התרופה חלקיקים לעתים קרובות היא תוכננה במיוחד כדי occur ב lysosomes (כלומר, אספקת סמים lysosomotropic) 6 שבו ההיענות pH של המוביל ננו-חלקיקים (pH ליזוזומלית כ 4.5) יכול לשמש טריגר אנזימים שחרור או ליזוזומלית תרופה לשחרר את מטען מהמוביל 7.
שיעורים רבים של חומרים שונים שניתן להשתמש בהם כדי ליצור חלקיקים (למשל, מתכות ורבים חומרים אורגניים ואי-אורגניים). עם זאת, biopolymers הם מתעוררים חומרים אטרקטיביים כמו בגלל biocompatibility הידוע, פריקות ביולוגיות ורעילות 8 נמוכות. biopolymers הרב הם נבדק, כולל אלבומין, אלגינט, chitosan ומשי. מבין אלה, משי התפתח מתחרה מבטיח לפיתוח לתוך מערכות אספקת סמי 9. משי מסוגים שונים המיוצרים על ידי מספר פרוקי רגליים, כולל עכבישים (למשל, clavipes Nephila) ו המשי (למשל, Bombyx מורי). משי תולעת משי משמש הרבה יותר Extenבאופן בלעדי מ קורי עכביש כי תולעי המשי הוא מבוית לחלוטין והמשי שלה ובכך מייצג חומר-מוצא לשחזור. משי תולעת המשי הוא ארגון המזון והתרופות האמריקני (FDA) אישר חומר לשימוש בבני אדם, במיוחד כחומר תפר; יש לו רקורד בטיחות חזק בבני אדם, והוא ידוע לבזות in vivo 10. הפרופיל השפל של משי יכול להיות מכוון עדין יותר והוא נע בין שעות (משי גביש נמוך) עד 12 חודשים או יותר (משי גביש גבוה). מוצרים פגומים משי הם רעילים עוברים מטבוליזם בגוף 10. מבנה המשי מקנה את היכולת לרתק תרכובות משקל מולקולרי קטנות וסמי חלבון macromolecular 11, מה שהופך אותו חומר טוב לשחרור סמים מבוקר. תרופות חלבון (למשל, נוגדנים) רגישות denaturation, צבירה, מחשוף פרוטאוליטים ופינוי על ידי המערכת החיסונית. עם זאת, משי מייצב חלבונים תרופתיים עקב יכולת חציצה מחדש nanocrystalline שלהgions ויכולתה להתאים את תוכן מים הננומטרי 11. תכונות ייחודיות אלה מספקים הגנה פיזית להפחית ניידות מטען 11 והם בדרך כלל לא רואים עם פולימרים אחרים (ביו). מערכות שיגור רבות תרופה נגד הסרטן, עבור הידרוג משי מבוסס למשל 12, סרטים 13-15 חלקיקים 16,17, פותח עכשיו לנצל תכונות אלו (הנסקרת ב אזכור 18,19)
הנה, חלקיקי משי התאפיינו קביעת הגודל ולחייב שלהם על פני פרק זמן ממושך. דוקסורוביצין, תרופה נגד סרטן רלוונטית קליני, שמש כתרופת מודל מחקר העמסת cytotoxicity תרופה בתאי סרטן שד אנושי משולשים שליליים שטופלו חלקיקי משי טעון בסמים.
Protocol
1. הכנת פתרון Silk הפוכה מהונדסים מן Bombyx מורי גלמים
הערה: מתודולוגיה זו מבוססת על פרוטוקולים תארו במקום 12,27.
- חותכים 5 גרם של פקעות מיובשות עם מספריים לתוך 5 מ"מ x 5 חתיכות מ"מ. הסר את כל השכבות מלוכלכות.
- תשקול 4.24 גרם של סודיום קרבונט ולהוסיף זה בזהירות עד 2 ליטר של מים רותחים מזוקקים.
הערה: זה מניב פתרון קרבונט 0.02 M נתרן. - מוסיפים את חתיכות המעטפת לחתוך הפתרון סודיום קרבונט רותחים ומרתיחים במשך 60 דקות כדי degum סיבי משי. מערבבים את משי מדי פעם כדי להבטיח עיבוד מדגם הומוגני.
- הסר את משי Degummed ולשטוף עם 1 ליטר מים מזוקקים במשך 20 דקות; חזור על שלב הכביסה לפחות 3 פעמים.
- הסר את המשי המכובס ולסחוט אותה היטב כדי להסיר עודפי נוזלים ולאחר מכן להתיר / למשוך את המשי ביד. מניחים את משי התיר במנדף לאוורר לילה יבש. זה בדרך כלל מניבה 3.6 גרם של ים Degummedסיבי ודומיו.
- למחרת, לשקול את 5 גרם סיבי משי Degummed אוויר יבש ולארוז המשי בחוזקה לתוך החלק התחתון של מבחנה 50 מ"ל.
- כן פתרון 9.3 M LiBr טרי. ממיסים את סיבי משי LiBr באמצעות משי 1 גרם עד 4 מ"ל יחס LiBr. מכסה את מדגם המשי LiBr עם רדיד אלומיניום על מנת למנוע אידוי ולאפשר המשי לפזר לחלוטין ב 60 מעלות צלזיוס. שלב זה נמשך עד 4 שעות והוא נעזר תוך ערבוב מדי פעם.
- להרטיב קלטת דיאליזה (חתוכים משקל מולקולרי של 3,500 Da) במים למשך 5 דקות. להזריק 15 מ"ל הפתרון משי LiBr לתוך קלטת דיאליזה 15 מ"ל ולהשתמש מחט מזרק כדי להסיר בועות אוויר.
- Dialyze נגד 1 ליטר של מים מזוקקים להחליף את המים ב 1, 3 ו -6 שעות (כלומר, 3 שינויים ביום הראשון) ושוב על הבוקר והערב הבא (כלומר, 2 שינויים ביום השני), ושוב על למחרת בבוקר (כלומר, שינוי של 1 ביום שלישי).
- אסוף את soluti משיעל מתוך הקלטת דיאליזה צנטריפוגות הפתרון במשך 20 דקות ב 5 מעלות צלזיוס ב 9,500 x ז. לשחזר את supernatant וחזור תהליך צנטריפוגה זה עוד פעמיים.
- קבע את משקל סירה במשקל ריק (W1) ולהוסיף 1 מ"ל של פתרון ממשי. רשום את המשקל שוב (W2) ולאחר מכן לייבש את המדגם על ידי השארת את הסירה במשקל ב -60 ºC לילה. לאחר מכן, לקבוע את המשקל היבש הכולל (W3) (משי יבש סירה במשקל). הריכוז של הפתרון הממשי (w / v) הוא:% = (W3-W1 / W2-W1) x 100.
2. הכנת משי החלקיקים מן ההפוך מהונדס פתרון Silk
- הוסף% 5 (w / v) dropwise פתרון ממשי כדי אצטון תוך שמירה על> 75% (v / v) פתרון אצטון. לדוגמה, להוסיף 9 מ"ל של 5% (w / v) dropwise פתרון ממשי (10 μl / ירידה בשיעור של 50 טיפות / min) ל -34 מ"ל אצטון.
- צנטריפוגה המשקע ב 48,000 XG במשך שעה 2 ב 4 ° C..
- לשאוב supernatant ו resuspend Pellet במים מזוקקים על ידי פירוק הגלולה ראשון עם מרית ולאחר מכן הוספה 20 מ"ל מים מזוקקים. השתמש בעצות pipet להסיר הגלולה מן המרית. לאחר vortexing במשך 20 שניות ואחריו שני מחזורי sonication באמצעות בדיקה קולית ב משרעת 30% למשך 30 שניות, למעלה למעלה בצינור צנטריפוגות עד אפס מקום עם מים מזוקקים.
- חזור על צנטריפוגה צעד resuspension לפחות פעמיים.
- Resuspend גלולה ב 6 מ"ל מים מזוקקים, כמפורט 2.3 ולאחסן ב 4 ° C עד השימוש. עבור מחקרי תרבית תאים, מניות nanoparticle משי יכולות להיות מוקרנת גמא 17.
3. קביעת ריכוז Nanoparticle משי
- חלקיקי משי צנטריפוגה ב 48,000 XG במשך שעה 2 ב 4 ° C..
- לאסוף את כל החלקיקים ב 3 מיליליטר של מים מזוקקים, ואחריו שני מחזורי sonication ב משרעת 30% למשך 30 שניות.
- מחלק את 3 מיליליטר המלאה של חלקיקי משי לתוך 2 מיליליטר ו 1 מיליליטר המון ולהעביר לתוך יחסי הציבורדואר שקלה 2 צינורות מ"ל. רשום את המשקל הכולל של מדגם 2 מ"ל. אחסן במגרש 1 מ"ל ב 4 מעלות צלזיוס עד לשימוש; מדגם 1 מ"ל זה ישמש כדי ליצור עקומת כיול.
- הקפאת הצמד ואז Lyophilize במגרש nanoparticle משי 2 מ"ל בתוך מייבש להקפיא למשך הלילה. לאחר ייבוש בהקפאה, reweigh צינור 2 מיליליטר ולחשב את כמות חלקיקי משי (מ"ג) כי נכחו במקור במדגם 2 מיליליטר.
- לדלל את המניות nanoparticle משי 1 מ"ל מים מזוקקים כדי ליצור עקומת כיול של 5 נקודות (0.04-7 מ"ג / מ"ל). ודא כי דגימות לא לחרוג המקסימלי ספיגת.
- קבע את הספיגה של כל דילול סטנדרטי ב 600 ננומטר. זה נעשה הכי טוב באמצעות התקנת צלחת 96-היטב. ספיגה מגרש לעומת ריכוז (מ"ג / מיליליטר) עבור העקומה הסטנדרטית. לאחר מכן השתמש עקומת תקן זה באופן שיגרתי כדי לקבוע את הריכוז של חלקיקי משי השעיות.
4. הכנת חלקיקי משי טעון דוקסורוביצין
- הכנת התמיסה דוקסורוביצין
- ממיסים 1.2 מ"ג של דוקסורוביצין HCl ב 8 מ"ל מים מזוקקים.
- לעשות עד 10 מ"ל עם מים מזוקקים להניב המניות עבודה של 116 מיקרוגרם / מ"ל (0.2 μmol / מ"ל).
- הכנה של חלקיקי משי טעונים דוקסורוביצין
- מערבבים 2 מ"ל של 0.2 μmol / פתרון דוקסורוביצין מ"ל עם 200 μl של 10, 30 או 50 מ"ג / מ"ל של חלקיקים משי בתוך שפופרת 2 מ"ל.
- לדגור על השעיית משי-דוקסורוביצין בטמפרטורת החדר (25 מעלות צלזיוס) במשך הלילה על מערבל מסתובב.
- לאחר מכן, בצנטריפוגה ההשעיה דוקסורוביצין-משי 194,000 XG במשך 30 דקות. שטפו את חלקיקי משי טעון-דוקסורוביצין עם מים מזוקקים לחזור על הליך זה עוד פעמיים.
- פינת supernatant ו לציין את הנפח הכולל (דגימה זו משמשת כדי לקבוע את יעילות אנקפסולציה).
- Resuspend חלקיקי המשי טעון-דוקסורוביצין במים מזוקקים, להגן מפני אור ולאחסן ב 4 ºC until שימוש.
- קביעת יעילות Encapsulation וטעינה ותרופות
- Pipet 200 μl של supernatant משלב 4.2.4 לתוך צלחת microtiter שחור.
- שימוש בקורא microplate פלואורסצנטי למדוד קרינה הקשורים דוקסורוביצין בכל הגדרת מכפיל קבועה.
- קבע את אורך הגל עירור על 485 ננומטר אורך גל ופליטה כדי 590 ננומטר ולהקליט את ערכי הקרינה.
- ליצור עקומת כיול דוקסורוביצין. ודא מדידות נרכשות עם גדרות מכשיר זהות (כלומר, עם הגדרת מכפיל קבועה). באמצעות עקומת כיול, לחשב את ריכוז דוקסורוביצין ב supernatant בשילוב. חזור על המדידה הזו בשלושה ניסויים בלתי תלויים.
- השתמש במשוואה (1) כדי לקבוע את יעילות אנקפסולציה:
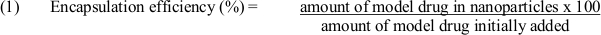
אפיון 5. של משי Nanoחלקיקים
- הערכת הגודל זיטה הפוטנציאל של טרייה המאוחסנים משי חלקיקים.
- חלקיקי משי חנות במים מזוקקים ב 4 מעלות צלזיוס ו -25 מעלות צלזיוס.
- למדוד את פוטנציאל הגודל זטא של חלקיקי המשי בימים 0, 14 ו -28 באמצעות פיזור אור דינאמי (DLS). גדר מדדים שבירים כדי 1.33 עבור מים מזוקקים 1.60 עבור חלבון 17. חישוב גדלים של חלקיקים עם תוכנת ממשק המשתמש.
- הערכה מורפולוגי של חלקיקים משי על ידי מיקרוסקופית אלקטרונים סורק (SEM).
- מניחים דיסק דבק פחמן על בדל SEM ובהמשך לצרף פרוסות סיליקון.
- לדלל חלקיקים משי לריכוז של 1 מ"ג / מ"ל. פיפטה 10 μl של המדגם על גבי פרוסות סיליקון, להקפיא את המדגם ב -80 מעלות צלזיוס ולינה Lyophilize באמצעות מערכת ייבוש בהקפאה לפי הוראות היצרן.
- מעיל המדגם עם זהב שכבת עד 20 ננומטר עבהבאמצעות coater גמגום ואקום נמוך.
הערה: גדרות מכשירות להשתנות בהתאם לדגם. המודל המשמש כאן הוא אוטומטיים לחלוטין פועל על ידי עובי בלבד. - דגימות תמונה עם מיקרוסקופ אלקטרונים סורק של 5 קילו ו בהגדלת 40,000 פי.
6. במבחנה Cytotoxicity של שליטה טעון דוקסורוביצין חלקיקים משי
- כדאיות התא בעקבות חשיפה משי חלקיקים.
- תרבות תאים מד"א- MB-231 ב RPMI 1640 עם 10% FBS V / V. פלייט תאים על בתרבית רקמה מטופלים קלקר דגירה באווירה 5% CO 2 humidified על 37 מעלות צלזיוס. באופן שגרתי תת בנקודת המפגש 80% כל 2-3 ימים.
- פלייט תאים מד"א- MB-231 בצפיפות של 2 x 10 4 תאים / ס"מ 2 ב 96-גם הצלחות. אפשר התאים להתאושש לילה.
- להוסיף (i) 0.001-1 מיקרוגרם דוקסורוביצין diffusible בחופשיות, (ii) 0.001-.5 חלקיקי משי מ"ג ו -0.1 מ"ג חלקיקי משיעמוס 0.001-1 דוקסורוביצין מיקרוגרם לתוך צלחות 96-היטב (נפח סופי 100 μl לכל היטב).
- לקבוע כדאיות התא ריכוז מעכבות מקסימלי וחצי (IC 50) על ידי הוספת (3- (4,5-dimethylthiazol-2-י.ל.) ברומיד -2,5-diphenyltetrazolium (MTT 5 מ"ג / מ"ל ב PBS) בשעה 72 hr. דגירה במשך 5 שעות, לנקז את הבארות בזהירות עם טפטפתי לפזר את formazan עם 100 μl של dimethylsulfoxide. מדוד את הספיגה ב 560 ננומטר. חזור המדידה הזו בשלושה ניסויים בלתי תלויים.
הערה: הערכים הספיגים של בקרות מטופל לשמש ער ייחוס עבור כדאיויות תא 100%.
- SEM של בתאים שנחשפו משי חלקיקים.
- זרע תאים מד"א- MB-231 על coverslips זכוכית סטרילית בצפיפות של 2 x 10 4 תאים / 2 ס"מ. אפשר התאים להתאושש לילה. לחשוף את התאים לתנאי הטיפול הרצויים עבור 72 שעות.
- תקן את התאים עם glutaraldehyde נ 2% / v ב PBS למשך 30 דקות, לשטוף עם diמים השתיקו פעמים, מייבש עם סדרת אתנול, ו נקודה קריטית לייבש את הדגימות, כמפורט במקומות אחר 28.
- גמגום מעיל דגימות עם זהב שכבת עד 20 ננומטר עבה באמצעות coater גמגום ואקום נמוך.
הערה: גדרות מכשירות להשתנות בהתאם לדגם. המודל המשמש כאן הוא אוטומטיים לחלוטין פועל על ידי עובי בלבד. - תמונה הדגימות על ידי SEM באמצעות האצת אלקטרונים של 5 קילו וולט והגדלה 700 פי.
תוצאות
הנתונים נותחו סטטיסטית כמפורט לעיל 17. מבחן t שמש זוגות מדגם וניתוח חד סטרי של שונות (ANOVA) ואחריו ההשוואה המרובה של Bonferroni פוסט הוק מבחן דוגמאות רבות. כוכבית מציינת מובהקות סטטיסטית כדלקמן: * P <0.05 ו ** P <0.001. כל הנתונים מוצגים ערכים ממוצעים ± סטיית...
Discussion
שיטות שונות זמינות לייצר חלקיקי משי, כוללים אלכוהול פוליוויניל מיזוג 20, ריסוס ייבוש 21, מתובל מתוך 22, microdot נימי הדפסת 23, סופר הקריטי CO 2 ממטרים 24 ו nanoprecipitation 16,25 (הנסקרת תוך התייחסות 26). עם זאת, nanoprecipitation, בשל הפשטות הכוללת של?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
This research was supported by a Marie Curie FP7 Career Integration Grant 334134 within the seventh European Union Framework Program.
Materials
| Name | Company | Catalog Number | Comments |
| Acetone | VWR International, Radnor, PA, USA | 20066.33 | |
| Automated Critical Point Dryer | Leica Microsystems, Wetzlar, Germany | EM CPD300 | |
| Balancing | Mettler Toledo, Greifensee, Switzerland | NewClassic MS | |
| Black polystyrene microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3991 | |
| Capillary cell (DTS 1070) | Malvern Instrument, Worcestershire, UK | DTS107 | |
| Carbon adhesive disc | Agar Scientific, Essex, UK | G3347N | |
| Centrifuge | Hermle Labortechnik, Wehingen, Germany | Z323K | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Avanti J-E, Rotor: J20 | |
| Centrifuge | Beckman Coulter, Brea, CA, USA | Optima L-70K, Rotor: 50.2 Ti, Adaptor 303392 | |
| Coater, low vacuum | Leica Microsystems, Wetzlar, Germany | EM ACE200 | |
| Cuvettes, polystyrene, disposable | Fisher Scientific, Waltham, MA, USA | FB55147 | |
| Doxorubixin | LC Laboratories, Boston, MA, USA | D4000 | |
| Electronic pipetting, Easypet | Eppendorf, Hamburg, Germany | N/A | |
| FE-SEM | Hitachi High-Technologies, Krefeld, Germany | SU6600 | |
| Fetal Bovine Serum | Thermo Scientific, Waltham, MA, USA | 16000-044 | |
| Freeze dryer | Martin Christ, Osterode, Germany | Epsilon 2-4 | |
| Heat inactivated Bombyx mori silk cocoons | Tajima Shoji, Kanagawa, Japan | N/A | |
| Hotplate with Stirrer | Bibby Scientific, Stanffordshire, UK | US 152 | |
| Incubator | Memmert, Schwabach, Germany | INB 200 | |
| Insulin, human recombinant, zinc solution | Thermo Scientific, Waltham, MA, USA | 12585-014 | |
| Lithium bromide | Acros Organics, Geel, Belgium | AC199870025 | |
| MDA-MB-231 | ATCC, Manassas, VA, U.S.A | N/A | |
| Micropipette and tips | Eppendorf, Hamburg, Germany | N/A | |
| Microplate Reader | Molecular devices, Sunnyvale, CA, USA | SpectraMax M5 | |
| Oak Ridge High-Speed Centrifuge Tubes, 50 ml | Thermo Scientific, Waltham, MA, USA | N/A | |
| Open-Top Thickwall Polycarbonate tube, 4 ml | Beckman Coulter, Brea, CA, USA | 355645 | |
| Penicilin/streptomycin | Thermo Scientific, Waltham, MA, USA | 15140-122 | |
| RPMI medium | Thermo Scientific, Waltham, MA, USA | 11875-093 | |
| Serological pipettes, 5 ml | Sigma-Aldrich, St. Louis, MO, USA | ||
| Silicon wafers | Agar Scientific, Essex, UK | G3391 | |
| Slide-A-Lyzer Dialysis cassettes, 3.5K MWCO, 15 ml | Thermo Scientific, Waltham, MA, USA | 87724 | |
| Sodium carbonate anhydrous | Fisher Scientific, Waltham, MA, USA | S/2840/62 | |
| Specimen stubs for SEM | Agar Scientific, Essex, UK | G301 | |
| Ultrasonic homogenizer | Bandelin, Berlin, Germany | Sonoplus HD 2070 | |
| UV transparent microplate, 96 well | Sigma-Aldrich, St. Louis, MO, USA | 3635 | |
| Vortex | IKA, Staufen, Germany | Genius 3 | |
| Zetasizer | Malvern Instrument, Worcestershire, UK | Nano ZS | |
| Zetasizer Software version 7.11 | DLS software | ||
| Micro Modulyo | Thermo Fisher | 230 | Freeze drying system |
References
- Haley, B., Frenkel, E. Nanoparticles for drug delivery in cancer treatment. Urol. Oncol. 26 (1), 57-64 (2008).
- Sun, T., Zhang, Y. S., Pang, B., Hyun, D. C., Yang, M., Xia, Y. Engineered nanoparticles for drug delivery in cancer therapy. Angew. Chem. Int. Ed. 53 (46), 12320-12364 (2014).
- Davis, M. E., Chen, Z. G., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nat. Rev. Drug Discov. 7 (9), 771-782 (2008).
- Sheridan, C. Proof of concept for next-generation nanoparticle drugs in humans. Nature Biotechnol. 30 (6), 471-473 (2012).
- Matsumura, Y., Hitoshi, M. A New Concept for Macromolecular Therapeutics in Cancer Chemotherapy: Mechanism of Tumoritropic Accumulation of Proteins and the Antitumor Agent Smancs. Cancer Res. 46, 6387 (1986).
- De Duve, C., De Barsy, T., Poole, B., Trouet, A., Tulkens, P., Van Hoof, F. Lysosomotropic agents. Biochem. Pharmacol. 23 (18), 2495-2531 (1974).
- Duncan, R., Richardson, S. C. W. Endocytosis and intracellular trafficking as gateways for nanomedicine delivery: opportunities and challenges. Mol. Pharm. 9 (9), 2380-2402 (2012).
- Vishakha, K., Kishor, B., Sudha, R. Natural Polymers - A Comprehensive Review. Int. J. Pharm. Biomed. Res. 3 (4), 1597-1613 (2012).
- Pritchard, E. M., Kaplan, D. L. Silk fibroin biomaterials for controlled release drug delivery. Expert. Opin. Drug Del. 8 (6), 797-811 (2011).
- Thurber, A. E., Omenetto, F. G., Kaplan, D. L. In vivo bioresponses to silk proteins. Biomaterials. 71, 145-157 (2015).
- Pritchard, E. M., Dennis, P. B., Omenetto, F., Naik, R. R., Kaplan, D. L. Physical and chemical aspects of stabilization of compounds in silk. Biopolymers. 97 (6), 479-498 (2012).
- Seib, F. P., Pritchard, E. M., Kaplan, D. L. Self-Assembling Doxorubicin Silk Hydrogels for the Focal Treatment of Primary Breast. Adv. Funct. Mater. 23 (1), 58-65 (2013).
- Seib, F. P., Kaplan, D. L. Doxorubicin-loaded silk films: drug-silk interactions and in vivo performance in human orthotopic breast cancer. Biomaterials. 33 (33), 8442-8450 (2012).
- Seib, F. P., Coburn, J., et al. Focal therapy of neuroblastoma using silk films to deliver kinase and chemotherapeutic agents in vivo. Acta. Biomater. 20, 32-38 (2015).
- Coburn, J. M., Na, E., Kaplan, D. L. Modulation of vincristine and doxorubicin binding and release from silk films. J. Control. Release. 220, 229-238 (2015).
- Seib, F. P., Jones, G. T., Rnjak-Kovacina, J., Lin, Y., Kaplan, D. L. pH-dependent anticancer drug release from silk nanoparticles. Adv. Healthc. Mater. 2 (12), 1606-1611 (2013).
- Wongpinyochit, T., Uhlmann, P., Urquhart, A. J., Seib, F. P. PEGylated Silk Nanoparticles for Anticancer Drug Delivery. Biomacromolecules. 16 (11), 3712-3722 (2015).
- Seib, F. P., Kaplan, D. L. Silk for Drug Delivery Applications: Opportunities and Challenges. Isr. J. Chem. 53 (9-10), 1-12 (2013).
- Yucel, T., Lovett, M. L., Kaplan, D. L. Silk-based biomaterials for sustained drug delivery. J. Control. Release. 190, 381-397 (2014).
- Wang, X., Yucel, T., Lu, Q., Hu, X., Kaplan, D. L. Silk nanospheres and microspheres from silk/pva blend films for drug delivery. Biomaterials. 31 (6), 1025-1035 (2010).
- Qu, J., Wang, L., Hu, Y., You, R., Li, M. Preparation of Silk Fibroin Microspheres and Its Cytocompatibility. J. Biomater. Nanobiotechnol. 4, 84-90 (2013).
- Lammel, A., Hu, X., Park, S., Kaplan, D., Scheibel, T. Controlling silk fibroin particle features for drug delivery. Biomaterials. 31 (16), 4583-4591 (2010).
- Gupta, V., Aseh, A., Rìos, C. N., Aggarwal, B. B., Mathur, A. B. Fabrication and characterization of silk fibroin-derived curcumin nanoparticles for cancer therapy. Int. J. Nanomedicine. 4, 115-122 (2009).
- Zhao, Z., et al. Generation of silk fibroin nanoparticles via solution-enhanced dispersion by supercritical CO2. Ind. Eng. Chem. Res. 52 (10), 3752-3761 (2013).
- Tudora, M., Zaharia, C., Stancu, I. Natural silk Fibroin micro-and nanoparticles with potential uses in drug delivery systems. U.P.B. Sci. Bull., Series B. 75 (1), 43-52 (2013).
- Zhao, Z., Li, Y., Xie, M. B. Silk Fibroin-Based Nanoparticles for Drug Delivery. Int. J. Mol. Sci. 16 (3), 4880-4903 (2015).
- Rockwood, D., Preda, R., Yücel, T. Materials fabrication from Bombyx mori silk fibroin. Nat. Protoc. 6 (10), 1-43 (2011).
- Seib, F. P., Müller, K., Franke, M., Grimmer, M., Bornhäuser, M., Werner, C. Engineered extracellular matrices modulate the expression profile and feeder properties of bone marrow-derived human multipotent mesenchymal stromal cells. Tissue. Eng. Part A. 15 (10), 3161-3171 (2009).
- Lai, P., Daear, W., Löbenberg, R., Prenner, E. J. Overview of the preparation of organic polymeric nanoparticles for drug delivery based on gelatine, chitosan, poly(d,l-lactide-co-glycolic acid) and polyalkylcyanoacrylate. Colloids Surf., B, Biointerfaces. 118, 154-163 (2014).
- Subia, B., Kundu, S. C. Drug loading and release on tumor cells using silk fibroin-albumin nanoparticles as carriers. Nanotechnology. 24 (3), 035103 (2013).
- Zhang, Y. Q., Shen, W. D., Xiang, R. L., Zhuge, L. J., Gao, W. J., Wang, W. B. Formation of silk fibroin nanoparticles in water-miscible organic solvent and their characterization. J. Nanopart. Res. 9 (5), 885-900 (2006).
- Jin, H. J., Kaplan, D. L. Mechanism of silk processing in insects and spiders. Nature. 424 (6952), 1057-1061 (2003).
- Yhr Bae, ., Park, K. Targeted drug delivery to tumors: myths, reality and possibility. J. Control. Release. 153 (3), 198-205 (2011).
- Lammel, A., Schwab, M., Hofer, M., Winter, G., Scheibel, T. Recombinant spider silk particles as drug delivery vehicles. Biomaterials. 32 (8), 2233-2240 (2011).
- Holliday, D. L., Speirs, V. Choosing the right cell line for breast cancer research. Breast. Cancer. Res. 13, 215 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved