A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إنتاج وبلورة وتحديد هيكل
In This Article
Summary
Proline-proline endopeptidase-1 (PPEP-1) is a secreted metalloprotease and promising drug-target from the human pathogen Clostridium difficile. Here we describe all methods necessary for the production and structure determination of this protein.
Abstract
New therapies are needed to treat Clostridium difficile infections that are a major threat to human health. The C. difficile metalloprotease PPEP-1 is a target for future development of inhibitors to decrease the virulence of the pathogen. To perform biophysical and structural characterization as well as inhibitor screening, large amounts of pure and active protein will be needed. We have developed a protocol for efficient production and purification of PPEP-1 by the use of E. coli as the expression host yielding sufficient amounts and purity of protein for crystallization and structure determination. Additionally, using microseeding, highly intergrown crystals of PPEP-1 can be grown to well-ordered crystals suitable for X-ray diffraction analysis. The methods could also be used to produce other recombinant proteins and to study the structures of other proteins producing intergrown crystals.
Introduction
المطثية العسيرة هي واحدة من الأسباب الرئيسية للنوسكميل المرتبطة المضادات الحيوية عدوى الإسهال 1. تنتقل هذه البكتيريا اللاهوائية إيجابية الجرام من خلال شكل بوغ لها عن طريق الفم برازي الطريق. في العقد الماضي، جديدة '' باء '' أو '' hypervirulent '' سلالات (على سبيل المثال BI / NAP1 / 027) تسبب في زيادة كبيرة في الإصابات الجديدة ومعدلات الوفيات في أمريكا الشمالية وأوروبا 2. جيم المرض -associated العسيرة (CDAD) هي التي تهدد الحياة التهاب القولون مع معدلات وفيات عالية 3. وتتراوح الأعراض من الإسهال 4 إلى التهاب القولون الغشائي الكاذب (5) وتضخم القولون السامة غالبا ما تكون قاتلة 6.
علاج CDAD صعبة كما سلالات ضراوة مقاومة للأدوية المتعددة ومعدل تكرار مرتفع 7. وفي يشمل العلاج اللحظة ميترونيدازول المضادات الحيوية، fidaxomicin أو فانكومايسين، أو في repetitiالحالات المتكررة vely البراز زرع الجراثيم. هناك حاجة ماسة إلى استراتيجيات علاجية جديدة 8. يتم تسجيل بعض التقدم كما العلاجية الأجسام المضادة وحيدة النسيلة بزلوتوكسوماب، تستهدف جيم السم العسيرة ب 9، مؤخرا اجتاز بنجاح المرحلة الثالثة من التجارب السريرية ورفعت للموافقة عليها مع ادارة الاغذية والعقاقير وEMA. بالإضافة إلى ذلك، يتم اختبار مضادات حيوية جديدة في الوقت الراهن في مراحل مختلفة من التجارب السريرية 10.
لتطوير علاج فعال يجب تحديد الأهداف العلاجية الجديدة. واكتشفت مؤخرا جيم ببتيداز داخلية-1 البروتيني العسيرة البرولين البرولين (PPEP-1؛ CD2830 / Zmp1، EC 3.4.24.89) مثل هذا الهدف واعد، وعدم وجود PPEP-1 في سلالة خروج المغلوب يقلل ضراوة C . صعب في الجسم الحي 11. PPEP-1 هو metalloprotease يفرز 12،13 الشق اثنين جيم adhesins صعب في اجتماعهم محطة سي 13 وبالتالي الإفراج عن bacter ملتصقةالجيش العراقي من ظهارة الأمعاء الإنسان. وبالتالي، فإنه يشارك في الحفاظ على التوازن بين النمط الظاهري لاطئة ومتحركة من جيم صعب. لتطوير مثبطات انتقائية ضد PPEP-1 وأن نفهم كيف أنها تعترف ركائز لها معرفة وثيقة من هيكلها ثلاثي الأبعاد أمر لا غنى عنه. لقد تمكنا من حل التركيب البلوري الأول من PPEP-1 وحده، وفي مجمع مع الببتيد الركيزة 14. PPEP-1 هو الأنزيم البروتيني الأولى المعروفة التي انتقائي يشق روابط الببتيد بين اثنين من مخلفات البرولين 15. فإنه يلزم الركيزة بطريقة مزدوجة متلوى واستقرار ذلك عن طريق شبكة الأليفاتية العطرية طويلة من المخلفات الموجودة في S-الحلقة التي تغطي الموقع البروتيني نشط 14. هذا الوضع ملزم الركيزة هي فريدة من نوعها لPPEP-1 والتي لا توجد في البروتياز الإنسان حتى الآن. وهذا ما يجعل منه هدفا المخدرات واعدة، وبعيدا عن الهدف آثار مثبطات المستبعد جدا.
لتطوير وشاشة انتقائية PPEP-1 يلعنهibitors في المستقبل هناك حاجة إلى كمية كبيرة من الذهب الخالص وmonodisperse PPEP-1 البروتين. وعلاوة على ذلك، لتحديد طريقة الربط من مثبطات الأولى، وهياكل التعاون وضوح الشمس مع PPEP-1 سوف يتعين تحديدها. في أيدينا PPEP-1 تنتج باستمرار بلورات intergrown. وهكذا وضعنا إجراء الأمثل لإنتاج بلورات واحدة ذات جودة حيود PPEP-1. في هذا البروتوكول وصفنا في التفاصيل الحل إنتاج وتنقية والبلورة وهيكل PPEP-1 14. نحن نستخدم تعبير الخلايا في القولونية من البديل PPEP-1 التي تفتقر إلى تسلسل إشارة إفراز، اللوني تقارب وحجم الإقصاء اللوني مع إزالة العلامة تنقية، تليها microseeding 16 إلى شاشة الأمثل وتحديد هيكل عبر الزنك والطول الموجي واحد تشتت الشاذة (والزنك SAD) 17. ويمكن تكييف هذا البروتوكول للإنتاج وهيكل تحديد البروتينات الأخرى (على سبيل المثال </ م> metalloproteases) وعلى وجه الخصوص للبروتينات ينتج بلورات intergrown. بناء على طلبها، DNA البلازميد للبناء (pET28a-NHIS-rPPEP-1) البيانات الحيود ويمكن توفير لأغراض تعليمية.
Protocol
1. الاستنساخ وإنشاء التصميم
- استنساخ تسلسل الأمثل كودون (لكولاي) من جيم صعب PPEP-1 بدون الببتيد إشارة [الأحماض الأمينية 27-220، واسمه المؤتلف الآخرة PPEP-1 (rPPEP-1) 11] في ناقلات pET28a باستخدام تجربة الاقتراب من الموت أنا وXho أنا تقييد مواقع (الشكل 1) مع رامزة توقف في (ناقلات الناتجة pET28a-NHIS-rPPEP-1) 3'نهاية. وهذا ينتج عنه N-عضال 6xHis الموسومة البروتين (NHIS-rPPEP-1) مع موقع الثرومبين الانقسام مما يسمح بإزالة علامة خلال تنقية (الشكل 1). يحتوي البلازميد الكاسيت المقاومة كانامايسين للاختيار. ووصف الاشعال المستخدمة في الاستنساخ في أي مكان آخر (14).
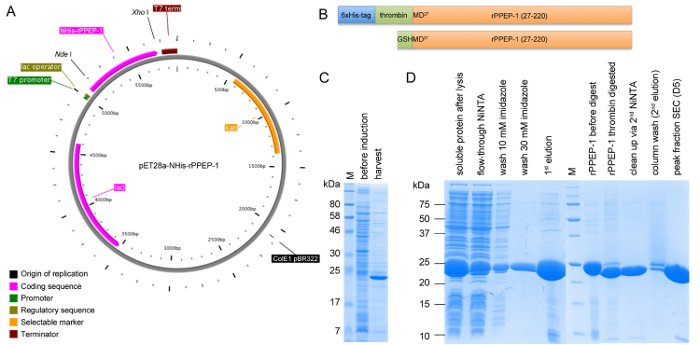
الشكل 1: تمثيل تخطيطي لبناء pET28a-NHIS-rPPEP-1 و SDS-PAGE تحليل expression وجميع الخطوات تنقية. (A) خريطة متجه من NHIS-rPPEP-1 المستنسخة في ناقلات pET28a باستخدام تجربة الاقتراب من الموت I / Xho أنا خلقت مع PlasMapper. (ب) تمثيل تخطيطي للNHIS-rPPEP-1 بناء (اللوحة العليا) وبناء النهائي بعد الثرومبين-انشقاق من 6xHis العلامة مع ما ينجم عن ذلك إضافي GSHM تسلسل في N-محطة (اللوحة السفلى). تحليل SDS-PAGE (C) للتعبير في BL21 (DE3) نجم عند 37 درجة مئوية لمدة 4 ساعات و (د) من عينات من جميع الخطوات تنقية (M: الوزن الجزيئي علامة). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
2. التعبير وتنقية rPPEP-1
- التعبير عن NHIS-rPPEP-1
- المكياج والأوتوكلاف LB (استذابة مرق) متوسطة (10 جرام / لتر تريبتون، 5 غرام / لتر خلاصة الخميرة، و 10 غرام / لتر كلوريد الصوديوم، adjuشارع إلى 7.5 درجة الحموضة مع هيدروكسيد الصوديوم). تكملة مع كبريتات كانامايسين (50 ميكروغرام / مل) قبل الاستخدام (LB / كان المتوسطة).
- تطعيم 200 مل الثقافة بين عشية وضحاها من تحول حديثا كولاي في LB / اساسه المتوسطة. تنمو بين عشية وضحاها في 37 درجة مئوية مع اهتزاز عند 220 دورة في الدقيقة.
- في صباح اليوم التالي، والتحقق من OD 600 (الكثافة البصرية في 600 نانومتر الطول الموجي) من الثقافة بين عشية وضحاها. تطعيم اثنين من 2.8 لتر حير قوارير تحتوي على 1 L LB / اساسه المتوسطة مع كل ثقافة بين عشية وضحاها إلى OD 600 من 0.1. تكملة مع ثلاث قطرات من مستحلب مائي من السيليكون لمنع تشكيل رغوة المفرط. زراعة خلايا في 37 درجة مئوية تهتز في 180 دورة في الدقيقة حتى OD 600 تصل إلى 0.6.
- أخذ عينة قبل الاستقراء لتحليل SDS-PAGE (ما يعادل 1 مل من ثقافة في OD 600 = 1)؛ إضافة IPTG إلى 0.5 التركيز النهائي ملي للحث على التعبير عن NHIS-rPPEP-1. مواصلة النمو عند 37 درجة مئوية / 180 دورة في الدقيقة لمدة 4 ساعة.
- تحديد 600 OD في 10X ديlution وأخذ عينة الحصاد (ما يعادل 1 مل من ثقافة في OD 600 = 1).
- جمع الخلايا بواسطة الطرد المركزي لمدة 20 دقيقة في 7000 x ج و 4 درجات مئوية. لإزالة المتبقية LB و resuspend المتوسط الكريات خلية من 1 لتر من الثقافة في 40 مل العازلة TBS (تريس مخزنة المالحة: 20 ملي تريس، حمض الهيدروكلوريك، ودرجة الحموضة 7.5، 200 مم كلوريد الصوديوم) ونقل إلى أنبوب الطرد المركزي 50 مل. جمع الخلايا بواسطة الطرد المركزي لمدة 10 دقيقة في 10000 x ج و 4 درجات مئوية، ومخزن في -80 درجة مئوية حتى الاستخدام. تحليل التعبير (مجموع لست] وكسور القابلة للذوبان) عن طريق SDS-PAGE 18.
- تنقية علامة عليه rPPEP-1
- أخذ 50 عينة ميكرولتر من كل خطوة تنقية للتحليل SDS-PAGE. Resuspend وبيليه خلية من 1 لتر من الثقافة في المخزن TBS تستكمل مع 10 ميكروغرام / مل DNaseI. استخدام 5 مل من TBS / DNaseI في غرام من الخلايا.
- ليز الخلايا عن طريق صوتنة على الجليد / المياه باستخدام 30٪ السعة لمدة 15 دقيقة (2 البقول ثانية مع وقفة 2 ثانية). إزالة الأنقاض من قبل الطرد المركزيifugation لمدة 10 دقيقة في 10000 x ج و 4 درجات مئوية، ونقل طاف لأنبوب نابذة. المحللة واضح في نابذة فائقة السرعة لمدة 30 دقيقة على 165000 x ج و 4 درجات مئوية.
- عمل في 4-6 درجة مئوية. باستخدام مضخة أو اللوني نظام تحوي تتوازن 2 مل من حمض (NiNTA) الراتنج والنيكل nitrilotriacetic في عمود الزجاج مع العازلة TBS تستكمل مع 10 ملي ايميدازول 7.5 درجة الحموضة. بدلا من ذلك، استخدم تدفق الجاذبية.
- ضبط المحللة تطهيرها مع 1 م ايميدازول درجة الحموضة 7.5 إلى تركيز النهائي من 10 ملم. تطبيق المحللة إلى العمود وغسل تدريجي مع العازلة TBS تستكمل مع 10 ملي و 30 ملي ايميدازول، على التوالي، حتى امتصاص الأشعة فوق البنفسجية في 280 نانومتر وصلت إلى خط الأساس.
- أزل البروتين مع العازلة TBS بالإضافة إلى 250 ملي ايميدازول. إعادة توازن العمود إلى TBS تستكمل مع 10 ملي ايميدازول وتخزينها بين عشية وضحاها.
- تحديد تركيز البروتين إما في 280 نانومتر باستخدام coeffi الانقراضcient من 25،900 م -1 سم -1 أو بأي وسيلة أخرى (مثل برادفورد طريقة 19). إضافة 2 وحدات من الثرومبين في ملغ من البروتين وdialyze الحل البروتين بين عشية وضحاها في 4 درجات مئوية مقابل حجم 50X من TBS (50X من حجم شطف NiNTA).
ملاحظة: خذ الفراغ الصحيح لتحديد تركيز البروتين، كما يمتص ايميدازول بقوة في 280 نانومتر. - تمرير الحل بروتين أكثر من الراتنج NiNTA معايرتها لإزالة البروتين uncleaved. المقبل، تطبيق نفس الحجم من TBS تستكمل مع 10 ملي ايميدازول إلى العمود لاسترداد جميع البروتين المشقوق. لتنظيف العمود، أزل كل ما تبقى من البروتين مع 250 ملي ايميدازول. تحليل العينات عن طريق SDS-PAGE (الشكل 1).
- التركيز على حل البروتين إلى 4 مل في 10 فترات دقيقة في 4000 x ج و 4 درجات مئوية باستخدام وحدة الترشيح الفائق الطرد المركزي. مزيج من البروتين التركيز بعد كل فاصل لمنع هطول الأمطار وتجميعها. في هذه الخطوة عرضيةلوحظ لاي بعض الأمطار لrPPEP-1 على الرغم من إجراء الاختلاط.
- تطبيق البروتين تتركز على عمود حجم الإقصاء اللوني قبل معايرتها (في المخزن TBS) في 4-6 درجة مئوية. أزل عمود مع العازلة TBS، وجمع 1 مل الكسور وتخضع 5 ميكرولتر من كل جزء الثاني لتحليل SDS-PAGE. rPPEP-1 elutes في ذروة واحدة المقابلة لمونومر (الشكل 2). أحيانا ذروة طفيفة في أكبر الوزن الجزيئي لوحظ (المواجه الذروة)، الذي يتوافق مع ديمر من البروتين. يجب أن يكون العائد حوالي 50 ملغ من البروتين النقي لكل لتر من الثقافة. تحليل جميع العينات عن طريق SDS-PAGE 18 (الشكل 2).
- أخذ 50 عينة ميكرولتر من كل خطوة تنقية للتحليل SDS-PAGE. Resuspend وبيليه خلية من 1 لتر من الثقافة في المخزن TBS تستكمل مع 10 ميكروغرام / مل DNaseI. استخدام 5 مل من TBS / DNaseI في غرام من الخلايا.
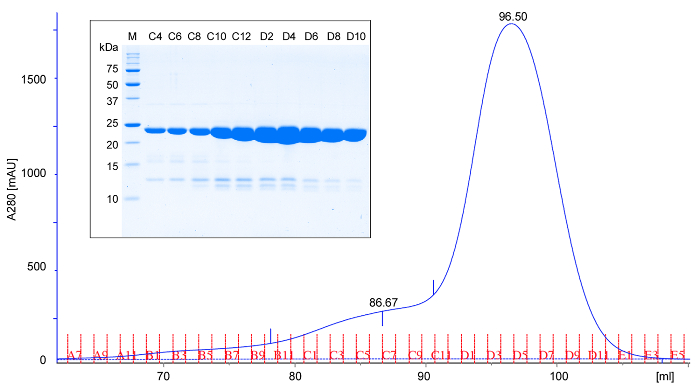
الشكل 2: الممثل اللوني حجم الإقصاء وSDS-PAGE تحليل rPPEP-1. اللوني حجم الاستبعاد (A280. الامتصاصية في 280 نانومتر) من تنقيته rPPEP-1 بلا علامات باستخدام 16/600) العمود (في تريس، حمض الهيدروكلوريك، ودرجة الحموضة 7.5، 200 مم كلوريد الصوديوم في 6 ° C. واستنادا إلى حجم شطف، rPPEP-1 يهاجر كما هو متوقع ل22 كيلو دالتون البروتين، مما يشير إلى أنه في الغالب أحادى. نادرا ما تظهر ذروة المواجهة طفيفة الذي يتوافق مع ديمر. (الشكل) تحليل SDS-PAGE من الكسور من اللوني استبعاد حجم (M، الوزن الجزيئي علامة). يتم تطبيق كل جزء الثاني. العصابات باهتة تحت rPPEP-1 الفرقة الرئيسية تتوافق مع التي تحدث في بعض الأحيان شوائب طفيفة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
3. بلورة وكريستال الأمثل عن طريق Microseeding
ملاحظة: rPPEP-1 يبلور من الظروف التي تنتج باستمرار بلورات intergrown للغاية لا تصلح للتحليل حيود الأشعة السينية (الشكل 3). لذلك، وضعت استراتيجية الأمثل (الشكل 4) للحصول على بلورات ذات جودة عالية (الشكل 5).
- الفحص الأولي من rPPEP-1 باستخدام الشاشات التجارية
ملاحظة: إجراء محاكمات تبلور في شكل قطرة يجلس باستخدام معيار شاشات متاحة تجاريا والروبوت التبلور.- تركيز البروتين النقي إلى 12 ملغ / مل باستخدام جهاز الترشيح الفائق الطرد المركزي في فترات 5 دقائق في 4000 x ج و 4 درجات مئوية. مزيج من البروتين التركيز بعد كل فاصل لمنع هطول الأمطار وتجميعها. تحديد تركيز البروتين إما في 280 نانومتر باستخدام معامل انقراض 25900 م -1 سم -1 أو بأي وسيلة أخرى (على سبيل المثال طريقة برادفورد). تتوازن البروتين إلى 20 درجة مئوية. ازالة جميع الجزيئات والغبار بواسطة الطرد المركزي لمدة 10 دقيقة في 16000 x ج و 20 درجة مئوية.
- إما استخدام لوحات تبلور بالفعل معبأة سلفا حد ذاتهاaled وتخزينها في 4 درجات مئوية أو ملء الآبار خزان لوحات مع 70 ميكرولتر من كل حالة التبلور. تتوازن جميع لوحات تبلور إلى 20 درجة مئوية. العمل بسرعة، حيث أن كميات صغيرة تجف بسرعة. استخدام غرفة الرطوبة حول قفص الاتهام لالروبوت، إذا أمكن ذلك.
ملاحظة: استخدام الشاشات التالية كإجراء القياسية: SaltRx، مؤشر، PEG / ايون، كريستال، معالج، باكت ++، JCSG ++. - إعداد الشاشة قبل pipetting البروتين وخزان في subwells 2-4. حجم الانخفاض هو 300 نيكولا لانغ والنسب (البروتين: الخزان) هي 200: 100 (subwell 2)، 150: 150 (subwell 3) و 100: 200 (subwell 4) (في هولندا). على الفور ختم لوحة وضعها في غرفة عند 20 درجة مئوية.
- تفقد الصواني فورا بعد مجموعة المتابعة، ومن ثم تفقد كل يوم خلال الأسبوع الأول تليها التفتيش الأسبوعية.
- شارك في بلورة rPPEP-1 مع بروابط
- للمشاركة في بلورة المجمعات الببتيد rPPEP-1 الركيزة مزيج rPPEP-1في 24 ملغ / مل في نسبة 1: 1 (ت / ت) مع وجود فائض المولي 7 أضعاف من حل الببتيد (AC-EVNPPVPD-NH 2) مسحوق مجفف بالتجميد بالفاعلات في المخزن TBS)، والتي سوف تعطي تركيز النهائي من 12 ملغ / مل ص-PPEP-1 البروتين وزيادة المولي 7 أضعاف من الببتيد على PPEP-1. احتضان لمدة 30 دقيقة عند 20 درجة مئوية وازالة جميع الجزيئات والغبار بواسطة الطرد المركزي لمدة 10 دقيقة في 16000 x ج و 20 درجة مئوية. المضي قدما في بلورة باستخدام الإجراء microseeding كما هو موضح في غير منضم ص-PPEP-1 البروتين.

الشكل (3): بلورات التمثيلية من الشاشات الأولية. بلورات Intergrown من rPPEP-1 في 12 ملغ / مل نمت في الشرط. (A) شاشة كريستال I / 38 (سيترات الصوديوم 1.4 M ثلاثي القواعد يذوى، 0.1 M HEPES الصوديوم 7.5 درجة الحموضة، 200 نيكولا لانغ: 100 نيكولا لانغ). (ب) SaltRx الشاشة / 52 (2.4 M فوسفات الأمونيوم بنك دبي الإسلاميأسيك، 0.1 M تريس درجة الحموضة 8.5. 100 نيكولا لانغ: 200 نيكولا لانغ) و (C) (200 نيكولا لانغ: 100 نيكولا لانغ). (D) SaltRx الشاشة / 96 (60٪ ت / ت Tacsimate الرقم الهيدروجيني 7.0، 0.1 M BIS-تريس البروبان 7.0 درجة الحموضة، 200 نيكولا لانغ: 100 نيكولا لانغ). شريط مقياس = 0.2 مم. نسب حجم دائما بروتين: الخزان. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
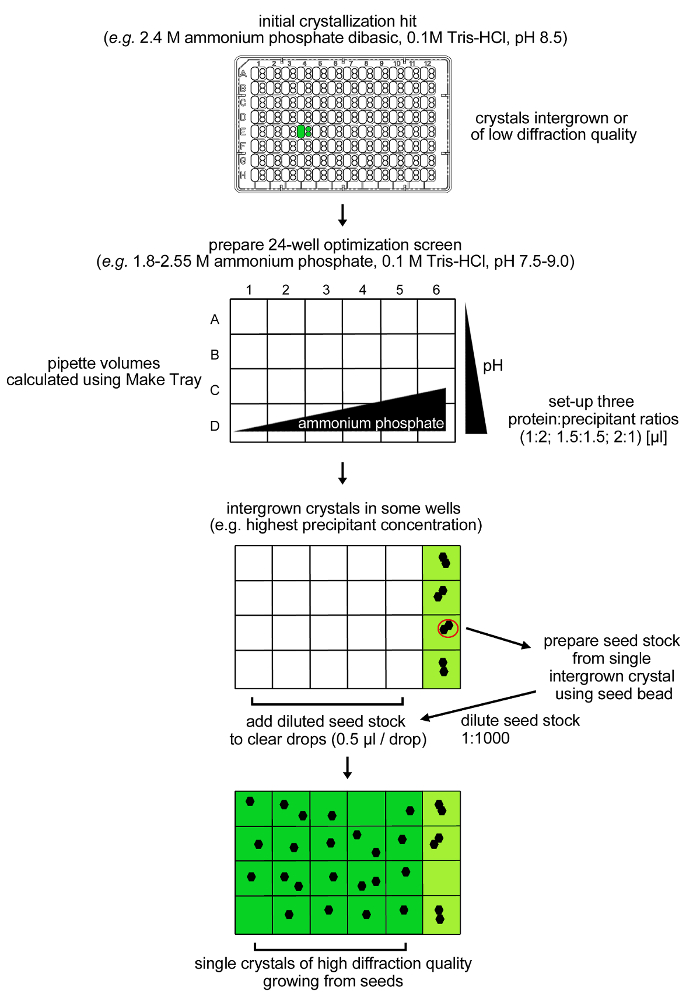
الشكل 4: الإجراء الأمثل لrPPEP-1 التبلور. استنسخت البلورات الأولية من rPPEP-1 في 12 ملغ / مل من تدني نوعية الحيود ومع العديد من السياج (intergrown) في شاشة الأمثل 24 حالة. مرة أخرى، لوحظ فقط بلورات intergrown في ظروف تحتوي على 2.55 M فوسفات الأمونيوم ثنائي القاعدة. وقد تم إعداد مخزون البذور من الكريستال intergrown واحدة والمخفف 1: 1000 في نفس كونديتأيون (microseeding). تم إضافة وحدة تخزين من 0.5 ميكرولتر من مخزون البذور مخففة في قطرات واضحة المتبقية ونما بلورات واحدة في كل الظروف تقريبا. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- الكريستال الأمثل باستخدام microseeding
ملاحظة: تظهر بلورات intergrown درجة عالية من rPPEP-1 بعد يومين في حالة تحتوي على 2.4 M فوسفات الأمونيوم ثنائي القاعدة، 0.1 M تريس، حمض الهيدروكلوريك، ودرجة الحموضة 8.5 (شاشة SaltRx، حالة E4، كل subwells ثلاثة) (الشكل 3). تم تطبيق إجراء الأمثل باستخدام شاشة شبكة حول الشرط الأولي جنبا إلى جنب مع microseeding (الشكل 4).- إعداد شاشة شبكة (الشكل 4) تضم 24 الأحوال مع 1،8 حتي 2،55 M فوسفات الأمونيوم ثنائي القاعدة (في خطوات 0.15 M) و 0.1 M تريس، حمض الهيدروكلوريك درجة الحموضة 7،5-9،0 (في الخطوات من 0.5 درجة الحموضة وحدات) من appropriحلول أكل الأوراق المالية (4 M فوسفات الأمونيوم و1 مخازن M تريس).
ملاحظة: استخدام علبة صغير جعل (http://hamptonresearch.com/make_tray.aspx) لحساب الكميات ومخطط pipetting لللحصول على 2 مل من كل الظروف التي تسمح لأداء 10 شاشات الأمثل. 4 M الأمونيوم حل سهم الفوسفات من الصعب للاستعداد. الحرارة الحل خلال اثارة بحل تماما المسحوق في الماء. - ماصة 200 ميكرولتر من كل حل شاشة الشبكة في الآبار من 24 لوحة جيدا وتتوازن عند 20 درجة مئوية.
- تعيين يدويا حتى لوحة التبلور. حجم الانخفاض 3 ميكرولتر والنسب (البروتين: الخزان) و2: 1، 1.5: 1.5 و 1: 2 (في ميكرولتر). هنا، واستخدام ماصة الإزاحة الإيجابية لتجنب تشكيل فقاعة الهواء. على الفور ختم لوحة وضعها في غرفة عند 20 درجة مئوية. تجنب تشكيل فقاعة الهواء.
ملاحظة: بعد 1-4 أيام تظهر بلورات intergrown غاية في الشروط الأربعة التي تحتوي على هواتف 2.55 M الأمونيومثنائي القاعدة sphate و 0.1 M تريس، حمض الهيدروكلوريك درجة الحموضة 7،5-9،0 (الشكل 4). تتشكل لا البلورات في 20 الشروط المتبقية مع تركيز فوسفات الأمونيوم أدناه 2.55 م ويستخدم هذا الإجراء microseeding للحصول على بلورات واحدة من rPPEP-1 في هذه الظروف. - إعداد المخزون microseed التي كتبها حصاد الكريستال intergrown واحد من واحد من شرطين مع 2.55 M الأمونيوم ثنائي القاعدة فوسفات و 0.1 M تريس، حمض الهيدروكلوريك 8.0 درجة الحموضة أو 8.5. يمكن أن تعلق على بلورات على سطح البلاستيك. تشوه حذرا من البلاستيك المحيطة بها مع إبرة الوخز بالإبر يساعد على فصل البلورات.
- نقل 50 ميكرولتر من المحلول الام منها في أنبوب 1.5 مل تحتوي على صغيرة حبة الزجاج مصقول للغاية (الخرز مقابل البذور). باستخدام حلقة النايلون شنت نقل وضوح الشمس في 1 ميكرولتر من المحلول الام وضعها على شريحة غطاء زجاجي.
- نقل السائل الذي يحتوي على وضوح الشمس في أنبوب والدوامة بسرعة عالية لمدة 30 ثانية. جعل 1:1000 التخفيف من مخزون البذور في أنبوب 1.5 مل جديد يحتوي على نفس الطازجة حالة ودوامة تماما لمدة 5 ثوان.
ويمكن تخزين مخزون البذور في -80 درجة مئوية لاستخدامها لاحقا: ملاحظة.
- إزالة ختم من لوحة تغطي الشروط 20 مع قطرات اضحة وماصة 0.5 ميكرولتر من مخزون البذور (1: 1000 تمييع) في الآبار. ختم لوحة وضعها في غرفة عند 20 درجة مئوية. تظهر البلورات واحدة من جودة عالية الحيود في 2-7 أيام (الشكل 5).
- إعداد شاشة شبكة (الشكل 4) تضم 24 الأحوال مع 1،8 حتي 2،55 M فوسفات الأمونيوم ثنائي القاعدة (في خطوات 0.15 M) و 0.1 M تريس، حمض الهيدروكلوريك درجة الحموضة 7،5-9،0 (في الخطوات من 0.5 درجة الحموضة وحدات) من appropriحلول أكل الأوراق المالية (4 M فوسفات الأمونيوم و1 مخازن M تريس).
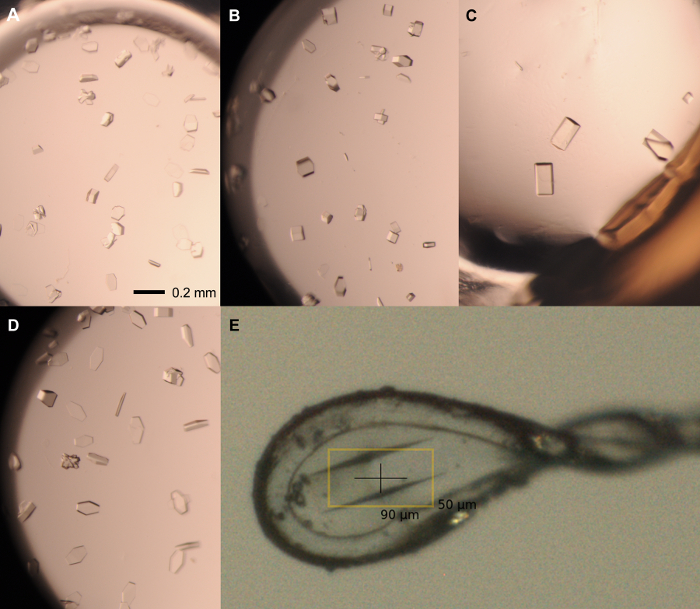
الرقم 5: بلورات التمثيلية من الشاشة الأمثل. بلورات واحدة من rPPEP-1 في 12 ملغ / مل المصنف مع 1: 1،000 التخفيف مخزون البذور التي تزرع في الحالات التالية: (أ) 2.1 M فوسفات الأمونيوم ثنائي القاعدة، 0.1 م تريس 7.5 درجة الحموضة. 1.5 ميكرولتر: 1.5 ميكرولتر. (ب) 2.1 M الأمونيوم ثنائي القاعدة فوسفات، 0.1 م تريس 7.5 درجة الحموضة. 2 ميكرولتر: 1 ميكرولتر. (C) 2.25 M فوسفات الأمونيوم ثنائي القاعدة، 0.1 M تريس الرقم الهيدروجيني 8؛ 2 ميكرولتر: 1 ميكرولتر. (D) 2.1 M فوسفات الأمونيوم ثنائي القاعدة، 0.1 M تريس الرقم الهيدروجيني 8؛ 1 ميكرولتر: 2 ميكرولتر. (E) الخيالة وضوح الشمس في 0.1-0.2 ميكرون حلقة من النايلون، ونمت في 2.1 M فوسفات الأمونيوم ثنائي القاعدة، 0.1 M تريس الرقم الهيدروجيني 8 (2 ميكرولتر: 1 ميكرولتر) والبرد المحمية في 2.1 M فوسفات الأمونيوم ثنائي القاعدة، 0.1 M تريس الرقم الهيدروجيني 8، 20٪ الجلسرين. شريط مقياس = 0.2 ملم في (م). حجم الحصة هي دائما بروتين: الخزان. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
4. مجموعة كريستال تصاعد والبيانات
ملاحظة: للحصول على أن يتم تنظيمها على أفضل نوعية من بلورات البيانات حيود في ذروة جودتها وحجمها. بلورات يمكن تخزينها في النيتروجين السائل حتى عالبريد تعرض لتحليل حيود الأشعة السينية في 100 ك. ولذلك، فإن حالة التي تنشأ يجب تعديلها لالبرد الظروف. يمكن rPPEP-1 البلورات يكون البرد التي تحميها إضافة إما الجلسرين 20٪ أو 30٪ سكروز (استبدال الماء في حالة من البرد حاصن).
- الكريستال تصاعد
ملاحظة: يجب أن يتم تنفيذ جميع الخطوات التلاعب الكريستال تحت مجهر تشريحي.- اختيار الحجم الأمثل للحلقة من النايلون لمدة القصوى من بلورات المختار. أطول محور نموذجية من rPPEP-1 بلورات حوالي 100-200 ميكرون (الشكل 5). إعداد شريحة الغطاء والبرد حالة المناسبة (على سبيل المثال 2.1 M فوسفات الأمونيوم ثنائي القاعدة، 0.1 M تريس، ودرجة الحموضة 8.0، 20٪ الجلسرين).
- ملء دوار رغوة مع النيتروجين السائل، تحميل المشبك قارورة مع قارورة وقبل تبريده في السائل مملوءة النيتروجين 800 مل رغوة ديوار. ضع كم البرد وحامل قصب البرد ملحوظ مع معرف مناسبةفي السائل مملوءة النيتروجين 2 لتر رغوة ديوار. تحميل عصا المغناطيسي مع حلقة من النايلون مثبتة.
ملاحظة: ارتداء الملابس الواقية (eyeshield / النظارات والقفازات) عند العمل مع النيتروجين السائل. انخفضت الأجسام الحارة في النيتروجين السائل قد تنتج البقع.
- ملء دوار رغوة مع النيتروجين السائل، تحميل المشبك قارورة مع قارورة وقبل تبريده في السائل مملوءة النيتروجين 800 مل رغوة ديوار. ضع كم البرد وحامل قصب البرد ملحوظ مع معرف مناسبةفي السائل مملوءة النيتروجين 2 لتر رغوة ديوار. تحميل عصا المغناطيسي مع حلقة من النايلون مثبتة.
- خفض فتح ختم الشريط مع مشرط حاد وإزالته مع ملقط. ماصة 1 ميكرولتر من البرد حالة على الشريحة الغطاء (أو بدلا من ذلك في بئر فارغة على نفس لوحة) وإزالة الكريستال من قطرة الصيد مع حلقة النايلون شنت (الشكل 5). بلورات المرفقة يمكن فصله بسهولة من الأرض عن طريق تشويه البلاستيكية المحيطة بها مع إبرة الوخز بالإبر.
- بسرعة نقل الكريستال إلى قطرة من البرد حالة والسماح لها تتوازن لمدة 1 ثانية. الأسماك وضوح الشمس في أسرع وقت ممكن ويغرق التجميد في النيتروجين السائل.
- عندما النيتروجين السائل حول الحلقة التي شنت توقف يغلي، ووضع حلقة في القارورة.ضع القارورة على حامل قصب البرد وعندما محملة 6 قوارير وضع كم البرد في جميع أنحاء حامل. تخزين بلورات في خزان مملوء النتروجين السائل حتى الاستخدام.
- اختيار الحجم الأمثل للحلقة من النايلون لمدة القصوى من بلورات المختار. أطول محور نموذجية من rPPEP-1 بلورات حوالي 100-200 ميكرون (الشكل 5). إعداد شريحة الغطاء والبرد حالة المناسبة (على سبيل المثال 2.1 M فوسفات الأمونيوم ثنائي القاعدة، 0.1 M تريس، ودرجة الحموضة 8.0، 20٪ الجلسرين).
- جمع البيانات
يمكن أن يتم جمع البيانات من على ديفراكتوميتر المنزل، إن وجدت، أو في خط الأشعة السنكروترون: ملاحظة. للجمعت-1 rPPEP البيانات على X06DA خط الأشعة من مصدر السويسري الخفيفة، بول شيرر، معهد، Villigen، سويسرا باستخدام العد كشف هجين الفوتون. يمكن توفير البيانات الأصلية وجميع الملفات المستخدمة في تصميم هيكل بناء على طلبها.- إعداد الطول الموجي للشعاع إلى 1.282 Å (9،667 كيلو)، والذي هو سمة الأشعة السينية الطاقة امتصاص حافة (الذروة) من عنصر الزنك. rPPEP-1 هو metalloprotease التي تحتوي على الزنك واحد لكل جزيء في موقع نشط.
- جمع البيانات في 100 ك في وضع معكوس شعاع في 10 ° أسافين ليصبح المجموع 270 درجة في كل directioن. وقت التعرض هو 0.1 ثانية مع 0.1 درجة دوران لكل صورة. تعيين انتقال إلى 14٪ (0.14).
- لجمع الأصلي عالية الدقة بيانات من الكريستال الثاني منشؤها من نفس الحالة بلورة إعداد الطول الموجي للشعاع إلى 1.00 Å (12،398 كيلو). جمع البيانات في 100 ك الساعة التعرض هو 0.1 ثانية مع 0.1 درجة دوران لكل صورة. تعيين إحالته إلى 70٪ (0.7).
5. هيكل تحديد عبر الزنك والصحراء
ملاحظة: من أجل تحديد هيكل rPPEP-1 عن طريق الزنك والصحراء هناك حاجة إلى بعض المعرفة البلورات الأساسية فضلا عن حزم البرمجيات XDS 20، فونيكس 21 وبرنامج الطير المائي 22. لرؤية الهياكل الحاجة للبرنامج PyMOL 23 أو الوهم 24. البيانات التي تم جمعها في الطول الموجي المقابلة إلى الذروة عند حافة امتصاص الزنك عنصر يمكن أن تستخدم لواحد الطول الموجي يمكن التخلص الشاذersion (SAD) 25 للحصول على المعلومات المرحلة التي يمكن أن تمتد لجميع ذرات البروتين.
- معالجة المعلومات
- معالجة اثنين من مجموعات البيانات الذروة (العادية ومعكوس) باستخدام برنامج XDS (بدلا من ذلك iMosflm أو HKL3000) في المجموعة الفراغية P2 1 2 1 2 1 (مجموعة الفضاء 19) فصل زملائه في فريدل في (بيانات الشاذة). يجب أن تكون المعلمات خلية وحدة في جميع أنحاء أ، ب، ج (أ) = 43.17، 71.68، 117.70 وα = β = γ (درجة) = 90. وهذا يعطي اثنين HKL ملفات (ملفات انعكاس).
- تفقد CORRECT.LP الملف. استخدام بيانات تصل إلى قرار فيه CC 1/2 هو 50٪ على الأقل. مقياس معا على حد سواء قواعد البيانات / الملفات تفكير (HKL ملفات) باستخدام معالج xscale. تفقد XSCALE.LP الملف. تحقق أي مدى تمتد إشارة الشاذة (SigAno) ولاحظ القرار مع وجود علاقة شاذة (Anomal كور) من حوالي 30٪، وهو 2 (أ) في حالة البيانات المستخدمة هنا تم جمعها إلى 1.67 Å. هذا القرار قطع للإشارة الشاذة المستخدمة في فونيكس AutoSol.
- تحويل (تحجيم) HKL ملف إلى ملف انعكاس CCP4 الشكل (المسمى، على سبيل المثال، peak_anom.mtz) باستخدام XDSCONV خلق فرعية R خالية من 5٪ والحفاظ على البيانات الشاذة (FRIEDEL'S_LAW = FALSE). تحقق من ملف MTZ للاتساق مع mtzdmp برنامج فحص المعلمات وحدة الخلية، ومجموعة الفضاء وجود فرعية مجانية R (التسمية FreeRflag) والبيانات الشاذة (تسميات DANO / SIGDANO). إعداد أيضا ملف MTZ إضافي مع XDSCONV دون استخراج البيانات الشاذة (FRIEDEL'S_LAW = صحيح، اسمه، على سبيل المثال، peak_native.mtz) لصقل في مرحلة لاحقة.
- حل التحتية (تقرير المرحلة)
- تشغيل فونيكس AutoSol باستخدام peak_anom.mtz ملف التفكير. اختر ص / ذروة MAD كنوع البيانات واختيار 2 مواقع الزنك (كما أن هناك نوعان من الجزيئات في وحدة غير متكافئة). اختيار إما من experi المزيد من الدقيقالقيم العقلية لو '/ و' 'المعلمات (تحدد في مسح مضان في خط الأشعة) أو القيم theotetical F' = -8.245 وو '' = 3.887. أيضا تحميل ملف FASTA تحتوي على تسلسل الأحماض الأمينية من البروتين المتبلور.
- تعيين الحد قرار إلى قرار مع وجود علاقة شاذة (Anomal كور) من حوالي 30٪ (تحدد في 5.1.2)، في هذا الحالة 2 وحدد الخيار "نموذج autobuild". باستخدام مراحل الموقعين الزنك وجدت من قبل فونيكس HySS (جزء من خط أنابيب فونيكس AutoSol) يمكن استنتاج مراحل للبروتين كاملة ونموذج بنى (عن طريق فونيكس حل) في كثافة الإلكترونات. ويطلق على أفضل نموذج "overall_best.pdb".
- بناء نموذج، والصقل والتحقق من صحة
- حدد الخيار "نموذج autobuild" لبناء أكثر من نموذج rPPEP-1 تلقائيا. تفقد كثافة الإلكترونات عند 1.0 σ مستوى كفاف باستخدام PROGRAم الطير المائي (الشكل 6). وينبغي أن يكون الضام وتحاصر ذرات النموذج. ومن الناحية المثالية ينبغي أيضا بناء بعض جزيئات الماء في نموذج (في قرار أفضل من 2.5 Å). يجب أن يحتوي على كميات كبيرة من المياه (المسافة بين الجزيئات) أي كثافة.
- تحقق مما إذا كان نموذج كله كاملة (جميع الأحماض الأمينية في صلب كثافة الإلكترونات). إن لم يكن، وبناء عليها يدويا باستخدام الأدوات التي توفرها الطير المائي. حدد الهيكل عن طريق تشغيل جولات متكررة من فونيكس حدث مع 5 صقل جولات كل باستخدام ملف نموذج overall_best.pdb، ملف peak_native.mtz انعكاس وملف تسلسل FASTA. واليدوي بناء نموذج في الطير المائي.
- التحقق من نوعية النموذج الهيكلي بالأدوات منها في الطير المائي.
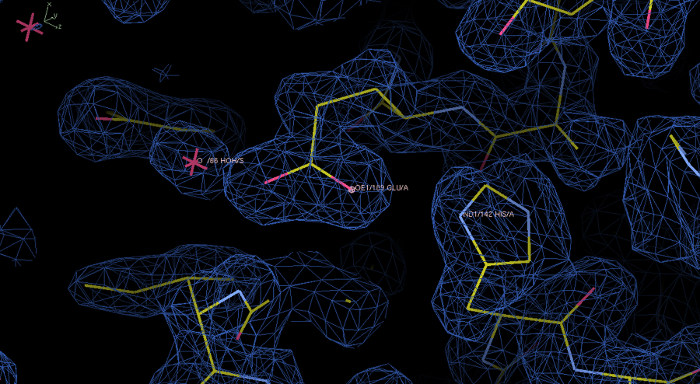
الشكل 6: التجريبية خريطة كثافة الإلكترونات وطراز rPPEP-1 بعدفونيكس Autosol تشغيل. كثافة الإلكترون باللون الأزرق على مستوى كفاف من 1.0 σ المعروضة في الطير المائي البرنامج. في هذه الخريطة الأولية يتم حل كثافة الإلكترونات بشكل رائع ونموذج بناء في كثافة الإلكترونات. يظهر في التكبير بقايا His142 وGlu189، فضلا عن جزيء الماء. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
6. هيكل العزم على قرار عالية عبر استبدال الجزيئية
ملاحظة: من أجل الحصول عالية الدقة من المعلومات حول هيكلية rPPEP-1 مجموعة البيانات الأصلية التي يتم جمعها. ثم يتم توظيف إجراء استبدال الجزيئي باستخدام 26،27 البرامج فيزر (ضمن حزمة البرامج فونيكس) باستخدام هيكل تحدد عن طريق الزنك SAD كنموذج. هذا الإجراء يمكن أن تستخدم أيضا في وقت لاحق عندما حل هياكل rPPEP-1 المعقد مع جزيئات صغيرة.
- للحصول على التركيب البلوري مع دقة أعلى (في هذه الحالة تصل إلى 1.4 Å) معالجة بيانات الأصلي باستخدام برنامج XDS (بدلا من ذلك iMosflm أو HKL3000) في المجموعة الفراغية P2 1 2 1 2 1 (مجموعة الفضاء 19). يجب أن تكون المعلمات خلية وحدة في جميع أنحاء أ، ب، ج (أ) = 43.17، 71.77، 117.80 وα = β = γ (درجة) = 90. وهذا يعطي واحد HKL ملفات (ملف انعكاس).
- تفقد CORRECT.LP الملف. استخدام بيانات تصل إلى قرار فيه CC 1/2 هو 50٪ على الأقل. تحويل ملف HKL في ملف انعكاس CCP4 الشكل (المسمى، على سبيل المثال، native.mtz) باستخدام XDSCONV خلق فرعية R خالية من 5٪. تحقق من ملف MTZ للاتساق مع mtzdmp برنامج فحص المعلمات خلية وحدة، مجموعة الفضاء وجود R فرعية مجانية (التسمية FreeRflag).
- إعداد PDB ملف يحتوي على نموذج من overall_best.pdb تحديدها في وقت سابق، وإزالة جميع جزيئات الماء وجميع بروابط (أي. ذرة الزنك). أيضا تحميل ملف FASTA تحتوي على تسلسل الأحماض الأمينية من البروتين المتبلور. تشغيل طابعة Phaser في فونيكس باستخدام native.mtz ملف التفكير. البحث عن جزيئين لكل وحدة غير متكافئة.
- بعد نجاح الحل هيكل (TFZ-درجة أكبر من 8، وهنا 10.2) تفقد نموذج (يسمى native_phaser.1.pdb) وخريطة كثافة الإلكترونات في الطير المائي. بناء وصقل هيكل عن طريق تشغيل جولات متكررة من فونيكس حدث مع 5 صقل جولات كل باستخدام ملف نموذج native_phaser.1.pdb، ملف انعكاس native.mtz وملف تسلسل FASTA. واليدوي بناء نموذج في الطير المائي.
- التحقق من نوعية النموذج الهيكلي بالأدوات منها في الطير المائي.
النتائج
هى overexpressed rPPEP-1 في العديد من سلالات كولاي، مع أعلى عائد في كولاي BL21 (DE3) نجم (الشكل 1C). بعد أول NiNTA خطوة تقارب اللوني و6xHis العلامة يمكن المشقوق بنجاح خارج من أكثر من البروتين وفي خطوة NiNTA الثانية بروتين غير مهضوم يمكن فصلها تماما عن هضم ...
Discussion
الأشعة السينية البلورات لا تزال هي الطريقة الأسرع والأكثر دقة لتحديد الهياكل قرار بالقرب الذرية ثلاثية الأبعاد للبروتينات 28. ومع ذلك، فإنه يتطلب نمو البلورات واحدة امر جيد. هذه غالبا ما تكون صعبة للحصول على والدولة البلورية هي مصطنعة. ومع ذلك، فإن المقارنة بين...
Disclosures
The authors have nothing to disclose.
Acknowledgements
ونحن نشكر الموظفين في X06DA خط الأشعة في المصدر السويسري الخفيفة، بول شيرر، معهد، Villigen، سويسرا للحصول على دعم خلال جمع البيانات السنكروترون. ونحن ممتنون لمونيكا غومبرت حصول على الدعم الفني الممتاز. تم دعم المشروع من قبل جامعة كولونيا ومنح INST 216 / 682-1 FUGG من مجلس البحوث الألمانية. ومن المسلم به زمالة الدكتوراه من كلية الدراسات العليا الدولية في الصحة التنمية ومرض لCP. تلقت البحوث المؤدية إلى هذه النتائج بتمويل من برنامج الإطار السابع للجماعة الأوروبية (FP7 / 2007-2013) بموجب اتفاقية منحة رقم 283570 (BioStruct-X).
Materials
| Name | Company | Catalog Number | Comments |
| Genes / Vectors / cell strains | |||
| pET28a vector | Merck-Millipore | 69864 | Thrombin cleavable N-terminal His-tag |
| E. coli strain BL21 (DE3) Star | ThermoFisher Scientific | C601003 | RNase H deficient |
| Codon-optimized gene (for E. coli) of PPEP-1 (CD630_28300) | Geneart (Thermo Fisher Scientific) | custom | amino acids 27-220 |
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Yeast extract | any | ||
| Tryptone | any | ||
| Antifoam B | Sigma-Aldrich | A5757 | aqueous-silicone emulsion |
| Agar | any | ||
| Kanamycin | any | ||
| IPTG | AppliChem | A1008 | |
| Tris-HCl | AppliChem | A1087 | Buffer grade |
| NaCl | any | Buffer grade | |
| DNaseI | AppliChem | A3778 | |
| Imidazole | AppliChem | A1073 | Buffer grade |
| Thrombin | Sigma-Aldrich | T4648 | |
| Ammonium phosphate dibasic | Sigma-Aldrich | 215996 | |
| Glycerol 100% | any | purest grade | |
| Sucrose | Sigma-Aldrich | 84097 | |
| Liquid nitrogen | any | for storage and cryocooling of crystals | |
| Name | Company | Catalog Number | Comments |
| Equipment (general) | |||
| Shaking incubator | any | providing temperatures of 20 °C - 37 °C | |
| Glassware | any | baffled Erlenmeyer flasks (50 ml - 2.8 L) | |
| Centrifuge for large culture volumes | any | centrifuge for processing volumes up to 12 L | |
| Sonicator Vibra-Cell VCX500 | Sonics | SO-VCX500 | or any other sonicator / cell disruptor |
| Ultracentrifuge | any | centrifuge providing speeds up to 150,000 x g | |
| NiNTA Superflow resin | Qiagen | ||
| Empty Glass Econo-Column | Bio-Rad | 7371007 | or any other empty glass or plastic column |
| Size exclusion chromatography column HiLoad Superdex 200 16/600 | GE Healthcare | 28989335 | |
| Chromatography system Äkta Purifier | GE Healthcare | 28406264 | or any other chromatography system |
| Dialysis tubing Spectra/Por 3 | Spectrum Labs | 132724 | |
| Dialysis tubing closures | Spectrum Labs | 132738 | |
| Ultrafiltration units (concentrators) 10,000 NWCO | any | ||
| UV-Vis spectrophotometer | any | ||
| Name | Company | Catalog Number | Comments |
| Equipment (crystallography) | |||
| Low volume pipette 0.1-10 µl | any | ||
| Positive displacement pipette Microman M10 | Gilson | F148501 | |
| Crystallization robot | any | ||
| 96-well crystallization plates TTP IQ with three protein wells | TTP | 4150-05810 | or any other 96-well crystallization plate |
| 24-well CombiClover Junior Plate | Jena Bioscience | EB-CJR | |
| Crystal Clear Sealing Tape | Hampton Research | HR3-511 | |
| Siliconized Glass Cover Slides | Hampton Research | HR3-225 | |
| Commercial crystallization screens: SaltRx, Index, PEG/Ion, Crystal | Hampton Research | diverse | |
| Commercial crystallization screens: Wizard, PACT++, JCSG++ | Jena Bioscience | diverse | |
| JBS Beads-for-Seeds | Jena Bioscience | CO-501 | |
| CrystalCap SPINE HT (nylon loops) | Hampton Research | diverse | loop sizes 0.025 mm - 0.5 mm |
| CrystalCap Vial | Hampton Research | HR4-904 | |
| Cryogenic Foam Dewar 800 ml | Hampton Research | HR4-673 | |
| Cryogenic Foam Dewar 2 L | Hampton Research | HR4-675 | |
| Vial Clamp, Straight | Hampton Research | HR4-670 | |
| CrystalWand Magnetic, Straight | Hampton Research | HR4-729 | |
| CryoCane 6 Vial Holder | Hampton Research | HR4-711 | |
| CryoSleeve | Hampton Research | HR4-708 | |
| CryoCane Color Coder - White | Hampton Research | HR4-713 | |
| Scalpel | any | ||
| Straight microforcep | any | for manipulation of sealing tape. etc. | |
| Acupuncture needle | any | e.g. from a pharmacy | |
| Stereo microscope | any | for inspection of crystallization plates and crystal mounting, magnification up to 160X |
References
- Bouza, E. Consequences of Clostridium difficile infection: understanding the healthcare burden. Clin Microbiol Infect. 18 (Suppl 6), 5-12 (2012).
- O'Connor, J. R., Johnson, S., Gerding, D. N. Clostridium difficile infection caused by the epidemic BI/NAP1/027 strain. Gastroenterology. 136 (6), 1913-1924 (2009).
- Mitchell, B. G., Gardner, A. Mortality and Clostridium difficile infection: a review. Antimicrob Resist Infect Control. 1 (1), (2012).
- George, W. L., Sutter, V. L., Finegold, S. M. Antimicrobial agent-induced diarrhea--a bacterial disease. J Infect Dis. 136 (6), 822-828 (1977).
- George, R. H., et al. Identification of Clostridium difficile as a cause of pseudomembranous colitis. Br Med J. 1 (6114), 695 (1978).
- Bartlett, J. G. Narrative review: the new epidemic of Clostridium difficile-associated enteric disease. Ann Intern Med. 145 (10), 758-764 (2006).
- Kelly, C. P., LaMont, J. T. Clostridium difficile--more difficult than ever. N Engl J Med. 359 (18), 1932-1940 (2008).
- Ünal, C. M., Steinert, M. Novel therapeutic strategies for Clostridium difficile infections. Expert Opin Ther Targets. 20 (3), 269-285 (2016).
- Kelly, C. P., et al. The Monoclonal Antibody, Bezlotoxumab Targeting C. difficile Toxin B Shows Efficacy in Preventing Recurrent C. difficile Infection (CDI) in Patients at High Risk of Recurrence or of CDI-Related Adverse Outcomes. Gastroenterology. 150 (4), S122 (2016).
- Tsutsumi, L. S., Owusu, Y. B., Hurdle, J. G., Sun, D. Progress in the discovery of treatments for C. difficile infection: A clinical and medicinal chemistry review. Curr Top Med Chem. 14 (1), 152-175 (2014).
- Hensbergen, P. J., et al. Clostridium difficile secreted Pro-Pro endopeptidase PPEP-1 (ZMP1/CD2830) modulates adhesion through cleavage of the collagen binding protein CD2831. FEBS Lett. 589 (24), 3952-3958 (2015).
- Cafardi, V., et al. Identification of a novel zinc metalloprotease through a global analysis of Clostridium difficile extracellular proteins. PLoS One. 8 (11), e81306 (2013).
- Hensbergen, P. J., et al. A novel secreted metalloprotease (CD2830) from Clostridium difficile cleaves specific proline sequences in LPXTG cell surface proteins. Mol Cell Proteomics. 13 (5), 1231-1244 (2014).
- Schacherl, M., Pichlo, C., Neundorf, I., Baumann, U. Structural Basis of Proline-Proline Peptide Bond Specificity of the Metalloprotease Zmp1 Implicated in Motility of Clostridium difficile. Structure. 23 (9), 1632-1642 (2015).
- Rawlings, N. D., Waller, M., Barrett, A. J., Bateman, A. MEROPS: the database of proteolytic enzymes, their substrates and inhibitors. Nucleic Acids Res. 42 (Release 10.0), D503-D509 (2014).
- Bergfors, T. Seeds to crystals. J Struct Biol. 142 (1), 66-76 (2003).
- Dauter, Z., Dauter, M., Dodson, E. Jolly SAD. Acta Crystallogr D Biol Crystallogr. 58 (Pt 3), 494-506 (2002).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Kabsch, W. XDS. Acta Crystallogr D Biol Crystallogr. 66 (Pt 2), 125-132 (2010).
- Adams, P. D., et al. PHENIX: a comprehensive Python-based system for macromolecular structure solution. Acta Crystallogr D Biol Crystallogr. 66, 213-221 (2010).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallogr D Biol Crystallogr. 66 (Pt 4), 486-501 (2010).
- . . The PyMOL Molecular Graphics System. , (2002).
- Pettersen, E. F., et al. UCSF Chimera--a visualization system for exploratory research and analysis. J Comput Chem. 25 (13), 1605-1612 (2004).
- Wang, B. C. Resolution of phase ambiguity in macromolecular crystallography. Methods Enzymol. 115, 90-112 (1985).
- McCoy, A. J., Grosse-Kunstleve, R. W., Adams, P. D., Winn, M. D., Storoni, L. C., Read, R. J. Phaser crystallographic software. J Appl Crystallogr. 40 (Pt 4), 658-674 (2007).
- Zwart, P. H., et al. Automated structure solution with the PHENIX suite. Methods Mol Biol. 426, 419-435 (2008).
- Zheng, H., Handing, K. B., Zimmerman, M. D., Shabalin, I. G., Almo, S. C., Minor, W. X-ray crystallography over the past decade for novel drug discovery - where are we heading next?. Expert Opin Drug Discov. 10 (9), 975-989 (2015).
- Rubino, J. T., et al. Structural characterization of zinc-bound Zmp1, a zinc-dependent metalloprotease secreted by Clostridium difficile. J Biol Inorg Chem. 21 (2), 185-196 (2016).
- Carson, M., Johnson, D. H., McDonald, H., Brouillette, C., Delucas, L. J. His-tag impact on structure. Acta Crystallogr D Biol Crystallogr. 63 (Pt 3), 295-301 (2007).
- Gasteiger, E., Walker, J. M., et al. Protein Identification and Analysis Tools on the ExPASy Server. The Proteomics Protocols Handbook. , 571-607 (2005).
- Dummler, A., Lawrence, A. M., de Marco, A. Simplified screening for the detection of soluble fusion constructs expressed in E. coli using a modular set of vectors. Microb Cell Fact. 4, 34 (2005).
- Stura, E. A., Wilson, I. A. Applications of the streak seeding technique in protein crystallization. J Crys Growth. 110 (1), 270-282 (1991).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved