Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Üretim, Kristalleşme ve Yapı Tayini ve
Bu Makalede
Özet
Proline-proline endopeptidase-1 (PPEP-1) is a secreted metalloprotease and promising drug-target from the human pathogen Clostridium difficile. Here we describe all methods necessary for the production and structure determination of this protein.
Özet
New therapies are needed to treat Clostridium difficile infections that are a major threat to human health. The C. difficile metalloprotease PPEP-1 is a target for future development of inhibitors to decrease the virulence of the pathogen. To perform biophysical and structural characterization as well as inhibitor screening, large amounts of pure and active protein will be needed. We have developed a protocol for efficient production and purification of PPEP-1 by the use of E. coli as the expression host yielding sufficient amounts and purity of protein for crystallization and structure determination. Additionally, using microseeding, highly intergrown crystals of PPEP-1 can be grown to well-ordered crystals suitable for X-ray diffraction analysis. The methods could also be used to produce other recombinant proteins and to study the structures of other proteins producing intergrown crystals.
Giriş
Clostridium difficile, hastane antibiyotik ilişkili ishal enfeksiyonlarının 1 en önemli nedenlerinden biridir. Bu Gram-pozitif anaerobik bakteri dışkı-ağız yolu ile kendi spor formu yoluyla bulaşır. Son on yılda, yeni '' salgın '' ya da '' hipervirülan 'suşları (/ 027 örneğin BI / NAP1) Kuzey Amerika ve Avrupa'da 2 yeni enfeksiyonların ve ölüm oranlarında ciddi bir artışa neden olmuştur. C. difficile -associated hastalığı (CDAD) yüksek ölüm oranları 3 ile hayatı tehdit eden kolon iltihabıdır. Belirtiler ishal 4'ten psödomembranöz kolit 5 ve genellikle ölümcül zehirli megakolon 6 arasında değişir.
Öldürücü suşlar Çok ilaca dirençli ve nüks oranı 7 yüksek olduğu gibi CDAD tedavisi zordur. anı tedavisi antibiyotikler metronidazol, fidaxomicin ya da vankomisin veya repetiti olarak içeren enf tekrarlayan olgular dışkı Mikrobiyota nakli. Yeni tedavi stratejileri acilen 8 ihtiyaç vardır. Bazı ilerlemeler C. difficile toksin B 9 hedefleyen terapötik monoklonal antikor Bezlotoxumab olarak kaydedilir, son zamanlarda başarılı bir faz III klinik çalışmalarda geçti ve FDA ve EMA ile onay için açılmıştı. Ek olarak, yeni antibiyotikler klinik çalışmalarda 10 farklı aşamalarında anda denenmektedir.
yeni tedavi hedefleri belirlenmelidir etkili bir tedavi geliştirmek. (; CD2830 / Zmp1; PPEP-1 EC 3.4.24.89), C. difficile proteaz prolin-prolin endopeptidaz-1 keşfedilen bir knock-out suşunda PPEP-1 eksikliği gibi umut verici bir hedef olduğunu, C hastalık oluşturma azalır ., in vivo 11 difficile. PPEP-1 de C-terminalinde iki tane C. difficile adezinleri yaran bir salgılanmış metaloproteaz 12,13 olan 13 ve böylece yapışık Bacter serbestİnsan bağırsak epitelinden ia. Bu nedenle, C. difficile sesil ve hareketli fenotip arasındaki dengeyi koruyarak yer almaktadır. PPEP-1'e karşı seçici inhibitörlerinin geliştirilmesi ve onun yüzeyler üç boyutlu yapının samimi bilgi vazgeçilmez olduğunu tanır anlamak. Bir alt-tabaka peptidi 14 PPEP-1 tek başına veya karmaşık ilk kristal yapışım çözdük. PPEP-1 ilk olarak bilinen proteaz, iki prolin kalıntıları 15 ila seçimli olarak böler peptid bağlar. Bu çift bükülmüş bir şekilde alt-tabakanın bağlanır ve proteaz aktif mevki 14 kapsar S döngüsünde yer alan tortuların uzun bir alifatik-aromatik ağ aracılığıyla stabilize eder. Bu alt-tabaka bağlanma modu PPEP-1'e özgü olan ve bugüne kadar, insan proteazlar bulunamadı. Bu umut verici bir ilaç hedef haline getirir ve çok olası inhibitörlerinin hedef dışı etkileri.
Ekran seçici PPEP-1 inh geliştirmek veibitors gelecek saf ve tek dağılımlı PPEP-1 proteininin büyük bir miktarı gereklidir. Bundan başka, tespit edilmesi gerekir PPEP-1 ilk önleyicileri, ko-kristal yapıları bağlanmasının modunu belirler. Bizim ellerde PPEP-1 sürekli iç içe gelişmiş kristaller üretir. Böylece PPEP-1 tek sapması kalitede kristaller üretmek için bir optimizasyon yöntemi geliştirmişlerdir. Bu protokolde, ayrıntılı PPEP-1 14 üretimi, saflaştırma, kristalleştirme ve Yapı çözümü tarif etmektedir. Bu salgılama sinyal dizisi, saflaştırma işareti kaldırılması ile afinite kromatografisi ve boyut çıkarma kromatografisine eksik PPEP-1 varyantın Escherichia coli hücre içi ifade kullanmak, çinko tek dalga boyu anormal dağılma vasıtasıyla bir optimizasyon ekran ve yapı belirlenmesi halinde 16 mikro-tohumlama ardından (çinko-SAD) 17. Bu protokol, (diğer proteinlerin üretimi ve yapı tayini için uyarlanabilir, örneğin </ Em> metaloproteazlar) ile iç içe gelişmiş kristallerinin üretilmesi proteinler için, özellikle de. İstek üzerine, yapının DNA (pET28a-USES-rPPEP-1) ve difraksiyon verileri, eğitim amacıyla temin edilebilir.
Protokol
1. Klonlama ve Tasarım Construct
- Sinyal peptidi olmaksızın C. difficile PPEP-1 (E. coli için) kodon optimize edilmiş diziyi klonu [amino asitler 27-220, buradan sonra yeniden birleştirici PPEP-1 isimli (rPPEP-1) 11] Nde I ile pET28a vektöre ve Xho I kısıtlama sahaları, 3'-ucuna (elde edilen vektör pET28a-USES-rPPEP-1) bir durdurma kodonu ile (Şekil 1). Bu arıtma sırasında etiketi çıkarma sağlayan bir trombin ayrılma sitesinin (Şekil 1), bir N-terminal 6xHis etiketli protein (USES-rPPEP-1) üretir. Plazmid seçimi için bir kanamisin direnç kasetini içermektedir. Klonlama için kullanılan primerler başka 14 tarif edilmiştir.
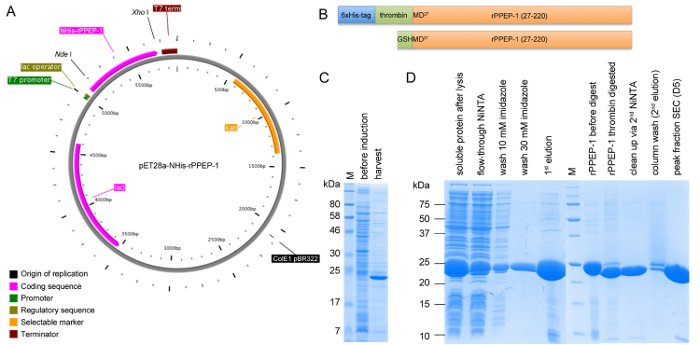
Şekil 1: Expre arasında yapı pET28a-USES-rPPEP-1 ve SDS-PAGE analizi şematik temsilisalgılanması ve saflaştırma adımları. USES-rPPEP-1 (A), vektör haritası I PlasMapper ile oluşturulan Nde / Xhol kullanılarak pET28a vektörü içine klonlandı. (B) USES-rPPEP-1 yapısı (üst panel) şematik gösterimi ve N-terminali (alt panel) de elde edilen ek GSHM-dizisi ile 6xHis etiketi trombin bölünme sonra nihai yapısı. Tüm saflaştırma işlemleri, (: moleküler ağırlık işaretleyici M) 4 saat ve örnekler (D) 37 ° C 'de, BL21 (DE3) yıldız ifade SDS-PAGE analizi (C). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
2. ekspresyonu ve rPPEP-1 saflaştırılması
- USES-rPPEP-1 ekspresyonu
- Makyaj ve otoklav LB (lizojeni suyu) ortamı (10 g / L tripton, 5 g / L maya ekstresi, 10 g / L NaCl, Adjust) NaOH ile 7.5 pH'a için. kanamisin sülfat (50 mg / ml), sadece kullanım (LB / Kan ortamı) daha önce birlikte tamamlayın.
- LB / kan ortamı taze transforme edilen E. coli 200 ml'lik bir gece boyunca bir kültürü inoküle. 220 rpm'de çalkalanarak 37 ° C'de gece boyunca büyütün.
- Sonraki sabah, gece boyunca kültürün OD 600 (600 nm dalga boyunda optik yoğunluk) kontrol edin. İki 2.8 L bir OD 0.1 600 gecede kültürü ile 1 L LB / Kan orta her içeren şişeler şaşırmış aşılamak. Aşırı köpük oluşumunu önlemek için sulu-silikon emülsiyonu üç damla ile tamamlayın. 600 0,6 ulaşana OD kadar 180 rpm'de çalkalanarak 37 ° C'de hücreler büyütün.
- SDS-PAGE analizi için ön indüksiyonlu örneği alın (OD 600 kültüründen 1 ml'lik eş = 1); USES-rPPEP-1 ekspresyonunu başlatmak için 0.5 mM nihai bir konsantrasyona kadar IPTG ilave edin. 4 saat 37 ° C / 180 rpm'de büyümeye devam.
- 10x di OD 600 belirleyindökülmesinden (OD 600 = 1 bir kültürden 1 ml eşdeğer) bir hasat örnek almak ve.
- 7,000 x g'de 20 dakika 4 ° C'de santrifüj ile hücreler toplanır. 50 ml'lik bir santrifüj tüpüne ve transfer: 40 ml kültür, 1 L arasında TBS tampon bakiye LB ortamı tekrar süspansiyon hücre pelletleri çıkarmak için (20 mM Tris-HCl, pH 7.5, 200 mM NaCl tuzlu Tris tamponlu). kullanılana kadar -80 ° C'de 10,000 x g'de 10 dakika ve 4 ° C'de ve mağaza santrifüj ile hücreler toplanır. SDS-PAGE 18 üzerinden ifade (toplam lizatları ve çözülebilir fraksiyonları) analiz.
- Etiketlenmemiş rPPEP-1 saflaştırılması
- SDS-PAGE analizi için, her saflaştırma aşamasının 50 ul numune alın. 10 ug / ml DNasel ile desteklenmiş TBS tampon kültür 1 L hücre pelletini. hücre gramı başına TBS / DNasel 5 ml kullanın.
- 15 dakika (2 saniye ara ile 2 sn darbe) 30% genliği kullanılarak buz / su üzerine sonikasyon ile Hücreleri,. centr tarafından pislikleri temizleyinUltrasantrifüj işlemi tüp 10,000 x g'de 10 dakika ve 4 ° C'de ve transfer supernatant ifugation. 165,000 x g ve 4 ° C'de 30 dakika boyunca bir ultrasantrifüjdeki temizle lisatı.
- 4-6 ° C'de çalışın. peristaltik pompa veya kromatografi sistemi kullanılarak 10 mM imidazol, pH 7.5 ile takviye edilmiş TBS tamponu ile cam bir sütun içinde nikel nitrilotriasetik asit (Ninta) reçine 2 ml denge. Alternatif olarak, yerçekimi akışı kullanın.
- 10 mM'lik nihai bir konsantrasyona kadar 1 M imidazol, pH 7.5 ile temizlenir lizat ayarlayın. kolona lizat uygulayın ve taban çizgisi ulaştı 280 nm'de UV emilimi kadar 10 mM ve 30 mM imidazol ile takviye TBS tamponu ile kademeli yıkayın.
- TBS tamponu artı 250 mM imidazol ile proteinini ayrıştırmak. 10 mM imidazol ile desteklenmiş TBS sütun yeniden dengelenmesi ve Gecede saklamak.
- söndürme Katsayısı olarak kullanılarak 280 nm protein konsantrasyonu ya da belirlemekve cient 25900 M -1 -1 cm veya başka herhangi bir yöntemle (örneğin Bradford yöntemi 19) tarafından. mg protein başına trombin 2 adet ekleyin ve TBS bir 50x hacimli (Ninta elüsyon hacmi 50x) karşı 4 ° C de bir gece boyunca protein çözeltisi dialyze.
Not: imidazol, 280 nm'de güçlü bir emiciliğe gibi, protein konsantrasyonu belirlenmesi için doğru boş al. - bölünmemiş protein kaldırmak için dengelenmiş Ninta reçine üzerinde protein çözeltisi geçirin. Daha sonra, her yarık proteinin geri kazanılması için sütuna TBS aynı hacmi 10 mM imidazol ile desteklenmiş geçerlidir. sütunu temizlemek için, 250 mM imidazol ile kalan tüm protein Zehir. SDS-PAGE (Şekil 1) aracılığıyla örnekleri analiz edin.
- 4,000 x g'de santrifüj lü bir ultrafıltrasyon ünitesi kullanılarak 4 ° C'de 10 dakika aralıklarla 4 ml protein çözeltisi konsantre edilir. yağış ve toplanmasını önlemek için her aradan sonra konsantre protein karıştırın. ara sıra Bu adımdaly bir çöktürme karıştırma prosedürlerine rağmen rPPEP-1 görülmektedir.
- 4-6 ° C de (TBS tamponu içinde) önceden dengelenmiş bir boyut çıkarım kromatografi kolonuna konsantre edildi protein uygulanır. TBS tampon ile kolon Zehir, 1 ml'lik fraksiyonların konuyu SDS-PAGE analizi için her ikinci fraksiyon 5 ul toplar. rPPEP-1 monomer (Şekil 2) karşılık gelen tek bir tepe noktası olarak ayrışır. Bazen daha büyük molekül ağırlığında bir ikincil tepe protein dimeri karşılık gelen, (önü zirve) gözlenir. Verim kültür bir L başına, saf protein yaklaşık 50 mg olmalıdır. SDS-PAGE 18 ile tüm örnekleri (Şekil 2) analiz edin.
- SDS-PAGE analizi için, her saflaştırma aşamasının 50 ul numune alın. 10 ug / ml DNasel ile desteklenmiş TBS tampon kültür 1 L hücre pelletini. hücre gramı başına TBS / DNasel 5 ml kullanın.
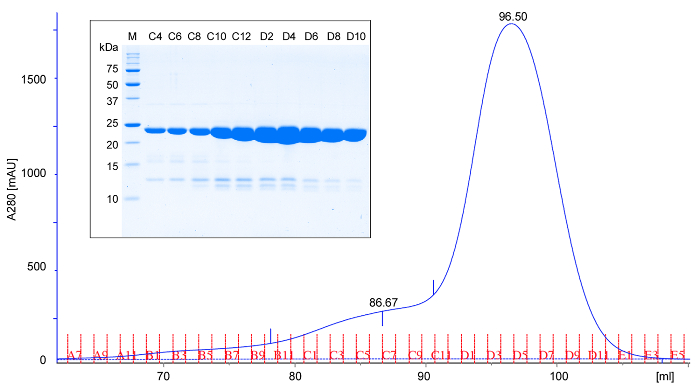
Şekil 2: rPPEP-1 Örnek boyut dışlama kromatografisi ve SDS-PAGE analizi. Ebat eksklüzyon kromatogram (A280; 6 ° C 'de Tris-HCI, pH 7.5, 200 mM NaCl içinde (16/600) kolonu kullanılarak saflaştırılmış etiketlenmemiş rPPEP-1 280 nm'de emicilik). elusyon hacminde göre rPPEP-1 göç eder baskın olarak monomerik olduğunu düşündüren bir 22 kDa proteini için beklendiği gibi. Nadiren hafif fronting pik bir dimer karşılık gelen görünür. (Ek) boyut dışlama kromatografisinden elde edilen parçaların SDS-PAGE analizi (M, moleküler ağırlık markörü). Her saniye fraksiyon uygulanır. Ana rPPEP-1 bant altında soluk bantlar genellikle küçük kirleri meydana karşılık gelmektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Mikro-tohumlama kullanılması 3. kristalizasyon ve kristal Optimizasyonu
Not: rPPEP-1 sürekli X-ışını kırınım analizi için uygun değildir yüksek koroziyona kristaller üretmeye koşullar kristalleşir (Şekil 3). Bu nedenle, bir optimizasyon stratejisi (Şekil 4), yüksek kaliteli kristaller (Şekil 5) elde etmek üzere geliştirilmiştir.
- Ticari ekranlarını kullanarak rPPEP-1 ilk tarama
NOT: Standart ticari olarak mevcut ekranları ve kristalleşme robot kullanılarak oturan damla biçiminde kristalleşme denemeleri yapın.- mi 4000 xg ve 4 ° C'de 5 dakikalık aralıklarla bir santrifüj ultrasüzme cihazı kullanılarak / 12 mg saflaştırılmış proteini konsantre edilir. yağış ve toplanmasını önlemek için her aradan sonra konsantre protein karıştırın. 25,900 M-1 cm-1 ekstinksiyon katsayısı kullanılarak ya da başka bir yöntemle (örneğin, Bradford yöntemi) 280 nm'de protein konsantrasyonu ya da belirler. 20 ° C'ye kadar protein dengelenmesi. 16.000 x g'de 10 dakika ve 20 ° C'de santrifüj ile uzaklıkta tanecikleri ve tozları temizleyin.
- Ya zaten önceden doldurulmuş kristalleşme plakaları se kullanınaled ve 4 ° C'de saklandı veya her kristalleştirme koşulu 70 ul plakaların rezervuar kuyu doldurun. 20 ° C'ye kadar, tüm kristalizasyon plakaları dengelenmesi. küçük hacimleri hızla kurumasına olarak, hızlı bir şekilde çalışın. eğer mümkünse, robotun rıhtım etrafında bir nem odası kullanın.
NOT: SaltRx, Endeks, PEG / İyon, Kristal, Wizard, PAKT ++ JCSG ++: standart bir prosedür olarak aşağıdaki ekranları kullanın. - subwells 2-4 içine protein ve rezervuar pipetleme ekranı ayarlayın. Hangi 200: 100 (subwell 2), 150: 150 (subwell 3) ve 100 (nl) 200 (subwell 4): Bırak hacmi 300 nl ve oranları (rezervuar proteini) 'dir. Hemen, 20 ° C'de bir odada plaka ve yer kapatın.
- set-up hemen sonra tepsiler inceleyin ve sonra haftalık inceleme ardından ilk haftasında her gün kontrol edin.
- Ligandları ile rPPEP-1 ko-kristalizasyonu,
- alt-tabaka peptit rPPEP-1 komplekslerinin birlikte kristalleşme için rPPEP-1 karıştırın1 24 mg / ml: 1 oranında (hac / hac) 12 bir son konsantrasyon elde edecek peptid çözeltisi (Ac-EVNPPVPD-NH2) TBS tamponunda çözündürülmüş liyofilize toz) içindeki bir 7-kat molar fazlası ile mg / ml r-PPEP-1 proteini ve PPEP-1 e göre bir peptid 7 kat molar fazlalık. 20 ° C'de 30 dakika süreyle inkübe ve 16,000 xg ile 20 ° C 'de 10 dakika süre ile santrifüjleme ile Tüm tanecikleri ve tozları temizlemek. Bağlanmamış R-PPEP-1 proteini için tarif edildiği gibi kristalleştirme mikro-tohumlama işlemi kullanılarak devam edin.

Şekil 3: İlk ekranlarından Temsilcisi kristaller. rPPEP-1 12 mg arasında koroziyona kristaller / ml durumda büyütülür. I / 38 (1.4 M sodyum sitrat dihidrat tribazik, 0.1 M HEPES pH 7.5, sodyum, 200 nl: 100 NL) (A) kristal ekranı. (B) SaltRx ekran / 52 (2.4 M amonyum fosfat dibTe, 0.1 M Tris, pH 8.5; 100 nl: 200 nl) ve (C) (200 nl: 100 nl). (D) SaltRx ekranı / 96 (% 60 h / h Tacsimate pH 7.0, 0.1 M BIS-TRIS Propan, pH 7.0; 200 nl: 100 nl). Ölçek çubuğu = 0.2 mm. Hacim oranları her zaman protein vardır: rezervuar. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
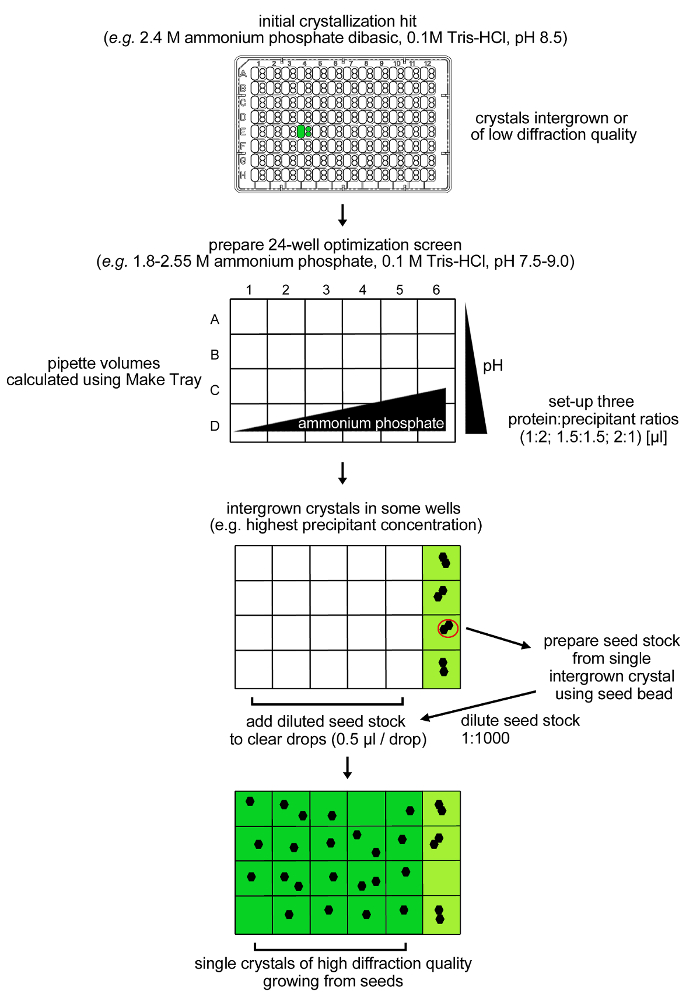
Şekil 4: rPPEP-1 kristalleşme için optimizasyon prosedürü. Birden çok perde (koroziyona), düşük kırılma kalitesi 12 mg / ml ile rPPEP-1 ilk kristaller 24 koşulu iyileştirme ekranında yeniden üretildi. Yine, yalnızca koroziyona kristaller 2.55 M amonyum fosfat dibazik ihtiva eden koşullar gözlenmiştir. Bir tohum hazır tek koroziyona kristal hazırlandı ve tamponu 1: 1000, aynı iklimlendirme halindeiyon (mikro-tohumlama). seyreltilmiş tohum stokunun 0,5 ul bir hacmi kalan net damlalar halinde ilave edildi ve tek kristaller hemen hemen tüm koşullarda büyüdü. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Mikro-tohumlama ile kristal optimizasyonu
Not: rPPEP-1 yüksek koroziyona kristaller 2.4 M amonyum fosfat dibazik, 0.1 M Tris-HCl, pH 8.5 (SaltRx ekran, durumu E4, üç subwells) (Şekil 3) ihtiva eden bir durumda, iki gün sonra ortaya çıkar. Mikro-tohumlama ile birlikte ilk koşulu etrafında bir ızgara ekranını kullanarak bir optimizasyon prosedürü (Şekil 4) uygulandı.- Ödenek ile ilgili (0.5 pH sıralı olarak) (0.15 M 'lik adımlarla) 2.55 M amonyum fosfat dibazik ve 0.1 M Tris-HCI, pH 7,5-9,0 - 1.8 24 koşulları içeren Tablo ekran (Şekil 4) hazırlanmasıyedik stok çözeltileri (4 M amonyum fosfat ve 1 M Tris tamponları).
NOT: 10 optimizasyon ekranları gerçekleştirmek için izin veren her şartta 2 ml elde etmek için hacimleri ve pipetleme düzenini hesaplamak için yap Tepsi uygulaması (http://hamptonresearch.com/make_tray.aspx) kullanın. 4 M amonyum fosfat stok solüsyonu hazırlamak zordur. su içinde tümüyle tozu çözmek üzere karıştırma sırasında solüsyon ısıtın. - Pipet 200 24 oyuklu bir plaka gözlerine, her Tablo ekran çözeltisi ul ve 20 ° C de dengelenmesi.
- El ile kristalleşme plakasını kurdu. (Ul) 2: 1, 1.5: 1.5 ile 1 (Rezervuar proteini) 2 olan damla hacmi 3 ul oranlarını gösterir. Burada, hava kabarcığı oluşumunu önlemek için bir pozitif yer değiştirme pipet kullanın. Hemen, 20 ° C'de bir odada plaka ve yer kapatın. hava kabarcığı oluşumunu önlemek.
Not: bir ila dört gün sonra yüksek oranda iç içe gelişmiş kristaller 2.55 M amonyum pho içeren dört durumlarında ortaya çıkançevi- ren dibazik ve 0.1 M Tris-HCI, pH 7,5-9,0 (Şekil 4). Resim kristaller mikro-tohumlama işlemi, bu koşullarda rPPEP-1 tek kristalleri elde etmek için kullanılan 2.55 M aşağıdaki amonyum fosfat konsantrasyonu, geri kalan 20 koşullarında oluşturulur. - 2.55 M amonyum fosfat dibazik ve 0.1 M Tris-HCI, pH 8.0 veya 8.5 olan iki koşullardan biri tek bir içe gelişmiş kristal hasadı bir microseed stok hazırlayın. Kristaller, plastik yüzeye bağlı olabilir. Bir akupunktur iğnesi ile çevredeki plastik dikkatli deformasyon kristalleri ayırmak için yardımcı olur.
- Transfer küçük cilalı cam boncuk içeren bir 1.5 ml tüp içine ilgili ana sıvının 50 ul (boncuklar-için-tohum). Takılı bir naylon döngü kullanarak bir cam kapak slayt üzerine yerleştirilen ana çözeltinin 1 ul içine kristal aktarın.
- 30 saniye boyunca yüksek hızda boru ve girdap içine kristali içeren sıvı transferi. Bir 1 Üyeler:5 saniye süreyle iyice aynı taze hazırlanmış durumunu ve vorteks içeren yeni bir 1.5 ml tüp içine tohum stokunun 1000 seyreltme.
Not: Tohum stoklarının daha sonra kullanılmak üzere -80 ° C'de muhafaza edilebilir.
- kuyulara: (1000 seyreltme 1) açık damlaları ve pipet tohum stokunun 0.5 ul ile 20 koşullarını kapsayan keçesini çıkarın. 20 ° C'da bir oda içinde plaka ve yer kapatılmalıdır. Yüksek kırınım kaliteli tek kristalleri 2-7 gün (Şekil 5) görünür.
- Ödenek ile ilgili (0.5 pH sıralı olarak) (0.15 M 'lik adımlarla) 2.55 M amonyum fosfat dibazik ve 0.1 M Tris-HCI, pH 7,5-9,0 - 1.8 24 koşulları içeren Tablo ekran (Şekil 4) hazırlanmasıyedik stok çözeltileri (4 M amonyum fosfat ve 1 M Tris tamponları).
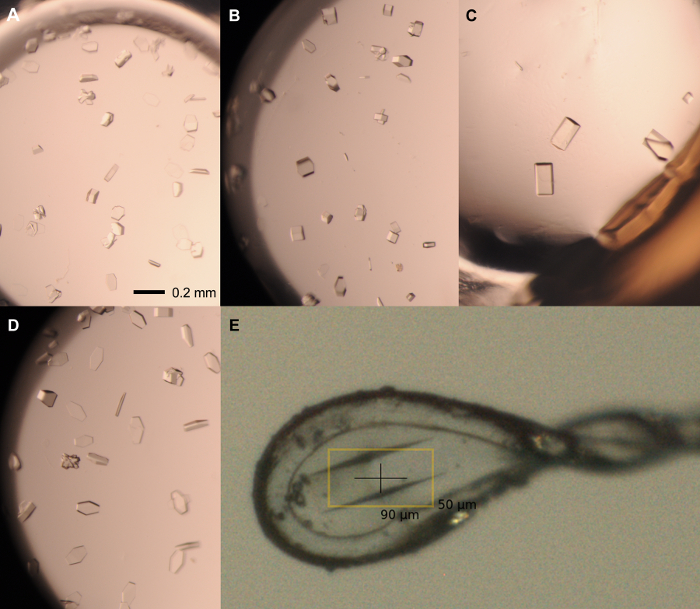
Şekil 5: optimizasyon ekranından Temsilcisi kristaller. 12 mg rPPEP-1, Tek kristalleri / ml tohumlanmış 1: aşağıdaki koşullarda yetiştirilen 1000 seyreltme tohum stokundan: (A) 2.1 M amonyum fosfat dibazik, 0.1 M Tris, pH 7.5; 1.5 ul: 1.5 ul; (B) 2.1 M amonyum fosfat dibazik, 0.1 M Tris, pH 7.5; 2 ul 1 ul; (C) 2.25 M amonyum fosfat dibazik, 0.1 M Tris, pH 8; 2 ul 1 ul; (D) 2.1 M amonyum fosfat dibazik, 0.1 M Tris, pH 8; 1 ul: 2 ul. (E) 2.1 M amonyum fosfat dibazik büyütüldü, 0.1-0.2 um naylon döngüsünde kristal monte edilmiş, 0.1 M Tris, pH 8 (2 | il 1 | il) ve kriyo korunmuş 0.1 M Tris pH 8 2.1 M amonyum fosfat dibazik olarak, % 20 gliserol. Ölçek çubuğu (MS) 'de = 0.2 mm. Cilt oranı her zaman protein vardır: rezervuar. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
4. Kristal Montaj ve Veri Toplama
NOT: kırınım veri kristallerinin en iyi kalite kalitesi ve büyüklüğü zirvesinde monte edilmelidir elde etmek. bunlar ar kadar kristaller sıvı azot içinde saklanabilirBu nedenle, 100 K X-ışını kırınımı analizine tabi E, bunlar kaynaklandığı durumu kriyo-koşullarına ayarlanması gerekir. rPPEP-1 kristalleri cryo-korunmuş 20% gliserol veya% 30 sukroz (cryo karşı koruyucu ile durumda su yerine) ya da eklenmesi ile olabilir.
- kristal montaj
NOT: Tüm kristal manipülasyon adımlar stereomicroscope altında yapılmalıdır.- seçilen kristallerin maksimum uzunluğu için naylon döngü optimal boyutu seçin. RPPEP-1 kristallerinin tipik bir uzun ekseni yaklaşık 100-200 um (Şekil 5). Bir kapak slayt ve uygun kriyo-durum hazırlayın (örneğin, 2.1 M amonyum fosfat dibazik, 0.1 M Tris, pH 8.0,% 20 gliserol).
- Sıvı azot ile köpük Dewars doldurun bir şişeye ile flakon kelepçe yük ve sıvı azot dolu 800 ml köpük Dewar bunu önceden serin. cryo kol ve uygun bir tanımlayıcı ile işaretlenmiş bir cryo kamışı tutucu yerleştirinsıvı azot doldurulmuş 2L köpük Dewar. monte edilmiş naylon döngü ile manyetik çubuk yerleştirin.
NOT: sıvı nitrojen ile çalışırken koruyucu giysi (Eyeshield / gözlük, eldiven) giyiniz. Sıcak nesneler dökülmelerini üretebilir sıvı azot içine daldı.
- Sıvı azot ile köpük Dewars doldurun bir şişeye ile flakon kelepçe yük ve sıvı azot dolu 800 ml köpük Dewar bunu önceden serin. cryo kol ve uygun bir tanımlayıcı ile işaretlenmiş bir cryo kamışı tutucu yerleştirinsıvı azot doldurulmuş 2L köpük Dewar. monte edilmiş naylon döngü ile manyetik çubuk yerleştirin.
- keskin bir bisturi ile sızdırmazlık bandı açın ve forseps ile çıkarın kesin. Pipet 1 kapak slayt üzerine cryo durumun ul (veya alternatif de aynı plaka üzerinde boş bir yer) ve monte naylon döngü (Şekil 5) ile balıkçılık ile açılan kristal çıkarın. Ekli kristaller kolayca akupunktur iğnesi ile çevredeki plastik deforme tarafından yerden ayrılabilir.
- Hızla cryo durumun damlasına kadar kristali aktarmak ve 1 saniye için dengelenmeye izin verin. sıvı azot içinde mümkün ve dalma-freeze kısa sürede kristal dışarı balık.
- monte edilen döngü etrafında sıvı azot kaynama durduğunda, şişe içinde bir döngü yerleştirin.cryo kamışı tutucu şişe yerleştirin ve 6 şişeleri ile yüklendiğinde tutucu etrafında bir cryo kovanı yerleştirin. kullanılana kadar sıvı nitrojen ile dolu bir tank içinde kristaller saklayın.
- seçilen kristallerin maksimum uzunluğu için naylon döngü optimal boyutu seçin. RPPEP-1 kristallerinin tipik bir uzun ekseni yaklaşık 100-200 um (Şekil 5). Bir kapak slayt ve uygun kriyo-durum hazırlayın (örneğin, 2.1 M amonyum fosfat dibazik, 0.1 M Tris, pH 8.0,% 20 gliserol).
- Veri koleksiyonu
NOT: Veri toplama varsa, evde difraktometresi yürütülen ya da bir sinkrotron beamline de yapılabilir. rPPEP-1 veri melez foton sayma dedektörü kullanarak İsviçre Işık Kaynağı, Paul-Scherrer-Enstitüsü, Villigen, İsviçre beamline X06DA toplandı için. yapı tespitinde kullanılan orijinal veri ve tüm dosyaları talep üzerine temin edilebilir.- element çinko karakteristik X-ışını soğurma kenarı enerjisi (tepe noktası) olan 1.282 A (9,667 keV) e ışınının dalga boyu ayarlayın. rPPEP-1 aktif sitede bir molekül için tek çinko içeren bir metaloproteaz olduğunu.
- Her directio 270 ° 'lik bir toplam 10 ° takozlar ters-ışın modunda 100 K veri toplamakn. pozlama süresi görüntü başına 0.1 ° rotasyon 0,1 sn. % 14 (0.14) ile iletim ayarlayın.
- Aynı kristalleşme durumundan kaynaklanan bir ikinci kristalden bir yerli yüksek çözünürlüklü veri kümesi toplamak için 1.00 Å (12398 keV) kiriş dalga boyu kurdu. pozlama süresi görüntü başına 0.1 ° rotasyon 0.1 sn 100 K veri toplamak. % 70 (0.7) için şanzımanı ayarlayın.
Çinko-SAD aracılığıyla 5. Yapı Tayini
NOT: Bazı temel kristalografik bilgiye ihtiyaç vardır çinko SAD yanı sıra yazılım paketleri XDS 20, Phenix 21 ve program Baldır ayaklar 22 üzerinden rPPEP-1 yapısını belirlemek amacıyla. Yapıların görselleştirme programı pirol 23 veya Chimera 24 ihtiyaç vardır. element çinko emme kenarında karşılık gelen tepe dalga boyunda toplanan veriler tek dalga boyuna sahip anormal bir disp için kullanılabilirersion (SAD) 25 tüm protein atomları için uzatılabilir faz bilgileri elde etmek.
- Veri işleme
- Friedel adlı arkadaşları (anormal veriler) ayıran uzay grubunda P2 1 2 1 2 1 (boşluk grubu 19) yazılım XDS (alternatif iMosflm veya HKL3000) kullanılarak (normal ve ters) iki tepe veri setleri işleyin. birim hücre parametreleri, a, b, c (A) civarında olmalıdır = 43.17, 71.68, 117,70 ve α = β = γ (°) = 90. İki HKL dosyaları (yansıma dosyaları) verir.
- Dosya CORRECT.LP kontrol edin. CC 1/2 en az% 50 olduğu çözünürlüğe kadar verileri kullanın. Birlikte XScale kullanarak her iki veri setleri / yansıma dosyaları (HKL-dosyaları) Ölçeğe. Dosya XSCALE.LP kontrol edin. anormal sinyal (SigAno) uzanır ne kadar kontrol ve burada kullanılan 1.67 Å toplanan verilerin durumunda 2 Å yaklaşık% 30, bir anormal korelasyon (anomal Corr) ile çözünürlüğü unutmayın. BuPhenix Autosol kullanılan anormal sinyal çözünürlüğü cut-off.
- XDSCONV% 5 R serbest alt kümesini oluşturur ve anormal veriler (FRIEDEL'S_LAW = YANLIŞ) tutmak kullanılarak (peak_anom.mtz, örneğin, adlı) bir CCP4 format yansıma dosyası içine (ölçekli) HKL-dosya dönüştürme. Birim hücre parametreleri, uzay grubu ve R serbest alt kümesinin varlığı (etiket FreeRflag) ve anormal veriler teftiş programı mtzdmp ile tutarlılık için MTZ-dosyasını kontrol edin (DANO / SIGDANO etiketler). anormal veri ayıklama olmadan da XDSCONV ile ek MTZ dosyası hazırlayın (FRIEDEL'S_LAW = TRUE; adlı örneğin, peak_native.mtz için) arıtma için daha sonraki bir aşamada.
- Alt yapı çözeltisi (faz belirleme)
- yansıma dosyası peak_anom.mtz kullanarak Phenix Autosol çalıştırın. veri türü olarak SAD / MAD zirve seçin ve (asimetrik birim başına iki molekül olduğu gibi) 2 çinko siteleri seçin. Daha kesin bu deneyimlerden birini seçinf f '/ f' (beamline bir floresan tarama belirlenen) parametreleri veya theotetical değerler '= -8,245 ve f' '= 3,887 mental değerleri. Ayrıca kristalize proteininin amino asit sekansını ihtiva eden FAŞTA dosyası yükleyin.
- Bu durumda 2 Å olarak, (5.1.2'de belirlenen) yaklaşık% 30 anormal korelasyon (anomal Corr) ile çözünürlüğüne çözünürlük sınırı ayarlamak ve "autobuild modeli" seçeneğini seçin. elektron yoğunluğu içine bütün protein fazlar çıkarılabilir olabilir Phenix HYSS (Phenix Autosol boru hattının bir parçası) tarafından bulunan iki çinko siteleri ve (Phenix RESOLVE) tarafından inşa edilen modelin aşamalarını kullanarak. en iyi model "overall_best.pdb" denir.
- Model kurma, arıtma ve doğrulama
- otomatik rPPEP-1 modelinin en oluşturmak için seçenek "autobuild modeli" seçeneğini seçin. progra kullanılarak 1.0 σ kontur seviyesine elektron yoğunluğunu kontrol edinm Coot (Şekil 6). Bu bağ ve model atomları çevreleyen olmalıdır. İdeal bazı su molekülleri (2.5 Å daha çözünürlükte) modele inşa edilmelidir. Toplu su (molekülleri arasındaki boşluk) hiçbir yoğunluk içermelidir.
- tüm model tamamlandı (elektron yoğunluğu yerleşik tüm amino asitleri) olup olmadığını kontrol edin. Değilse, el Coot tarafından sağlanan araçları kullanarak onları inşa. 5 arıtma Phenix daraltın yinelenen mermi çalıştırarak yapısını daraltın her overall_best.pdb model dosyası, peak_native.mtz yansıma dosyası ve FAŞTA dizisi dosyasını kullanarak mermi; ve Coot manuel model kurma.
- Coot içinde ilgili araçları ile yapısal modelin kalitesini doğrulamak.
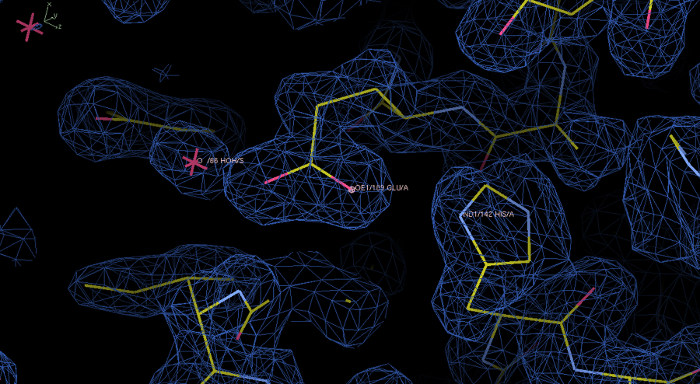
Sonra Deneysel elektron yoğunluğu haritası ve rPPEP-1 modeli: Şekil 6Phenix Autosol çalıştırın. Program Coot görüntülenen 1,0 σ bir kontur seviyesinde mavi elektron yoğunluğu. Bu ilk harita elektron yoğunluğu güzel çözümlenir ve modelin elektron yoğunluğu içine inşa. Yaklaştırma artıkları His142 ve Glu189, hem de bir su molekülü gösterir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Moleküler Değiştirme yoluyla Yüksek Çözünürlük 6. Yapı Tayini
NOT: rPPEP-1 yerli veri kümesi hakkında yüksek çözünürlüklü yapısal bilgi elde etmek için toplanır. Sonra (Phenix yazılım paketi içinde) yazılım Phaser 26,27 kullanarak bir moleküler değiştirme işlemi çinko-SAD bir model olarak aracılığıyla belirlenen yapısı kullanılarak kullanılır. Küçük molekülleri ile kompleks rPPEP-1 yapılarını çözmek Bu prosedür, aynı zamanda, daha sonra kullanılabilir.
- (1.4 Å bu durumda kadar) daha yüksek çözünürlüğe sahip bir kristal yapı elde etmek uzay grubuna P2 1 2 1 2 1 (boşluk grubu 19) yazılım XDS (alternatif iMosflm veya HKL3000) kullanarak yerel veri kümesi işlemek. birim hücre parametreleri, a, b, c (A) civarında olmalıdır = 43.17, 71.77, 117,80 ve α = β = γ (°) = 90. Bu, bir HKL dosyaları (yansıtma dosyası) verir.
- Dosya CORRECT.LP kontrol edin. CC 1/2 en az% 50 olduğu çözünürlüğe kadar verileri kullanın. XDSCONV% 5 R serbest alt kümesini oluşturur kullanarak (native.mtz, örneğin, adlı) bir CCP4 format yansıma dosyası içine HKL dosyası dönüştürün. Birim hücre parametreleri, uzay grubu ve R serbest alt kümesi (etiket FreeRflag) varlığını teftiş programı mtzdmp ile tutarlılık için MTZ dosyasını kontrol edin.
- (Daha önce belirlenen overall_best.pdb gelen modeli içeren PDB dosyası hazırlayın ve tüm su moleküllerini ve tüm ligandları kaldırmak, yani. çinko atomu). Ayrıca kristalize proteininin amino asit sekansını ihtiva eden FAŞTA dosyası yükleyin. yansıma dosyası native.mtz kullanarak Phenix Phaser çalıştırın. Asimetrik birim başına iki molekülün arayın.
- modeli (adlandırılmış native_phaser.1.pdb) ve Coot elektron yoğunluğu haritası incelemek, başarılı yapı çözümü (burada 10,2 8 daha büyük TFZ-skoru) sonra. Yapı ve 5 arıtma Phenix daraltın yinelenen mermi çalıştırarak yapısını rafine her native_phaser.1.pdb model dosyası, native.mtz yansıma dosyası ve FAŞTA dizisi dosyasını kullanarak mermi; ve Coot manuel model kurma.
- Coot içinde ilgili araçları ile yapısal modelin kalitesini doğrulamak.
Sonuçlar
rPPEP-1, E. coli BL21 (DE3) Yıldız (Şekil 1C) en yüksek verimle çeşitli E.coli suşları aşırı eksprese edilir. İlk Ninta afinite kromatografi basamağından sonra, 6xHis-Tag başarılı protein çoğundan yanlabilir ve ikinci Ninta aşamada, düzenlenmemiş protein tam trombin sindirilmiş protein (Şekil 1D) ayrılabilir. Ara sıra muhtemelen dimerik türler (Şekil 2A) 'e uygun önü ile, monomer olarak...
Tartışmalar
X-ışını kristalografisi hala proteinlerin 28 üç boyutlu yakın atomik çözünürlükte yapılarını belirlemek için hızlı ve en doğru yöntemdir. Bununla birlikte, iyi sıralı tek kristallerinin büyümesini gerektirir. Bunlar genellikle almak zordur ve kristal devlet yapaydır. Bununla birlikte, diğer yöntemler ile belirlenmiş olan X-ışını kristalografisi ile tespit edilmiş protein yapılarının karşılaştırılması, özellikle NMR genellikle çok iyi bir uyum göstermektedir. PPEP-1...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Biz sinkrotron veri toplama sırasında destek için İsviçre Işık Kaynağı, Paul-Scherrer-Enstitüsü, Villigen, İsviçre'de beamline X06DA personeli teşekkür ederiz. Biz mükemmel teknik destek için Monika Gompert minnettarız. Proje Köln Üniversitesi tarafından desteklenen ve Alman Araştırma Konseyi INST 216 / 682-1 FUGG hibe edildi. CP Kalkınma Sağlığı ve Hastalıkları Uluslararası Graduate School bir doktora bursu kabul edilmektedir. Bu sonuçlara yol açan bir araştırma hibe sözleşmesi No. 283570 (BioStruct-X) kapsamında Avrupa Topluluğu Yedinci Çerçeve Programı (FP7 / 2007-2013) fon aldı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Genes / Vectors / cell strains | |||
| pET28a vector | Merck-Millipore | 69864 | Thrombin cleavable N-terminal His-tag |
| E. coli strain BL21 (DE3) Star | ThermoFisher Scientific | C601003 | RNase H deficient |
| Codon-optimized gene (for E. coli) of PPEP-1 (CD630_28300) | Geneart (Thermo Fisher Scientific) | custom | amino acids 27-220 |
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Yeast extract | any | ||
| Tryptone | any | ||
| Antifoam B | Sigma-Aldrich | A5757 | aqueous-silicone emulsion |
| Agar | any | ||
| Kanamycin | any | ||
| IPTG | AppliChem | A1008 | |
| Tris-HCl | AppliChem | A1087 | Buffer grade |
| NaCl | any | Buffer grade | |
| DNaseI | AppliChem | A3778 | |
| Imidazole | AppliChem | A1073 | Buffer grade |
| Thrombin | Sigma-Aldrich | T4648 | |
| Ammonium phosphate dibasic | Sigma-Aldrich | 215996 | |
| Glycerol 100% | any | purest grade | |
| Sucrose | Sigma-Aldrich | 84097 | |
| Liquid nitrogen | any | for storage and cryocooling of crystals | |
| Name | Company | Catalog Number | Comments |
| Equipment (general) | |||
| Shaking incubator | any | providing temperatures of 20 °C - 37 °C | |
| Glassware | any | baffled Erlenmeyer flasks (50 ml - 2.8 L) | |
| Centrifuge for large culture volumes | any | centrifuge for processing volumes up to 12 L | |
| Sonicator Vibra-Cell VCX500 | Sonics | SO-VCX500 | or any other sonicator / cell disruptor |
| Ultracentrifuge | any | centrifuge providing speeds up to 150,000 x g | |
| NiNTA Superflow resin | Qiagen | ||
| Empty Glass Econo-Column | Bio-Rad | 7371007 | or any other empty glass or plastic column |
| Size exclusion chromatography column HiLoad Superdex 200 16/600 | GE Healthcare | 28989335 | |
| Chromatography system Äkta Purifier | GE Healthcare | 28406264 | or any other chromatography system |
| Dialysis tubing Spectra/Por 3 | Spectrum Labs | 132724 | |
| Dialysis tubing closures | Spectrum Labs | 132738 | |
| Ultrafiltration units (concentrators) 10,000 NWCO | any | ||
| UV-Vis spectrophotometer | any | ||
| Name | Company | Catalog Number | Comments |
| Equipment (crystallography) | |||
| Low volume pipette 0.1-10 µl | any | ||
| Positive displacement pipette Microman M10 | Gilson | F148501 | |
| Crystallization robot | any | ||
| 96-well crystallization plates TTP IQ with three protein wells | TTP | 4150-05810 | or any other 96-well crystallization plate |
| 24-well CombiClover Junior Plate | Jena Bioscience | EB-CJR | |
| Crystal Clear Sealing Tape | Hampton Research | HR3-511 | |
| Siliconized Glass Cover Slides | Hampton Research | HR3-225 | |
| Commercial crystallization screens: SaltRx, Index, PEG/Ion, Crystal | Hampton Research | diverse | |
| Commercial crystallization screens: Wizard, PACT++, JCSG++ | Jena Bioscience | diverse | |
| JBS Beads-for-Seeds | Jena Bioscience | CO-501 | |
| CrystalCap SPINE HT (nylon loops) | Hampton Research | diverse | loop sizes 0.025 mm - 0.5 mm |
| CrystalCap Vial | Hampton Research | HR4-904 | |
| Cryogenic Foam Dewar 800 ml | Hampton Research | HR4-673 | |
| Cryogenic Foam Dewar 2 L | Hampton Research | HR4-675 | |
| Vial Clamp, Straight | Hampton Research | HR4-670 | |
| CrystalWand Magnetic, Straight | Hampton Research | HR4-729 | |
| CryoCane 6 Vial Holder | Hampton Research | HR4-711 | |
| CryoSleeve | Hampton Research | HR4-708 | |
| CryoCane Color Coder - White | Hampton Research | HR4-713 | |
| Scalpel | any | ||
| Straight microforcep | any | for manipulation of sealing tape. etc. | |
| Acupuncture needle | any | e.g. from a pharmacy | |
| Stereo microscope | any | for inspection of crystallization plates and crystal mounting, magnification up to 160X |
Referanslar
- Bouza, E. Consequences of Clostridium difficile infection: understanding the healthcare burden. Clin Microbiol Infect. 18 (Suppl 6), 5-12 (2012).
- O'Connor, J. R., Johnson, S., Gerding, D. N. Clostridium difficile infection caused by the epidemic BI/NAP1/027 strain. Gastroenterology. 136 (6), 1913-1924 (2009).
- Mitchell, B. G., Gardner, A. Mortality and Clostridium difficile infection: a review. Antimicrob Resist Infect Control. 1 (1), (2012).
- George, W. L., Sutter, V. L., Finegold, S. M. Antimicrobial agent-induced diarrhea--a bacterial disease. J Infect Dis. 136 (6), 822-828 (1977).
- George, R. H., et al. Identification of Clostridium difficile as a cause of pseudomembranous colitis. Br Med J. 1 (6114), 695 (1978).
- Bartlett, J. G. Narrative review: the new epidemic of Clostridium difficile-associated enteric disease. Ann Intern Med. 145 (10), 758-764 (2006).
- Kelly, C. P., LaMont, J. T. Clostridium difficile--more difficult than ever. N Engl J Med. 359 (18), 1932-1940 (2008).
- Ünal, C. M., Steinert, M. Novel therapeutic strategies for Clostridium difficile infections. Expert Opin Ther Targets. 20 (3), 269-285 (2016).
- Kelly, C. P., et al. The Monoclonal Antibody, Bezlotoxumab Targeting C. difficile Toxin B Shows Efficacy in Preventing Recurrent C. difficile Infection (CDI) in Patients at High Risk of Recurrence or of CDI-Related Adverse Outcomes. Gastroenterology. 150 (4), S122 (2016).
- Tsutsumi, L. S., Owusu, Y. B., Hurdle, J. G., Sun, D. Progress in the discovery of treatments for C. difficile infection: A clinical and medicinal chemistry review. Curr Top Med Chem. 14 (1), 152-175 (2014).
- Hensbergen, P. J., et al. Clostridium difficile secreted Pro-Pro endopeptidase PPEP-1 (ZMP1/CD2830) modulates adhesion through cleavage of the collagen binding protein CD2831. FEBS Lett. 589 (24), 3952-3958 (2015).
- Cafardi, V., et al. Identification of a novel zinc metalloprotease through a global analysis of Clostridium difficile extracellular proteins. PLoS One. 8 (11), e81306 (2013).
- Hensbergen, P. J., et al. A novel secreted metalloprotease (CD2830) from Clostridium difficile cleaves specific proline sequences in LPXTG cell surface proteins. Mol Cell Proteomics. 13 (5), 1231-1244 (2014).
- Schacherl, M., Pichlo, C., Neundorf, I., Baumann, U. Structural Basis of Proline-Proline Peptide Bond Specificity of the Metalloprotease Zmp1 Implicated in Motility of Clostridium difficile. Structure. 23 (9), 1632-1642 (2015).
- Rawlings, N. D., Waller, M., Barrett, A. J., Bateman, A. MEROPS: the database of proteolytic enzymes, their substrates and inhibitors. Nucleic Acids Res. 42 (Release 10.0), D503-D509 (2014).
- Bergfors, T. Seeds to crystals. J Struct Biol. 142 (1), 66-76 (2003).
- Dauter, Z., Dauter, M., Dodson, E. Jolly SAD. Acta Crystallogr D Biol Crystallogr. 58 (Pt 3), 494-506 (2002).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Kabsch, W. XDS. Acta Crystallogr D Biol Crystallogr. 66 (Pt 2), 125-132 (2010).
- Adams, P. D., et al. PHENIX: a comprehensive Python-based system for macromolecular structure solution. Acta Crystallogr D Biol Crystallogr. 66, 213-221 (2010).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallogr D Biol Crystallogr. 66 (Pt 4), 486-501 (2010).
- . . The PyMOL Molecular Graphics System. , (2002).
- Pettersen, E. F., et al. UCSF Chimera--a visualization system for exploratory research and analysis. J Comput Chem. 25 (13), 1605-1612 (2004).
- Wang, B. C. Resolution of phase ambiguity in macromolecular crystallography. Methods Enzymol. 115, 90-112 (1985).
- McCoy, A. J., Grosse-Kunstleve, R. W., Adams, P. D., Winn, M. D., Storoni, L. C., Read, R. J. Phaser crystallographic software. J Appl Crystallogr. 40 (Pt 4), 658-674 (2007).
- Zwart, P. H., et al. Automated structure solution with the PHENIX suite. Methods Mol Biol. 426, 419-435 (2008).
- Zheng, H., Handing, K. B., Zimmerman, M. D., Shabalin, I. G., Almo, S. C., Minor, W. X-ray crystallography over the past decade for novel drug discovery - where are we heading next?. Expert Opin Drug Discov. 10 (9), 975-989 (2015).
- Rubino, J. T., et al. Structural characterization of zinc-bound Zmp1, a zinc-dependent metalloprotease secreted by Clostridium difficile. J Biol Inorg Chem. 21 (2), 185-196 (2016).
- Carson, M., Johnson, D. H., McDonald, H., Brouillette, C., Delucas, L. J. His-tag impact on structure. Acta Crystallogr D Biol Crystallogr. 63 (Pt 3), 295-301 (2007).
- Gasteiger, E., Walker, J. M., et al. Protein Identification and Analysis Tools on the ExPASy Server. The Proteomics Protocols Handbook. , 571-607 (2005).
- Dummler, A., Lawrence, A. M., de Marco, A. Simplified screening for the detection of soluble fusion constructs expressed in E. coli using a modular set of vectors. Microb Cell Fact. 4, 34 (2005).
- Stura, E. A., Wilson, I. A. Applications of the streak seeding technique in protein crystallization. J Crys Growth. 110 (1), 270-282 (1991).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır