Method Article
طريقة الكهربية لالكامل خلية الجهد المشبك تسجيلات من
In This Article
Summary
تسجيلات خلية كاملة من مستقبلات ذبابة الفاكهة ميلانوغاستر تمكن من قياس المطبات السوداء العفوية، المطبات الكم، والاستجابات العيانية للضوء، والعلاقات الحالية الجهد في ظل ظروف مختلفة. في تركيبة مع D. ميلانوغاستر أدوات التلاعب الجيني، وهذه الطريقة تمكن من دراسة في كل مكان إينوزيتول الدهون مسار الإشارات وهدفها، وقناة ترب.
Abstract
وقد سجلت ثنائيات التسجيلات المشعة ذات الجهد الكامل من مستشعرات ذبابة الفاكهة ذبابة الفاكهة ثورة في مجال التنغيم البصري اللافقاري، مما مكن من استخدام علم الوراثة الجزيئي ميلانوغاستر لدراسة قنوات التشفير الدهني للأنوزيتول وقنوات المستقبلات المؤقتة (ترب) على مستوى الجزيء الواحد. وقد اتقن حفنة من المختبرات هذه التقنية القوية، والتي تمكن من تحليل الاستجابات الفسيولوجية للضوء في ظل ظروف عالية التحكم. هذه التقنية تسمح للسيطرة على وسائل الإعلام داخل الخلايا وخارج الخلية. الغشاء الجهد؛ والتطبيق السريع للمركبات الدوائية، مثل مجموعة متنوعة من المؤشرات الأيونية أو الرقم الهيدروجيني، إلى وسائل الإعلام داخل وخارج الخلية. مع ارتفاع نسبة إشارة إلى الضوضاء بشكل استثنائي، وهذا الأسلوب يتيح قياس الظلام عفوية والتيارات التي يسببها ضوء التيتانيوم ( أي المطبات العفوية والكمية) والميكروسكوبية التي يسببها التيارات الخفيفة (ليك) من الخطيئةغل D. ميلانوغاستر فوتوريبتورس. ويوضح هذا البروتوكول، بتفصيل كبير، جميع الخطوات الرئيسية اللازمة لأداء هذه التقنية، والذي يتضمن كل من التسجيلات الكهربية والبصرية. ويصف الإجراء تشريح الشبكية ذبابة لتحقيق سليمة وقابلة للحياة خارج الجسم الحي معزولة أوماتيديا في غرفة حمام. كما يتم تفصيل المعدات اللازمة لأداء كامل الخلية والقياسات التصوير مضان أيضا. وأخيرا، يتم شرح المزالق في استخدام هذا التحضير الدقيق خلال التجارب الموسعة.
Introduction
وقد وضعت الدراسات الوراثية واسعة من ذبابة الفاكهة، ذبابة الفاكهة ميلانوغاستر ( D. ميلانوغاستر) ، التي بدأت منذ أكثر من 100 سنة، D. ميلانوغاستر يطير كنموذج تجريبي مفيد للغاية للتشريح الجيني للعمليات البيولوجية المعقدة. المنهجية الموصوفة أدناه يجمع بين القوة المتراكمة لل D. ميلانوغاستر الوراثة الجزيئية مع نسبة الإشارة إلى الضوضاء عالية من كامل خلية التصحيح المشبك التسجيلات. هذا الجمع يسمح لدراسة D. ميلانوغاستر فوتوترانزدكتيون كنموذج للإشارة إينوزيتول والدهون وتنظيم قناة ترب وتنشيط، سواء في البيئة الأصلية وعلى أعلى دقة من جزيئات واحدة.
تطبيق طريقة تسجيل الخلية بأكملها إلى D. مستقبلات ميلانوغاستر قد أحدثت ثورة في دراسة فوتوترانزكتيون اللافقاريات. وقد تم تطوير هذه الطريقة من قبل هاردي 1 و إندبفي نهاية المطاف من قبل رانغاناثان وزملاؤه قبل 2 ~ 26 عاما، وكان يهدف إلى استغلال أدوات التلاعب الوراثي واسعة من D. ميلانوغاستر واستخدامها للكشف عن آليات فوتوترانزكتيون وإشارة الأينوزيتول والدهون. في البداية، عانت هذه التقنية من انخفاض سريع في حساسية الضوء وانخفاض العائد من أوماتيديا أثناء عملية تشريح، مما منع الدراسات الكمية مفصلة. في وقت لاحق، إضافة أتب و ناد إلى ماصة التصحيح زيادة كبيرة في ملاءمة إعداد للتسجيلات الكمية لفترات طويلة. وبعد ذلك، تم توصيف واسع النطاق لآلية تنبيغ الإشارة على المستوى الجزيئي.
حاليا، D. ميلانوغاستر فوتوترانسكتيون هو واحد من عدد قليل من النظم التي فوسفوانوسيتيد إشارات وقنوات ترب يمكن دراستها خارج الجسم الحي في قرار جزيء واحد. وهذا يجعل D. ميلانوغاستر فوتروترانزكتيون و ليثودولوغي وضعت لدراسة هذه الآلية نظام نموذج حساس للغاية. يصف هذا البروتوكول كيفية تشريح الشبكية ميلانوغاستر و ميكانيكالي قطاع أوماتيديا معزولة من الصباغ المحيطة (الدبقية) الخلايا. وهذا يتيح تشكيل الختم جيغا وكامل خلية التصحيح المشبك على الهيئات الخلية مبصرة. لحسن الحظ، فإن معظم بروتينات التشوير تقتصر على ربدومير ولا تنتشر. بالإضافة إلى ذلك، هناك كا 2 + عازلة عازلة غير قابلة للحركة دعا كالفوتين، وتقع بين مقصورة الإشارات وجسم الخلية 3 ، 4 ، ومستوى التعبير عالية من نا + / كا 2 + مبادل (كالكه) في ميكروفيلي 5 . معا، حبس البروتين إلى رابدومير، العازلة كالفوتين، والتعبير عالية من كالك تسمح لفترة طويلة نسبيا ( أي ما يصل إلى ~ 20 دقيقة) تسجيلات خلية كاملة، دون فقدان المكونات الأساسيةمن عملية فوتوترانسكتيون مع الحفاظ على حساسية عالية للضوء. يصف البروتوكول التالي كيفية الحصول على أوماتيديا معزولة وأداء التسجيلات خلية كاملة التي تظهر للحفاظ على الخصائص الأصلية للتسلسل فوتوترانزدكتيون. تم إجراء التجارب كاملة المشبك خلية التصحيح على صرصور فصل ( بيريبلانيتا أميريكانا ) 6 والكريكيت ( غريلوس بيماكولاتوس ) 7 أوماتيديا على نحو مماثل لتلك التي وصفها D. ميلانوغاستر . بالإضافة إلى ذلك، تم إجراء التجارب المشبك التصحيح على مستقبلات ضوئية فصل من البطلينوس الملف، ( ليما سكابرا ) والاسكالوب ( بكتن إراديانز ) بطريقة مختلفة قليلا عن تلك التي أجريت على D. ميلانوغاستر ، مما يسمح لكل خلية كاملة 8 وقياسات قناة واحدة 9 - هنا، وصفت الإنجازات الرئيسية التي تم الحصول عليها في D. ميلانوغاستر باستخدام هذه التقنية. المناقشة طيصف وصف بعض المزالق والقيود المفروضة على هذه التقنية.
Protocol
1. إعداد كاشف
ملاحظة: إعداد جميع الحلول وفقا للتعليمات الواردة في الجداول 1-4 .
- ملء حقنة 10 مل مع الحل خارج الخلية (إس أو إس-0Ca 2+ ؛ حسب الاقتضاء؛ انظر الجدول 1 ) والحفاظ على الجليد.
- إعداد قارورة واحدة من الحل تريتوراتيون (تيسي؛ انظر الجدول 2 ؛ أي إس أو إس-0Ca 2 + + فبس والسكروز) والحفاظ على هذا على الجليد.
- إعداد إس كافية للتجربة والحفاظ على هذا على الجليد حتى الحاجة.
ملاحظة: لا يلزم نضح حمام مستمر، وبالتالي فإن حجم إس لا يلزم أن يكون أكثر من بضع عشرات مل. - باستخدام فلتر 22 بفد ميكرون، تحميل الحل داخل الخلايا (انظر الجدول 3 أو الجدول 4 ) إلى حقنة 1 مل مع القطب ملء طرف ممدود. الحفاظ على هذا على الجليد.
2. الإعداد العام لأدوات تشريح
"jove_content" فو: كيب-together.within-بادج = "1"> 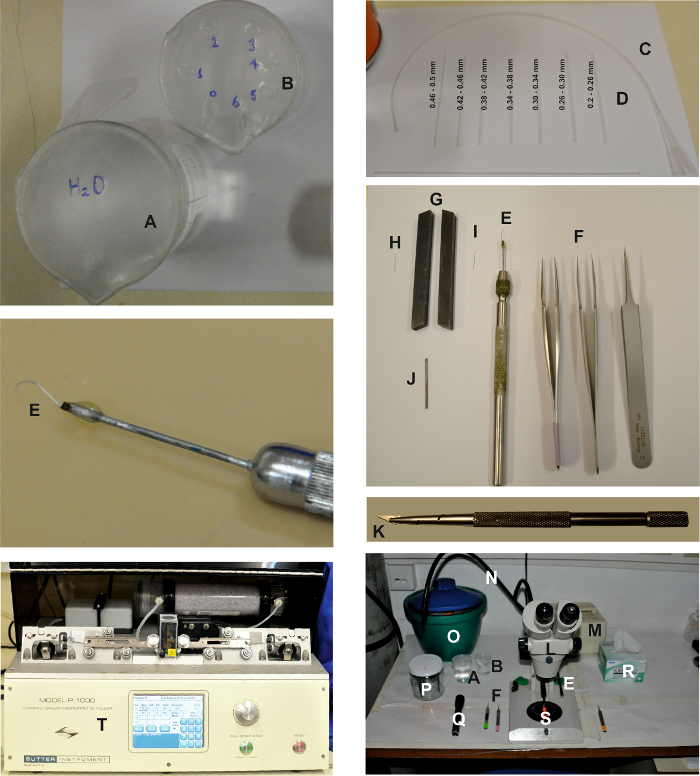
الشكل 1: الأدوات والأدوات اللازمة لصنع معزولة أوماتيديا. تظهر الصور مختلف الأجهزة المطلوبة لإنشاء إعداد أوماتيديا معزولة، كما هو موضح في بروتوكول مفصل أعلاه. اثنين من الأكواب، واحدة مملوءة بالماء ( A ) والآخر مليئة الإيثانول ( B ) لتنظيف ماصات ثريتوراتيون ( D )، والتي ترتبط إلى أنابيب ( C ). أدوات تشريح هي: 2 أزواج من غرامة و 1 زوج من ملاقط الخشنة ( F ) وشبكية شبكية العين ( E ). من أجل إعداد شبكية العين الشبكية، يتم الضغط على إبرة تشريح الجزئي ( H ) بين اثنين من أدوات مخرطة تعمل كنائب ( G ) لتسطيح الجزء العلوي من الإبرة ( I ). ثم يتم توصيله إلى بي ممدود إيس من المعدن باستخدام الغراء ( J ) وتركيبها على حامل إبرة ( E ). شفرة شفرة الحلاقة وحامل: كسر قبالة وجبل شريحة صغيرة صغيرة من شفرة حلاقة باستخدام حامل شفرة حلاقة ( K ). وتتألف منطقة العمل تشريح من مجهر ( L ) ومصدر الضوء الأحمر بارد (( M)، ) مع اثنين من أدلة الضوء ( N ). يتم وضع أدوات تشريح، بما في ذلك ملاقط ( F )، مغرفة شبكية العين ( E )، والأكواب ( A و B )، مصباح يدوي مع فلتر أحمر ( Q )، ومساحات حساسة ( R ) على جانبي مجهر. يتم وضع دلو الثلج مع إس، فبس-إس، والمحاقن حل داخل الخلايا، وطبق بتري 60 مم ( S )، وحامل القطب ( P ) أيضا على الطاولة. يتم سحب أقطاب التسجيل باستخدام مجتذب أفقي ( T ).e.com/files/ftp_upload/55627/55627fig1large.jpg "تارجيت =" _ بلانك "> الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- بناء شبكية الشبكية لعزل الشبكية.
- إدراج نقطة (1-4 ملم) من إبرة تشريح الجزئي (إبرة الحشرات، طول 12 مم، 0.1 ملم القطر) بين الفكين الملزمة اثنين وتسطيح ذلك عن طريق التنصت مع مطرقة صغيرة.
- جبل إبرة بالارض على حامل إبرة تشريح الصغير (انظر جدول المواد ).
- باستخدام زوج من ملاقط، منحنى نهاية بالارض من الإبرة لتشكيل هوك مع انحناء ~ 2.5 ملم.
- إنشاء ماصات تريتوراتيون لفصل أوماتيديا.
- وضع 1.2 × 0.68 ملم (أود X إد) شعري زجاجي على لهب مفتوح وتلميع النار عليه للحد من افتتاحه.
- قياس حجم فتح الشعيرات الدموية تحت المجهر. فرز الماصات تريتوراتيون أوماتيديال إلى سيفn وفقا لحجم فتحاتهم ( أي 0.2-0.5 مم). تخزينها في حاويات مناسبة منفصلة ( مثل أنابيب الاختبار).
- ملء كوب صغير واحد مع الماء المقطر المزدوج (دو) وكأس صغير آخر مع الايثانول 70٪. تغطية كل كوب مع ورقة الفيلم البارافين.
- لكمة ثقب صغير واحد في ورقة فيلم البارافين تغطي دور دو (انظر الشكل 1A ).
- لكمة سبعة ثقوب صغيرة في ورقة الفيلم البارافين تغطي الدورق الايثانول وعدد الثقوب من 0 إلى 6 (انظر الشكل 1B ).
- وضع ماصة واحدة أوماتيديال تريتوراتيون من كل مجموعة حجم في كل ثقب فيلم البارافين، مثل أن ماصة مع أكبر افتتاح يقع في حفرة 0 و ماصة مع أصغر افتتاح يقع في حفرة 6TH.
- ربط البلاستيك 200 ميكرولتر ماصة طرف إلى 35 سم طويلة، 1.57 × 1.14 ملم (أود × إد) قطعة من أنابيب البولي ايثيلين. تربط.ر الطرف الآخر من الأنابيب إلى واحدة من ماصات أريتديال تريتوراتيون مع أكبر افتتاح ( أي 0.46 - 0.5 ملم)، وضمان أن نهاية مدببة من ماصة تريتوراتيون لا تواجه في الأنابيب.
- إعداد ماصات تسجيل خلية كاملة عن طريق سحب ماصات التصحيح المشبك من 1 × 0.58 ملم (أود X إد) خيوط البورسليكات تحتوي على الشعيرات الدموية الزجاج.
ملاحظة: يجب أن تكون مقاومة الماصات 8-15 MΩ عند استخدام البوتاسيوم القائم على حل غلوكونات الخلايا (IS1). أي مناسبة ماصة التصحيح ماصة يمكن استخدامها (للحصول على أمثلة، انظر جدول المواد ). تلميع النار ليست ضرورية. - إعداد غرفة تسجيل (انظر الشكل 2 ) عن طريق تحديد ساترة (انظر جدول المواد ) إلى الجزء السفلي من غرفة حمام باستخدام البارافين ذاب أو عالية فراغ سيليكون الشحوم. استخدام أي مناسبة محلية الصنع أو غرفة التجارية التي تسمح الوصول الكهربائي والنضح.
- جبل الحمام على خشبة المسرح من الميكروسكوب مقلوب. وضع أنبوب نظام نضح، ونظام الشفط، والأرض ( أي أغ-أجكل سلك / بيليه) في الحمام (انظر جدول المواد والشكل 2 ).
- وضع اثنين من أزواج من غرامة # 5 ملاقط ( الشكل 1 ) على سطح العمل للاستخدام خلال تشريح الشبكية وخطوات العزلة أوماتيدييا.
3. D. ميلانوغاستر تربية
- ريس D. ميلانوغاستر الذباب في كثافة سكانية منخفضة ( أي ~ 20 الذباب في زجاجة 6 أوقية) في زجاجات تحتوي على الأغذية القياسية مسحوق الذرة في 19-24 درجة مئوية.
ملاحظة: من الأفضل أن تعمل على الذباب تكييفها الظلام. للحفاظ على حساسية عالية للضوء، والحد من التنوع ومنع انحطاط الشبكية في الذباب متحولة. - الخلفية الذباب في الظلام لمدة 24 ساعة على الأقل قبل التجربة.
ملاحظة: الذباب المستخدمة للتجارب يجب أن يكون استقبالنتلي إكلوسيد (<2 ساعة) وما زالت لينة، شاحب، وعرض العقي. أوماتيديديا يمكن أيضا أن تكون مستعدة بسهولة من الشرانق، على الرغم من حساسيتها للضوء ثم تعتمد بشكل حاد على سن 10 .
4. تشريح الشبكية و أوماتيدييا العزلة: الخيار 1
ملاحظة: قم بتنفيذ جميع الخطوات التالية تحت المجهر التكبير مجسمة باستخدام التضخيم مناسبة للعرض بشكل صحيح إعداد (انظر الشكل 1 ).
- وضع أربع قطرات من إس-0Ca 2+ وإسقاط واحد من حل تيسي على طبق بتري 60 ملم التي تم تسليمها.
- باستخدام ملاقط الخام، وقبض حديثا إكلوسيون (<2 ساعة بعد إكلوسيون) تطير من قبل أجنحةها أو الجسم. من هذه النقطة على، تنفيذ جميع الإجراءات بسرعة وتحت الإضاءة الحمراء الخافتة في 20 ± 1 درجة مئوية.
- في حين لا يزال يمسك الطاير مع ملاقط الخام، استخدم الزوج الأول من ملاقط غرامة لفصل رأس ذبابة من الجسم. Submeرج الرأس في إس-0Ca 2 + إسقاط الأول.
- تشريح الرأس في النصف على طول الطائرة السهمي باستخدام الزوج الثاني من ملاقط غرامة. تأكد من أنه في نهاية هذه الخطوة، كلا العينين لا تزال سليمة.
- نقل نصف الرأس إلى إس-0Ca 2+ إسقاط الثاني والنصف الآخر إلى إس-0Ca الثالث 2+ قطرة.
- باستخدام ملاقط غرامة، وإزالة أكبر قدر ممكن من الأنسجة المحيطة العين ممكن وضمان عدم حدوث أي ضرر لشبكية العين.
- فهم بحزم حافة القرنية واحدة مع ملاقط غرامة ومغرفة خارج شبكية العين باستخدام سكوبر.
ملاحظة: عند الانتهاء من هذه الخطوة، سيتم ترك القرنية فارغة وسليمة، مفصولة عن شبكية العين سليمة. - شطف ماصة تريتوراتيون متصلا الأنابيب مع دو وملء ماصة مع كمية صغيرة من إس-0Ca 2+ من قطرة الرابعة.
ملاحظة: يجب أن يتم تنفيذ هذه الخطوة في كل مرة يتم استخدام ماصة جديدة أوماتيديا فصل وإزالة جيئة وذهابام الدورق الايثانول (الحل ملء ماصة يجب أن تتطابق مع الحل الذي يتم غمر الشبكية). - نضح بلطف عن طريق الفم لرسم الشبكية معزولة في ماصة. استخدام الحذر الشديد لا تطمح فقاعات الهواء في ماصة.
- نقل الشبكية معزولة إلى انخفاض تيسي. تنفيذ الخطوات 4.6-4.10 على العين الثانية كذلك.
- مسح بعيدا قطرات إس-0Ca 2+ باستخدام مناديل حساسة، وترك فقط قطرة من تيسي تحتوي على كلا الشبكية على طبق بتري. إضافة ست قطرات أخرى من تيسي إلى أعلى طبق بتري. نقل كل من شبكية العين إلى واحدة من قطرات تيسي أخرى.
- استبدال ماصة تريتوراتيون مع ماصة من افتتاح أصغر قطرها. شطف كما هو موضح في الخطوة 4.8، وذلك باستخدام تيسي كحل لملء ماصة.
- نضح بسرعة وبشكل متكرر ونزوح كل الشبكية في الحل لبدء فصل أوماتيديا معزولة جردت من الخلايا الصباغية من شبكية العين بأكملها.
ملاحظة: أوما معزولةالشحوم مرئية في قطرة تيسي، ومع تقدم عملية العزل، يصبح انخفاض تيسي أقل شفافة. - نقل الشبكية المتبقية إلى قطرة تيسي المقبل. ملء ماصة مع قطرة تيسي السابق بأكمله (التي تحتوي على أوماتيديا معزولة) وينسف قطرة في غرفة الحمام.
- كرر الخطوات 4.12-4.14 لتحقيق أوماتيديا معزولة القصوى. انتظر حوالي 1 دقيقة للسماح أوماتيديا معزولة إلى بالوعة وربط إلى الجزء السفلي من غرفة حمام.
- باستخدام نظام نضح، بدء تدفق إس-0Ca 2+ مع 1.5 ملي كا 2+ في غرفة حمام. تأكد من أن الغرفة مليئة تماما مع الحل، من أسفل إلى أعلى، وأن الأرض مغمورة تماما في الحل. الاستمرار في غسل الحمام 4-5x.
5. تشريح الشبكية و أوماتيدييا العزلة: الخيار 2
ملاحظة: قم بتنفيذ جميع الخطوات التالية تحت المجهر التكبير مجسمة، وذلك باستخدام أمبليفيكاتيون مناسبة للعرض بشكل صحيح إعداد (انظر الشكل 1 ).
- إعداد شفرة حلاقة الحلاقة وحامل. كسر قبالة وجبل شريحة صغيرة صغيرة من شفرة حلاقة باستخدام حامل شفرة حلاقة ( الشكل 1 ).
- إعداد طبق سيليكون تشريح / كتلة وفقا لتعليمات الشركة الصانعة (انظر جدول المواد ).
- لتشريح، وخلق انخفاض كبير (<0.5 مل) من الحل إس على كتلة تشريح السيليكون. إضافة اثنين من "خزان" قطرات (~ 50 ميكرولتر لكل منهما) من حل تيسي إلى طبق بتري 60 ملم
- شل الحركة إكلوسيد حديثا (<2 ساعة بعد الإكلوسيون) يطير في أنبوب زجاجي على الجليد والاستفادة من قبل أجنحةها باستخدام ملاقط. من هذه النقطة على، تنفيذ جميع الإجراءات بسرعة وتحت الإضاءة الحمراء الخافتة في 20 ± 1 درجة مئوية.
- عقد الطاير مع ملاقط، وقطع رأس الطاير باستخدام رقاقة شفرة حلاقة شنت في حامل. التقاط دبوس الحشرات (12 ملم طويلة،0.1 ملم في القطر) مع ملاقط و بيرس الرأس بين العينين.
- تغمر لفترة وجيزة الرأس في الايثانول 70٪. وهذا يمنع فقاعات الهواء من تشكيل على رأس / سطح العين. دبوس الرأس تحت إس إس إسقاط على سيليكون طبق تشريح.
- قطع كلتا العينين باستخدام رقاقة شفرة حلاقة باستخدام حركة نشر على طول خط الهامش الأمامي للعين.
- فهم بحزم حافة القرنية واحدة مع ملاقط غرامة.
- مغرفة شبكية العين باستخدام سكوبر.
ملاحظة: عند الانتهاء من هذه الخطوة، سيتم ترك القرنية فارغة وسليمة، مفصولة عن شبكية العين سليمة. - دون الإضرار شبكية العين، واستخدام ملاقط ومغرفة لإزالة بلطف التمسك أكياس الهواء وأنسجة المخ الزائدة.
ملاحظة: إعداد شبكية العين معزولة مفيد أيضا لتحليلات وصمة عار الغربية للبروتينات الشبكية غير محددة 11 ، الأنسجة كامل جبل، والتصوير الشبكية كله. ويمكن أيضا إجراء التسجيلات المشبك التصحيح على فأوتوريسبتورس من شبكية العين كلها 12 . - خذ ماصة تريتشوراتيون مع أكبر قطر، وتوصيله إلى الأنابيب، وردم ماصة مع كمية صغيرة من تيسي من أحد قطرات خزان في طبق بتري شفط لطيف ( أي عن طريق الفم). تنفيذ هذه الخطوة في كل مرة يتم استخدام ماصة أوماتيديا تريتيوراتيون جديدة.
- ضربة بلطف تيسي على شبكية العين اثنين عن طريق الفم ثم رسم الشبكية معزولة في ماصة باستخدام شفط لطيف. توخي الحذر لضمان عدم وجود فقاعات الهواء تدخل ماصة.
- نقل الشبكية معزولة إلى طبق بتري، وتشكيل قطرة صغيرة (~ 20 ميكرولتر)، وغسلها مرة أو مرتين مع تيسي من واحدة من قطرات خزان.
- احتضان شبكية العين في الظلام لمدة 20-25 دقيقة.
- استبدال ماصة تريتوراتي أوماتيدي مع ماصة مع افتتاح أصغر قطرها (باستخدام تيسي جديدة من أحد قطرات خزان كما في الخطوة 4.6 لإعادة ملء ماصة).
- بسرعةنضح و إكسيرات كلا الشبكية في قطرة صغيرة (~ 20 ميكرولتر) لبدء فصل أوماتيديا معزولة.
ملاحظة: في المرحلة الأولى، يجب أن تفكك الدبقية المصطبغة المحيطة بها، وترك الحطام صغيرة واضحة في الحل. - بعد تراكم الحطام الصغيرة الكبيرة، ولكن قبل فصل العديد من أوماتيديا، واستخدام تيسي جديدة من واحدة من قطرات خزان ونقل الشبكية إلى قطرة صغيرة جديدة.
- حدد أصغر ماصة ترييتوراتيون قطر، الردم، والاستمرار في ترايتورات.
ملاحظة: كما أوماتيدييا تبدأ الآن لفصل، وينبغي أن أشكالها ممدود تكون واضحة للعيان تحت قوة عالية من ستيريوميكروسكوب. إذا لزم الأمر، والحفاظ على تغيير ماصات ثريتوراتيون لأقطار أصغر حتى غلة جيدة من أوماتيديا مرئية - مرة واحدة عائد معقول من أوماتيديا مرئية والقطرة لم تعد شفافة، وملء ماصة مع قطرة بأكملها تحتوي على أوماتيديا معزولة و إكسيرات انخفاض بلطف فيأسفل غرفة حمام مملوءة مسبقا مع إس.
- انتظر حوالي 1 دقيقة للسماح للأوماتيديا معزولة لتغرق وتستقر في الجزء السفلي من غرفة حمام.
- باستخدام نظام نضح، بدء تدفق إس في غرفة حمام. تأكد من أن الغرفة مليئة تماما من الحل، من أسفل إلى أعلى، وأن الأرض مغمورة تماما في الحل. الاستمرار في غسل الحمام 4-5x.
ملاحظة: بعد ذلك، لا يلزم نضح المستمر، على الرغم من حمام يجب مسح لفترة وجيزة قبل إدخال ماصة التصحيح الجديدة.
6. كله خلية تسجيل

الشكل 2: نظرة عامة على الإعداد الكهربية والبصرية. الإعداد يحتوي على الحديد، رسمت أسود قفص فاراداي ( F ). يتم تغطية الجانب الأمامي باستخدام الستار الأسود مع شبكة النحاس داخل. هذا التكوينأوراتي تمكن إعداد لتكون مختومة تماما من أي ضوء الضالة ومناسبة لتسجيل المطبات عفوية داكنة. يتم إصلاح المجهر مضان مقلوب ( A ) إلى طاولة مضادة للاهتزاز ( E ). جهاز تسجيل مبصرة يتكون من غرفة حمام الزجاج الاكريليك محلية الصنع ( O ) مع إدخال نضح ( س )، ماصة شفط ( S )، والأرض الفضة الفضة كلوريد ( P ). يتم تركيب غرفة حمام على مرحلة المجهر ( T ) مع محول محلية الصنع. يتم توصيل ماصة تسجيل عن طريق الفضة والفضة كلوريد الأسلاك إلى حامل الزجاج الاكريليك، والذي يتم توصيله إلى مكبر للصوت مرحلة الرأس ( C ). ثم يتم تركيب المرحلة الرأس على ميكرومانيبولاتور الخشنة التي شنت على غرامة شيز ميكرومانيبولاتور الميكانيكية ( B ). يتكون نظام نضح ( D ) من مجموعة حقنة، في حين أن تدفق ليكوييتم التحكم d بواسطة صمامات قرصة ( H ). ويرتبط الرف كهربائيا بنفس الأرض المركزية التي ترتبط بها جميع المعدات داخل قفص فاراداي وتتألف من مضخم التصحيح المشبك ( N )، الذبذبات ( J )، مولد نبض / وظيفة ( K )، A إلى D تحويل ( L )، وحدة تحكم نضح ( I )، وعجلة تصفية ومصراع تحكم ( M ). لتجارب التصوير، تبريد (-110 درجة مئوية، انظر جدول المواد ) يتم توصيل كاميرا كسد عبر منفذ جانبي ( G ). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
ملاحظة: خلال جميع الخطوات التالية، استخدم فقط إضاءة الضوء الأحمر الخافت والتأكد من أن التعرض للأوماتيديا للضوء هو الحد الأدنى ( أي العمل بسرعة وإيقاف مصدر الضوء تشريح وغرفة الإضاءة الحمراء المستخدمة لعرض أوماتيديا عند تنفيذ المهام التي لا تتطلب عرض أوماتيديوم). بالإضافة إلى ذلك، تنفيذ جميع الخطوات التالية وفقا لبروتوكول الكهربية القياسية.
- تحت مجهر مقلوب (40X الهدف)، فحص بعناية كل من أوماتيديا في الحمام واختيار أوماتيديوم مناسبة للتجربة.
- تأكد من أن الغشاء الخارجي لل أوماتيديوم على نحو سلس وسليم، أن المحور الطويل هو تقريبا في زاوية اليمنى بالنسبة لاتجاه نهج القطب (كما رأينا في الشكل 3A )، وأن القسم البعيدة من أوماتيديوم لا تحيط بها أي الأنسجة الزائدة. وضع أوماتيديوم اختيارها في المحور البصري للعدسة الهدف (في وسط مجال الرؤية) لضمان إضاءة موحدة.
- ملء ماصة التصحيح مع حل داخل الخلايا (IS1 أو IS2).
ملاحظة: لياتأكد من استجابة شدة وتحليل عثرة، واستخدام IS1. لقياس إمكانية عكس القنوات الحساسة للضوء، استخدم IS2. - جبل ماصة التصحيح على حامل القطب.
- ضربة في ماصة عن طريق الفم، من خلال أنبوب متصلا حامل القطب، مما تسبب في لملء مع الضغط الإيجابي. إغلاق صمام أنبوب للحفاظ على الضغط.
- باستخدام ميكرومانيبولاتور، إدراج القطب في غرفة حمام.
- توجيه القطب على مقربة من القسم البعيدة من أوماتيديوم، بحيث لا يوجد أي اتصال بين القطب و أوماتيديوم، حتى يمكن ملاحظة ديمبل صغير (بسبب الضغط الإيجابي في ماصة التصحيح) في أوماتيديوم.
- افتح برنامج التسجيل (انظر جدول المواد ). فتح "وحدة اختبار الغشاء" لتطبيق نبضات الجهد مربع المستمر من 2 مف بمعدل 100 هرتز.
- تعيين إمكانية تقاطع إلى "صفر"، عن طريق ضبط المناسب نوb في المشبك التصحيح المشبك لضبط قاعدة نبض مربع إلى "صفر" الحالية
ملاحظة: الإعداد الكهربية يشمل مرحلة الرأس ( أي التضخيم المرحلة الأولى) متصلة مكبر للصوت ( أي التضخيم المرحلة الثانية). وتحول الإشارة التماثلية المضخمة إلى إشارة رقمية باستعمال محول A / D، الذي يسيطر عليه برنامج مثبت على حاسوب بيسي. - الافراج عن الضغط الإيجابي في ماصة عن طريق فتح صمام الأنبوب متصلا حامل القطب. خلق بلطف الضغط السلبي في ماصة عن طريق مص من الأنبوب، مما يؤدي إلى جمعية ماصة إلى غشاء الخلية. إغلاق صمام أنبوب للحفاظ على الضغط.
- تأكد من أن مقاومة القطب ينظر إليها على شاشة الكمبيوتر مرتفعة إلى 100 - 150 MΩ. الافراج عن الضغط السلبي في ماصة يدويا عن طريق فتح صمام الأنبوب متصلا حامل القطب.
- تأكد من أن إلإترود المقاومة إلى 1-2 غيغابايت على الأقل.
ملاحظة: عند هذه النقطة، وقد تم تشكيل ختم بين القطب والمستقبلة للضوء. - إزاحة التيارات بالسعة من ماصة عن طريق ضبط المقبض المناسب في المشبك التصحيح المشبك.
- إنشاء نوبات سريعة، قصيرة، وقوية من الضغط السلبي في القطب، مص عن طريق الفم من الأنبوب متصلا حامل القطب إلى "كسر" في الغشاء مبصرة وخلق تكوين خلية كاملة. بدلا من ذلك، استخدم "زر زاب" لتطبيق نبضات الكهربائية قصيرة ومستطيلة، بدءا من مدة "0.1 مللي ثانية"، أو تطبيق مزيج من كلتا الطريقتين.
ملاحظة: يتم الكشف عن الجيل من تكوين خلية كاملة عن طريق الزيادة المفاجئة في السعة ماصة (عادة ~ 60 يف ل ويلديب R1-6 مبصرة؛ السعة فقط ~ 20 يف يشير إلى تسجيل من مستقبلة ضوئية R7؛ السعة فوق ~ 90 يف يشير إلى تسجيل من اثنينالمستقبلات الضوئية). - تعيين إمكانية عقد من مبصرة للجهد المطلوب (عادة، -70 مف)، يدويا باستخدام المقبض المناسب في مكبر للصوت التصحيح المشبك.
ملاحظة: من الممكن تنفيذ هذه الخطوة بعد الحصول على ختم (الخطوة 6.11) وقبل تكوين خلية كاملة قد تحققت. - إزاحة التيارات السعوية ومقاومة سلسلة (قياس سلسلة مقاومة قيمة أكبر من 25 MΩ يشير إلى أن ماصة القطب قد انسداد)، وإذا لزم الأمر ( أي لتيارات أكبر)، وتطبيق تعويض المقاومة سلسلة باستخدام المقابض المناسبة في مضخم التصحيح المشبك .
- إغلاق الستار الأمامي الأسود من قفص فاراداي للحصول على الظلام الأقصى والعزلة الكهربائية.
- بدء عملية التسجيل باستخدام البرنامج وإدارة المحفزات الخفيفة و / أو المواد الدوائية وفقا للإجراءات التجريبية المطلوبة.
7. في وقت واحد وأولي خلية تسجيلات وكالسيوم 2+ التصوير
- لمؤشرات الكالسيوم 2+ المشفرة وراثيا، عزل أوماتيديا كما هو موضح أعلاه باستخدام D. ميلانوغاستر الذباب معربا عن GCaMP6f 13 . استخدام كاميرا كسد (انظر جدول المواد ) لقياس مضان والتأكد من أن المجهر مجهز مع الإثارة المناسبة والانبعاثات مرشحات ومرآة مزدوج اللون (انظر جدول المواد ) 4 .
- لاستخدام خارجي كا 2 + مؤشر ( الشكل 4 ؛ انظر جدول المواد )، وعزل أوماتيديا كما هو موضح أعلاه. وبالإضافة إلى ذلك، تأكد من أن حل ماصة يتضمن مؤشر الكالسيوم 20-100 ميكرومتر.
- استخدام برامج التصوير (انظر جدول المواد ) للحصول على الصور بمعدل 40 هرتز. أداء الحصول على الصور خلال فترة 10 ثانية الظلام تليها مكثفة 2 ثانية ضوء ستيmulation.
- استخدم برنامج التصوير وحدد منطقة اهتمام (روي). قياس كثافة فلورزنس في عائد الاستثمار. متوسط مضان الظلام (F D ) وطرحه من تسجيلات مضان أثناء الضوء (F L ) التحفيز (F L -F D ). تطبيع هذه القياسات وفقا لشدة مضان في بداية التحفيز الضوء (F L 0 ).
النتائج
وقد مكنت الطريقة الموصوفة التسجيل الدقيق للتيارات الوحدوية الأساسية التي تولد العوامات الكمونية عفوية وخفيفة أثارت، والذي جمع لإنتاج استجابة العيانية للضوء، في ظل ظروف محددة. كما سمحت المقارنة بين ويلديب والذباب الطافرة التي لها عيوب في جزيئات الإشارات الحرجة ( الشكلان 3 و 5 ) 14 و 15 و 16 و 17 و 18 . وبالإضافة إلى ذلك، فإن القدرة على قياس إمكانات انعكاس تحت ظروف ثنائية الأيونية كشفت الخصائص الفيزيائية الحيوية الأساسية للقنوات ترب و ترب مثل (تربل) قنوات 18 ، 19 . كما مكنت من قياس آثار بدائل الأحماض الأمينية في منطقة المسام من ترب التي عدلت كا 2+نفاذية 20 .
استجابة الضوء التي حصل عليها التصحيح المشبك خلية كاملة التسجيلات يعتمد خطيا على شدة الضوء على الأقل 4 أوامر من الحجم. هذا لا يمكن حلها باستخدام إرغ وطرق تسجيل الخلايا. وبناء على ذلك، كشفت سلسلة من الردود على ومضات موجزة من زيادة كثافة ومؤامرة من وظيفة استجابة شدة خطية صارمة من استجابة فلاش مع زيادة شدة الضوء. خطية صارمة يحمل ما لا يقل عن عدة مئات من با، ولكن من النقاش ما إذا كان بعد ذلك هو الخطية أو السيطرة المشبك الذي ينهار ( الشكل 6 ). وتشير هذه النتائج إلى أن الاستجابات العيانية للضوء هي عبارة عن توليف خطي للاستجابات الوحدوية للضوء ( أي المطبات الكمومية).
وقد تم تأسيسها بشكل جيد باستخدام تسجيلات الجهد الذي ضوء خافت التحفيز إنديربط تقلبات الجهد منفصلة ( أي المطبات الكمومية) في معظم الأنواع اللافقارية. تنجم المطبات الكمومية D. ميلانوغاستر من افتتاح متزامن من ~ 15 قنوات ترب و ~ 2 قنوات تربل في ذروة عثرة 18 . يتم إنشاء كل عثرة من امتصاص فوتون واحد، في حين أن استجابة العيانية لأضواء أكثر كثافة هو جمع هذه الردود الأولية 14 ، 21 . المطبات تختلف اختلافا كبيرا في الكمون، والوقت بالطبع، والسعة، حتى عندما تكون ظروف التحفيز متطابقة. توليد عثرة هو عملية عشوائية وصفها إحصاءات بواسون، حيث أن كل استيعابها بشكل فعال الفوتون لا يسبب سوى عثرة واحدة. وتتطلب العلاقة بين الفوتون وحيدة العثرة أن كل خطوة في السلسلة لا تشمل آلية "تشغيل" فعالة فحسب، بل أيضا آلية فعالة "منعطفة". الميزة الوظيفية هي إنتاج أفوتون حساسة جدا مع استجابة عابرة سريعة مناسبة تماما لكل من حساسية والقرار الزمني المطلوبة من قبل النظام البصري. يتم الكشف عن متطلبات آلية إيقاف التشغيل الفعالة عند فشل التصوير الضوئي النشط ( أي ميتارهودوبسين، M) أو هدفه، G q α، ويؤدي إلى الإنتاج المستمر للمطبات لفترة طويلة بعد إيقاف تشغيل الضوء ( الشكل 3 ) 15 ، 22 ، 23 ، 24 .
عثرة يمثل النشاط التعاوني للقنوات ترب / تربل في ميكروفيلوس. وعلى هذا النحو، فإن أي فرضية لتفعيل القناة ينبغي أن تفسر أيضا تنشيط القناة التعاونية. في الآونة الأخيرة، وقد أثبتت هاردي وزملاؤه أن الضوء يثير تقلصات سريعة من مستقبلات ضوئية، مما يشير إلى أن ضوء الحساسيات(ترب / تربل) بوابات ميكانيكية 25 . هذا التنشيط الميكانيكي، جنبا إلى جنب مع البروتونات الملحوظة التي أطلقتها بلك بوساطة بيب 2 التحلل، وتعزيز فتح قنوات ترب / تربل وشرح الطبيعة التعاونية لإنتاج عثرة 26 . حاليا، D. مستقبلات ميلانوغاستر هي واحدة من عدد قليل من النظم التي فوسفوانوسيتيد إشارات وقنوات ترب يمكن دراستها في الجسم الحي ، مما يجعل D. ميلانوغاستر فوتوترانزدكتيون والمنهجية التي تم تطويرها لدراسة هذه الآلية نظام نموذج قيمة للغاية.
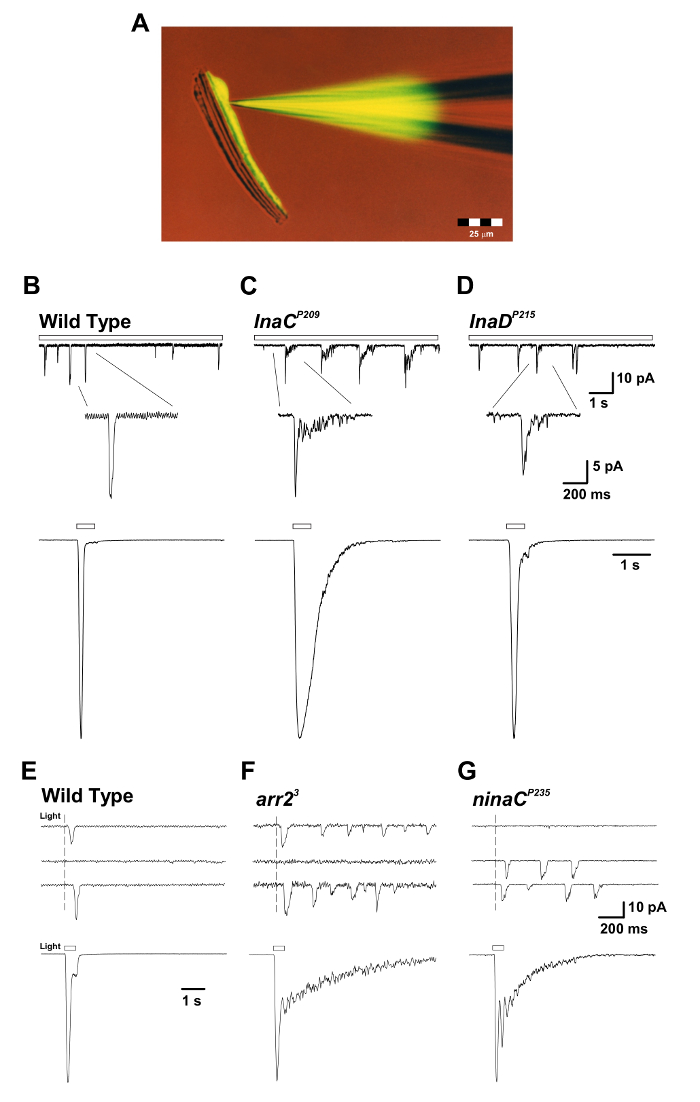
الشكل 3: إناك P209 و P215 إناد المسوخ تكشف استجابة بطيئة إنهاء الاستجابة المجهرية للضوء ومضخات الكم واحدة. ( A ) معزولة أوماتيديوم بريباحصص مع ماصة التصحيح مليئة الفلورسنت لوسيفر الأصفر تش صبغ (الإثارة: 430 نانومتر، الانبعاثات: 540 نانومتر) خلال تسجيل خلية كاملة. لاحظ أن صبغ الفلورسنت منتشر وصفت هيئة خلية مبصرة واحدة وأن الأجسام الخلية مبصرة منفصلة من محاور عصبية ممدود ولكن لا تزال تحافظ على الجدوى. هذا الإعداد هو مناسبة لتسجيلات خلية كاملة في وقت واحد والتجارب التصوير. (بد) الألواح العليا: الجهد خلية كاملة استجابات عثرة الكم فرضت على ضوء خافت المستمر (شريط مفتوح) في وت ، إناك P209 ، و إناد P215 الذباب متحولة. ويلاحظ إنهاء بطيء من المطبات في إناك P209 و إناد P215 المسوخ نسبة إلى الذباب وت . يعرض أدناه أقحم شكل مكبرة من المطبات واحدة. الألواح السفلية: سجلت الخلايا الكاملة المعيارية الاستجابات المجهرية المسجلة لنبضة ضوئية طولها 500 مللي ثانية (1.5 × 10 5 فوتونات لكل ثانية) من ويلديب أعلاه والذباب الطافرة. (إغ) الألواح العليا: كامل خلية الجهد فرضت عثرة الكم الردود على موجزة (1 مللي ثانية)، ضوء خافت استحضار ردود فوتون واحد في ويلديب ، ar2 3 ، و نيناك P235 الذباب متحولة. لاحظ القطار من المطبات لوحظ في arm2 3 و نيناك P235 الذباب متحولة ردا على امتصاص الفوتون واحد. الألواح السفلية: الجهد الكلي خلية الجهد استجابات مقيدة إلى نبض الضوء مس 500 (1.5 × 10 4 فوتونات / ثانية) في المسوخ المقابلة. لاحظ بطء إنهاء الاستجابات العيانية التي لوحظت في ar2 3 و نيناك P235 متحولة الذباب نسبة إلى وت . الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
d / 55627 / 55627fig4.jpg "/>
الشكل 4: الخلوية كا 2 + ديناميات التالية يتأثر إشارة كا 2 + يتأثر تدفق كالفوتين. سلسلة زمنية من الصور مستقبلة للضوء من ويلديب و كين 1٪ الذباب تبين مضان مؤشر كا 2 + خلال التحفيز الضوء. يتم رسم الصور كثافة الخام باستخدام الترميز كاذبة اللون (شريط = 10 ميكرون؛ رؤوس السهام تشير ماصة). الشكل أعيد طبعه بإذن من فايس وآخرون. 4 - الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
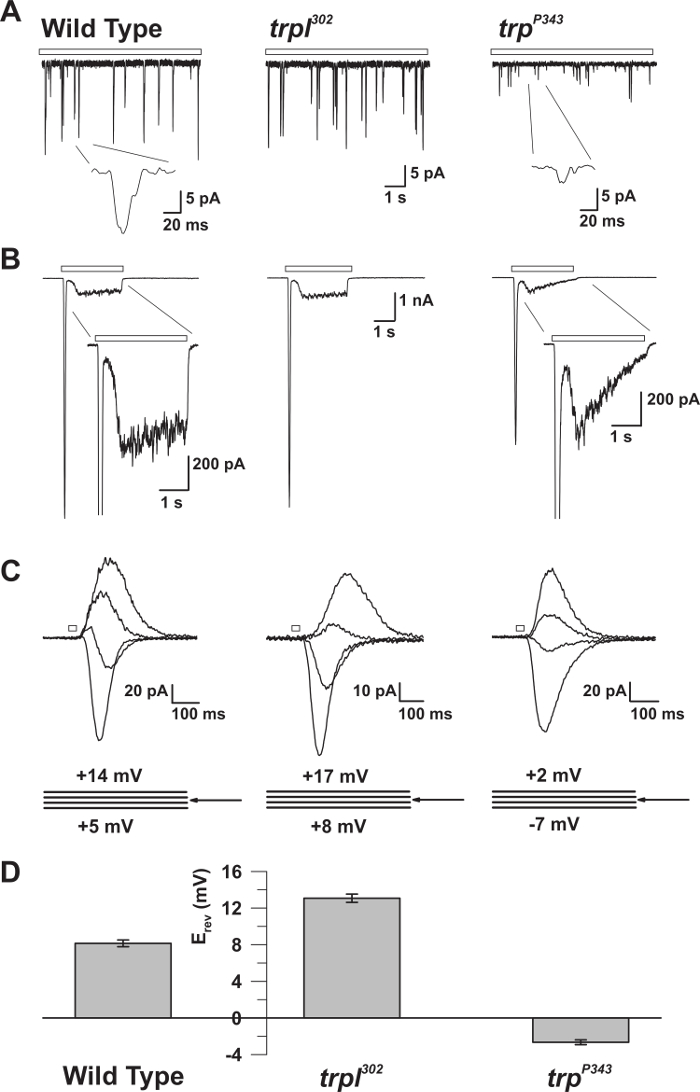
الشكل 5: الخصائص الكهربية من وت، ترب، و تربل المسوخ. ( a ) كامل-- خلية الجهد المشبك ريكوردمس من المطبات الكمومية ردا على ضوء خافت المستمر (شريط مفتوح) في وت، ترب 302 ، و ترب P343 الذباب متحولة فارغة. لوحظت انخفاض كبير في السعة من ترب P34 3 المطبات. أقحم: تظهر المطبات الكم واحدة مكبرة من ويلديب و ترب P343 الذباب متحولة فارغة. ( B ) كامل خلية الجهد المشبك التسجيلات ردا على نبضة ضوء 3 ثانية من ويلديب والمسوخ المقابلة. ويلاحظ استجابة عابرة حالة مستقرة من طافرة P343 متحولة. أقحم: يتم عرض ردود الضوء مكبرة من وت و ترب P343 متحولة. ( C ) عائلة من التيارات التي يسببها ضوء فرضه من سلالات ذبابة أعلاه، أثارت ردا على نبض ضوء 20 مللي ثانية، في خطوات الجهد من 3 مف، وقياس حول احتمال انعكاس (E ريف). ( د ) رسم بياني يتآمر متوسط E ريف ويلديب ومتان مختلفةالخبر. أشرطة الخطأ هي سيم احتمال انعكاس (E ريف) من وت بين E إيجابية من ترب 302 ، الذي يعبر فقط ترب، و E ريف طافرة P343 طافرة فارغة، والتي تعبر عن تربل فقط. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
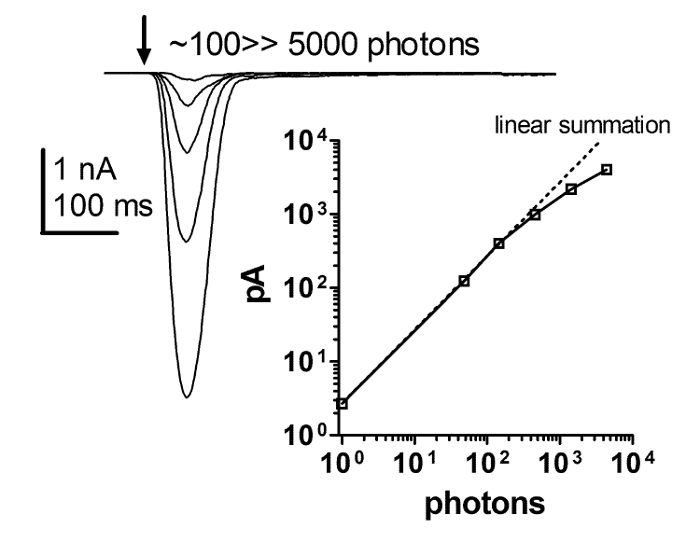
الشكل 6: استجابة فلاش خطي بدقة مع زيادة كثافة الضوء.
سلسلة من الاستجابات الحالية لمضات موجزة من زيادة شدة الضوء ومؤامرة من الاعتماد على اتساع الذروة من استجابة الضوء على زيادة شدة ومضات ضوء وجيزة. هذه العلاقة تكشف عن خطية صارمة بين الاستجابة فلاش وزيادة شدة الضوء. هذه الخطية الصارمةيحمل ما لا يقل عن عدة مئات من با، مع شدة الضوء التي تمتد على 4 أوامر من حيث الحجم، في حين أنه من المشكوك فيه ما إذا كان الخطية أو السيطرة المشبك الذي ينهار بعد ذلك. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| الرقم الهيدروجيني | 7.15 (ضبط مع هيدروكسيد الصوديوم) |
| الكاشف | تركيز (مم) |
| كلوريد الصوديوم | 120 |
| بوكل | 5 |
| مغكل 2 | 4 |
| TES | 10 |
| البرولين | 25 |
| ألانين | 5 |
| مخزن في -20 درجة مئوية. | |
| ملاحظة: هذا الحل هو اسميا كا 2 + مجانا ولكن ليس لديه كا 2+ المخازن المضافة وأضافت وبالتالي سيكون لها ما يقرب من 5-10 ميكرومتر تتبع كا 2 + . حل خارج الخلية (إس) = إس-0Ca 2+ مع 1.5 ملي كاكل 2 ، التي تتم عن طريق إضافة كاكل 2 من 0.5 أو 1 M حل الأسهم إس-0Ca 2+ . | |
الجدول 1: كا + خالية من الحل خارج الخلية (إس). الوصف الكيميائي والكميات المحددة المطلوبة لإنتاج كا + خالية من إس.
| الكاشف | كمية |
| FBS | 15 مل |
| سكر القصب | 1.5 جم |
| تقسيم إلى 150 قسامة ميكرولتر في 1.5 مل قارورة وتخزينها في -20 76، C. | |
| حل تريتوراتيون (تيسي) | ملء 1 قارورة من 150 مل من محلول الأسهم مع 1،350 مل إس أو إس-0Ca 2+ ، لتتناسب مع الحل المستخدم أثناء تشريح. |
الجدول 2: مصل بقري الجنين (فبس) + السكروز - الحل الأسهم. وصف الكيميائية والكميات المحددة المطلوبة لإنتاج مصل الأبقار الجنين (فبس) + السكروز - حل المخزون.
| الرقم الهيدروجيني | 7.15 (ضبط مع كوه) |
| الكاشف | تركيز (مم) |
| غلوكونات البوتاسيوم (كغلو) | 140 |
| مغكل 2 | 2 |
| TES | 10 |
| ملح المغنيسيوم أتب (مغاتب) | 4 |
| ملح صوديوم غتب (نا 2 غتب) | 0.4 |
| β-نيكوتيناميد أدينين هيدروكيد الأدينين (ناد) | 1 |
| مخزن في -20 درجة مئوية. |
الجدول 3: الحل داخل الخلايا (IS1). الوصف الكيميائي والكميات المحددة المطلوبة لإنتاج IS1، والتي تستخدم في الغالب لاستجابة كثافة والقياسات عثرة الكم.
| الرقم الهيدروجيني | 7.15 (ضبط مع سوه) |
| الكاشف | تركيز (مم) |
| CSCL | 120 |
| مغكل 2 | 2 |
| TES | 10 |
| ملح المغنيسيوم أتب (مغاتب) | 4 |
| ملح صوديوم غتب (نا 2 غتب) | 0.4 |
| β-نيكوتيناميد أدينين هيدروكيد الأدينين (ناد) | 1 |
| تيترا-إيثيل-أمونيوم كلوريد (تاي) | 15 |
| مخزن في -20 درجة مئوية. |
الجدول 4: الحل داخل الخلايا (IS2). الوصف الكيميائي والكميات المحددة المطلوبة لإنتاج الحل IS2 داخل الخلايا، والذي يستخدم في الغالب لقياسات انعكاس المحتملة للتيار الناجم عن الضوء.
Discussion
تطبيق التسجيلات خلية كاملة ل D. ميلانوغاستر المستقبلات الضوئية يسمح لاكتشاف والوظيفي توضيح بروتينات التشوير الجديدة، مثل قنوات ترب 27 ، 28 ، 29 و إيناد 30 ، 31 ، 32 بروتين سقالة. من أي وقت مضى منذ إدخال الأولي لهذه التقنية، فإنه مكن من حل المسائل الأساسية على المدى الطويل فيما يتعلق بالآلية الأيونية والجهد الاعتماد على استجابة الضوء. حدث هذا بسبب القدرة الممنوحة على التحكم بدقة في الجهد الغشاء وخارج الخلية وتكوين الأيونية داخل الخلايا 19 ، 28 .
وكانت عقبة رئيسية من تقنية لقط التصحيح في D. ميلانوغاستر هشاشة معزولة أوماتيديبا بريباحصة. وقد كشفت الدراسات التفصيلية أن سلامة الآلات فوتوترانسكتيون يعتمد بشكل حاد على العرض المستمر من أتب، وخصوصا أثناء التعرض للضوء، الأمر الذي يؤدي إلى استهلاك كبير من أتب. لسوء الحظ، والشريط الميكانيكية للخلايا الصباغ ( أي الدبقية)، وهو مطلوب للوصول إلى غشاء مبصرة مع ماصة التصحيح، ويزيل المصدر الرئيسي من الأيضات اللازمة لإنتاج أتب 33 . تطبيق أتب خارجي في ماصة تسجيل يستوفي جزئيا فقط متطلبات لكميات كبيرة من أتب. نقص المعروض من أتب يؤدي إلى تفعيل عفوية للقنوات ترب وإلى تفكك الآلات فوتوترانسكتيون من القنوات تنشيط الضوء، مما تسبب في زيادة كبيرة في كا 2 الخلوية + وإلغاء الاستجابة الطبيعية للضوء 34 ، 35 . هذا التسلسل من الأحداث ليس بسبب الضرر منمستقبلات ضوئية من خلال إجراء تشريح، ولكن بدلا من استنفاد الخلوية من أتب. لمنع هذا التسلسل من الأحداث من حدوث والحفاظ على استجابات الضوء الطبيعي، لا ينبغي أن تتعرض مستقبلات ضوئية لأضواء مكثفة، والتي تستهلك كميات كبيرة من أتب. أيضا، ناد يجب أن تدرج في ماصة تسجيل، ويفترض لتسهيل إنتاج أتب في الميتوكوندريا 18 ، 36 . لقياسات العفوية والكمية المطبات، وصعوبة أعلاه هو الحد الأدنى لأن فقط أضواء خافتة تستخدم. في الممارسة العملية، يمكن الحفاظ على تسجيل خلية كاملة مستقرة لمدة ~ 20-25 دقيقة، على الرغم من أن هناك ميل لحركية الاستجابة لإبطاء خلال هذه الفترة. قد يبقى إعداد واحد من أوماتيديا انفصال قابلة للحياة لمدة تصل إلى 2 ساعة.
وهناك عيب إضافي في إعداد أوماتيديا معزولة هو عدم إمكانية الوصول إلى ميكروفيلي، مما يترجم إلى عدم إمكانية الوصول إلى ترب وقنوات تربل إلى ماصة تسجيل، ومنع التسجيلات قناة واحدة. وباستخدام طريقة طوروها، نجح باسيغالوبو وزملاؤه في تسجيل نشاط قناة واحدة مباشرة من ربدومير 37 . ومع ذلك، يختلف هذا النشاط قناة من تلك القنوات تربل أعرب متغايرة في خلايا زراعة الأنسجة 38 ومن النشاط قناة ترب المستمدة من تحليل الضوضاء النار التي تم الحصول عليها من أوماتيديا معزولة 34 . ويفترض أن إجراء تشريح تضررت كثيرا الخلايا مبصرة عند استخدام هذا الأسلوب.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وقد حظي الجزء التجريبي من هذا البحث بدعم من المنح المقدمة من مؤسسة العلوم الوطنية الأميركية-الإسرائيلية (بم و إيل)، ومؤسسة العلوم الإسرائيلية (إيسف)، و بروجيكتوكوبيراتيون ديوتسش (ديب) (إلى بم)، و بيوتيشنولوغي ومجلس بحوث العلوم البيولوجية (أرقام منحة ببسرك: بب / M007006 / 1 و بب / D007585 / 1) إلى رش
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 5 mL syringe | |||
| 1 mL syringe with elongated tip | |||
| Petri dish | 60 mm | ||
| Syringe filters | Millex | 22 µm PVDF filter | |
| Capillaries (for omatidia separation) | Glass, 1.2 x 0.68 mm (~7.5 cm each) | ||
| Polyethylene Tubing | Becton Dickinson | 1.57 x 1.14 mm (35 cm) | |
| 2 small beakers | 50 mL or less | ||
| 2 paraffin film sheets | Parafilm M | ~5 x 5 cm | |
| Bath chamber | home-made | ||
| Cover slips | 22 x 22 mm No. 0 | ||
| Paraplast Plus | Sigma | Paraffin – polyisobutylene mixture | To glue the coverslip onto the bottom of the bath chamber |
| Ground | Warner Instruments | 64-1288 | Hybrid Assembly Ag-AgCl Wire Assembly |
| Headless micro dissection needle | Entomology, 12 mm | ||
| Micro dissecting needle holder | |||
| Vise | |||
| 2 fine tweezers + 1 rough tweezers | Dumont #5, Biology | 0.05 x 0.02 mm, length 110 mm, Inox | |
| Stereoscopic zoom Microscope | Nikon | SMZ-2B | |
| Cold light source | Schott | KL1500 LCD | |
| Filter (Color) for cold light source | Schott | RG620 | |
| Delicate wipers | Kimtech | Kimwipes | |
| Electrode holder | Warner Instruments | QSW-T10P | Q series Holders compatible with Axon amplifiers, straight body style |
| Silver Wire | Warner Instruments | 0.25 mm diameter, needs to be chloridized | |
| Micromanipulator | Sutter Instruments | MP 85 | Huxley-Wall Style Micromanipulator |
| Faraday cage | home made | Electromagnetic noise shielding and black front curtain | |
| Anti-vibration Table | Newport | VW-3036-OPT-01 | |
| Osilloscope | GW | GOS-622G | |
| Perfusion system | Warner Instruments | VC-8P | Pinch valve control system |
| Perfusion valve controller | Scientific instruments | BPS-8 | |
| Suction system | |||
| Amplifier | Molecular Device | Axopatch-1D | |
| Head-stage | Molecular Device | CV - 4 | Gain: x 1/100 |
| A/D converter | Molecular Device | Digidata 1440A | |
| Clampex | Molecular Device | 10 | software |
| pCLAMP | Molecular Device | 10 | software |
| Light source (Xenon Arc lamp) | Sutter Instruments | Lambda LS | |
| Light detector | home made | phototransistor | |
| Filter wheel and shutter controller | Sutter Instruments | Lambda 10-2 with a Uniblitz shutter | |
| Filters (Natural density filter) | Chroma | 6,5,4,3,2,1,0.5,0.3 | |
| Filter (Color) | Schott | OG590, Edge filter | |
| Xenon Flash Lamp system | Dr. Rapp OptoElecftronic | JML-C2 | |
| Light guide | Quartz | ||
| Pulse generator | AMPI | Master 8 | |
| Microscope | Olympus | IX71, Inverted | |
| Red illumination filter (Microscope) | RG630 / RG645 ø45mm | ||
| Microscope objective | Olympus | X60/0.9 UplanFL N air or X60/1.25 UplanFI oil | |
| CCD Camera | Andor | iXon DU885K | |
| NIS Element | Nikon | AR | software |
| Ca+2 indicator | Invitrogen | Calcium green 5N | |
| Excitation & emission filters and dichroic mirror | Chroma | 19002 - AT - GFP/FITC Longpass set | |
| Vertical pipette puller | Narishige | Model PP83 | Use either vertical or horizontal puller, as preferred. |
| Horizontal pipette puller | Sutter Instrument | Model P-1000 Flaming/Brown Micropipette Puller | |
| Filament | Sutter Instrument | 3 mm trough or square box | |
| Capillaries | Harvard Apparatus | borosilicate glass capillaries | 1 x 0.58 mm |
References
- Hardie, R. C. Whole-cell recordings of the light induced current in dissociated Drosophila photoreceptors: evidence for feedback by calcium permeating the light-sensitive channels. Proc. R. Soc. Lond. B. 245, 203-210 (1991).
- Ranganathan, R., Harris, G. L., Stevens, C. F., Zuker, C. S. A Drosophila mutant defective in extracellular calcium- dependent photoreceptor deactivation and rapid desensitization. Nature. 354, 230-232 (1991).
- Martin, J. H., Benzer, S., Rudnicka, M., Miller, C. A. Calphotin: a Drosophila photoreceptor cell calcium-binding protein. Proc. Natl. Acad. Sci. U.S.A. 90 (4), 1531-1535 (1993).
- Weiss, S., et al. Compartmentalization and Ca2+ buffering are essential for prevention of light-induced retinal degeneration. J Neurosci. 32 (42), 14696-14708 (2012).
- Wang, T., et al. Light activation, adaptation, and cell survival functions of the Na + /Ca 2+ exchanger CalX. Neuron. 45 (3), 367-378 (2005).
- Weckstrom, M., Hardie, R. C., Laughlin, S. B. Voltage-activated potassium channels in blowfly photoreceptors and their role in light adaptation. J. Physiol. Lond. 440, (1991).
- Frolov, R. V., Immonen, E. V., Weckström, M. Performance of blue- and green-sensitive photoreceptors of the cricket Gryllus bimaculatus. J Comp Physiol A Neuroethol Sens Neural Behav Physiol. 200 (3), 209-219 (2014).
- Nasi, E. Whole-cell clamp of dissociated photoreceptors from the eye of Lima scabra. J Gen Physiol. 97 (1), 35-54 (1991).
- Nasi, E., Gomez, M. P. Light-activated ion channels in solitary photoreceptors of the scallop Pecten irradians. J. Gen. Physiol. 99, 747-769 (1992).
- Hardie, R. C., Peretz, A., Pollock, J. A., Minke, B. Ca 2+ limits the development of the light response in Drosophila photoreceptors. Proc. R. Soc. Lond. B. Biol. Sci. 252, 223-229 (1993).
- Kohn, E., et al. Functional Cooperation between the IP3 Receptor and Phospholipase C Secures the High Sensitivity to Light of Drosophila Photoreceptors In Vivo. J Neurosci. 35 (6), 2530-2546 (2015).
- Hevers, W., Hardie, R. C. Serotonin modulates the voltage dependence of delayed rectifier and Shaker potassium channels in Drosophila photoreceptors. Neuron. 14 (4), 845-856 (1995).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Henderson, S. R., Reuss, H., Hardie, R. C. Single photon responses in Drosophila photoreceptors and their regulation by Ca 2. J. Physiol. Lond. 524 (Pt 1), 179-194 (2000).
- Scott, K., Zuker, C. S. Assembly of the Drosophila phototransduction cascade into a signalling complex shapes elementary responses. Nature. 395 (6704), 805-808 (1998).
- Elia, N., Frechter, S., Gedi, Y., Minke, B., Selinger, Z. Excess of G betae over G qalphae in vivo prevents dark, spontaneous activity of Drosophila photoreceptors. J. Cell Biol. 171 (3), 517-526 (2005).
- Katz, B., Minke, B. Phospholipase C-Mediated Suppression of Dark Noise Enables Single-Photon Detection in Drosophila Photoreceptors. J. Neurosci. 32 (8), 2722-2733 (2012).
- Hardie, R. C., et al. Molecular basis of amplification in Drosophila phototransduction. Roles for G protein, phospholipase C, and diacylglycerol kinase. Neuron. 36 (4), 689-701 (2002).
- Reuss, H., Mojet, M. H., Chyb, S., Hardie, R. C. In vivo analysis of the Drosophila light-sensitive channels, TRP and TRPL. Neuron. 19, 1249-1259 (1997).
- Liu, C. H., et al. In vivo identification and manipulation of the Ca 2+ selectivity filter in the Drosophila transient receptor potential channel. J. Neurosci. 27 (3), 604-615 (2007).
- Ahmad, S. T., Natochin, M., Barren, B., Artemyev, N. O., O'Tousa, J. E. Heterologous expression of bovine rhodopsin in Drosophila photoreceptor cells. Invest Ophthalmol Vis Sci. 47 (9), 3722-3728 (2006).
- Scott, K., Sun, Y., Beckingham, K., Zuker, C. S. Calmodulin regulation of Drosophila light-activated channels and receptor function mediates termination of the light response in vivo. Cell. 91 (3), 375-383 (1997).
- Liu, C. H., et al. Ca 2+ -dependent metarhodopsin inactivation mediated by calmodulin and NINAC myosin III. Neuron. 59 (5), 778-789 (2008).
- Cook, B., et al. Phospholipase C and termination of G-protein-mediated signalling in vivo. Nat. Cell Biol. 2 (5), 296-301 (2000).
- Hardie, R. C., Franze, K. Photomechanical responses in Drosophila photoreceptors. Science. 338 (6104), 260-263 (2012).
- Huang, J., et al. Activation of TRP channels by protons and phosphoinositide depletion in Drosophila photoreceptors. Curr. Biol. 20 (3), 189-197 (2010).
- Minke, B., Wu, C. F., Pak, W. L. Isolation of light-induce response of the central retinular cells from the electroretinogram of Drosophila. J. Comp. Physiol. 98, 345-355 (1975).
- Hardie, R. C., Minke, B. The trp gene is essential for a light-activated Ca2+ channel in Drosophila photoreceptors. Neuron. 8, 643-651 (1992).
- Niemeyer, B. A., Suzuki, E., Scott, K., Jalink, K., Zuker, C. S. The Drosophila light-activated conductance is composed of the two channels TRP and TRPL. Cell. 85 (5), 651-659 (1996).
- Huber, A., et al. The transient receptor potential protein (Trp), a putative store- operated Ca 2+ channel essential for phosphoinositide-mediated photoreception, forms a signaling complex with NorpA, InaC and InaD. EMBO J. 15 (24), 7036-7045 (1996).
- Shieh, B. H., Niemeyer, B. A novel protein encoded by the InaD gene regulates recovery of visual transduction in Drosophila. Neuron. 14 (1), 201-210 (1995).
- Tsunoda, S., et al. A multivalent PDZ-domain protein assembles signalling complexes in a G-protein-coupled cascade. Nature. 388 (6639), 243-249 (1997).
- Tsacopoulos, M., Veuthey, A. L., Saravelos, S. G., Perrottet, P., Tsoupras, G. Glial cells transform glucose to alanine, which fuels the neurons in the honeybee retina. J. Neurosci. 14 (3 Pt 1), 1339-1351 (1994).
- Hardie, R. C., Minke, B. Spontaneous activation of light-sensitive channels in Drosophila photoreceptors. J. Gen. Physiol. 103, 389-407 (1994).
- Agam, K., et al. Metabolic stress reversibly activates the Drosophila light-sensitive channels TRP and TRPL in vivo. J Neurosci. 20 (15), 5748-5755 (2000).
- Agam, K., Frechter, S., Minke, B. Activation of the Drosophila TRP and TRPL channels requires both Ca2+ and protein dephosphorylation. Cell Calcium. 35 (2), 87-105 (2004).
- Delgado, R., Muñoz, Y., Peña-Cortés, H., Giavalisco, P., Bacigalupo, J. Diacylglycerol activates the light-dependent channel TRP in the photosensitive microvilli of Drosophila melanogaster photoreceptors. J Neurosci. 34 (19), 6679-6686 (2014).
- Parnas, M., Katz, B., Minke, B. Open channel block by Ca2+ underlies the voltage dependence of Drosophila TRPL channel. J. Gen. Physiol. 129 (1), 17-28 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved