Method Article
שיטה אלקטרו-קולית לקולקציית מתח מלא
In This Article
Summary
כל תא הקלטות של תסיסנית melanogaster photoreceptors לאפשר מדידה של ספונטני בליטות כהה, בליטות קוונטיות, תגובות מאקרוסקופיות לאור, ואת המתח הנוכחי היחסים בתנאים שונים. בשילוב עם ד melanogaster כלים מניפולציה גנטית, שיטה זו מאפשרת את המחקר של inositol- השומן ליפיד המסלול נתיב היעד שלה, ערוץ TRP.
Abstract
כל מתח מתח clamp הקלטות מ תסיסנית melanogaster photoreceptors חוללו מהפכה בתחום transduction חזותית חוליות, המאפשר את השימוש של ד melanogaster מולקולרית גנטיקה ללמוד inositol- ליפידים איתות ו transient קולטן פוטנציאליים (TRP) ערוצים ברמת מולקולה אחת. קומץ מעבדות שולט בטכניקה חזקה זו, המאפשרת ניתוח של תגובות פיזיולוגיות לאור בתנאי מבוקר מאוד. טכניקה זו מאפשרת שליטה על התקשורת תאיים תאיים; מתח הקרום; ואת היישום המהיר של תרכובות פרמקולוגיות, כגון מגוון של אינדיקטורים יוניים או pH, על התקשורת תוך חוץ תאיים. עם יחס אות לרעש גבוה במיוחד, שיטה זו מאפשרת למדוד זרמים חד-ספריים כהים וספונטאניים ( כלומר, ספונטניות וקוונטיות) וזרמים בהזרקה מאקרוסקופית (LIC)Gle ד מלנוגאסטר photoreceptors. פרוטוקול זה מתאר, בפירוט רב, את כל הצעדים העיקריים הדרושים לביצוע טכניקה זו, הכוללת גם אלקטרו הקלטות אלקטרו אופטי. הליך לטיה רטייה זבוב להשגת vivo לשעבר שלם ושל קיימא ommatidia מבודדים בחדר אמבטיה מתואר. הציוד הדרוש כדי לבצע את כל התא פלואורסצנטי הדמיה מדידות מפורטים גם. לבסוף, את מלכודות באמצעות הכנה עדינה זו במהלך ניסויים מורחבים מוסברים.
Introduction
מחקרים גנטיים נרחבים של זבוב הפירות, תסיסנית מלנוגאסטר ( ד מלנוגאסטאר) , שיזמה לפני יותר מ -100 שנה, הקימו את זבוב המלנוגאסטר ד 'כמודל ניסיוני שימושי ביותר עבור הניתוח הגנטי של תהליכים ביולוגיים מורכבים. המתודולוגיה המתוארת להלן משלבת את הכוח המצטבר של גנטיקה מולנוגאסטארית מולקולרית עם היחס בין אות לרעש גבוה של קליפ שלם של קליפים. שילוב זה מאפשר את המחקר של dot melanogaster phototransduction כמודל של inositol- ליפידים איתות ו TRP ערוץ הרגולציה והפעלה, הן בסביבה יליד ברזולוציה הגבוהה ביותר של מולקולות בודדות.
יישום של שיטת הקלטה של כל התא כדי dor melanogaster photoreceptors חוללה מהפכה במחקר של phototransduction חוליות. שיטה זו פותחה על ידי הארדי 1 ו indepבסופו של דבר על ידי Ranganathan ועמיתיו 2 ~ 26 שנים, והוא נועד לנצל את כלי מניפולציה גנטית נרחב של ד melanogaster ולהשתמש בהם כדי לחשוף מנגנונים של phototransduction ו inositol- ליפידים איתות. בתחילה, טכניקה זו סבלה מהורדה מהירה ברגישות לאור ותשואה נמוכה של אומטידיה במהלך תהליך הניתוח, אשר מנע מחקרים כמותיים מפורטים. מאוחר יותר, תוספת של ATP ו NAD כדי פיפטה תיקון להגדיל באופן דרמטי את ההתאמה של ההכנות הקלטות כמותיות ממושכות. לאחר מכן, אפיון נרחב של מנגנון התמרת האות ברמה המולקולרית מומש.
נכון לעכשיו, dot melanogaster phototransduction היא אחת המערכות כמה שבו איתות phosphoinositide ו TRP ערוצים ניתן ללמוד vivo לשעבר ברזולוציה מולקולה אחת. זה עושה ד melanogaster phototransduction ואת ליתיאודולוגיה שפותחה כדי ללמוד מנגנון זה מודל רגיש מאוד. פרוטוקול זה מתאר כיצד לנתח את הרשתית מלנוגאסטר ד ו מכנית רצועת ommatidia מבודדים מן הפיגמנט (תאים) גליל. זה מאפשר את היווצרות של ג 'יגה חותם ואת מהדק תיקון כל תא על גופי התא photoreceptor. למרבה המזל, רוב חלבונים איתות מוגבל ל rhabdomere ולא לפזר. בנוסף, יש חיץ Ca 2 + נייח קרא calphotin, הממוקם בין תא איתות לגוף התא 3 , 4 , ואת רמת ביטוי גבוהה של Na + / Ca 2 + מחליף (CalX) ב microvilli 5 . יחד, את החלבון חלבון rhabdomere, המאגר calphotin, ואת הביטוי הגבוה של CalX לאפשר יחסית ממושכת ( כלומר עד 20 דקות) כל התא הקלטות, ללא אובדן של רכיבים חיונייםשל תהליך phototransduction תוך שמירה על רגישות גבוהה לאור. הפרוטוקול הבא מתאר כיצד להשיג ommatidia מבודד ולבצע הקלטות תא שלם שנראה לשמור על המאפיינים הילידים של מפל phototransduction. כל תא תיקון ניסויים מהדק על מקק מנותק ( Periplaneta אמריקה ) 6 ו קריקט ( Gryllus bimaculatus ) 7 ommatidia בוצעו באופן דומה לזה המתואר עבור ד melanogaster . בנוסף, תיקון ניסויים מהדק על photoreceptors ניתק של צדפות הקובץ, ( סקלה לימה ) ו סקאלופ ( פקטן irradians ) בוצעו בצורה שונה במקצת מזו שנערכה על ד melanogaster , המאפשר מדידות 8 ו-כל ערוץ יחיד 9 . הנה, את ההישגים העיקריים שהושגו ד melanogaster באמצעות טכניקה זו מתוארים. הדיון אכולל את התיאור של כמה מלכודות ומגבלות של טכניקה זו.
Protocol
1. הכנה מגיב
הערה: הכן את כל הפתרונות בהתאם להוראות בלוחות 1-4 .
- מלאו מזרק 10 מ"ל עם פתרון תאיים (ES או ES-0Ca 2 + , כנדרש, ראה טבלה 1 ) ולשמור אותו על הקרח.
- הכן בקבוקון אחד של פתרון Trituration (TS, ראה טבלה 2 , כלומר ES או ES-0Ca 2 + + FBS ו סוכרוז) ולשמור על זה על הקרח.
- הכן מספיק ES עבור הניסוי ולשמור על זה על הקרח עד הצורך.
הערה: זלוף אמבט רציף אינו נדרש, ולכן נפח ES לא צריך להיות יותר מאשר כמה עשרות מ"ל. - באמצעות מסנן PVDF 22 מיקרומטר, לטעון את הפתרון תאיים (ראה טבלה 3 או טבלה 4 ) לתוך מזרק 1 מ"ל עם אלקטרודה מילוי קצה מוארך. שמור את זה על הקרח.
2. כללי ההתקנה של כלים לנתח
"Jove_content" עבור: keep-together.within-page = "1"> 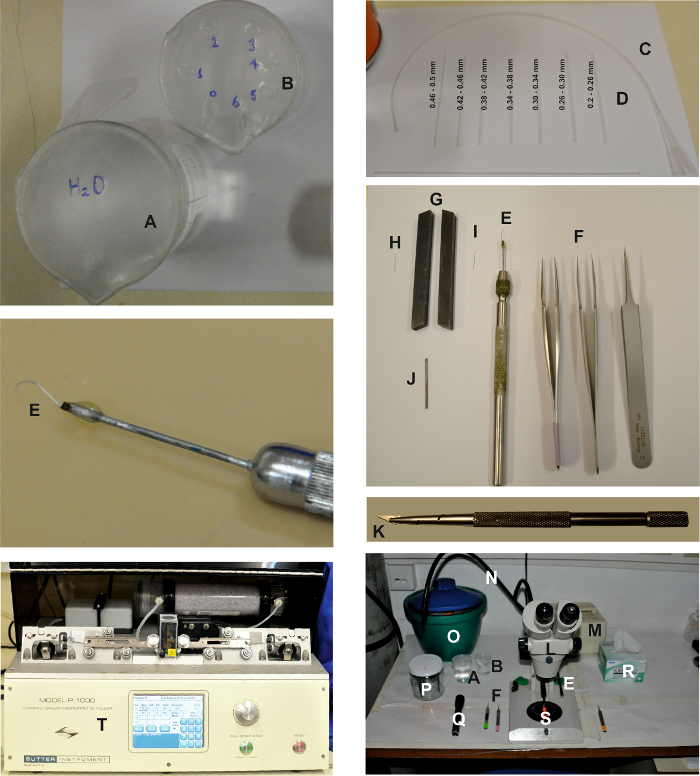
איור 1: כלים ומכשירים הדרושים להכנת הכנת האומטידיה המבודדת. התמונות מציגות את המכשירים השונים הדרושים ליצירת הכנת האומטידיה המבודדת, כמתואר בפרוטוקול המפורט לעיל. שתי כוסות, אחת מלאה במים ( A ) והשנייה מלא באתנול ( B ) לניקוי טפטורות טריטורציה ( D ), המחוברים לצינור ( C ). כלים לנתח הם: 2 זוגות של קנס ו 1 זוג של פינצטה גס ( F ) ו scooper הרשתית ( E ). כדי להכין את scooper הרשתית, מחט מיקרו דיסקציה ( H ) נלחץ בין שני כלים מחרטה מתנהג כמו סגן ( G ) כדי לשטח את החלק העליון של המחט ( I ). ואז הוא מחובר pi מוארך Ece של מתכת באמצעות דבק ( J ) ו רכוב על המחט מחזיק ( E ). סכין גילוח ומחזיק: סכין גילוח קטנה עם סכין גילוח ( K ). אזור העבודה לנתיחה מורכב משקפת ( L ) ומקור אור אדום מגניב (( M), ) עם שני מדריכים אור ( N ). כלים לנתיחה, כולל פינצטה ( F ), סקופרינה הרשתית ( E ), כוסות ( A ו- B ), פנס עם מסנן אדום ( Q ), ואת המגבים עדין ( R ) ממוקמים משני צדי המשקפת. דלי קרח עם ES, FBS-ES, מזרקים פתרון תאיים, צלחת פטרי 60 מ"מ ( S ), ואת מחזיק אלקטרודה ( P ) ממוקמים גם על השולחן. אלקטרודות ההקלטה נמשכות באמצעות משיכה אופקית ( T )."לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו." Target = "_ blank"
- לבנות scooper הרשתית לבודד את הרשתית.
- הכנס את הנקודה (1-4 מ"מ) של מחט מיקרו דיסקציה (מחט אנטומולוגית, 12 מ"מ אורך, 0.1 מ"מ קוטר) בין שני מלתעות מלחך ולשטח אותו על ידי הקשה עם פטיש קטן.
- הר את המחט שטוח על מיקרו מחט לנתח מחט (ראה טבלה של חומרים ).
- בעזרת זוג פינצטה, לעקם את קצה שטוח של המחט כדי ליצור וו עם עקמומיות של ~ 2.5 מ"מ.
- יצירת טפיטורציה טפיטורציה עבור הפרדת ommatidia.
- מניחים 1.2 x 0.68 מ"מ (OD x ID) זכוכית נימי על אש פתוחה להבריק אותו כדי לצמצם את הפתיחה שלו.
- מדוד את גודל פתח נימי מתחת למיקרוסקופ. מיין את טמפרטורות הפיכת ommatidial שנוצר לתוך seveN קבוצות לפי גודל הפתחים שלהן ( כלומר 0.2-0.5 מ"מ). אחסן אותם במיכלים מתאימים נפרדים ( למשל מבחנות).
- ממלאים כוס אחת קטנה עם מים מזוקקים (DDW) ועוד כוס קטנה עם אתנול 70%. מכסים כל כוס עם סרט סרט פרפין.
- פונץ חור אחד קטן בסדין הסרט פרפין מכסה את כוס DDW (ראה איור 1 א ).
- פונץ שבעה חורים קטנים בסדין פרפין הסרט מכסה את אתנול כוס מספר חורים 0 עד 6 (ראה איור 1 ב ).
- מקום אחד פיפטה טחינה פיזור ommatidial מכל גודל הקבוצה בכל חור הסרט פרפין, כך פיפטה עם הפתיחה הגדולה ביותר נמצא החור ה 0 ואת פיפטה עם הפתיחה הקטנה ביותר ממוקם חור ה -6.
- חבר פלסטיק 200 פיפטה μL קצה 35 ס"מ, 1.57 x 1.14 מ"מ (OD x ID) חתיכת צינורות פוליאתילן. ConnecT הקצה השני של הצינור לאחד הטפיחות טחינה פיזור ommatidial עם הפתיחה הגדולה ביותר ( כלומר 0.46 - 0.5 מ"מ), להבטיח כי הקצה המחודד של פיפטה טחינה לא עומד לתוך הצינור.
- הכינו את כל התא בטפטפות הקלטה על ידי משיכת טפיחות תיקון מהדק מ 1 x 0.58 מ"מ (OD x ID) נימה borosilicate המכילים נימים זכוכית.
הערה: ההתנגדות של pipettes צריך להיות 8-15 MΩ בעת שימוש אשלגן מבוסס gluconate פתרון תאיים (IS1). כל תיקון מתאים פיפטה תיקון ניתן להשתמש (לדוגמאות, לראות את טבלה של חומרים ). אש ליטוש לא הכרחי. - הכן חדר ההקלטה (ראה איור 2 ) על ידי תיקון coverslip (ראה טבלה של חומרים ) לתחתית חדר אמבטיה באמצעות פרפין מומס או גבוהה סיליקון שומן ואקום. השתמש בכל בית תוצרת בית או מסחרי המאפשר גישה אלקטרודה זלוף.
- הר אמבטיה על הבמה של מיקרוסקופ הפוך. מניחים את מערכת צינור זלוף, מערכת יניקה, הקרקע ( כלומר Ag- AgCl חוט / גלולה) באמבטיה (ראה טבלה של חומרים איור 2 ).
- מקום שני זוגות של פינצטה # 5 פינצטה ( איור 1 ) על משטח העבודה לשימוש במהלך דיסקציה הרשתית צעדים בידוד ommatidia.
3. ד melanogaster Rearing
- להרים זבובים מלנוגאסטר בצפיפות אוכלוסייה נמוכה ( כלומר ~ 20 זבובים בבקבוק 6 עוז) בבקבוקים המכילים מזון תירס רגיל ב 19-24 מעלות צלזיוס.
הערה: עדיף לעבוד על זבובים כהה המותאמים. כדי לשמור על רגישות גבוהה לאור, להפחית את המגוון ולמנוע ניוון הרשתית בזבובים מוטציה. - אחורי זבובים בחושך לפחות 24 שעות לפני הניסוי.
הערה: זבובים המשמשים את הניסויים צריך להיות receNclly eclosed (<2 h) ועדיין רך, חיוור, ולהציג את meconium. אומטידיה יכולה גם להיות מוכנה בקלות מן הגלמים, אם כי הרגישות שלהם לאור תלויה אז תלולה בגיל 10 .
4. ניתוק רשתית ובידוד אומטידיה: אפשרות 1
הערה: בצע את כל השלבים הבאים תחת מיקרוסקופ זום stereoscopic באמצעות הגברה מתאים לראות את ההכנה כראוי (ראה איור 1 ).
- מקום ארבע טיפות של ES-0Ca 2 + ו טיפה אחת של פתרון TS על צלחת פטרי 60 מ"מ כי כבר התהפך.
- בעזרת פינצטה גסה, לתפוס eclosed החדש (<2 שעות לאחר eclosion) לעוף על ידי כנפיו או הגוף. מנקודה זו ואילך, בצע את כל ההליכים במהירות תחת תאורה אדומה עמום ב 20 ± 1 ° C.
- בעוד עדיין לתפוס את הזבוב עם פינצטה מחוספס, להשתמש הראשון זוג פינצטה בסדר לנתק את הראש לעוף מהגוף. תתRge את הראש הראשון ES-0Ca 2 + ירידה.
- לנתח את הראש במחצית על המטוס sagittal באמצעות זוג השני של פינצטה בסדר. ודא כי, בשלב זה של שלב, שתי העיניים הן עדיין שלם.
- מעבירים חצי אחד של הראש השני ES-0Ca 2 + טיפה וחצי השני השלישי טיפת ES-0Ca 2 + .
- באמצעות פינצטה בסדר, להסיר כמה שרקמות סביב העין ככל האפשר ולהבטיח כי לא נגרם נזק הרשתית.
- בחוזקה לתפוס את קצה אחד הקרנית עם פינצטה בסדר לגרוף את הרשתית באמצעות scooper.
הערה: עם השלמת שלב זה, הקרנית יישאר ריק שלם, מופרדים הרשתית שלם. - שוטפים את פיפטה טחינה קשור צינורות עם DDW ולמלא את פיפטה עם כמות קטנה של ES-0Ca 2 + מן הירידה הרביעית.
הערה: שלב זה חייב להתבצע בכל פעם חדש פיפטה המפריד ommatidia משמש ומוסיר הלוך ושובמ 'אתנול כוס (הפתרון מילוי פיפטה צריך להתאים את הפתרון שבו הרשתית שקוע). - בעדינות לשאוף על ידי הפה כדי לצייר את הרשתית מבודד לתוך פיפטה. השתמש בזהירות רבה לא לשאוף בועות אוויר לתוך פיפטה.
- מעבירים את הרשתית מבודד לירידה של TS. בצע את הצעדים 4.6-4.10 בעין השנייה גם כן.
- נגב את טיפות ES-0Ca 2 + באמצעות מגבונים עדינים, ומשאיר רק את טיפת TS המכיל הן retinae על צלחת פטרי. הוסף שש טיפות נוספות של TS לחלק העליון של צלחת פטרי. מעבירים את שתי הרשתיות לאחת מטיפות TS האחרות.
- החלף את פיפטה טחינה עם פיפטה של פתיחת קוטר קטן יותר. שוטפים אותו כמתואר בשלב 4.8, באמצעות TS כפתרון למלא את פיפטה.
- במהירות ו שוב ושוב לשאוף ו expirate שניהם retinae בפתרון כדי להתחיל את ההפרדה של ommatidia מבודד חשוף של תאים פיגמנט מכל הרשתית כולה.
הערה: האומה המבודדתTidia גלויים טיפה TS, וככל תהליך הבידוד מתקדמת, טיפת TS הופך פחות שקוף. - מעבירים את הרשתית הנותרת לירידה הבאה TS. ממלאים את פיפטה עם טיפה TS כולו לשעבר (המכיל את ommatidia מבודד) ו expirate את הירידה לתוך חדר אמבטיה.
- חזור על שלבים 4.12-4.14 כדי להשיג ommatidia מבודד מקסימלי. המתן כ 1 דקות כדי לאפשר ommatidia מבודד לשקוע לאגד לתחתית חדר האמבט.
- באמצעות מערכת זלוף, להתחיל את זרימת ES-0Ca 2 + עם 1.5 מ"מ Ca 2 + לתוך חדר אמבטיה. ודא כי החדר מלא לחלוטין עם הפתרון, מלמטה למעלה, וכי הקרקע שקוע לחלוטין הפתרון. ממשיכים לשטוף את האמבטיה 4-5x.
5. ניתוק רשתית ובידוד אומטידיה: אפשרות 2
הערה: בצע את כל השלבים הבאים תחת מיקרוסקופ הזום stereoscopic, באמצעות ampliFication מתאים לראות כראוי את ההכנה (ראה איור 1 ).
- הכן שבב סכין גילוח ובעל. לנתק ולהעביר שבב משולש קטן של סכין גילוח באמצעות בעל סכין גילוח ( איור 1 ).
- הכן צלחת סיליקון לנתיחה / בלוק על פי הוראות היצרן (ראה טבלה של חומרים ).
- עבור לנתיחה, ליצור ירידה גדולה (<0.5 מ"ל) של פתרון ES על בלוק לנתיחה סיליקון. הוסף שתי "המאגר" טיפות (~ 50 μL כל אחד) של פתרון TS לצלחת פטרי 60 מ"מ
- לשתק aclosed לאחרונה (<2 שעות לאחר eclosion) לטוס בתוך צינור זכוכית על הקרח להרים אותו על ידי כנפיו באמצעות פינצטה. מנקודה זו ואילך, בצע את כל ההליכים במהירות תחת תאורה אדומה עמום ב 20 ± 1 ° C.
- מחזיק את הזבוב עם פינצטה, לחתוך את הראש של הזבוב באמצעות שבב סכין גילוח מותקן מחזיק. להרים סיכה חרק (12 מ"מ אורך,0.1 מ"מ קוטר) עם פינצטה ו חודרים את הראש בין העיניים.
- קצר לצלול את הראש באתנול 70%; זה מונע בועות אוויר מלהרכיב על הראש / משטח העין. להצמיד את הראש תחת ירידה ES על צלחת לנתיחה סיליקון.
- חותכים את שתי העיניים באמצעות שבב סכין גילוח באמצעות תנועה ניסור לאורך הקו של השוליים הפרונטליים של העין.
- בחוזקה לתפוס את קצה אחד הקרנית עם פינצטה בסדר.
- סקופ את הרשתית באמצעות scooper.
הערה: עם השלמת שלב זה, הקרנית יישאר ריק שלם, מופרדים הרשתית שלם. - מבלי לפגוע הרשתית, להשתמש פינצטה ו scooper להסיר בעדינות דבקי אוויר דבקים ורקמת המוח עודף.
הערה: הכנת retinae מבודד הוא גם שימושי עבור ניתוח כתם המערבי של חלבונים שאינם ספציפיים retinae 11 , היסטולוגיה הר שלם, ואת הדמיה הרשתית כולו. תיקון הקלטות מהדק יכול להתבצע גם על phOtoreceptors מן הרשתית כולה 12 . - קח את פיפטה טחינה עם הקוטר הגדול ביותר, לחבר אותו צינורות, ולמלא את פיפטה עם כמות קטנה של TS מאחד טיפות המאגר בצלחת פטרי ידי יניקה עדינה ( כלומר על ידי הפה). בצע את זה צעד בכל פעם חדש פיפטה טחינה פיזור ommatidia משמש.
- בעדינות מכה TS מעל שתי retinae על ידי הפה ולאחר מכן לצייר retinae מבודד לתוך פיפטה באמצעות יניקה עדינה. השתמש זהירות כדי להבטיח כי אין בועות אוויר להיכנס פיפטה.
- מעבירים את הרשתית מבודד לצלחת פטרי, ויצרו ירידה קטנה (~ 20 μL), ולשטוף אותם פעם או פעמיים עם TS מאחד טיפות המאגר.
- דגירה retinae בחושך במשך 20-25 דקות.
- החלף את פיפטה טחינה פיזור ommatidia עם פיפטה עם פתיחת קוטר קטן יותר (באמצעות TS טרי מאחד טיפות המאגר כמו בשלב 4.6 כדי למלא את פיפטה).
- מַהֵרלשאוב ו expirate הן retinae ב ירידה קטנה (~ 20 μL) כדי להתחיל את ההפרדה של ommatidia מבודד.
הערה: בשלב הראשון, גליה פיגמנט שמסביב צריך להתפורר, משאיר פסולת גלוי קטן בתמיסה. - לאחר שפסולת קטנה משמעותית צברה, אך לפני שאומטידיה רבים נפרדו, השתמשו ב- TS טריים מאחד מאגמי המאגרים והעבירו את הרשתית לירידה קטנה.
- בחר פיפטה טחינה קוטר קטן יותר, מילוי חוזר, ולהמשיך triturate.
הערה: כמו ommatidia עכשיו להתחיל להיפרד, צורות מוארכות שלהם צריך להיות גלוי בבירור תחת הכוח הגבוה של stereomicroscope. במידת הצורך, לשמור על שינוי טפטורות טחינה עד קטרים קטנים יותר עד תשואה טובה של אומטידיה גלוי - לאחר תשואה סבירה של ommatidia גלויים ואת טיפה כבר לא שקוף, למלא את פיפטה עם טיפה כולו המכיל ommatidia מבודדים לפוג את טיפה בעדינות לתוךהתחתון של החדר באמבטיה מראש מלא ES.
- המתן כ 1 דקות כדי לאפשר ommatidia מבודדים לשקוע להתיישב על החלק התחתון של חדר האמבט.
- באמצעות מערכת זלוף, להתחיל את זרימת ES לתוך חדר אמבטיה. ודא כי החדר מלא לחלוטין של הפתרון, מלמטה למעלה, וכי הקרקע שקוע לחלוטין הפתרון. ממשיכים לשטוף את האמבטיה 4-5x.
הערה: לאחר מכן, זלוף מתמשך אינו נדרש, אם כי האמבטיה צריך להיות סומק לרגע לפני החדרת פיפטה תיקון חדש.
6. תא שלם הקלטה

איור 2: סקירה כללית של ההגדרה האלקטרו-אופטית. המתקן מכיל ברזל, צבוע שחור כלוב פאראדיי ( F ). הצד הקדמי מכוסה באמצעות וילון שחור עם רשת נחושת בפנים. תצורה זוהאורטור מאפשר את ההכנה להיות אטום לחלוטין מכל אור תועה והוא מתאים להקלטת בליטות ספונטניות כהות. מיקרוסקופ פלואורסצנטי הפוך ( A ) הוא קבוע שולחן אנטי רטט ( E ). מנגנון הקלטה photoreceptor מורכב תוצרת בית אקריליק תוצרת בית אמבטיה ( O ) עם קלט זלוף ( ש ), פיפטה יניקה ( S ), וכסף כסף כסף כלורי ( P ). תא האמבטיה הוא רכוב על הבמה מיקרוסקופ ( T ) עם מתאם תוצרת בית. פיפטה ההקלטה מחובר באמצעות כסף כסף חוט כלוריד כדי מחזיק זכוכית אקריליק, אשר מחובר לשלב ראש מגבר ( C ). בשלב הראש הוא רכוב מכן על micromanipulator גס כי הוא רכוב על micromanipulator מכני XYZ בסדר ( ב ). מערכת זלוף ( D ) מורכב סט מזרק, בעוד זרימת liquiD נשלטת על ידי שסתומים קמצוץ ( H ). המתלה מחובר באופן חשמלי לאותה קרקע מרכזית שאליה מחובר כל הציוד בתוך כלוב פאראדיי וכולל מגבר מהדק תיקון ( N ), אוסצילוסקופ ( J ), מחולל דופק / פונקציה ( K ), A D ממיר ( L ), בקר זלוף ( I ), גלגל מסנן בקר תריס ( M ). עבור ניסויים הדמיה, מקורר (-110 ° C, ראה טבלה של חומרים ) מצלמה CCD מחובר דרך יציאת צד ( G ). אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
הערה: במהלך כל השלבים הבאים, השתמש רק באור עמום של אור אדום וודא שחשיפה של האומטידיה לאור היא מינימלית ( כלומר, עבודה במהירות ולכבות את מקור האור לנתח ותאורה אדומה קאמרית המשמש לצפייה ommatidia בעת ביצוע משימות שאינן דורשות צפייה ommatidium). בנוסף, בצע את כל השלבים הבאים בהתאם לפרוטוקול אלקטרו-סטנדרטי.
- תחת מיקרוסקופ הפוך (40X אובייקטיבי), לבדוק היטב את כל ommatidia באמבטיה ולבחור אומטידיום מתאים לניסוי.
- ודא כי הקרום החיצוני של האומטידיום הוא חלק ושלם, כי ציר ארוך הוא בערך בזווית ישרה ביחס לכיוון הגישה האלקטרודה (כפי שניתן לראות בתרשים 3A ), וכי הקטע הדיסטלי של האומטידיום אינו מוקף על ידי רקמות עודפות. מניחים את ommatidium הנבחר על ציר אופטי של העדשה אובייקטיבי (במרכז שדה הראייה) כדי להבטיח תאורה אחידה.
- ממלאים פיפטה תיקון עם פתרון תאיים (IS1 או IS2).
הערה: עבוריבטוח התגובה עוצמת ניתוח בליטה, להשתמש IS1. כדי למדוד את פוטנציאל ההיפוך של הערוצים הרגישים לאור, השתמש ב- IS2. - הר פיפטה תיקון על בעל האלקטרודה.
- מכה לתוך פיפטה על ידי הפה, דרך צינור מחובר בעל האלקטרודה, מה שגרם לו למלא בלחץ חיובי. סגור את שסתום צינור כדי לשמור על הלחץ.
- באמצעות micromanipulator, להכניס את האלקטרודה לתוך חדר אמבטיה.
- מדריך את האלקטרודה קרוב לחלק דיסטלי של אומטידיום, כך שאין קשר בין האלקטרודה לבין אומטידיום, עד גומת קטן (בשל הלחץ החיובי פיפטה תיקון) ניתן לראות את אומטידיום.
- פתח את תוכנת ההקלטה (ראה טבלה של חומרים ). פתח את "מודול הבדיקה קרום" כדי להחיל פולסים מתח רציף מרובע של 2 mV בקצב של 100 הרץ.
- הגדרת פוטנציאל צומת "אפס", על ידי התאמת kno המתאיםB ב מגבר מהדק תיקון כדי להגדיר את הבסיס של הדופק מרובע לזרם "אפס"
הערה: ההתקנה electrophysiological כולל שלב ראש ( כלומר הגברה בשלב ראשון) מחובר למגבר ( כלומר הגברה בשלב השני). אות אנלוגי מוגבר מומר אות דיגיטלי באמצעות ממיר A / D, אשר נשלט על ידי תוכנה המותקנת במחשב PC. - שחרר את הלחץ החיובי בפיפטה על ידי פתיחת שסתום של הצינור מחובר בעל האלקטרודה. בעדינות ליצור לחץ שלילי בפיפטה על ידי מציצה מתוך הצינור, המוביל את העמותה של פיפטה לקרום התא. סגור את שסתום צינור כדי לשמור על הלחץ.
- ודא כי התנגדות האלקטרודה שנצפתה על מסך המחשב מורמת ל - 100 - 150 MΩ. שחרר את הלחץ השלילי בפיפטה על ידי פתיחה ידנית של שסתום של הצינור מחובר בעל האלקטרודה.
- ודא כי elההתנגדות ectrode הוא מורם לפחות 1-2 GΩ.
הערה: בשלב זה, חותם נוצר בין האלקטרודה לבין photoreceptor. - לקזז את הזרמים הקיבוליים של פיפטה על ידי התאמת החוגה המתאימה מגבר מהדק תיקון.
- יצירת מהיר, קצר, וחוזק חזק של לחץ שלילי האלקטרודה, מוצץ על ידי הפה מתוך הצינור מחובר בעל האלקטרודה כדי "לשבור" לתוך קרום photoreceptor וליצור תצורה של תא שלם. לחלופין, השתמש בלחצן "Zap" כדי להחיל פולסים חשמליים מלבניים קצרים, המתחילים עם "0.1 ms" או להחיל שילוב של שתי השיטות.
הערה: הדור של תצורת התא כולו מתגלה על ידי עלייה פתאומית קיבול פיפטה (בדרך כלל ~ 60 pF עבור photoreceptor wildtype R1-6, קיבול של רק 20 ~ pF מציין הקלטה מתוך photoreceptor R7, קיבול לעיל ~ 90 pF מציין הקלטה משנייםPhotoreceptors). - הגדר את פוטנציאל ההחזקה של photoreceptor למתח הנדרש (בדרך כלל, -70 mV), באופן ידני באמצעות החוגה המתאימה במגבר מהדק התיקון.
הערה: ניתן לבצע את שלב זה לאחר חותם הושג (שלב 6.11) ולפני תצורת תא שלם הושגה. - לקזז את הזרמים הקיבוליים ואת התנגדות הסדרה (ערך ההתנגדות בסדרה הנמדדת מעל 25 MΩ מציין כי פיפטה האלקטרודה כבר סתומה), ואם נדרש ( כלומר עבור זרמים גדולים יותר), להחיל פיצוי התנגדות סדרה באמצעות הכפתורים המתאימים מגבר מהדק תיקון .
- סגור את המסך הקדמי השחור של כלוב פאראדיי כדי להשיג אפלה מקסימלית בידוד חשמלי.
- להתחיל את תהליך ההקלטה באמצעות התוכנה ולנהל גירויים אור ו / או חומרים פרמקולוגיים על פי הנוהל הניסיוני הרצוי.
7. בו זמניתהקלטות Ole-Cell ו Ca 2 + הדמיה
- עבור מחוונים Ca + + מקודדים גנטית, לבודד את ommatidia כפי שתואר לעיל באמצעות ז melanogaster זבובים להביע GCaMP6f 13 . השתמש במצלמת CCD (ראה טבלה של חומרים ) למדידת הקרינה ולוודא כי המיקרוסקופ מצויד מסננים עירור פליטה תקין ומראה dichroic (ראה טבלה של חומרים ) 4 .
- לשימוש אינדיקטור Ca 2 + אקסוגני ( איור 4 , ראה טבלה של חומרים ), לבודד את ommatidia כמתואר לעיל. בנוסף, להבטיח כי הפתרון פיפטה כולל מחוון סידן 20-100 מיקרומטר.
- השתמש בתוכנת הדמיה (ראה טבלה של חומרים ) לרכוש תמונות בקצב של 40 הרץ. ביצוע רכישת תמונה במהלך תקופה של 10 כהה ואחריו אינטנסיבי 2 s sti אורMulation.
- השתמש בתוכנת הדמיה והגדר אזור עניין (החזר ROI). למדוד את עוצמת הקרינה החזר ה- ROI. ממוצע הקרינה כהה (F D ) ו להחסיר אותו מהקלטות פלואורסצנטי במהלך אור (F L ) גירוי (F L -F D ). מנרמל את המדידות הללו על פי עוצמת הקרינה בתחילת גירוי האור (F L 0 ).
תוצאות
השיטה המתוארת אפשרה את ההקלטה המדויקת של הזרמים האוניברסליים הבסיסיים המייצרים בליטות קוונטיות ספונטניות וקלות, אשר מסכמות את התגובה המאקרוסקופית לאור, בתנאים מוגדרים. היא גם אפשרה השוואה בין זבובים wildtype ו מוטציה כי יש פגמים במולקולות איתות קריטי ( תרשימים 3 ו - 5 ) 14 , 15 , 16 , 17 , 18 . בנוסף, היכולת למדוד פוטנציאל היפוך בתנאים דו-יוניים גילתה מאפיינים ביו-פיסיקליים בסיסיים של TRP ו- TRP (ערוצים) 18 , 19 . זה גם איפשר את המדידה של ההשפעות של חומצות אמינו תחליפים באזור הנקבוביות של TRP כי שונה Ca 2 + שלהחדירות 20 .
התגובה האור המתקבל על ידי תיקון מהדק כל תא הקלטות תלוי ליניארי על עוצמת האור לפחות 4 סדרי גודל. זה לא יכול להיפתר באמצעות ERG ושיטות הקלטה תאיים. לפיכך, סדרה של תגובות על הבזקים קצרים של העוצמה הגוברת ומזימה של פונקציית התגובה האינטנסיבית חשפה ליניאריות קפדנית של תגובת הפלאש עם עוצמת האור הגוברת. הליניאריות הקפדנית מחזיקה עד לפחות כמה מאות pA, אך ניתן להתווכח אם לאחר מכן היא ליניארית או שליטה מהדק כי נשבר ( איור 6 ). תוצאות אלו מצביעות על כך שהתגובות המאקרוסקופיות לאור הן סיכום ליניארי של התגובות היחידות לאור ( כלומר, בליטות קוונטיות).
היא כבר מבוססת היטב באמצעות הקלטות מתח כי אור עמום גירוי indUces תנודות מתח בדידים ( כלומר, הקוונטים bumps) ברוב המינים חסרי חוליות. D מלנוגאסטר הקוונטים bumps תוצאה של פתיחת מושרשת של ~ 15 ערוצים TRP ו ~ 2 TRPL ערוצי בשיא של גבשושית 18 . כל בליטה נוצרת על ידי ספיגתו של פוטון בודד, ואילו התגובה המקרוסקופית לאורות אינטנסיביים יותר היא סיכום של תגובות אלה היסודי 14 , 21 . הבליטות משתנות באופן משמעותי בזמן חביון, זמן ומשרעת, גם כאשר תנאי הגירוי זהים. דור הבליטה הוא תהליך סטוכסטי המתואר על ידי הסטטיסטיקה פואסון, לפיה כל פוטון נספג ביעילות מעורר רק מכה אחת. מערכת הפוטון החד-פעמית דורשת שכל צעד במפל כולל לא רק מנגנון "הפעלה עצמית" יעיל, אלא גם מנגנון "כיבוי" יעיל באותה מידה. היתרון הפונקציונאלי הוא ייצור שלמאוד פוטון רגיש עם תגובה מהירה חולף מתאים מאוד הן את הרגישות ואת הפתרון הזמני הנדרש על ידי מערכת חזותית. הדרישה למנגנון כיבוי יעיל מתגלה כאשר הפוטופיגמנט הפעיל ( כלומר metarhodopsin, M) או היעד שלו, ה- q α α, אינו מצליח להשבית ומוביל לייצור רציף של בליטות זמן רב לאחר כיבוי האור ( איור). 3 ) 15 , 22 , 23 , 24 .
הבליטה מייצגת את הפעילות השיתופית של ערוצי TRP / TRPL ב microvillus. ככזה, כל השערה של הפעלת ערוץ צריך גם להסביר הפעלה ערוץ שיתופית. לאחרונה, הרדי ועמיתיו הוכיחו כי האור מעורר התכווצויות מהירות של photoreceptors, מה שמרמז כי אור רגיש(TRP / TRPL) ניתן לנשל באופן מכני 25 . פעולה מכנית זו, יחד עם הפרוטונים שנצפו על ידי PLC- בתיווך PIP 2 הידרוליזה, לקדם את הפתיחה של ערוצי TRP / TRPL ולהסביר את האופי השיתופי של ייצור בליטה 26 . נכון לעכשיו, dore melanogaster photoreceptors הם אחד המעטים המערכות שבהן איתות phosphoinositide ו TRP ערוצים ניתן ללמוד in vivo , ובכך הפיכת dot melanogaster phototransduction ואת המתודולוגיה פיתחה ללמוד מנגנון זה מערכת מודל יקר מאוד.
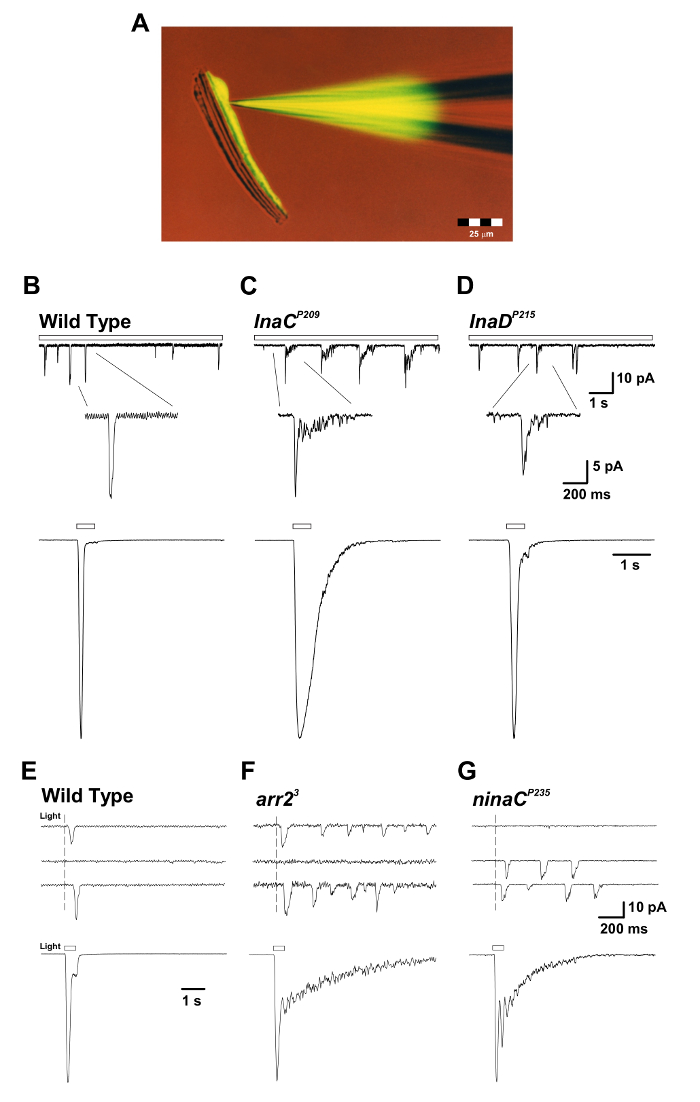
איור 3: inaC P209 ו inaD P215 מוטנטים לחשוף תגובה איטית סיום של תגובה מאקרוסקופית לאור של הבטן הקוונטית יחיד. ( א ) מבודד ommatidium prepaRation עם פיפטה תיקון מלא פלואורסצנטי לוציפר צבע צהוב CH (עירור: 430 ננומטר, פליטה: 540 ננומטר) מוצג במהלך הקלטה בתא שלם. שים לב כי צבע פלואורסצנטי diffused ו שכותרתו תא תא יחיד photoreceptor וכי גופי התא photoreceptor מנותקים מן האקסונים המוארכים שלהם, אך עדיין לשמור על הכדאיות. הכנה זו מתאימה להקלטות תא שלם בו זמנית וניסויי הדמיה. ( BD ) לוחות עליון: מתח של תא שלם הידק התגובות הקוונטית מכה הקפדה על אור עמום רציף (בר פתוח) ב WT, inaC P209 , ו inaD P215 זבובים מוטציה. סיומת איטית של בליטות נצפתה inaC P209 ו inaD P215 מוטציות יחסית זבובים WT. הבלעה להלן מציגה את הצורה המוגדלת של בליטות בודדות. פאנלים תחתונים: תגובות מנורמליות של כל התא שנרשמו בתא מקרוסקופי לדופק אור של 500 מילי-סיביות (1.5 x 10 5 פוטונים לכל ים) של wildtype לעיל זבובים מוטנטים. (EG) פאנלים עליונים: מתח של תא שלם הידק התגובות קוונטית הקצבום קצר (1 MS), אור עמום מעוררים תגובות פוטון יחיד wildtype, arr2 3 , ו זנבות מוטציה ninaC P235 . הערה הרכבת של הבליטות שנצפו arr2 3 ו ניאנק P235 זבובים מוטציה בתגובה ספיגת פוטון בודד. פאנלים תחתונים: מתח של תא שלם הדביק תגובות מנורמל לדופק אור 500 מילישניות (1.5 x 10 4 פוטונים / ים) במוטנטים המתאימים. שים לב לסיום האיטי של התגובות המאקרוסקופיות שנצפו ב- arr2 3 ו ניאנק P235 זבובים מוטציה יחסית WT. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
D / 55627 / 55627fig4.jpg "/>
איור 4: נייד Ca 2 + Dynamics בעקבות איתות המושרה Ca 2 + זרם מושפע על ידי Calphotin. סדרת זמן של תמונות photoreceptor של wildtype ו Cpn 1% זבובים מראה את הקרינה של מחוון Ca 2 + במהלך גירוי האור. תמונות בעוצמה גולמית הם זממו באמצעות שקר צבע קידוד (בר = 10 מיקרומטר, ראשי חצים מצביעים על פיפטה). איור הודפס באישור של Weiss et al. 4 . אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
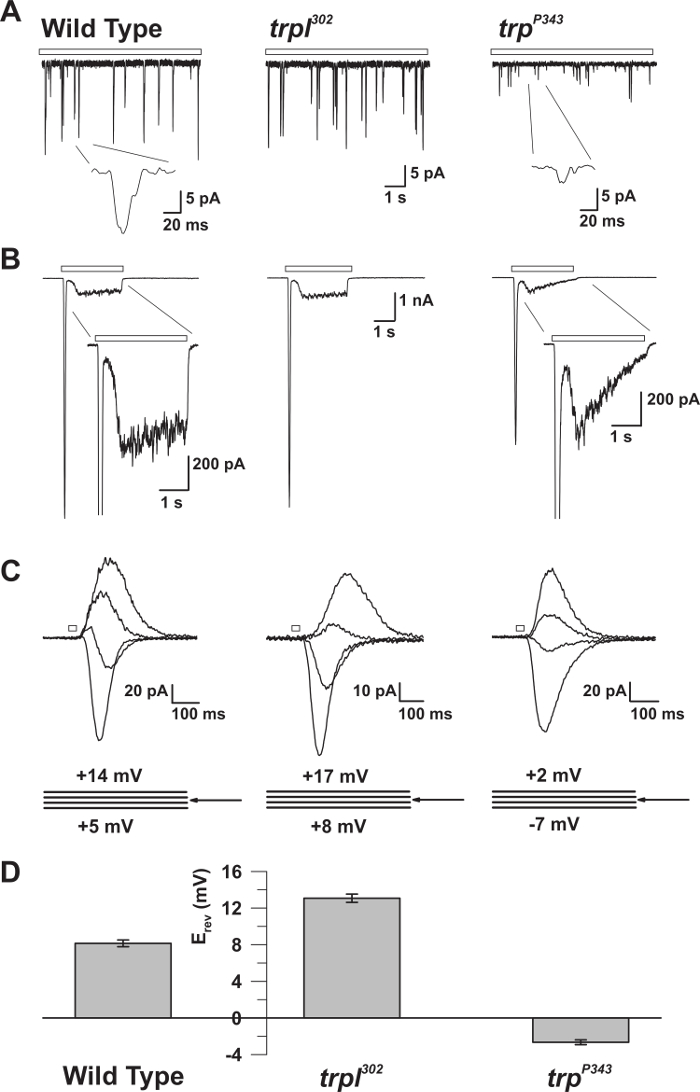
איור 5: המאפיינים האלקטרוניים של WT, trp, ו trpl מוטציות. ( A ) מתח מלא מתח clo recoRdings של קוונטי bumps בתגובה אור עמום רציף (בר פתוח) ב WT, trpl 302 , ו trp P343 זבובים מוטנטים null. אמפליטודות מופחתות מאוד של trp P34 3 bumps הם נצפו. הבלעה: הגדלת בליטות קוונטיות יחיד של wildtype ו trp P343 זבובים מוטנטים n מוצגים. ( ב ) מתח תא מלא clamp הקלטות בתגובה לדופק אור 3 של wildtype ואת מוטציות המתאימים. התגובה הארעית של מצב קבוע של מוטציה P343 trp נצפתה. הבלעה: תגובות אור מוגדל של WT ו trp P343 מוטציה מוצגים. ( ג ) משפחה של זרמים אור המושרה האור של זנים לעיל זבוב, לעורר בתגובה לדופק אור 20 ms, על צעדים מתח של 3 mV, נמדד סביב פוטנציאל היפוך (E rev ). ( ד ) היסטוגרמה המתווימה את הרושם הממוצע של wildtype ואת המוטאנים השוניםTs. ברים שגיאה הם SEM פוטנציאל ההיפוך (E rev ) של WT הוא בין rev חיובי E של trpl 302 , אשר מבטא רק TRP, ואת E rev של טרפ P343 מוטציה trp , המבטא רק TRPL. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
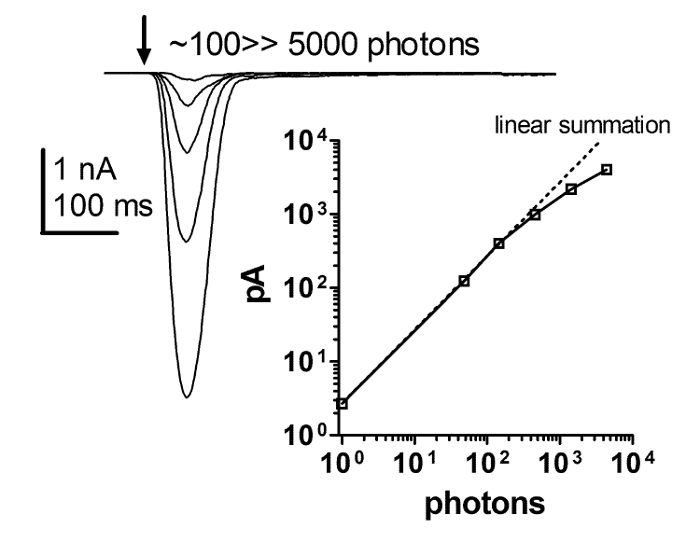
איור 6: תגובה Flash היא ליניארית עם הגדלת עוצמת האור.
סדרה של תגובות עכשוויות על הבזקים קצרים של עוצמת האור הגוברת ומזימה של התלות של משרעת שיא התגובה האור על העוצמה הגוברת של הבזקים אור קצר. מערכת יחסים זו חושפת ליניאריות קפדנית בין תגובת הפלאש לבין עוצמת האור הגוברת. ליניאריות קפדנית זומחזיק עד לפחות כמה מאות PAA, עם עוצמת אור פורש מעל 4 סדרי גודל, בעוד הוא שנוי במחלוקת אם זה ליניאריות או שליטה מהדק כי נשבר לאחר מכן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
| PH | 7.15 (להתאים עם NaOH) |
| מֵגִיב | ריכוז (mM) |
| NaCl | 120 |
| KCl | 5 |
| MgCl 2 | 4 |
| TES | 10 |
| פרולין | 25 |
| אלנין | 5 |
| חנות ב -20 מעלות צלזיוס. | |
| הערה: פתרון זה הוא nomineally Ca 2 + חינם אבל אין Ca 2 + מאגרים הוסיף ולכן יהיה בערך 5-10 מיקרומטר זכר Ca 2 + . פתרון תאיים (ES) = ES-0Ca 2 + עם 1.5 מ"מ CaCl 2 , שנעשו על ידי הוספת CaCl 2 מ 0.5 או 1 M פתרון המניה ES-0Ca 2 + . | |
טבלה 1: Ca +2 - פתרון תאיים חינם (ES). תיאור כימי ואת הכמויות הספציפיות הנדרשות כדי לייצר Ca +2 ללא תשלום ES.
| מֵגִיב | כמות |
| FBS | 15 מ"ל |
| סוכרוז | 1.5 גרם |
| מחלקים אל 150 aliquots μL ב 1.5 מ"ל בקבוקונים לאחסן ב -20 76; C. | |
| פתרון Trituration (TS) | מילוי 1 בקבוקון של 150 מ"ל של פתרון המניות עם 1,350 מ"ל ES או ES-0Ca 2 + , כדי להתאים את הפתרון המשמש במהלך לנתיחה. |
טבלה 2: סרום שור עוברית (FBS) + Sucrose - פתרון המניה. תיאור כימי ואת כמויות ספציפיות נדרש לייצר בסרום שור העובר (FBS) + סוכרוז - פתרון המניה.
| PH | 7.15 (כוונן עם KOH) |
| מֵגִיב | ריכוז (mM) |
| אשלגן gluconate (Kglu) | 140 |
| MgCl 2 | 2 |
| TES | 10 |
| מלח מגנזיום ATP (MgATP) | 4 |
| מלח נתרן GTP (Na 2 GTP) | 0.4 |
| Β-Nicotinamide adenine דינוקליוטיד הידרט (NAD) | 1 |
| חנות ב -20 מעלות צלזיוס. |
טבלה 3: פתרון תאיים (IS1). תיאור כימי ואת הכמויות הספציפיות הדרושות לייצור IS1, המשמש בעיקר לתגובה בעוצמה ומדידות הקוונטים.
| PH | 7.15 (התאם עם CsOH) |
| מֵגִיב | ריכוז (mM) |
| CsCl | 120 |
| MgCl 2 | 2 |
| TES | 10 |
| מלח מגנזיום ATP (MgATP) | 4 |
| מלח נתרן GTP (Na 2 GTP) | 0.4 |
| Β-Nicotinamide adenine דינוקליוטיד הידרט (NAD) | 1 |
| טטרה-אתיל-אמוניום כלורי (TAE) | 15 |
| חנות ב -20 מעלות צלזיוס. |
טבלה 4: פתרון תאיים (IS2). תיאור כימי ואת הכמויות הספציפיות הנדרשות כדי לייצר פתרון תאיים IS2, אשר משמש בעיקר עבור המדידות פוטנציאל היפוך של האור המושרה הנוכחי.
Discussion
היישום של כל תא הקלטות ד מלנוגאסטור photoreceptors מותר גילוי ופונקציונציה תפקודית של חלבונים איתות חדשניים, כגון ערוצי TRP 27 , 28 , 29 ו INAD 30 , 31 , 32 פיגום חלבון. מאז הכניסה הראשונית של טכניקה זו, היא אפשרה את הפתרון של שאלות בסיסיות לטווח ארוך לגבי המנגנון היוני תלות מתח התגובה האור. זה קרה בגלל היכולת להעניק יכולת במדויק את המתח קרום תאיים תאיים הרכב תאיים 19 , 28 .
המכשול העיקרי של הטכניקה מהדק תיקון ב מלנוגאסטר כבר את השבריריות של מבודד ommatidia prepaמָנָה. מחקרים מפורטים גילו כי שלמות של מכונות phototransduction ביקורתית תלויה באספקה מתמשכת של ATP, במיוחד במהלך החשיפה לאור, אשר מוביל לצריכה גדולה של ה- ATP. למרבה הצער, פסים מכניים של פיגמנט ( כלומר גליה) תאים, אשר נדרש להגיע קרום photoreceptor עם פיפטה תיקון, מבטלת את המקור העיקרי של מטבוליטים הדרושים לייצור ATP 33 . יישום של ATP אקסוגני לתוך פיפטה ההקלטה רק חלקית ממלא את הדרישה עבור כמויות גדולות של ATP. אספקת קצר של ATP מוביל הפעלה ספונטנית של ערוצי TRP כדי ניתוק של מכונות phototransduction מן האור מופעל ערוצים, גרימת עלייה גדולה של Ca 2 + הסלולר וביטול התגובה הרגילה לאור 34 , 35 . רצף אירועים זה אינו נובע מנזקPhotoreceptors על ידי הליך לנתיחה, אלא כדי דלדול הסלולר של ה- ATP. כדי למנוע רצף אירועים זה להתרחש ולשמור על תגובות אור נורמלי, photoreceptors לא צריך להיות חשוף אורות אינטנסיביים, אשר צורכים כמויות גדולות של ה- ATP. כמו כן, NAD חייב להיכלל פיפטה ההקלטה, ככל הנראה כדי להקל על הייצור ATP במיטוכונדריה 18 , 36 . עבור מדידות של ספונטני ומכשולים קוונטיים, הקושי הנ"ל הוא מינימלי כי רק אורות עמומים משמשים. בפועל, הקלטה כל תא יציב יכול להישמר ~ 20-25 דקות, אם כי יש נטייה קינטיקה התגובה להאט לאורך תקופה זו. הכנה אחת של ommatidia ניתק עשוי להישאר קיימא עד 2 שעות.
חסרון נוסף של הכנת אומטידיה מבודדת הוא הנגישות של microvilli, אשר מתרגמת את הנגישות של TRP וTRPL ערוצים הקלטה פיפטה, מניעת הקלטות ערוץ יחיד. באמצעות שיטה שפותחה, הצליחו Bacigalupo ועמיתיו להקליט באופן ישיר פעילות ערוץ יחיד מ 37 rhabdomere. עם זאת, פעילות ערוץ זה שונה מזה של ערוצים TRPL הביע heterologously בתרבית רקמות תאים 38 ו מפעילות ערוץ TRP נגזר ניתוח רעש ירו המתקבל ommatidia מבודד 34 . יש להניח, הליך לנתיחה פגום מאוד תאים photoreceptor בעת שימוש בשיטה זו.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
החלק הניסויי של מחקר זה נתמך על ידי מענקים מהקרן הלאומית למדע של ארה"ב-ישראל (ל- BM ו- IL), לקרן המדע הישראלי (ISF), ל- Deutsch-Israelische Projektkooperation (ל- BM) ולביוטכנולוגיה ואת המועצה למדעי הביולוגיה מחקר (BBSRC גרנט מספרים: BB / M007006 / 1 ו BB / D007585 / 1) כדי RCH
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 5 mL syringe | |||
| 1 mL syringe with elongated tip | |||
| Petri dish | 60 mm | ||
| Syringe filters | Millex | 22 µm PVDF filter | |
| Capillaries (for omatidia separation) | Glass, 1.2 x 0.68 mm (~7.5 cm each) | ||
| Polyethylene Tubing | Becton Dickinson | 1.57 x 1.14 mm (35 cm) | |
| 2 small beakers | 50 mL or less | ||
| 2 paraffin film sheets | Parafilm M | ~5 x 5 cm | |
| Bath chamber | home-made | ||
| Cover slips | 22 x 22 mm No. 0 | ||
| Paraplast Plus | Sigma | Paraffin – polyisobutylene mixture | To glue the coverslip onto the bottom of the bath chamber |
| Ground | Warner Instruments | 64-1288 | Hybrid Assembly Ag-AgCl Wire Assembly |
| Headless micro dissection needle | Entomology, 12 mm | ||
| Micro dissecting needle holder | |||
| Vise | |||
| 2 fine tweezers + 1 rough tweezers | Dumont #5, Biology | 0.05 x 0.02 mm, length 110 mm, Inox | |
| Stereoscopic zoom Microscope | Nikon | SMZ-2B | |
| Cold light source | Schott | KL1500 LCD | |
| Filter (Color) for cold light source | Schott | RG620 | |
| Delicate wipers | Kimtech | Kimwipes | |
| Electrode holder | Warner Instruments | QSW-T10P | Q series Holders compatible with Axon amplifiers, straight body style |
| Silver Wire | Warner Instruments | 0.25 mm diameter, needs to be chloridized | |
| Micromanipulator | Sutter Instruments | MP 85 | Huxley-Wall Style Micromanipulator |
| Faraday cage | home made | Electromagnetic noise shielding and black front curtain | |
| Anti-vibration Table | Newport | VW-3036-OPT-01 | |
| Osilloscope | GW | GOS-622G | |
| Perfusion system | Warner Instruments | VC-8P | Pinch valve control system |
| Perfusion valve controller | Scientific instruments | BPS-8 | |
| Suction system | |||
| Amplifier | Molecular Device | Axopatch-1D | |
| Head-stage | Molecular Device | CV - 4 | Gain: x 1/100 |
| A/D converter | Molecular Device | Digidata 1440A | |
| Clampex | Molecular Device | 10 | software |
| pCLAMP | Molecular Device | 10 | software |
| Light source (Xenon Arc lamp) | Sutter Instruments | Lambda LS | |
| Light detector | home made | phototransistor | |
| Filter wheel and shutter controller | Sutter Instruments | Lambda 10-2 with a Uniblitz shutter | |
| Filters (Natural density filter) | Chroma | 6,5,4,3,2,1,0.5,0.3 | |
| Filter (Color) | Schott | OG590, Edge filter | |
| Xenon Flash Lamp system | Dr. Rapp OptoElecftronic | JML-C2 | |
| Light guide | Quartz | ||
| Pulse generator | AMPI | Master 8 | |
| Microscope | Olympus | IX71, Inverted | |
| Red illumination filter (Microscope) | RG630 / RG645 ø45mm | ||
| Microscope objective | Olympus | X60/0.9 UplanFL N air or X60/1.25 UplanFI oil | |
| CCD Camera | Andor | iXon DU885K | |
| NIS Element | Nikon | AR | software |
| Ca+2 indicator | Invitrogen | Calcium green 5N | |
| Excitation & emission filters and dichroic mirror | Chroma | 19002 - AT - GFP/FITC Longpass set | |
| Vertical pipette puller | Narishige | Model PP83 | Use either vertical or horizontal puller, as preferred. |
| Horizontal pipette puller | Sutter Instrument | Model P-1000 Flaming/Brown Micropipette Puller | |
| Filament | Sutter Instrument | 3 mm trough or square box | |
| Capillaries | Harvard Apparatus | borosilicate glass capillaries | 1 x 0.58 mm |
References
- Hardie, R. C. Whole-cell recordings of the light induced current in dissociated Drosophila photoreceptors: evidence for feedback by calcium permeating the light-sensitive channels. Proc. R. Soc. Lond. B. 245, 203-210 (1991).
- Ranganathan, R., Harris, G. L., Stevens, C. F., Zuker, C. S. A Drosophila mutant defective in extracellular calcium- dependent photoreceptor deactivation and rapid desensitization. Nature. 354, 230-232 (1991).
- Martin, J. H., Benzer, S., Rudnicka, M., Miller, C. A. Calphotin: a Drosophila photoreceptor cell calcium-binding protein. Proc. Natl. Acad. Sci. U.S.A. 90 (4), 1531-1535 (1993).
- Weiss, S., et al. Compartmentalization and Ca2+ buffering are essential for prevention of light-induced retinal degeneration. J Neurosci. 32 (42), 14696-14708 (2012).
- Wang, T., et al. Light activation, adaptation, and cell survival functions of the Na + /Ca 2+ exchanger CalX. Neuron. 45 (3), 367-378 (2005).
- Weckstrom, M., Hardie, R. C., Laughlin, S. B. Voltage-activated potassium channels in blowfly photoreceptors and their role in light adaptation. J. Physiol. Lond. 440, (1991).
- Frolov, R. V., Immonen, E. V., Weckström, M. Performance of blue- and green-sensitive photoreceptors of the cricket Gryllus bimaculatus. J Comp Physiol A Neuroethol Sens Neural Behav Physiol. 200 (3), 209-219 (2014).
- Nasi, E. Whole-cell clamp of dissociated photoreceptors from the eye of Lima scabra. J Gen Physiol. 97 (1), 35-54 (1991).
- Nasi, E., Gomez, M. P. Light-activated ion channels in solitary photoreceptors of the scallop Pecten irradians. J. Gen. Physiol. 99, 747-769 (1992).
- Hardie, R. C., Peretz, A., Pollock, J. A., Minke, B. Ca 2+ limits the development of the light response in Drosophila photoreceptors. Proc. R. Soc. Lond. B. Biol. Sci. 252, 223-229 (1993).
- Kohn, E., et al. Functional Cooperation between the IP3 Receptor and Phospholipase C Secures the High Sensitivity to Light of Drosophila Photoreceptors In Vivo. J Neurosci. 35 (6), 2530-2546 (2015).
- Hevers, W., Hardie, R. C. Serotonin modulates the voltage dependence of delayed rectifier and Shaker potassium channels in Drosophila photoreceptors. Neuron. 14 (4), 845-856 (1995).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Henderson, S. R., Reuss, H., Hardie, R. C. Single photon responses in Drosophila photoreceptors and their regulation by Ca 2. J. Physiol. Lond. 524 (Pt 1), 179-194 (2000).
- Scott, K., Zuker, C. S. Assembly of the Drosophila phototransduction cascade into a signalling complex shapes elementary responses. Nature. 395 (6704), 805-808 (1998).
- Elia, N., Frechter, S., Gedi, Y., Minke, B., Selinger, Z. Excess of G betae over G qalphae in vivo prevents dark, spontaneous activity of Drosophila photoreceptors. J. Cell Biol. 171 (3), 517-526 (2005).
- Katz, B., Minke, B. Phospholipase C-Mediated Suppression of Dark Noise Enables Single-Photon Detection in Drosophila Photoreceptors. J. Neurosci. 32 (8), 2722-2733 (2012).
- Hardie, R. C., et al. Molecular basis of amplification in Drosophila phototransduction. Roles for G protein, phospholipase C, and diacylglycerol kinase. Neuron. 36 (4), 689-701 (2002).
- Reuss, H., Mojet, M. H., Chyb, S., Hardie, R. C. In vivo analysis of the Drosophila light-sensitive channels, TRP and TRPL. Neuron. 19, 1249-1259 (1997).
- Liu, C. H., et al. In vivo identification and manipulation of the Ca 2+ selectivity filter in the Drosophila transient receptor potential channel. J. Neurosci. 27 (3), 604-615 (2007).
- Ahmad, S. T., Natochin, M., Barren, B., Artemyev, N. O., O'Tousa, J. E. Heterologous expression of bovine rhodopsin in Drosophila photoreceptor cells. Invest Ophthalmol Vis Sci. 47 (9), 3722-3728 (2006).
- Scott, K., Sun, Y., Beckingham, K., Zuker, C. S. Calmodulin regulation of Drosophila light-activated channels and receptor function mediates termination of the light response in vivo. Cell. 91 (3), 375-383 (1997).
- Liu, C. H., et al. Ca 2+ -dependent metarhodopsin inactivation mediated by calmodulin and NINAC myosin III. Neuron. 59 (5), 778-789 (2008).
- Cook, B., et al. Phospholipase C and termination of G-protein-mediated signalling in vivo. Nat. Cell Biol. 2 (5), 296-301 (2000).
- Hardie, R. C., Franze, K. Photomechanical responses in Drosophila photoreceptors. Science. 338 (6104), 260-263 (2012).
- Huang, J., et al. Activation of TRP channels by protons and phosphoinositide depletion in Drosophila photoreceptors. Curr. Biol. 20 (3), 189-197 (2010).
- Minke, B., Wu, C. F., Pak, W. L. Isolation of light-induce response of the central retinular cells from the electroretinogram of Drosophila. J. Comp. Physiol. 98, 345-355 (1975).
- Hardie, R. C., Minke, B. The trp gene is essential for a light-activated Ca2+ channel in Drosophila photoreceptors. Neuron. 8, 643-651 (1992).
- Niemeyer, B. A., Suzuki, E., Scott, K., Jalink, K., Zuker, C. S. The Drosophila light-activated conductance is composed of the two channels TRP and TRPL. Cell. 85 (5), 651-659 (1996).
- Huber, A., et al. The transient receptor potential protein (Trp), a putative store- operated Ca 2+ channel essential for phosphoinositide-mediated photoreception, forms a signaling complex with NorpA, InaC and InaD. EMBO J. 15 (24), 7036-7045 (1996).
- Shieh, B. H., Niemeyer, B. A novel protein encoded by the InaD gene regulates recovery of visual transduction in Drosophila. Neuron. 14 (1), 201-210 (1995).
- Tsunoda, S., et al. A multivalent PDZ-domain protein assembles signalling complexes in a G-protein-coupled cascade. Nature. 388 (6639), 243-249 (1997).
- Tsacopoulos, M., Veuthey, A. L., Saravelos, S. G., Perrottet, P., Tsoupras, G. Glial cells transform glucose to alanine, which fuels the neurons in the honeybee retina. J. Neurosci. 14 (3 Pt 1), 1339-1351 (1994).
- Hardie, R. C., Minke, B. Spontaneous activation of light-sensitive channels in Drosophila photoreceptors. J. Gen. Physiol. 103, 389-407 (1994).
- Agam, K., et al. Metabolic stress reversibly activates the Drosophila light-sensitive channels TRP and TRPL in vivo. J Neurosci. 20 (15), 5748-5755 (2000).
- Agam, K., Frechter, S., Minke, B. Activation of the Drosophila TRP and TRPL channels requires both Ca2+ and protein dephosphorylation. Cell Calcium. 35 (2), 87-105 (2004).
- Delgado, R., Muñoz, Y., Peña-Cortés, H., Giavalisco, P., Bacigalupo, J. Diacylglycerol activates the light-dependent channel TRP in the photosensitive microvilli of Drosophila melanogaster photoreceptors. J Neurosci. 34 (19), 6679-6686 (2014).
- Parnas, M., Katz, B., Minke, B. Open channel block by Ca2+ underlies the voltage dependence of Drosophila TRPL channel. J. Gen. Physiol. 129 (1), 17-28 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved