Method Article
全細胞電圧クランプ記録のための電気生理学的方法
要約
ショウジョウバエmelanogaster光受容体からの全細胞記録は、様々な条件下での自然発生的な暗いバンプ、量子隆起、光に対する肉眼的応答、および電流 - 電圧関係の測定を可能にする。 D. melanogaster遺伝子操作ツールと組み合わせて、この方法は、遍在するイノシトール - 脂質シグナル伝達経路およびその標的であるTRPチャネルの研究を可能にする。
要約
ショウジョウバエmelanogaster光受容体からの全細胞電圧クランプ記録は、 無細胞視覚伝達の分野に革命をもたらし、イノシトール - 脂質シグナル伝達および一過性受容体電位(TRP)チャネルを単一分子レベルで研究するためのD.メラノガスター分子遺伝学の使用を可能にした。少数の研究室がこの強力な技術を習得し、高度に制御された条件下での光に対する生理学的反応の分析を可能にする。この技術により、細胞内および細胞外の培地を制御することができます。膜電圧;ならびに種々のイオン性またはpH指示薬などの薬理学的化合物の細胞内および細胞外媒体への迅速な適用が含まれる。例外的に高い信号対雑音比で、この方法は、暗い自発的および光誘起単位電流( すなわち、自発的および量子的バンプ)および巨視的光誘起電流(LIC)を罪から測定することを可能にするgle D. melanogaster光受容体。このプロトコルは、電気生理学的および光学的記録の両方を含むこの技術を実行するために必要なすべての重要なステップを詳細に概説している。浴室内のインタクトで生存可能なエクスビボで隔離された眼軟化の達成のためのハエの網膜切開術が記載されている。全細胞および蛍光イメージング測定を行うために必要な装置もまた詳細に記載されている。最後に、拡張された実験中にこの繊細な調製物を使用する際の落とし穴について説明する。
概要
100年以上前に開始されたショウジョウバエDrosophila melanogaster( D. melanogaster)の広範な遺伝子研究は、複雑な生物学的プロセスの遺伝子解剖のための非常に有用な実験モデルとして、 D. melanogaster flyを確立した。以下に記載される方法論は、全細胞パッチクランプ記録の高いシグナル対ノイズ比とD.メラノガスター分子遺伝学の蓄積されたパワーとを組み合わせる。この組み合わせは、ネイティブ環境および単一分子の最高分解能の両方におけるイノシトール - 脂質シグナル伝達およびTRPチャネル調節および活性化のモデルとしてのD. melanogaster光形質導入の研究を可能にする。
D. melanogaster光受容体への全細胞記録法の適用は、無脊椎光伝達の研究に革命をもたらした。この方法はHardie 1によって開発されたもので、2 〜26年前にRanganathanらによって永久に命名され、 D. melanogasterの広範な遺伝子操作ツールを利用して、光伝達およびイノシトール - 脂質シグナル伝達のメカニズムを解明するためにそれらを使用するように設計された。最初に、この技法は、解剖プロセス中の光感受性の急速な低下および眼球の収量の低下が原因で、詳細な定量的研究が妨げられた。その後、パッチピペットにATPおよびNADを添加することにより、長期間の定量的記録のための調製の適合性が劇的に向上した。その後、分子レベルでのシグナル伝達機構の広範な特徴付けが実現された。
現在、 D.メラノガスターの光形質導入は、ホスホイノシチドシグナル伝達およびTRPチャネルを1分子分解能で生体外で研究することができるいくつかのシステムの1つである。これはD.メラノガスターの光伝達と私を作るこのメカニズムを非常に敏感なモデルシステムを研究するために開発した。このプロトコルは、 D. melanogaster網膜を解剖し、周囲の色素(グリア)細胞から単離された眼瞼を機械的に剥がす方法を記載する。これにより、光受容体細胞本体上にギガシールおよび全細胞パッチクランプを形成することが可能になる。幸いにも、ほとんどのシグナル伝達タンパク質は横紋筋に限定され、拡散しません。さらに、シグナルコンパートメントと細胞体3,4の間に位置するcalphotinと呼ばれる不動のCa 2+緩衝液と、微絨毛5の Na + / Ca 2+交換体(CalX)の高発現レベルがあります。一緒に、横紋筋肉へのタンパク質閉じ込め、カルホチン緩衝液、およびCalXの高発現は、必須成分の損失なしに、比較的長期間( すなわち、 〜20分まで)の全細胞記録を可能にする光に対する高い感度を維持しながら、以下のプロトコルは、孤立した眼軟骨を得て、光伝達カスケードの本来の性質を保存するように見える全細胞記録を行う方法を記載する。解離したゴキブリ( Periplaneta americana ) 6およびクリケット( Gryllus bimaculatus ) 7眼瞼の全細胞パッチクランプ実験を、 D. melanogasterについて記載したのと同様に行った 。さらに、ファイルクラム( Lima scabra )およびスカラップ( Pecten照射器 )の解離した光受容体に対するパッチクランプ実験は、D。メラノガスター( melanogaster )で行われたものとはわずかに異なる方法で行われ、全細胞8および単一チャネル測定9 。ここでは、この技術を用いたD. melanogasterで得られた主な成果について述べる。ディスカッションiいくつかの落とし穴の説明とこの技法の限界点については触れていない。
プロトコル
1.試薬の調製
注:すべてのソリューションは、 表1-4の指示に従って準備してください。
- Extracellular Solution(ESまたはES-0Ca 2+ ;必要に応じて、 表1を参照)で10 mLシリンジを満たし、氷上に保ちます。
- 1回のTrituration Solution(TS; 表2参照; すなわち ESまたはES-0Ca 2+ + FBSおよびスクロース)のバイアルを調製し、これを氷上に保つ。
- 実験のために十分なESを準備し、必要になるまで氷上でこれを維持する。
注:連続浴灌流は必要ないので、ESの量は数十mL以上である必要はない。 - 22μmのPVDFフィルターを使用して、細長い先端を充填した電極を備えた1 mLシリンジに細胞内溶液( 表3または表4を参照)をロードする。これを氷の上に置いておきます。
2.解剖ツールの一般的なセットアップ
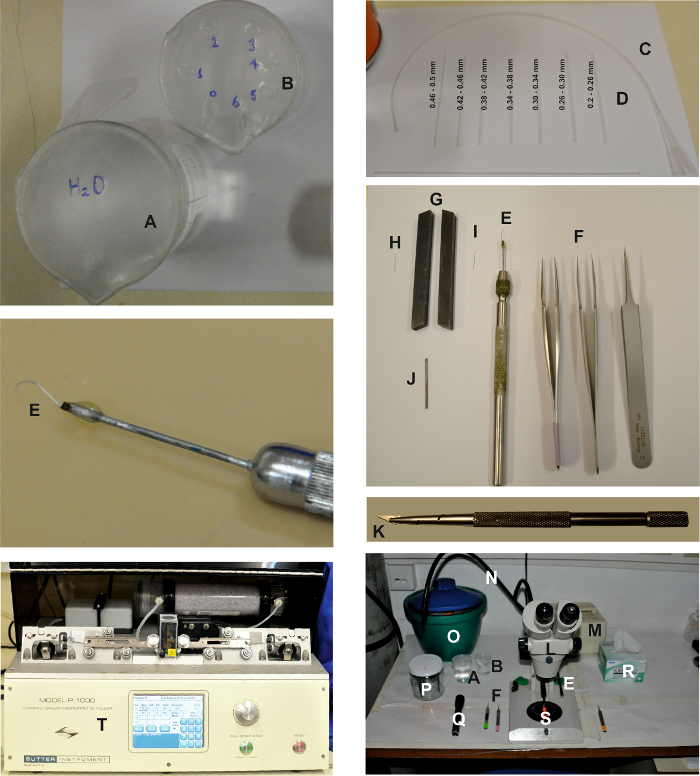
図1:孤立した個体の準備に必要なツールとデバイス。写真は、上記の詳細なプロトコールに記載されているように、孤立した眼軟骨調製物を作製するために必要とされる種々の装置を示す。 2つのビーカーは、チューブ( C )に接続された粉砕ピペット( D )を洗浄するために、水( A )とエタノール( B )で満たされたビーカーです。解剖用具は、2組の細かいものと1組の粗いピンセット( F )と網膜のはしご( E )である。網膜スカーパーを調製するために、針( I )の頂部を平坦にするために、副切開部( G )として働く2つの旋盤ツールの間で微小切開針( H )を押す。次に、それは、細長いπ接着剤( J )を使用して針ホルダー( E )に取り付けられた金属製のものである。かみそりブレードチップとホルダ:かみそりブレードホルダー( K )を使用して、かみそりブレードの小さな三角形チップを切り離して取り付けます。解剖作業領域は、2つの光ガイド( N )を有する双眼鏡( L )とクールな赤色光源( M)とで構成されている。双眼鏡の両側には、ピンセット( F )、網膜スカーパー( E )、ビーカー( AとB )、赤いフィルター付き懐中電灯( Q )、繊細なワイパー( R )などの解剖器具が置かれています。 ES、FBS-ES、細胞内溶液注射器、60mmペトリ皿( S )、および電極ホルダー( P )を備えたアイスバケットもテーブル上に置かれる。記録電極は水平引っ張り装置( T )を用いて引っ張られる。e.com/files/ftp_upload/55627/55627fig1large.jpg "target =" _ blank ">この図の拡大版を表示するには、ここをクリックしてください。
- 網膜を単離するために網膜スコーパーを構築する。
- 2つのバイスジョーの間にマイクロ切開針(昆虫学針、12 mm長さ、直径0.1 mm)の点(1~4 mm)を挿入し、小さなハンマーでタップして平らにする。
- 平らな針をマイクロ解剖針ホルダーに取り付けます( 表の表を参照 )。
- 一対のピンセットを使用して、針の平坦な端部を湾曲させて、約2.5mmの曲率を有するフックを形成する。
- 眼球分離のための粉砕ピペットを作成する。
- 開いたフレームの上に1.2 x 0.68 mm(OD x ID)のガラスキャピラリを置き、ファイアポリッシュして開きます。
- 顕微鏡下で毛細血管開口部の大きさを測定する。作成された核肥大ピペットをseveそれらの開口部の大きさ( すなわち 、0.2〜0.5mm)に応じてn個のグループに分割される。別々の適切な容器( 例:試験管)に保管してください。
- 1つの小型ビーカーに二重蒸留水(DDW)を入れ、別の小型ビーカーにエタノール70%を入れます。各ビーカーをパラフィンフィルムシートで覆う。
- DDWビーカーを覆うパラフィンフィルムシートに1つの小さな穴をあけてください( 図1A参照)。
- エタノールビーカーを覆うパラフィンフィルムシートに7つの小さな穴を穿孔し、0〜6の穴に番号を付けます( 図1B参照)。
- 最大の開口部を有するピペットが0 番目の穴に位置し、最小の開口部を有するピペットが6 番目の穴に位置するように、パラフィンフィルムの各穴に各サイズのグループの1つの耳軟化ピペットを配置する。
- プラスチック製の200μLピペットチップを長さ35cm、長さ1.57 x 1.14 mm(OD x ID)のポリエチレンチューブに接続します。コネクチューブのもう一方の端を、最も大きな開口部( すなわち 、0.46〜0.5mm)を有する核肥大ピペットの1つに接続し、磨砕ピペットの尖った端部がチューブに面していないことを保証する。
- ガラスキャピラリーを含む1 x 0.58 mm(OD x ID)の硼珪酸塩フィラメントからパッチクランプピペットを引っ張って全細胞記録ピペットを調製する。
注:グルコン酸カリウムベースの細胞内溶液(IS1)を使用する場合、ピペットの抵抗は8〜15MΩでなければなりません。任意の適切なパッチピペットプラーを使用することができる(例えば、 表の表を参照 )。火炎研磨は必要ありません。 - 溶融パラフィンまたは高真空シリコーングリースを使用して、カバーガラス( 表の表を参照 )を浴槽の底に固定して、記録チャンバー( 図2参照)を準備します。電極のアクセスと灌流を可能にする任意の適切な自家製または市販のチャンバーを使用する。
- 浴槽を倒立顕微鏡のステージに設置する。灌流システムチューブ、吸引システム、およびグランド(Ag-AgClワイヤ/ペレット)を浴に置きます(材料表および図2参照)。
- 網膜の切開および眼軟骨単離の工程中に使用するために、2対のファイン#5ピンセット( 図1 )を作業面に置きます。
3. D.メラノガスターの飼育
- Raise D. Melanogasterは、19-24℃で標準的なコーンミール食品を含むボトルに含まれる密度が低い( すなわち 、6オンスのボトルで〜20フライ)。
注:ダーク適応フライで作業することが望ましいです。光に対する高い感受性を維持するために、多様性を減少させ、突然変異体ハエの網膜変性を予防する。 - 実験の少なくとも24時間前に、暗闇の中でハエを後退させる。
注:実験に使用されたハエは、(2時間未満)、まだ柔らかく、薄く、胎便を表示する。眼角膜炎は、蛹から容易に調製することもできるが、光に対する感受性は10歳に依存する。
4.網膜切開および外皮分離:オプション1
注:ステレオスコピックズーム顕微鏡の下で、次のすべてのステップを、適切に準備を見るのに適した増幅を使用して実行します( 図1を参照)。
- 裏返された60mmのペトリ皿上にES-0Ca 2+ 4滴とTS溶液1滴を置きます。
- 大まかなピンセットを使用して、新しく閉鎖された(eclosion後<2 h)の翼または体で飛ぶ。この点から、20±1℃の暗赤色照明下で、すべての手順を迅速に実行してください。
- 大まかなピンセットでフライをつかんでいる間、ファインピンセットの最初のペアを使用して、フライヘッドを体から取り外します。サブ最初のES-0Ca 2+ドロップでヘッドを立てます。
- 細かいピンセットの第2のペアを使用して、矢状面に沿って頭を半分に解剖する。このステップの最後に、両方の目が元のままであることを確認してください。
- ヘッドの半分を2番目のES-0Ca 2+ドロップに移し、残りの半分を3番目のES-0Ca 2+ドロップに移します。
- 細かいピンセットを使用して、できるだけ多くの眼を覆う組織を除去し、網膜に害を与えないようにします。
- 1つの角膜の端を細かいピンセットでしっかりと把握し、スコーカーを使用して網膜を掬い取ってください。
注:このステップが完了すると、角膜は無傷のまま残り、無傷の網膜から分離されます。 - DDWでチュービングに接続した粉砕ピペットをすすぎ、第4滴から少量のES-0Ca 2+でピペットを満たします。
注記:このステップは、新しい眼嚢分離ピペットを使用して除去するたびに実行する必要がありますエタノールビーカー(ピペットを満たしている溶液は、網膜が浸水している溶液と一致する必要があります)。 - 静かに口から吸引して、分離した網膜をピペットに引き込みます。ピペットに気泡を吹き込むように注意してください。
- 孤立した網膜をTSの滴に移す。 2番目の目についても、4.6-4.10の手順を実行します。
- デリケートなワイプを使用してES-0Ca 2+の滴を拭き取り、ペトリ皿上の両方の網膜を含むTSの滴だけを残す。ペトリ皿の上部にさらに6滴のTSを加えます。両方のレチナを他のTSドロップの1つに転送します。
- 粉砕ピペットを小径の開口のピペットに交換してください。ピペットを満たすためのソリューションとしてTSを使用して、ステップ4.8で説明したように洗浄します。
- 迅速かつ繰り返して、溶液中の両方の網膜を吸引して切開して、網膜全体から色素細胞を除去した孤立した眼軟骨の分離を開始する。
注:孤立した眼鏡TSドロップで見えており、分離プロセスが進むにつれて、TSドロップの半透明性が低下します。 - 残りの網膜を次のTSドロップに転送します。ピペットを元のTS滴全体(孤立した眼瞼を含む)で満たし、滴を浴室に吐き出す。
- 最大孤立した眼瞼を達成するために、ステップ4.12~4.14を繰り返す。孤立した個眼が沈んで浴槽の底に結合するのを約1分待つ。
- 灌流システムを用いて、1.5mMのCa 2+を含むES-0Ca 2+の浴槽への流れを開始する。チャンバーが底部から上部まで溶液で完全に満たされていること、および地面が溶液に完全に浸水していることを確認します。浴槽を4〜5倍洗浄し続ける。
5.網膜切開および眼球分離:オプション2
注:ステレオスコピックズーム顕微鏡の下で、以下のすべての手順を実行します。製剤を適切に見るのに適した製剤( 図1参照)。
- かみそりの刃のチップとホルダーを準備する。カミソリのブレードホルダーを使用して、カミソリの刃の小さな三角形のチップを切り離して取り付けます( 図1 )。
- 製造者の指示に従って、シリコーン解剖皿/ブロックを準備する( 表の表を参照 )。
- 解剖のために、シリコーン解剖ブロック上に大きな溶液(<0.5mL)のES溶液を作成する。 60ミリリットルのペトリ皿にTS溶液の2つの「リザーバー」滴(それぞれ〜50μL)を加える。
- 新しく閉鎖された(エクローション後2時間)フライを氷上のガラス管に固定し、ピンセットを用いて翼でピックアップします。この点から、20±1℃の暗赤色照明下で、すべての手順を迅速に実行してください。
- ピンセットでフライを保持し、ホルダーにマウントされたかみそりのブレードチップを使用して、フライの頭を切断します。昆虫のピン(12mmの長さ、直径0.1mm)をピンセットで挟み、目の間に頭を突き刺す。
- 短時間、頭部を70%エタノールに浸す。これにより気泡が頭部/目の表面に形成されることが防止される。シリコーン解剖皿のESドロップの下に頭を固定する。
- 目の前縁の線に沿ってのソーイング運動を使用して、かみそりブレードチップを使用して両眼を切断する。
- 細いピンセットで角膜の端をしっかりつかんでください。
- スカーパーを使って網膜をすくい取る。
注:このステップが完了すると、角膜は無傷のまま残り、無傷の網膜から分離されます。 - 網膜を傷つけることなく、ピンセットとスカーフを使用して、付着した気嚢や余分な脳組織を静かに除去します。
注記:単離された網膜の調製は、非特異的網膜タンパク質11 、全マウント組織学および全網膜イメージングのウェスタンブロット分析にも有用である。パッチクランプの録音は、ph網膜全体からの卵受容体12 。 - 最も直径の大きい粉砕ピペットを取り出し、配管に接続し、ゆっくりと吸い取る( すなわち口で)ペトリ皿のリザーバー滴から少量のTSでピペットを埋め戻します。新しい口角調整研削ピペットを使用するたびにこの手順を実行します。
- 静かに2つの網膜上のTSを口から吹き飛ばし、穏やかな吸引を用いて孤立した網膜をピペットに引きます。気泡がピペットに入らないように注意してください。
- 孤立した網膜をペトリ皿に移し、小さな液滴(約20μL)を形成し、それらをリザーバー滴の1つからTSで1回または2回洗浄する。
- 網膜を暗所で20〜25分間インキュベートする。
- 口径の小さい粉砕ピペットを小径の開口部を持つピペットに交換します(ピペットを埋め戻すには、ステップ4.6のようにリザーバー滴の1つから新しいTSを使用します)。
- 急速に孤立した眼軟骨の分離を開始するために、小さな液滴(〜20μL)で両方の網膜を吸引して切る。
注:最初の段階で、周囲の色素沈着グリアは崩壊し、溶液中に目に見える小さな破片が残るはずです。 - かなりの小さな破片が蓄積した後、多くの個眼が分離する前に、リザーバーの液滴の1つから新鮮なTSを使用し、網膜を新しい小さな液滴に移す。
- 小径の摩砕ピペットを選択し、バックフィルして粉砕を続けます。
注:今では眼球運動が分離し始めているので、その細長い形状は実体顕微鏡の高倍率の下ではっきりと見えるはずです。必要であれば、良好な収量の目が見えるようになるまで粉砕ピペットをより小さな直径に変更してください - 適度な収量の目が見えるようになり、滴がもはや半透明でなくなったら、孤立した個体を含む滴全体をピペットに充填し、液滴を静かにESが予め充填された浴室の底部。
- 孤立した個眼が沈んで浴槽の底に沈むのを約1分待つ。
- 灌流システムを使用して、浴室にESの流れを開始する。チャンバーが底部から上部まで溶液で完全に満たされていること、および溶液中に地面が完全に沈んでいることを確認します。浴槽を4〜5倍洗浄し続ける。
注:その後、新しいパッチピペットを導入する前に、浴を短時間洗い流す必要がありますが、連続灌流は必要ありません。
6.全細胞記録

図2:電気生理学的および光学的セットアップの概要。セットアップには、鉄、黒塗装のファラデーケージ( F )が含まれています。フロントサイドは、内部に銅メッシュが付いた黒いカーテンで覆われています。この設定漂遊光から完全に封止され、暗い自発的なバンプを記録するのに適しています。倒立型蛍光顕微鏡( A )は、除振台( E )に固定されている。光受容体記録装置は、灌流入力( Q )、吸引ピペット( S )、および銀塩化銀( P )を有する自家製アクリルガラスバスチャンバー( O )からなる。浴室は、手作りアダプターを用いて顕微鏡ステージ( T )上に取り付けられる。記録ピペットは、銀 - 塩化銀線を介してアクリル製のガラスホルダーに接続され、アクリル製のガラスホルダーはアンプヘッドステージ( C )に接続されています。ヘッドステージは、次に、微細なXYZ機械式マイクロマニピュレータ( B )上に取り付けられた粗いマイクロマニピュレータ上に取り付けられる。灌流システム( D )はシリンジセットで構成され、一方、リキdはピンチ弁( H )によって制御される。パッチ・クランプ・アンプ( N )、オシロスコープ( J )、パルス/ファンクション・ジェネレータ( K )、A〜Fのいずれか1つから構成されています。 Dコンバータ( L )、灌流コントローラ( I )、およびフィルタホイールおよびシャッタコントローラ( M )を含む。イメージング実験では、冷却された(-110℃、材料の表を参照 )CCDカメラがサイドポート( G )を介して接続されています。 この図の拡大版を見るには、ここをクリックしてください。
注:次のすべての手順では、暗い赤色の照明のみを使用して、くまなぎの光への露出が最小限になるようにしてください( つまり 、個眼鏡を見ることを要求しない作業を行う場合には、眼瞼を見るために使用される解剖用光源および室内赤色照明をオフにする)。さらに、標準的な電気生理学的プロトコールに従って以下のステップのすべてを実施する。
- 倒立顕微鏡(40倍の対物レンズ)下で、入浴中のすべての個体を慎重に検査し、実験に適した個体を選択する。
- 個眼球の外膜が滑らかで無傷であり、長軸が電極接近方向に対してほぼ直角であり( 図3Aに見られるように)、個体の遠位部分がいずれかに囲まれていないことを確認する過剰組織。選択した個眼鏡を対物レンズの光軸(視野の中心)に置き、均一な照度を確保します。
- 細胞内溶液(IS1またはIS2)でパッチピペットを充填する。
注:Meaに強度応答とバンプ分析がIS1を使用していることを確認してください。受光チャンネルの反転電位を測定するには、IS2を使用します。 - パッチピペットを電極ホルダーに取り付けます。
- 電極ホルダーに接続されたチューブを通してピペットを口から吹き込み、陽圧で満たします。チューブのバルブを閉じて圧力を維持します。
- マイクロマニピュレーターを使用して、電極を浴室に挿入する。
- 口腔内で小さなディンプル(パッチピペットの正圧による)が観察されるまで、電極と個体間の接触がないように、電極を個体の遠位部に近づける。
- 記録ソフトウェアを開きます( 表の表を参照 )。 "メンブレンテストモジュール"を開き、2mVの連続的な方形電圧パルスを100Hzのレートで印加します。
- 適切なノーを調整することによって、接合電位を「ゼロ」に設定するbをパッチクランプアンプに入れて、方形パルスのベースを「ゼロ」電流に設定します
注:電気生理学的セットアップには、アンプに接続されたヘッドステージ( すなわち、第1ステージ増幅)( すなわち、第2ステージ増幅)が含まれる。増幅されたアナログ信号は、PCコンピュータにインストールされたソフトウェアによって制御されるA / D変換器を使用してデジタル信号に変換される。 - 電極ホルダーに接続されたチューブのバルブを開くことにより、ピペットの正圧を解放します。チューブから吸い出すことによって、ピペットの陰圧を静かに作り、細胞膜へのピペットの会合をもたらす。チューブのバルブを閉じて圧力を維持します。
- コンピュータの画面に表示されている電極抵抗が100〜150MΩに上昇していることを確認します。電極ホルダーに接続されたチューブのバルブを手動で開き、ピペット内の負圧を解放します。
- エル電気抵抗が少なくとも1〜2GΩに上昇する。
注記:この時点で、電極と感光体との間にシールが形成されている。 - パッチクランプアンプの適切なノブを調整して、ピペットの容量性電流をオフセットします。
- 電極ホルダーに接続されたチューブから吸い口を吸い出し、受光体膜に「壊れ」、全体のセル構成を作り出します。あるいは、「Zapボタン」を使用して、「0.1 ms」の持続時間で始まる短い長方形の電気パルスを適用するか、または両方の方法の組み合わせを適用します。
注:全細胞構成の生成は、ピペット静電容量の突然の増加(通常、野生型R1-6光受容体では約60pFであり、約20pFの静電容量はR7光受容体からの記録を示し、 〜90 pFは2つからの録音を示します光受容体)。 - パッチクランプアンプの適切なノブを使用して、感光体の保持電位を必要な電圧(通常は-70mV)に設定します。
注記:シールが得られた後(ステップ6.11)、全セル構成が達成される前に、このステップを実行することが可能です。 - 容量性電流と直列抵抗を相殺します(25MΩを超える測定直列抵抗値は電極ピペットが詰まっていることを示します)。必要に応じて( つまり大きな電流の場合)、パッチクランプアンプの適切なノブを使用して直列抵抗補償を適用します。
- ファラデーケージの黒い先幕を閉じて、最大の暗闇と電気的分離を得てください。
- ソフトウェアを使用して記録プロセスを開始し、所望の実験手順に従って光刺激および/または薬理学的物質を投与する。
7.同時にWhオレ - 細胞記録およびCa 2+イメージング
- 遺伝的にコードされたCa 2+指示薬については、GCaMP6fを発現するD. melanogasterハエを使用して、上記のようにして個体を単離する。 蛍光測定にはCCDカメラ( 表の表を参照 )を使用し、顕微鏡に適切な励起および発光フィルターとダイクロイックミラー( 表の表を参照 )が装備されていることを確認します4 。
- 外因性のCa 2+インジケータ( 図4 ;材料の表を参照 )の使用のためには、上記のように眼球を単離する。さらに、ピペット溶液に20〜100μMのカルシウムインジケータが含まれていることを確認してください。
- 40 Hzの速度で画像を取得するには、画像ソフトウェア( 表の表を参照 )を使用します。 10秒間の暗時間中に画像取得を行い、続いて強い2秒間の光照射を行う交配。
- イメージングソフトウェアを使用し、関心領域(ROI)を定義します。 ROIの蛍光強度を測定する。暗色蛍光(F D )を平均し、光(F L )刺激(F L -F D )中の蛍光記録から差し引く。光刺激の開始時の蛍光強度(F L 0 )に従ってこれらの測定値を標準化する。
結果
記載された方法は、定義された条件下で、光に対する巨視的応答を生成するために合計される自発的および光誘発量子隆起を生成する基本単位電流の正確な記録を可能にした。また、重要なシグナル伝達分子( 図3および5 )14,15,16,17,18に欠損を有する野生型および突然変異体ハエの比較も可能にした。さらに、二イオン条件下で逆電位を測定する能力は、TRPおよびTRP様(TRPL)チャネルの基本的な生物物理学的特性を明らかにした18,19。 TRPの細孔領域におけるアミノ酸置換の影響を測定し、そのCa 2+を修飾した透磁率20 。
パッチクランプ全細胞記録によって得られる光応答は、少なくとも4桁の光強度に直線的に依存する。これは、ERGおよび細胞内記録方法を用いて解決することはできなかった。したがって、増加する強度の簡単なフラッシュに対する一連の応答および強度応答関数のプロットは、光度の増加に伴うフラッシュ応答の厳密な直線性を明らかにした。厳密な直線性は少なくとも数百pAまで保持されますが、その後はリニアリティであるのか、またはブレークダウンするクランプ制御であるのかは議論の余地があります( 図6 )。これらの結果は、光に対する巨視的応答が、光( すなわち、量子隆起)に対する単一応答の線形合計であることを示唆している。
光刺激indを薄暗くする電圧記録を用いてよく確立されている大部分の無脊椎動物種では個別の電圧変動( すなわち量子隆起)が生じる。 D.メラノガスターの量子バンプは、バンプ18の頂点に〜15個のTRPチャネルと〜2個のTRPLチャネルが協調して開かれた結果生じる。それぞれのバンプは単一光子の吸収によって生成されるが、より強い光に対する巨視的応答はこれらの基本応答の合計である14,21。バンプは、刺激条件が同一であっても、待ち時間、時間経過および振幅において著しく変化する。バンプ生成はポアソン統計によって記述される確率論的プロセスであり、それによってそれぞれが効果的に吸収される光子は1つのバンプのみを引き出す。シングルフォトン - シングルバンプ関係では、カスケードの各ステップに効率的な「ターンオン」メカニズムだけでなく、同様に効果的な「ターンオフ」メカニズムも含まれている必要があります。機能上の利点は、非常に敏感な光子計数器であり、視覚系によって要求される感度および時間分解能の両方に非常によく適した高速過渡応答を有する。効率的なターンオフメカニズムの必要性は、活性フォトピグメント( すなわち、メタロドプシン、M)またはそのターゲットである Gqαが不活性化に失敗し、光がオフになった後も継続してバンプが連続的に生じる場合に明らかになる3 ) 15,22,23,24 。
バンプは、微絨毛におけるTRP / TRPLチャネルの協同的活性を表す。このように、チャネル活性化の仮説は、協調チャネル活性化も説明すべきである。最近Hardieらは、光が光受容体の急速な収縮を誘発することを実証しており、光感受性eチャネル(TRP / TRPL)は機械的にゲートされていてもよい25 。この機械的活性化は、PLC媒介PIP 2加水分解によって放出される観測されたプロトンと一緒に、TRP / TRPLチャネルの開口を促進し、バンプ生成の協同的性質を説明する。現在、 D. melanogaster光受容体は、ホスホイノシチドシグナル伝達およびTRPチャネルをインビボで研究することができるいくつかのシステムの1つであり、 D. melanogaster光形質導入を作成し、このメカニズムを研究する方法論が非常に貴重なモデルシステムである。
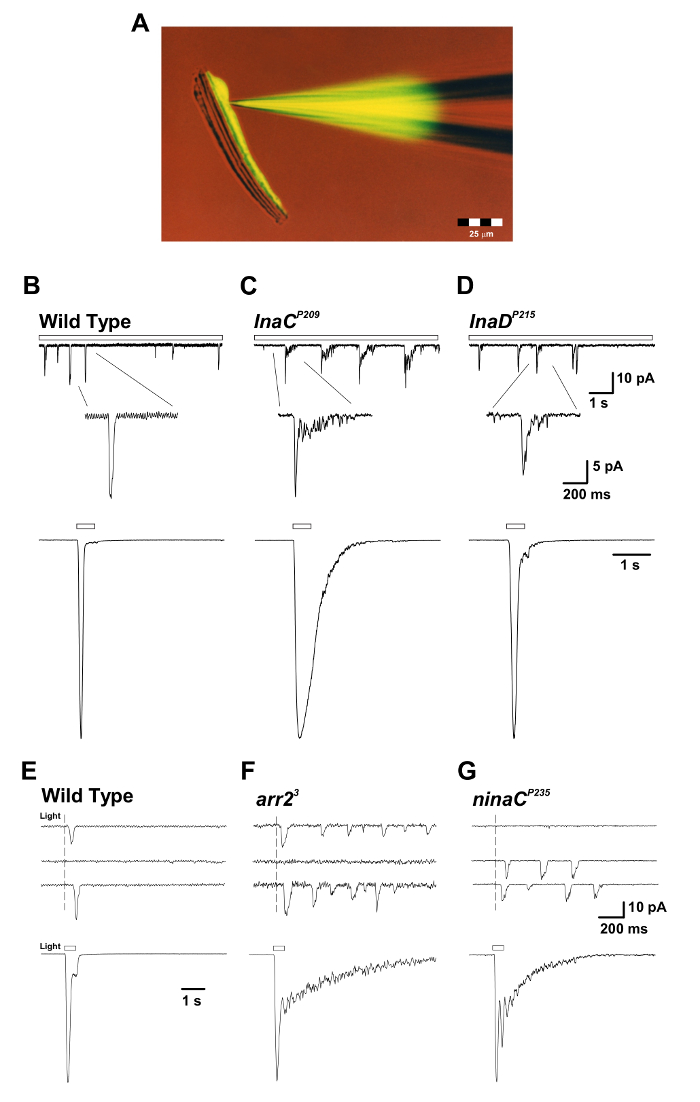
図3:inaC P209およびinaD P215突然変異体は、光および単一量子隆起の巨視的応答の遅い応答終結を明らかにする。 ( A )単離したオマチジウムプレパ全細胞記録の間に、蛍光Lucifer Yellow CH色素(励起:430nm;発光:540nm)で満たされたパッチピペットを用いて定量する。蛍光色素は単一の光受容体細胞体を拡散して標識し、光受容体細胞体はそれらの細長い軸索から引き離されるが生存能力を維持することに留意されたい。この調製は、全細胞同時記録および画像化実験に適している。 ( BD )上部パネル:WT、 inaC P209 、およびinaD P215突然変異体ハエにおける連続的な薄暗い光(オープンバー)に対する全細胞電圧クランプ量子塊応答 。バンプのゆっくりとした終結が、WTハエと比較してinaC P209およびinaD P215突然変異体で観察される。以下の挿入図は、単一のバンプの拡大された形状を示しています。下部パネル:上記野生型の500ms光パルス(1.5×10 5光子/秒)に対する標準化全細胞応答の巨視的応答を記録した突然変異体ハエ。 (EG)上のパネル:野生型、 arr2 3 、およびninaC P235突然変異体ハエの単一光子応答を誘発する短時間(1ms)の薄暗い光に対する全細胞電圧クランプされた量子バンプ応答。単一の光子吸収に応答して、 arr2 3およびninaC P235突然変異体ハエで観察されるバンプの列に注目されたい。ボトムパネル:対応する突然変異体の500ms光パルス(1.5×10 4光子/秒)に対する全細胞電圧クランプ正規化応答。 arr2 3で観察された巨視的応答の緩慢な終結に注意してください ninaC P235突然変異体はWTと比較して飛ぶ。 この図の拡大版を見るには、ここをクリックしてください。
d / 55627 / 55627fig4.jpg "/>
図4:信号誘発Ca 2+流入後の細胞内Ca 2+ダイナミクスは、カルホチンによって影響を受ける。野生型およびCpn 1%の光受容体画像の時系列は、光刺激中のCa 2+指示薬の蛍光を示す。生強度画像は、偽色コーディング(棒=10μm;矢印はピペットを示す)を用いてプロットされる。 Weiss らの許可を得て再版された図。 4 。 この図の拡大版を見るには、ここをクリックしてください。
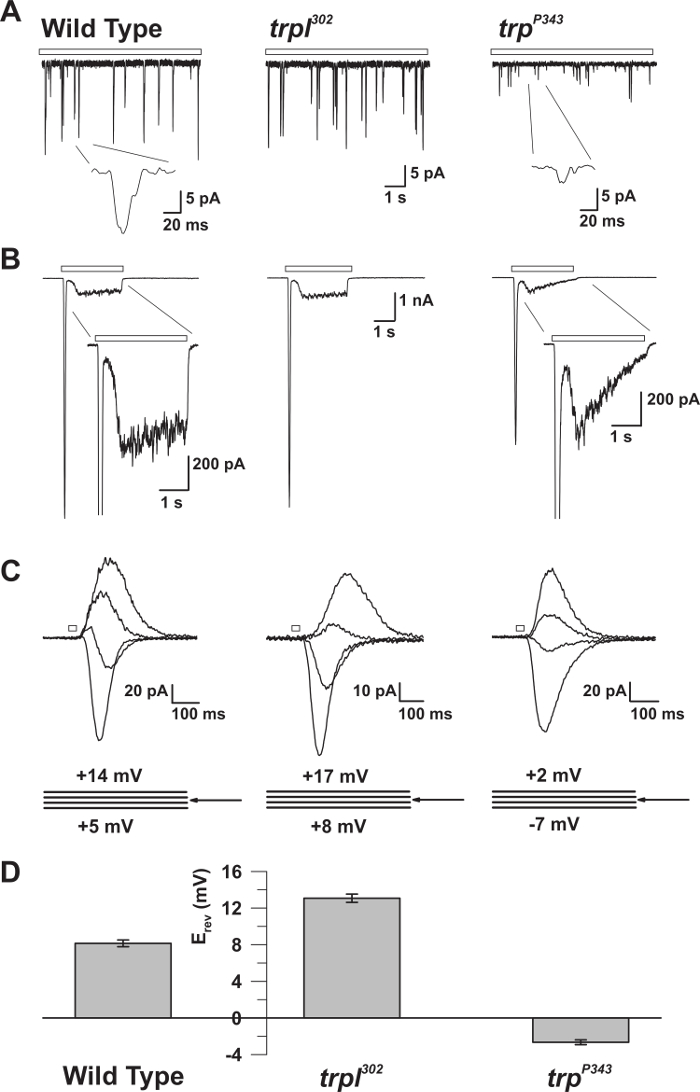
図5:WT、trp、およびtrpl変異体の電気生理学的性質。 ( A )全セル電圧クランプ・リコWT、 trp302 、およびtrp P343ヌル突然変異体ハエにおける連続的な薄暗い光(オープンバー)に応答する量子隆起の範囲。 trp P34 3バンプの振幅が大きく減少しています。挿入:野生型およびtrp P343ヌル突然変異体ハエの拡大単一量子隆起が示される。 ( B )野生型および対応する突然変異体の3秒の光パルスに応答する全細胞電圧クランプ記録。 trp P343変異体の一過性定常状態応答が観察される。挿入:WTおよびtrp P343突然変異体の拡大された光応答が示される。 ( C )逆電位(E rev )付近で測定した、3mVの電圧ステップで、20msの光パルスに応答して誘発された、上記フライひずみの重畳された光誘起電流のファミリー。 ( D ) 野生型の平均E revおよび種々のムタンをプロットするヒストグラムts。エラーバーはSEMである.WTの逆転電位(E rev )は、TRPのみを発現するtrp302の正のE revと、TRPLのみを発現するtrp P343ヌル変異体のE revとの間にある。 この図の拡大版を見るには、ここをクリックしてください。
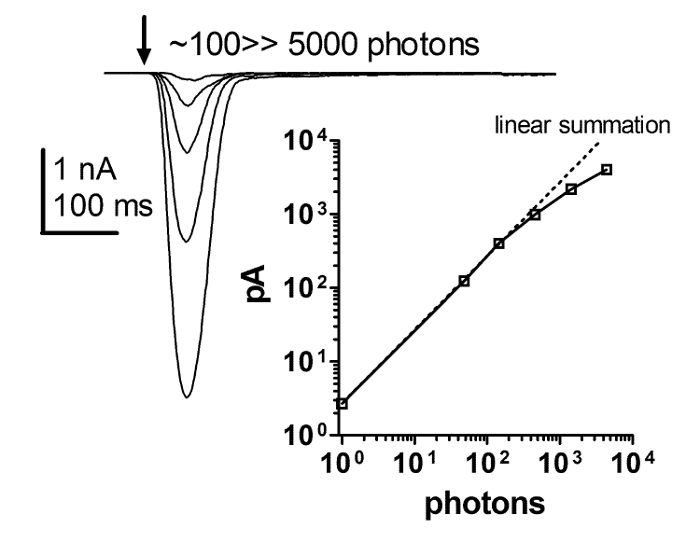
図6:フラッシュレスポンスは、光強度が増加するにつれて厳密に線形です。
増加する光強度の簡単なフラッシュに対する即時の一連の応答と、短い光フラッシュの増加する強度に対する光応答のピーク振幅の依存性のプロット。この関係は、フラッシュ応答と光度の増加との間の厳密な直線性を明らかにする。この厳しい直線性光強度が4桁以上に及ぶ、少なくとも数百pAを保持するが、それが直線性であるかそれ以降に分解するクランプ制御であるかは議論の余地がある。 この図の拡大版を見るには、ここをクリックしてください。
| pH | 7.15(NaOHで調整) |
| 試薬 | 濃度(mM) |
| NaCl | 120 |
| KCl | 5 |
| MgCl 2 | 4 |
| TES | 10 |
| プロリン | 25 |
| アラニン | 5 |
| -20℃で保存する。 | |
| 注:この溶液は、名目上はCa 2+を含まないが、Ca 2+緩衝液を添加していないため、約5〜10μMのCa 2+トレースを有するであろう。細胞外溶液(ES)= 0.5mMまたは1Mストック溶液からCaClをES-0Ca 2+に添加して調製した1.5mM CaCl 2を含むES-0Ca 2+ 。 | |
表1:Ca +2を含まない細胞外溶液(ES)。化学物質の説明およびCa +2を含まないESの製造に必要な特定の量。
| 試薬 | 量 |
| FBS | 15mL |
| スクロース | 1.5g |
| 1.5mLバイアルで150μLアリコートに分け、-20℃で保存する 76; C。 | |
| 粉砕溶液(TS) | 解剖中に使用された溶液と一致するように、ストック溶液150mLの1バイアルにESまたはES-0Ca 2+ 1350mLを充填する。 |
表2:胎児ウシ血清(FBS)+ショ糖ストック溶液。胎児ウシ血清(FBS)+ショ糖ストック溶液の製造に必要な化学的説明および特定量。
| pH | 7.15(KOHで調整) |
| 試薬 | 濃度(mM) |
| グルコン酸カリウム(Kglu) | 140 |
| MgCl 2 | 2 |
| TES | 10 |
| ATPマグネシウム塩(MgATP) | 4 |
| GTPナトリウム塩(Na 2 GTP) | 0.4 |
| β-ニコチンアミドアデニンジヌクレオチド水和物(NAD) | 1 |
| -20℃で保存する。 |
表3:細胞内溶液(IS1)。 IS1の製造に必要な化学的説明と特定量。これは主に強度応答と量子バンプ測定に使用されます。
| pH | 7.15(CsOHで調整) |
| 試薬 | 濃度(mM) |
| CsCl | 120 |
| MgCl 2 | 2 |
| TES | 10 |
| ATPマグネシウム塩(MgATP) | 4 |
| GTPナトリウム塩(Na 2 GTP) | 0.4 |
| β-ニコチンアミドアデニンジヌクレオチド水和物(NAD) | 1 |
| テトラエチル - 塩化アンモニウム(TAE) | 15 |
| -20℃で保存する。 |
表4:細胞内溶液(IS2)。光誘起電流の逆電位測定に主に使用される細胞内溶液IS2を生成するために必要な化学的記述および特定量。
ディスカッション
D. melanogaster光受容体への全細胞記録の適用は、TRPチャネル27,28,29およびINAD30,31,32スカフォールドタンパク質のような新規シグナル伝達タンパク質の発見および機能解明を可能にした。この技術の最初の導入以来、イオンのメカニズムと光応答の電圧依存性に関する長期的な基本的な問題を解決することができました。これは、膜電圧および細胞外および細胞内イオン組成を正確に制御する能力が付与されているために生じた19,28。
D. melanogasterにおけるパッチクランプ法の主な障害は、単離された眼球プリペアの脆弱性であった配給詳細な研究により、光伝達機構の完全性は、特に光暴露中のATPの連続的な供給に決定的に依存し、これがATPの大量消費をもたらすことが明らかにされている。残念なことに、パッチピペットで光受容体膜に到達するために必要な色素( すなわち、グリア)細胞の機械的ストライピングは、ATP産生に必要な代謝産物の主要な供給源を排除する33 。記録用ピペットへの外因性ATPの適用は、大量のATPの必要性を部分的に満たすに過ぎない。 ATPの供給が不十分であれば、TRPチャネルの自発的活性化と、光活性化チャネルからの光伝達機構の解離が起こり、細胞のCa 2+が大幅に増加し、正常な光応答34,35が失われます。この一連の出来事は、解剖処置によってではなく、むしろATPの細胞枯渇による。この一連の事象の発生を防止し、正常な光応答を維持するために、光受容体は強烈な光に曝されるべきではなく、大量のATPを消費する。また、おそらくミトコンドリアのATP産生を促進するために、記録ピペットにNADを含める必要があります(18,36)。自発的および量子的なバンプの測定の場合、薄暗い光のみが使用されるので、上記の難点は最小限である。実際には、安定した全細胞記録を約20〜25分間維持することができるが、応答速度がこの期間に亘って低下する傾向がある。解離した個眼症の単一の調製物は、2時間まで生存し続けることができる。
単離された個体化調製物のさらなる欠点は、TRPの接近不可能性につながる微絨毛の接近不可能性であり、TRPLチャンネルを録音ピペットに接続し、シングルチャンネル録音を防止します。彼らが開発した方法を用いて、Bacigalupoらは、横紋筋からの単一チャネル活動を直接記録することに成功した37 。しかしながら、このチャネル活性は、組織培養細胞38で異種的に発現されたTRPLチャネルのものとは異なり、孤立した口角炎34から得られたショットノイズ分析に由来するTRPチャネル活性とは異なる。おそらく、解剖手順は、この方法を使用する際に光受容細胞を大きく損傷した。
開示事項
著者は何も開示することはない。
謝辞
この研究の実験部分は、米国 - イスラエル国家科学財団(BM&IL)、イスラエル科学財団(ISF)、ドイツ - イスラエル教プロジェクトプロジェクト(DIP)(BMへ)、およびバイオテクノロジー(BBSRCグラント番号:BB / M007006 / 1およびBB / D007585 / 1)からRCH
資料
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 5 mL syringe | |||
| 1 mL syringe with elongated tip | |||
| Petri dish | 60 mm | ||
| Syringe filters | Millex | 22 µm PVDF filter | |
| Capillaries (for omatidia separation) | Glass, 1.2 x 0.68 mm (~7.5 cm each) | ||
| Polyethylene Tubing | Becton Dickinson | 1.57 x 1.14 mm (35 cm) | |
| 2 small beakers | 50 mL or less | ||
| 2 paraffin film sheets | Parafilm M | ~5 x 5 cm | |
| Bath chamber | home-made | ||
| Cover slips | 22 x 22 mm No. 0 | ||
| Paraplast Plus | Sigma | Paraffin – polyisobutylene mixture | To glue the coverslip onto the bottom of the bath chamber |
| Ground | Warner Instruments | 64-1288 | Hybrid Assembly Ag-AgCl Wire Assembly |
| Headless micro dissection needle | Entomology, 12 mm | ||
| Micro dissecting needle holder | |||
| Vise | |||
| 2 fine tweezers + 1 rough tweezers | Dumont #5, Biology | 0.05 x 0.02 mm, length 110 mm, Inox | |
| Stereoscopic zoom Microscope | Nikon | SMZ-2B | |
| Cold light source | Schott | KL1500 LCD | |
| Filter (Color) for cold light source | Schott | RG620 | |
| Delicate wipers | Kimtech | Kimwipes | |
| Electrode holder | Warner Instruments | QSW-T10P | Q series Holders compatible with Axon amplifiers, straight body style |
| Silver Wire | Warner Instruments | 0.25 mm diameter, needs to be chloridized | |
| Micromanipulator | Sutter Instruments | MP 85 | Huxley-Wall Style Micromanipulator |
| Faraday cage | home made | Electromagnetic noise shielding and black front curtain | |
| Anti-vibration Table | Newport | VW-3036-OPT-01 | |
| Osilloscope | GW | GOS-622G | |
| Perfusion system | Warner Instruments | VC-8P | Pinch valve control system |
| Perfusion valve controller | Scientific instruments | BPS-8 | |
| Suction system | |||
| Amplifier | Molecular Device | Axopatch-1D | |
| Head-stage | Molecular Device | CV - 4 | Gain: x 1/100 |
| A/D converter | Molecular Device | Digidata 1440A | |
| Clampex | Molecular Device | 10 | software |
| pCLAMP | Molecular Device | 10 | software |
| Light source (Xenon Arc lamp) | Sutter Instruments | Lambda LS | |
| Light detector | home made | phototransistor | |
| Filter wheel and shutter controller | Sutter Instruments | Lambda 10-2 with a Uniblitz shutter | |
| Filters (Natural density filter) | Chroma | 6,5,4,3,2,1,0.5,0.3 | |
| Filter (Color) | Schott | OG590, Edge filter | |
| Xenon Flash Lamp system | Dr. Rapp OptoElecftronic | JML-C2 | |
| Light guide | Quartz | ||
| Pulse generator | AMPI | Master 8 | |
| Microscope | Olympus | IX71, Inverted | |
| Red illumination filter (Microscope) | RG630 / RG645 ø45mm | ||
| Microscope objective | Olympus | X60/0.9 UplanFL N air or X60/1.25 UplanFI oil | |
| CCD Camera | Andor | iXon DU885K | |
| NIS Element | Nikon | AR | software |
| Ca+2 indicator | Invitrogen | Calcium green 5N | |
| Excitation & emission filters and dichroic mirror | Chroma | 19002 - AT - GFP/FITC Longpass set | |
| Vertical pipette puller | Narishige | Model PP83 | Use either vertical or horizontal puller, as preferred. |
| Horizontal pipette puller | Sutter Instrument | Model P-1000 Flaming/Brown Micropipette Puller | |
| Filament | Sutter Instrument | 3 mm trough or square box | |
| Capillaries | Harvard Apparatus | borosilicate glass capillaries | 1 x 0.58 mm |
参考文献
- Hardie, R. C. Whole-cell recordings of the light induced current in dissociated Drosophila photoreceptors: evidence for feedback by calcium permeating the light-sensitive channels. Proc. R. Soc. Lond. B. 245, 203-210 (1991).
- Ranganathan, R., Harris, G. L., Stevens, C. F., Zuker, C. S. A Drosophila mutant defective in extracellular calcium- dependent photoreceptor deactivation and rapid desensitization. Nature. 354, 230-232 (1991).
- Martin, J. H., Benzer, S., Rudnicka, M., Miller, C. A. Calphotin: a Drosophila photoreceptor cell calcium-binding protein. Proc. Natl. Acad. Sci. U.S.A. 90 (4), 1531-1535 (1993).
- Weiss, S., et al. Compartmentalization and Ca2+ buffering are essential for prevention of light-induced retinal degeneration. J Neurosci. 32 (42), 14696-14708 (2012).
- Wang, T., et al. Light activation, adaptation, and cell survival functions of the Na + /Ca 2+ exchanger CalX. Neuron. 45 (3), 367-378 (2005).
- Weckstrom, M., Hardie, R. C., Laughlin, S. B. Voltage-activated potassium channels in blowfly photoreceptors and their role in light adaptation. J. Physiol. Lond. 440, (1991).
- Frolov, R. V., Immonen, E. V., Weckström, M. Performance of blue- and green-sensitive photoreceptors of the cricket Gryllus bimaculatus. J Comp Physiol A Neuroethol Sens Neural Behav Physiol. 200 (3), 209-219 (2014).
- Nasi, E. Whole-cell clamp of dissociated photoreceptors from the eye of Lima scabra. J Gen Physiol. 97 (1), 35-54 (1991).
- Nasi, E., Gomez, M. P. Light-activated ion channels in solitary photoreceptors of the scallop Pecten irradians. J. Gen. Physiol. 99, 747-769 (1992).
- Hardie, R. C., Peretz, A., Pollock, J. A., Minke, B. Ca 2+ limits the development of the light response in Drosophila photoreceptors. Proc. R. Soc. Lond. B. Biol. Sci. 252, 223-229 (1993).
- Kohn, E., et al. Functional Cooperation between the IP3 Receptor and Phospholipase C Secures the High Sensitivity to Light of Drosophila Photoreceptors In Vivo. J Neurosci. 35 (6), 2530-2546 (2015).
- Hevers, W., Hardie, R. C. Serotonin modulates the voltage dependence of delayed rectifier and Shaker potassium channels in Drosophila photoreceptors. Neuron. 14 (4), 845-856 (1995).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Henderson, S. R., Reuss, H., Hardie, R. C. Single photon responses in Drosophila photoreceptors and their regulation by Ca 2. J. Physiol. Lond. 524 (Pt 1), 179-194 (2000).
- Scott, K., Zuker, C. S. Assembly of the Drosophila phototransduction cascade into a signalling complex shapes elementary responses. Nature. 395 (6704), 805-808 (1998).
- Elia, N., Frechter, S., Gedi, Y., Minke, B., Selinger, Z. Excess of G betae over G qalphae in vivo prevents dark, spontaneous activity of Drosophila photoreceptors. J. Cell Biol. 171 (3), 517-526 (2005).
- Katz, B., Minke, B. Phospholipase C-Mediated Suppression of Dark Noise Enables Single-Photon Detection in Drosophila Photoreceptors. J. Neurosci. 32 (8), 2722-2733 (2012).
- Hardie, R. C., et al. Molecular basis of amplification in Drosophila phototransduction. Roles for G protein, phospholipase C, and diacylglycerol kinase. Neuron. 36 (4), 689-701 (2002).
- Reuss, H., Mojet, M. H., Chyb, S., Hardie, R. C. In vivo analysis of the Drosophila light-sensitive channels, TRP and TRPL. Neuron. 19, 1249-1259 (1997).
- Liu, C. H., et al. In vivo identification and manipulation of the Ca 2+ selectivity filter in the Drosophila transient receptor potential channel. J. Neurosci. 27 (3), 604-615 (2007).
- Ahmad, S. T., Natochin, M., Barren, B., Artemyev, N. O., O'Tousa, J. E. Heterologous expression of bovine rhodopsin in Drosophila photoreceptor cells. Invest Ophthalmol Vis Sci. 47 (9), 3722-3728 (2006).
- Scott, K., Sun, Y., Beckingham, K., Zuker, C. S. Calmodulin regulation of Drosophila light-activated channels and receptor function mediates termination of the light response in vivo. Cell. 91 (3), 375-383 (1997).
- Liu, C. H., et al. Ca 2+ -dependent metarhodopsin inactivation mediated by calmodulin and NINAC myosin III. Neuron. 59 (5), 778-789 (2008).
- Cook, B., et al. Phospholipase C and termination of G-protein-mediated signalling in vivo. Nat. Cell Biol. 2 (5), 296-301 (2000).
- Hardie, R. C., Franze, K. Photomechanical responses in Drosophila photoreceptors. Science. 338 (6104), 260-263 (2012).
- Huang, J., et al. Activation of TRP channels by protons and phosphoinositide depletion in Drosophila photoreceptors. Curr. Biol. 20 (3), 189-197 (2010).
- Minke, B., Wu, C. F., Pak, W. L. Isolation of light-induce response of the central retinular cells from the electroretinogram of Drosophila. J. Comp. Physiol. 98, 345-355 (1975).
- Hardie, R. C., Minke, B. The trp gene is essential for a light-activated Ca2+ channel in Drosophila photoreceptors. Neuron. 8, 643-651 (1992).
- Niemeyer, B. A., Suzuki, E., Scott, K., Jalink, K., Zuker, C. S. The Drosophila light-activated conductance is composed of the two channels TRP and TRPL. Cell. 85 (5), 651-659 (1996).
- Huber, A., et al. The transient receptor potential protein (Trp), a putative store- operated Ca 2+ channel essential for phosphoinositide-mediated photoreception, forms a signaling complex with NorpA, InaC and InaD. EMBO J. 15 (24), 7036-7045 (1996).
- Shieh, B. H., Niemeyer, B. A novel protein encoded by the InaD gene regulates recovery of visual transduction in Drosophila. Neuron. 14 (1), 201-210 (1995).
- Tsunoda, S., et al. A multivalent PDZ-domain protein assembles signalling complexes in a G-protein-coupled cascade. Nature. 388 (6639), 243-249 (1997).
- Tsacopoulos, M., Veuthey, A. L., Saravelos, S. G., Perrottet, P., Tsoupras, G. Glial cells transform glucose to alanine, which fuels the neurons in the honeybee retina. J. Neurosci. 14 (3 Pt 1), 1339-1351 (1994).
- Hardie, R. C., Minke, B. Spontaneous activation of light-sensitive channels in Drosophila photoreceptors. J. Gen. Physiol. 103, 389-407 (1994).
- Agam, K., et al. Metabolic stress reversibly activates the Drosophila light-sensitive channels TRP and TRPL in vivo. J Neurosci. 20 (15), 5748-5755 (2000).
- Agam, K., Frechter, S., Minke, B. Activation of the Drosophila TRP and TRPL channels requires both Ca2+ and protein dephosphorylation. Cell Calcium. 35 (2), 87-105 (2004).
- Delgado, R., Muñoz, Y., Peña-Cortés, H., Giavalisco, P., Bacigalupo, J. Diacylglycerol activates the light-dependent channel TRP in the photosensitive microvilli of Drosophila melanogaster photoreceptors. J Neurosci. 34 (19), 6679-6686 (2014).
- Parnas, M., Katz, B., Minke, B. Open channel block by Ca2+ underlies the voltage dependence of Drosophila TRPL channel. J. Gen. Physiol. 129 (1), 17-28 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved