A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أزاله الحساسية والتعافي من المستقبلات الضوئية جراد الصيد عند تسليم التحفيز الخفيفة
In This Article
Summary
يتم تقديم بروتوكول لدراسة التحسس والحساسية استعاده المستقبلات فوتوفيش كوظيفة من وقت الساعة البيولوجية.
Abstract
يتم تقديم طريقه لدراسة الحساسية واستعاده المستقبلات الضوئية جراد الصيد. قمنا بأداء التسجيلات الكهربائية داخل الخلايا للخلايا المستقبلة الضوئية في اييستالكس المعزولة باستخدام تكوين الجهد الكهربي المتحول الأحادي المتقطع. أولا ، مع شفره حلاقه قمنا بفتح في القرنية الظهرية للوصول إلى شبكيه العين. بعد ذلك ، قمنا بإدخال القطب الزجاجي من خلال الفتحة ، واخترقت خليه كما ذكرت من قبل تسجيل المحتملة السلبية. وقد فرضت إمكانات الغشاء في إمكانات الراحة للمستقبلات الضوئية وتم تطبيق نبض ضوئي لتنشيط التيارات. وأخيرا ، استخدم بروتوكول الوميض الضوئي لقياس التحسس والانتعاش الحاليين. الاولي [ليغت-فلش] مشغلات, بعد فتره متاخره, ال [ترنسكايشن] تيار أيونيه, اي بعد يبلغ ذروه اتساع [دبل] نحو دوله [ديستيزد]; الفلاش الثاني ، الذي يطبق علي فترات زمنيه مختلفه ، يقيم حاله التوصيل المنشط الخفيف. لتوصيف التيار الذي اثار الضوء ، تم قياس ثلاثه معلمات: 1) الكمون (الوقت المنقضي بين التسليم فلاش ضوء واللحظة التي يحقق الحالي 10 ٪ من قيمته القصوى) ؛ 2) الذروة الحالية ؛ و 3) الحساسية الوقت الثابت (ثابت الوقت الاسي للمرحلة الاضمحلال الحالي). تتاثر جميع المعلمات بالنبضة الاولي.
ولتحديد كميه الاسترداد من التحسس ، استخدمت النسبة p2/p1 مقابل الوقت بين البقول. p1 هو ذروه الحالية التي أثيرت من قبل النبض الضوئي الأول ، و p2 هو ذروه الحالية التي اثارها النبض الثاني. وقد تم تركيب هذه البيانات علي مجموع الوظائف الاسيه. وأخيرا ، تم اجراء هذه القياسات كوظيفة من وقت الساعة البيولوجية.
Introduction
ولكي ينظر اليه علي انه محفز بصري ، يجب ان يكون الضوء الذي يصل إلى العينين محولا إلى اشاره كهربائيه. التالي ، في جميع الكائنات البصرية ، والضوء يؤدي محول التيار الأيوني ، والتي بدورها تنتج تغييرا في القدرة الغشائية للخلايا المستقبلات الضوئية ، ما يسمي مستقبلات المحتملة. وبسبب هذا ، فان حساسية الضوء في العين تعتمد أساسا علي حاله التوصيل المنشط الخفيف ، والذي يمكن ان يكون اما متاحا ليتم تنشيطه أو تحسسه.
في المستقبلات الضوئية لجراد الصيد ، يؤدي الضوء بطيئه ، عابره ، الايونيه الحالية1. عند الاضاءه ، ينشا تيار المحول بعد التاخر أو الكمون قبل الوصول إلى الحد الأقصى ؛ بعد ذلك [ديايز], بما ان ال [ترنسكايشن] قنوات يسقط داخل [ديستيزد] دوله في اي هم يكون لا يستجيبون إلى بعيده ضوء تحفيز2. وهذا هو ، الضوء ، بالاضافه إلى تفعيل الحالية محول المسؤولية من الرؤية ، ويدفع أيضا تناقص عابره من حساسية الخلايا مستقبلات ضوئيه. وقد تمثل أزاله الحساسية اليه حماية عامه ضد التعرض المفرط لحافز كاف. يتم استرداد حساسية العين للضوء كما يتعافى التوصيل المحول من التحسس.
التسجيل داخل الخلايا هو تقنيه مفيده لقياس النشاط الكهربائي للخلايا المنفعلة3،4،5،6،7،8. ومن أمثله هذه الاخيره الخلايا المنوية10 والخلايا المستقبلة الضوئية التي درست هنا. في تجربتنا ، مستنقعات المستقبلات الضوئية Procambarus من الصعب عزل والحفاظ علي الثقافة الابتدائية ؛ بالاضافه إلى ذلك ، فهي قضبان رقيقه تجعل من الصعب التوصل إلى تشكيل الختم جيجا. في التسجيلات داخل الخلايا ، يتم متقدمة قطب حاد في خليه التي يتم الاحتفاظ بها في مكان من قبل الانسجه المحيطة بها. يتم تقطيع القطب بواسطة الدوائر التبديل عاليه السرعة من مكبر للصوت ، لذلك يتم أخذ عينات الحالية بين نبضات الجهد. ويعرف هذا الوضع بأنه المشبك الجهد الكهربي أحادي القطب (وضع dSEVC)11. المقاومة العالية (الفتحة الصغيرة) للالكترود تعيق التبادل المتبادل بين الخلية ومحاليل الماصة ، مما يؤدي إلى الحد الأدنى من الاضطراب في الوسط داخل الخلايا3. والعيب المحتمل لهذه التقنية هو ان الادراج القطب قد تنتج تيار غير انتقائي تسرب; لذلك ، يجب توخي الحذر لتجنب التسجيل من الخلايا حيث حجم التسريب الحالي قد تتداخل مع القياسات المقصودة4،12.
هنا ، ونحن نستخدم اييستالكس معزولة جراد الصيد لتقييم الحساسية والانتعاش من التشغيل الضوئي أيون التنشيط عن طريق أداء التسجيلات الكهربائية داخل الخلايا للخلايا مستقبلات الضوئية تحت ظروف مشبك الجهد.
Protocol
ملاحظه: تتوافق التجارب مع قوانين حماية الماشية في المكسيك.
1. الاعداد التجريبي
- الاتصالات العامة
- توصيل مكبر الصوت إلى جهاز كمبيوتر مناسب من خلال محول التناظرية إلى الرقمية واستخدام الذبذبات لمراقبه التجربة (الشكل 1).
- قم بتوصيل الفوتوتيميتور إلى A/D تحويلها.
- غرفه التسجيل
- وضع غرفه التسجيل علي راس الجدول المضادة للاهتزاز وتحديد موقعه داخل قفص فاراداي.
ملاحظه: هذا يمنع الاهتزاز الميكانيكية والضوضاء الكهربائية التي قد تؤثر علي التسجيل. وادلي لدينا قفص فاراداي من شبكه سلكيه مظلمة. A محليه الصنع ، 2 مل ، يتم استخدام غرفه تسجيل الأكريليك (الشكل 2). - اعداد حل الحمام للحفاظ علي الاعداد علي قيد الحياة13: 205 MM nacl ؛ 5 مم KCl; 2 مم MgSO4; 13 مم CaCl2; 5 مم Hepes-NaOH ، pH 7.3.
ملاحظه: الحل لا يشمل سكر العنب أو اي فقاعات بنسبه 95 ٪ O2، 5 ٪ CO2 الخليط لان الاجراء التجريبي قصير بما فيه الكفاية للكشف عن الضرر عن طريق التسجيل الكهربائي (انظر الخطوة 2 ، 15 لاكتمال).
- وضع غرفه التسجيل علي راس الجدول المضادة للاهتزاز وتحديد موقعه داخل قفص فاراداي.
- اقطاب
- استخدام قطب الأسلاك الفضية المطلية بالكلوريد كقطب مرجعي
ملاحظه: طلاء كلوريد الفضة ضروري للسماح للتفاعل الكهربائي: AgCl (s) + e−↔ Ag (s) + Cl-. - الرمل الأسلاك الفضية (سمك ~ 1 مم ، طول ~ 10 سم) مع ورقه الصنفرة الصف غرامه من أجل تنظيف سطحه.
- شطف الأسلاك الفضية مع الماء المقطر.
- تزج الفضة النظيفة الأسلاك في 4-6 ٪ محلول الصوديوم هيبوكلوال (NaClO) حتى يظهر الظلام (حوالي 20 دقيقه).
- استخدام الماصات الزجاجية رقيقه مليئه محلول المنحل بالكهرباء (2.7 M KCl) كقطب داخل الخلايا.
- سحب أنبوب الشعرية الزجاجية (القطر الداخلي ≈ 1 ملم) مع ساحبه ماصه الصغرى للحصول علي غيض رقيقه مع فتحه صغيره (0.01-0.1 μm)14.
- أملا الزجاج الشعري المسحوب بمحلول 2.7 M KCl. أولا أملاها بواسطة الغطاء (تزج بطرف الماصة في محلول 2.7 M KCl) ثم أملا نصف الماصة بابره حقن دقيقه. إذا لزم الأمر ، اضغط علي ماصه القطب للقضاء علي فقاعات الهواء.
- قم بتوصيل القطب الكهربي بحاملها. قم بتوصيل حامل المضخم بمضخم الصوت. وضع القطب حامل-headstage مع مستقره 3-د الجزئي. خفض القطب حتى حل الحمام يغطي غيض.
ملاحظه: يجب ان يكون القطب الكهربي اتجاها عموديا
- استخدام قطب الأسلاك الفضية المطلية بالكلوريد كقطب مرجعي
- حدد وضع جسر مكبر للصوت (في القسم الوضع من مكبر للصوت ، اضغط علي زر جسر) وقياس مقاومه القطب. تاكد من ان المقاومة حوالي 50 MΩ11.
ملاحظه: يسمح حجم القطب هذا بتسجيل كهربائي جيد النوعية مع تلف محدود للخلية. - Null الازاحه الحالية وتعويض العابرين بالسعة باستخدام زر موقف القابضة في قسم الجهد المشبك من مكبر للصوت ، وزر تحييد السعه في ميكروالكترود 1 قسم من مكبر للصوت.
- نظام سوبرفيوجن
- صب محلول الحمام (الخطوة 1-2-2) في وعاء مناسب (زجاجه المصل 250 mL) وتوصيله إلى مجموعه أنابيب الري (3.2 مم من القطر الداخلي) ، التالي ربط غرفه التسجيل. استخدام نظام superfusion يحركها الجاذبية. تنظيم معدل تدفق إلى ~ 0.5 mL/s.
- قم بتوصيل الغرفة بجهاز شفط. تنظيم نظام شفط المحلول بطريقه لا تختلف فيها الكمية الاجماليه لغرفه التسجيل. استخدام مضخة فراغ لشفط.
ملاحظه: وحده تخزين ثابته في غرفه التسجيل من المهم للحفاظ علي الكاباسيتانسيس الضالة ثابت طوال التجربة.
2. المواد البيولوجية
ملاحظه: استخدام الكبار جراد المستنقعات (7-10 سم طويل) في مرحله intermolt من الجنس غير واضحة.
- ساعة سيركاديان
- قبل شهر واحد من التجارب ، والحفاظ علي 100 جراد تحت الضوء 12-ح/12-ح دوره الظلام15 (الضوء الأبيض ، 2.4 kW/م2).
ملاحظه: شهر واحد هو الوقت الكافي لمزامنة السكان جراد الصيد. - تحديد وقت الساعة البيولوجية من السكان جراد الصيد عن طريق تقييم السعه من الكتروريمينوجرام من خمسه الحيوانية المختارة عشوائيا15.
ملاحظه: وقت الساعة البيولوجية 0 h (CT 0) يشير إلى بداية يوم ذاتي ، ايالوقت الذي يكون فيه الكائن الحي نشطا عاده16،17،18،19 (الشكل 3). جراد الصيد هو الحيوانية الليلية ، لذلك تحت الضوء 12-h/12-h دوره الظلام ، فانه نشط خلال المرحلة المظلمة.
- قبل شهر واحد من التجارب ، والحفاظ علي 100 جراد تحت الضوء 12-ح/12-ح دوره الظلام15 (الضوء الأبيض ، 2.4 kW/م2).
- اجراء عزل eyestalk
- في وقت الساعة البيولوجية المطلوبة ، تخدير جراد البحر مختاره عن طريق الغمر في مياه الصنبور في 0-4 درجه مئوية ، لمده 15 دقيقه.
- عن طريق مقص غرامه ، وفصل تجدي من القاعدة.
- الوصول إلى شبكيه العين باستخدام شفره الحلاقة لجعل فتحه (~ 1-mm2) في القرنية الظهرية.
- وضع تجدي في وسط غرفه التسجيل (حفره مغطاه بالسيليكون) مع فتح الوصول إلى شبكيه العين في الأعلى من الغرفة.
- الحفاظ علي تجدي تحت الظلام المستمر لمده 20 دقيقه.
ملاحظه: 20 دقيقه هو الوقت الكافي للخلية المستقبلات الضوئية لتكون مظلمة تماما تكييفها.
3. المستقبلات الضوئية المخو
- وضع القطب الصغير والمحور الطولي eyestalk موازيه في مثل هذه الطريقة التي يتم توسيط ميكروالكترود للوصول إلى شبكيه العين. استخدام المجهر مجسمه (10X) لوضع الاجهزه في التكوين الصحيح.
- رصد فرق الجهد بين الأقطاب المرجعية والتسجيل عن طريق تحديد الوضع جسر11 من مكبر للصوت.
- خفض القطب في الحمام وبعد ذلك وضعه الحق علي شبكيه العين.
- الابتعاد عن المجهر ووضع المصباح الضوئي موازيه للمحور الطولي لeyestalk.
ملاحظه: المسافة بين مصباح وغرفه سوبرفيوجن ما يقرب من 15 سم. - خفض ببطء القطب الصغير حتى يتم الكشف عن انخفاض الجهد المفاجئ.
ملاحظه: انخفاض الجهد من حوالي − 50 mV يشير إلى مخو من خليه مستقبلات ضوئيه صحية. - تقديم اختبار ضوء فلاش (الضوء الأبيض ، 7.2 كيلوواط/م2، 10 μs المدة) لتسجيل مستقبلات الضوئية المحتملة.
ملاحظه: مستقبلات المستقبلات الضوئية امكانيه الاستقطاب من السعه 10-15 mV ومده 300 مللي ثانيه (الشكل 4).
4. التسجيل الكهربائي
- تاكد من ان خلايا المستقبلات الضوئية تتكيف تماما مع الظروف المظلمة (انظر الخطوة 2.3).
- تسليم فلاش اختبار الضوء كل 2 دقيقه. أتمته الوقت بين ومضات عن طريق اختيار قيمه كافيه (120 s) من "الوقت بين الحلقات" في برنامج الحصول علي البيانات.
ملاحظه: 2 دقيقه هو الوقت اللازم للسماح للانتعاش الكلي للتيارات الكامنة وراء الاستجابة الكهربائية للمستقبلات الضوئية. - مراقبه إمكانات الغشاء يستريح ، فضلا عن السعه والمدة المحتملة للمستقبلات. نفترض ان المستقبلات الضوئية تتكيف تماما بمجرد احتمال بقاء الغشاء ، والسعه ، ومده المستقبلات المحتملة دون تغيير. اييستالكس الاحتفاظ سابقا تحت الظلام المستمر لمده 20 دقيقه (الخطوة 2.3) استكمال التكيف في حوالي 5 دقيقه.
- توقف عن تحفيز الخلية 2 دقيقه قبل تسجيل الضوء-أثارت الحالية.
- تسليم فلاش اختبار الضوء كل 2 دقيقه. أتمته الوقت بين ومضات عن طريق اختيار قيمه كافيه (120 s) من "الوقت بين الحلقات" في برنامج الحصول علي البيانات.
- التسجيل الحالي
- المشبك الجهد في قياس القيمة المحتملة غشاء يستريح من الخلية عن طريق اختيار "السعه القابضة" في البرمجيات الحصول علي البيانات (في الموجي علي قسم قناه الإخراج التناظرية).
- حدد وضع dSEVC لمضخم الصوت. في قسم الوضع من مكبر الصوت ، حدد الزر SEVC والتبديل رافعه إلى موقف SEVC Discont.
- تعيين معدل التبديل إلى 500-1000 هرتز (باستخدام زر ضبط معدل من مكبر للصوت) ، كما تحددها سرعه القطب11.
- تقديم فلاش ضوء ، ومراقبه تدفق الأيونات التي أثيرت.
ملاحظه: هذا هو الضوء التي اثارتها أو محول التيار (الشكل 5). - العودة إلى وضع جسر علي مكبر للصوت وتسجيل إمكانات مستقبلات عن طريق إرسال فلاش ضوء (انظر القسم 3). تاكد من ان خليه المستقبلات الضوئية تتكيف تماما مع الظروف المظلمة. قياس الخصائص المحتملة للمستقبلات (السعه والمدة) ومقارنتها مع القياسات الاولي. نفترض ان خليه المستقبلات الضوئية المخيخيد هي خليه سليمه إذا كان لديهم نفس الخصائص.
ملاحظه: بعد الاجتثاث تجدي ، والتحضير البيولوجية قابله للحياة خلال 2 ح التالية.
- اثنين من النبض البروتوكول: قياس الانتعاش من التحسس مع اثنين من بروتوكول ضوء فلاش.
ملاحظه: بروتوكول الفلاش الضوئي الاثنين مشابه لبروتوكول الجهد الكهربي القياسي ذو النبضتين المستخدم لقياس الاسترداد من تعطيل القناات ذات الجهد المسور20. يؤدي الوميض الضوئي الأول إلى تغيير مؤقت في حساسية خليه المستقبلات الضوئية ويقيم الفلاش الثاني حاله التوصيل المنشط الخفيف.- تسليم زوج من البقول الخفيفة. تطبيق الفلاش الثاني بعد الفاصل الزمني المطلوب (من 300 مللي ثانيه إلى 2 دقيقه).
- رقمنه التيارات في 10 كيلوهرتز أخذ العينات مع البرمجيات الحصول علي البيانات وحفظ البيانات لتحليل خارج خط11.
ملاحظه: يتم تضمين جدول مع قيم تكوين البرنامج كمواد تكميليه.
5. تحليل البيانات
- حركيه من ال [ليغت-تثر] تيار
- قياس ثلاثه المعلمات الحالية: الكمون التنشيط L ، الوقت المنقضي من التسليم ضوء فلاش حتى يبلغ الحالي 10 ٪ من السعه القصوى (الشكل 5) ؛ الذروة أو القصوى الحالية السعهp; والحساسية الوقت الثابت t. قياس ثابت الوقت التحسس (Τ) من خلال تركيب مرحله الاضمحلال الحالية إلى:
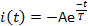
حيث ، ا =-I (t = 0) هو ثابت إيجابي (الشكل 5).
- قياس ثلاثه المعلمات الحالية: الكمون التنشيط L ، الوقت المنقضي من التسليم ضوء فلاش حتى يبلغ الحالي 10 ٪ من السعه القصوى (الشكل 5) ؛ الذروة أو القصوى الحالية السعهp; والحساسية الوقت الثابت t. قياس ثابت الوقت التحسس (Τ) من خلال تركيب مرحله الاضمحلال الحالية إلى:
- التحسس والتعافي
ملاحظه: تم تقييم الاسترداد من أزاله الحساسية علي انه النسبة p2/p1، حيث ان p1 هي المعلمة ذات الصلة (اما L ، Ip، أو T) من التحكم الحالي ، و p2 هي المعلمة المناظرة للاختبار الثاني الحالي.- قطعه p2/p1 (اما L ، Ip، أو T) كداله للوقت بين البقول.
- اعتمادا علي المعلمة ، تناسب نقاط كل مؤامرة إلى:
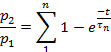
أو إلى: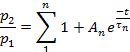
- استخدم اختبارا إحصائيا مناسبا لتحديد عدد المصطلحات الاسيه المطلوبة لاحتواء البيانات التجريبية.
النتائج
أولا ، يتم الحصول علي إمكانات مستقبلات تمثيليه لخلايا المستقبلات الضوئية لجراد الصيد (الشكل 4). [افتروردس], اختبرت [ليغت-فلش] كان ان يشغل الضوء [ترنسكايشن] تيار (شكل 5). المحول الحالي1 ينشط بعد تاخر, الوصول إلى القصوى وبعد ذلك يسقط ...
Discussion
وقد ثبت ان جراد الصيد نموذجا ممتازا بسبب قدرته علي البقاء علي قيد الحياة في ظل ظروف غير طبيعيه. هناك سهوله الوصول إلى في الجسم المجري وفي المختبر التحليلات الفسيولوجية الكهربائية. الاضافه إلى ذلك ، فان القشريات هي مجموعه مواتيه للبحوث البيولوجية العصبية في مجال المقارنة الزمنيه...
Disclosures
ليس لدينا ما نكشف عنه
Acknowledgements
وكان هذا العمل مدعوما بمنحه من الUNAM IN224616-RN224616. ويود أصحاب البلاغ ان يشكروا السيدة جوزيفينا بولادو ، رئيسه أداره الترجمة الورقية العلمية ، من شعبه البحوث في كليه الطب ، UNAM ، علي تحرير النسخة الانكليزيه من هذه المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| Axoclamp2A | Axon Instruments Inc | Amplifier | |
| Digidata 1200 Interface | Axon Instruments Inc | Digitizer | |
| Oscilloscope TDS430A | Tektronix | Analogic Oscilloscope | |
| Photostimulator PS33 Plus | Grass | Lamp | |
| Puller PC-100 | Narishige | Micropipette Puller | |
| Puller P-97 | Sutter Instruments | Micropipette Puller | |
| Glass Capillary Tube Kimax-51 | Kimble Products | 34502 | 0.8, 1.10, 100 mm |
| HS-2 Headstage | Axon Instruments Inc | Headstage | |
| Micromanipulator MX-4 | Narishige | Mechanical Micromanipulator | |
| Stereoscopic Microscope | Zeiss | Microscope | |
| pClamp | Axon Instruments Inc | Data acquisition software for digidata 1200 interface | |
| Clampfit | Axon Instruments, Inc | Analysis software linked to pClamp | |
| Origin | OriginLab Corp. | Data analysis and graphing software | |
| Sodium Chloride | Sigma | S7653 | >99.5% |
| Potassium Chloride | Sigma | P-9333 | Minimum 99% |
| Magnesium Sulfate | Sigma | M7506 | Minimum 99.5% |
| Calcium Chloride | Sigma | C5080 | Minimum 99.0% |
| Hepes | Sigma | H7523 | >99.5% |
| Sodium Hydroxide | Sigma | S8045 | 98.00% |
| Sodium hypochlorite solution | Sigma | 425044 | Available chlorine, 10-15% |
References
- Barriga-Montoya, C., Gómez-Lagunas, F., Fuentes-Pardo, B. Effect of pigment dispersing hormone on the electrical activity of crayfish visual photoreceptors during the 24-h cycle. Comp. Biochem. Physiol. A Comp. Physiol. 157 (4), 338-345 (2010).
- Barriga-Montoya, C., de la O-Martínez, A., Fuentes-Pardo, B., Gómez-Lagunas, F. Desensitization and recovery of crayfish photoreceptors. Dependency on circadian time, and pigment-dispersing hormone. Comp. Biochem. Physiol. A Comp. Physiol. 203, 297-303 (2017).
- Wickenden, A. D. Overview of electrophysiological techniques. Curr. protoc. pharmacol. 11, 1-17 (2014).
- Brette, R., Destexhe, A. Intracellular recording. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Cummins, D., Goldsmith, T. H. Cellular identification of the violet receptor in the crayfish eye. J. Comp. Physiol. 142 (2), 199-202 (1981).
- Eguchi, E. Rhabdom structure and receptor potentials in single crayfish retinular cells. J. Cell and Comp. Physiol. 66, 411-430 (1965).
- Nosaki, H. Electrophysiological study of color encoding in the compound eye of crayfish, Procambarus clarkii. Z. vergl. Physiologie. 64 (3), 318-323 (1969).
- Miller, C. S., Glantz, R. M. Visual adaptation modulates a potassium conductance in retinular cells of the crayfish. Vis Neurosci. 17 (3), 353-368 (2000).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods Enzymol. 525, 59-79 (2013).
- Finkel, A. Axoclamp-2A microelectrode clamp theory and operation. Axon Instruments, Inc. , (1990).
- Sakmann, B. . Single-channel recording. , (2013).
- Van Harreveld, A. A physiological solution for freshwater crustacea. Proc. Soc. Exp. Biol. Med. 34 (4), 428-432 (1936).
- Oesterle, A. . pipette cookbook. , 97 (2008).
- Fuentes-Pardo, B., Ramos-Carvajal, J. The phase response curve of electroretinographic circadian rhythm of crayfish. Comp. Biochem. Physiol. A Comp. Physiol. 74 (3), 711-714 (1983).
- Pace-Schott, E. F., Hobson, J. A. The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat. Rev. Neurosci. 3 (8), 591-605 (2002).
- Pittendrigh, C. S., Aschoff, J. On the mechanism of the entrainment of a circadian rhythm by light cycles. Circadian Clocks. , 277-297 (1965).
- Pittendrigh, C. S., Aschoff, J. Circadian systems: entrainment. Handbook Behavioral Neurobiology Biological Rhythms. , 94-124 (1981).
- Vitaterna, M. H., Takahashi, J. S., Turek, F. W. Overview of circadian rhythms. Alcohol Res. Health. 25 (2), 85-93 (2001).
- Hille, B. . Ion channels of excitable membranes. 507, (2001).
- Dircksen, H., Strauss, J. Circadian clocks in crustaceans: identified neuronal and cellular systems. Front Biosci. 15, 1040-1074 (2010).
- Terakita, A., Hariyama, T., Tsukahara, Y., Katsukura, Y., Tashiro, H. Interaction of GTP-binding protein Gq with photoactivated rhodopsin in the photoreceptor membranes of crayfish. FEBS Lett. 330, 197-200 (1993).
- Terakita, A., Takahama, H., Hariyama, T., Suzuki, T., Tsukahara, Y. Light regulated localization of the beta-subunit of Gq-type G-protein in the crayfish photoreceptors. J Comp Physiol A. 183 (4), 411-417 (1998).
- Terakita, A., Takahama, H., Tamotsu, S., Suzuki, T., Hariyama, T., Tsukahara, Y. Light-modulated subcellular localization of the alpha-subunit of GTP-binding protein Gq in crayfish photoreceptors. Vis Neurosci. 13 (3), 539-547 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved