Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir Işık Uyaranteslimi Üzerine Kerevit Fotoreseptörlerinin Duyarsızlaştırılması ve İyileştirilmesi
Bu Makalede
Özet
Kerevit fotoreseptörlerinin sirkadiyen zamanın bir fonksiyonu olarak duyarsızlaştırma ve duyarlılık geri kazanımı için bir protokol sunulmuştur.
Özet
Kerevit fotoreseptörlerinin duyarsızlaştırılması ve geri kazanımı üzerinde çalışmak için bir yöntem sunulmuştur. İzole göz sapındaki fotoreseptör hücrelerinin hücre içi elektrik kayıtlarını, kesintisiz tek elektrot anahtarlı voltaj-kelepçe konfigürasyonunu kullanarak gerçekleştirdik. İlk olarak, jiletle retinaya ulaşmak için sırt korneasında bir açıklık yaptık. Daha sonra, açıklığa cam bir elektrot yerleştirdik ve negatif bir potansiyelin kaydedildiği gibi bir hücreye delip geçtik. Membran potansiyeli fotoreseptörün dinlenme potansiyeline kenetlendi ve akımları aktive etmek için bir ışık darbesi uygulandı. Son olarak, iki ışık flaş protokolü mevcut duyarsızlaştırma ve kurtarma ölçmek için kullanılmıştır. İlk ışık flaşı, bir gecikme döneminden sonra, transdüksiyon iyonik akımı tetikler, bir tepe genliğine ulaştıktan sonra duyarsız bir duruma doğru çürür; değişen zaman aralıklarında uygulanan ikinci flaş, ışıkla aktive edilen iletkenliğin durumunu değerlendirir. Işık la kaplı akımı karakterize etmek için üç parametre ölçüldü: 1) gecikme süresi (ışık flaşı teslimi ile akımın maksimum değerinin %10'unu elde ettiği an arasında geçen süre); 2) pik akım; ve 3) duyarsızlaştırma süresi sabiti (mevcut bozunma evresinin üstel zaman sabiti). Tüm parametreler ilk nabızdan etkilenir.
Duyarsızlaştırmadan iyileşmeyi ölçmek için, p2/p1 oranı darbeler arasındaki zamana göre kullanılmıştır. p1, ilk ışık darbesinin uyardığı en yüksek akımdır ve p2 ikinci darbenin uyardığı en yüksek akımdır. Bu veriler üstel fonksiyonların toplamına monte edildi. Son olarak, bu ölçümler sirkadiyen zamanın işlevi olarak yapılmıştır.
Giriş
Görsel bir uyarıcı olarak algılanabilmesi için gözlere ulaşan ışığın bir elektrik sinyaline aktarılması gerekir. Bu nedenle, tüm görsel organizmalarda, ışık bir transdüksiyon iyon akımı tetikler, hangi sırayla fotoreseptör hücrelerinin membran potansiyelinde bir değişiklik üretir, sözde reseptör potansiyeli. Bu nedenle, gözün ışık hassasiyeti öncelikle etkinleştirilen veya duyarsızlaştırılabilen ışık aktive iletkeninin durumuna bağlıdır.
Kerevit fotoreseptörlerinde ışık yavaş, geçici, iyonik akım1'itetikler. Aydınlatma üzerine, transdüksiyon akımı maksimum ulaşmadan önce bir gecikme veya gecikme sonra ortaya çıkar; bundan sonra çürür, transdüksiyon kanalları daha fazla ışık uyarıcı tepkisiz olduğu bir duyarsız duruma düşmek gibi2. Yani, ışık, görme sorumlu transdüksiyon akımı aktive ek olarak, aynı zamanda fotoreseptör hücrelerinin duyarlılığı geçici bir artış neden olur. Duyarsızlaştırma yeterli bir uyarıcıaşırı maruz kalma karşı genel bir koruyucu mekanizma temsil edebilir. Transdüksiyon iletkenliği duyarsızlaşmadan sonra iyileştikçe gözün ışığa karşı hassasiyeti geri kazanılır.
Hücre içi kayıt,3,4,5,6,7,8gibi heyecanlı hücrelerin elektriksel aktivitesini ölçmek için kullanışlı bir tekniktir. Hücre içi kayıt yama-kelepçe tekniği9gelişiyle daha az sıklıkta olmasına rağmen, hala uygun bir yaklaşım zaman hücreleri ya izole etmek zor, ya da yama-kelepçe giga-mühürler oluşumunu zorlaştıran bir geometri mevcut(yani,mühürler veya yama elektrot ve membranlar arasında sıkı temas 109ohms sırası elektrik direnci ile). İkinci örnek sperm hücreleri10 ve fotoreseptör hücreleri burada incelenmiştir. Deneyimlerimize göre, Procambarus clarkii fotoreseptörleri izole etmek ve birincil kültürde tutmak zordur; ayrıca, giga-mühür oluşumunu elde etmeyi zorlaştıran ince çubuklardır. Hücre içi kayıtlarda, keskin bir elektrot, çevre doku tarafından yerinde tutulan bir hücreye ilerler. Elektrot amplifikatörün yüksek hızlı anahtarlama devresi ile doğranır, böylece akım gerilim darbeleri arasında örneklenir. Bu mod, kesintisiz tek elektrot voltaj kelepçesi (dSEVC modu)11olarak bilinir. Elektrotun yüksek direnci (küçük açıklık) hücre ve pipet çözeltileri arasındaki difüzyon değişimini engelleyerek hücre içi ortam3'ünen az bozulmasına neden olur. Bu tekniğin potansiyel bir dezavantajı elektrot ekleme non-selektif sızıntı akımı üretebilir; bu nedenle, sızıntı akımının boyutunun amaçlananölçümlerietkileyebilecek hücrelerden kayıt tan kaçınmaya özen, 4,12.
Burada, gerilim kelepçesi koşullarında fotoreseptör hücrelerinin hücre içi elektrik kayıtlarını gerçekleştirerek ışıkla aktive edilmiş iyon iletkenliğin deyanamasını ve geri kazanımını değerlendirmek için izole kerevit göz dürbünlerini kullanırız.
Protokol
NOT: Deneyler Meksika Hayvanları Koruma Yasaları ile uyumludur.
1. Deneysel Kurulum
- Genel bağlantılar
- Amplifikatörü analogdan dijitale dönüştürücü aracılığıyla uygun bir bilgisayara bağlayın ve deneyi izlemek için bir osiloskop kullanın(Şekil 1).
- Fotostimülatörü dönüştürülmüş A/D'ye bağlayın.
- Kayıt odası
- Kayıt odasını titreşim önleyici bir masanın üzerine yerleştirin ve faraday kafesin içine yerleştirin.
NOT: Bu, kaydı etkileyebilecek mekanik titreşim ve elektrik gürültüsünü önler. Faraday kafesimiz koyu telli örgüden yapılmıştı. Ev yapımı, 2 mL, akrilik kayıt odası kullanılır (Şekil 2). - Preparatı canlı tutmak için banyo çözeltisini hazırlayın13: 205 mM NaCl; 5 mM KCl; 2 mM MgSO4; 13 mM CaCl2; 5 mM Hepes-NaOH, pH 7.3.
NOT: Çözelti dekstroz veya %95 O2,%5 CO2 karışımı ile köpüren herhangi bir çözelti içermez, çünkü deneysel prosedür elektrik kaydının verdiği hasarı tespit edecek kadar kısadır (tamlık için adım 4.2.3'e bakınız).
- Kayıt odasını titreşim önleyici bir masanın üzerine yerleştirin ve faraday kafesin içine yerleştirin.
- Elektrot -lar
- Referans elektrot olarak klorür kaplı gümüş telli elektrot kullanın
NOT: Elektrot reaksiyonuna izin vermek için gümüş klorür kaplama gereklidir: AgCl(ler) + e−↔ Ag(lar) + Cl-. - Kum bir gümüş tel (kalınlık ~ 1 mm, uzunluk ~ 10 cm) ince dereceli emery kağıt ile amacıyla yüzeyini temizlemek için.
- Gümüş teli distile suyla durulayın.
- Temiz gümüş teli %4-6 sodyum hipoklorit çözeltisi (NaClO) koyu görünene kadar (yaklaşık 20 dk) batırın.
- Hücre içi elektrot olarak elektrolit çözeltisi (2,7 M KCl) ile doldurulmuş ince cam pipetler kullanın.
- Küçük bir açıklık (0.01-0.1 μm)14ile ince bir uç elde etmek için bir mikro pipet çekmece ile bir cam kılcal tüp (iç çapı 』 1 mm) çekin.
- Çekilen kılcal camı 2,7 M KCl çözeltisi ile doldurun. Önce kılcal damarla doldurun (pipet ucunu 2,7 M KCl çözeltisine batırın) ve daha sonra pipetin yarısını ince bir enjeksiyon iğnesi ile doldurun. Gerekirse, hava kabarcıkları ortadan kaldırmak için elektrot pipet dokunun.
- Elektrot tutucuya bağlayın. Tutucuyu amplifikatör başlığına amplifikatörle bağlayın. Elektrot tutucu-headstage'i kararlı bir 3-B mikromanipülatörle yerleştirin. Banyo çözeltisi ucunu kaplayana kadar elektrot aşağı.
NOT: Elektrot dikey bir oryantasyona sahip olmalıdır
- Referans elektrot olarak klorür kaplı gümüş telli elektrot kullanın
- Amplifikatörün Köprü Modunu seçin (amplifikatörün Mod bölümünde, Köprü düğmesine basın) ve elektrot direncini ölçün. Direncin yaklaşık 50 MΩ11olduğundan emin olun.
NOT: Bu elektrot boyutu hücreye sınırlı hasar ile iyi kalitede bir elektrik kaydı sağlar. - Amplifikatörün voltaj kelepçesindeki Tutma Pozisyonu düğmesini ve amplifikatörün Microelectrode 1 bölümündeki Kapasitans Nötralizasyon düğmesini kullanarak ofset akımını etkisiz hale getirin ve kapasitif geçici leri telafi edin.
- Süper füzyon sistemi
- Banyo çözeltisini (adım 1.2.2) uygun bir hazneye (250 mL serum şişesi) dökün ve bir sulama boru setine (3,2 mm dahili çap) bağlayarak kayıt odasını bağlayın. Yerçekimi nekadar süper füzyon sistemi kullanın. Akış hızını ~ 0,5 mL/s olarak düzenleyin.
- Hazneyi bir emme cihazına bağlayın. Çözelti emme sistemini kayıt odasının toplam hacminin değişmeyecek şekilde düzenleyin. Emme için bir vakum pompası kullanın.
NOT: Kayıt odasındasabit bir ses, deney boyunca başıboş kapasitansları sabit tutmak için önemlidir.
2. Biyolojik Malzeme
Not: Belirsiz seksin intermolt aşamasında yetişkin kerevitler P. clarkii (7-10 cm uzunluğunda) kullanın.
- Sirkadiyen zamanlı
- Deneylerden bir ay önce, 12 saat açık/12-h karanlık döngü15 (beyaz ışık, 2,4 kW/m2)altında 100 kerevit idame ettirin.
NOT: Bir ay kerevit popülasyonunu senkronize etmek için yeterlidir. - Kerevit popülasyonunun sirkadiyen zamanını, rastgele seçilen beş hayvanın elektroretinogramlarının genliğini değerlendirerekbelirleyin 15.
NOT: 0 h sirkadiyen zaman (CT 0) öznel bir günün başlangıcını gösterir, yani,bir organizmanın normalde aktif olduğu zaman16,17,18,19 ( Şekil3). Kerevit bir gece hayvanıdır, bu yüzden 12-h ışık/12-h karanlık döngüsü altında, karanlık evrede aktiftir.
- Deneylerden bir ay önce, 12 saat açık/12-h karanlık döngü15 (beyaz ışık, 2,4 kW/m2)altında 100 kerevit idame ettirin.
- Eyestalk izolasyon prosedürü
- İstenilen sirkadiyen zamanda, seçilmiş bir kereviti 0-4 °C'de musluk suyuna 15 dakika süreyle dalarak anestezi edin.
- İnce bir makas ile, göz sapını tabandan ayırın.
- Dorsal korneada bir açıklık (~ 1-mm2)yapmak için bir jilet kullanarak retina erişin.
- Odanın üst kısmında retina erişim açıklığı ile kayıt odasının (silikon ile kaplı delik) merkezine göz sapı yerleştirin.
- 20 dakika boyunca sürekli karanlık altında göz talk tutun.
NOT: 20 dk fotoreseptör hücresinin tamamen koyu adapte olması için yeterli bir süredir.
3. Fotoreseptör Impaling
- Mikroelektrot ve göz sapı uzunlamasına eksenini, mikroelektrotun retinaya erişim için ortalanmış olacak şekilde paralel bir şekilde yerleştirin. Aygıtları doğru yapılandırmaya yerleştirmek için stereoskopik mikroskop (10X) kullanın.
- Amplifikatörün Köprü Modu11'ini seçerek referans ve kayıt elektrotları arasındaki voltaj farkını izleyin.
- Elektrot banyoya indirin ve daha sonra retinanın üzerine yerleştirin.
- Mikroskobu uzaklaştırın ve fotostimülatör lambasını göz sapınuzun uzunlamasına eksenine paralel konumlandırın.
NOT: Lamba ve süperfüzyon odası arasındaki mesafe yaklaşık 15 cm'dir. - Ani voltaj düşüşü algılanana kadar mikroelektrotu yavaşça indirin.
NOT: −50 mV civarındaki gerilim düşüşü, sağlıklı bir fotoreseptör hücresinin delinmesini gösterir. - Fotoreseptörün reseptör potansiyelini kaydetmek için bir test ışığı (beyaz ışık, 7,2 kW/m2, 10 μs süre) sunun.
NOT: Fotoreseptör reseptör potansiyeli 10-15 mV genlik ve 300 ms süreli depolarizasyon potansiyelidir(Şekil 4).
4. Elektrik Kayıt
- Fotoreseptör hücrelerinin karanlık koşullara tamamen uyum sağladığından emin olun (bkz. adım 2.3).
- Her 2 dakikada bir test ışığı flaşı sunun. Veri toplama yazılımında yeterli bir değer (120 s) "bölümler arası zaman" seçerek yanıp söner arasındaki zamanı otomatikleştirin.
NOT: Fotoreseptörün elektriksel yanıtının altında yatan akımların tamamen geri kazanımı için 2 dk gerekli süredir. - Dinlenme zarı potansiyelini ve reseptör potansiyelinin genliğini ve süresini izleyin. Membran potansiyeli, genliği ve reseptör potansiyelinin süresi değişmeden kaldığında fotoreseptörün tamamen adapte olduğunu varsayalım. Eyestalks daha önce 20 dakika (adım 2.3) için sürekli karanlık altında tutulan yaklaşık 5 dakika içinde adaptasyon tamamlamak.
- Işık lı akımı kaydetmeden önce hücreyi 2 dk uyarmayı durdurun.
- Her 2 dakikada bir test ışığı flaşı sunun. Veri toplama yazılımında yeterli bir değer (120 s) "bölümler arası zaman" seçerek yanıp söner arasındaki zamanı otomatikleştirin.
- Geçerli kayıt
- Veri toplama yazılımında (Analog Çıkış Kanalı bölümündeki Dalga formunda) "Genlik tutma" seçeneğini seçerek hücrenin ölçülen istirahat membranı potansiyel değerindeki gerilimi kıskaca alır.
- Amplifikatörün dSEVC modunu seçin. Amplifikatörün Mod bölümünde, SEVC düğmesini seçin ve kolu Discont SEVC konumuna geçirin.
- Elektrot11'inhızına göre belirlenen anahtarlama hızını 500-1.000 Hz olarak ayarlayın (amplifikatörün Hız Ayarlama düğmesini kullanarak).
- Bir ışık flaşı sunun ve uyarılmış iyon akını gözlemleyin.
NOT: Bu ışık-elicited veya transdüksiyon akımıdır (Şekil 5). - Amplifikatörün Bridge moduna dönün ve bir ışık flaşı göndererek bir reseptör potansiyeli kaydedin (bölüm 3'e bakın). Fotoreseptör hücresinin tamamen karanlık koşullara adapte olduğundan emin olun. Reseptör potansiyel özelliklerini (genlik ve süre) ölçün ve ilk ölçümlerle karşılaştırın. Kazığa saplanmış fotoreseptör hücresinin aynı özelliklere sahipse sağlıklı bir hücre olduğunu varsayalım.
NOT: Göz talk ablasyon sonra, biyolojik hazırlık aşağıdaki 2 saat sırasında uygulanabilir.
- İki darbe protokolü: Desensitizasyondan kurtarmayı iki ışık flaşı protokolü ile ölçün.
NOT: İki ışık flaşprotokolü, voltaj kapılı kanalların inaktivasyonundan kaynaklanan geri kazanımı ölçmek için kullanılan standart iki darbegerilim protokolüne benzer20. İlk ışık flaşı fotoreseptör hücresinin hassasiyetinde geçici bir değişikliğe neden olur ve ikinci flaş ışıkla aktive edilen iletkenliğin durumunu değerlendirir.- Bir çift ışık darbesi getirin. İkinci flaşı istenilen zaman aralığından sonra uygulayın (300 ms'den 2 dk'ya kadar).
- Veri toplama yazılımı ile 10 KHz örneklemede akımları dijitalleştirin ve verileri çevrimdışı analiz için kaydedin11.
NOT: Yazılımın yapılandırma değerlerini içeren bir tablo ek malzeme olarak ek olarak ek olarak eklenmiştir.
5. Veri Analizi
- Işık la kaplı akımın kinetik
- Üç geçerli parametreyi ölçün: etkinleştirme gecikmesi L, akım maksimal genliğinin %10'una erişene kadar ışık flaşı tesliminden geçen süre(Şekil 5); tepe veya maksimal akım genliği Ip; ve duyarsızlaştırma süresi sabiti T. Dedesensitizasyon zaman sabitini (Τ) akım bozunma fazını aşağıdakilere sığdırarak ölçün:
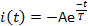
nerede, A = -I(t=0) pozitif bir sabittir (Şekil 5).
- Üç geçerli parametreyi ölçün: etkinleştirme gecikmesi L, akım maksimal genliğinin %10'una erişene kadar ışık flaşı tesliminden geçen süre(Şekil 5); tepe veya maksimal akım genliği Ip; ve duyarsızlaştırma süresi sabiti T. Dedesensitizasyon zaman sabitini (Τ) akım bozunma fazını aşağıdakilere sığdırarak ölçün:
- Duyarsızlaştırma ve kurtarma
Not: Duyarsızlaştırmadan kurtarma oranı p2/p1olarak değerlendirildi, p1 kontrol akımının ilgili parametresi (L, Ipveya T) ve p2 ikinci test akımının karşılık gelen parametresidir.- Çizici p2/p1 (ya L, Ip, veya T) darbeler arasında zaman fonksiyonu olarak.
- Parametreye bağlı olarak, her çizimin noktalarını aşağıdakilere sığdırın:
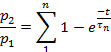
veya: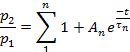
- Deneysel verilere uymak için gereken üstel terimlerin sayısını belirlemek için uygun bir istatistiksel test kullanın.
Sonuçlar
İlk olarak, kerevit fotoreseptör hücrelerinin temsili reseptör potansiyeli elde edilir (Şekil 4). Daha sonra, ışık transdüksiyon akımını tetiklemek için bir test ışığı-flaş uygulandı (Şekil 5). Katyonik transdüksiyon akımı1 bir gecikmeden sonra devreye girer, maksimal bir hıza ulaşır ve daha sonra yavaşça yavaş yavaş iyileştiği emici bir duyarsız duruma düşer.
Tartışmalar
Kerevit, doğal olmayan koşullar altında hayatta kalma yeteneği nedeniyle mükemmel bir model olduğu kanıtlanmıştır. In vivo ve in vitro elektrofizyolojik analizlere kolayca ulaşabilirsiniz. Buna ek olarak, kabuklular karşılaştırmalı kronobiyoloji alanında nörobiyolojik araştırmalar için uygun bir gruptur21.
Bu yazıda, kerevit fotoreseptör hücrelerinin ışıkla aktive edilmiş transdüksiyon akımının duyarsızlaştırılması ...
Açıklamalar
Açıklayacak bir şeyimiz yok.
Teşekkürler
Bu çalışma DGAPA-UNAM IN224616-RN224616 hibe tarafından desteklenmiştir. Yazarlar, Bu makalenin İngilizce versiyonunu düzenlediği için, UAM'deki Facultad de Medicina'daki División de Investigación'dan Bilimsel Makale Çeviri Bölümü Başkanı Bayan Josefina Bolado'ya teşekkür etmek istiyorlar.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Axoclamp2A | Axon Instruments Inc | Amplifier | |
| Digidata 1200 Interface | Axon Instruments Inc | Digitizer | |
| Oscilloscope TDS430A | Tektronix | Analogic Oscilloscope | |
| Photostimulator PS33 Plus | Grass | Lamp | |
| Puller PC-100 | Narishige | Micropipette Puller | |
| Puller P-97 | Sutter Instruments | Micropipette Puller | |
| Glass Capillary Tube Kimax-51 | Kimble Products | 34502 | 0.8, 1.10, 100 mm |
| HS-2 Headstage | Axon Instruments Inc | Headstage | |
| Micromanipulator MX-4 | Narishige | Mechanical Micromanipulator | |
| Stereoscopic Microscope | Zeiss | Microscope | |
| pClamp | Axon Instruments Inc | Data acquisition software for digidata 1200 interface | |
| Clampfit | Axon Instruments, Inc | Analysis software linked to pClamp | |
| Origin | OriginLab Corp. | Data analysis and graphing software | |
| Sodium Chloride | Sigma | S7653 | >99.5% |
| Potassium Chloride | Sigma | P-9333 | Minimum 99% |
| Magnesium Sulfate | Sigma | M7506 | Minimum 99.5% |
| Calcium Chloride | Sigma | C5080 | Minimum 99.0% |
| Hepes | Sigma | H7523 | >99.5% |
| Sodium Hydroxide | Sigma | S8045 | 98.00% |
| Sodium hypochlorite solution | Sigma | 425044 | Available chlorine, 10-15% |
Referanslar
- Barriga-Montoya, C., Gómez-Lagunas, F., Fuentes-Pardo, B. Effect of pigment dispersing hormone on the electrical activity of crayfish visual photoreceptors during the 24-h cycle. Comp. Biochem. Physiol. A Comp. Physiol. 157 (4), 338-345 (2010).
- Barriga-Montoya, C., de la O-Martínez, A., Fuentes-Pardo, B., Gómez-Lagunas, F. Desensitization and recovery of crayfish photoreceptors. Dependency on circadian time, and pigment-dispersing hormone. Comp. Biochem. Physiol. A Comp. Physiol. 203, 297-303 (2017).
- Wickenden, A. D. Overview of electrophysiological techniques. Curr. protoc. pharmacol. 11, 1-17 (2014).
- Brette, R., Destexhe, A. Intracellular recording. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Cummins, D., Goldsmith, T. H. Cellular identification of the violet receptor in the crayfish eye. J. Comp. Physiol. 142 (2), 199-202 (1981).
- Eguchi, E. Rhabdom structure and receptor potentials in single crayfish retinular cells. J. Cell and Comp. Physiol. 66, 411-430 (1965).
- Nosaki, H. Electrophysiological study of color encoding in the compound eye of crayfish, Procambarus clarkii. Z. vergl. Physiologie. 64 (3), 318-323 (1969).
- Miller, C. S., Glantz, R. M. Visual adaptation modulates a potassium conductance in retinular cells of the crayfish. Vis Neurosci. 17 (3), 353-368 (2000).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods Enzymol. 525, 59-79 (2013).
- Finkel, A. Axoclamp-2A microelectrode clamp theory and operation. Axon Instruments, Inc. , (1990).
- Sakmann, B. . Single-channel recording. , (2013).
- Van Harreveld, A. A physiological solution for freshwater crustacea. Proc. Soc. Exp. Biol. Med. 34 (4), 428-432 (1936).
- Oesterle, A. . pipette cookbook. , 97 (2008).
- Fuentes-Pardo, B., Ramos-Carvajal, J. The phase response curve of electroretinographic circadian rhythm of crayfish. Comp. Biochem. Physiol. A Comp. Physiol. 74 (3), 711-714 (1983).
- Pace-Schott, E. F., Hobson, J. A. The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat. Rev. Neurosci. 3 (8), 591-605 (2002).
- Pittendrigh, C. S., Aschoff, J. On the mechanism of the entrainment of a circadian rhythm by light cycles. Circadian Clocks. , 277-297 (1965).
- Pittendrigh, C. S., Aschoff, J. Circadian systems: entrainment. Handbook Behavioral Neurobiology Biological Rhythms. , 94-124 (1981).
- Vitaterna, M. H., Takahashi, J. S., Turek, F. W. Overview of circadian rhythms. Alcohol Res. Health. 25 (2), 85-93 (2001).
- Hille, B. . Ion channels of excitable membranes. 507, (2001).
- Dircksen, H., Strauss, J. Circadian clocks in crustaceans: identified neuronal and cellular systems. Front Biosci. 15, 1040-1074 (2010).
- Terakita, A., Hariyama, T., Tsukahara, Y., Katsukura, Y., Tashiro, H. Interaction of GTP-binding protein Gq with photoactivated rhodopsin in the photoreceptor membranes of crayfish. FEBS Lett. 330, 197-200 (1993).
- Terakita, A., Takahama, H., Hariyama, T., Suzuki, T., Tsukahara, Y. Light regulated localization of the beta-subunit of Gq-type G-protein in the crayfish photoreceptors. J Comp Physiol A. 183 (4), 411-417 (1998).
- Terakita, A., Takahama, H., Tamotsu, S., Suzuki, T., Hariyama, T., Tsukahara, Y. Light-modulated subcellular localization of the alpha-subunit of GTP-binding protein Gq in crayfish photoreceptors. Vis Neurosci. 13 (3), 539-547 (1996).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır