É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Dessensibilização e recuperação de fotorreceptores de lagostins após a entrega de um estímulo leve
Neste Artigo
Resumo
Um protocolo para o estudo da dessensibilização e recuperação da sensibilidade de fotorreceptores de lagostins em função do tempo circadiano é apresentado.
Resumo
Um método para estudar a dessensibilização e recuperação de fotorreceptores de lagostins é apresentado. Realizamos gravações elétricas intracelulares de células fotorreceptoras em eyestalks isolados usando a configuração de tensão-clamp comutada por eletrodo. Primeiro, com uma lâmina de barbear fizemos uma abertura na córnea dorsal para ter acesso à retina. Depois disso, inserimos um eletrodo de vidro através da abertura, e penetramos uma célula conforme relatado pelo registro de um potencial negativo. O potencial da membrana foi apertado no potencial de descanso do fotorreceptor e um luz-pulso foi aplicado para ativar correntes. Finalmente, o protocolo de dois flashs leves foi empregado para medir a dessensibilização e recuperação atuais. O primeiro flash de luz desencadeia, após um período de atraso, a corrente iônica de transdução, que depois de atingir uma amplitude máxima decai em direção a um estado dessensibilizado; o segundo flash, aplicado em intervalos de tempo variados, avalia o estado da condutância ativada pela luz. Para caracterizar a corrente provocada pela luz, três parâmetros foram medidos: 1) latência (o tempo decorrido entre a entrega de flash de luz e o momento em que a corrente atinge 10% de seu valor máximo); 2) pico de corrente; e 3) tempo de dessensibilização constante (tempo exponencial constante da fase atual de decadência). Todos os parâmetros são afetados pelo primeiro pulso.
Para quantificar a recuperação da dessensibilização, a razão p2/p1 foi empregada versus o tempo entre os pulsos. p1 é a corrente de pico evocada pelo primeiro pulso de luz, e p2 é a corrente de pico evocada pelo segundo pulso. Esses dados foram ajustados a uma soma de funções exponenciais. Finalmente, essas medidas foram realizadas em função do tempo circadiano.
Introdução
A fim de ser percebido como um estímulo visual, a luz atingindo os olhos deve ser transduzida em um sinal elétrico. Assim, em todos os organismos visuais, a luz desencadeia uma corrente íon-transducção, que por sua vez produz uma mudança no potencial de membrana das células fotorreceptoras, o chamado potencial receptor. Devido a isso, a sensibilidade à luz do olho depende principalmente do estado da condutância ativada pela luz, que pode estar disponível para ser ativada ou insensível.
Em fotorreceptores de lagostins, a luz desencadeia uma corrente lenta, transitória e iônica1. Após a iluminação, a corrente de transdução surge após um atraso ou latência antes de atingir o seu máximo; depois disso, decai, como os canais de transdução cair em um estado insensível em que eles não respondem a mais estímulo luz2. Ou seja, a luz, além de ativar a corrente de transdução responsável pela visão, também induz um decrement transitório da sensibilidade das células fotorreceptoras. A dessensibilização pode representar um mecanismo de proteção geral contra a superexposição a um estímulo adequado. A sensibilidade do olho à luz é recuperada à medida que a condução da transdução se recupera da dessensibilização.
A gravação intracelular é uma técnica útil para medir a atividade elétrica das células excitáveis3,4,5,6,7,8. Embora a gravação intracelular tenha se tornado menos frequente com o advento da técnica de braçadeira9,ainda é uma abordagem conveniente quando as células são difíceis de isolar, ou apresentam uma geometria que dificulta a formação das focas giga de fixação de remendos(ou seja,focas ou contatos apertados entre o eletrodo de remendo e membranas com resistência elétrica da ordem de 109ohms). Exemplos desteúltimo são espermatozóides10 e as células fotorreceptoras aqui estudadas. Em nossa experiência, os fotorreceptores Procambarus clarkii são difíceis de isolar e manter na cultura primária; além disso, são hastes finas que tornam difícil a formação giga-seal. Em gravações intracelulares, um eletrodo afiado é avançado em uma célula que é mantida no lugar pelo tecido circundante. O eletrodo é picado pelos circuitos de comutação de alta velocidade do amplificador, de modo que a corrente é amostrada entre pulsos de tensão. Este modo é conhecido como clampedede descontínuo de eletrodo único (modo dSEVC)11. A alta resistência (pequena abertura) do eletrodo dificulta a troca difusão entre a célula e as soluções de pipetas, produzindo uma perturbação mínima do ambiente intracelular3. Uma desvantagem potencial desta técnica é que a inserção de eletrodos pode produzir uma corrente de vazamento não seletiva; portanto, deve ser tomado cuidado para evitar o registro de células onde o tamanho da corrente de vazamento pode interferir com as medições pretendidas4,12.
Aqui, usamos eyestalks lagostins isolados para avaliar a dessensibilização e recuperação da condução de íons ativados pela luz apartir da realização de gravações elétricas intracelulares de células fotorreceptoras condições de braçadeira de tensão.
Protocolo
NOTA: Os experimentos cumprem as Leis de Proteção animal do México.
1. Configuração experimental
- Conexões gerais
- Conecte o amplificador a um computador adequado através de um conversor analógico e use um osciloscópio para monitorar o experimento (Figura 1).
- Conecte o photostimulator ao A/D convertido.
- Câmara de gravação
- Coloque a câmara de gravação em cima de uma mesa anti-vibração e localizá-lo dentro de uma gaiola faraday.
NOTA: Isso evita vibração mecânica e ruído elétrico que pode afetar a gravação. Nossa gaiola de Faraday era feita de malha de arame escurecido. Uma câmara caseira, 2 mL, de gravação acrílica é usada(Figura 2). - Prepare a solução de banho para manter a preparação viva13:205 mM NaCl; 5 mM KCl; 2 mM MgSO4; 13 mM CaCl2; 5 mM Hepes-NaOH, pH 7.3.
NOTA: A solução não inclui dextrose ou qualquer borbulhação por 95% O2,5% co2 mistura porque o procedimento experimental é curto o suficiente para detectar danos pela gravação elétrica (ver passo 4.2.3 para completude).
- Coloque a câmara de gravação em cima de uma mesa anti-vibração e localizá-lo dentro de uma gaiola faraday.
- Eletrodos
- Use um eletrodo de fio de prata revestido de cloreto como eletrodo de referência
NOTA: Revestimento de cloreto de prata é necessário para permitir a reação do eletrodo: AgCl (s) + e−↔ Ag (s) + Cl-. - Areia um fio de prata (espessura ~ 1 mm, comprimento ~ 10 cm) com um papel emery grau fino, a fim de limpar sua superfície.
- Lave o fio de prata com água destilada.
- Mergulhe o fio de prata limpo em uma solução de hipoclorite de sódio de 4-6% (NaClO) até que pareça escuro (aproximadamente 20 min).
- Use pipetas de vidro finas cheias de uma solução de eletrólitos (2,7 M KCl) como eletrodo intracelular.
- Puxe um tubo capilar de vidro (diâmetro interno - 1 mm) com um puxador de micro-pipeta para obter uma ponta fina com uma pequena abertura (0,01-0,1 μm)14.
- Encha o vidro capilar puxado com uma solução KCl de 2,7 m. Primeiro preenchê-lo por capilaridade (mergulhe a ponta da pipeta na solução KCl 2.7 M) e, em seguida, preenchê-lo pela pipeta com uma agulha de injeção fina. Se necessário, toque na pipeta de eletrodo para eliminar bolhas de ar.
- Conecte o eletrodo ao seu titular. Conecte o suporte ao farol do amplificador com o amplificador. Posicione o palco do suporte de eletrodo com um micromanipulador 3D estável. Abaixe o eletrodo até que a solução do banho cubra sua ponta.
NOTA: O eletrodo deve ter uma orientação vertical
- Use um eletrodo de fio de prata revestido de cloreto como eletrodo de referência
- Selecione o modo ponte do amplificador (na seção de modo do amplificador, pressione o botão Ponte) e medir a resistência do eletrodo. Certifique-se de que a resistência é de cerca de 50 MΩ11.
NOTA: Este tamanho do eletrodo permite uma gravação elétrica de boa qualidade com danos limitados à célula. - Anule a corrente de compensação e compense os transientes capacitivos usando o botão Holding Position na seção Voltage Clamp do amplificador e o botão de neutralização de capacitação na seção Microeletrodo 1 do amplificador.
- Sistema de superfusão
- Despeje a solução de banho (passo 1.2.2) em um recipiente adequado (uma garrafa de soro de 250 mL) e conecte-a a um conjunto de tubos de irrigação (3,2 mm de diâmetro interno), conectando assim a câmara de gravação. Use um sistema de superfusão movido pela gravidade. Regular a taxa de fluxo para ~ 0,5 mL/s.
- Conecte a câmara a um dispositivo de sucção. Regular o sistema de solução de sucção de tal forma que o volume total da câmara de gravação não varia. Use uma bomba de vácuo para a sucção.
NOTA: Um volume constante na câmara de gravação é importante para manter capacitances dispersos constantes durante todo a experiência.
2. Material Biológico
Nota: Use lagostins adultos P. clarkii (7-10 cm de comprimento) na fase intermolt de sexo indistinto.
- Tempo circadiano
- Um mês antes dos experimentos, manter 100 lagostins um ciclo escuro de 12 h luz/12-h15 (luz branca, 2,4 kW/m2).
NOTA: Um mês é tempo suficiente para sincronizar a população de lagostins. - Determinar o tempo circadiano da população de lagostins, avaliando a amplitude dos eletroretinogramas de cinco animais escolhidos aleatoriamente15.
NOTA: 0 h tempo circadiano (CT 0) indica o início de um dia subjetivo, ou seja,tempo durante o qual um organismo é normalmente ativo16,17,18,19 ( Figura3). O lagostim é um animal noturno, por isso, um ciclo escuro de 12 h light/12-h, ele está ativo durante a fase escura.
- Um mês antes dos experimentos, manter 100 lagostins um ciclo escuro de 12 h luz/12-h15 (luz branca, 2,4 kW/m2).
- Procedimento de isolamento eyestalk
- No tempo circadiano desejado, anestesiaum lagostim selecionado por imersão na água da torneira a 0-4 °C, por 15 min.
- Por meio de uma tesoura fina, desasejá-lo da base.
- Acesse a retina usando uma lâmina de barbear para fazer uma abertura (~ 1 mm2)na córnea dorsal.
- Coloque o eyestalk no centro da câmara de gravação (o buraco coberto com silicone) com a abertura de acesso à retina no topo da câmara.
- Mantenha o eyestalk a escuridão constante por 20 min.
NOTA: 20 min é tempo suficiente para a célula fotorreceptor a ser totalmente escura adaptada.
3. Impaling photoreceptor
- Coloque o microeletrodo e o eixo longitudinal do eyestalk paralelos de tal forma que o microeletrodo está centrado para acesso à retina. Use um microscópio estereoscópico (10X) para colocar os dispositivos na configuração correta.
- Monitore a diferença de tensão entre os eletrodos de referência e gravação selecionando o Modo Ponte11 do amplificador.
- Abaixe o eletrodo no banho e, posteriormente, colocá-lo sobre a retina.
- Afaste o microscópio e posicione a lâmpada do photostimulador paralela ao eixo longitudinal do eyestalk.
NOTA: A distância entre a lâmpada e a câmara de superfusão é de aproximadamente 15 cm. - Abaixe lentamente o microelectrode até que uma gota repentina da tensão esteja detectada.
NOTA: Uma queda de tensão de cerca de −50 mV indica o empalamento de uma célula fotorreceptorsaudável saudável. - Entregue um flash de luz de teste (luz branca, 7,2 kW/m2,10 μs de duração) para registrar o potencial receptor do fotorreceptor.
NOTA: O potencial receptor do fotorreceptor é um potencial despolarizante de 10-15 mV amplitude e 300 ms duração (Figura 4).
4. Gravação elétrica
- Certifique-se de que as células fotorreceptoras estão totalmente adaptadas às condições escuras (ver passo 2.3).
- Entregue um flash de luz de teste a cada 2 min. Automatiza o tempo entre flashes, escolhendo um valor adequado (120 s) de "tempo entre os episódios" no software de aquisição de dados.
NOTA: 2 min é o momento necessário para permitir a recuperação total das correntes subjacentes à resposta elétrica do fotorreceptor. - Monitorar o potencial de membrana de repouso, bem como a amplitude e duração do potencial do receptor. Suponha que o fotorreceptor esteja completamente adaptado uma vez que o potencial, a amplitude e a duração do potencial do receptor permaneçam inalterados. Eyestalks anteriormente mantidos escuridão constante por 20 min (passo 2.3) completar a sua adaptação em aproximadamente 5 min.
- Pare de estimular a célula 2 min antes de gravar a corrente provocada pela luz.
- Entregue um flash de luz de teste a cada 2 min. Automatiza o tempo entre flashes, escolhendo um valor adequado (120 s) de "tempo entre os episódios" no software de aquisição de dados.
- Gravação atual
- Aperte a tensão no valor potencial de membrana de repouso medido da célula selecionando "Amplitude de retenção" no software de aquisição de dados (em forma de onda na seção Canal de Saída Analógica).
- Selecione o modo dSEVC do amplificador. Na seção Mode do amplificador, selecione o botão SEVC e alterne a alavanca para a posição Discont SEVC.
- Defina a taxa de comutação para 500-1.000 Hz (usando o botão Rate Adjust do amplificador), conforme determinado pela velocidade do eletrodo11.
- Entregar um flash leve, e observar o influxo de íons evocado.
NOTA: Esta é a corrente de luz-eliciada ou transdução (Figura 5). - Retorne ao modo Bridge no amplificador e grave um potencial receptor enviando um flash de luz (ver seção 3). Certifique-se de que a célula fotorreceptora está totalmente adaptada às condições escuras. Medir as características potenciais do receptor (amplitude e duração) e comparar com as primeiras medidas. Suponha que a célula fotorreceptoremada empalada é uma célula saudável se tiver as mesmas características.
NOTA: Depois de eyestalk ablação, preparação biológica é viável durante o seguinte 2 h.
- Dois protocolos de pulso: Medir a recuperação da dessensibilização com um protocolo de dois flashs leves.
NOTA: O protocolo de dois flashs de luz é semelhante ao protocolo padrão de tensão de dois pulsos usado para medir a recuperação da inativação dos canais de tensão20. O primeiro flash leve provoca uma mudança temporária na sensibilidade da célula fotorreceptora e o segundo flash avalia o estado da condutância ativada pela luz.- Entregar um par de pulsos de luz. Aplique o segundo flash após um intervalo de tempo desejado (de 300 ms a 2 min).
- Digitalize as correntes a 10 amostras khz com o software de aquisição de dados e guarde os dados para análise off-line11.
NOTA: Uma tabela com os valores de configuração do software é incluída como material suplementar.
5. Análise de dados
- Cinética da corrente suscitada pela luz
- Medida três parâmetros atuais: latência de ativação L, o tempo decorrido da entrega em flash leve até que a corrente atinja 10% de sua amplitude máxima (Figura 5); pico ou máxima amplitude atual Ip; e tempo de dessensibilização constante T. Medir o tempo de dessensibilização constante (Τ), ajustando a fase atual de decadência para:
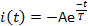
onde, A = -I (t=0) é uma constante positiva(Figura 5).
- Medida três parâmetros atuais: latência de ativação L, o tempo decorrido da entrega em flash leve até que a corrente atinja 10% de sua amplitude máxima (Figura 5); pico ou máxima amplitude atual Ip; e tempo de dessensibilização constante T. Medir o tempo de dessensibilização constante (Τ), ajustando a fase atual de decadência para:
- Dessensibilização e recuperação
Nota: A recuperação da dessensibilização foi avaliada como a razão p2/p1,onde p1 é o parâmetro relevante (L, ipou T) da corrente de controle, e p2 é o parâmetro correspondente da segunda corrente de teste.- Enredo p2/p1 (ou L, ip,ou T) em função do tempo entre os pulsos.
- Dependendo do parâmetro, ajuste os pontos de cada parcela para:
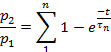
ou para: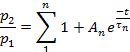
- Use um teste estatístico apropriado para determinar o número de termos exponenciais necessários para se adequar aos dados experimentais.
Resultados
Primeiro, um potencial receptor representativo de células fotorreceptoras de lagostins é obtido (Figura 4). Posteriormente, um flash de luz de teste foi aplicado para desencadear a corrente de transdução de luz (Figura 5). A corrente de transdução cationic1 ativa após um atraso, atingindo um máximo e, posteriormente, lentamente cai em um estado absorvente insensível do qual se recupera lentamente....
Discussão
O lagostim provou ser um excelente modelo devido à sua capacidade de sobreviver em condições não naturais. Há fácil acesso a análises eletrofisiológicas in vivo e in vitro. Além disso, os crustáceos são um grupo favorável à pesquisa neurobiológica no campo da cronobiologia comparativa21.
Neste artigo, o estudo da dessensibilização e recuperação da corrente de transdução ativada pela luz das células fotorreceptoras de lagostins é m...
Divulgações
Não temos nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela subvenção DGAPA-UNAM IN224616-RN224616. Os autores querem agradecer à Sra. Josefina Bolado, Chefe do Departamento de Tradução de Artigos Científicos, da División de Investigación da Facultad de Medicina, UNAM, por editar a versão em inglês deste manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Axoclamp2A | Axon Instruments Inc | Amplifier | |
| Digidata 1200 Interface | Axon Instruments Inc | Digitizer | |
| Oscilloscope TDS430A | Tektronix | Analogic Oscilloscope | |
| Photostimulator PS33 Plus | Grass | Lamp | |
| Puller PC-100 | Narishige | Micropipette Puller | |
| Puller P-97 | Sutter Instruments | Micropipette Puller | |
| Glass Capillary Tube Kimax-51 | Kimble Products | 34502 | 0.8, 1.10, 100 mm |
| HS-2 Headstage | Axon Instruments Inc | Headstage | |
| Micromanipulator MX-4 | Narishige | Mechanical Micromanipulator | |
| Stereoscopic Microscope | Zeiss | Microscope | |
| pClamp | Axon Instruments Inc | Data acquisition software for digidata 1200 interface | |
| Clampfit | Axon Instruments, Inc | Analysis software linked to pClamp | |
| Origin | OriginLab Corp. | Data analysis and graphing software | |
| Sodium Chloride | Sigma | S7653 | >99.5% |
| Potassium Chloride | Sigma | P-9333 | Minimum 99% |
| Magnesium Sulfate | Sigma | M7506 | Minimum 99.5% |
| Calcium Chloride | Sigma | C5080 | Minimum 99.0% |
| Hepes | Sigma | H7523 | >99.5% |
| Sodium Hydroxide | Sigma | S8045 | 98.00% |
| Sodium hypochlorite solution | Sigma | 425044 | Available chlorine, 10-15% |
Referências
- Barriga-Montoya, C., Gómez-Lagunas, F., Fuentes-Pardo, B. Effect of pigment dispersing hormone on the electrical activity of crayfish visual photoreceptors during the 24-h cycle. Comp. Biochem. Physiol. A Comp. Physiol. 157 (4), 338-345 (2010).
- Barriga-Montoya, C., de la O-Martínez, A., Fuentes-Pardo, B., Gómez-Lagunas, F. Desensitization and recovery of crayfish photoreceptors. Dependency on circadian time, and pigment-dispersing hormone. Comp. Biochem. Physiol. A Comp. Physiol. 203, 297-303 (2017).
- Wickenden, A. D. Overview of electrophysiological techniques. Curr. protoc. pharmacol. 11, 1-17 (2014).
- Brette, R., Destexhe, A. Intracellular recording. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Cummins, D., Goldsmith, T. H. Cellular identification of the violet receptor in the crayfish eye. J. Comp. Physiol. 142 (2), 199-202 (1981).
- Eguchi, E. Rhabdom structure and receptor potentials in single crayfish retinular cells. J. Cell and Comp. Physiol. 66, 411-430 (1965).
- Nosaki, H. Electrophysiological study of color encoding in the compound eye of crayfish, Procambarus clarkii. Z. vergl. Physiologie. 64 (3), 318-323 (1969).
- Miller, C. S., Glantz, R. M. Visual adaptation modulates a potassium conductance in retinular cells of the crayfish. Vis Neurosci. 17 (3), 353-368 (2000).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods Enzymol. 525, 59-79 (2013).
- Finkel, A. Axoclamp-2A microelectrode clamp theory and operation. Axon Instruments, Inc. , (1990).
- Sakmann, B. . Single-channel recording. , (2013).
- Van Harreveld, A. A physiological solution for freshwater crustacea. Proc. Soc. Exp. Biol. Med. 34 (4), 428-432 (1936).
- Oesterle, A. . pipette cookbook. , 97 (2008).
- Fuentes-Pardo, B., Ramos-Carvajal, J. The phase response curve of electroretinographic circadian rhythm of crayfish. Comp. Biochem. Physiol. A Comp. Physiol. 74 (3), 711-714 (1983).
- Pace-Schott, E. F., Hobson, J. A. The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat. Rev. Neurosci. 3 (8), 591-605 (2002).
- Pittendrigh, C. S., Aschoff, J. On the mechanism of the entrainment of a circadian rhythm by light cycles. Circadian Clocks. , 277-297 (1965).
- Pittendrigh, C. S., Aschoff, J. Circadian systems: entrainment. Handbook Behavioral Neurobiology Biological Rhythms. , 94-124 (1981).
- Vitaterna, M. H., Takahashi, J. S., Turek, F. W. Overview of circadian rhythms. Alcohol Res. Health. 25 (2), 85-93 (2001).
- Hille, B. . Ion channels of excitable membranes. 507, (2001).
- Dircksen, H., Strauss, J. Circadian clocks in crustaceans: identified neuronal and cellular systems. Front Biosci. 15, 1040-1074 (2010).
- Terakita, A., Hariyama, T., Tsukahara, Y., Katsukura, Y., Tashiro, H. Interaction of GTP-binding protein Gq with photoactivated rhodopsin in the photoreceptor membranes of crayfish. FEBS Lett. 330, 197-200 (1993).
- Terakita, A., Takahama, H., Hariyama, T., Suzuki, T., Tsukahara, Y. Light regulated localization of the beta-subunit of Gq-type G-protein in the crayfish photoreceptors. J Comp Physiol A. 183 (4), 411-417 (1998).
- Terakita, A., Takahama, H., Tamotsu, S., Suzuki, T., Hariyama, T., Tsukahara, Y. Light-modulated subcellular localization of the alpha-subunit of GTP-binding protein Gq in crayfish photoreceptors. Vis Neurosci. 13 (3), 539-547 (1996).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados