Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Desensitisierung und Wiederherstellung von Krebse Photorezeptoren nach der Lieferung eines leichten Stimulus
In diesem Artikel
Zusammenfassung
Ein Protokoll zur Untersuchung der Desensibilisierung und Empfindlichkeit sebung von Krebsphotorezeptoren als Funktion der zirkadianen Zeit wird vorgestellt.
Zusammenfassung
Eine Methode zur Untersuchung der Desensibilisierung und Wiederherstellung von Krebsphotorezeptoren wird vorgestellt. Wir führten intrazelluläre elektrische Aufnahmen von Photorezeptorzellen in isolierten Augenstielen mit der diskontinuierlichen Konfiguration der Einzelelektroden-Geschalteten Spannungsklemme durch. Zuerst haben wir mit einer Rasierklinge eine Öffnung in der dorsalen Hornhaut gemacht, um Zugang zur Netzhaut zu erhalten. Danach setzten wir eine Glaselektrode durch die Öffnung ein und drangen in eine Zelle ein, wie durch die Aufzeichnung eines negativen Potentials berichtet. Das Membranpotential wurde auf das Ruhepotential des Photorezeptors eingeklemmt und ein Lichtimpuls angewendet, um Ströme zu aktivieren. Schließlich wurde das zwei Lichtblitzprotokoll verwendet, um die aktuelle Desensibilisierung und Wiederherstellung zu messen. Der erste Lichtblitz löst nach einer Verzögerungsperiode den transduktionsionischen Strom aus, der nach Erreichen einer Spitzenamplitude in einen desensithissiierten Zustand abfällt; der zweite Blitz, der in unterschiedlichen Zeitintervallen angewendet wird, bewertet den Zustand der lichtaktivierten Leitfähigkeit. Um den lichtentwirrten Strom zu charakterisieren, wurden drei Parameter gemessen: 1) Latenz (die Zeit, die zwischen der Lichtblitzabgabe verstrichen ist, und dem Moment, in dem der Strom 10% seines Maximalwerts erreicht); 2) Spitzenstrom; und 3) Desensibilisierungszeitkonstante (exponentielle Zeitkonstante der aktuellen Zerfallsphase). Alle Parameter werden vom ersten Impuls beeinflusst.
Um die Erholung von der Desensibilisierung zu quantifizieren, wurde das Verhältnis p2/p1 im Vergleich zur Zeit zwischen den Impulsen verwendet. p1 ist der Spitzenstrom, der durch den ersten Lichtimpuls evoziert wird, und p2 ist der Spitzenstrom, der vom zweiten Impuls evoziert wird. Diese Daten wurden an eine Summe exponentiver Funktionen angepasst. Schließlich wurden diese Messungen in Abhängigkeit von der zirkadianen Zeit durchgeführt.
Einleitung
Um als visueller Reiz wahrgenommen zu werden, muss Licht, das die Augen erreicht, in ein elektrisches Signal umgewandelt werden. Somit löst Licht in allen visuellen Organismen einen Transduktionsionenstrom aus, der wiederum eine Veränderung des Membranpotenzials von Photorezeptorzellen, dem sogenannten Rezeptorpotential, bewirkt. Aus diesem Grund hängt die Lichtempfindlichkeit des Auges in erster Linie vom Zustand der lichtaktivierten Leitfähigkeit ab, die entweder aktiviert oder desensizipiert werden kann.
Bei Krebsphotorezeptoren löst Licht einen langsamen, transienten, ionischen Stromaus 1. Bei der Beleuchtung entsteht der Transduktionsstrom nach einer Verzögerung oder Latenz, bevor er sein Maximum erreicht; danach zerfällt es, da die Transduktionskanäle in einen desensiwordenen Zustand fallen, in dem sie nicht auf weitere Lichtreize reagieren2. Das heißt, Licht, zusätzlich zur Aktivierung der Transduktionsströmung verantwortlich des Sehens, induziert auch eine vorübergehende Dekrementierung der Empfindlichkeit von Photorezeptorzellen. Die Desensizipierung kann einen allgemeinen Schutzmechanismus gegen eine Übermäßige Exposition gegenüber einem angemessenen Stimulus darstellen. Die Lichtempfindlichkeit des Auges wird wiederhergestellt, wenn sich die Transduktionsleitfähigkeit von der Desensibilisierung erholt.
Intrazelluläre Aufzeichnung ist eine nützliche Technik zur Messung der elektrischen Aktivität von erregbaren Zellen3,4,5,6,7,8. Obwohl die intrazelluläre Aufzeichnung mit dem Aufkommen der Patch-Clamp-Technik9seltener geworden ist, ist es immer noch ein bequemer Ansatz, wenn Zellen entweder schwer zu isolieren sind oder eine Geometrie darstellen, die die Bildung der patch-clamping Giga-Dichtungen erschwert(d.h.Dichtungen oder enge Kontakte zwischen der Patchelektrode und Membranen mit elektrischem Widerstand in der Größenordnung von 109Ohm). Beispiele für letztere sind die Spermien10 und die hier untersuchten Photorezeptorzellen. Nach unserer Erfahrung, Procambarus clarkii Photorezeptoren sind schwierig zu isolieren und in der Primärkultur zu halten; Darüber hinaus sind es dünne Stäbe, die die Giga-Siegelbildung schwer zu erreichen machen. In intrazellulären Aufnahmen wird eine scharfe Elektrode in eine Zelle vorgeschoben, die vom umgebenden Gewebe an Ort und Stelle gehalten wird. Die Elektrode wird durch die Hochgeschwindigkeitsschaltschaltung des Verstärkers gehackt, so dass Strom zwischen Spannungsimpulsen abgetastet wird. Dieser Modus wird als diskontinuierliche Single-Elektroden-Spannungsklemme (dSEVC-Modus)11bezeichnet. Der hohe Widerstand (kleine Öffnung) der Elektrode behindert den Diffusionsaustausch zwischen der Zelle und den Pipettenlösungen, was zu einer minimalen Störung des intrazellulären Milieus3führt. Ein möglicher Nachteil dieser Technik ist, dass das Einsetzen von Elektroden einen nicht selektiven Leckstrom erzeugen kann; Daher ist darauf zu achten, dass die Aufzeichnung von Zellen vermieden wird, bei denen die Größe des Leckstroms die vorgesehenen Messungen4,12beeinträchtigen kann.
Dabei verwenden wir isolierte Krebsaugenstiele, um die Desensibilisierung und Wiederherstellung der lichtaktivierten Ionenleitfähigkeit zu bewerten, indem wir intrazelluläre elektrische Aufnahmen von Photorezeptorzellen unter Spannungsklemmenbedingungen durchführen.
Protokoll
HINWEIS: Die Experimente entsprechen den Tierschutzgesetzen Mexikos.
1. Versuchsaufbau
- Allgemeine Verbindungen
- Schließen Sie den Verstärker über einen Analog-Digital-Wandler an einen geeigneten Computer an und verwenden Sie ein Oszilloskop, um das Experiment zu überwachen (Abbildung 1).
- Verbinden Sie den Photostimulator mit dem konvertierten A/D.
- Aufnahmekammer
- Platzieren Sie die Aufnahmekammer auf einen Anti-Vibrations-Tisch und lokalisieren Sie sie in einem Faraday-Käfig.
HINWEIS: Dies verhindert mechanische Vibrationen und elektrische Geräusche, die die Aufzeichnung beeinträchtigen können. Unser Faraday Käfig bestand aus abgedunkelten Drahtgittern. Es wird eine hausgemachte, 2 ml Acrylaufnahmekammer verwendet (Abbildung 2). - Bereiten Sie die Badlösung vor, um das Präparat am Leben zu halten13: 205 mM NaCl; 5 mM KCl; 2 mM MgSO4; 13 mM CaCl2; 5 mM Hepes-NaOH, pH 7.3.
HINWEIS: Die Lösung umfasst keine Dextrose oder ein Sprudeln um 95% O2, 5%CO2-Mischung, da das experimentelle Verfahren kurz genug ist, um Schäden durch die elektrische Aufzeichnung zu erkennen (siehe Schritt 4.2.3 für Vollständigkeit).
- Platzieren Sie die Aufnahmekammer auf einen Anti-Vibrations-Tisch und lokalisieren Sie sie in einem Faraday-Käfig.
- Elektroden
- Verwenden Sie eine chloridbeschichtete Silberdrahtelektrode als Referenzelektrode
ANMERKUNG: Silberchlorid-Beschichtung ist notwendig, um die Elektrodenreaktion zu ermöglichen: AgCl(s) + e-↔ Ag(s) + Cl-. - Sand einen silbernen Draht (Dicke 1 mm, Länge 10 cm) mit einem feinen Grad Schmiralpapier, um seine Oberfläche zu reinigen.
- Spülen Sie den Silberdraht mit destilliertem Wasser.
- Tauchen Sie den sauberen Silberdraht in eine 4-6% Natriumhypochloritlösung (NaClO) ein, bis er dunkel erscheint (ca. 20 min).
- Verwenden Sie dünne Glaspipetten, die mit einer Elektrolytlösung (2,7 M KCl) als intrazelluläre Elektrode gefüllt sind.
- Ziehen Sie ein Glaskapillarrohr (Innendurchmesser 1 mm) mit einem Mikropipettenzieher, um eine dünne Spitze mit einer kleinen Öffnung (0,01-0,1 m) zu erhalten14.
- Füllen Sie das gezogene Kapillarglas mit einer 2,7 M KCl-Lösung. Zuerst mit Kapillarität füllen (die Pipettenspitze in die 2,7 M KCl-Lösung eintauchen) und dann die Hälfte der Pipette mit einer feinen Injektionsnadel füllen. Tippen Sie bei Bedarf auf die Elektrodenpipette, um Luftblasen zu beseitigen.
- Schließen Sie die Elektrode an ihren Halter an. Schließen Sie den Halter mit dem Verstärker an die Verstärkerkopfbühne an. Positionieren Sie die Elektrodenhalter-Kopfbühne mit einem stabilen 3D-Mikromanipulator. Senken Sie die Elektrode, bis die Badlösung ihre Spitze bedeckt.
ANMERKUNG: Die Elektrode muss eine vertikale Ausrichtung haben
- Verwenden Sie eine chloridbeschichtete Silberdrahtelektrode als Referenzelektrode
- Wählen Sie den Brückenmodus des Verstärkers (im Modusbereich des Verstärkers, drücken Sie die Bridge-Taste) und messen Sie den Elektrodenwiderstand. Stellen Sie sicher, dass der Widerstand ca. 50 M x11beträgt.
HINWEIS: Diese Elektrodengröße ermöglicht eine hochwertige elektrische Aufzeichnung mit begrenzten Schäden an der Zelle. - Null den Offsetstrom und kompensieren kapazitive Transienten mit der Halteposition-Taste im Abschnitt Spannungsklemme des Verstärkers und der Capacitance Neutralization-Taste in Microelectrode 1 Abschnitt des Verstärkers.
- Superfusionssystem
- Gießen Sie die Badlösung (Schritt 1.2.2) in einen geeigneten Behälter (eine 250 ml Serumflasche) und schließen Sie sie an ein Bewässerungsrohrset (3,2 mm Innendurchmesser) an, wodurch die Aufnahmekammer angeschlossen wird. Verwenden Sie ein schwerkraftgetriebenes Superfusionssystem. Regulieren Sie den Durchfluss auf 0,5 ml/s.
- Schließen Sie die Kammer an eine Saugvorrichtung an. Regulieren Sie das Lösungssaugsystem so, dass das Gesamtvolumen der Aufnahmekammer nicht variiert. Verwenden Sie eine Vakuumpumpe zum Absaugen.
HINWEIS: Ein konstantes Volumen in der Aufnahmekammer ist wichtig, um streunende Kapazitanzen während des gesamten Experiments konstant zu halten.
2. Biologisches Material
Hinweis: Verwenden Sie erwachsene Krebse P. clarkii (7-10 cm lang) im Intermolt-Stadium des undeutlichen Geschlechts.
- Circadian Zeit
- Einen Monat vor den Experimenten 100 Krebse unter einem 12-h-Licht-/12-h-Dunkelzyklus15 (weißes Licht, 2,4 kW/m2)aufbewahren.
HINWEIS: Ein Monat ist ausreichend Zeit, um die Krebspopulation zu synchronisieren. - Bestimmen Sie die zirkadiane Zeit der Krebspopulation, indem Sie die Amplitude von Elektroretinogrammen von fünf zufällig ausgewählten Tieren15bewerten.
ANMERKUNG: 0 h zirkadiane Zeit (CT 0) gibt den Beginn eines subjektiven Tages an, d.h.die Zeit, in der ein Organismus normalerweise aktiv ist16,17,18,19 ( Abbildung3). Der Krebs ist ein nachtaktives Tier, so dass er unter einem 12-h-Licht-/12-h-Dunkelzyklus während der dunklen Phase aktiv ist.
- Einen Monat vor den Experimenten 100 Krebse unter einem 12-h-Licht-/12-h-Dunkelzyklus15 (weißes Licht, 2,4 kW/m2)aufbewahren.
- Eyestalk Isolationsverfahren
- Zur gewünschten zirkadianen Zeit eine ausgewählte Krebse durch Eintauchen in Leitungswasser bei 0-4 °C, für 15 min ansiedeln.
- Mit einer feinen Schere den Augenstiel von der Basis lösen.
- Greifen Sie mit einer Rasierklinge auf die Netzhaut zu, um eine Öffnung (ca. 1 mm2) in der dorsalen Hornhaut zu machen.
- Platzieren Sie den Augentalk in der Mitte der Aufnahmekammer (das Loch mit Silikon bedeckt) mit der Zugangsöffnung zur Netzhaut auf der Oberseite der Kammer.
- Halten Sie die Augensprechen in ständiger Dunkelheit für 20 min.
HINWEIS: 20 min ist ausreichend Zeit, um die Photorezeptorzelle vollständig dunkel anzupassen.
3. Photorezeptor Impaling
- Setzen Sie die Mikroelektrode und die Längsachse des Eyestalks so parallel, dass die Mikroelektrode für den Zugang zur Netzhaut zentriert ist. Verwenden Sie ein stereoskopisches Mikroskop (10X), um die Geräte in der richtigen Konfiguration zu platzieren.
- Überwachen Sie den Spannungsunterschied zwischen der Referenz- und der Aufnahmeelektroden, indem Sie den Bridge Mode11 des Verstärkers auswählen.
- Senken Sie die Elektrode in das Bad und legen Sie sie danach direkt über die Netzhaut.
- Bewegen Sie das Mikroskop weg und positionieren Sie die Fototimulatorlampe parallel zur Längsachse des Eyestalk.
HINWEIS: Der Abstand zwischen Lampe und Superfusionskammer beträgt ca. 15 cm. - Senken Sie die Mikroelektrode langsam, bis ein plötzlicher Spannungsabfall erkannt wird.
HINWEIS: Ein Spannungsabfall von ca. 50 mV zeigt die Präsementung einer gesunden Photorezeptorzelle an. - Liefern Sie einen Testlichtblitz (weißes Licht, 7,2 kW/m2, 10 s Dauer), um das Rezeptorpotenzial des Photorezeptors aufzuzeichnen.
HINWEIS: Das Rezeptorpotenzial des Photorezeptors ist ein depolarisierendes Potential von 10-15 mV Amplitude und 300 ms Dauer (Abbildung 4).
4. Elektrische Aufzeichnung
- Stellen Sie sicher, dass die Photorezeptorzellen vollständig an dunkle Bedingungen angepasst sind (siehe Schritt 2.3).
- Liefern Sie alle 2 min einen Testlichtblitz. Automatisieren Sie die Zeit zwischen den Blitzen, indem Sie einen angemessenen Wert (120 s) der "Zeit zwischen den Episoden" in der Datenerfassungssoftware auswählen.
HINWEIS: 2 min ist die notwendige Zeit, um die vollständige Wiederherstellung der Ströme zu ermöglichen, die der elektrischen Reaktion des Photorezeptors zugrunde liegen. - Überwachen Sie das ruhende Membranpotential sowie die Amplitude und Dauer des Rezeptorpotentials. Angenommen, der Photorezeptor ist vollständig angepasst, sobald das Membranpotenzial, die Amplitude und die Dauer des Rezeptorpotentials unverändert bleiben. Eyestalks, die zuvor 20 min lang unter ständiger Dunkelheit gehalten wurden (Schritt 2.3), runden ihre Anpassung in ca. 5 min ab.
- Stoppen Sie die Stimulierung der Zelle 2 min vor der Aufnahme des lichtentlösten Stroms.
- Liefern Sie alle 2 min einen Testlichtblitz. Automatisieren Sie die Zeit zwischen den Blitzen, indem Sie einen angemessenen Wert (120 s) der "Zeit zwischen den Episoden" in der Datenerfassungssoftware auswählen.
- Aktuelle Aufzeichnung
- Klemmen Sie die Spannung am gemessenen Ruhenmembranpotentialwert der Zelle, indem Sie in der Datenerfassungssoftware (in Wellenform auf dem Abschnitt Analoger Ausgangskanal) "Amplitude halten" auswählen.
- Wählen Sie den dSEVC-Modus des Verstärkers aus. Wählen Sie im Modusbereich des Verstärkers die SEVC-Taste aus und schalten Sie den Hebel in die Position Discont SEVC.
- Stellen Sie die Schaltrate auf 500-1.000 Hz (mit Hilfe der Rate Adjust-Taste des Verstärkers), wie durch die Geschwindigkeit der Elektrode11bestimmt.
- Liefern Sie einen Lichtblitz, und beobachten Sie den evozierten Ionenzustrom.
ANMERKUNG: Dies ist der lichtentlockte oder transduktionsstrom (Abbildung 5). - Kehren Sie in den Bridge-Modus am Verstärker zurück und zeichnen Sie ein Rezeptorpotential auf, indem Sie einen Lichtblitz senden (siehe Abschnitt 3). Stellen Sie sicher, dass die Photorezeptorzelle vollständig an dunkle Bedingungen angepasst ist. Messen Sie die Eigenschaften des Rezeptorpotentials (Amplitude und Dauer) und vergleichen Sie sie mit den ersten Messungen. Angenommen, die aufgespießte Photorezeptorzelle ist eine gesunde Zelle, wenn sie die gleichen Eigenschaften hat.
HINWEIS: Nach der Augentalk-Ablation ist die biologische Zubereitung während der folgenden 2 h lebensfähig.
- Zwei Pulsprotokoll: Messen Sie die Erholung von der Desensibilisierung mit einem Zwei-Licht-Blitz-Protokoll.
HINWEIS: Das zwei Lichtblitz-Protokoll ähnelt dem Standard-Zweipuls-Spannungsprotokoll, das zur Messung der Wiederherstellung von Inaktivierung von spannungsgebundenen Kanälen20verwendet wird. Der erste Lichtblitz bewirkt eine vorübergehende Änderung der Empfindlichkeit der Photorezeptorzelle und der zweite Blitz wertet den Zustand der lichtaktivierten Leitfähigkeit aus.- Liefern Sie ein Paar Lichtimpulse. Tragen Sie den zweiten Blitz nach einem gewünschten Zeitintervall (von 300 ms bis 2 min) auf.
- Digitalisieren Sie die Ströme bei 10 KHz Sampling mit der Datenerfassungssoftware und speichern Sie die Daten für die Off-Line-Analyse11.
HINWEIS: Eine Tabelle mit den Konfigurationswerten der Software ist als Zusatzmaterial enthalten.
5. Datenanalyse
- Kinetik des lichtentelicitten Stroms
- Messen Sie drei aktuelle Parameter: Aktivierungslatenz L, die Zeit, die von der Lichtblitzlieferung verstrichen ist, bis der Strom 10 % seiner maximalen Amplitude erreicht (Abbildung 5); Spitzen- oder Maximalstromamplitude Ip; und Desensibilisierungszeitkonstante T. Messen Sie die Desensibilisierungszeitkonstante () durch Anpassung der aktuellen Zerfallsphase an:
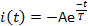
wobei A = -I(t=0) eine positive Konstante ist (Abbildung 5).
- Messen Sie drei aktuelle Parameter: Aktivierungslatenz L, die Zeit, die von der Lichtblitzlieferung verstrichen ist, bis der Strom 10 % seiner maximalen Amplitude erreicht (Abbildung 5); Spitzen- oder Maximalstromamplitude Ip; und Desensibilisierungszeitkonstante T. Messen Sie die Desensibilisierungszeitkonstante () durch Anpassung der aktuellen Zerfallsphase an:
- Desensitisierung und Erholung
Anmerkung: Die Wiederherstellung aus der Desensibilisierung wurde als Verhältnis p2/p1bewertet, wobei p1 der relevante Parameter (entweder L, Ipoder T) des Steuerstroms und p2 der entsprechende Parameter des zweiten Teststroms ist.- Plot p2/p1 (entweder L, Ipoder T) als Funktion der Zeit zwischen den Impulsen.
- Passen Sie die Punkte jedes Diagramms je nach Parameter an:
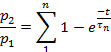
oder an: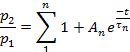
- Verwenden Sie einen geeigneten statistischen Test, um die Anzahl der exponentiellen Begriffe zu bestimmen, die erforderlich sind, um die experimentellen Daten anzupassen.
Ergebnisse
Zunächst wird ein repräsentatives Rezeptorpotential von Krebsphotorezeptorzellen erhalten (Abbildung 4). Anschließend wurde ein Testlichtblitz angewendet, um den Lichttransduktionsstrom auszulösen (Abbildung 5). Der kationische Transduktionsstrom1 aktiviert sich nach einer Verzögerung, erreicht ein Maximum und fällt danach langsam in einen absorbierenden desensinationen Zustand, aus dem er sich langs...
Diskussion
Die Krebse haben sich als ausgezeichnetes Modell erwiesen, da sie unter nicht-natürlichen Bedingungen überleben können. Es gibt einen einfachen Zugang zu elektrophysiologischen In-vivo- und In-vitro-Analysen. Darüber hinaus sind Krebstiere eine günstige Gruppe für neurobiologische Forschung auf dem Gebiet der vergleichenden Chronobiologie21.
In diesem Beitrag wird die Untersuchung der Desensibilisierung und Wiederherstellung des lichtaktivierten ...
Offenlegungen
Wir haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch dGAPA-UNAM IN224616-RN224616-Zuschuss unterstützt. Die Autoren danken Frau Josefina Bolado, Leiterin der Abteilung für wissenschaftliche Übersetzung von Papieren, aus divisién de Investigacion in facultad de Medicina, UNAM, für die Bearbeitung der englischsprachigen Version dieses Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| Axoclamp2A | Axon Instruments Inc | Amplifier | |
| Digidata 1200 Interface | Axon Instruments Inc | Digitizer | |
| Oscilloscope TDS430A | Tektronix | Analogic Oscilloscope | |
| Photostimulator PS33 Plus | Grass | Lamp | |
| Puller PC-100 | Narishige | Micropipette Puller | |
| Puller P-97 | Sutter Instruments | Micropipette Puller | |
| Glass Capillary Tube Kimax-51 | Kimble Products | 34502 | 0.8, 1.10, 100 mm |
| HS-2 Headstage | Axon Instruments Inc | Headstage | |
| Micromanipulator MX-4 | Narishige | Mechanical Micromanipulator | |
| Stereoscopic Microscope | Zeiss | Microscope | |
| pClamp | Axon Instruments Inc | Data acquisition software for digidata 1200 interface | |
| Clampfit | Axon Instruments, Inc | Analysis software linked to pClamp | |
| Origin | OriginLab Corp. | Data analysis and graphing software | |
| Sodium Chloride | Sigma | S7653 | >99.5% |
| Potassium Chloride | Sigma | P-9333 | Minimum 99% |
| Magnesium Sulfate | Sigma | M7506 | Minimum 99.5% |
| Calcium Chloride | Sigma | C5080 | Minimum 99.0% |
| Hepes | Sigma | H7523 | >99.5% |
| Sodium Hydroxide | Sigma | S8045 | 98.00% |
| Sodium hypochlorite solution | Sigma | 425044 | Available chlorine, 10-15% |
Referenzen
- Barriga-Montoya, C., Gómez-Lagunas, F., Fuentes-Pardo, B. Effect of pigment dispersing hormone on the electrical activity of crayfish visual photoreceptors during the 24-h cycle. Comp. Biochem. Physiol. A Comp. Physiol. 157 (4), 338-345 (2010).
- Barriga-Montoya, C., de la O-Martínez, A., Fuentes-Pardo, B., Gómez-Lagunas, F. Desensitization and recovery of crayfish photoreceptors. Dependency on circadian time, and pigment-dispersing hormone. Comp. Biochem. Physiol. A Comp. Physiol. 203, 297-303 (2017).
- Wickenden, A. D. Overview of electrophysiological techniques. Curr. protoc. pharmacol. 11, 1-17 (2014).
- Brette, R., Destexhe, A. Intracellular recording. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Cummins, D., Goldsmith, T. H. Cellular identification of the violet receptor in the crayfish eye. J. Comp. Physiol. 142 (2), 199-202 (1981).
- Eguchi, E. Rhabdom structure and receptor potentials in single crayfish retinular cells. J. Cell and Comp. Physiol. 66, 411-430 (1965).
- Nosaki, H. Electrophysiological study of color encoding in the compound eye of crayfish, Procambarus clarkii. Z. vergl. Physiologie. 64 (3), 318-323 (1969).
- Miller, C. S., Glantz, R. M. Visual adaptation modulates a potassium conductance in retinular cells of the crayfish. Vis Neurosci. 17 (3), 353-368 (2000).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods Enzymol. 525, 59-79 (2013).
- Finkel, A. Axoclamp-2A microelectrode clamp theory and operation. Axon Instruments, Inc. , (1990).
- Sakmann, B. . Single-channel recording. , (2013).
- Van Harreveld, A. A physiological solution for freshwater crustacea. Proc. Soc. Exp. Biol. Med. 34 (4), 428-432 (1936).
- Oesterle, A. . pipette cookbook. , 97 (2008).
- Fuentes-Pardo, B., Ramos-Carvajal, J. The phase response curve of electroretinographic circadian rhythm of crayfish. Comp. Biochem. Physiol. A Comp. Physiol. 74 (3), 711-714 (1983).
- Pace-Schott, E. F., Hobson, J. A. The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat. Rev. Neurosci. 3 (8), 591-605 (2002).
- Pittendrigh, C. S., Aschoff, J. On the mechanism of the entrainment of a circadian rhythm by light cycles. Circadian Clocks. , 277-297 (1965).
- Pittendrigh, C. S., Aschoff, J. Circadian systems: entrainment. Handbook Behavioral Neurobiology Biological Rhythms. , 94-124 (1981).
- Vitaterna, M. H., Takahashi, J. S., Turek, F. W. Overview of circadian rhythms. Alcohol Res. Health. 25 (2), 85-93 (2001).
- Hille, B. . Ion channels of excitable membranes. 507, (2001).
- Dircksen, H., Strauss, J. Circadian clocks in crustaceans: identified neuronal and cellular systems. Front Biosci. 15, 1040-1074 (2010).
- Terakita, A., Hariyama, T., Tsukahara, Y., Katsukura, Y., Tashiro, H. Interaction of GTP-binding protein Gq with photoactivated rhodopsin in the photoreceptor membranes of crayfish. FEBS Lett. 330, 197-200 (1993).
- Terakita, A., Takahama, H., Hariyama, T., Suzuki, T., Tsukahara, Y. Light regulated localization of the beta-subunit of Gq-type G-protein in the crayfish photoreceptors. J Comp Physiol A. 183 (4), 411-417 (1998).
- Terakita, A., Takahama, H., Tamotsu, S., Suzuki, T., Hariyama, T., Tsukahara, Y. Light-modulated subcellular localization of the alpha-subunit of GTP-binding protein Gq in crayfish photoreceptors. Vis Neurosci. 13 (3), 539-547 (1996).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten