Method Article
التفريق بين الخلايا الظهارية الصبغية الشبكية من الخلايا الجذعية Pluripotent المستحث أو الجنينية البشرية سريعة وموجهة
In This Article
Summary
ويصف هذا البروتوكول كيفية إنتاج الخلايا الظهارية الصبغية الشبكية (RPE) من الخلايا الجذعية pluripotent. يستخدم الأسلوب مزيج من عوامل النمو والجزيئات الصغيرة لتوجيه تمايز الخلايا الجذعية إلى RPE غير ناضجة في أربعة عشر يوما و RPE ناضجة، والوظيفية بعد ثلاثة أشهر.
Abstract
يصف لنا وسيلة قوية لتوجيه التفريق بين الخلايا الجذعية pluripotent في الشبكية الصباغ الخلايا الظهارية (RPE). هو الغرض من توفير بروتوكول مفصل ودقيق تبين بوضوح كل خطوة وجعل هذه متاحة للباحثين في المجال. ويؤدي هذا البروتوكول طبقة متجانسة من RPE مع تشريح ضئيلة أو لا دليل هناك حاجة. الطريقة المعروضة هنا قد ثبت أن تكون فعالة لفعل الخلايا الجذعية pluripotent (التوجيهية)، والخلايا الجذعية الجنينية البشرية. بالإضافة إلى ذلك، يصف لنا طرق لتجميد المصارف الوسيطة الخلية التي تسمح للتخزين على المدى الطويل. قد يكون من المفيد للجنة التوجيهية المرض في صحن النمذجة أو التطبيق السريري RPE التي تم إنشاؤها باستخدام هذا البروتوكول.
Introduction
ظهارة صباغ الشبكية هو أحادي الطبقة المصطبغة الخلايا التي توفر دعما حاسما فوتوريسيبتورس. الخلايا الظهارية الصبغية الشبكية (RPE) وظائف عديدة في الرؤية، بما في ذلك امتصاص الضوء، ونقل المواد الغذائية، وأيون، ريتينويد ركوب الدراجات، مستقبله الجزء الخارجي البلعمه، وعامل النمو إفراز1. وهناك مجموعة متنوعة من ضمور الشبكية التي تؤثر على وظيفة RPE ويؤدي إلى فقدان الرؤية، بما في ذلك المتعلقة بالعمر البقعي والتهاب الشبكية الصباغي. جيل RPE من الخلايا الجذعية pluripotent قد يسهل البحث لفهم هذه أمراض العيون، ويمكن أن توفر مصدرا غير محدود ل RPE ل العلاجات الخلية2. في الواقع، تستخدم عدة تجارب سريرية جارية RPE المستمدة من الخلايا الجذعية pluripotent3.
هذا البروتوكول التفريق أصلاً ووصف بوشهولز4 واستنادا إلى أسلوب تم نشرها مسبقاً من كليج5. يحاكي هذا الإجراء العادي في فيفو العملية التنموية لتوجيه الخلايا الجذعية pluripotent غير متمايزة صوب مصير RPE عن طريق التلاعب بعوامل النمو الأنسولين (الأنسولين)، عامل النمو تنتجها الخلايا الليفية الأساسية (صندوق الأجيال القادمة-2؛ فجفباسيك)، تحويل عامل النمو بيتا (TGF-β)، و WNT مسارات4،5. البروتوكول تحسنت إلى حد كبير بإضافة مؤثر مسار WNT المتأخرة في البروتوكول الذي أثمر 97.77% ± 0.1% قبل melanosome البروتين (PMEL) الخلايا إيجابية، وقد تكيفت مع ظروف خالية من كرة6،7. أظهرت RPE الناتجة للتعبير عن علامات RPE على الصعيدين نسخة والبروتين، تفرز عوامل نمو RPE المعروفة مع الأقطاب المناسبة، والقيام البلعمه لمستقبله شرائح الخارجي8. هذا البروتوكول أسرع وأكثر موثوقية من بروتوكولات "عفوية" التمايز التي تنطوي على إزالة عامل النمو تنتجها الخلايا الليفية الأساسية8بسيطة. وعلاوة على ذلك، أن تسلسل الحمض النووي الريبي وتظهر البيانات أن RPE الحصول عليها باستخدام هذا البروتوكول مشابهة جداً لتلك التي تم الحصول عليها باستخدام النهج العفوي أكثر شيوعاً8. ينشئ الأسلوب 14 يوما RPE التي تناسب "ف 5" ذكرها ماتزوني9 (المصطبغة، الاستقطاب، متجولة، بعد انتهاء الانقسامية، مضلع)9. في حين أن هذا الإجراء أثبت أن استنساخه في مختبرات متعددة، نود أن نعترف عدة أساليب المفاضلة موجهة إضافية التي تم نشرها في السنوات الأخيرة10،،من1112 , 13.
Protocol
1. "إعداد الكواشف" لليوم 0 إلى يوم 14 من البروتوكول
- إعداد المكونات المتوسطة التالية:
- جعل 100 مل من التمايز الشبكية المتوسطة (المبثوثة) بإضافة 1 مل من 100 x N2 الملحق، 2 مل من 50 الملحق x B27، و 1 مل من 100 × الأحماض الأمينية غير الأساسية (نيا) لمل 96 من دولبيكو ' s تعديل خليط المتوسطة/المغذيات الأساسية 9 F12 (DMEM/F12).
- جعل 10 مل من 1 م نيكوتيناميد (NIC) بحل ز 1.221 من NIC في 8 مل من الماء المعقم وفورتيكسينج، ويصل الحجم إلى 10 مل بالماء المعقم. تصفية العقيمة الحل.
- تعد بالتالي عوامل النمو والجزيئات الصغيرة:
- إعادة رأس الماوس المؤتلف، ديككوبف البشرية WNT مما يشير إلى مسار المانع 1 (DKK-1)، ومنتدى إدارة الإنترنت-1 إلى 100 ميكروغرام/مل كل في ألبومين المصل البقري 0.1% (BSA) في حل مخزنة الفوسفات (PBS). مخزن في-20 درجة مئوية لمدة تصل إلى 3 أشهر وقاسمه حسب الحاجة.
- إعادة تشكيل صندوق الأجيال القادمة-أساسية إلى 10 ميكروغرام/مل والمؤتلف الإنسان/الماوس/فأر A أضافت إلى 100 ميكروغرام/مل كل في جيش صرب البوسنة 0.1% في برنامج تلفزيوني. مخزن في-80 درجة مئوية لمدة تصل إلى سنة واحدة وقاسمه حسب الحاجة.
- 5402 سو إعادة تشكيل (صندوق الأجيال القادمة الخاصة بمستقبلات التيروزين كيناز المانع) و CHIR99021 (الجليكوجين synthase كيناز 3، GSK-3β، مثبط) إلى 10 ملم في ثنائي ميثيل سلفوكسيد ([دمس]). قاسمة ومخزن في-20 درجة مئوية لتصل إلى سنة واحدة أو لمدة 6 أشهر، على التوالي.
- الحصول على ما يلي اليوم 0 و/أو يوم x ethylenediaminetetraacetic 14:1 حمض (يدتا) الحل (0.2 ز يدتا الواحدة 1 لتر من برنامج تلفزيوني)، برنامج تلفزيوني X 1-/-إنزيم الانفصال مثل التربسين (برنامج تلفزيوني دون الكالسيوم أو المغنيسيوم، ودرجة الحموضة 7.4)، س 1 (TDE)، دببس (دولبيكو ' s برنامج تلفزيوني)، RPE دعم المتوسطة (RSM)، و Y-27632 هيدروكلوريد (استخدم في 10 ميكرون).
2. : 0 يوم Pluripotent الخلايا الجذعية المرور للتمايز
- تنمو مستعمرات الخلايا الجذعية في ظروف خالية من علبة التغذية بالورق، وخالية من المصل إلى حوالي 80% في التقاء قبل باساجينج-
ملاحظة: انظر المناقشة للحصول على تفاصيل حول تحسين هذه الخطوة- - معطف صفيحة 12-جيدا مع المائية المستندة إلى المصفوفة خارج الخلية (اكمة) وفقا لتوصيات الشركة المصنعة. السماح بتعيين ح 1 في درجة حرارة الغرفة أو بين عشية وضحاها في 4 ° C.
- قاسمة حجم المبثوثة وبرنامج تلفزيوني-/-يلزم لليوم 0 والحارة في حمام مائي إلى 37 درجة مئوية قبل إضافة عوامل النمو. إحضار أدتا إلى درجة حرارة الغرفة.
- إضافة عوامل النمو اللازمة ليوم 0 المبثوثة دافئة مع 10 ملم NIC، 50 نانوغرام/مل رأس 10 نانوغرام/مل DKK-1، و 10 نانوغرام/مليلتر منتدى إدارة الإنترنت-1. من مخزون هو موضح في الخطوة 1، 2، إضافة 100 ميليلتر من NIC و 5 ميليلتر من رأس 1 ميليلتر DKK-1 ميليلتر 1 IGF-1 إلى 10 مل المبثوثة. اختيار
- لإزالة جميع المستعمرات المتمايزة استناداً إلى التشكل من الخلايا الجذعية التي سوف تكون باساجيد للتفرقة. استخدام تلميح بيبيت P10 يدوياً إزالة الخلايا المتمايزة.
ملاحظة: تشير الخلايا الليفية بين المستعمرات، فضلا عن خلايا معتمة داخل المستعمرات إلى خلايا متمايزة إزالة. انظر المناقشة للحصول على تفاصيل حول الخلايا المتمايزة. - ممر بئر واحدة للوحة 6-جيدا إلى 4 آبار لصفيحة 12-جيدا (1:4)-
ملاحظة: انظر المناقشة لمزيد من التفاصيل عن باساجينج الخلايا الجذعية في هذه المرحلة.- نضح المتوسطة الخلايا الجذعية من الخلايا الجذعية وغسل الآبار مرة واحدة مع 2 مل من برنامج تلفزيوني المعالجون مسبقاً--/---
- "برنامج تلفزيوني نضح"-/-وشطف جيدا ثلاث مرات مع 1 مل يدتا كل من لوحة 6-جيدا جيدا.
- برفق إمالة اللوحة ونضح يدتا. لا تحرض لوحة بأي طريقة لتجنب رفع الخلايا قبل الأوان-
- بعد الغسيل الثالث، أضف 1 مل يدتا واحتضان في درجة حرارة الغرفة في غطاء محرك السيارة لمدة 3-5 دقائق. عدم الإزعاج اللوحة خلال هذا الاحتضان.
- اعقلوها يدتا وإضافة 1 مل المبثوثة الواحدة علاوة على ذلك سوف يكون المصنف مع 0.5 مل متوسطة إضافية. على سبيل المثال، يغسل 1 جيدا من لوحة 6-جيدا مع 4.5 مل المبثوثة على لوحة على 4 آبار للوحة 12-جيدا-
- استخدام مكشطة خلية لفصل الخلايا بلطف. جمع كافة الخلايا في أنبوب مخروطي وتريتوراتي الخلايا في المبثوثة من بيبيتينج صعودا وهبوطاً 5 مرات. ننأى بكتل كبيرة من الخلايا، ولكن لا تريتوراتي لتعليق خلية مفردة. توزيع الخلايا بشكل متساو في بيبيت. إكمال هذه الخطوة بسرعة للحيلولة دون رياتاتشمينت إلى اللوحة-
- بذور الخلايا على لوحات 12-جيدا المغلفة بإدارة المحتوى في المؤسسة (1 مل تعليق الخلية الواحدة وكذلك)-
- إمالة لوحة ذهابا وإيابا لتوزيع الخلايا بالتساوي في جميع أنحاء الآبار. بلطف ضع في حاضنة ثقافة خلية على 37 درجة مئوية و 5% CO 2 حتى تغيير المتوسطة القادمة.
- ملاحظة في الوقت المحدد. متوسط التغير في نفس الوقت كل يوم.
3. يوم 1 إلى 14: "إضافة عوامل النمو"
- يوم 1: تغيير المتوسطة في جميع الآبار (1 مل كل بئر) استخدام المبثوثة مع تكوين عامل النمو لليوم 0 (راجع الخطوة رقم 2.4).
- يوم 2: تغيير متوسطة استخدام المبثوثة (1 مل كل بئر) مع 10 ملم NIC و 5 نانوغرام/مل صندوق الأجيال القادمة-أساسية، 10 نانوغرام/مل رأس، 10 نانوغرام/مل DKK-1 و 10 نانوغرام/مل منتدى إدارة الإنترنت-1. من مخزون هو موضح في الخطوة 1، 2، إضافة 100 ميليلتر NIC 5 ميليلتر من صندوق الأجيال القادمة-أساسية، 1 ميليلتر من رأس، 1 ميليلتر من DKK1 و 1 ميليلتر من IGF1 إلى 10 مل المبثوثة.
- يوم 4: تغيير متوسطة استخدام المبثوثة (1 مل كل بئر) مع 100 نانوغرام/مليلتر أضافت A و 10 نانوغرام/مل DKK-1 10 نانوغرام/مل منتدى إدارة الإنترنت-1. من مخزون هو موضح في الخطوة 1، 2، إضافة 10 ميليلتر أضافت A و 1 ميليلتر من DKK1 1 ميليلتر من IGF-1 إلى 10 مل المبثوثة.
ملاحظة: نلاحظ أن الخلايا متكدسة في هذه المرحلة- - يوم 6: تغيير متوسطة استخدام المبثوثة (1 مل كل بئر) مع 100 ألف أضافت نانوغرام/مليلتر و 10 ميكرون سو 5402. من مخزون هو موضح في الخطوة 1، 2، إضافة 10 ميليلتر أضافت أ و 10 ميليلتر من سو 5402 إلى 10 مل المبثوثة.
- أيام 8 و 10 و 12: تغيير متوسطة استخدام المبثوثة (1 مل كل بئر) مع 100 نانوغرام/مليلتر أضافت A و 10 ميكرون سو 5402 3 ميكرومتر CHIR99021. من مخزون هو موضح في الخطوة 1، 2، إضافة 10 ميليلتر أضافت A و 10 ميليلتر من 5402 سو 3 ميليلتر من CHIR99021 إلى 10 مل المبثوثة.
4. يوم إثراء لمرور 0 RPE
- معطف صفيحة 6-جيدا مع عامل النمو خفضت اكمة وفقا لتوصيات الشركة المصنعة. السماح بتعيين ح 1 في درجة حرارة الغرفة أو بين عشية وضحاها في 4 ° C.
- قاسمة حجم دببس اللازمة ومل 1 من المبثوثة في البئر لتخصيب اليورانيوم والدافئة في حمام مائي إلى 37 درجة إحضار جيم TDE لدرجة حرارة الغرفة والدافئة حجم اللازمة RSM وكاشف مضادات الميكروبات، و Y-27632 إلى 37 درجة مئوية. كاشف
- إضافة مضادات الميكروبات و Y-27632 الحصول على 0.5 x و 10 ميكرون التراكيب على التوالي إلى RSM. استخدام هذه الوسيلة في الأيام الأولى من 4-7 لتحسين مرفق.
- Aspirate المتوسطة المستهلك من جميع الآبار وإضافة 1 مل كل بئر المبثوثة المعالجون مسبقاً (لا عوامل النمو المطلوبة)-
- باستخدام مجهر تشريح، تشريح يدوياً وكشط بعيداً من كافة الخلايا غير RPE استخدام تلميح بيبيت P10.
ملاحظة: راجع المقطع نتائج تمثيلية للأمثلة. - بعد التشريح، نضح المبثوثة وكل خلية الحطام. أغسل مرتين مع 1 مل دببس حرارة قبل كل بئر-
- إضافة 0.5 مل TDE كل من صفيحة 12-جيدا جيدا واحتضان في 37 درجة مئوية للحد الأدنى 5 استخدام مكشطة خلية بلطف إزالة الخلايا من اللوحة. استخدام بيبيت P1000 بلطف تريتوراتي تعليق خلية/TDE من بيبيتينج صعودا ونزولاً من 3-4 مرات لإنشاء تعليق موحد.
- تمييع تعليق خلية/TDE 01:10 في RSM المعالجون مسبقاً، دون Y-27632. الطرد المركزي من تعليق خلية في 173 س ز لمدة 5 دقائق في درجة حرارة الغرفة-
- نضح المتوسطة من بيليه الخلايا وريسوسبيند الخلايا في RSM مع 10 ميكرون Y-27632 (1 مل كل بئر أثري)-
- سلالة الخلايا باستخدام مصفاة خلية شبكة نايلون مع 40 ميكرومتر المسام. حساب عدد الخلايا في وحدة محدد باستخدام هيموسيتوميتير وحساب تركيز الخلايا في حل المتوترة.
- خلايا البذور على عامل النمو خفضت لوحات المغلفة بإدارة المحتوى في المؤسسة في 1 × 10 5 خلايا/سم 2 في 4 مل RSM مع 10 ميكرون Y-27632.
- RSM استبدال 10 ميكرون Y-27632 ح 48 بعد خلية البذر والاستمرار في استبدال وسائل الإعلام كل 3-4 أيام (مثلاً الاثنين والخميس). عدم استبدال ميكرومتر 10 Y-27632 بعد 4-7 أيام-
- تسمح للخلايا أن تنضج لمدة 28 إلى 35 يوما في 37 درجة مئوية و 5% CO 2. مواصلة ليحل محل RSM كل 3-4 أيام (مثلاً الاثنين والخميس)-
5. نضج: ممر 1 و 2 من RPE
ملاحظة: يتم الإشارة إلى وحدات تخزين 1 جيدا من لوحة 6-جيدا أو قارورة T75 كما هو مبين بأقواس.
- بين أيام 28 إلى 35 من المرور 0، معطف (قارورة T75) لوحة 6-جيدا مع اكمة وفقا لتوصيات الشركة المصنعة.
- قاسمة حجم دببس و RSM اللازمة والحارة في حمام مائي إلى 37 درجة جيم جلب TDE لدرجة حرارة الغرفة.
- Aspirate قضى المتوسطة من الآبار والمياه والصرف الصحي كذلك مرتين مع 2 مل (10 مل) من قبل حرارة دببس-
ملاحظة: لا تستخدم 10 ميكرون Y-27632. - "دببس نضح" وإضافة 1 مل (5 مل) من TDE. وضع في حاضنة في 37 درجة مئوية و 5% CO 2 لمدة 5 دقائق. بعد الحضانة، يتم عرض الخلايا في مجهر مقلوب للتأكد من الخلايا على التعاقد، وفصل-
- برفق باستخدام مكشطة خلية حجم مناسب، إزالة الخلايا من أسفل البئر أو قارورة.
- استخدام تلميح P1000 (10 مل المصلية بيبيت) بلطف تريتوراتي تعليق خلية/TDE صعودا وهبوطاً 3-4 مرات لإنشاء تعليق موحد.
- يضعف الخلية تعليق 01:10 في RSM. حجز 2 مل (5 مل) من RSM أشطف جيدا/قارورة وإضافة إلى تعليق خلية المخفف.
ملاحظة: لا تسمح وقت التعرض إنزيم تتجاوز 25 دقيقة - الطرد المركزي من تعليق خلية في 173 س ز لمدة 5 دقائق في درجة حرارة الغرفة-
- نضح المتوسطة من بيليه الخلايا وريسوسبيند الخلايا الموجودة في 1 مل (5 مل) من RSM
- سلالة الخلايا باستخدام مصفاة خلية شبكة نايلون مع 40 ميكرومتر المسام. حساب عدد الخلايا في وحدة محدد باستخدام هيموسيتوميتير وحساب تركيز الخلايا في حل المتوترة.
- بذور الخلايا على لوحات المغلفة بأكمة 1 × 10 5 خلايا/سم 2 في 4 مل (15 مل) من RSM.
- تسمح للخلايا أن تنضج لمدة 30 يوما. الاستمرار في تغيير RSM كل 3-4 أيام-
- تكرار الإجراء أعلاه (الخطوة 5، 2-5، 11) في اليوم 30 مرور الخلايا من سن 1 إلى 2-
6. إنشاء مصرف للخلية المتوسطة: نعد للمرور يوم 2 3-5 RPE
ملاحظة: كريوبريسيرفي الخلايا في حين أنها هي سوبكونفلوينت (~ 50%)، واستعادت لا الصباغ.
- بناء على عدد الخلايا، حساب حجم المتوسطة للواسمات مع [دمس] 10% المطلوبة للخلايا بتركيز 3 × 10 6 خلايا/مل ريسوسبيند.
- اتبع الخطوات 5.2 إلى 5.8. ريسوسبيند بيليه خلية في المتوسط للواسمات مع [دمس] 10% إلى 3 × 10 6 خلايا/مل ونقل 1 مل تعليق خلية للقنينات المبردة 1.2 مل.
- وضع قنينات المبردة في حاوية تجميد مصممة لتبريد في-1 درجة مئوية/دقيقة ووضع في-80 درجة مئوية بين عشية وضحاها. نقل إلى النتروجين السائل للتخزين على المدى الطويل.
ملاحظة: هذه الخلايا يكون مرور 3 عند ذوبان الجليد. ثقافة الخلايا لمدة 30 يوما أكثر قبل التوصيف. بذور ممر RPE 3 في 1.5 × 10 5 لكل سم 2 عند ذوبان الجليد. 2 ، 4 ، 6 ، 7
النتائج
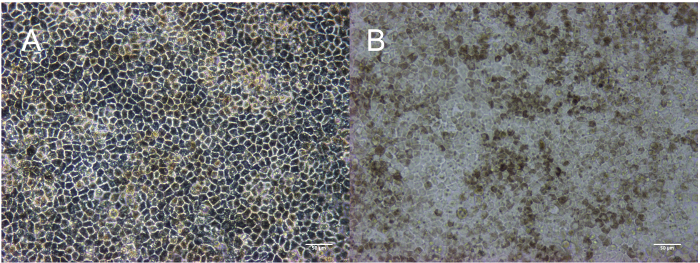
ويؤدي هذا الأسلوب إنتاج أحادي الطبقة متجانسة والمصطبغة، وكوبويدال من RPE. الجدول الزمني في الشكل 1 يناظر الصور هو مبين في الشكل 2. كما هو مبين في الشكل 2 أ، هي معبأة مستعمرات الخلايا الجذعية بأحكام مع حواف محددة وليس الخلايا الليفية بين المستعمرات أو خلايا معتمة داخل المستعمرات. ويقدم الشكل 2B تمثيل RPE غير الناضجة التي سوبكونفلوينت. إذا كانت الخلايا بالفعل المتلاقية في هذه المرحلة، أنها لا يمكن توسيع الإسقاطات ذات الأهمية الحاسمة لعملية المفاضلة. لن قادراً على إنشاء من أحادي الطبقة وتشكل تقاطعات ضيق، المميزة ظهارة الخلايا التي تكون شديدة سوبكونفلوينت. وترد تفاصيل بشأن كيفية تحسين هذا الملتقى في قسم مناقشة. يبين الشكل 2 مورفولوجية هذين النوعين الأكثر شيوعاً من غير RPE التي قد تنشأ خلال هذه العملية التمايز: بقع العصبية أو الليفية. من المهم أن نلاحظ أن هذه البقع العصبية تظهر معتمة لا سيما في مجهر تشريح، بينما البقع محددة، مثل الليفية تقريبا شفافة على مجهر تشريح. يمكن أن تكون مفيدة لوضع علامة هذه المناطق على طبق استنبات الأنسجة مع قلم مختبر واقية من الإيثانول التعرف عليها بسهولة أكبر على كل مركب مجهر الضوء ومجهر تشريح. تظهر الأرقام 2D-و حدود مميزة مشرقة ومورفولوجيا حصاة كبيرة، وتصبغ تشير إلى ثقافة صحية والنضج RPE. الرقم 3 صورة تكبير أعلى لإظهار مظهر مختلفة ناضجة تماما RPE يصور مرحلة التباين ومجهر الحقل مشرق. في مرور 3 أيام 30، الخلايا على استعداد لتوصيف الموضحة في المنشورات السابقة، بما في ذلك التعبير الجيش الملكي النيبالي والتعبير البروتين وإفراز عامل النمو والبلعمه2،4،6 ،7. وتظهر هذه الأوصاف أن الخلايا الممثلة في هذه الصور ليس فقط المصطبغة وكوبويدال، لكن أيضا متجولة وبعد الانقسامية والاستقطاب.
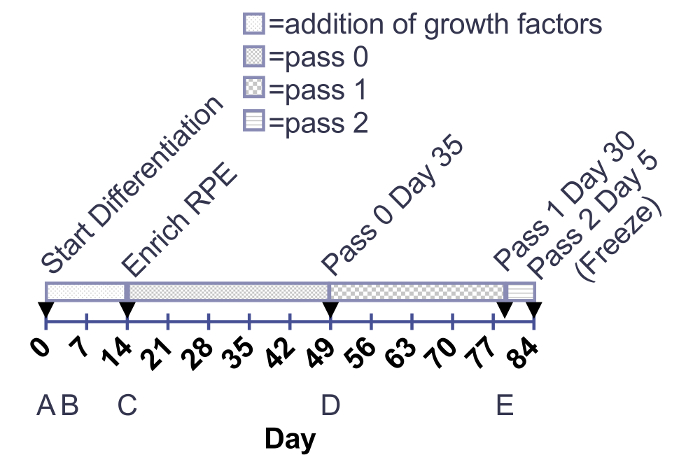
رقم 1:. المخطط الزمني لإضافة عوامل نمو ونضج RPE. تتم إضافة عوامل النمو إلى لوحات 12-جيدا من 0-14 يوم. إنضاج RPE تستزرع في لوحات 6-جيدا أو قوارير T75 من اليوم لتخصيب اليورانيوم إلى 30 يوما بعد ذوبان الجليد (مرور يوم 3 30). تشير الأسهم إلى الخلية الانزيمية باساجينج. (ألف-هاء) أدناه الحدود الزمنية التي تتوافق مع الصور في الشكل 2. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

رقم 2: مورفولوجيا الممثل والتقاء النضج RPE. الخلايا الجذعية المستحثة pluripotent مباشرة قبل باساجينج للتمايز (A). سوبكونفلوينت الخلايا RPE غير ناضجة في اليوم 2 (ب) وقبل اختيار لإزالة الإثراء في يوم 14؛ تظهر بقع غير RPE (المشار إليها بواسطة الأسهم البيضاء) كبقع أو معتمة "أشرطة" (ج). RPE على المرور 0 و 1 و 3 في يوم 30 (د، ه، وو). شريط المقياس = 200 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
الشكل 3: ناضجة RPE في مرور 3: 30 يوم مورفولوجيا cuboidal صورت في مرحلة التباين (A) وتصبغ صورت في مشرق الميدانية (ب). شريط المقياس = 50 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
ويصف هذا البروتوكول كيفية إنتاج الخلايا الظهارية الصبغية الشبكية من الخلايا الجذعية pluripotent. الأسلوب الأمثل باستخدام الخلايا الجذعية pluripotent محرض والجنينية البشرية كلا من أسلوب ثقافة خالية من علبة التغذية بالورق، وخالية من المصل. منذ عزل الأولية من الخلايا الجذعية الجنينية البشرية في عام 1998، واشتقاق الخلايا الجذعية المستحثة pluripotent (التوجيهية) في عام 2007، وضعت العديد من الخلايا الجذعية الثقافة أساليب منذ14،،من1516، 17. هذه الأساليب ينبغي أن تكون كافية لإنتاج مستعمرات الخلايا الجذعية التي عرضه لهذه التفرقة. لا توجد أي قيود معروفة بالانطباق هذا الأسلوب للخلايا الجذعية pluripotent المشتقة وصيانتها بشكل صحيح.
أن الخطوات الأكثر أهمية هي باساجينج الخلايا الجذعية إلى اليوم 0 من التمايز (الخطوة 2، 5) والحاجة المحتملة لتشريح اليدوي في 14 يوم من العملية (الخطوة 4، 5). عند اختيار لإزالة خلايا متمايزة من مستعمرات الخلايا الجذعية، الإشارة إلى الصور في كينت18. كما هو مبين، تشير إلى الخلايا الليفية بين المستعمرات والخلايا مبهمة ضمن مستعمرات الخلايا المتمايزة التي يجب إزالتها قبل بداية هذا البروتوكول18. وينبغي أن باساجيد فقط من المستعمرات غير متمايزة، ومحكم معبأة مع حواف محددة للتفريق.
عدد الخلايا الجذعية تبذر كل بئر (الخطوة 2.6.7) معقد بحقيقة أن الخلايا الجذعية لا تريتوراتيد في تعليق خلية مفردة عند مرور، ولا يمكن أن تحسب بدقة باستخدام هيموسيتوميتير. التقريب بين الخلايا الجذعية المتلاقية 80% يشار ل 1 باساجينج جيدا من لوحة 6-جيدا في آبار 4 من لوحة 12-جيدا. الاختلافات بين خطوط الخلايا الجذعية، مثل معدل النمو، يمكن أن تؤثر على مدى سرعة RPE غير ناضجة التوصل إلى التقاء بين 0 إلى 4 أيام. أن الخلايا الجذعية سوف تنتج RPE بغض النظر عن التقاء دقيقة، ولكن العائد خلية ستتأثر سلبا إذا كانت الخلايا ضئيلة جداً في هذه المرحلة. ينبغي أن تكون الخلايا RPE غير ناضجة حوالي 40-50% روافد في اليوم 1، وما يقرب من 100 ٪ روافد يوم 4. إذا كانت الخلايا لا تنتج من أحادي الطبقة المتلاقية يوم 4 أو 6، ينبغي تكرار البروتوكول في زيادة كثافة بذر في اليوم 0. على سبيل المثال، إذا كان باساجيد 1 جيدا من لوحة 6-جيدا إلى 4 آبار للوحة 12-جيدا في اليوم 0 و RPE غير ناضجة لا روافد 100% في يوم 4، تقليل البذر لفقرة 1:3 أو 1:2 في اليوم 0 أو السماح للخلايا الجذعية لتصبح أكثر المتلاقية قبل باساجينج. من الضروري إنشاء كثافة بذر متسقة عند مقارنة خطوط خلايا متعددة.
الخطوة تشريح اليدوي في يوم 14 ضروري فقط عندما تكون الخلايا غير RPE موجودة في الثقافة (الشكل 2). منذ إضافة CHIR99021 إلى البروتوكول، تتطلب العديد من خطوط الخلايا الجذعية pluripotent قليلاً التشريح إلى أي دليل. بعض الاستعدادات وقوع أعلى لبقع العصبية ومن الأهمية بمكان لإزالة تلك الخلايا. إذا RPE ليست قابلة للتطبيق على المرور 0 خلال مرور 3، فمن الممكن تكرار البروتوكول التمايز وقتاً كافياً لإزالة كافة الخلايا غير RPE. وهذا لا يحدث كثيرا، ولكن هو بالذكر هنا أن نلاحظ أن هذه الخطوة تسلخ في يوم 14 يمكن أن يكون الأمثل عند الحاجة.
وهناك مجموعة متنوعة من البروتوكولات التمايز RPE التي تختلف من حيث التكلفة، فضلا عن أساليب الثقافة والكفاءة والتقدير الكمي، والتقييم الوظيفي، هذه الأخيرة التي تم استعراض دقيق2. ونحن نفضل الطريقة 14 يوما بالتفصيل هنا بسبب فعاليتها، والقدرة على التكيف، وتطبيقها على مجموعة واسعة من الخلية خطوط4،،من78. الخطوة نعد في هذا البروتوكول يوفر أيضا ميزة كبيرة في إنشاء مصرف لخلية متوسطة لاستخدامها في المستقبل، تجنب تقلب الكثير بالكثير في التجارب. بدءاً من الآبار 4 فقط من لوحة 12-جيدا، فمن الممكن للتوسع في لوحات 6-جيدا في المرور 0 وقوارير T75 في المقطع 1 و 2. في مرور يوم 2 3-5، عندما تكون الخلايا لا تزال سوبكونفلوينت واستعادت لا الصباغ، فمن الممكن كريوبريسيرفي عشرات ملايين خلايا وثم ذوبان الجليد RPE ناضجة ومكان مخصص لمرور 3 يوم 30، لفحص الحمض النووي الريبي التعبير، التعبير البروتين، وعامل النمو إفراز، البلعمه، إلخ. وقد أنشأنا أيضا بروتوكولات لتوسيع نطاق RPE ل مقاطع من 13 إلى 19.
التطلع إلى الأمام، هذا الأسلوب سوف تكون مفيدة للجنة التوجيهية النمذجة لأمراض العين وتوليد RPE للعلاج. وفيما يتعلق باللجنة التوجيهية المرض النمذجة، هذا البروتوكول يستخدم حاليا في المختبر لإنتاج RPE من خطوط تصحيح كريسبر مع عناصر التحكم غير تصحيحه من المريض نفسه. وعلاوة على ذلك، هذا البروتوكول قابل للتكيف إلى ركائز الاصطناعية وظروف خالية من كرة مفيدة للالتزام بممارسات التصنيع الجيدة المطلوبة لعلاج خلوي.
Disclosures
الدكتور كليغ هو مؤسس المشارك للتجدد LLC تقنيات التصحيح.
Acknowledgements
يؤيد هذا العمل "مبادرة غارلاند" للرؤية، ومعهد كاليفورنيا للطب التجديدي (سيرم؛ منح DR1 01444، CL1-00521، TB1 01177، FA1-00616 و TG2 01151)، ومؤسسة المجتمع المحلي لولاية فيرمونت، مؤسسة Breaux، مؤسسة مكافحة العمى ين-جوند برنامج تسريع البحوث متعدية الجنسيات.
Materials
| Name | Company | Catalog Number | Comments |
| SterilGARD III laminar flow biosafety cabinet | Baker | model: SG603A-HE, type: A2, class: 2 | 6' Baker laminar flow biosafety cabinet |
| Dissection Hood | Labconco | Model 3970405 | laminar flow bench top |
| dissecting microscope | Nikon | SMZ 1500 | heated stage |
| air-jacketed CO2 incubator | Sanyo | MCO-17AIC | 37 oC and 5% CO2 |
| inverted phase contrast microscope | Olympus | IX53 | |
| Name | Company | Catalog Number | Comments |
| Media Components | |||
| DMEM/F12 | Gibco | 10565042 | |
| N2 Supplement | Gibco | 17502048 | |
| B27 Supplement | Gibco | 17504044 | |
| NEAA | Gibco | 11140050 | |
| Name | Company | Catalog Number | Comments |
| Growth Factors and Reagents | |||
| Nicotinamide | Sigma | N0636 | |
| Recombinant mouse noggin | R&D systems | 1967-NG-025 | |
| Recombinant human DKK-1 | R&D systems | 5439-DK-010 | |
| Recombinant IGF-1 | R&D systems | 291-G1-200 | |
| FGF-basic | Peprotech | 100-18B | |
| Recombinant human/mouse/rat Activin A | Peprotech | 120-14E | |
| SU5402 FGF inhibitor | Santa Cruz Biotechnology | sc-204308 | |
| Name | Company | Catalog Number | Comments |
| Substrates | |||
| Matrigel Basement Membrane Matrix, Phenol Red-Free, LDEV-Free | Corning | 356237 | extracellular matrix-based hydrogel (ECMH) |
| Matrigel hESC-Qualified Matrix, LDEV-Free | Corning | 354277 | growth factor reduced ECMH |
| Name | Company | Catalog Number | Comments |
| Other reagents | |||
| 1X Versene (EDTA) | Gibco | 15040066 | |
| DPBS | Gibco | 14190250 | |
| 1X PBS (no calcium, no magnesium) | Gibco | 10010023 | |
| TrypLE (trypsin-like dissociation enzyme, TDE) | Gibco | 12563011 | |
| X-VIVO 10 (RPE supporting medium) | Lonza | BW04-743Q | |
| Y-27632 | Tocris | 12-541-0 (1254) | |
| CryoStor CS10 | BioLife Solutions | 210102 | cryopreservation medium |
| 1.2 mL Cryogenic Vial | Corning | 430487 | |
| Mr. Frosty (freezing container) | Nalgene | 5100-0001 | freezing container |
| Normocin | Invivogen | ant-nr-2 | antimicrobial reagent |
| Name | Company | Catalog Number | Comments |
| Other Equipment | |||
| Pipet-aid | Drummond | 4-000-101 | |
| 12-well culture plate | Corning | CLS3516 | Used during differentiation. |
| T75 flask | Corning | 430641 | Used during RPE maturation. |
| 6-well culture plate | Corning | CLS3513 | Used during RPE maturation. |
| cell scraper | Corning | 08-771-1A | Used during passages. |
| cell strainer | Falcon | 352340 | Used during passages before cell count. |
References
- Strauss, O. The retinal pigment epithelium in visual function. Physiol. Rev. 85 (3), 845-881 (2005).
- Leach, L. L., Clegg, D. O. Concise Review: Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients With Ocular Disease. Stem Cells. 33 (8), 2363-2373 (2015).
- Pennington, B. O., Clegg, D. O. Pluripotent Stem Cell-Based Therapies in Combination with Substrate for the Treatment of Age-Related Macular Degeneration. J. Ocul. Pharmacol. Ther. 32 (5), 261-271 (2016).
- Buchholz, D. E., Pennington, B. O., Croze, R. H., Hinman, C. R., Coffey, P. J., Clegg, D. O. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium. Stem Cells Transl. Med. 2 (5), 384-393 (2013).
- Clegg, D. O., Buchholz, D., Hikita, S., Rowland, T., Hu, Q., Johnson, L. V. Retinal Pigment Epithelial Cells: Development In Vivo and Derivation from Human Embryonic Stem Cells In Vitro for Treatment of Age-Related Macular Degeneration. Stem Cell Res. Ther. (Chapter 1), 1-24 (2008).
- Leach, L. L., Buchholz, D. E., Nadar, V. P., Lowenstein, S. E., Clegg, D. O. Canonical/β-catenin Wnt pathway activation improves retinal pigmented epithelium derivation from human embryonic stem cells. Invest. Ophthalmol. Vis. Sci. 56 (2), 1002-1013 (2015).
- Pennington, B. O., Clegg, D. O., Melkoumian, Z. K., Hikita, S. T. Defined culture of human embryonic stem cells and xeno-free derivation of retinal pigmented epithelial cells on a novel, synthetic substrate. Stem Cells Transl. Med. 4 (2), 165-177 (2015).
- Leach, L. L., et al. Induced Pluripotent Stem Cell-Derived Retinal Pigmented Epithelium: A Comparative Study Between Cell Lines and Differentiation Methods. J. Ocul. Pharmacol. Ther. 32 (5), 317-330 (2016).
- Mazzoni, F., Safa, H., Finnemann, S. C. Understanding photoreceptor outer segment phagocytosis: use and utility of RPE cells in culture. Exp. Eye Res. 126, 51-60 (2014).
- Sonoda, S., Spee, C., Barron, E., Ryan, S. J., Kannan, R., Hinton, D. R. A protocol for the culture and differentiation of highly polarized human retinal pigment epithelial cells. Nat. Protoc. 4 (5), 662-673 (2009).
- Choudhary, P., et al. Directing Differentiation of Pluripotent Stem Cells Toward Retinal Pigment Epithelium Lineage. Stem Cells Transl. Med. 6 (2), 490-501 (2017).
- Maruotti, J., et al. Small-molecule-directed, efficient generation of retinal pigment epithelium from human pluripotent stem cells. Proc. Natl. Acad. Sci. U.S.A. 112 (35), 10950-10955 (2015).
- Lane, A., et al. Engineering efficient retinal pigment epithelium differentiation from human pluripotent stem cells. Stem Cells Transl. Med. 3 (11), 1295-1304 (2014).
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1147 (1998).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318 (5858), 1917-1920 (2007).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Amit, M., Itskovitz-Eldor, J. Derivation and spontaneous differentiation of human embryonic stem cells. J. Anat. 200 (Pt 3), 225-232 (2002).
- Kent, L. Culture and Maintenance of Human Embryonic Stem Cells. J. Vis. Exp. (34), e1427-e1427 (2009).
- Croze, R. H., et al. ROCK Inhibition Extends Passage of Pluripotent Stem Cell-Derived Retinal Pigmented Epithelium. Stem Cells Transl. Med. 3 (9), 1066-1078 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved