Method Article
Schnelle, gezielte Differenzierung der retinalen Pigment epithelialen Zellen aus menschlichen embryonalen oder induzierte pluripotente Stammzellen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die retinalen Pigment Epithelzellen (RPE) aus pluripotenten Stammzellen zu produzieren. Die Methode verwendet eine Kombination von Wachstumsfaktoren und kleine Moleküle, um die Differenzierung von Stammzellen in unreifen RPE in vierzehn Tagen und Reifen, funktionale RPE nach drei Monaten zu lenken.
Zusammenfassung
Wir beschreiben eine robuste Methode um die Differenzierung von pluripotenten Stammzellen in retinalen pigment Epithelzellen (RPE) zu lenken. Zum Zwecke der Erbringung eine detaillierte und gründliche Protokoll ist zu jedem Schritt zeigen und dies ohne weiteres Forscher auf dem Gebiet zur Verfügung. Dieses Protokoll führt zu einer homogenen Schicht von RPE mit minimal oder keine manuelle Präparation erforderlich. Die hier vorgestellte Methode hat gezeigt, dass effektiv für induzierte pluripotente Stammzellen (iPSC) und humane embryonale Stammzellen. Darüber hinaus beschreiben wir Methoden für die Kryokonservierung von intermediate Zellbanken, die langfristigen Lagerung zu ermöglichen. RPE erzeugt unter Verwendung dieses Protokolls möglicherweise nützlich für iPSC Krankheit im Gericht Modellierung oder klinische Anwendung.
Einleitung
Das retinale Pigmentepithel ist eine Monolage von pigmentierten Zellen, die Photorezeptoren entscheidend unterstützt. Retinalen Pigment Epithelzellen (RPE) haben zahlreiche Funktionen in Vision, einschließlich Lichtabsorption, Nährstoff- und Ionen-Transport, Radfahren, Retinoid Photorezeptor äußere Segment Phagozytose und Wachstum Faktor Sekretion1. Es gibt eine Vielzahl von retinalen Dystrophien, die Einfluss auf die Funktion des RPE und führen zu einem Verlust des Sehens, wie altersbedingte Makula-Degeneration und Retinitis Pigmentosa. Generation von RPE aus pluripotenten Stammzellen Forschung um diese Erkrankungen des Auges zu verstehen erleichtern kann und bieten eine unbegrenzte Quelle von RPE Zelle Therapien2. In der Tat nutzen mehrere klinische Studien im Gange RPE aus pluripotenten Stammzellen3abgeleitet.
Diese Differenzierung-Protokoll wurde ursprünglich von Buchholz4 beschrieben und stützte sich auf die bisher veröffentlichten Methode von Clegg5. Das Verfahren ahmt den normalen in Vivo Entwicklungsprozess direkten undifferenzierte pluripotente Stammzellen in Richtung einer RPE Schicksal durch Manipulation von Insulin Wachstumsfaktoren (IGF), grundlegende Fibroblasten-Wachstumsfaktor (FGF-2; FGF-basic), Umwandlung von Wachstumsfaktor-Beta (TGF-β) und WNT Wege4,5. Das Protokoll wurde deutlich durch Zugabe von einem WNT Signalweg Agonist spät in das Protokoll verbessert die ergab 97.77 % ± 0,1 % Pre-Melanosome Protein (PMEL) positive Zellen und Xeno-freien Bedingungen6,7adaptiert wurde. Die daraus resultierende RPE haben gezeigt, dass express RPE Marker der Abschrift und Ebene Protein sezernieren bekannten RPE Wachstumsfaktoren mit entsprechenden Polarität, und Phagozytose der Photorezeptor Außensegmenten8durchführen. Dieses Protokoll ist schneller und zuverlässiger als "spontane" Protokolle der Differenzierung, die einfache Entnahme von grundlegenden Fibroblasten-Wachstumsfaktor8betreffen. Darüber hinaus RNA-Sequenzierung, die Daten zeigen, dass RPE unter Verwendung dieses Protokolls sind sehr ähnlich denen, die mit der häufiger spontan Ansatz8. Die 14-Tage-Methode generiert RPE, die "5 P" von Mazzoni9 (pigmentierte, polarisierte, phagocytic, Post-mitotische, polygonale)9erwähnt passen. Während dieses Verfahren bewährt hat, in mehreren Labors reproduziert werden, wollen wir mehrere zusätzliche gezielte Differenzierung Methoden zu erkennen, die in den letzten Jahren10,11,12 veröffentlicht wurden , 13.
Protokoll
1. Vorbereitung der Reagenzien für Tag 0, Tag 14 des Protokolls
- die folgenden Mittelkomponenten vorbereiten:
- machen 100 mL der Netzhaut Differenzierung Medium (RDM) durch Zugabe von 1 mL 100 x N2 Ergänzung, 2 mL 50 x B27 Ergänzung und 1 mL 100 x nicht-essentielle Aminosäure (NEAA) auf 96 mL Dulbecco ' s geändert wesentliches Medium/Nährstoff-Mischung F12 9 (DMEM/F12).
- Machen 10 mL 1 M Nicotinamid (NIC) durch auflösende 1,221 g NIC in 8 mL sterilem Wasser, aufschütteln und die Lautstärke auf 10 mL mit sterilem Wasser zu bringen. Steril filter die Lösung.
- Bereiten die folgenden Wachstumsfaktoren und kleine Moleküle:
- stellen rekombinante Maus Birne, menschliche Dickkopf WNT Signalisierung Pathway Inhibitor 1 (DKK-1) und IGF-1 bis 100 µg/mL in 0,1 % Rinderserumalbumin (BSA) in Phosphat-gepufferte Lösung (PBS). Aliquot nach Bedarf und Store bei-20 ° C bis zu 3 Monaten.
- Rekonstruieren FGF-Basic 10 µg/mL und rekombinanten menschlichen/Maus/Ratte Activin A bis 100 µg/mL jeweils in 0,1 % BSA mit PBS-Puffer. Aliquot nach Bedarf und Store bei-80 ° C bis zu 1 Jahr.
- Rekonstruieren SU 5402 (FGF-Rezeptor-spezifische Tyrosin-Kinase-Hemmer) und CHIR99021 (Glykogen-Synthase Kinase 3, GSK-3β, Inhibitor) bis 10 mM in Dimethyl Sulfoxid (DMSO). Aliquoten und Store bei-20 ° C für bis zu 1 Jahr oder 6 Monate, bzw..
- Erhalten die folgenden Tag 0 und/oder Tag 14: 1 X ethylenediaminetetraacetic Säure (EDTA)-Lösung (0,2 g EDTA pro 1 L des PBS), 1 X PBS- / - (PBS ohne Calcium oder Magnesium, pH-Wert 7,4), 1 X Dissoziation Trypsin-ähnlichen Enzyms (TDE), DPBS (Dulbecco ' s PBS), RPE Unterstützung Medium (RSM) und Y-27632 Dihydrochloride (Einsatz bei 10 µM).
2. Tag 0: Tag der pluripotenten Stammzelle Passage zur Differenzierung
- wachsen Stammzellen Kolonien in den Feeder-frei, Serum Bedingungen bis ca. 80 % Zusammenfluss vor Passagierung.
Hinweis: Siehe Diskussion Einzelheiten über diesen Schritt optimieren. - Mantel eine 12-Well-Platte mit extrazellulären Matrix-basierte Hydrogel (ECMH) gemäß den Empfehlungen des Herstellers. Ermöglichen, für 1 h bei Raumtemperatur oder über Nacht bei 4 ° c
- Aliquot das Volumen der RDM und PBS- / - für Tag 0 und im Wasserbad auf 37 ° C warm vor dem Hinzufügen von Wachstumsfaktoren benötigt. EDTA auf Raumtemperatur bringen.
- Fügen die Wachstumsfaktoren für Tag 0 zu der erwärmten RDM mit 10 mM NIC, 50 ng/mL Birne, 10 ng/mL DKK-1 und 10 ng/mL IGF-1 erforderlich. Aus den Beständen in Schritt 1.2 beschrieben, fügen 100 µL NIC, 5 µl Birne, 1 µL DKK-1 und 1 µL von IGF-1 bis 10 mL des RDM.
- Wählen Sie entfernen alle differenziertere Kolonien anhand der Morphologie aus den Stammzellen, die zur Differenzierung passagiert werden wird. Verwenden Sie eine P10 Pipettieren Spitze, um die differenzierte Zellen manuell zu entfernen.
Hinweis: Handelt Zellen zwischen Kolonien sowie die undurchsichtigen Zellen innerhalb von Kolonien zeigen differenzierte Zellen entfernt werden. Siehe Diskussion Einzelheiten zu differenzierten Zellen. - Passage einen einzigen Brunnen von einem 6-Well-Platte in 4 Vertiefungen einer 12-Well-Platte (1:4).
Hinweis: Siehe Diskussion Einzelheiten über Passagierung Stammzellen in diesem Stadium.- Aspirieren der Stammzell-Medium aus den Stammzellen und Waschen der Brunnen einmal mit 2 mL vorgewärmten PBS- / -.
- Aspirieren PBS- /- und spülen jedes gut dreimal mit 1 mL EDTA pro Bohrloch einer 6-Well-Platte.
- Sanft die Platte kippen und aspirieren EDTA. Die Platte in irgendeiner Weise zu vermeiden, heben vorzeitig die Zellen nicht agitieren.
- Nach der dritten Wäsche, fügen Sie 1 mL EDTA und bei Raumtemperatur in der Haube für 3-5 min inkubieren. Stören Sie nicht die Platte während diese Inkubation.
- EDTA Aspirieren und 1 mL RDM pro Bohrloch, die ausgesät wird mit 0,5 mL extra Medium. Zum Beispiel Waschen 1 auch von einer 6-Well-Platte mit 4,5 mL RDM auf Platte 4 Bohrungen von einem 12-Well-Platte.
- Verwenden einen Zelle Schaber, um die Zellen sanft zu lösen. Sammeln Sie alle Zellen in einem konischen Rohr und genannte Zellen im RDM durch Pipettieren rauf und runter 5 Mal. Große Klumpen von Zellen zu trennen, aber nicht auf einzelne Zellsuspension genannte. Verteilen Sie die Zellen in das Pipettieren gleichmäßig. Führen Sie diesen Schritt schnell zur Wiederbefestigung der Platte zu verhindern.
- Samen Zellen auf den ECM-beschichtete 12-Well-Platten (1 mL Zellsuspension pro Bohrloch).
- Neigung die Platte hin und her, um die Zellen gleichmäßig in die Vertiefungen verteilen. Legen Sie vorsichtig bis zur nächsten mittlere Änderung in einer Zelle Kultur Inkubator bei 37 ° C und 5 % CO 2.
- Beachten Sie die genaue Zeit. Wechsel-Medium zur gleichen Zeit jeden Tag.
3. Tag 1 bis 14: Zugabe von Wachstumsfaktoren
- Tag1: das Medium auf alle Wells (1 mL pro Well) verändern die Zusammensetzung der Wachstumsfaktor für Tag 0 (siehe Punkt 2.4) RDM mit.
- Tag2: ändern Sie das Medium mit RDM (1 mL pro Well) mit 10 mM NIC, 5 ng/mL FGF-Basic 10 ng/mL Birne, 10 ng/mL DKK-1 und 10 ng/mL IGF-1. Aus den Beständen in Schritt 1.2 beschrieben, fügen 100 µL NIC, 5 µL von FGF-Basic 1 µL Birne, 1 µL DKK1 und 1 µL IGF1 bis 10 mL des RDM.
- Tag 4: Ändern des Mediums mit RDM (1 mL pro Well) mit 100 ng/mL Activin A, 10 ng/mL DKK-1 und 10 ng/mL IGF-1. Aus den Beständen in Schritt 1.2 beschrieben, fügen Sie 10 µL Activin A, 1 µL DKK1 und 1 µL von IGF-1 bis 10 mL des RDM.
Hinweis: Beachten Sie, dass Zellen in diesem Stadium konfluierende sind. - Tag 6: das Medium mit RDM (1 mL pro Well) mit 100 ng/mL Activin A und 10 µM SU 5402 verändern. Aus den Beständen in Schritt 1.2 beschrieben, fügen Sie 10 µL des Activin A und 10 µL SU 5402 bis 10 mL des RDM.
- Tage, 8, 10 und 12: Ändern des Mediums mit RDM (1 mL pro Well) mit 100 ng/mL Activin A, 10 µM SU 5402 und 3 µM CHIR99021. Aus den Beständen in Schritt 1.2 beschrieben, fügen Sie 10 µL Activin A, 10 µL SU 5402 und 3 µL CHIR99021 bis 10 mL des RDM.
4. Tag der Bereicherung Passage 0 des RPE
- Mantel ein 6-Well-Platte mit Wachstumsfaktor reduziert ECMH gemäß Empfehlungen des Herstellers. Ermöglichen, für 1 h bei Raumtemperatur oder über Nacht bei 4 ° c
- Aliquot das Volumen des DPBS benötigt und 1 mL der RDM pro Bohrloch der Bereicherung und Warm in einem Wasserbad auf 37 ° C. Bring die TDE Raumtemperatur und Warm erforderlichen Volumen von RSM, antimikrobielle Reagens und Y-27632 auf 37 ° c
- Add antimikrobielle Reagenz und Y-27632 Beschaffung von 0,5 x und 10 µM Kompositionen bzw. RSM. Nutzen Sie dieses Medium für die ersten 4 bis 7 Tage, Anlage zu verbessern.
- Absaugen verbrauchter Medium aus allen Brunnen und 1 mL pro Bohrloch des vorgewärmten RDM (keine Wachstumsfaktoren erforderlich).
- Manuell zu sezieren und Kratzen entfernt alle nicht-RPE-Zellen mit einer P10 Pipettieren Spitze sezierenden Mikroskop,.
Hinweis: Siehe Abschnitt repräsentative Ergebnisse für Beispiele. - Nach Dissektion, Aspirieren RDM und alle Zelle Rückstand. Waschen zweimal mit 1 mL vorgewärmten DPBS pro Bohrloch.
- 0,5 mL der TDE pro Bohrloch einer 12-Well-Platte und Inkubation bei 37 ° C für 5 min. Verwendung einer Zelle Spachtel zu entfernen vorsichtig die Zellen von der Platte. Verwenden Sie ein P1000 pipettieren, um sanft die Zelle/TDE Suspension genannte durch Pipettieren 3-4 Mal rauf und runter zu schaffen eine homogene Suspension.
- Verdünnen die Zelle/TDE Aussetzung 01:10 in vorgewärmten RSM, ohne Y-27632. Zellsuspension bei 173 X g für 5 min bei Raumtemperatur zentrifugiert.
- Aspirieren Sie das Medium aus der Zelle Pellet und Aufschwemmen der Zellen im RSM mit 10 µM Y-27632 (1 mL pro bereichert nun).
- Belasten die Zellen mit einem Nylon Mesh Zelle Sieb mit 40 µm-Poren. Die Anzahl der Zellen in einem bestimmten Volumen mit einem Hemocytometer und berechnen Sie die Konzentration der Zellen in der angespannten Lösung.
- Samenzellen auf den Wachstumsfaktor reduziert ECM-beschichteten Platten 1 x 10 5 Zellen/cm 2 in 4 mL RSM mit 10 µM Y-27632.
- Ersetzen die RSM mit 10 µM Y-27632 48 h nach der Aussaat Zelle und weiterhin Medien ersetzen alle 3-4 Tage (z.B. montags und donnerstags). Ersetzen nicht die 10 µM nach ca. 4-7 Tagen Y-27632.
- Können die Zellen 28 bis 35 Tage bei 37 ° C und 5 % CO 2 Reifen. Weiterhin die RSM ersetzen alle 3-4 Tage (z.B. montags und donnerstags).
5. Reifung: Durchgang 1 und 2 des RPE
Hinweis: Bände sind für 1 gut von einer 6-Well-Platte oder ein Fläschchen T75 angegeben, da durch die Klammern dargestellt.
- Zwischen 28 bis 35 Tagen Passage 0, Mantel eine 6-Well-Platte (T75 Kolben) mit ECMH gemäß den Herstellerempfehlungen.
- Aliquot das Volumen des DPBS und RSM benötigte und warm in einem Wasserbad auf 37 ° c bringen TDE Raumtemperatur.
- Aspirat verbrachte Medium aus Brunnen und Waschen auch zweimal mit 2 mL (10 mL) vorgewärmt DPBS.
Hinweis: Verwenden Sie nicht 10 µM Y-27632. - Aspirieren DPBS und 1 mL (5 mL) TDE. Legen Sie im Inkubator bei 37 ° C und 5 % CO 2 für 5 Minuten. Nach der Inkubation Ansicht Zellen auf einem inversen Mikroskop die Zellen bestätigen contracting und abnehmen.
- Mit einem entsprechend großen Zelle Schaber entfernen Sie vorsichtig die Zellen aus dem Boden des Brunnen oder Kolben.
- Einen P1000-Tipp (10 mL serologische Pipettieren) verwenden, um sanft die Zelle/TDE Aussetzung oben und unten genannte 3-4 Mal zu erstellen eine homogene Suspension.
- Verdünnen Zelle Aussetzung 01:10 in RSM. Reservieren Sie 2 mL (5 mL) von RSM spülen den Brunnen/Kolben und Hinzufügen der verdünnter Zellsuspension.
Hinweis: Lassen Sie nicht Enzym Belichtungszeit bis 25 min. überschreiten - Die Zellsuspension bei 173 X g für 5 min bei Raumtemperatur zentrifugieren.
- Aspirieren Sie das Medium aus der Zelle Pellet und Aufschwemmen der Zellen in 1 mL (5 mL) RSM
- Belasten die Zellen mit einem Nylon Mesh Zelle Sieb mit 40 µm-Poren. Die Anzahl der Zellen in einem bestimmten Volumen mit einem Hemocytometer und berechnen Sie die Konzentration der Zellen in der angespannten Lösung.
- Samen Zellen auf die ECMH-beschichtete Platten 1 x 10 5 Zellen/cm 2 in 4 mL (15 mL) von RSM.
- Können die Zellen, die 30 Tage durch Milchsäuregärung reifen. Weiterhin die RSM alle 3-4 Tage verändern.
- Wiederholen Sie das oben beschriebene Verfahren (Schritt 5.2-5.11) am Tag 30 bis die Zellen aus Abschnitt 1 bis 2 Durchgang.
6. Erstellen einer Intermediate Zellbank: Kryokonservierung von Passage 2 Tag 3-5 RPE
Hinweis: Ovarialgewebe Zellen, während sie subconfluent (~ 50 %) und Pigment nicht wiedererlangt haben.
- Basierend auf der Anzahl der Zellen, berechnen das Volumen der Kryokonservierung Medium mit 10 % DMSO notwendig, um die Zellen in einer Konzentration von 3 x 10 6 Zellen/mL Aufschwemmen.
- Folgen Sie den Schritten 5,2 bis 5,8. Aufschwemmen der Zelle Pellet in der Kryokonservierung Medium mit 10 % DMSO, 3 x 10 6 Zellen/mL und 1 mL Zellsuspension auf 1,2 mL kryogenen Fläschchen übertragen.
- Legen kryogene Fläschchen in einem eiskalten Container bei-1 ° C/min abkühlen und stellen Sie über Nacht bei-80 ° C ausgelegt. Transfer zum flüssigen Stickstoff für die Langzeitspeicherung.
Hinweis: Diese Zellen werden Passage 3 beim Auftauen. Kulturzellen Sie für 30 Tage vor der Charakterisierung. Samen passage 3 RPE 1,5 x 10 5 pro cm 2 beim Auftauen. 2 , 4 , 6 , 7
Ergebnisse
Diese Methode führt bei der Herstellung von einer homogenen, pigmentierte und quaderförmigen Monolage RPE. Die Zeitachse in Abbildung 1 entspricht den Bildern, die in Abbildung 2dargestellt. Wie in Abbildung 2Adargestellt, sind die Stammzellen Kolonien mit definierten Kanten und keine handelt Zellen zwischen den Kolonien oder undurchsichtige Zellen innerhalb von Kolonien dicht. Abbildung 2 b bietet eine Darstellung der unreifen RPE, die subconfluent sind. Wenn die Zellen in diesem Stadium bereits konfluierende sind, können nicht sie Projektionen erstrecken, die für den Differenzierungsprozess von entscheidender Bedeutung sind. Zellen, die stark subconfluent werden nicht in der Lage eine Monolage bilden enge Kreuzungen, charakteristisch für Epithel. Details zur Optimierung dieser Zusammenfluss werden in die Diskussion Abschnitt beschrieben. Abbildung 2 zeigt die Morphologie von die zwei häufigsten Arten von nicht-RPE, die während dieser Differenzierungsprozess auftreten: neuronale oder handelt Patches. Es ist wichtig zu beachten, dass diese neuronalen Patches auf dem sezierenden Mikroskop besonders undurchsichtig erscheinen, während die definierten, handelt wie Patches auf dem sezierenden Mikroskop fast durchscheinend sind. Es kann hilfreich sein, markieren Sie diese Bereiche auf einer Gewebekultur-Platte mit einem Ethanol-Beweis-Lab-Stift, sie leichter auf einem zusammengesetzten Lichtmikroskop und sezierenden Mikroskop zu identifizieren sein. Figuren-2D-F zeigen die charakteristischen hellen Grenzen, Kopfsteinpflaster Morphologie und Pigmentierung, die angeben, eine gesunde, reifende Kultur des RPE. Abbildung 3 ist eine höhere Vergrößerung Bild zu zeigen, das unterschiedliche Erscheinungsbild der vollreifen RPE von Phasenkontrast und Hellfeld Mikroskopieren dargestellt. In der Passage 3 Tag 30, die Zellen sind bereit für die Charakterisierung, die in früheren Publikationen, darunter RNA Ausdruck, Proteinexpression Wachstumsfaktor Sekretion und Phagozytose2,4,6 beschrieben wurde ,7. Diese Charakterisierungen zeigen, dass die Zellen in diesen Bildern vertreten nicht nur pigmentierte und quaderförmigen, aber auch phagocytic, Post-mitotischen und polarisiert.
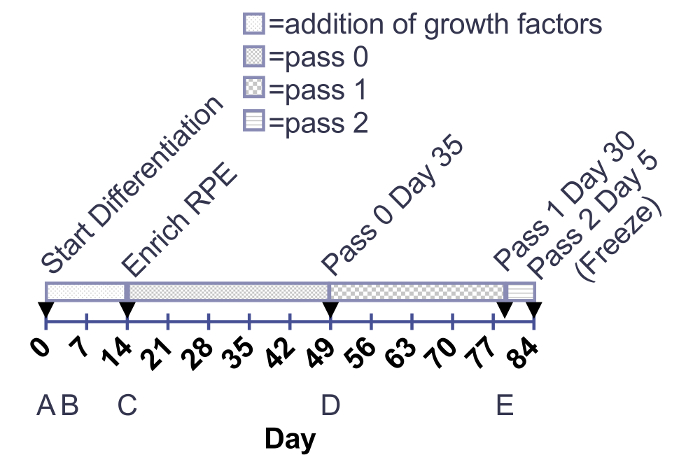
Abbildung 1:. Zeitplan für die Zugabe von Wachstumsfaktoren und Reifung des RPE. Wachstumsfaktoren werden 12-Well Platten von Tag 0-14 hinzugefügt. RPE Reifung sind in 6-Well Platten oder T75 Fläschchen ab Tag der Bereicherung zu 30 Tage nach dem Tauwetter (Durchgang 3 Tag 30) kultiviert. Pfeile zeigen auf enzymatische Zelle Passagierung. (A-E) unterhalb die Fristen entsprechen die Bilder in Abbildung 2. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: repräsentative Morphologie und Zusammenfluss der Reifung RPE. Induzierte pluripotente Stammzellen unmittelbar vor Passagierung zur Differenzierung (A). Unreife RPE Zellen Subconfluent am Tag 2 (B) und vor der Abholung zu entfernende Bereicherung am 14. Tag; nicht-RPE Patches (gekennzeichnet durch weiße Pfeile) erscheinen als Flecken oder opak "Ribbons" (C). RPE in der Passage 0, 1 und 3 auf 30 Tage (D, E, und F). Maßstabsleiste = 200 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
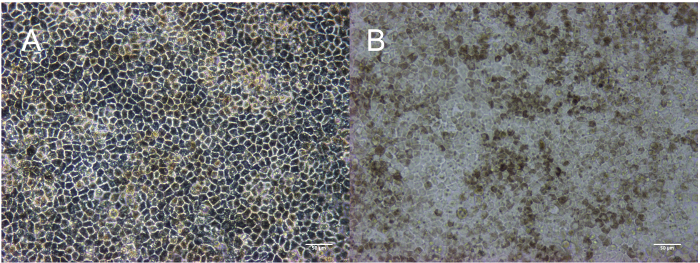
Abbildung 3: Reifen RPE in der Passage 3: Tag 30 Quaderförmigen Morphologie im Phasenkontrast (A) dargestellt und Pigmentierung im Hellfeld (B) dargestellt. Maßstabsleiste = 50 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Dieses Protokoll beschreibt die retinalen Pigment Epithelzellen aus pluripotenten Stammzellen zu produzieren. Die Methode wurde mit beiden menschlichen embryonalen und induzierte pluripotente Stammzellen aus einem Feeder-frei, Serum Kultur-Methode optimiert. Seit der ersten Isolierung von humanen embryonalen Stammzellen im Jahr 1998 und die Ableitung von induzierten pluripotenten Stammzellen (iPSC) im Jahr 2007 entwickelt eine Vielzahl von Stammzelle-Kultur, die Methoden wurden14,15,16, 17. Diese Methoden sollten ausreichen, für die Herstellung von Stammzellen Kolonien, die anfällig für diese Differenzierung. Es gibt keine bekannten Einschränkungen der Anwendbarkeit dieser Methode, ordnungsgemäß abgeleitet und gepflegte pluripotente Stammzellen.
Die wichtigsten Schritte sind die Passagierung der Stammzellen an Tag 0 der Differenzierung (Schritt 2.5) und den potenziellen Bedarf an manuellen Präparation am 14. Tag des Prozesses (Schritt 4.5). Bei der Kommissionierung, um differenzierte Zellen aus den Stammzellen Kolonien zu entfernen, finden Sie die Bilder in Kent18. Wie angegeben, zeigen die handelt Zellen zwischen den Kolonien und den undurchsichtigen Zellen innerhalb von Kolonien differenzierte Zellen, die vor dem Beginn dieses Protokoll18entfernt werden müssen. Nur undifferenzierte, dicht gepackte Kolonien mit definierten Kanten sollten zur Differenzierung passagiert.
Die Anzahl der Stammzellen entkernt pro Bohrloch (Schritt 2.6.7) wird durch die Tatsache erschwert, dass die Stammzellen können nicht in einem einzigen Zellsuspension auf Durchgang verrieben werden und kann nicht mit einer Hemocytometer genau gezählt werden. Die Angleichung der 80 % konfluierende Stammzellen ist für Passagierung 1 auch von einer 6-Well-Platte in 4 Vertiefungen einer 12-Well-Platte angezeigt. Unterschiede zwischen Zelllinien, wie Wachstumsrate, beeinflussen, wie schnell die unreifen RPE erreichen Zusammenfluss zwischen 0 bis 4 Tage. Die Stammzellen werden RPE unabhängig von der genauen Zusammenfluss produzieren, aber die Zellausbeute wird negativ beeinflusst werden, wenn die Zellen in diesem Stadium zu spärlich sind. Die unreifen RPE-Zellen sollte ca. 40-50 % Zusammenfluss an Tag 1 und fast 100 % Zusammenfluss von Tag 4. Wenn die Zellen nicht konfluierende Monolage von Tag 4 oder 6 produzieren, sollten das Protokoll in eine höhere Aussaatdichte am Tag 0 wiederholt werden. Beispielsweise wenn 1 auch von einer 6-Well-Platte in 4 Vertiefungen ein 12-Well-Platte am Tag 0 passagiert wurde und unreifen RPE sind nicht 100 % Zusammenfluss am Tag 4, reduzieren Sie die Aussaat zu einer 1:3 oder 1:2 Passage am Tag 0 oder ermöglichen die Stammzellen mehr konfluierende zu vor Passagierung. Es ist wichtig, eine konsequente Aussaatdichte herzustellen, wenn mehrere Zelllinien zu vergleichen.
Die manuelle Präparation Schritt am 14. Tag ist nur erforderlich, wenn nicht-RPE-Zellen in Kultur (Abbildung 2) vorhanden sind. Seit dem Zusatz von CHIR99021 des Protokolls erfordern viele pluripotenten Stammzelllinien wenig bis gar keine manuellen Präparation. Manche Präparate haben eine höhere Inzidenz von neuronalen Patches und es ist wichtig, diese Zellen zu entfernen. Wenn die RPE nicht beim Durchgang 0 durch Passage 3 lebensfähig sind, ist es möglich, die Differenzierung Protokoll ausreichend Zeit nehmen, entfernen alle nicht-RPE-Zellen zu wiederholen. Dies geschieht nicht oft, aber es ist um zu beachten, dass der Dissektion Schritt am 14. Tag optimiert werden kann, bei Bedarf hier erwähnt.
Es gibt eine Vielzahl von RPE Differenzierung Protokollen, die variieren in Preis als auch Kulturmethoden, Effizienz, Quantifizierung und funktionale Bewertung, von denen die letztere wurde überprüft gründlich2. Wir bevorzugen die 14-Tage-Methode detailliert hier wegen seiner Wirksamkeit, die Anpassungsfähigkeit und die Anwendbarkeit auf eine breite Palette von Zelle Linien4,7,8. Die Kryokonservierung Schritt in diesem Protokoll bietet auch einen großen Vorteil bei der Erstellung einer zwischengeschalteten Zellbank für zukünftigen Gebrauch, Vermeidung von Charge zu Charge Variabilität in Experimenten. Beginnend mit nur 4 Brunnen von einem 12-Well-Platte, ist es möglich, in 6-Well-Platten in der Passage 0 und T75 Fläschchen in der Passage 1 und 2 zu erweitern. In der Passage 2 Tag 3-5 Wenn die Zellen immer noch subconfluent sind und Pigment nicht wiedererlangt haben, ist es möglich, Ovarialgewebe zig Millionen von Zellen und dann Auftauen Reife RPE, benannten Passage 3 Tag 30, RNA Ausdruck, Protein-Expression, Wachstumsfaktor zu überprüfen Sekretion, Phagozytose, etc.. Wir haben auch Protokolle erweitern RPE für bis zu 13 Passagen 19etabliert.
Ich freue mich, werden diese Methode für iPSC Modellierung von okulären Erkrankungen und Generierung von RPE für Zelltherapie. In Bezug auf iPSC Krankheit Modellierung, wird dieses Protokoll derzeit im Labor verwendet, um RPE von CRISPR-korrigierte Zeilen mit nicht korrigiert Steuerelementen aus dem gleichen Patienten zu produzieren. Darüber hinaus ist dieses Protokoll anpassbar an synthetische Substrate und Xeno-freien Bedingungen, die nützlich für die Einhaltung der guten Herstellungspraxis für eine zelluläre Therapie erforderlich sind.
Offenlegungen
Dr. Clegg ist Mitbegründer der regenerativen Patch Technologies LLC.
Danksagungen
Diese Arbeit wurde von der Girlande-Initiative für Vision, California Institute für Regenerationsmedizin (CIRM; Zuschüsse DR1-01444, CL1-00521, TB1-01177, FA1-00616 und TG2-01151), The Vermont Community Foundation, der Stiftung Breaux, unterstützt und die Kampf gegen Blindheit Wynn-Gund translatorische Beschleunigung Forschungsprogramm Stiftung.
Materialien
| Name | Company | Catalog Number | Comments |
| SterilGARD III laminar flow biosafety cabinet | Baker | model: SG603A-HE, type: A2, class: 2 | 6' Baker laminar flow biosafety cabinet |
| Dissection Hood | Labconco | Model 3970405 | laminar flow bench top |
| dissecting microscope | Nikon | SMZ 1500 | heated stage |
| air-jacketed CO2 incubator | Sanyo | MCO-17AIC | 37 oC and 5% CO2 |
| inverted phase contrast microscope | Olympus | IX53 | |
| Name | Company | Catalog Number | Comments |
| Media Components | |||
| DMEM/F12 | Gibco | 10565042 | |
| N2 Supplement | Gibco | 17502048 | |
| B27 Supplement | Gibco | 17504044 | |
| NEAA | Gibco | 11140050 | |
| Name | Company | Catalog Number | Comments |
| Growth Factors and Reagents | |||
| Nicotinamide | Sigma | N0636 | |
| Recombinant mouse noggin | R&D systems | 1967-NG-025 | |
| Recombinant human DKK-1 | R&D systems | 5439-DK-010 | |
| Recombinant IGF-1 | R&D systems | 291-G1-200 | |
| FGF-basic | Peprotech | 100-18B | |
| Recombinant human/mouse/rat Activin A | Peprotech | 120-14E | |
| SU5402 FGF inhibitor | Santa Cruz Biotechnology | sc-204308 | |
| Name | Company | Catalog Number | Comments |
| Substrates | |||
| Matrigel Basement Membrane Matrix, Phenol Red-Free, LDEV-Free | Corning | 356237 | extracellular matrix-based hydrogel (ECMH) |
| Matrigel hESC-Qualified Matrix, LDEV-Free | Corning | 354277 | growth factor reduced ECMH |
| Name | Company | Catalog Number | Comments |
| Other reagents | |||
| 1X Versene (EDTA) | Gibco | 15040066 | |
| DPBS | Gibco | 14190250 | |
| 1X PBS (no calcium, no magnesium) | Gibco | 10010023 | |
| TrypLE (trypsin-like dissociation enzyme, TDE) | Gibco | 12563011 | |
| X-VIVO 10 (RPE supporting medium) | Lonza | BW04-743Q | |
| Y-27632 | Tocris | 12-541-0 (1254) | |
| CryoStor CS10 | BioLife Solutions | 210102 | cryopreservation medium |
| 1.2 mL Cryogenic Vial | Corning | 430487 | |
| Mr. Frosty (freezing container) | Nalgene | 5100-0001 | freezing container |
| Normocin | Invivogen | ant-nr-2 | antimicrobial reagent |
| Name | Company | Catalog Number | Comments |
| Other Equipment | |||
| Pipet-aid | Drummond | 4-000-101 | |
| 12-well culture plate | Corning | CLS3516 | Used during differentiation. |
| T75 flask | Corning | 430641 | Used during RPE maturation. |
| 6-well culture plate | Corning | CLS3513 | Used during RPE maturation. |
| cell scraper | Corning | 08-771-1A | Used during passages. |
| cell strainer | Falcon | 352340 | Used during passages before cell count. |
Referenzen
- Strauss, O. The retinal pigment epithelium in visual function. Physiol. Rev. 85 (3), 845-881 (2005).
- Leach, L. L., Clegg, D. O. Concise Review: Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients With Ocular Disease. Stem Cells. 33 (8), 2363-2373 (2015).
- Pennington, B. O., Clegg, D. O. Pluripotent Stem Cell-Based Therapies in Combination with Substrate for the Treatment of Age-Related Macular Degeneration. J. Ocul. Pharmacol. Ther. 32 (5), 261-271 (2016).
- Buchholz, D. E., Pennington, B. O., Croze, R. H., Hinman, C. R., Coffey, P. J., Clegg, D. O. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium. Stem Cells Transl. Med. 2 (5), 384-393 (2013).
- Clegg, D. O., Buchholz, D., Hikita, S., Rowland, T., Hu, Q., Johnson, L. V. Retinal Pigment Epithelial Cells: Development In Vivo and Derivation from Human Embryonic Stem Cells In Vitro for Treatment of Age-Related Macular Degeneration. Stem Cell Res. Ther. (Chapter 1), 1-24 (2008).
- Leach, L. L., Buchholz, D. E., Nadar, V. P., Lowenstein, S. E., Clegg, D. O. Canonical/β-catenin Wnt pathway activation improves retinal pigmented epithelium derivation from human embryonic stem cells. Invest. Ophthalmol. Vis. Sci. 56 (2), 1002-1013 (2015).
- Pennington, B. O., Clegg, D. O., Melkoumian, Z. K., Hikita, S. T. Defined culture of human embryonic stem cells and xeno-free derivation of retinal pigmented epithelial cells on a novel, synthetic substrate. Stem Cells Transl. Med. 4 (2), 165-177 (2015).
- Leach, L. L., et al. Induced Pluripotent Stem Cell-Derived Retinal Pigmented Epithelium: A Comparative Study Between Cell Lines and Differentiation Methods. J. Ocul. Pharmacol. Ther. 32 (5), 317-330 (2016).
- Mazzoni, F., Safa, H., Finnemann, S. C. Understanding photoreceptor outer segment phagocytosis: use and utility of RPE cells in culture. Exp. Eye Res. 126, 51-60 (2014).
- Sonoda, S., Spee, C., Barron, E., Ryan, S. J., Kannan, R., Hinton, D. R. A protocol for the culture and differentiation of highly polarized human retinal pigment epithelial cells. Nat. Protoc. 4 (5), 662-673 (2009).
- Choudhary, P., et al. Directing Differentiation of Pluripotent Stem Cells Toward Retinal Pigment Epithelium Lineage. Stem Cells Transl. Med. 6 (2), 490-501 (2017).
- Maruotti, J., et al. Small-molecule-directed, efficient generation of retinal pigment epithelium from human pluripotent stem cells. Proc. Natl. Acad. Sci. U.S.A. 112 (35), 10950-10955 (2015).
- Lane, A., et al. Engineering efficient retinal pigment epithelium differentiation from human pluripotent stem cells. Stem Cells Transl. Med. 3 (11), 1295-1304 (2014).
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1147 (1998).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318 (5858), 1917-1920 (2007).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Amit, M., Itskovitz-Eldor, J. Derivation and spontaneous differentiation of human embryonic stem cells. J. Anat. 200 (Pt 3), 225-232 (2002).
- Kent, L. Culture and Maintenance of Human Embryonic Stem Cells. J. Vis. Exp. (34), e1427-e1427 (2009).
- Croze, R. H., et al. ROCK Inhibition Extends Passage of Pluripotent Stem Cell-Derived Retinal Pigmented Epithelium. Stem Cells Transl. Med. 3 (9), 1066-1078 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten