Method Article
人胚胎或诱导多能干细胞对视网膜色素上皮细胞的快速定向分化
摘要
该协议描述了如何产生多能干细胞的视网膜色素上皮细胞 (RPE)。该方法结合生长因子和小分子, 将干细胞分化为未成熟的 rpe, 在十四天后成熟, 功能性视网膜色素上皮细胞三月后。
摘要
我们描述了一种强有力的方法来引导多能干细胞分化为视网膜色素上皮细胞 (RPE)。提供详细和彻底的协议的目的是明确地展示每一个步骤, 并使这一领域的研究人员可以随时获得。该协议的结果是一个均匀层的 RPE 与最低或不需要手动解剖。该方法已被证明是有效的诱导多能干细胞 (iPSC) 和人类胚胎干细胞。此外, 我们还描述了允许长期储存的中间细胞银行的超低温保存方法。使用此协议生成的 RPE 可能有助于 iPSC disease-in-a 的建模或临床应用。
引言
视网膜色素上皮是一单层的色素细胞, 为光提供重要的支持。视网膜色素上皮细胞 (RPE) 具有多种视觉功能, 包括光吸收、养分和离子转运、甲酸循环、感光外段吞噬、生长因子分泌1。有多种视网膜营养, 影响 RPE 的功能, 并导致视力丧失, 包括年龄相关的黄斑变性和视网膜色素变性。从多能干细胞生成视网膜色素上皮可以促进研究, 以了解这些眼病, 并可以提供一个无限来源的 rpe 细胞治疗2。事实上, 许多临床试验正在进行中利用 RPE 从多能干细胞3。
此差异化协议最初是由布赫兹4描述的, 并基于以前发布的克莱格5方法。该过程模仿正常的体内发展过程, 通过操纵胰岛素生长因子 (igf-i), 碱性成纤维细胞生长因子 (FGF-2), 将未分化的多能干细胞定向到 RPE 的命运。基本), 转化生长因子β (TGF β) 和 WNT 通路4,5。该协议是显着改善, 加入了 WNT 通路激动剂后期在协议, 产生97.77% ± 0.1% pre-melanosome 蛋白 (PMEL) 阳性细胞, 并已适应异无条件6,7。结果表明 rpe 在转录和蛋白质水平上表达 rpe 标记, 以适当的极性分泌已知的 rpe 生长因子, 并对感光性外段进行吞噬8。该协议比 "自发" 的分化协议更迅速和可靠, 涉及简单去除碱性成纤维细胞生长因子8。此外, RNA 测序数据显示, 使用此协议获得的 RPE 与使用更常见的自发方法8所获得的结果非常相似。14天的方法生成 RPE, 适合 Mazzoni9 (色素、极化、吞噬、有丝分裂、多边形)9中提到的 "5 P"。虽然这个过程在多个实验室中被证明是可重现的, 但我们希望承认在最近几年中发布的一些额外的定向鉴别方法10,11,12,13。
研究方案
1. 准备0天到14天的试剂
- 准备以下介质组件:
- 使100毫升的视网膜分化培养基 (RDM) 加入1毫升的 100x N2 补充, 2 毫升50x B27 补充剂, 1 毫升100x 非必需氨基酸 (NEAA) 到96毫升的 Dulbecco 和 #39; s 修饰的基本培养基/营养混合物 F12 9 (DMEM/F12).
- 10 毫升的1米烟酰胺 (nic) 溶解1.221 克的 nic 在8毫升的无菌水, 涡流, 并使体积到10毫升无菌水。无菌过滤器的解决方案.
- 准备以下生长因子和小分子:
- 重建重组小鼠, 人类 dickkopf WNT 信号通路抑制剂 1 (DKK-1), IGF-1 到100和 #181; 每0.1% 牛血清白蛋白中的 g/毫升(BSA) 在磷酸盐缓冲溶液 (PBS)。分的需要, 并存储在-20 和 #176; C 最多3月.
- 重组细胞因子-基本到10和 #181; g/毫升和人/鼠/鼠/老鼠激活 A 到100和 #181; 每 0.1% BSA 在 PBS 中的 g/毫升。分的需要, 并存储在-80 和 #176; C 为1年.
- 在二甲基亚砜中重组 SU 5402 (受体特异性酪氨酸激酶抑制剂) 和 CHIR99021 (糖原合成酶激酶3、GSK-3 和 #946; 抑制剂) 到10毫米。分和存储在-20 和 #176; C 分别为1年或6月.
- 在0天和/或天14中获取以下内容: 1x 乙酸酸 (edta) 溶液 (pbs 每1升0.2 克 edta), 1X pbs-/(pbs 无钙或镁, pH 7.4), 1x 胰蛋白酶样离解酶 (TDE), DPBS (Dulbecco 和 #39; s pbs),视网膜色素上皮支持培养基 (RSM) 和 Y-27632 二盐酸盐 (使用10和 #181; M).
2。0天: 用于分化的多能干细胞节
- 在无饲养、无血清条件下, 在传代前将干细胞菌落培养到大约80% 汇合处.
注意: 有关优化此步骤的详细信息, 请参阅讨论.
根据制造商的建议, - 将12层板与胞外矩阵水凝胶 (ECMH) 一起涂上。允许在室温或隔夜在4和 #176 时设置1小时; C.
- 分0天所需的 RDM 和 PBS 的体积, 在水浴中加热到37和 #176; C 之前加入生长因子。将 EDTA 带到室温.
- 添加0天所需的生长因子, 以 10 mM NIC, 50 ng/毫升的 RDM, 10 ng/毫升 DKK-1, 和 10 ng/毫升 IGF-1。从步骤1.2 中所描述的股票中, 添加100和 #181; l 的 NIC, 5 和 #181; l, 1 和 #181; l DKK-1, 和1和 #181; l IGF-1 到10毫升的 RDM.
- 选择删除所有分化的殖民地基于形态学从干细胞, 将传代分化。使用 P10 吸管提示手动删除区分的单元格.
注意: 在菌落之间的纤维细胞以及菌落内的不透明细胞表明被分化的细胞被移除。有关区分单元格的详细信息, 请参阅讨论. - 通过一个6孔板的单井到4井的12孔板 (1:4).
注: 有关传代干细胞的详细信息, 请参阅本阶段的讨论。- 从干细胞中吸取干细胞培养基, 然后用2毫升的5ml 冲洗一次.
- 吸入 PBS-/-和冲洗每井三次与1毫升的 EDTA 每井 6-井板.
- 轻轻倾斜板并抽出 EDTA。不要以任何方式搅动板以避免过早地提起细胞.
- 在第三次洗涤后, 加入1毫升的 EDTA, 在室温下孵育3-5 分钟。在这个孵化过程中请勿干扰板.
- 吸入 EDTA, 并添加1毫升的 RDM 每井将被播种0.5 毫升额外的培养基。例如, 用4.5 毫升的 RDM 洗1井板, 在12孔板的4口上板.
- 使用单元格刮刀轻轻地分离细胞。收集所有的细胞在一个锥形管和研制的细胞在 RDM 由移上下5次。分离大团簇的细胞, 但不研制单细胞悬浮。在吸管中均匀分布单元格。快速完成这一步, 以防止再附着到盘子上.
- 在 ECM 上包衣的12孔板 (每井1毫升的细胞悬浮液) 上的种子细胞.
- 前后倾斜板, 使单元均匀分布在井中。在37和 #176 的细胞培养孵化器中轻轻地放在一起; C 和 5% CO 2 直到下一个介质发生变化.
- 记下确切的时间。每天在同一时间更改介质.
3。1天至 14: 增加生长因子
- 日 1: 在所有水井上 (1 毫升) 上使用 RDM, 并在0天的生长因子成分中改变培养基 (见步骤 2.4).
- 2 天: 使用 RDM (每井1毫升) 与 10 mM NIC、5 ng/毫升的碱性成的基质、10 ng/ml、10 ng/毫升 DKK-1 和 10 ng/毫升 IGF-1。从步骤1.2 中所描述的股票中, 添加100和 #181; l 的 NIC, 5 和 #181; l 的基本, 1 和 #181; 我的脑袋, 1 和 #181; l DKK1, 1 和 #181; l IGF1 到10毫升的 RDM.
- 天 4: 使用 RDM (每井1毫升) 与 100 ng/毫升激活 A, 10 ng/毫升 DKK-1, 和 10 ng/毫升 IGF-1 改变培养基。从步骤1.2 所描述的股票中, 添加10和 #181; 激活, 1 和 #181; l DKK1, 1 和 #181; l IGF-1 到10毫升 RDM.
注意: 观察细胞在这个阶段是汇合的. - 6 天: 使用 RDM (每井1毫升) 与 100 ng/毫升激活 A 和 10 #181; M SU 5402。从步骤1.2 中所描述的股票中, 添加10和 #181; 激活 A 和 10 #181; SU 5402 到10毫升的 RDM.
- 天8、10和 12: 使用 RDM (1 毫升) 与 100 ng/ml 激活 A、10和 #181; m SU 5402, 3 和 #181; m CHIR99021。从1.2 步所描述的股票中, 添加10和 #181; 激活 A、10和 #181; SU 5402、3和 #181; l CHIR99021 到10毫升 RDM.
4。充实的天到段落 0 RPE
- 涂上6个有生长因子的板, 根据制造商的建议减少 ECMH。允许在室温或隔夜在4和 #176 时设置1小时; C.
- 分 DPBS 所需的体积和1毫升的 RDM 的丰富和温暖在水浴到37和 #176; c. 将 TDE 到室温和热的必要体积的 RSM, 抗菌试剂, Y-27632 到37和 #176; c.
- 添加抗菌试剂和 Y-27632, 分别获得0.5x 和 10 #181; M 组合物。在前4-7 天使用此介质可改善附件.
- 从所有水井中抽出培养基, 并在 5ml RDM 中添加1毫升 (不需要生长因子).
- 使用解剖显微镜, 手工解剖和刮去所有非 RPE 细胞使用 P10 吸管提示.
注: 有关示例, 请参见代表性结果部分. - 解剖后, 吸气 RDM 和所有细胞碎片。每井1毫升的 5ml DPBS 洗两次.
- 在12孔板上加0.5 毫升的 TDE, 孵育在37和 #176; C 为 5 min. 用刮板机轻轻地将电池从盘子中取出。使用 P1000 吸管轻轻研制的细胞/TDE 悬浮由移上下3-4 次, 以创建一个统一的悬挂.
- 在 5ml RSM 中稀释细胞/TDE 悬浮液 1:10, 无 Y-27632。离心机细胞悬浮在 173 x g 为5分钟在室温.
- 从细胞颗粒中吸取培养基, 在 RSM 中重10和 #181; M Y-27632 (1 毫升).
- 用尼龙网状细胞过滤器, 用40和 #181; m 孔。使用例计算指定卷中的单元格数, 并算出应变解的单元格的浓度.
- 生长因子上的种子细胞在 1 x 10 5 单元/cm 2 的 4 mL 中降低了 ECM 涂层板的10和 #181; M Y-27632.
- 将 RSM 替换为10和 #181; 在单元播种后 Y-27632 48 小时, 并继续每3-4 天替换一次媒体 ( 如 星期一和星期四)。不要更换10和 #181; 4-7 天后 Y-27632.
- 允许单元格在37和 #176 中成熟28到35天; C 和 5% CO 2 。继续每3-4 天更换一次 RSM ( 例如 在星期一和星期四).
5。成熟: RPE 的段落1和2注意: 卷被表明为1井 6-井板或 T75 烧瓶表明由括号.
- 在28至35通道0天之间, 根据制造商的建议, 将6个井板 (T75 烧瓶) 与 ECMH 一起涂上.
- 分 DPBS 和 RSM 的体积需要和温暖的水浴到37和 #176; c. 将 TDE 带到室温.
- 从井中抽出培养基, 用2毫升 (10 毫升) 的 5ml DPBS 冲洗两次.
注意: 不要使用10和 #181; Y-27632. - 吸 DPBS 并添加1毫升 (5 毫升) 的 TDE。在孵化箱中放置37和 #176; C 和 5% CO 2 , 用于 5 min。在孵化后, 在倒置显微镜上观察细胞以确认细胞是收缩和分离的.
- 使用适当大小的刮板, 轻轻地从井底或烧瓶底部取出电池.
- 使用 P1000 提示 (10 毫升血清吸管) 轻轻研制细胞/TDE 悬架向上和向下3-4 次, 以创建一个统一的悬浮.
- 在 RSM 中稀释电池悬浮液1:10。保留2毫升 (5 毫升) 的 RSM 冲洗井/烧瓶, 并添加到稀释的细胞悬浮.
注意: 不允许酶暴露时间超过25分钟. - 在室温下将电池悬浮在 173 x g 离心5分钟.
- 从细胞颗粒中吸取培养基, 并在1毫升 (5 毫升) 的 RSM 中重细胞
- 用尼龙网状细胞过滤器, 用40和 #181; m 孔。使用例计算指定卷中的单元格数, 并算出应变解的单元格的浓度. 在 RSM 的 4 ml (15 毫升) 中,
- ECMH 涂层板上的种子单元格位于 1 x 10 5 单元格/cm 2 中。
- 允许细胞成熟30天。继续每3-4 天更改一次 RSM.
- 在30天重复上述步骤 (步骤 5.2-5.11) 以通过1至2的单元格.
6。创建中间细胞库: 2 天3-5 视网膜色素上皮冷冻保存
注意: 冷冻细胞, 而他们是 subconfluent (〜 50%), 并没有恢复色素.
- 基于单元格的数量, 计算在 3x10^-7 6 单元/mL 的浓度下重细胞所需的10% 甲基亚砜冷冻培养基的体积。
- 按照步骤5.2 到5.8。重在超低温保存培养基中, 用10% 甲基亚砜到 3 x 10 6 细胞/毫升, 并将细胞悬浮液1毫升转移至1.2 毫升低温小瓶.
- 将低温小瓶置于冷冻容器中, 其设计为-1 和 #176 冷却; c/分钟, 在-80 和 #176 处过夜。转换为长期贮存的液氮.
注意: 这些细胞在解冻后将是3通道。在特征化前的30天内培养细胞。种子通道 3 RPE 在 1.5 x 10 5 每 cm 2 解冻后。 2 , 4 , 6 , 7
结果
这种方法的结果是生产的一个均匀, 色素, 和立方单层的 RPE。图 1中的时间轴对应于图 2中描述的图像。如图 2A所示, 干细胞菌落被定义的边缘紧紧地包住, 在菌落之间没有纤维细胞或不透明细胞。图 2B提供了 subconfluent 的未成熟 RPE 的表示形式。如果细胞在这个阶段已经汇合, 它们就不能扩展对分化过程至关重要的预测。严重 subconfluent 的细胞将无法建立单层和形成紧密的交界处, 上皮的特点。关于如何优化这一汇合的细节在讨论部分概述。图 2C显示了在分化过程中可能出现的两种最常见的非 RPE 类型的形态学: 神经或纤维补丁。重要的是要注意, 这些神经补丁在解剖显微镜上显得特别不透明, 而定义的, 纤维样斑块几乎是半透明的解剖显微镜。它可以帮助标记这些区域在一个组织培养板与乙醇实验室钢笔更容易识别他们在复合光显微镜和解剖显微镜。图 2 d-F显示了特征鲜明的边界、鹅卵石形态和色素沉着, 表明 RPE 的健康、成熟的文化。图 3是一个更高的放大倍数图像, 以显示完全成熟的视网膜色素上皮的不同外观, 由相衬和明亮的现场显微镜描述。在3天 30, 细胞已经准备好的特征, 已在以前的出版物中描述, 包括 RNA 表达, 蛋白质表达, 生长因子分泌, 吞噬2,4,6 ,7。这些特征表明, 这些图像中所代表的细胞不仅是色素和立方, 而且还有吞噬、有丝分裂和极化。
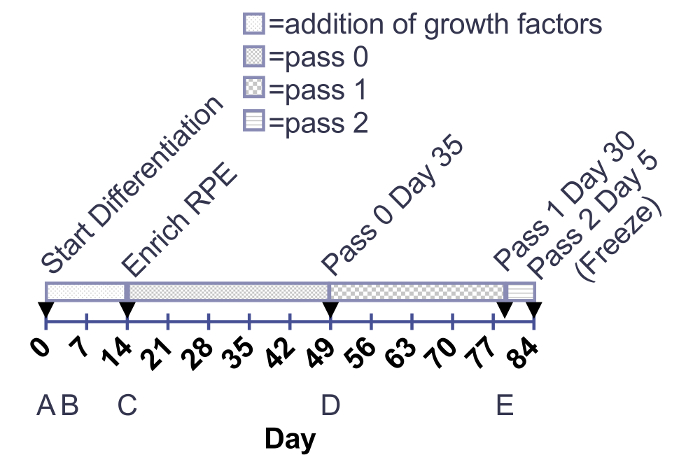
图 1:。增加生长因子和 RPE 成熟度的时间轴.生长因子被添加到 12-井板块从0-14 天。成熟 RPE 被培养在6个好板材或 T75 烧瓶从充实天到30天 post-thaw (段落3天 30)。箭头指示酶细胞传代。(A-E) 在时间线下面对应于图 2中的图像。请单击此处查看此图的较大版本.

图 2: 成熟 RPE 的代表性形态学和汇合.传代前立即诱导的多能干细胞分化 (A)。未成熟的 RPE 细胞 subconfluent 在2天 (B) 和 pick-to-remove 富集前14天;非 RPE 补丁 (由白色箭头表示) 显示为补丁或不透明的 "色带" (C)。在 30 (D, E,和F) 上的通道0、1和3的 RPE。缩放栏 = 200 µm.请单击此处查看此图的较大版本.
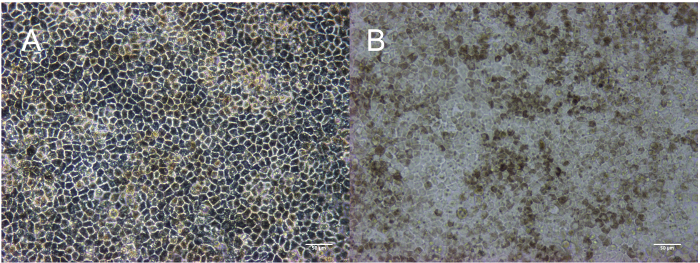
图 3: 成熟 RPE 在段落 3: 天 30立方形态学描述的相衬 (A) 和色素沉着描绘在明亮的领域 (B)。缩放栏 = 50 µm.请单击此处查看此图的较大版本.
讨论
该协议描述了如何产生多能干细胞的视网膜色素上皮细胞。该方法是利用人胚胎和诱导多能干细胞从无饲养, 无血清培养方法优化。自1998年人类胚胎干细胞最初分离和2007年诱导多能干细胞 (iPSC) 的衍生, 大量的干细胞培养方法已被开发14,15,16, 17。这些方法应该足以产生容易分化的干细胞群。这一方法对于正确推导和维持多能干细胞的适用性没有已知的限制。
最关键的步骤是传代的干细胞到0天的分化 (步骤 2.5) 和潜在的需要手工解剖在14天的过程 (步骤 4.5)。当选择从干细胞群中移除分化的细胞时, 请参考肯特18中的图像。如前所述, 菌落之间的纤维细胞和菌落间的不透明细胞表明在开始本协议18之前需要移除的分化细胞。只有无差别的, 严密包装的殖民地与定义的边缘应该是传代的分化。
每井 (步 2.6.7) 的干细胞数目是复杂的, 因为干细胞不能 triturated 成一个单一的细胞悬浮在通道上, 不能准确地计算使用例。80% 汇合的干细胞的近似值被表明为传代1井 6-井板入4口井 12-井板。干细胞系之间的差异, 如生长速率, 可能会影响未成熟 RPE 达到0天到4之间汇合的速度。干细胞会产生 RPE, 而不考虑精确的汇合, 但如果细胞在这个阶段太稀疏, 细胞的产量会受到负面影响。不成熟的 RPE 细胞应该是大约40-50% 汇合在天1和近100% 汇合在天4。如果细胞在4或6天内没有产生汇合的单层, 则应在0天以较高的播种密度重复该协议。例如, 如果6井板块的1井在0天传代4口井, 而未成熟的 RPE 则不是100% 的汇合点, 在4或1:3 天内将播种量减少到1:2 个或0通道, 或者让干细胞变得更加汇合在传代之前在比较多个单元格线时, 建立一致的播种密度是至关重要的。
14天的手工解剖步骤是唯一必要的, 当非 RPE 细胞存在于文化中 (图 2C)。由于 CHIR99021 加入了该协议, 许多多能干细胞系几乎不需要人工解剖。有些准备工作的神经补丁的发病率较高, 这是至关重要的, 以消除这些细胞。如果 rpe 是不可行的通道0通过 3, 它有可能重复的差异化协议采取足够的时间, 以消除所有的非 rpe 细胞。这并不经常发生, 但这里提到的是, 14 天的解剖步骤可以在需要时进行优化。
有各种不同的视网膜色素上皮分化协议的成本以及文化方法, 效率, 量化和功能评估, 后者已被彻底审查2。我们更喜欢这里详细介绍的14天的方法, 因为它的功效, 适应性和适用范围广泛的细胞线4,7,8。该协议中的超低温保存步骤也为将来的使用建立一个中间细胞库提供了一个重要的优势, 避免了实验中的批次变异性。从仅4口井开始以一个12井板材, 它是可能的扩展成 6-井板材在段落0和 T75 烧瓶在段落1和2。在2天 3-5, 当细胞仍然 subconfluent, 并没有恢复色素, 它是可能的冷冻数千万细胞, 然后解冻成熟 RPE, 指定通道3天 30, 以检查 RNA 表达, 蛋白表达, 生长因子分泌、吞噬等。我们还建立了一些协议, 以扩大 RPE 多达13通道19。
展望未来, 该方法将有助于眼部疾病的 iPSC 建模和细胞治疗 RPE 的生成。关于 iPSC 疾病的建模, 该协议目前正在实验室中使用, 以产生 RPE 从 CRISPR 纠正线与 non-corrected 控制从同一病人。此外, 该协议适用于合成基质和无异的条件, 对于坚持细胞治疗所需的良好生产实践是有用的。
披露声明
Dr. 克莱格是再生修补技术有限责任公司的创始人。
致谢
这项工作得到了《视觉花环倡议》、加利福尼亚再生医学研究所 (CIRM、DR1-01444、CL1-00521、TB1-01177、FA1-00616 和 TG2-01151)、佛蒙特州社区基金会、布里奥克斯基金会和基础战斗失明永利-Gund 平移研究加速计划。
材料
| Name | Company | Catalog Number | Comments |
| SterilGARD III laminar flow biosafety cabinet | Baker | model: SG603A-HE, type: A2, class: 2 | 6' Baker laminar flow biosafety cabinet |
| Dissection Hood | Labconco | Model 3970405 | laminar flow bench top |
| dissecting microscope | Nikon | SMZ 1500 | heated stage |
| air-jacketed CO2 incubator | Sanyo | MCO-17AIC | 37 oC and 5% CO2 |
| inverted phase contrast microscope | Olympus | IX53 | |
| Name | Company | Catalog Number | Comments |
| Media Components | |||
| DMEM/F12 | Gibco | 10565042 | |
| N2 Supplement | Gibco | 17502048 | |
| B27 Supplement | Gibco | 17504044 | |
| NEAA | Gibco | 11140050 | |
| Name | Company | Catalog Number | Comments |
| Growth Factors and Reagents | |||
| Nicotinamide | Sigma | N0636 | |
| Recombinant mouse noggin | R&D systems | 1967-NG-025 | |
| Recombinant human DKK-1 | R&D systems | 5439-DK-010 | |
| Recombinant IGF-1 | R&D systems | 291-G1-200 | |
| FGF-basic | Peprotech | 100-18B | |
| Recombinant human/mouse/rat Activin A | Peprotech | 120-14E | |
| SU5402 FGF inhibitor | Santa Cruz Biotechnology | sc-204308 | |
| Name | Company | Catalog Number | Comments |
| Substrates | |||
| Matrigel Basement Membrane Matrix, Phenol Red-Free, LDEV-Free | Corning | 356237 | extracellular matrix-based hydrogel (ECMH) |
| Matrigel hESC-Qualified Matrix, LDEV-Free | Corning | 354277 | growth factor reduced ECMH |
| Name | Company | Catalog Number | Comments |
| Other reagents | |||
| 1X Versene (EDTA) | Gibco | 15040066 | |
| DPBS | Gibco | 14190250 | |
| 1X PBS (no calcium, no magnesium) | Gibco | 10010023 | |
| TrypLE (trypsin-like dissociation enzyme, TDE) | Gibco | 12563011 | |
| X-VIVO 10 (RPE supporting medium) | Lonza | BW04-743Q | |
| Y-27632 | Tocris | 12-541-0 (1254) | |
| CryoStor CS10 | BioLife Solutions | 210102 | cryopreservation medium |
| 1.2 mL Cryogenic Vial | Corning | 430487 | |
| Mr. Frosty (freezing container) | Nalgene | 5100-0001 | freezing container |
| Normocin | Invivogen | ant-nr-2 | antimicrobial reagent |
| Name | Company | Catalog Number | Comments |
| Other Equipment | |||
| Pipet-aid | Drummond | 4-000-101 | |
| 12-well culture plate | Corning | CLS3516 | Used during differentiation. |
| T75 flask | Corning | 430641 | Used during RPE maturation. |
| 6-well culture plate | Corning | CLS3513 | Used during RPE maturation. |
| cell scraper | Corning | 08-771-1A | Used during passages. |
| cell strainer | Falcon | 352340 | Used during passages before cell count. |
参考文献
- Strauss, O. The retinal pigment epithelium in visual function. Physiol. Rev. 85 (3), 845-881 (2005).
- Leach, L. L., Clegg, D. O. Concise Review: Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients With Ocular Disease. Stem Cells. 33 (8), 2363-2373 (2015).
- Pennington, B. O., Clegg, D. O. Pluripotent Stem Cell-Based Therapies in Combination with Substrate for the Treatment of Age-Related Macular Degeneration. J. Ocul. Pharmacol. Ther. 32 (5), 261-271 (2016).
- Buchholz, D. E., Pennington, B. O., Croze, R. H., Hinman, C. R., Coffey, P. J., Clegg, D. O. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium. Stem Cells Transl. Med. 2 (5), 384-393 (2013).
- Clegg, D. O., Buchholz, D., Hikita, S., Rowland, T., Hu, Q., Johnson, L. V. Retinal Pigment Epithelial Cells: Development In Vivo and Derivation from Human Embryonic Stem Cells In Vitro for Treatment of Age-Related Macular Degeneration. Stem Cell Res. Ther. (Chapter 1), 1-24 (2008).
- Leach, L. L., Buchholz, D. E., Nadar, V. P., Lowenstein, S. E., Clegg, D. O. Canonical/β-catenin Wnt pathway activation improves retinal pigmented epithelium derivation from human embryonic stem cells. Invest. Ophthalmol. Vis. Sci. 56 (2), 1002-1013 (2015).
- Pennington, B. O., Clegg, D. O., Melkoumian, Z. K., Hikita, S. T. Defined culture of human embryonic stem cells and xeno-free derivation of retinal pigmented epithelial cells on a novel, synthetic substrate. Stem Cells Transl. Med. 4 (2), 165-177 (2015).
- Leach, L. L., et al. Induced Pluripotent Stem Cell-Derived Retinal Pigmented Epithelium: A Comparative Study Between Cell Lines and Differentiation Methods. J. Ocul. Pharmacol. Ther. 32 (5), 317-330 (2016).
- Mazzoni, F., Safa, H., Finnemann, S. C. Understanding photoreceptor outer segment phagocytosis: use and utility of RPE cells in culture. Exp. Eye Res. 126, 51-60 (2014).
- Sonoda, S., Spee, C., Barron, E., Ryan, S. J., Kannan, R., Hinton, D. R. A protocol for the culture and differentiation of highly polarized human retinal pigment epithelial cells. Nat. Protoc. 4 (5), 662-673 (2009).
- Choudhary, P., et al. Directing Differentiation of Pluripotent Stem Cells Toward Retinal Pigment Epithelium Lineage. Stem Cells Transl. Med. 6 (2), 490-501 (2017).
- Maruotti, J., et al. Small-molecule-directed, efficient generation of retinal pigment epithelium from human pluripotent stem cells. Proc. Natl. Acad. Sci. U.S.A. 112 (35), 10950-10955 (2015).
- Lane, A., et al. Engineering efficient retinal pigment epithelium differentiation from human pluripotent stem cells. Stem Cells Transl. Med. 3 (11), 1295-1304 (2014).
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1147 (1998).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318 (5858), 1917-1920 (2007).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Amit, M., Itskovitz-Eldor, J. Derivation and spontaneous differentiation of human embryonic stem cells. J. Anat. 200 (Pt 3), 225-232 (2002).
- Kent, L. Culture and Maintenance of Human Embryonic Stem Cells. J. Vis. Exp. (34), e1427-e1427 (2009).
- Croze, R. H., et al. ROCK Inhibition Extends Passage of Pluripotent Stem Cell-Derived Retinal Pigmented Epithelium. Stem Cells Transl. Med. 3 (9), 1066-1078 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。