A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام تمازي المعدلة لتقييم نتائج الذاكرة الفنية بعد توقف القلب
In This Article
Summary
ويصف هذا البروتوكول استخدام تمازي المعدلة لتقييم التعلم/الذاكرة الفنية في الاختناق الناجم عن السكتة القلبية الاسكيمية الدماغي.
Abstract
الخلفية: تقييم خفيفة إلى معتدلة من ضعف الإدراك في نموذج عالمي الاسكيمية دماغي (أي سكتة قلبية) يمكن أن يكون صعباً بسبب ضعف الحركة بعد الجراحة. على سبيل المثال، الفئران الذين الخضوع للعمليات الجراحية ويتعرضون للمتاهة المائية موريس قد لا قادراً على السباحة، مما يفرغ التجربة.
أسلوب جديد: أنشأنا اختبار تمازي تناوب عفوية سلوكية معدلة. والميزة الرئيسية للبروتوكول تمازي المعدلة هو تصميمه بسيطة نسبيا من القوة ما يكفي لتقييم التعلم/الذاكرة الفنية بعد الاسكيمية. بالإضافة إلى ذلك، يتم تحليل البيانات بسيطة ومباشرة. كنا في تمازي لتحديد العجز التعلم/الذاكرة الفئران في وجود أو غياب خفيفة إلى معتدلة (6 دقيقة) سكتة قلبية أسفيكسيال (ACA) على حد سواء. الفئران لديهم ميل طبيعي لاستكشاف، وسوف تستكشف بالأسلحة البديلة في تمازي، بينما الفئران هيبوكامبال lesioned تميل إلى اعتماد تفضيل الجانب مما أدى إلى نسب انخفاض التناوب التلقائي، كاشفة هيبوكامبال المتصلة التعلم الوظيفي/الذاكرة في وجود أو عدم وجود هيئة مكافحة الفساد.
النتائج: مجموعات هيئة مكافحة الفساد قد نسب الجانب ذات الأفضلية الأعلى والمصطنعة أقل بالمقارنة مع عنصر التحكم.
مقارنة مع "أساليب القائمة": "موريس" الماء والمتاهة بارنز أكثر بروزا لتقييم وظيفة التعلم/الذاكرة. ومع ذلك، المتاهة المائية موريس مرهقة أكثر من غيرها متاهات. المتاهة بارنز يستخدم على نطاق واسع لقياس الذاكرة مرجع (طويلة الأجل)، بينما عجز عصبي المستحثة بهيئة مكافحة الفساد هي أوثق صلة بعامل الذاكرة (قصيرة الأجل).
الاستنتاجات: قمنا بتطوير استراتيجية بسيطة، لكنها فعالة لتحديد عامل الذاكرة (قصيرة الأجل) عبر تمازي في نموذجنا الاسكيمية الدماغي العالمية (هيئة مكافحة الفساد).
Introduction
وفقا "جمعية القلب الأمريكية" (2017)، توقف القلب (CA)--وفيات المستحث يحدث كل أربع دقائق، ويؤثر على أكثر من 400 ألف شخص سنوياً في الولايات المتحدة1. أنها موثقة توثيقاً جيدا أن كاليفورنيا يمكن أن يسبب إصابة في الدماغ الخلايا العصبية نتيجة لعدم كفاية الدم نضح2،،من34. تحدث إصابات الدماغ الناجمة عن CA في المنطقة الحساسة الاسكيمية CA1 الحصين5،،من67، التي تؤثر على الخلايا العصبية التي تعتبر هامة للتعلم والذاكرة8،9، 10،،من1112. وعلاوة على ذلك، فقدان كثافة العمود الفقري الجذعية، تحت ظروف الدماغية في قرن آمون (أي CA1 الخلايا العصبية)، يلعب دوراً حاسما في الذاكرة المكانية ضعف13،،من1415. بسبب هذه التغييرات المرضية بعد كاليفورنيا، الاضطرابات السلوكية مثل: القلق والاكتئاب، واضطراب الإجهاد اللاحق للصدمة النفسية، وفقدان الذاكرة أكثر انتشارا. على الرغم من أن هناك أوجه التقدم في التكنولوجيا الطبية (أي كفاءة الخدمات الإسعافية) التي ترتبط بتحسين معدلات البقاء على قيد الحياة في كاليفورنيا، تفشل معظم العلاجات محصن (باستثناء انخفاض حرارة الجسم) إلى تحسين النتائج الوظيفية بعد CA16 ،17. الناجين من كاليفورنيا عادة نوعية حياة فقراء، وهي مثقلة بالطبية الإضافية الإنفاق16.
تقييمات الحالة المعرفية الاسكيمية الدماغي عن طريق الاختبارات السلوكية مهمة لتحديد فعالية المخدرات على حد سواء، ووضع في نهاية المطاف تجربة سريرية ناجحة. في الأربعينات من القرن الماضي، صمم إدوارد تولمان أول محاكمة السلوك لدراسة الذاكرة المكانية على أساس الحصين18. وفي وقت لاحق، وضعت متاهات مختلفة (أي موريس المياه المتاهة، متاهة شعاعي، T أو Y-المتاهة، والمتاهة بارنز) لتقييم التعلم هيبوكامبال المكانية والذاكرة في الفئران19،،من2021،22 ،23. أحد الاختبارات السلوكية المستخدمة على نطاق واسع هو المتاهة المائية موريس، الذي يدرس المكاني التعلم والذاكرة في الفئران نماذج24. ومع ذلك، يتطلب المتاهة المائية موريس الفئران للسباحة وممارسة وظيفة كاملة موتور والتحكم. لتجارب الاسكيمية مثل نموذج أسفيكسيال سكتة قلبية (هيئة مكافحة الفساد، ونموذج الفئران من كاليفورنيا)، كانوليشن شريان فخذي/الوريد يطلب الحصول على ضغط الدم الحيوية وغازات الدم ومقدمة من المخدرات المختلفة. حيث يمكن أن تمنع cannulation شريان فخذي/المنوال التنقل الساق مما يجعل الفئران القدرة على السباحة بشكل صحيح، قد لا تكون متاهة المياه موريس الأكثر ملاءمة لاختبار الإعاقات الإدراكية تحت هيئة مكافحة الفساد.
المتاهة بارنز هو اختبار السلوكية الأخرى المستخدمة على نطاق واسع لدراسة التعلم المكانية والذاكرة في نماذج القوارض. لا تتطلب المتاهة بارنز كشفه من وظيفة كاملة موتور والتحكم، وهكذا أقل إرهاقاً من المتاهة المائية موريس. في الماضي، ونحن إجراء تجارب باستخدام المتاهة بارنز لتحديد إذا كان تحدث الاختلافات الوظيفية التعلم/الذاكرة بين عنصر التحكم أو الشام مقابل الفئران المستحثة بهيئة مكافحة الفساد. البيانات التي تم الحصول عليها للمتاهة بارنز لم يكن القرار لاختبار الإعاقات الإدراكية عقب خفيفة إلى معتدلة هيئة مكافحة الفساد يرجع ذلك إلى حقيقة أن المتاهة بارنز يستخدم على نطاق واسع لقياس مرجعية (طويلة الأجل) الذاكرة25،26، في حين العجز الناجم عن هيئة مكافحة الفساد عصبي أكثر ارتباطاً وثيقا بالعامل (قصيرة الأجل) الذاكرة27،،من2829،30 مما يدل على أن المتاهة بارنز أقل قابلة للاستمرار لتقييم وظيفة الذاكرة في هيئة مكافحة الفساد لدينا نموذج.
وهكذا وضعنا تمازي معدلة استخدام اختبار التناوب التلقائي لتقييم عامل الذاكرة (قصيرة الأجل) بعد هيئة مكافحة الفساد. اختبار التناوب التلقائي تمازي المعدلة والميزة الرئيسية هو بساطته والحد الأدنى من الإجهاد على الفئران مقارنة بغيرها من الاختبارات السلوكية يرجع ذلك إلى حقيقة أن تمازي المعدلة لا تتطلب تدريبا الحيوانية السابقة، كما جيدا كما الثقيلة الحسابية تحليل أو الروتين الفرعي (أي تصوير الفيديو من الفئران) كما هو مطلوب من المتاهة المائية موريس والمتاهة بارنز. هنا نظهر أن الاختبار التناوب التلقائي تمازي المعدلة هو نموذج تجريبي سلوكية بسيطة ولكن ذات كفاءة عالية يمكن أن توفر ما يكفي القرار بدقة لكشف وتقييم الدالة هيبوكامبال في الأمراض التي تسبب فقدان الذاكرة على المدى القصير (أي هيئة مكافحة الفساد).
Protocol
جميع الإجراءات التجريبية كانت تجري وفقا للمبادئ التوجيهية "المعاهد الوطنية للصحة" ووافقت عليه لجنة الاستخدام (مركز علوم الصحة LSU-شريفبورت) ورعاية الحيوان المؤسسية لاستخدام الذكور (الفئران "سبراغ داولي" 300-350 غ، 9-10 أسابيع من العمر). وقد صام الفئران بين عشية وضحاها قبل الجراحة هيئة مكافحة الفساد.
1-تمازي جهاز التصميم والإعداد
ملاحظة: يستند تصميم تمازي الشماس ورولنز 2006 النموذجي31.
- تصميم هيكل 3D المتاهة استخدام SketchUp32. لإنشاء بنية ثلاثية الأبعاد تمازي، بناء ذراع ابدأ مع على طول خارج من 200 ملم، والعرض من 165 ملم، وارتفاع 148 مم لتلائم أبعاد الطباعة للطابعة ثلاثية الأبعاد. استخدام سمك جدار 5.5 ملم وسمك 8 مم الكلمة.
- طباعة المتاهة باستخدام طابعة 3D (انظر الجدول للمواد)32. إذا لم يتوفر طابعة ثلاثية الأبعاد في المختبر، استخدام مواد أخرى مثل الخشب أو اللوح الليفي متوسط الكثافة، أو من بلاستيك (أي فينيل كلوريد)، والتي يمكن شراؤها من محلات تحسين المنزل.
- بسبب قيود الارتفاع في مجال الطباعة، بناء جدران المتاهة في طباعة 3D منفصلة اثنين ومعا لبناء المتاهة الجمعية (أي ارتفاع جدار ثاني أضيفت إلى المقطع المتاهة زيادة الارتفاع 140 ملم، لارتفاع جدار إجمالي 280 مم). كل قاعدة الطباعة 3D منفصلة الواردة "T" على شكل تأمين إليه، حيث توصيل مقطع واحد إلى التالي.
- تقاطع طرق الذراع ابدأ مع الأسلحة والهدف، قم بإنشاء مقطع 165 ملم واسعة الانضمام إلى عرض الذراع ابدأ بأن الأسلحة والهدف. بناء الأسلحة الهدف باستخدام طريقة تصميم مماثل كذراع ابدأ؛ ومع ذلك، تقليل عرض الذراع إلى 100 ملم في تصميم الشماس ورولنز.
- الرجاء انظر الشكل 1 التخطيطي المفصل/أبعاد تمازي.
- وتشمل قسم مركزي في تصميم تقاطع بداية الذراع والذراعين الهدف. توسيع هذا القسم من الجدار الخلفي من تمازي و 200 ملم في الذراع ابدأ بتقسيم الأسلحة الهدف. توسيع هذا القسم أيضا ارتفاع المتاهة (الشكل 1).
2-سكتة قلبية أسفيكسيال (ACA)
- اﻷوتوكﻻف الجراحية أدوات (121 درجة مئوية لمدة 15 دقيقة) قبل البدء بعملية جراحية. تطهير الجدول الجراحية من الإيثانول 70% عن 15 دقيقة للحلاقة الشعر الحيواني في موقع الجراحة. تطبيق حل تدين للجلد الأسطح لعملية جراحية.
- أنيسثيتيزيشن
- تخدير الفئران مع 4% إيسوفلوراني و 30:70 مزيج من س2 ن2س (300 مل/دقيقة س2 و 700 مل/دقيقة ن2س) عبر قناع.
- إعطاء الجرذان التنبيب داخل الرغامى للتهوية الميكانيكية (بعد التنبيب، كانت متصلة الفئران إلى جهاز التنفس الصناعي).
- المحافظة على التخدير بتخفيض إيسوفلوراني من 4 في المائة إلى 2 في المائة مع خليط 30:70 س2 و N2O. استخدام الأسلوب قرصه-استجابة لتحديد عمق التخدير.
- تطبيق مرهم على العينين لمنع جفاف بينما تحت التخدير. ريجل درجة حرارة الجسم قبل القوارض تدفئة وسادة مع تحقيقا الشرج كمرجع لدرجة حرارة.
- التنبيب داخل الرغامى
- وضع الفئران في قاعة التعريفي. تخدير الفئران مع مزيج isoflurane و 30:70 4% من س2 و N2o.
- إزالة الفئران من قاعة التعريفي. مكان تخديره من الحيوان في موقف ضعيف مع الوجه للفئران نحو قناع التخدير.
- تحرك اللسان نحو اليمين أو اليسار للحيوان بالإبهام الأيمن والسبابة أما بلطف.
- تنزلق قسطرة الوريدية مرنة 14-قياس (49 مم طوله) على إبرة قياس 17 نصيحة كليلة بيبيتينج (93 مم-طويلة بزاوية 10-درجة في تلميح للابرة). أدخل إبرة بيبيتينج 17-قياس نصيحة فظة في القصبة الهوائية.
- بلطف سحب الإبرة بيبيتينج 17-قياس من القصبة الهوائية. قم بتوصيل محور القسطرة 14-قياس التنفس الصناعي. ضبط حجم السكتة الدماغية التنفس الصناعي إلى 0.67 مل/100 غرام، ومعدل التنفس للأنفاس في الدقيقة 60.
- الحفاظ على درجة حرارة الرأس والجسم عند 37 درجة مئوية خلال الإجراء بأكمله من القوارض تدفئة وسادة مع المسبار الشرجي كمرجع لدرجة حرارة.
- القسطرة الوريدية والشريانية فخذي
- حلاقة الشعر قرب منطقة الاربية (جانبي) وتطبيق تدين للجلد الأسطح لعملية جراحية.
- وضعت الفئران في موقف ضعيف. جعل شق (10 مم) في منطقة الاربية مع المقص الجراحي.
- فصل النسيج الضام بالملقط تلميح غير حادة حتى يتم كشفها في الرباط الآربي. استخدام هيموستات لفهم الرباط الآربي. فخذي الشريان والوريد تحت الرباط الآربي.
- استخدام الملقط تلميح غير حادة لفصل النسيج الضام حتى يتعرض فخذي الشريان والوريد.
- بلطف منفصلة على فخذي العصب الذي يمتد على طول شريان فخذي عن طريق الملقط تلميح جيد. فصل شريان فخذي والوريد كوحدة عن طريق الملقط تلميح جيد بعناية.
- استخدام الملقط تلميح جيد لفصل شريان فخذي من هذا السياق.
- ضع 2 قطعة من 5-0 الحرير خياطة (واحد نحو ساقه والآخر نحو الجسم) ضمن هذا السياق.
- قرانهما فضفاضة على الجانب القرب من الجسم. استخدام هيموستات لعقد وسحب خياطة قدر الإمكان نحو متقابلين من الجسم.
- قرانهما فضفاضة على الجانب قرب المحطة. عقد وسحب الخياطة نحو الساق عبر هيموستات للسماح الوريد لملء مع الدم.
- جعل شق صغير في الوريد (حوالي 0.1 ملم) بواسطة مقص تشريح الصغرى (بزاوية 45 درجة). امتصاص أي الدم مع شاش معقم.
- إرفاق حقنه إبرة نصيحة كليلة (مليئة بالمياه المالحة مع 20 يو/مليلتر الهيبارين) قسطرة PE-50. شغل القسطرة PE-50 مع المحلول الملحي مع 20 يو/مليلتر الهيبارين. قطع القسطرة PE-50 مع مقص التشريح بزاوية 45 درجة إنشاء نقطة أو حادة نهاية. استخدام الملقط نصيحة فظة لعقد نهاية القسطرة PE-50. برفق إدراج القسطرة PE-50 في الوريد الفخذي.
- بعد أن يتم إدخال القسطرة تماما، ببطء إدارة 0.1 مل من الهيبارين/المالحة التأكد من أنه لا يوجد أي تسرب. شركة خياطة عقده (عقده واحدة) لتثبيت القسطرة PE-50 التعادل. تبقى القسطرة PE-50 لاستمرار الحقن (رابعا) من المخدرات المختلفة.
- استخدام حقنه 1 مل متصلة مع 23 قياس محول كعب روتين نظام إدارة بروميد vecuronium (0.67 مغ/كغ، يدير كل 10 دقائق) عن طريق الوريد الفخذي شل الفئران طوال فترة الإجراءات.
- ضع 2 قطعة من 5-0 الحرير خياطة (واحد نحو ساقه والآخر نحو الجسم) تحت الشريان.
- قرانهما فضفاضة على الجانب قرب المحطة. استخدام هيموستات لعقد وسحب خياطة قدر الإمكان نحو الساق.
- قرانهما فضفاضة على الجانب القرب من الجسم. عقد وسحب الخياطة نحو الجسم عبر هيموستات السماح للشريان لملء مع الدم.
- جعل شق صغير بالشريان (حوالي 0.1 ملم) بواسطة مقص تشريح الصغرى (بزاوية 45 درجة).
- إرفاق حقنه إبرة نصيحة كليلة (مليئة بالمياه المالحة مع 20 يو/مليلتر الهيبارين) قسطرة PE-50. شغل القسطرة PE-50 مع المحلول الملحي مع 20 يو/مليلتر الهيبارين. قطع القسطرة PE-50 مع مقص التشريح بزاوية 45 درجة لخلق وضع نهاية نقطة أو حادة. استخدام الملقط نصيحة فظة لعقد نهاية القسطرة PE-50. استخدام الملقط نصيحة فظة لعقد نهاية القسطرة PE-50. برفق إدراج PE-50 القسطرة في شريان فخذي.
- بعد أن يتم إدخال القسطرة تماما، رسم ببطء إلى الوراء المحاقن للتأكد من أن القسطرة الوظيفية. شركة خياطة عقده (عقده واحدة) لتثبيت القسطرة PE-50 التعادل. تبقى القسطرة PE-50 للتسجيل المستمر للغازات، وضغط الدم الشرياني.
- أسفيكسيال "سكتة قلبية" (ACA) الداخلي
- ضبط المعلمات الفسيولوجية (أي ص2، pCO2، وضغط الدم، وقيمة pH) حسب الحاجة بتحوير حجم السكتة الدماغية، س2 أو مستويات2س ن. استخدام نطاقات الفسيولوجية طبيعية لهذه المعلمات: ص2: 100 ملم زئبق، pCO2: 35-40 مم زئبق، وضغط الدم: 100 ملم زئبق، ودرجة الحموضة: 7.4.
- استخدام حقنه 1 مل متصلة بمحول قياس 23 كعب روتين نظام إدارة بروميد vecuronium (0.67 مغ/كغ، رابعا) عن طريق الوريد الفخذي وانتظر 2 دقيقة تأكد من أن ضغط الدم في أو حوالي 100 مم زئبق قبل أداء هيئة مكافحة الفساد.
- حمل انقطاع النفس (6 دقيقة) بقطع الأنبوب داخل الرغامى (14-قياس محور القسطرة) التنفس الصناعي. كذلك حظر أنبوب داخل الرغامى بحقنه 1 مل لضمان توقف التنفس أثناء إكمال.
ملاحظة: وقت الاختناق 6-مين يعرف الفترة ما بين انقطاع التنفس الصناعي وبداية للإنعاش. ويعرف سكتة قلبية كاملة يعني ضغط الشرياني أقل من 10 ملم زئبق. - خلال دقيقة الأخيرة لانقطاع النفس، ضبط معدل التنفس للتنفس إلى 80 نفسا بالدقيقة، وزيادة س2 إلى 2 لتر في الدقيقة مع 0% N2o. هذا الإجراء سوف تفجير أي isoflurane المتبقية أو ن2س المتبقية في التنفس الصناعي.
- دقيقة بعد انقطاع النفس، إزالة حقنه 1 مل من أنبوب داخل الرغامى. أنبوب داخل الرغامى للتنفس الصناعي من إعادة الاتصال.
- استخدام حقنه 1 مل متصلة مع 23 قياس محول كعب روتين نظام إدارة أدرينالين (0.005 ملغ/كغ، رابعا) عن طريق الوريد الفخذي وإدارة الضغط الصدر اليدوي بالإبهام، والفهرس، والأوسط الأصابع على الصدر للحيوان في حركة دائرية خفيفة على x و محور ع (200/دقيقة) حتى عودة الدورة الدموية التلقائية (متوسط الضغط الشرياني ≥ 50 مم زئبق)33،34،35.
- استخدام آخر 1 مل حقنه متصلة مع 23 قياس محول كعب روتين نظام إدارة بيكربونات الصوديوم (1 meq/كغ، رابعا) عن طريق الوريد فخذي فورا بعد عودة الدورة الدموية التلقائية (50 ملم زئبق أو أعلى)3433،، 35 للتخفيف من حدة الحماض التنفسي.
- الدم قياس الغازات مرة أخرى 10 دقيقة بعد الإنعاش لتحديد وضع حمض-قاعدة (pH بعد هيئة مكافحة الفساد ينبغي أن تكون حوالي 7.35 إلى 7.40)
- استخدام هيموستات المشبك فخذي الشريان والوريد. ببطء لطف إزالة القسطرة الوريدية والشريانية استخدام الملقط تلميح غير حادة. سد شريان فخذي/الوريد مع خياطة حرير 5-0 منع النزيف. إغلاق الجلد تغمر الموقع الجراحي باستخدام خياطة حرير 3-0. استخدم الأسلوب سوتورينج توقف لتقليل احتمالات إعادة فتح الجرح.
- انتظر حتى الفئران يتنفس نفسها (عادة 30 دقيقة إلى 60 دقيقة بعد الإنعاش) وقطع الفئران من التنفس الصناعي وإزالة أنبوب داخل الرغامى بلطف.
- مكان الفئران في حاضنة الرضيع (27 درجة مئوية، والرطوبة 50%) بين عشية وضحاها. ضع الغذاء خففت (أدلى به مغطس لهم في الماء) والمياه إلى حاضنة طفل بين عشية وضحاها.
- نقل الفئران إلى القفص الفردية وتعود الفئران إلى مرفق الحيوان مع تشو العادية والمياه. بدء اختبارات تمازي 3 أيام بعد هيئة مكافحة الفساد.
3-تمازي
-
إعداد الحيوانات
- قبل يوم من الجراحة (الشام أو هيئة مكافحة الفساد)، التعامل مع كل الفئران لمدة 5 دقائق. ابدأ رفع الفئران من قفص بهم (480 ملم × 250 مم × 200 مم، قفص بلاستيكية شفافة) عند التعامل مع (الشكل 2).
- بعد التعامل مع الفئران، بلطف التقاط الفأر من ذيله مع يد واحدة مع غيرها من ناحية دعم لها ' الساقين. السماح لهم بالانتقال من ناحية إلى القفص (100 مم ارتفاع) 5 مرات. فصل كل الفئران في أقفاص فردية، حيث أنها لا تسيطر على للأغذية و/أو الحرب.
- نقل صورية أو جراحة هيئة مكافحة الفساد (الشكل 2)، وبعد ثلاثة أيام على الفئران مع القفص في غرفة هادئة ومظلمة قبل بدء التشغيل الأول. فقط قم بتشغيل مصباح مكتب طاقة منخفضة ووضعه في ركن غرفة الاختبار للحفاظ على الحد الأدنى من الإضاءة. السماح للفئران للتكيف مع الظلام لمدة 10 دقائق.
- إجراء جميع التجارب في فترة ما بعد الظهر لتجنب أي آثار الدافيء التباين في الأداء لدى الفئران. لا ننصح المشغل على الفئران التي تلقت شام أو جراحة هيئة مكافحة الفساد التي.
-
التناوب التلقائي
- انتشار طبقة رقيقة من الفراش (~ 10 مم) لتغطية الطابق بأكمله من المتاهة. ثم مكان الفئران في بداية الذراع (أسفل "T")، الذي هو نقطة الانطلاق لكل تشغيل، وإتاحة الفرصة أمام كل فأر 3 دقيقة لاستكشاف في الذراع الأيمن أو الأيسر والهدف.
- متى يلزم الفئران بذراع هدف معين (جميع آثار أقدام أربعة من الفئران قد دخلت الذراع الهدف)، كتلة "T" تقاطع بين بداية الذراع والذراع الهدف المتعارضة (الشكل 1) لمنع الفئران من دخول الذراع الأهداف المتعارضة. ترك الفئران في المتاهة لمدة 30 ثانية، ثم التقاط الفئران ووضعه مرة أخرى في قفصة لمدة الحد أدنى (~ 30 ثانية). قم بإزالة الوصلات "T" كتلة (125 ملم × 230 مم X 65 مم، أدلى به طابعة ثلاثية الأبعاد) من تمازي.
- وضع الفئران في الذراع ابدأ وكرر 3.2.2. يعرف التناوب: عندما يدخل الفئران الذراع المعاكس بالمقارنة مع السابق تشغيل36. لدى الفئران أداء يدير 4 يوميا على النحو التالي:
1شارع تشغيل
تشغيل 2nd
10-دقيقة استراحة
تشغيل 3rd
تشغيل 4th - تغيير الفراش خلال فترة الاستراحة 10-دقيقة وبين الحيوانات للقضاء على التحيز رائحة. تنظيف في تمازي مع الإيثانول 75% تليها الماء المقطر في نهاية كل يوم التجريبية.
- كرر الخطوات من 3.2.1. -3.2.4. لمدة يومين آخرين (يعمل 12 في المجموع) كما في الشكل 2.
-
وتناوب معدل والجانب حسابات معدل التفضيل
- حساب النسبة المئوية التناوب و % "تفضيل الجانب"، حيث
L: اختر الفئران في الذراع الأيسر
R: الفئران اختيار الذراع الأيمن
تصحيح الاختيار: 2nd تشغيل يختلف عن 1st في مجموعة معينة (كل مجموعة تحتوي على دورتين كاملتين)
خيار غير صحيحة: الفئران اختر نفس الذراع مماثلة لتشغيل سابقة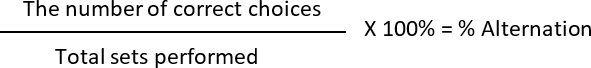
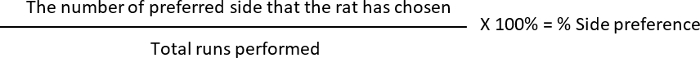
على سبيل المثال:
يوم 1: L L/L L
يوم 2: L L/L R
يوم 3: R L/L L
تناوب: 2 (الاختيارات الصحيحة) 6 (مجموعات مجموع المنجز) * 100 = 33.33%
تفضيل الجانب: 10 (ل، الجانبية المفضل) 12 (مجموع تشغيل إجراء) * 100 = 83.33%
- حساب النسبة المئوية التناوب و % "تفضيل الجانب"، حيث
-
الرعاية اللاحقة للعمليات الجراحية:
- إعطاء الجرذان البوبرينورفين (IP 0.01 مغ/كغ) كل ح 12 لمدة يومين بعد الجراحة. مراقبة الفئران ليصل إلى 1 ساعة بعد السكتة القلبية.
- إرفاق الفئران للتنفس الصناعي وتدفئة وسادة حتى قد وعيه كافية للحفاظ على ريكومبينسي القصية. للحفاظ على درجة حرارة جسم الحيوان بعد الجراحة، وضع الفئران في حاضنة رضيع (تعيين في 27 درجة مئوية، والرطوبة 50%).
- توفير خففت تشاو (أدلى به مغطس في الماء) للحيوانات ل 24 ساعة الأولى بعد العملية الجراحية. إذا على الفئران لم تكن مياه الشرب، إدارة المياه المالحة والاريثروسين (100 مل/كغ/يوم، القائمة) حتى يسترد الحيوان وهو مياه الشرب بحرية.
- تعطي المضادات الحيوية الموضعية الفئران مع تخفيف الألم (مرهم باسيتراسين وليدوكائين) في جميع الجروح. نقل الفئران مرة أخرى إلى مرفق الحيوان بعد ما يتعافى تماما.
-
أسلوب القتل الرحيم
- استخدام isoflurane 5% و 100% N2س euthanize الحيوانات في نهاية التجربة.
النتائج
هيئة مكافحة الفساد (الاسكيمية الدماغي العالمية) يسبب أساسا العمل28،العجز في الذاكرة (قصيرة الأجل)29. تقييم الدالة للتعلم والذاكرة بعد هيئة مكافحة الفساد، استخدمنا اختبار التناوب عفوية المعدلة لتقييم عمل الذاكرة (قصيرة الأجل)30....
Discussion
تم إجراء تعديلات في هذه الدراسة بالمقارنة مع الشماس ورولنز بروتوكول31. تم استخدام الطابعة ثلاثية الأبعاد لبناء تمازي. 3D-الطباعة يوفر بدائل تمازي تجارياً بأسعار معقولة وفعالة من حيث التكلفة. للحد من الفئران للقلق أثناء الاختبار، أنجز في تمازي في غرفة مظلمة مع الحد الأدنى من ال?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وأيد هذا العمل بالوطنية معاهد للصحة الوطنية "المعهد للاضطرابات العصبية" والسكتة الدماغية منح 1R01NS096225-01A1، "جمعية القلب الأمريكية" منح اها-13SDG1395001413، 17GRNT33660336 اها اها-17POST33660174، ولاية لويزيانا منحة جامعة الدولة في مجلس البحوث المعونة، مالكولم موشي القلب والأوعية الدموية أبحاث الزمالة، ومعهد الدماغ ماكنايت إيفلين واو.
Materials
| Name | Company | Catalog Number | Comments |
| 3D Printer | MakerBot | Replicator | Fifth generation |
| 3D Printer Filament | Hatchbox | PLA, 1.75 mm filament diameter | |
| 200 Proof Pure Ethanol | Koptec | V1005SG | |
| Sani-Chips | PJ Murphy-Forest Products | Size: 8 to 20 mesh; 2.2 cubic foot/package; autoclavable bags | |
| Rat | Charles River Laboratories | Sprague-Dawley | |
| Vecuronium bromide | Sun Pharmaceutical | 47335-931-40 | 10 mg |
| Epinephrine | Par Pharmaceutical | 42023-103-01 | Adrenalin Chloride Solution 1 mg/mL, 1:1000 |
| Buprenorphine Hydrochloride Injection | Pfizer | 00409-2012-32 | 0.3mg/mL |
| SketchUp | Trimble Inc. | 3D modeling software | |
| VentElite Small Animal Ventilator | Harvard Apparatus | 55-7040 | Animals raging in size from mouse to guinea pig (10g to 1kg) |
| PowerLab 8/35 | Adinstruments | PL3508 | 8 analog input channels – 4 of which can be used in differential mode. |
| Bio Amps | Adinstruments | FE132 | The Bio Amp is a galvanically isolated, high-performance differential bio amplifier optimized for the measurement of a wide variety of biological signals such as ECG, EMG and EEG recordings. |
| Quad Bridge Amp | Adinstruments | FE224 | A four-channel, non-isolated bridge amplifier designed to allow the PowerLab to connect to most DC bridge transducers. |
| LabChart 8 | Adinstruments | ||
| ABL80 FLEX CO-OX blood gas analyzer | Radiometer | pH / p CO2 / p O2 | |
| SURFLO Teflon I.V. Catheter | Terumo | sc-361556 | Only use the flexible thin wall catheter (49-mm long) |
| Pipet/Infusion Needle | Hamilton | 7748-03 | 17-gauge; 93-mm long; 10-degree angle |
| Classic T3 Vaporizer | SurgiVet | VCT302 | Classic T3 Isoflurane Funnel Fill |
| ENVIRO-PURE Charcoal Canister | SurgiVet | 32373B10 | Designed to absorb waste anesthetic gas |
| O2 single flowmeter | SurgiVet | 32375B1 | 0-1000 mL |
| N2O Flowmeter | VetEquip | 401721 | 0-4LPM |
| Clay Adams Intramedic Luer-Stub Adapter (Sterile) | Becton Dickinson | 427565 | 23 gauge |
| Micro Forceps | Black and Black surgical | B3FRC-18 RM-8 | 7 1/4" (18 cm), 8mm RH, counterweight w/ guide pin 2mm, platform 6 x .3 mm, curved. |
| Halstead Mosquito Forceps | Roboz | RS-7111 | Curved; 5" Length, 1.3 mm tip diameter, 2.1 mm jaw width |
| Mixter Forceps | Roboz | RS-7291 | 5.25" Curved Extra Delicate, 1.1 mm tips |
| Castroviejo Micro Dissecting Spring Scissors | Roboz | RS-5650 | Straight, Sharp Points; 9 mm Cutting Edge; 0.15 mm Tip Width; 3 1/2" Overall Length |
| Mayo-Stille Scissors | Roboz | RS-6891 | 5.5" Round Curved |
| Dumont #5 Forceps | Roboz | RS-5058 | 45 Deg Dumoxel Tip Size .10 x .06 mm |
| Olsen-Hegar Combination Scissor And Needle Holder | Roboz | RS-7884 | Cross Serration Tip; 5.5" Length |
| Moloney Forceps | Roboz | RS-8254 | Serrated; Slight Curve; 4.5" Length |
References
- Writing Group, M., et al. Heart Disease and Stroke Statistics-2016 Update: A Report From the American Heart Association. Circulation. 133, e38-e360 (2016).
- Beuret, P., et al. Cardiac arrest: prognostic factors and outcome at one year. Resuscitation. 25, 171-179 (1993).
- Kim, Y. J., et al. Long-term neurological outcomes in patients after out-of-hospital cardiac arrest. Resuscitation. 101, 1-5 (2016).
- Earnest, M. P., Yarnell, P. R., Merrill, S. L., Knapp, G. L. Long-term survival and neurologic status after resuscitation from out-of-hospital cardiac arrest. Neurology. 30, 1298-1302 (1980).
- Cerchiari, E. L., Safar, P., Klein, E., Cantadore, R., Pinsky, M. Cardiovascular function and neurologic outcome after cardiac arrest in dogs. The cardiovascular post-resuscitation syndrome. Resuscitation. 25, 9-33 (1993).
- Petito, C. K., Feldmann, E., Pulsinelli, W. A., Plum, F. Delayed hippocampal damage in humans following cardiorespiratory arrest. Neurology. 37, 1281-1286 (1987).
- Schmidt-Kastner, R., Freund, T. F. Selective vulnerability of the hippocampus in brain ischemia. Neuroscience. 40, 599-636 (1991).
- Corkin, S. What's new with the amnesic patient H.M.?. Nat Rev Neurosci. 3, 153-160 (2002).
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. 1957. J Neuropsychiatry Clin Neurosci. 12, 103-113 (2000).
- Smith, T. D., Calhoun, M. E., Rapp, P. R. Circuit and morphological specificity of synaptic change in the aged hippocampal formation. Neurobiol Aging. 20, 357-358 (1999).
- Gage, F. H., Dunnett, S. B., Bjorklund, A. Spatial learning and motor deficits in aged rats. Neurobiol Aging. 5, 43-48 (1984).
- Tulving, E., Markowitsch, H. J. Episodic and declarative memory: role of the hippocampus. Hippocampus. 8, 198-204 (1998).
- Neigh, G. N., et al. Cardiac arrest with cardiopulmonary resuscitation reduces dendritic spine density in CA1 pyramidal cells and selectively alters acquisition of spatial memory. Eur J Neurosci. 20, 1865-1872 (2004).
- Volpe, B. T., Davis, H. P., Towle, A., Dunlap, W. P. Loss of hippocampal CA1 pyramidal neurons correlates with memory impairment in rats with ischemic or neurotoxin lesions. Behav Neurosci. 106, 457-464 (1992).
- Astur, R. S., Taylor, L. B., Mamelak, A. N., Philpott, L., Sutherland, R. J. Humans with hippocampus damage display severe spatial memory impairments in a virtual Morris water task. Behav Brain Res. 132, 77-84 (2002).
- Lee, R. H., et al. Fatty acid methyl esters as a potential therapy against cerebral ischemia. OCL. 23, D108 (2016).
- Lee, R. H., Porto, L. F., et al. Chapter 1. Palmitic acid: occurrence, biochemistry and health effects. , 1-15 (2014).
- Tolman, E. C., Gleitman, H. Studies in spatial learning; place and response learning under different degrees of motivation. J Exp Psychol. 39, 653-659 (1949).
- Koopmans, G., Blokland, A., van Nieuwenhuijzen, P., Prickaerts, J. Assessment of spatial learning abilities of mice in a new circular maze. Physiol Behav. 79, 683-693 (2003).
- Barnes, C. A. Memory deficits associated with senescence: a neurophysiological and behavioral study in the rat. J Comp Psychol. 93, 74-104 (1979).
- Paul, C. M., Magda, G., Abel, S. Spatial memory: Theoretical basis and comparative review on experimental methods in rodents. Behav Brain Res. 203, 151-164 (2009).
- Vorhees, C. V., Williams, M. T. Assessing spatial learning and memory in rodents. ILAR J. 55, 310-332 (2014).
- Sharma, S., Rakoczy, S., Brown-Borg, H. Assessment of spatial memory in mice. Life Sci. 87, 521-536 (2010).
- Poon, T. P., et al. Spinal cord toxoplasma lesion in AIDS: MR findings. J Comput Assist Tomogr. 16, 817-819 (1992).
- Sunyer, B., Patil, S., Höger, H., Lubec, G. Barnes maze, a useful task to assess spatial reference memory in the mice. Nat Protoc. 390, (2007).
- Shoji, H., Hagihara, H., Takao, K., Hattori, S., Miyakawa, T. T-maze forced alternation and left-right discrimination tasks for assessing working and reference memory in mice. J Vis Exp. , (2012).
- Seeger, T., et al. M2 muscarinic acetylcholine receptor knock-out mice show deficits in behavioral flexibility, working memory, and hippocampal plasticity. J Neurosci. 24, 10117-10127 (2004).
- Olton, D. S., Feustle, W. A. Hippocampal function required for nonspatial working memory. Exp Brain Res. 41, 380-389 (1981).
- Hayashida, K., et al. Hydrogen inhalation during normoxic resuscitation improves neurological outcome in a rat model of cardiac arrest independently of targeted temperature management. Circulation. 130, 2173-2180 (2014).
- Dember, W. N., Richman, C. L. . Spontaneous alternation behavior. , (1989).
- Deacon, R. M., Rawlins, J. N. T-maze alternation in the rodent. Nature protocols. 1, 7-12 (2006).
- Wong, K. V., Hernandez, A. A review of additive manufacturing. ISRN Mechanical Engineering. 2012, (2012).
- Lin, H. W., et al. Derangements of post-ischemic cerebral blood flow by protein kinase C delta. Neuroscience. 171, 566-576 (2010).
- Lin, H. W., et al. Fatty acid methyl esters and Solutol HS 15 confer neuroprotection after focal and global cerebral ischemia. Transl Stroke Res. 5, 109-117 (2014).
- Lee, R. H., et al. Interruption of perivascular sympathetic nerves of cerebral arteries offers neuroprotection against ischemia. Am J Physiol Heart Circ Physiol. 312, H182-H188 (2017).
- Bali, Z. K., et al. Differential effects of alpha7 nicotinic receptor agonist PHA-543613 on spatial memory performance of rats in two distinct pharmacological dementia models. Behav Brain Res. 278, 404-410 (2015).
- McDonald, J. H. . Handbook of biological statistics. 2, (2009).
- Castellano, M. A., Diaz-Palarea, M. D., Rodriguez, M., Barroso, J. Lateralization in male rats and dopaminergic system: evidence of right-side population bias. Physiol Behav. 40, 607-612 (1987).
- Andrade, C., Alwarshetty, M., Sudha, S., Suresh Chandra, J. Effect of innate direction bias on T-maze learning in rats: implications for research. J Neurosci Methods. 110, 31-35 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved