需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
应用改良 T 迷宫评估心脏骤停后的功能记忆结果
摘要
本协议描述了使用一个改进的 T 迷宫评估功能学习/记忆在窒息心脏停搏诱发脑缺血。
摘要
背景: 评估轻度到中度认知损害在全球脑缺血 (即心脏骤停) 模型可能是困难的, 因为在手术后运动不良。例如, 接受外科手术的大鼠和莫里斯水迷宫可能无法游泳, 从而使实验无效。
新方法: 建立了改进的行为自发交替 T 迷宫试验。修改后的 T 迷宫协议的主要优点是它的相对简单的设计, 是强大到足以评估功能学习/记忆后缺血。此外, 数据分析简单明了。我们使用 T 迷宫来确定在轻度到中度 (6 分钟) 窒息心跳骤停 (ACA) 时, 老鼠的学习/记忆力缺陷。大鼠有一个自然的勘探倾向, 并将探索在 T 迷宫的替代武器, 而海马损伤大鼠倾向于采取侧偏爱, 导致减少自发交替率, 揭示海马相关功能性学习/记忆在存在或缺席 ACA。
结果: ACA 组有较高的侧偏爱比和较低的交替对照。
与现有方法比较: 莫里斯水和巴恩斯迷宫在评估学习/记忆功能方面更为突出。然而, 莫里斯水迷宫比其他迷宫更有压力。巴恩斯迷宫被广泛用于测量参考 (长期) 记忆, 而 ACA 诱发的认知赤字则与工作 (短期) 记忆更密切相关。
结论: 我们已经制定了一个简单的, 但有效的策略来描绘工作 (短期) 记忆通过 T 迷宫在我们的全球脑缺血模型 (ACA)。
引言
根据美国心脏协会 (2017), 心脏骤停 (CA) 导致的死亡率每四分钟发生一次, 在美国每年影响超过40万人1。据记载, 由于血液灌注不足2,3,4, CA 可能导致神经元脑损伤。CA 诱发的脑损伤发生在海马的缺血敏感的 CA1 区5,6,7, 影响对学习和记忆至关重要的神经元8,9, 10、11、12。此外, 在海马 (即 CA1 神经元) 缺血条件下, 树突状脊柱密度的丧失在空间记忆损伤中起着重要作用13,14,15。由于这些病理变化的 CA, 行为障碍, 如: 焦虑, 抑郁症, 创伤后应激障碍和记忆丧失更普遍。尽管在医疗技术 (即有效的门诊服务) 方面取得了进步, 与提高的钙存活率相关, 但大多数的神经保护治疗 (低温除外) 在 ca 16 之后无法改善功能结果 ,17。CA 幸存者的生活质量通常很差, 并且背负着增加的医疗开支16。
通过行为测试对脑缺血的认知状态评估是重要的, 以确定药物疗效和最终发展成功的临床试验。在二十世纪四十年代, 爱德华托尔曼设计了第一个行为试验研究 hippocampus-based 空间记忆18。随后, 开发了不同的迷宫 (如莫里斯水迷宫、径向迷宫、T 或 Y 迷宫和巴恩斯迷宫) 来评估大鼠的 hippocampal-based 空间学习和记忆19,20,21,22 ,23。一个更广泛使用的行为测试是莫里斯水迷宫, 它检查空间学习和记忆在大鼠模型24。然而, 莫里斯水迷宫需要大鼠游泳和发挥充分的运动功能和控制。对于缺血实验, 如窒息心脏骤停 (ACA, 大鼠模型的钙) 模型, 需要插管股动脉/静脉, 以获得重要的血压, 血液气体和引进各种药物。由于股动脉/静脉插管可以抑制腿部移动, 使大鼠的游泳能力正常, 莫里斯水迷宫可能不是最适合测试认知损伤的 ACA。
巴恩斯迷宫是另一个被广泛使用的行为测试, 用来检查啮齿动物模型中的空间学习和记忆。巴恩斯迷宫不需要充分发挥马达功能和控制, 因此比莫里斯水迷宫的压力更小。在过去, 我们使用巴恩斯迷宫来进行实验, 以确定在控制或假与 ACA 诱导的大鼠之间是否发生功能性学习/记忆差异。由于巴恩斯迷宫广泛用于测量参考 (长期) 内存25,26, 而为巴恩斯迷宫所获得的数据并没有在轻度到中度 ACA 之后测试认知损伤的决心, 而aca 引起的认知缺陷与工作 (短期) 内存27、28、29、30有关, 这表明巴恩斯迷宫在我们的 aca 中评估内存功能是不可行的。模型.
因此, 我们开发了一个改进的 T 迷宫使用自发交替测试, 以评估工作 (短期) 记忆后 ACA。改进的 t 迷宫自发交替试验的主要优点是它的简单性和最小的压力, 与其他行为测试相比, 由于修改的 t 迷宫不需要事先的动物训练, 以及重计算根据莫里斯水迷宫和巴恩斯迷宫的要求, 分析或程序 (即大鼠的视频成像)。在这里我们表明, 改进的 T 迷宫自发交替试验是一个简单而高效的行为试验范例, 可以提供足够的分辨率, 以准确地检测和评价海马功能的疾病, 造成短期记忆丧失(即 ACA)。
研究方案
所有实验程序都是按照国家卫生研究院的指导方针进行的, 并得到机构动物保育和使用委员会 (路易斯安那州立会健康科学中心-什里夫波特) 的批准, 用于雄性大大鼠的使用 (300-350 克, 9-10 周大)。大鼠在 ACA 手术前一夜禁食。
1. 迷宫设备的设计与设置
注: 在执事和罗的2006模型31上的 T 迷宫设计基础。
- 利用之32设计迷宫的3D 结构。要创建 T 型迷宫的3D 结构, 请构造一个外部长度为 200 mm、宽度为 165 mm 和高度 148 mm 的起始臂, 以适应3D 打印机的打印尺寸。使用壁厚5.5 毫米, 地板厚度为8毫米。
- 使用3D 打印机打印迷宫 (请参阅材料表)32。如果实验室中没有3D 打印机, 请使用其他材料, 如木材、中密度纤维板或塑料 (即聚氯乙烯), 可以从家居改善商店购买。
- 由于高度限制在打印区域, 构造迷宫的墙壁在二个分开的3D 印刷品并且一起在迷宫汇编 (即, 第二个墙壁高度被增加到迷宫部分增加高度由140毫米, 为总墙壁高度280毫米)。每个独立的3D 打印基座包含一个 "T" 形锁定机构, 其中一个部分连接到下一个。
- 在起点胳膊的连接点与目标胳膊, 创造一个165毫米宽部分加入开始胳膊的宽度与目标胳膊的那。用类似的设计方法作为启动臂来构造目标臂;但是, 根据执事和罗的设计, 将手臂的宽度减小到100毫米。
- 有关 T 形迷宫的详细示意图/维度, 请参见图 1 。
- 在开始臂和目标臂的接合处包括一个中心分区到设计中。从 T 迷宫和200毫米的后壁扩展这个分区到开始胳膊划分目标胳膊。此分区还扩展了迷宫的高度 (图 1)。
2. 窒息心脏骤停 (ACA)
- 高压釜手术工具 (121 ° c 为15分钟) 在开始手术之前。用70% 的乙醇消毒手术表15分钟, 在手术现场刮毛动物毛发。将控告溶液应用于皮肤表面进行外科手术。
- 麻醉
- 麻醉大鼠与4% 异氟醚和30:70 混合物 o2和 N2o (300 毫升/分钟 o 2 和700毫升/分钟 n 2O) 通过面具。
- 给大鼠气管插管进行机械通气 (插管后, 大鼠与呼吸机连接)。
- 通过将异氟醚降低4% 到 2%, 用30:70 混合物 o2和 N2来维持麻醉, 使用捏响应法确定麻醉深度。
- 将药膏涂抹在眼部, 防止麻醉时干燥。Regulae 的体温由啮齿动物加热垫和肛门探针作为温度参考。
- 气管插管
- 把老鼠放在感应室里。麻醉4% 异氟醚和30:70 混合 o2和 N2o 的大鼠。
- 从感应室取出老鼠将麻醉动物置于仰卧位, 将鼠脸朝向麻醉面罩。
- 用左手拇指和食指轻轻地向动物的左边或右边移动舌头。
- 滑行一个14口径的挠性静脉导管 (49 毫米长) 超过17口径钝尖移针 (93 毫米长, 在针的尖端10度角)。将17口径钝尖移针插入气管。
- 从气管轻轻拉出17口径的移针。将14针导管中枢连接到呼吸器。调整呼吸机冲程容积为 0.67 mL/100 g, 呼吸率60呼吸/分钟。
- 在整个过程中, 将头部和体温保持在37° c, 由啮齿动物加热垫以肛门探针作为温度参考。
- 股动脉和静脉插管
- 在腹股沟附近 (两侧) 剃毛, 并将控告到皮肤表面进行手术。
- 把老鼠放在仰卧位。用手术剪刀在腹股沟区做一个切口 (10 毫米)。
- 用钝尖钳分离结缔组织, 直至腹股沟韧带外露。用止血来抓腹股沟韧带。股动脉和静脉位于腹股沟韧带下方。
- 使用钝尖端钳分离结缔组织, 直到股动脉和静脉暴露。
- 用细尖钳将股神经沿股动脉轻轻分离。仔细分离股动脉和静脉作为一个单位通过细尖钳。
- 用细尖钳将股动脉与静脉分离。
- 在静脉下放置2件5-0 丝缝合线 (一条朝向腿部, 另一个朝向身体)。
- 在身体旁边绑一个松散的结。使用止血来保持和拉缝合尽可能接近身体的两侧。
- 在腿旁边系一个松散的结。通过止血将缝线拉向腿部, 使静脉充满血液。
- 用微解剖剪刀 (45 °角) 在静脉 (大约0.1 毫米) 上做一个小切口。用消毒纱布浸泡任何血液。
- 附上一个钝尖端针头注射器 (充满盐水与20ü/毫升肝素) 到一个 PE-50 导管。用生理盐水填充 PE-50 导管, 20 U/毫升肝素。切割 PE-50 导管与解剖剪刀在45°的角度, 以创建一个点或尖锐的结束。用钝尖钳夹住 PE-50 导管的末端。轻轻地将 PE-50 导管插入股静脉。
- 在导管完全插入后, 慢慢地管理0.1 毫升的肝素/生理盐水, 以确保没有泄漏。扎牢固缝合结 (single-knot) 以稳定 PE-50 导管。保持 PE-50 导管持续静脉注射 (IV) 各种药物的注射。
- 使用1毫升注射器连接23口存根适配器管理维库溴化 (0.67 毫克/千克, 管理每10分钟) 通过股静脉, 以固定在整个过程中的老鼠。
- 在动脉下放置2件5-0 丝缝线 (一条朝向腿部, 另一根朝向身体)。
- 在腿旁边系一个松散的结。使用止血来保持和拉缝合尽可能对腿部。
- 在身体旁边绑一个松散的结。通过止血保持和拉动缝合体, 使动脉充满血液。
- 用微解剖剪刀 (45 °角) 在动脉 (大约0.1 毫米) 上做一个小切口。
- 附上一个钝尖端针头注射器 (充满盐水与20ü/毫升肝素) 到一个 PE-50 导管。用生理盐水填充 PE-50 导管, 20 U/毫升肝素。切割 PE-50 导管与解剖剪刀在45度角, 创造一个点或尖锐的结束。用钝尖钳夹住 PE-50 导管的末端。用钝尖钳夹住 PE-50 导管的末端。轻轻地将 PE-50 导管插入股动脉。
- 在导管完全插入后, 慢慢地抽回注射器, 确保导管功能正常。扎牢固缝合结 (single-knot) 以稳定 PE-50 导管。保持 PE-50 导管连续记录动脉压力和血气。
- 窒息心脏骤停 (ACA) 程序
- 调整行程音量, o2或 N2o 级别, 根据需要调节生理参数 (如 pO2、不正常的2、血压和 pH 值)。使用这些参数的正常生理范围: pO2: 100 柱, 肺混浊,2: 35-40 柱, 血压: 100 柱, pH: 7.4。
- 使用1毫升注射器连接23口存根适配器管理维库溴化铵 (0.67 毫克/千克, 静脉注射) 经股静脉, 并等待2分钟. 在执行 ACA 之前, 请确保血压在100柱左右。
- 通过从呼吸机上拔下气管插管 (14 针导管中枢), 诱发窒息 (6 分钟)。通过1毫升注射器进一步阻断气管插管, 以确保完全窒息。
注意: 6 分钟的窒息时间被定义为呼吸机断开和复苏开始之间的时期。完整的心跳骤停被定义为平均动脉压低于10柱。 - 在最后一分钟的呼吸暂停, 调整呼吸频率的呼吸机80呼吸/分钟, 并增加 O2到2升/分钟与 0% N2O。此操作将会将其余的异氟醚或 N2O 在呼吸机中残留。
- 最小后呼吸暂停, 从气管插管中取出1毫升注射器。将气管插管重新连接到呼吸机。
- 使用1毫升注射器连接23口的存根适配器管理肾上腺素 (0.005 毫克/千克, 静脉注射) 通过股静脉和管理手动胸部按压的拇指, 指数, 和中指在动物的胸部在 x 和轻循环运动z-axis (200/分钟) 直到自发循环返回 (平均动脉压力≥50柱)33,34,35。
- 使用另1毫升注射器与23口的存根适配器连接, 以管理碳酸氢钠 (1 当量/千克, 静脉注射) 经股静脉后, 立即返回自发循环 (50 柱或更高)33,34,35以缓解呼吸道酸中毒。
- 在复苏后10分钟测量血气, 以确定酸碱状态 (ACA 后的 pH 值应在7.35 到7.40 左右)
- 用止血钳夹住股动脉和静脉。缓慢, 轻轻地用钝尖钳清除动脉和静脉导管。结扎股动脉/静脉5-0 丝缝合, 防止出血。用3-0 丝缝线缝合手术部位的皮肤。使用间断缝合技术, 以尽量减少伤口重新打开的机会。
- 等待, 直到鼠呼吸本身 (通常是30分钟到60分钟后复苏), 断开从呼吸机的老鼠, 并轻轻地取出气管插管。
- 将老鼠放在婴儿孵化器 (27 ° c, 50% 湿度) 过夜。将软化的食物 (通过浸泡在水中) 和水放入婴儿孵化器过夜。
- 把老鼠转移到单独的笼子里, 然后把老鼠带到动物设施里, 用普通的食物和水。T 迷宫测试开始3天后 ACA。
3. T 型迷宫
-
动物制剂
- 手术前一天 (假或 ACA), 处理每只老鼠5分钟。在处理 (图 2) 时, 切勿将老鼠从笼中提升 (480 mm x 250 mm x 200 mm, 塑料透明保持架)。
- 在处理老鼠之后, 用一只手轻轻地把老鼠从尾巴上捡起来, 另一只手支撑着它的腿。让他们从手跳到笼子 (100 毫米高度) 5 次。把每只老鼠分成单独的笼子, 这样它们就不会在食物和/或战斗中占主导地位。
- 假或 ACA 手术后三天 (图 2), 在第一次运行开始之前, 将笼子里的老鼠转移到一个安静、黑暗的房间里。只打开一个低功率的台灯, 并把它放在测试室的角落, 以保持最低照明。让老鼠适应黑暗10分钟。
- 下午进行所有实验, 以避免日变化对大鼠的影响。不要建议操作者接受假或 ACA 手术。
-
自发交替
- 铺一层薄薄的被褥 (〜10毫米厚) 覆盖整个地板的迷宫。然后将鼠放在开始臂 ("T" 的底部), 这是每一个运行的出发点, 并允许每只老鼠3分钟探索左右目标手臂。
- 一旦老鼠提交到一个特定的目标手臂 (所有四只爪子的老鼠已经进入目标臂), 阻止 "T" 连接的开始臂和对方的目标手臂 (图 1), 以防止老鼠进入对方的目标手臂。把老鼠留在迷宫里30秒, 然后把老鼠捡起来放回笼子里, 时间最短 (约30秒)。然后从 t 形迷宫中取出 "t" 型接合块 (125 mm x 230 mm x 65 mm, 由3D 打印机制作)。
- 把老鼠放在开始的手臂上, 重复3.2.2。交替定义为: 当鼠进入相反的手臂, 与以前的运行36。老鼠每天执行4次跑步, 如下所示:
1st运行
2nd运行
10分钟休息
3rd运行
4th运行 - 改变在10分钟的休息和动物之间的床上用品, 以消除气味偏见。在每个实验日结束时, 用75% 乙醇和蒸馏水清洗 T 迷宫。
- 重复步骤3.2.1。-3.2.4。两天 (总共运行 12), 如图 2所示。
-
交替率和边偏好率计算
- 计算% 的替换和% 的边首选项, 其中
L: 老鼠选择左臂
R: 老鼠选择右臂
正确的选择: 2nd运行与给定集中的 1st不同 (每个集合包含两个运行)
不正确的选择: 大鼠选择相同的手臂类似于以前的运行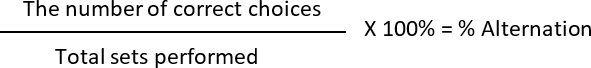
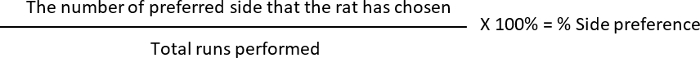
例如:
1天: 升升/升
2天: 升升/升 R
3天: R 升/升 l
替换: 2 (正确的选择)/6 (执行的总集合) * 100 = 33.33%
边偏爱:10 (L, 优选的边)/12 (总奔跑执行) * 100 = 83.33%
- 计算% 的替换和% 的边首选项, 其中
-
术后护理:
- 给老鼠丁丙诺啡 (0.01 毫克/千克 IP) 每12小时, 在手术后2天。观察大鼠心脏骤停后1小时。
- 将大鼠附着在呼吸机和加热垫上, 直到它恢复足够的意识来维持胸骨卧床。为了保持动物的体温, 在手术后, 把老鼠放在一个婴儿孵化器 (设置在27° c, 50% 湿度)。
- 在手术后的前24小时内, 向动物提供软化的 chow (浸泡在水中)。如果老鼠不喝水, 管理抑菌盐水 (100 毫升/公斤/天, ip), 直到动物恢复和饮用水自由。
- 给大鼠外用抗生素止痛 (肽和利多卡因软膏) 在所有的伤口。在它们完全恢复后, 将老鼠移回动物设施。
-
安乐死法
- 在实验结束时使用5% 异氟醚和 100% N2O 安乐动物。
结果
ACA (全球脑缺血) 主要导致工作 (短期) 记忆缺陷28,29。为了评估在 ACA 之后的学习和记忆功能, 我们使用了改进的自发交替测试来评估工作 (短期) 内存30。自发交替试验结果表明, ACA 组 (26.19 ± 4.96%) 连续三天的交替率明显低于对照组 (62.96 ± 6.07%)(* p0.05)35由于提交给 ACA 的大鼠与对照组相比 (82.14 ?...
讨论
与执事和罗的协议31相比, 本研究做了一些修改。3D 打印机被用来建造 T 形迷宫。3的 d-印刷提供了可负担的和 cost-effective 的替代商业化 T 迷宫。为了减少实验过程中大鼠的焦虑, 在暗室中进行了最小光照的 T 迷宫。一旦鼠进入目标的武器之一, 我们轻轻地阻断对方的手臂。这避免了可能的压力, 从测试, 以及可能损害老鼠的尾巴, 而降低了断头台的门。任何不必要的压力都会抑制老...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家卫生研究院/国家神经紊乱和中风补助金 1R01NS096225-01A1, 美国心脏协会授予 AHA-13SDG1395001413, AHA-17GRNT33660336, AHA-17POST33660174,路易斯安那州立大学资助研究委员会, 马尔科姆费斯特心血管研究奖学金, 和伊夫林 F. 麦克奈特脑研究所。
材料
| Name | Company | Catalog Number | Comments |
| 3D Printer | MakerBot | Replicator | Fifth generation |
| 3D Printer Filament | Hatchbox | PLA, 1.75 mm filament diameter | |
| 200 Proof Pure Ethanol | Koptec | V1005SG | |
| Sani-Chips | PJ Murphy-Forest Products | Size: 8 to 20 mesh; 2.2 cubic foot/package; autoclavable bags | |
| Rat | Charles River Laboratories | Sprague-Dawley | |
| Vecuronium bromide | Sun Pharmaceutical | 47335-931-40 | 10 mg |
| Epinephrine | Par Pharmaceutical | 42023-103-01 | Adrenalin Chloride Solution 1 mg/mL, 1:1000 |
| Buprenorphine Hydrochloride Injection | Pfizer | 00409-2012-32 | 0.3mg/mL |
| SketchUp | Trimble Inc. | 3D modeling software | |
| VentElite Small Animal Ventilator | Harvard Apparatus | 55-7040 | Animals raging in size from mouse to guinea pig (10g to 1kg) |
| PowerLab 8/35 | Adinstruments | PL3508 | 8 analog input channels – 4 of which can be used in differential mode. |
| Bio Amps | Adinstruments | FE132 | The Bio Amp is a galvanically isolated, high-performance differential bio amplifier optimized for the measurement of a wide variety of biological signals such as ECG, EMG and EEG recordings. |
| Quad Bridge Amp | Adinstruments | FE224 | A four-channel, non-isolated bridge amplifier designed to allow the PowerLab to connect to most DC bridge transducers. |
| LabChart 8 | Adinstruments | ||
| ABL80 FLEX CO-OX blood gas analyzer | Radiometer | pH / p CO2 / p O2 | |
| SURFLO Teflon I.V. Catheter | Terumo | sc-361556 | Only use the flexible thin wall catheter (49-mm long) |
| Pipet/Infusion Needle | Hamilton | 7748-03 | 17-gauge; 93-mm long; 10-degree angle |
| Classic T3 Vaporizer | SurgiVet | VCT302 | Classic T3 Isoflurane Funnel Fill |
| ENVIRO-PURE Charcoal Canister | SurgiVet | 32373B10 | Designed to absorb waste anesthetic gas |
| O2 single flowmeter | SurgiVet | 32375B1 | 0-1000 mL |
| N2O Flowmeter | VetEquip | 401721 | 0-4LPM |
| Clay Adams Intramedic Luer-Stub Adapter (Sterile) | Becton Dickinson | 427565 | 23 gauge |
| Micro Forceps | Black and Black surgical | B3FRC-18 RM-8 | 7 1/4" (18 cm), 8mm RH, counterweight w/ guide pin 2mm, platform 6 x .3 mm, curved. |
| Halstead Mosquito Forceps | Roboz | RS-7111 | Curved; 5" Length, 1.3 mm tip diameter, 2.1 mm jaw width |
| Mixter Forceps | Roboz | RS-7291 | 5.25" Curved Extra Delicate, 1.1 mm tips |
| Castroviejo Micro Dissecting Spring Scissors | Roboz | RS-5650 | Straight, Sharp Points; 9 mm Cutting Edge; 0.15 mm Tip Width; 3 1/2" Overall Length |
| Mayo-Stille Scissors | Roboz | RS-6891 | 5.5" Round Curved |
| Dumont #5 Forceps | Roboz | RS-5058 | 45 Deg Dumoxel Tip Size .10 x .06 mm |
| Olsen-Hegar Combination Scissor And Needle Holder | Roboz | RS-7884 | Cross Serration Tip; 5.5" Length |
| Moloney Forceps | Roboz | RS-8254 | Serrated; Slight Curve; 4.5" Length |
参考文献
- Writing Group, M., et al. Heart Disease and Stroke Statistics-2016 Update: A Report From the American Heart Association. Circulation. 133, e38-e360 (2016).
- Beuret, P., et al. Cardiac arrest: prognostic factors and outcome at one year. Resuscitation. 25, 171-179 (1993).
- Kim, Y. J., et al. Long-term neurological outcomes in patients after out-of-hospital cardiac arrest. Resuscitation. 101, 1-5 (2016).
- Earnest, M. P., Yarnell, P. R., Merrill, S. L., Knapp, G. L. Long-term survival and neurologic status after resuscitation from out-of-hospital cardiac arrest. Neurology. 30, 1298-1302 (1980).
- Cerchiari, E. L., Safar, P., Klein, E., Cantadore, R., Pinsky, M. Cardiovascular function and neurologic outcome after cardiac arrest in dogs. The cardiovascular post-resuscitation syndrome. Resuscitation. 25, 9-33 (1993).
- Petito, C. K., Feldmann, E., Pulsinelli, W. A., Plum, F. Delayed hippocampal damage in humans following cardiorespiratory arrest. Neurology. 37, 1281-1286 (1987).
- Schmidt-Kastner, R., Freund, T. F. Selective vulnerability of the hippocampus in brain ischemia. Neuroscience. 40, 599-636 (1991).
- Corkin, S. What's new with the amnesic patient H.M.?. Nat Rev Neurosci. 3, 153-160 (2002).
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. 1957. J Neuropsychiatry Clin Neurosci. 12, 103-113 (2000).
- Smith, T. D., Calhoun, M. E., Rapp, P. R. Circuit and morphological specificity of synaptic change in the aged hippocampal formation. Neurobiol Aging. 20, 357-358 (1999).
- Gage, F. H., Dunnett, S. B., Bjorklund, A. Spatial learning and motor deficits in aged rats. Neurobiol Aging. 5, 43-48 (1984).
- Tulving, E., Markowitsch, H. J. Episodic and declarative memory: role of the hippocampus. Hippocampus. 8, 198-204 (1998).
- Neigh, G. N., et al. Cardiac arrest with cardiopulmonary resuscitation reduces dendritic spine density in CA1 pyramidal cells and selectively alters acquisition of spatial memory. Eur J Neurosci. 20, 1865-1872 (2004).
- Volpe, B. T., Davis, H. P., Towle, A., Dunlap, W. P. Loss of hippocampal CA1 pyramidal neurons correlates with memory impairment in rats with ischemic or neurotoxin lesions. Behav Neurosci. 106, 457-464 (1992).
- Astur, R. S., Taylor, L. B., Mamelak, A. N., Philpott, L., Sutherland, R. J. Humans with hippocampus damage display severe spatial memory impairments in a virtual Morris water task. Behav Brain Res. 132, 77-84 (2002).
- Lee, R. H., et al. Fatty acid methyl esters as a potential therapy against cerebral ischemia. OCL. 23, D108 (2016).
- Lee, R. H., Porto, L. F., et al. Chapter 1. Palmitic acid: occurrence, biochemistry and health effects. , 1-15 (2014).
- Tolman, E. C., Gleitman, H. Studies in spatial learning; place and response learning under different degrees of motivation. J Exp Psychol. 39, 653-659 (1949).
- Koopmans, G., Blokland, A., van Nieuwenhuijzen, P., Prickaerts, J. Assessment of spatial learning abilities of mice in a new circular maze. Physiol Behav. 79, 683-693 (2003).
- Barnes, C. A. Memory deficits associated with senescence: a neurophysiological and behavioral study in the rat. J Comp Psychol. 93, 74-104 (1979).
- Paul, C. M., Magda, G., Abel, S. Spatial memory: Theoretical basis and comparative review on experimental methods in rodents. Behav Brain Res. 203, 151-164 (2009).
- Vorhees, C. V., Williams, M. T. Assessing spatial learning and memory in rodents. ILAR J. 55, 310-332 (2014).
- Sharma, S., Rakoczy, S., Brown-Borg, H. Assessment of spatial memory in mice. Life Sci. 87, 521-536 (2010).
- Poon, T. P., et al. Spinal cord toxoplasma lesion in AIDS: MR findings. J Comput Assist Tomogr. 16, 817-819 (1992).
- Sunyer, B., Patil, S., Höger, H., Lubec, G. Barnes maze, a useful task to assess spatial reference memory in the mice. Nat Protoc. 390, (2007).
- Shoji, H., Hagihara, H., Takao, K., Hattori, S., Miyakawa, T. T-maze forced alternation and left-right discrimination tasks for assessing working and reference memory in mice. J Vis Exp. , (2012).
- Seeger, T., et al. M2 muscarinic acetylcholine receptor knock-out mice show deficits in behavioral flexibility, working memory, and hippocampal plasticity. J Neurosci. 24, 10117-10127 (2004).
- Olton, D. S., Feustle, W. A. Hippocampal function required for nonspatial working memory. Exp Brain Res. 41, 380-389 (1981).
- Hayashida, K., et al. Hydrogen inhalation during normoxic resuscitation improves neurological outcome in a rat model of cardiac arrest independently of targeted temperature management. Circulation. 130, 2173-2180 (2014).
- Dember, W. N., Richman, C. L. . Spontaneous alternation behavior. , (1989).
- Deacon, R. M., Rawlins, J. N. T-maze alternation in the rodent. Nature protocols. 1, 7-12 (2006).
- Wong, K. V., Hernandez, A. A review of additive manufacturing. ISRN Mechanical Engineering. 2012, (2012).
- Lin, H. W., et al. Derangements of post-ischemic cerebral blood flow by protein kinase C delta. Neuroscience. 171, 566-576 (2010).
- Lin, H. W., et al. Fatty acid methyl esters and Solutol HS 15 confer neuroprotection after focal and global cerebral ischemia. Transl Stroke Res. 5, 109-117 (2014).
- Lee, R. H., et al. Interruption of perivascular sympathetic nerves of cerebral arteries offers neuroprotection against ischemia. Am J Physiol Heart Circ Physiol. 312, H182-H188 (2017).
- Bali, Z. K., et al. Differential effects of alpha7 nicotinic receptor agonist PHA-543613 on spatial memory performance of rats in two distinct pharmacological dementia models. Behav Brain Res. 278, 404-410 (2015).
- McDonald, J. H. . Handbook of biological statistics. 2, (2009).
- Castellano, M. A., Diaz-Palarea, M. D., Rodriguez, M., Barroso, J. Lateralization in male rats and dopaminergic system: evidence of right-side population bias. Physiol Behav. 40, 607-612 (1987).
- Andrade, C., Alwarshetty, M., Sudha, S., Suresh Chandra, J. Effect of innate direction bias on T-maze learning in rats: implications for research. J Neurosci Methods. 110, 31-35 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。