É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Utilizando o ZIF modificados para avaliar resultados de memória funcional após parada cardíaca
Neste Artigo
Resumo
Este protocolo descreve o uso de uma ZIF modificado para avaliar aprendizagem funcional/memória em isquemia cerebral induzida por parada cardíaca de asfixia.
Resumo
Fundo: Avaliação de leve a moderada impairment cognitive em um modelo de isquemia cerebral global (ou seja, parada cardíaca) pode ser difícil devido a pobre locomoção após a cirurgia. Por exemplo, ratos que se submetem a procedimentos cirúrgicos e estão sujeitos ao labirinto de água Morris podem não ser capazes de nadar, anulando, assim, o experimento.
Novo método: Estabelecemos um teste de ZIF modificados comportamental espontânea alternância. A grande vantagem do protocolo modificado ZIF é seu design relativamente simples que é poderoso o suficiente para avaliar a aprendizagem/memória funcional após a isquemia. Além disso, a análise de dados é simples e direta. Usamos a ZIF para determinar défices de aprendizagem/memória dos ratos tanto na presença ou ausência de leve a moderada (6 min) no cardíaca (ACA). Ratos têm uma tendência natural para a exploração e explorarão os braços alternativos na ZIF, Considerando que ratos hippocampal lesionado tendem a adotar um lado-preferência resultando em rácios de diminuição da alternância espontâneo, revelando o hipocampo-relacionados aprendizagem/memória funcional na presença ou ausência de ACA.
Resultados: Grupos ACA têm percentagens mais elevadas de preferência do lado e alternações mais baixas em comparação com o controle.
Comparação com o método existente (s): água a Morris e Barnes labirinto são mais proeminentes para avaliar a função de aprendizagem/memória. No entanto, o labirinto de água de Morris é mais estressante do que outros labirintos. O labirinto de Barnes é amplamente utilizado para medir a memória de referência (longo prazo), enquanto déficits neurocognitivos induzida por ACA são mais proximamente relacionados com memória (curto prazo) a trabalhar.
Conclusões: Nós desenvolvemos uma estratégia simples, mas eficaz para delinear a memória (curto prazo) via a ZIF a trabalhar no nosso modelo de isquemia cerebral global (ACA).
Introdução
De acordo com a American Heart Association (2017), parada cardíaca (CA)-mortalidade induzida ocorre a cada quatro minutos e afeta mais de 400.000 pessoas por ano no Estados Unidos1. É bem documentado que o CA pode causar lesão neuronal do cérebro como resultado de sangue insuficiente perfusão2,3,4. Lesão cerebral induzida por CA ocorre na região CA1 do hipocampo5,6,7, afetando os neurônios que são essenciais para a aprendizagem e memória8,9, sensíveis à isquemia 10,11,12. Além disso, a perda de densidade de espinha dendrítica, sob condições isquêmicas no hipocampo (ou seja, CA1 neurônios), desempenha um papel crítico na memória espacial imparidade13,14,15. Devido a essas alterações patológicas após CA, distúrbios comportamentais tais como: ansiedade, depressão, transtorno de estresse pós-traumático e perda de memória são mais prevalentes. Embora tenha havido avanços na tecnologia médica (ou seja, serviço ambulatorial eficiente) que correlacionam com melhores taxas de sobrevivência de CA, a maioria dos tratamentos neuroprotetor (exceto para hipotermia) falha melhorar os resultados funcionais após CA16 ,17. Sobreviventes de CA normalmente tem uma má qualidade de vida e estão sobrecarregados com incremental medical gastando16.
Avaliações de estado cognitivo para isquemia cerebral através de testes comportamentais são importantes para determinar a eficácia ambas as drogas e, finalmente, desenvolver um ensaio clínico bem sucedido. Na década de 1940, Edward Tolman projetado o primeiro julgamento de comportamento para estudar baseado no hipocampo memória espacial18. Posteriormente, labirintos diferentes (ou seja, o labirinto de água Morris, labirinto radial, T - ou Y-labirinto e labirinto Barnes) foram desenvolvidos para avaliar hippocampal espacial a aprendizagem e a memória em ratos19,20,21,22 ,23. Um do mais amplamente utilizado teste comportamental é o labirinto de água de Morris, que examina a aprendizagem espacial e memória em ratos modelos24. No entanto, o labirinto de água Morris requer o rato para nadar e exercer controle e função motora total. Para experimentos de isquemia, tais como o modelo no cardíaca (ACA, um modelo do rato de CA), canulação da veia/artéria femoral são necessárias para obter a pressão de sangue vital, gases do sangue e introdução de diversas drogas. Desde que a cateterização da veia/artéria femoral pode inibir a mobilidade de perna, tornando a capacidade do rato está a nadar corretamente, o labirinto de água Morris pode não ser o mais adequado testar deficiências cognitivas sob ACA.
O labirinto de Barnes é o outro teste comportamental amplamente utilizado para examinar a aprendizagem espacial e memória em modelos de roedores. O labirinto de Barnes não exige o esforço de função completa motora e controle e, portanto, menos estressante do que o labirinto de água Morris. No passado, realizamos experimentos usando o labirinto Barnes para determinar se as diferenças de aprendizagem funcional/memória ocorrem entre controle ou sham contra ratos induzida por ACA. Os dados obtidos para o labirinto de Barnes não tinha a resolução para testar deficiências cognitivas após leve a moderada ACA, devido ao fato de que o labirinto de Barnes é amplamente utilizado para medir a referência (longo prazo) memória25,26, enquanto Défices neurocognitivos induzida por ACA mais intimamente relacionados com o trabalho (curto prazo) memória27,28,29,30 sugerindo que o labirinto de Barnes é menos viável para avaliar a função de memória em nosso ACA modelo.
Assim, desenvolvemos uma ZIF modificado usando alternância espontânea teste para avaliar a memória (curto prazo) a trabalhar depois da ACA. Grande vantagem do teste alternância espontânea modificados ZIF é sua simplicidade e o mínimo de estresse em ratos em comparação com outros testes comportamentais, devido ao fato de que a ZIF modificado não requer formação prévia de animais, como bem tão pesado computacional análise ou sub-rotinas (ou seja, a imagem latente do rato), conforme exigido pelo labirinto de água de Morris e labirinto de Barnes. Aqui nós mostramos que o teste de alternância espontânea de ZIF modificado é um paradigma de avaliação comportamental ainda altamente eficiente e simples que pode oferecer a resolução suficiente para detectar com precisão e avaliar função hippocampal em doenças que causam perda de memória (ou seja, ACA).
Protocolo
Todos os procedimentos experimentais foram conduzidos em conformidade com as diretrizes do institutos nacionais da saúde e aprovados pelo Comitê de uso (Shreveport-LSU centro de Ciências da saúde) e cuidado institucional do Animal para o uso de masculino (de ratos Sprague Dawley 300-350 g, 9-10 semanas de idade). Ratos foram jejuou durante a noite antes da cirurgia ACA.
1. configuração e projeto do aparelho ZIF
Nota: Base para o design de ZIF do diácono e dos Rawlins 2006 modelo31.
- Projetar a estrutura 3D do labirinto utilizando SketchUp32. Para criar uma estrutura 3D da ZIF, construa o braço de iniciar com um comprimento exterior de 200 mm, largura de 165 mm e altura de 148 mm para caber dentro das dimensões de impressão da impressora 3D. Use uma espessura de parede de 5,5 mm e espessura de 8 mm piso.
- Imprimir usando uma impressora 3D labirinto (ver tabela de materiais)32. Se uma impressora 3D não está disponível no laboratório, use outros materiais como madeira, painel de fibras de média densidade ou um plástico (ou seja, policloreto de vinila), que pode ser comprado em lojas da melhoria home.
- Devido a restrições de altura na área de impressão, construir as paredes do labirinto em duas impressões 3D separados e unir mediante Assembleia de labirinto (ou seja, uma segunda altura de parede foi adicionada à seção de labirinto para aumentar a altura de 140 mm, para uma altura total da parede de 280 mm). Cada base de impressão 3D separado continha um "T" em forma de cruzeta, onde uma seção conectados para o próximo.
- Na junção do braço iniciar com os braços de objetivo, crie uma ampla seção de 165 mm para juntar-se a largura do braço iniciar com que armas da gol. Construir braços objetivo usando um método de projeto similar como o braço de início; no entanto, reduza a largura do braço para 100 mm por design de diácono e Rawlins.
- Por favor, veja a Figura 1 para esquema/dimensões detalhadas da ZIF.
- Inclua uma partição central no design na junção do braço iniciar e braços de objetivo. Estenda esta partição da parede traseira da ZIF e 200 mm para o braço de início para dividir os braços de objetivo. Esta partição estendida também a altura do labirinto (Figura 1).
2. no ataque cardíaco (ACA)
- Autoclave instrumentos cirúrgicos (121 ° C por 15 min) antes do início da cirurgia. Desinfecte a mesa cirúrgica por etanol a 70% por 15 min. barbear os pelos no local da cirurgia. Aplica uma solução de betadine para superfícies para operação cirúrgica de pele.
- Anesthetization
- ANESTHETIZE ratos com 4% isoflurano e 30:70 mistura de O2 e N2O (300 mL/min O2 e 700 mL/min N2O) através de máscara.
- Dar ratos intubação endotraqueal para ventilação mecânica (após a intubação, ratos foram ligados a um ventilador).
- Manter a anestesia, diminuindo o isoflurano de 4% para 2%, com uma mistura de 30:70 de O2 e N2O. uso o método pitada-resposta para determinar a profundidade da anestesia.
- Aplica a pomada sobre os olhos para evitar ressecamento enquanto sob anestesia. Regulae a temperatura do corpo por um roedor Aquecimento pad com uma sonda anal como uma referência de temperatura.
- Intubação endotraqueal
- Coloca o rato na câmara de indução. Anestesiar os ratos com a mistura de isoflurano e 30:70 de 4% de O2 e N2O.
- Remova o rato da câmara de indução. Animal anestesiado na posição supina, com a cara do rato para a máscara de anestesia local.
- Mova a língua para a esquerda ou direita do animal com o polegar esquerdo e dedo indicador.
- Deslize um cateter flexível intravenosa 14 mm (49 mm de comprimento) sobre uma agulha de ponta romba 17 calibre pipetagem (93 mm de comprimento com ângulo de 10 graus na ponta da agulha). Insira a agulha de pipetagem de calibre 17 ponta romba na traqueia.
- Suavemente, puxe a agulha de calibre 17 pipetagem da traqueia. Conecte o cateter de calibre 14-ao ventilador. Ajuste o volume de curso ventilador para 0,67 mL/100 g e frequência respiratória de 60 respirações por minuto.
- Manter a cabeça e corpo temperatura a 37 ° C durante todo o procedimento por um roedor Aquecimento pad com sonda anal como uma referência de temperatura.
- Cateterismo arterial e venoso femoral
- Raspar o cabelo perto da área inguinal (dois lados) e aplicar betadine para superfícies para operação cirúrgica de pele.
- Colocado o rato na posição supina. Fazer uma incisão (10 mm) na área inguinal com tesoura cirúrgica.
- Separe o tecido conjuntivo por pinças de ponta romba até o ligamento inguinal é exposto. Use uma pinça hemostática para agarrar o ligamento inguinal. A artéria e veia femoral estão por baixo do ligamento inguinal.
- Use pinça ponta romba para separar o tecido conjuntivo até a artéria e veia femoral são expostos.
- Suavemente separa o nervo femoral, que corre ao longo da artéria femoral através de pinças de ponta fina. Cuidadosamente, separar a artéria femoral e veia como uma unidade através de pinças de ponta fina.
- Use pinça de ponta fina para separar a artéria femoral a veia.
- Coloque 2 pedaços de sutura seda 5-0 (uma em direção a perna e o outro para o corpo) sob a veia.
- Faça um nó frouxo no lado perto do corpo. Use uma pinça hemostática para segurar e puxar a sutura na medida do possível, em direção os lados opostos do corpo.
- Faça um nó frouxo no lado perto da perna. Segure e puxe a sutura em direção a perna através de uma pinça hemostática para permitir que a veia encher com sangue.
- Faça uma pequena incisão na veia (cerca de 0,1 mm) por microdissecando a tesoura (em um ângulo de 45°). Absorva o sangue com uma gaze esterilizada.
- Anexe uma seringa de agulha de ponta romba (preenchida com soro fisiológico com heparina 20 de U/mL) para um cateter PE-50. Preencha o PE-50 cateter com soro fisiológico com heparina 20 de U/mL. Corte o cateter PE-50 com uma tesoura de dissecação em um ângulo de 45° para criar um ponto ou extremidade afiada. Use pinça ponta romba para segurar a extremidade do cateter PE-50. Insira cuidadosamente o cateter PE-50 na veia femoral.
- Depois que o cateter está completamente inserido, administre lentamente 0,1 mL de heparina/salina para garantir que não há nenhum vazamento. Amarre firme de sutura (single-nó) para estabilizar o cateter PE-50. Manter o cateter PE-50 injectável contínua intravenosa (IV) de diversas drogas.
- Uso uma seringa de 1 mL, conectada com um 23 gauge adaptador Luer de esboço para administrar o brometo de vecurônio (0,67 mg/kg, administrada a cada 10min) através da veia femoral para imobilizar o rato ao longo do processo.
- Coloque 2 pedaços de sutura seda 5-0 (uma em direção a perna e o outro para o corpo) sob a artéria.
- Faça um nó frouxo no lado perto da perna. Use uma pinça hemostática para segurar e puxar a sutura na medida do possível, em direção a perna.
- Faça um nó frouxo no lado perto do corpo. Segure e puxe os pontos para o corpo através de uma pinça hemostática para permitir que a artéria encher com sangue.
- Faça uma pequena incisão na artéria (cerca de 0,1 mm) por microdissecando a tesoura (em um ângulo de 45°).
- Anexe uma seringa de agulha de ponta romba (preenchida com soro fisiológico com heparina 20 de U/mL) para um cateter PE-50. Preencha o PE-50 cateter com soro fisiológico com heparina 20 de U/mL. Corte o cateter PE-50 com uma tesoura de dissecação em um ângulo de 45 graus para criar um final ponto ou afiado. Use pinça ponta romba para segurar a extremidade do cateter PE-50. Use pinça ponta romba para segurar a extremidade do cateter PE-50. Insira cuidadosamente o cateter PE-50 na artéria femoral.
- Depois que o cateter está completamente inserido, lentamente puxe para trás a seringa para garantir que esse cateter é funcional. Amarre firme de sutura (single-nó) para estabilizar o cateter PE-50. Manter o cateter PE-50 para gravação contínua de gases de pressão e sangue arteriais.
- No procedimento de parada cardíaca (ACA)
- Ajuste parâmetros fisiológicos (ou seja, pO2, pCO2, pressão arterial e valor de pH), conforme necessário, modulando o volume de curso, O2 ou níveis de N2O. Use faixas fisiológicas normais desses parâmetros: pO2: 100 mmHg, pCO2: 35-40 mmHg, pressão arterial: 100 mmHg e pH: 7.4.
- Uso uma seringa de 1 mL, conectada com um adaptador de esboço 23 calibre Luer para administrar o brometo de vecurônio (0,67 mg/kg, IV) através da veia femoral e esperar por 2 min. Verifique se a pressão arterial está em ou em torno de 100 mmHg antes de executar a ACA.
- Induzi apneia (6 min) desconectando o tubo endotraqueal (cateter 14-guage) do ventilador. Mais bloquear o tubo endotraqueal por uma seringa de 1 mL para garantir a completa do sono.
Nota: O tempo-6min asfixia é definido como o período entre a desconexão do ventilador e o início da reanimação. Completa parada cardíaca é definida como uma pressão arterial média inferior a 10 mmHg. - Durante a última min de apneia, ajustar a frequência respiratória do ventilador a 80 respirações por minuto e aumentar O2 a 2 L/min com 0% N2O. Esta ação vai explodir qualquer restante isoflurano ou N2O restante no ventilador.
- seringa de 1 mL min apneia, a seguir retire o tubo endotraqueal. Re-conecte o tubo endotraqueal ao ventilador.
- Uso uma seringa de 1 mL, conectada com um 23 gauge adaptador Luer de esboço para administrar epinefrina (0,005 mg/kg, IV) através da veia femoral e administrar as compressões manual pelo polegar, dedos indicador e médio no peito do animal em leves movimentos circulares no x e eixo z (200/min) até o retorno da circulação espontânea (pressão arterial média ≥ 50 mmHg)33,34,35.
- Uso de outra seringa de 1 mL, conectada com um 23 gauge adaptador Luer de esboço para administrar bicarbonato de sódio (1 meq/kg, IV) através da veia femoral, imediatamente após o retorno à circulação espontânea (50 mmHg ou superior)33,34, 35 para aliviar a acidose respiratória.
- Sangue de medida gases novamente 10 min após a ressuscitação para determinar o status de ácido-base (pH depois ACA deve ser de cerca de 7,35 a 7,40)
- Use uma pinça hemostática para fixar a artéria e veia femoral. Lenta e suavemente remova cateteres arteriais e venosos, usando pinça de ponta romba. Ligate artéria femoral/veia com uma sutura de seda 5-0 para evitar sangramento. Feche a pele sobrejacente local cirúrgico usando uma sutura de seda 3-0. Use a técnica de sutura interrompida para minimizar as chances da reabertura da ferida.
- Espere até que o rato se respira (geralmente de 30 min a 60 min após a reanimação), desligue o rato do ventilador e remova cuidadosamente o tubo endotraqueal.
- Lugar do rato na incubadora de bebê (27 ° C, 50% de umidade) durante a noite. Coloque os alimentos amolecido (feito por imersão-los na água) e a água para a incubadora do bebê durante a noite.
- Transferir o rato da gaiola individual e devolva o rato ao animal com água e comida normal. Testes de ZIF começam 3 dias depois da ACA.
3. ZIF
-
Preparação de animais
- O dia antes da cirurgia (farsa ou ACA), lidar com cada rato por 5 min. Nunca elevar ratos da gaiola (480 mm x 250 mm x 200 mm, gaiola plástica transparente) quando manipulação (Figura 2).
- Após manusear o rato, suavemente pegar o rato por sua cauda com uma mão com a outra mão apoiando suas ' pernas. Deixá-los saltar da mão para a gaiola (100 mm de altura), 5 vezes. Separe cada rato em gaiolas individuais, para que eles não vão dominar por comida e/ou luta.
- Três dias depois da farsa ou cirurgia ACA (Figura 2), transferi os ratos com a gaiola em um quarto silencioso e escuro antes do início da primeira corrida. Apenas ligue uma lâmpada de mesa de baixa potência e colocá-lo no canto da sala de testes para manter a iluminação mínima. Permitir que o rato para se adaptar à escuridão por 10 min.
- Execute todas as experiências da tarde para evitar os efeitos da variação diurna no desempenho dos ratos. Não aconselho o operador no qual Souza rato recebido ou cirurgia ACA.
-
Alternância de espontânea
- Espalhe uma camada fina de fundamento (~ 10 mm de espessura) para cobrir todo o piso do labirinto. Então lugar o rato para o braço de começo (parte inferior do "T"), que é o ponto de partida de cada um executar e permitir que cada um rato 3 min para explorar o braço direito ou esquerdo do gol.
- Uma vez que o rato compromete-se a um braço de objetivo específico (todas as quatro patas do rato entraram o braço gol), bloquear a junção em "T" entre o braço de iniciar e o braço de meta adversária (Figura 1) para impedir o rato entre o braço de meta adversária. Deixar o rato no labirinto por 30 segundos, em seguida, pegar o rato e coloque-o de volta à sua jaula por um tempo mínimo (~ 30 segundos). Em seguida, retire a junção em "T" quarteirão a ZIF (125 mm X 230 mm X 65 mm, feito por uma impressora 3D).
- Coloque o rato para o braço do começo e repetir 3.2.2. Alternância é definida como: quando o rato entra o braço oposto em comparação com o anterior executar36. Tem ratos executar 4 corridas por dia da seguinte forma:
1st executar
2nd executar
10-min intervalo
executar 3rd
4th executar - Mude a roupa de cama, durante o intervalo de 10 min e entre animais para eliminar o viés de perfume. Limpe a ZIF com 75% de etanol seguido de água destilada no final de cada dia experimental.
- Repita as etapas 3.2.1. -3.2.4. por mais dois dias (12 corridas no total) como ilustrado na Figura 2.
-
Alternância taxa e lado preferência cálculos da taxa de
- Calcular a % de alternância e a % de preferência de lado, onde
L: os ratos escolher o braço esquerdo
R: os ratos escolher o braço direito
Corrigir a escolha: a 2nd executar é diferente do 1st em um determinado conjunto (cada conjunto contém duas corridas)
Escolha incorreta: os ratos escolher o mesmo braço semelhante a execução anterior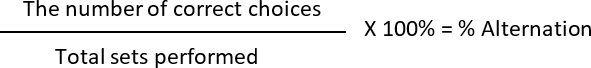
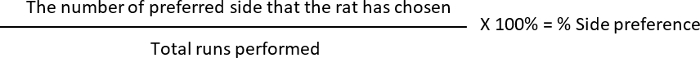
Exemplo:
Dia 1: L L / L L
Dia 2: L L / L R
Dia 3: R L / L L
Alternância: 2 (escolhas corretas) 6 (total de moda realizada) * 100 = 33,33%
Preferência de lado: 10 (L, lado preferencial) 12 (total executado realizado) * 100 = 83.33%
- Calcular a % de alternância e a % de preferência de lado, onde
-
Cuidados pós-operatórios:
- Dar ratos buprenorfina (0,01 mg/kg IP) cada 12h por 2 dias após a cirurgia. Observe os ratos para até 1 h após a parada cardíaca.
- Anexe ratos para o ventilador e a almofada de aquecimento até que recuperou a consciência suficiente para manter a prostração esternal. Para manter a temperatura corporal dos animais após a cirurgia, coloque o rato em uma incubadora de bebê (definir a 27 ° C, 50% de umidade).
- Fornece chow amolecida (feita por imersão em água) para animais para as primeiras 24 horas após a cirurgia. Se os ratos não eram água potável, administrar soro fisiológico bacteriostático (100 mL/kg/dia, I.P.) até que o animal se recupera e é água potável livremente.
- Dê o antibiótico tópico de ratos com alívio da dor (pomada de bacitracina e lidocaína) em todas as feridas. Volte ratos para as instalações de animais depois que eles se recuperar totalmente.
-
Método de eutanásia
- Use o isoflurano 5% e 100% N2O a eutanásia dos animais no final do experimento.
Resultados
ACA (isquemia cerebral global) causa principalmente trabalhando de28,de déficits de memória (curto prazo)29. Para avaliar a função de aprendizagem e memória após ACA, usamos o teste modificado de alternância espontânea para avaliar o trabalho de memória (curto prazo)30. Os resultados do teste de alternância espontânea sugerem que a taxa de alternância de três dias consecutivos no grupo ACA (26,...
Discussão
Modificações foram feitas no presente estudo em relação ao protocolo de diácono e Rawlins'31. A impressora 3D foi usada para construir a ZIF. A impressão 3D oferece alternativas acessíveis e cost-effective para ZIF comercializado. Para reduzir a ansiedade dos ratos durante o ensaio, a ZIF realizou-se no quarto escuro com iluminação mínima. Uma vez que o rato entrou um dos braços objetivo, bloqueamos suavemente o braço oposto. Isso evita o estresse possível do teste, os possíveis dano...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado pelo nacional institutos de saúde nacionais Instituto de doenças neurológicas e AVC conceder 1R01NS096225-01A1, a American Heart Association concede AHA-13SDG1395001413, 17GRNT33660336-AHA, AHA-17POST33660174, o Louisiana Grant de Universidade de estado no Conselho de pesquisa de ajuda, Malcolm Feist, The Cardiovascular Research Fellowship e o Instituto de cérebro Evelyn F. McKnight.
Materiais
| Name | Company | Catalog Number | Comments |
| 3D Printer | MakerBot | Replicator | Fifth generation |
| 3D Printer Filament | Hatchbox | PLA, 1.75 mm filament diameter | |
| 200 Proof Pure Ethanol | Koptec | V1005SG | |
| Sani-Chips | PJ Murphy-Forest Products | Size: 8 to 20 mesh; 2.2 cubic foot/package; autoclavable bags | |
| Rat | Charles River Laboratories | Sprague-Dawley | |
| Vecuronium bromide | Sun Pharmaceutical | 47335-931-40 | 10 mg |
| Epinephrine | Par Pharmaceutical | 42023-103-01 | Adrenalin Chloride Solution 1 mg/mL, 1:1000 |
| Buprenorphine Hydrochloride Injection | Pfizer | 00409-2012-32 | 0.3mg/mL |
| SketchUp | Trimble Inc. | 3D modeling software | |
| VentElite Small Animal Ventilator | Harvard Apparatus | 55-7040 | Animals raging in size from mouse to guinea pig (10g to 1kg) |
| PowerLab 8/35 | Adinstruments | PL3508 | 8 analog input channels – 4 of which can be used in differential mode. |
| Bio Amps | Adinstruments | FE132 | The Bio Amp is a galvanically isolated, high-performance differential bio amplifier optimized for the measurement of a wide variety of biological signals such as ECG, EMG and EEG recordings. |
| Quad Bridge Amp | Adinstruments | FE224 | A four-channel, non-isolated bridge amplifier designed to allow the PowerLab to connect to most DC bridge transducers. |
| LabChart 8 | Adinstruments | ||
| ABL80 FLEX CO-OX blood gas analyzer | Radiometer | pH / p CO2 / p O2 | |
| SURFLO Teflon I.V. Catheter | Terumo | sc-361556 | Only use the flexible thin wall catheter (49-mm long) |
| Pipet/Infusion Needle | Hamilton | 7748-03 | 17-gauge; 93-mm long; 10-degree angle |
| Classic T3 Vaporizer | SurgiVet | VCT302 | Classic T3 Isoflurane Funnel Fill |
| ENVIRO-PURE Charcoal Canister | SurgiVet | 32373B10 | Designed to absorb waste anesthetic gas |
| O2 single flowmeter | SurgiVet | 32375B1 | 0-1000 mL |
| N2O Flowmeter | VetEquip | 401721 | 0-4LPM |
| Clay Adams Intramedic Luer-Stub Adapter (Sterile) | Becton Dickinson | 427565 | 23 gauge |
| Micro Forceps | Black and Black surgical | B3FRC-18 RM-8 | 7 1/4" (18 cm), 8mm RH, counterweight w/ guide pin 2mm, platform 6 x .3 mm, curved. |
| Halstead Mosquito Forceps | Roboz | RS-7111 | Curved; 5" Length, 1.3 mm tip diameter, 2.1 mm jaw width |
| Mixter Forceps | Roboz | RS-7291 | 5.25" Curved Extra Delicate, 1.1 mm tips |
| Castroviejo Micro Dissecting Spring Scissors | Roboz | RS-5650 | Straight, Sharp Points; 9 mm Cutting Edge; 0.15 mm Tip Width; 3 1/2" Overall Length |
| Mayo-Stille Scissors | Roboz | RS-6891 | 5.5" Round Curved |
| Dumont #5 Forceps | Roboz | RS-5058 | 45 Deg Dumoxel Tip Size .10 x .06 mm |
| Olsen-Hegar Combination Scissor And Needle Holder | Roboz | RS-7884 | Cross Serration Tip; 5.5" Length |
| Moloney Forceps | Roboz | RS-8254 | Serrated; Slight Curve; 4.5" Length |
Referências
- Writing Group, M., et al. Heart Disease and Stroke Statistics-2016 Update: A Report From the American Heart Association. Circulation. 133, e38-e360 (2016).
- Beuret, P., et al. Cardiac arrest: prognostic factors and outcome at one year. Resuscitation. 25, 171-179 (1993).
- Kim, Y. J., et al. Long-term neurological outcomes in patients after out-of-hospital cardiac arrest. Resuscitation. 101, 1-5 (2016).
- Earnest, M. P., Yarnell, P. R., Merrill, S. L., Knapp, G. L. Long-term survival and neurologic status after resuscitation from out-of-hospital cardiac arrest. Neurology. 30, 1298-1302 (1980).
- Cerchiari, E. L., Safar, P., Klein, E., Cantadore, R., Pinsky, M. Cardiovascular function and neurologic outcome after cardiac arrest in dogs. The cardiovascular post-resuscitation syndrome. Resuscitation. 25, 9-33 (1993).
- Petito, C. K., Feldmann, E., Pulsinelli, W. A., Plum, F. Delayed hippocampal damage in humans following cardiorespiratory arrest. Neurology. 37, 1281-1286 (1987).
- Schmidt-Kastner, R., Freund, T. F. Selective vulnerability of the hippocampus in brain ischemia. Neuroscience. 40, 599-636 (1991).
- Corkin, S. What's new with the amnesic patient H.M.?. Nat Rev Neurosci. 3, 153-160 (2002).
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. 1957. J Neuropsychiatry Clin Neurosci. 12, 103-113 (2000).
- Smith, T. D., Calhoun, M. E., Rapp, P. R. Circuit and morphological specificity of synaptic change in the aged hippocampal formation. Neurobiol Aging. 20, 357-358 (1999).
- Gage, F. H., Dunnett, S. B., Bjorklund, A. Spatial learning and motor deficits in aged rats. Neurobiol Aging. 5, 43-48 (1984).
- Tulving, E., Markowitsch, H. J. Episodic and declarative memory: role of the hippocampus. Hippocampus. 8, 198-204 (1998).
- Neigh, G. N., et al. Cardiac arrest with cardiopulmonary resuscitation reduces dendritic spine density in CA1 pyramidal cells and selectively alters acquisition of spatial memory. Eur J Neurosci. 20, 1865-1872 (2004).
- Volpe, B. T., Davis, H. P., Towle, A., Dunlap, W. P. Loss of hippocampal CA1 pyramidal neurons correlates with memory impairment in rats with ischemic or neurotoxin lesions. Behav Neurosci. 106, 457-464 (1992).
- Astur, R. S., Taylor, L. B., Mamelak, A. N., Philpott, L., Sutherland, R. J. Humans with hippocampus damage display severe spatial memory impairments in a virtual Morris water task. Behav Brain Res. 132, 77-84 (2002).
- Lee, R. H., et al. Fatty acid methyl esters as a potential therapy against cerebral ischemia. OCL. 23, D108 (2016).
- Lee, R. H., Porto, L. F., et al. Chapter 1. Palmitic acid: occurrence, biochemistry and health effects. , 1-15 (2014).
- Tolman, E. C., Gleitman, H. Studies in spatial learning; place and response learning under different degrees of motivation. J Exp Psychol. 39, 653-659 (1949).
- Koopmans, G., Blokland, A., van Nieuwenhuijzen, P., Prickaerts, J. Assessment of spatial learning abilities of mice in a new circular maze. Physiol Behav. 79, 683-693 (2003).
- Barnes, C. A. Memory deficits associated with senescence: a neurophysiological and behavioral study in the rat. J Comp Psychol. 93, 74-104 (1979).
- Paul, C. M., Magda, G., Abel, S. Spatial memory: Theoretical basis and comparative review on experimental methods in rodents. Behav Brain Res. 203, 151-164 (2009).
- Vorhees, C. V., Williams, M. T. Assessing spatial learning and memory in rodents. ILAR J. 55, 310-332 (2014).
- Sharma, S., Rakoczy, S., Brown-Borg, H. Assessment of spatial memory in mice. Life Sci. 87, 521-536 (2010).
- Poon, T. P., et al. Spinal cord toxoplasma lesion in AIDS: MR findings. J Comput Assist Tomogr. 16, 817-819 (1992).
- Sunyer, B., Patil, S., Höger, H., Lubec, G. Barnes maze, a useful task to assess spatial reference memory in the mice. Nat Protoc. 390, (2007).
- Shoji, H., Hagihara, H., Takao, K., Hattori, S., Miyakawa, T. T-maze forced alternation and left-right discrimination tasks for assessing working and reference memory in mice. J Vis Exp. , (2012).
- Seeger, T., et al. M2 muscarinic acetylcholine receptor knock-out mice show deficits in behavioral flexibility, working memory, and hippocampal plasticity. J Neurosci. 24, 10117-10127 (2004).
- Olton, D. S., Feustle, W. A. Hippocampal function required for nonspatial working memory. Exp Brain Res. 41, 380-389 (1981).
- Hayashida, K., et al. Hydrogen inhalation during normoxic resuscitation improves neurological outcome in a rat model of cardiac arrest independently of targeted temperature management. Circulation. 130, 2173-2180 (2014).
- Dember, W. N., Richman, C. L. . Spontaneous alternation behavior. , (1989).
- Deacon, R. M., Rawlins, J. N. T-maze alternation in the rodent. Nature protocols. 1, 7-12 (2006).
- Wong, K. V., Hernandez, A. A review of additive manufacturing. ISRN Mechanical Engineering. 2012, (2012).
- Lin, H. W., et al. Derangements of post-ischemic cerebral blood flow by protein kinase C delta. Neuroscience. 171, 566-576 (2010).
- Lin, H. W., et al. Fatty acid methyl esters and Solutol HS 15 confer neuroprotection after focal and global cerebral ischemia. Transl Stroke Res. 5, 109-117 (2014).
- Lee, R. H., et al. Interruption of perivascular sympathetic nerves of cerebral arteries offers neuroprotection against ischemia. Am J Physiol Heart Circ Physiol. 312, H182-H188 (2017).
- Bali, Z. K., et al. Differential effects of alpha7 nicotinic receptor agonist PHA-543613 on spatial memory performance of rats in two distinct pharmacological dementia models. Behav Brain Res. 278, 404-410 (2015).
- McDonald, J. H. . Handbook of biological statistics. 2, (2009).
- Castellano, M. A., Diaz-Palarea, M. D., Rodriguez, M., Barroso, J. Lateralization in male rats and dopaminergic system: evidence of right-side population bias. Physiol Behav. 40, 607-612 (1987).
- Andrade, C., Alwarshetty, M., Sudha, S., Suresh Chandra, J. Effect of innate direction bias on T-maze learning in rats: implications for research. J Neurosci Methods. 110, 31-35 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados