Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Unter Verwendung der modifizierten T-Maze um Funktionsgedächtnis Ergebnisse nach Herzstillstand zu bewerten
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Verwendung einer modifizierten T-maze lernen/Funktionsgedächtnis in Asphyxie Herzstillstand-induzierte zerebraler Ischämie zu bewerten.
Zusammenfassung
Hintergrund: Bewertung leichte bis moderate kognitive Beeinträchtigung in einem globalen zerebralen Ischämie (d.h. Herzstillstand) Modell kann wegen schlechten Fortbewegung nach der Operation sein. Z. B. Ratten, die chirurgische Eingriffen unterzogen werden und unterliegen der Morris-Wasser-Irrgarten zu schwimmen, möglicherweise nicht so stornieren das Experiment.
Neue Methode: Wir etabliert einen veränderten Verhaltens spontane Wechsel-T-maze-Test. Der große Vorteil des modifizierten T-maze-Protokolls ist seine relativ einfaches Design, das stark genug, um lernen/Funktionsgedächtnis nach Ischämie zu bewerten ist. Darüber hinaus ist die Datenanalyse einfach und unkompliziert. Wir haben die T-maze bestimmen, die Ratten lernen/Gedächtnisdefizite sowohl in das Vorhandensein oder Fehlen von leicht bis mittelschwer (6 min) asphyktisch Herzstillstand (ACA). Ratten haben eine natürliche Tendenz zur Exploration und untersuchen die Alternative Arme in der T-maze, während hippocampal lesioned Ratten neigen dazu, anzunehmen, eine Seite-Präferenz führt verringerte spontane Wechsel Verhältnisse, enthüllt die hippocampal-bezogenen Lernen/Funktionsgedächtnis in das Vorhandensein oder Fehlen von ACA.
Ergebnisse: ACA Gruppen haben höhere Seite Preference-Verhältnisse und unteren Wechsel im Vergleich zur Kontrolle.
Vergleich mit bestehenden Methode(n): The Morris Wasser und Barnes Labyrinth sind prominenter zur Beurteilung lernen/Memory-Funktion. Der Morris-Wasser-Irrgarten ist jedoch mehr Stress als andere Labyrinthe. Das Barnes Labyrinth ist weit verbreitet, Referenz (Langzeit-) Speicher, zu messen, während ACA-induzierte neurokognitive Defizite zu arbeiten (Kurzzeitgedächtnis) näher verwandt sind.
Fazit: Wir haben eine einfache, aber effektive Strategie, um abzugrenzen, arbeiten (Kurzzeitgedächtnis) über die T-maze in unserem globalen zerebralen Ischämie-Modell (ACA) entwickelt.
Einleitung
Laut der American Heart Association (2017), Herzstillstand (CA)-induzierte Mortalität tritt alle vier Minuten und wirkt sich auf mehr als 400.000 Menschen pro Jahr in den Vereinigten Staaten1. Es ist gut dokumentiert, dass CA dazu führen, neuronale Hirnschädigung infolge unzureichender Blut Perfusion2,3,4 dass kann. CA-induzierten-Hirn-Trauma auftritt in der Ischämie-Sensitive CA1-Region des Hippocampus5,6,7, die Neuronen, die für lernen und Gedächtnis8,9von entscheidender Bedeutung sind, 10,11,12. Darüber hinaus spielt der Verlust der dendritischen Spine Stromdichte, ischämischen Bedingungen im Hippocampus (d.h. CA1 Neuronen), eine entscheidende Rolle in räumliche Gedächtnis Beeinträchtigung13,14,15. Aufgrund dieser pathologischen Veränderungen nach CA Verhaltens Störungen wie: Angst, Depression, posttraumatische Belastungsstörung und Gedächtnisverlust kommen häufiger. Zwar gab es Fortschritte in der Medizintechnik (d.h. effiziente ambulante Dienst), die mit verbesserter CA-Überlebensraten korrelieren, scheitern die meisten neuroprotektive Behandlungen (mit Ausnahme von Hypothermie) zur Verbesserung der funktionellen Ergebnisse nach CA16 ,17. CA Überlebenden in der Regel haben eine schlechte Qualität des Lebens, und sind mit zusätzlichen medizinischen16Ausgaben belastet.
Kognitiven Status Bewertungen für zerebrale Ischämie über Verhaltensstörungen Tests sind wichtig für beide Wirksamkeit von Medikamenten zu bestimmen und letztlich eine erfolgreiche klinische Studie zu entwickeln. In den 1940er Jahren entwarf Edward Tolman die erste Verhalten-Studie, Hippocampus-basierte räumliche Gedächtnis18zu studieren. Anschließend wurden verschiedene Labyrinthe (d. h. Morris Wasser-Irrgarten, radiale Labyrinth, T oder Y-Labyrinth, und Barnes Labyrinth) entwickelt, um hippocampal-basierte räumliche lernen und Gedächtnis bei Ratten19,20,21,22 bewerten ,23. Eines der gängigsten Verhaltens Test ist der Morris-Wasser-Irrgarten, der räumlichen Lernens untersucht und Speicher in der Ratte Modelle24. Der Morris-Wasser-Irrgarten erfordert jedoch die Ratte zu schwimmen und volle Motorik und Kontrolle ausüben. Für Ischämie Experimente wie das Modell asphyktisch Herzstillstand (ACA, einem Rattenmodell der CA) Kanülierung der Femoral Arterie/Vene müssen wichtige Blutdruck, Blutgase und Einführung von verschiedenen Drogen zu erhalten. Der Morris-Wasser-Irrgarten sind möglicherweise nicht das geeignetste, kognitive Beeinträchtigungen unter ACA zu testen, da Femoral Arterie/Vene Kanülierung Bein Mobilität Rendern die Ratte Fähigkeit, richtig zu schwimmen hemmen kann.
Das Barnes Labyrinth ist der anderen weit verbreiteten Verhaltens Test, räumliche lernen und Gedächtnis bei Nager-Modelle zu prüfen. Das Barnes Labyrinth erfordert keine Anstrengung der vollen motorischen Funktion und Kontrolle, und damit weniger belastend als Morris Wasser-Irrgarten. In der Vergangenheit führten wir Experimente mit dem Barnes Labyrinth um festzustellen, ob lernen/Funktionsgedächtnis Unterschiede zwischen auftreten Kontrolle oder Schein versus ACA-induzierte Ratten. Die Daten erhalten, für das Barnes Labyrinth nicht die Auflösung testen kognitive Beeinträchtigungen nach leichten bis moderaten ACA, da das Barnes Labyrinth weit verbreitet ist, Messen Sie Referenz (langfristig) Speicher25,26, zwar ACA-induzierte neurokognitive Defizite mehr eng mit arbeiten (kurzfristig) Speicher27,28,29,30 darauf hindeutet, dass das Barnes Labyrinth weniger rentabel für die Beurteilung der Memory-Funktion in unseren ACA Modell.
Wir haben somit eine modifizierte T-maze mit spontanen Wechsel Test auszuwertende arbeiten (Kurzzeitgedächtnis) nach ACA entwickelt. Modifizierter T-maze spontane Wechsel Test Hauptvorteil ist seine Einfachheit und minimale Belastung auf die Ratten im Vergleich zu anderen Verhaltensstörungen Tests, da die modifizierte T-maze keine tierischen Vorbildung als auch so schwer rechnerische erfordert Analyse oder Sub-Routinen (d.h. video Imaging der Ratte) je nach Bedarf durch den Morris Wasser-Irrgarten und Labyrinth Barnes. Hier zeigen wir, dass die modifizierte T-maze spontane Wechsel Test eine einfache und doch hoch effiziente Verhaltens Testversion Paradigma, die bieten genügend Auflösung genau zu erkennen und bewerten hippocampal Funktion in Krankheiten, die Verlust des phosphoreszierenden Gedächtnisses führen (d. h. ACA).
Protokoll
Alle experimentelle Verfahren wurden gemäß den Richtlinien des National Institutes of Health durchgeführt und durch die institutionelle Animal Care and Use Committee (LSU Health Sciences Center-Shreveport) für die Nutzung der männlichen Sprague-Dawley Ratten (genehmigt 300-350 g, 9-10 Wochen alt). Ratten wurden über Nacht vor der Operation ACA gefastet.
1. T-maze Apparat Design und Umgebung
Hinweis: Basieren Sie das T-maze-Design die Diakon und Rawlins' 2006 Modell31.
- 3D-Struktur des Labyrinths mit SketchUp32zu entwerfen. Um eine 3D-Struktur von der T-maze zu erstellen, konstruieren Sie die Start-Arm mit einer Außenlänge von 200 mm, breite 165 mm und Höhe von 148 mm passt in die Druckereien Dimensionen des 3D-Druckers. Verwenden Sie eine Wandstärke von 5,5 mm und 8 mm Bodendicke.
- Das Labyrinth mit einem 3D Drucker zu drucken (siehe Tabelle der Materialien)32. Wenn ein 3D-Drucker im Labor nicht verfügbar ist, verwenden Sie andere Materialien wie Holz, mitteldichte Holzfaserplatte oder einem Kunststoff (z. B. Polyvinylchlorid), die aus Baumärkten erworben werden können.
- Aufgrund von Höhenbeschränkungen im Druckbereich, konstruieren die Wände des Labyrinths in zwei separaten 3D-Drucke und gemeinsam bei der Labyrinth-Montage (d. h. eine zweite Wandhöhe wurde hinzugefügt, um die Labyrinth-Abschnitt auf der Höhe von 140 mm für eine gesamte Wandhöhe von 280 mm erhöhen). Jede separate 3D print-Basis enthalten eine "T" Form Verriegelungsmechanismus, wo verbunden einem Abschnitt zum nächsten.
- Erstellen Sie an der Kreuzung der Anfangsarm mit dem Ziel Wappen einen 165-mm breiten Abschnitt um die Breite des Start-Arm mit der Ziel-Waffen beizutreten. Konstruieren Sie die Ziel-Arme mit einem ähnlichen Design-Methode als die Anfangsarm; jedoch verringern Sie die Breite des Armes bis 100 mm pro das Design der Diakon und Rawlins.
- Detaillierten Schaltplan/Abmessungen der T-maze finden Sie in Abbildung 1 .
- Fügen Sie eine zentrale Partition in das Design an der Kreuzung des Anfangsarm und der Ziel-Arme. Verlängern Sie diese Partition aus der hinteren Wand der T-maze und 200 mm in den Start-Arm, die Ziel-Arme aufzuteilen. Diese Partition erweitert auch die Höhe des Labyrinths (Abbildung 1).
2. asphyktisch Herzstillstand (ACA)
- Autoklaven chirurgische Instrumente (121 ° C für 15 Minuten) vor Beginn der Operation. Desinfizieren Sie dem OP-Tisch von 70 % Ethanol zu 15 min. rasieren Tierhaare am Ort der Operation. Tragen Sie eine Betadine Lösung um Oberflächen für chirurgische Operation Haut auf.
- Anesthetization
- Ratten mit 4 % Isofluran und 30: 70 Mischung aus O2 und N2O (300 mL/min O2 und 700 mL/min N2O) per Maske zu betäuben.
- Geben Ratten Endotracheale Intubation für mechanische Lüftung (nach Intubation, wurden Ratten an ein Beatmungsgerät angeschlossen).
- Pflegen Sie Anästhesie durch Senkung der Isofluran von 4 % auf 2 % mit einer 30: 70-Mischung aus O2 und N2O. Verwendung der Pinch-Response-Verfahren auf die Tiefe der Narkose zu bestimmen.
- Tragen Sie Salbe auf Augen, Trockenheit während der Narkose zu verhindern. Regulae die Körpertemperatur durch ein Nagetier Heizkissen mit einer Analsonde als Temperatur Referenz.
- Endotracheale intubation
- Legen Sie die Ratte in der Induktion-Kammer. Betäuben Sie die Ratten mit 4 % Isofluran und 30: 70 Mischung aus O2 und N2O.
- Entfernen Sie die Ratte aus der Induktion-Kammer. Ort narkotisierten Tier in Rückenlage mit der Ratte Gesicht in Richtung der Anästhesie-Maske.
- Sanft bewegen Sie die Zunge in Richtung entweder links oder rechts des Tieres mit dem linken Daumen und Zeigefinger.
- Gleiten Sie einen 14er flexible intravenöse Katheter (49 mm langen) über eine stumpfe Spitze 17-Gauge Pipettieren Nadel (93 mm lang mit 10-Grad-Winkel an der Spitze der Nadel). Setzen Sie die 17-Gauge stumpfe Spitze Pipettieren Nadel in die Luftröhre.
- Ziehen Sie vorsichtig heraus das Pipettieren 17-Gauge-Nadel von der Luftröhre. Den 14-Gauge-Katheter-Hub an das Beatmungsgerät anschließen. Ventilator Schlagvolumen zu 0,67 mL/100 g und Atemfrequenz von 60 Atemzüge/min einstellen.
- Kopf und Körper Temperatur bei 37 ° C während des gesamten Verfahrens durch ein Nagetier Heizkissen mit Analsonde als Referenz Temperatur zu halten.
- Femoralen arteriellen und venösen Katheterisierung
- Rasieren Sie, Haare in der Nähe des leisten-(beide Seiten) und wenden Sie Betadine Oberflächen für den operativen Betrieb der Haut an.
- Die Ratte in der Rückenlage gelegt. Machen Sie einen Schnitt (10 mm) in der leisten-Gegend mit Chirurgische Scheren.
- Trennen Sie das Bindegewebe durch stumpfe Spitze Pinzette, bis der inguinalen Ligamentum ausgesetzt ist. Verwenden Sie eine Gefäßklemme, um leisten-Ligament zu erfassen. Die Femoral Arterie und Vene werden unterhalb der inguinalen Ligament.
- Verwenden Sie stumpfe Spitze Pinzette, um das Bindegewebe zu trennen, bis die Femoral Arterie und Vene freigelegt werden.
- Trennen Sie vorsichtig den femoralen Nerv führt entlang der Femoral Arterie über feine Spitze Pinzetten. Sorgfältig trennen die Femoral Arterie und Vene als Einheit über feine Spitze Pinzetten.
- Verwenden Sie feine Spitze Pinzette, um die Femoral Arterie aus der Vene zu trennen.
- Legen Sie 2 Stücke von 5-0 Seide Naht (eine in Richtung das Bein und der andere zum Körper hin) in die Vene.
- Knoten Sie einen losen seitlich am Körper. Verwenden Sie eine Gefäßklemme, halten und ziehen den Faden so weit wie möglich auf den gegenüberliegenden Seiten des Körpers.
- Verknoten Sie auf der Seite in der Nähe das Bein locker. Halten Sie und ziehen Sie den Faden in Richtung das Bein über eine Gefäßklemme erlauben die Vene mit Blut zu füllen.
- Machen Sie einen kleinen Schnitt in die Vene (ca. 0,1 mm) durch Mikro-sezieren Schere (in einem 45°-Winkel). Genießen Sie Blut mit steriler Gaze.
- Legen Sie eine stumpfe Spitze Nadel Spritze (gefüllt mit Kochsalzlösung mit 20 U/mL Heparin) auf einen PE-50-Katheter. Füllen Sie den PE-50-Katheter mit Kochsalzlösung mit 20 U/mL Heparin. Schneiden Sie in einem 45°-Winkel erstellen Sie einen Punkt oder scharfe Ende den PE-50-Katheter mit Dissektion Schere. Verwenden Sie stumpfe Spitze Pinzette an um das Ende des Katheters PE-50 zu halten. PE-50-Katheter vorsichtig in die femoral Ader einfügen
- Nachdem der Katheter vollständig eingeführt ist, verwalten Sie langsam 0,1 mL Heparin/Kochsalzlösung um sicherzustellen, dass es kein Leck. Knoten Sie fest Naht (Single-Knoten), PE-50 Katheter zu stabilisieren. Halten Sie die PE-50-Katheter für die kontinuierliche intravenöse (IV) Injektion von verschiedenen Drogen.
- Verwendung eine 1 mL Spritze verbunden mit einem 23 gauge Luer-Stub-Adapter, Vecuronium Bromid (0,67 mg/kg, verwaltet alle 10 Minuten) zu verwalten über die femoral Ader, die Ratte während des Verfahrens zu immobilisieren.
- Legen Sie 2 Stücke von 5-0 Seide Naht (eine in Richtung das Bein und der andere zum Körper hin) unter der Arterie.
- Verknoten Sie auf der Seite in der Nähe das Bein locker. Verwenden Sie eine Gefäßklemme, halten und ziehen den Faden so weit wie möglich auf das Bein.
- Knoten Sie einen losen seitlich am Körper. Halten Sie und ziehen Sie den Faden in Richtung des Körpers über einen Gefäßklemme erlauben die Arterie mit Blut zu füllen.
- Machen Sie einen kleinen Schnitt in der Arterie (ca. 0,1 mm) durch Mikro-sezieren Schere (in einem 45°-Winkel).
- Legen Sie eine stumpfe Spitze Nadel Spritze (gefüllt mit Kochsalzlösung mit 20 U/mL Heparin) auf einen PE-50-Katheter. Füllen Sie den PE-50-Katheter mit Kochsalzlösung mit 20 U/mL Heparin. Schneiden Sie den PE-50-Katheter mit Dissektion Schere in einem 45-Grad-Winkel erstelle ich ein Punkt oder Sharp End. Verwenden Sie stumpfe Spitze Pinzette an um das Ende des Katheters PE-50 zu halten. Verwenden Sie stumpfe Spitze Pinzette an um das Ende des Katheters PE-50 zu halten. Den PE-50 Katheter vorsichtig in die Femoral Arterie einfügen
- Nachdem der Katheter vollständig eingeführt ist, langsam zurückziehen der Spritze um sicherzustellen, dass diese Katheter funktionsfähig ist. Knoten Sie fest Naht (Single-Knoten), PE-50 Katheter zu stabilisieren. Halten Sie den PE-50-Katheter für die kontinuierliche Aufnahme von arteriellen Druck und Blut Gasen.
- Asphyktisch Herzstillstand (ACA) Verfahren
- Passen Sie physiologische Parameter (z. B. pO2, pCO2, Blutdruck und pH-Wert an) nach Bedarf durch Modulation Schlagvolumen, O2 oder N2O Ebenen. Verwenden Sie normalen physiologischen Bereich dieser Parameter: pO2: 100 MmHg, pCO2: 35-40 MmHg, Blutdruck: 100 MmHg und pH: 7.4.
- Verwenden Sie eine 1 mL Spritze verbunden mit einem 23 Gauge Luer Stub Adapter Vecuronium Bromid (0,67 mg/kg, I.V.) über femoral Ader zu verwalten und warten auf 2 min. Stellen Sie sicher, dass der Blutdruck ist oder rund 100 MmHg vor der Durchführung der ACA.
- Apnoe (6 min) durch den Endotrachealtubus (14-Guage Katheter Hub) vom Beatmungsgerät trennen zu induzieren. Weitere blockieren Sie den Endotrachealtubus durch eine 1 mL Spritze um komplette Apnoe zu gewährleisten.
Hinweis: Die 6-minütiger Asphyxie-Zeit bezeichnet den Zeitraum zwischen Beatmungsgerät Trennung und dem Beginn der Reanimation. Komplette Herzstillstand ist definiert als eine arterielle Mitteldruck niedriger als 10 MmHg. - Während der letzten Minuten der Apnoe einstellen Sie Atemfrequenz des Ventilators auf 80 Atemzüge/min und erhöhen Sie O2 , 2 L/min mit 0 % N2O. Diese Aktion werden alle verbleibenden Isoflurane oder N2O bleiben im Beatmungsgerät ausblasen.
- min nach Apnoe, entfernen 1 mL Spritze aus den Endotrachealtubus. Schließen Sie den Endotrachealtubus an den Ventilator.
- Verwendung eine 1 mL Spritze verbunden mit einem 23 gauge Luer-Stub-Adapter zu Epinephrin (0,005 mg/kg, I.V.) über femoral Ader verwalten und administrieren manuelle Herzdruckmassage durch den Daumen, zeige- und Mittelfinger auf das Tier Brust mit leichten kreisenden Bewegungen auf das x und z-Achse (200/min) bis Rückkehr der spontanen Zirkulation (arterielle Mitteldruck ≥ 50 MmHg)33,34,35.
- Verwendung einer anderen 1 mL Spritze verbunden mit einem 23 gauge Luer-Stub-Adapter, Natriumbicarbonat (1 mmol/kg, I.V.) über femoral Ader sofort nach Rückkehr in die spontane Zirkulation zu verwalten (50 MmHg oder höher)33,34, 35 , Respiratorische Azidose zu lindern.
- Maßnahme Blut Gase wieder 10 min nach Reanimation zu bestimmen, den Säure-Basen-Status (pH-Wert nach ACA sollte ca. 7,35 um 7.40)
- Verwenden Sie eine Gefäßklemme Femoral Arterie und Vene einspannen. Entfernen Sie langsam und sanft arterielle und venöse Katheter mit stumpfe Spitze Pinzette. Verbinden Sie Femoral Arterie/Vene mit einer 5-0 Seide Naht um Blutungen zu verhindern. Schließen Sie die Haut über der Operationsstelle mit einer 3: 0 Seide Naht. Verwenden Sie die unterbrochene Box-Technik, um die Chancen der Wunde Wiedereröffnung zu minimieren.
- Warten Sie, bis die Ratte selbst (in der Regel 30 min bis 60 min nach Reanimation) atmet, trennen Sie die Ratte vom Beatmungsgerät und entfernen Sie vorsichtig den Endotrachealtubus.
- Ort der Ratte in den Baby-Inkubator (27 ° C, 50 % Luftfeuchtigkeit) über Nacht. Weiche Speisen (hergestellt durch Einweichen in Wasser) und Wasser in den Brutkasten Baby über Nacht.
- Die Ratte in den einzelnen Käfig zu übertragen und die Ratte in Tierhaus mit regelmäßigen Chow und Wasser zurück. T-Maze Tests beginnen 3 Tage nach der ACA.
(3) T-maze
-
Tierische Vorbereitung
- Behandeln Sie am Tag vor der Operation (Schein oder ACA), jede Ratte für 5 Minuten. Heben Sie nie Ratten aus ihrem Käfig (480 mm x 250 mm x 200 mm, Kunststoff transparent Käfig) wenn Handhabung (Abbildung 2).
- Nach dem Umgang mit der Ratte, sanft abholen die Ratte seinen Schwanz mit einer Hand mit der anderen Hand unterstützt seine "Beine. Lassen Sie sie von der Hand in den Käfig (100 mm Höhe) 5 Mal springen. Jede Ratte ist in einzelne Käfige zu trennen, damit sie nicht für Lebensmittel und/oder Kampf dominieren werden.
- Übertragen Sie drei Tage nach dem Schein oder ACA-Chirurgie (Abbildung 2), die Ratten mit dem Käfig in einen ruhigen und dunklen Raum vor dem Start des ersten Laufs. Nur eine low-Power-Schreibtischlampe schalten Sie und legen Sie sie an der Ecke der Testraum, Mindestbeleuchtung beizubehalten. Lassen Sie die Ratte Anpassung an Dunkelheit für 10 min.
- Durchführen Sie alle Experimente, am Nachmittag um eventuelle Auswirkungen der Tagesgang auf Ratten Performance zu vermeiden. Raten Sie den Bediener nicht auf die Ratte erhielt Schein oder ACA Operation.
-
Spontane Wechsel
- Verteilen Sie eine dünne Schicht von Betten (~ 10 mm dick), um die gesamte Etage des Labyrinths zu decken. Legen Sie dann die Ratte am Start Arm (unten auf der "T"), ist der Ausgangspunkt eines jeden ausgeführt und erlauben jedem Ratte 3 min, die Ziel der rechten oder linken Arm zu erkunden.
- Sobald die Ratte zu einem bestimmten Ziel Arm begeht (alle vier Pfoten der Ratte eingegeben haben den Ziel-Arm), blockieren der "T"-Kreuzung zwischen Start-Arm und den gegnerischen Ziel (Abbildung 1) zu verhindern, dass die Ratte in das gegnerische Tor-Arm. Lassen Sie die Ratte im Labyrinth für 30 Sekunden, dann holen Sie die Ratte und legen Sie es zurück in seinen Käfig für eine minimale Zeit (~ 30 Sekunden). Entfernen Sie dann die "T"-Kreuzung (125 mm X 230 mm X 65 mm, gemacht von einem 3D-Drucker) aus der T-maze zu blockieren.
- Legen Sie die Ratte am Start Arm und wiederholen Sie 3.2.2. Wechsel ist definiert als: Wenn die Ratte betritt den gegenüberliegenden Arm im Vergleich zu den vorherigen laufen36. Haben Sie Ratten 4 Fahrten pro Tag wie folgt durchführen:
1St laufen
2Nd laufen
10 min Pause
3rd Lauf
4th ausgeführt - Ändern Sie die Bettwäsche in der 10-min-Pause und zwischen Tieren, Duft Vorurteile zu beseitigen. Reinigen Sie die T-maze mit 75 % Ethanol, gefolgt von destilliertem Wasser am Ende des experimentellen täglich.
- Wiederholen Sie die Schritte 3.2.1. -3.2.4. zwei weitere Tage (12 läuft insgesamt) wie in Abbildung 2.
-
Wechsel-Rate und Seite Präferenz Berechnung
- Berechnen Sie die Abwechslung und die % Seite bevorzugt, wo
L: die Ratten wählen Sie den linken arm
R: die Ratten wählen Sie den rechten arm
Wahl zu korrigieren: die 2Nd laufen unterscheidet sich von der 1St in einer gegebenen Menge (jedes Set enthält zwei Läufen)
Falsche Wahl: die Ratten wählen den gleichen Arm, ähnlich wie bei der vorherigen Ausführung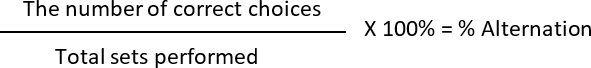
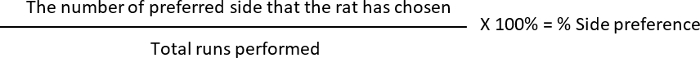
Beispiel:
Tag 1: L L / L L
Tag 2: L L / L-R
Tag 3: R L / L L
Wechsel: 2 (richtige Entscheidungen) 6 (total Sätze durchgeführt) * 100 = 33,33 %
Seite Präferenz: 10 (L, bevorzugte Seite) 12 (total Läufe durchgeführt) * 100 = 83,33 %
- Berechnen Sie die Abwechslung und die % Seite bevorzugt, wo
-
Postoperative Pflege:
- Geben Ratten Buprenorphin (0,01 mg/kg IP) alle 12 Stunden für 2 Tage nach der Operation. Beobachten Sie Ratten für bis zu 1 h nach Herzstillstand.
- Legen Sie Ratten auf den Ventilator und Heizkissen, bis es ausreichend Bewusstsein zur Aufrechterhaltung der sternalen liegen wiedererlangt hat. Um die Körpertemperatur der Tiere nach der Operation zu erhalten, legen Sie die Ratte in einem Baby-Inkubator (eingestellt bei 27 ° C, 50 % Luftfeuchtigkeit).
- Bieten Sie weiche Chow (hergestellt durch Einweichen in Wasser) für Tiere für die ersten 24 h nach der Operation. Wären die Ratten nicht Trinkwasser, verwalten bakteriostatische Kochsalzlösung (100 mL/kg/Tag, i.p.), bis das Tier erholt sich und Trinkwasser frei.
- Geben Sie die Ratten topisches Antibiotikum mit Schmerzlinderung (Bacitracin und Lidocain-Salbe) auf alle Wunden. Verschieben Sie Ratten wieder in die Tierstation, nachdem sie vollständig zu erholen.
-
Euthanasie-Methode
- Verwenden Sie 5 % Isofluran und 100 % N2O, die Tiere am Ende des Experiments einzuschläfern.
Ergebnisse
ACA (globalen zerebralen Ischämie) verursacht vor allem arbeiten (kurzfristig) Speicher Defizite28,29. Um die Funktion von lernen und Gedächtnis nach ACA zu bewerten, haben wir den modifizierten spontane Wechsel Test auszuwertende arbeiten (kurzfristig) Speicher30verwendet. Ergebnisse aus spontanen Wechsel Test deuten darauf hin, dass der Wechsel von drei aufeinander folgenden Tagen in der ACA-Gruppe (26,...
Diskussion
In der vorliegenden Studie im Vergleich zu Deacon und Rawlins Protokoll31wurden Änderungen vorgenommen. Der 3D-Drucker wurde verwendet, um die T-maze zu bauen. Der 3D-Druck bietet erschwingliche und kostengünstige Alternativen zu kommerzialisierten T-maze. Um Ratten Angst während des Tests zu reduzieren, wurde die T-maze in den dunklen Raum mit Mindestbeleuchtung durchgeführt. Sobald die Ratte einem der Arme Ziel eingegeben, blockiert wir sanft den gegnerischen Arm. Dies vermeidet möglich Str...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde unterstützt durch die nationalen Institute der Gesundheit/National Institute of Neurological Disorders und Schlaganfall gewähren 1R01NS096225-01A1, gewährt der American Heart Association AHA-13SDG1395001413, AHA-17GRNT33660336, AHA-17POST33660174, die Louisiana State University Grant in Aid Research Council, The Malcolm Feist Cardiovascular Research Fellowship und Evelyn F. McKnight Brain Institute.
Materialien
| Name | Company | Catalog Number | Comments |
| 3D Printer | MakerBot | Replicator | Fifth generation |
| 3D Printer Filament | Hatchbox | PLA, 1.75 mm filament diameter | |
| 200 Proof Pure Ethanol | Koptec | V1005SG | |
| Sani-Chips | PJ Murphy-Forest Products | Size: 8 to 20 mesh; 2.2 cubic foot/package; autoclavable bags | |
| Rat | Charles River Laboratories | Sprague-Dawley | |
| Vecuronium bromide | Sun Pharmaceutical | 47335-931-40 | 10 mg |
| Epinephrine | Par Pharmaceutical | 42023-103-01 | Adrenalin Chloride Solution 1 mg/mL, 1:1000 |
| Buprenorphine Hydrochloride Injection | Pfizer | 00409-2012-32 | 0.3mg/mL |
| SketchUp | Trimble Inc. | 3D modeling software | |
| VentElite Small Animal Ventilator | Harvard Apparatus | 55-7040 | Animals raging in size from mouse to guinea pig (10g to 1kg) |
| PowerLab 8/35 | Adinstruments | PL3508 | 8 analog input channels – 4 of which can be used in differential mode. |
| Bio Amps | Adinstruments | FE132 | The Bio Amp is a galvanically isolated, high-performance differential bio amplifier optimized for the measurement of a wide variety of biological signals such as ECG, EMG and EEG recordings. |
| Quad Bridge Amp | Adinstruments | FE224 | A four-channel, non-isolated bridge amplifier designed to allow the PowerLab to connect to most DC bridge transducers. |
| LabChart 8 | Adinstruments | ||
| ABL80 FLEX CO-OX blood gas analyzer | Radiometer | pH / p CO2 / p O2 | |
| SURFLO Teflon I.V. Catheter | Terumo | sc-361556 | Only use the flexible thin wall catheter (49-mm long) |
| Pipet/Infusion Needle | Hamilton | 7748-03 | 17-gauge; 93-mm long; 10-degree angle |
| Classic T3 Vaporizer | SurgiVet | VCT302 | Classic T3 Isoflurane Funnel Fill |
| ENVIRO-PURE Charcoal Canister | SurgiVet | 32373B10 | Designed to absorb waste anesthetic gas |
| O2 single flowmeter | SurgiVet | 32375B1 | 0-1000 mL |
| N2O Flowmeter | VetEquip | 401721 | 0-4LPM |
| Clay Adams Intramedic Luer-Stub Adapter (Sterile) | Becton Dickinson | 427565 | 23 gauge |
| Micro Forceps | Black and Black surgical | B3FRC-18 RM-8 | 7 1/4" (18 cm), 8mm RH, counterweight w/ guide pin 2mm, platform 6 x .3 mm, curved. |
| Halstead Mosquito Forceps | Roboz | RS-7111 | Curved; 5" Length, 1.3 mm tip diameter, 2.1 mm jaw width |
| Mixter Forceps | Roboz | RS-7291 | 5.25" Curved Extra Delicate, 1.1 mm tips |
| Castroviejo Micro Dissecting Spring Scissors | Roboz | RS-5650 | Straight, Sharp Points; 9 mm Cutting Edge; 0.15 mm Tip Width; 3 1/2" Overall Length |
| Mayo-Stille Scissors | Roboz | RS-6891 | 5.5" Round Curved |
| Dumont #5 Forceps | Roboz | RS-5058 | 45 Deg Dumoxel Tip Size .10 x .06 mm |
| Olsen-Hegar Combination Scissor And Needle Holder | Roboz | RS-7884 | Cross Serration Tip; 5.5" Length |
| Moloney Forceps | Roboz | RS-8254 | Serrated; Slight Curve; 4.5" Length |
Referenzen
- Writing Group, M., et al. Heart Disease and Stroke Statistics-2016 Update: A Report From the American Heart Association. Circulation. 133, e38-e360 (2016).
- Beuret, P., et al. Cardiac arrest: prognostic factors and outcome at one year. Resuscitation. 25, 171-179 (1993).
- Kim, Y. J., et al. Long-term neurological outcomes in patients after out-of-hospital cardiac arrest. Resuscitation. 101, 1-5 (2016).
- Earnest, M. P., Yarnell, P. R., Merrill, S. L., Knapp, G. L. Long-term survival and neurologic status after resuscitation from out-of-hospital cardiac arrest. Neurology. 30, 1298-1302 (1980).
- Cerchiari, E. L., Safar, P., Klein, E., Cantadore, R., Pinsky, M. Cardiovascular function and neurologic outcome after cardiac arrest in dogs. The cardiovascular post-resuscitation syndrome. Resuscitation. 25, 9-33 (1993).
- Petito, C. K., Feldmann, E., Pulsinelli, W. A., Plum, F. Delayed hippocampal damage in humans following cardiorespiratory arrest. Neurology. 37, 1281-1286 (1987).
- Schmidt-Kastner, R., Freund, T. F. Selective vulnerability of the hippocampus in brain ischemia. Neuroscience. 40, 599-636 (1991).
- Corkin, S. What's new with the amnesic patient H.M.?. Nat Rev Neurosci. 3, 153-160 (2002).
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. 1957. J Neuropsychiatry Clin Neurosci. 12, 103-113 (2000).
- Smith, T. D., Calhoun, M. E., Rapp, P. R. Circuit and morphological specificity of synaptic change in the aged hippocampal formation. Neurobiol Aging. 20, 357-358 (1999).
- Gage, F. H., Dunnett, S. B., Bjorklund, A. Spatial learning and motor deficits in aged rats. Neurobiol Aging. 5, 43-48 (1984).
- Tulving, E., Markowitsch, H. J. Episodic and declarative memory: role of the hippocampus. Hippocampus. 8, 198-204 (1998).
- Neigh, G. N., et al. Cardiac arrest with cardiopulmonary resuscitation reduces dendritic spine density in CA1 pyramidal cells and selectively alters acquisition of spatial memory. Eur J Neurosci. 20, 1865-1872 (2004).
- Volpe, B. T., Davis, H. P., Towle, A., Dunlap, W. P. Loss of hippocampal CA1 pyramidal neurons correlates with memory impairment in rats with ischemic or neurotoxin lesions. Behav Neurosci. 106, 457-464 (1992).
- Astur, R. S., Taylor, L. B., Mamelak, A. N., Philpott, L., Sutherland, R. J. Humans with hippocampus damage display severe spatial memory impairments in a virtual Morris water task. Behav Brain Res. 132, 77-84 (2002).
- Lee, R. H., et al. Fatty acid methyl esters as a potential therapy against cerebral ischemia. OCL. 23, D108 (2016).
- Lee, R. H., Porto, L. F., et al. Chapter 1. Palmitic acid: occurrence, biochemistry and health effects. , 1-15 (2014).
- Tolman, E. C., Gleitman, H. Studies in spatial learning; place and response learning under different degrees of motivation. J Exp Psychol. 39, 653-659 (1949).
- Koopmans, G., Blokland, A., van Nieuwenhuijzen, P., Prickaerts, J. Assessment of spatial learning abilities of mice in a new circular maze. Physiol Behav. 79, 683-693 (2003).
- Barnes, C. A. Memory deficits associated with senescence: a neurophysiological and behavioral study in the rat. J Comp Psychol. 93, 74-104 (1979).
- Paul, C. M., Magda, G., Abel, S. Spatial memory: Theoretical basis and comparative review on experimental methods in rodents. Behav Brain Res. 203, 151-164 (2009).
- Vorhees, C. V., Williams, M. T. Assessing spatial learning and memory in rodents. ILAR J. 55, 310-332 (2014).
- Sharma, S., Rakoczy, S., Brown-Borg, H. Assessment of spatial memory in mice. Life Sci. 87, 521-536 (2010).
- Poon, T. P., et al. Spinal cord toxoplasma lesion in AIDS: MR findings. J Comput Assist Tomogr. 16, 817-819 (1992).
- Sunyer, B., Patil, S., Höger, H., Lubec, G. Barnes maze, a useful task to assess spatial reference memory in the mice. Nat Protoc. 390, (2007).
- Shoji, H., Hagihara, H., Takao, K., Hattori, S., Miyakawa, T. T-maze forced alternation and left-right discrimination tasks for assessing working and reference memory in mice. J Vis Exp. , (2012).
- Seeger, T., et al. M2 muscarinic acetylcholine receptor knock-out mice show deficits in behavioral flexibility, working memory, and hippocampal plasticity. J Neurosci. 24, 10117-10127 (2004).
- Olton, D. S., Feustle, W. A. Hippocampal function required for nonspatial working memory. Exp Brain Res. 41, 380-389 (1981).
- Hayashida, K., et al. Hydrogen inhalation during normoxic resuscitation improves neurological outcome in a rat model of cardiac arrest independently of targeted temperature management. Circulation. 130, 2173-2180 (2014).
- Dember, W. N., Richman, C. L. . Spontaneous alternation behavior. , (1989).
- Deacon, R. M., Rawlins, J. N. T-maze alternation in the rodent. Nature protocols. 1, 7-12 (2006).
- Wong, K. V., Hernandez, A. A review of additive manufacturing. ISRN Mechanical Engineering. 2012, (2012).
- Lin, H. W., et al. Derangements of post-ischemic cerebral blood flow by protein kinase C delta. Neuroscience. 171, 566-576 (2010).
- Lin, H. W., et al. Fatty acid methyl esters and Solutol HS 15 confer neuroprotection after focal and global cerebral ischemia. Transl Stroke Res. 5, 109-117 (2014).
- Lee, R. H., et al. Interruption of perivascular sympathetic nerves of cerebral arteries offers neuroprotection against ischemia. Am J Physiol Heart Circ Physiol. 312, H182-H188 (2017).
- Bali, Z. K., et al. Differential effects of alpha7 nicotinic receptor agonist PHA-543613 on spatial memory performance of rats in two distinct pharmacological dementia models. Behav Brain Res. 278, 404-410 (2015).
- McDonald, J. H. . Handbook of biological statistics. 2, (2009).
- Castellano, M. A., Diaz-Palarea, M. D., Rodriguez, M., Barroso, J. Lateralization in male rats and dopaminergic system: evidence of right-side population bias. Physiol Behav. 40, 607-612 (1987).
- Andrade, C., Alwarshetty, M., Sudha, S., Suresh Chandra, J. Effect of innate direction bias on T-maze learning in rats: implications for research. J Neurosci Methods. 110, 31-35 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten