Method Article
عالية الدقة حجم التصوير من الخلايا العصبية باستبعاد استخدام Fluorescence الأسلوب وكرست أجهزة موائع جزيئية
In This Article
Summary
وحدة التخزين معلمة هامة فيما يتعلق بالخصائص الفسيولوجية والمرضية للخلايا. يصف لنا طريقة استبعاد فلورسنت السماح الكامل-ميدان قياس حجم الخلايا العصبية في المختبر مع القرار المحوري مكرمترك الفرعية المطلوبة لتحليل نيوريتيس والهياكل الحيوية ضمناً في نمو الخلايا العصبية.
Abstract
وحدة التخزين معلمة هامة فيما يتعلق بالخصائص الفسيولوجية والمرضية للخلايا العصبية في نطاقات زمنية مختلفة. الخلايا العصبية خلايا فريدة من نوعها تماما فيما يتعلق بما مورفولوجيس متشعب الموسعة وبناء على ذلك رفع العديد من التحديات المنهجية لقياس حجم. في حالة خاصة في المختبر نمو الخلايا العصبية، المنهجية المختارة ينبغي أن يتضمن القرار المحوري الفرعي مكرمترك جنبا إلى جنب مع المراقبة الميدانية الكاملة على جداول زمنية من دقائق إلى ساعات أو أيام. على عكس الأساليب الأخرى مثل التعمير شكل الخلية باستخدام التصوير [كنفوكل]، والقياسات كهربائياً أو "مجهر القوة الذرية"، أسلوب الاستبعاد Fluorescence المطورة حديثا (FXm) لديه القدرة على الوفاء بهذه التحديات. ومع ذلك، على الرغم من كونها بسيطة في مبدئه، يتطلب تنفيذ FXm عالية الاستبانة للخلايا العصبية تعديلات متعددة ومنهجية مخصصة. نحن الحاضرين هنا أسلوب يقوم على المزيج من استبعاد الأسفار وأجهزة موائع جزيئية مقصورات متعددة منخفضة-خشونة وأخيراً ميكروباتيرنينج لتحقيق في المختبر قياسات حجم الخلايا العصبية المحلية. عالية الدقة التي يوفرها الجهاز يسمح لنا بقياس حجم العمليات العصبية (نيوريتيس) المحلية وحجم بعض هياكل محددة تشارك في نمو الخلايا العصبية، مثل النمو والأقماع (الرابطة).
Introduction
معرفة دقيقة بحجم الهاتف الخلوي قد اجتذب اهتماما متزايداً في السنوات الأخيرة، مدفوعا بمسألة التوازن حجم الخلية في الكائنات الحية الدقيقة وحيدة الخلية 1 وأعم في الخلايا الانقسامية 2. ومع ذلك، مسألة حجم الخلية وثيق الصلة أيضا بالخلايا الانقسامية اللاحقة، التي يشكل فيها الخلايا العصبية مثال نموذجية.
وحدة التخزين في الواقع توقيع هامة من الأحداث الفسيولوجية والمرضية في جداول مختلفة والنقاط الزمنية في حياة الخلايا العصبية، من تشوه محواري عابر المرتبطة بالنشاط الكهربائي (مقياس ميلي ثانية) 3 إلى لا رجعة فيها الخلايا العصبية تورم التي تحدث أثناء مرحلة أعراض الأعصاب من الأمراض (على مدى السنوات في البشر) 4. ومع ذلك، يحدث تغيير حجم أكبر في مقياس وقت متوسط لمدة أيام أو أسابيع (اعتماداً على الكائن الحي المدروس) أثناء نمو الخلايا العصبية. مورفولوجية موسعة ومعقدة من الخلايا العصبية ويثير قضايا مضاعفات، منها تنظيم حجم الخلية. محواري طول وقطر في الواقع أحكام التنظيم في فيفو، مع القيم المحددة لكل نوع الخلايا العصبية 5،6.
ويمكن أيضا معالجة هذه المسائل، معقدة لمعالجة في فيفو، بطريقة مبسطة في المختبر. في هذا الهدف، مكرسة لقياس حجم سريعة ما يكفي لتتبع ديناميات النمو (أي في مقياس وقت الدقائق) ومتوافق مع المراقبة على مدى ساعات أو أيام مطلوب أسلوب. وقد وضعت العديد من الأساليب على مر السنوات لتوفير وصول مباشر أو غير مباشر لحجم الخلايا في المختبر. إعمار خلية من تصوير [كنفوكل] واحد منهم، ولكن هذا الأسلوب يعني وضع العلامات وتكرار التعرض للضوء أثناء عرض قرار محوري محدودة من شمال البحر الأبيض المتوسط حوالي 500 7. ملاحظة التغلب على هذه العوائق الماضية اثنين جزئيا بأسلوب أكثر تطورا ومؤخرا باسم شعرية مجهرية الضوء-ورقة 8. مجهر القوة الذرية كانت تستخدم 9 ولكن هذا الأسلوب المسح بجوهر بطيئة وشاقة. وعلاوة على ذلك، قد تتداخل الاتصال الجسدي فإنه يتطلب مع الخلية بقياس النظر ليونة المتطرفة من الخلايا العصبية 10. وقد استخدمت الأسلوب غير المباشر باستخدام مقاومة أو صدى لأنواع مختلفة من الخلايا 11، ولكن غير كافية لتمدد التصاق الخلايا مثل الخلايا العصبية.
أحد الأساليب الواعدة يستند إلى مقياس لحجم الخلايا في إغلاق غرفة مملوءة بصبغة فلورسنت المستبعدة. طريقة الاستبعاد الفلورية (FXm) بسيط في مبدئه أنها تتطلب لا وضع العلامات، ومناسبة للتصوير الضوئية سريعة وطويلة الأجل السكان خلية مع قرار محوري يحتمل أن تكون شبه ضوئية. أكثر دقة، القرار في ض يعتمد على كثافة fluorescence الحد الأقصى في دائرة الثقافة (أي في منطقة تخلو من الخلايا) مقسوماً على النطاق الديناميكي للكاميرا، على الرغم من أن يحد هذا القرار في نهاية المطاف من عدة مصادر للضوضاء. وكان هذا الأسلوب قوي جداً لمتابعة حجم ترحيل الخلايا ملتصقة 12 أو لدراسة تغير وحدة التخزين أثناء الانقسام خلايا الثدييات، كما هو موضح تماما في 13. ومع ذلك، تشكل الخلايا العصبية تحديا منهجياً للنظر على التبعات الواسعة في العمليات الفرعية مكرمترك FXm.
ونقدم هنا طريقة تؤدي إلى تصنيع الدوائر FXm السلس للوصول بدقة عالية الحجم وارتفاع فروع العصبية وديناميكية الهياكل المعنية في نمو الخلايا العصبية مثل الأقماع النمو.
ينبغي أن يكون للدوائر مرتفعات مماثلة من الكائن إلى قياس من أجل تحسين القرار المحوري. ولذلك، قمنا بتصميم أجهزة FXm مختلفة تتسم بقياس وسط دوائر ثلاث ارتفاعات مختلفة. أنحف (3 ميكرومتر في الطول) مكرس لقياس نورت: يستثني هذا الارتفاع المنخفض سوما، التي تبقى في قاعة 15 ميكرون متوسطة عالية القريب. الدوائر المركزية أكثر سمكا (10 و 12 ميكرومتر) عالية بما فيه الكفاية لمتابعة نمو الخلية كلها. ويشمل الجهاز أيضا خزانان الموجود على أي من جانبي الدائرة المركزية. وبالتالي تنفذ أربع حقن الثقوب (IH) وتم تعيينها كما يلي: مدخل ومخرج يؤدي إلى إدخال المعلقات الخلوية في الرقاقة، بينما الاثنان الآخران تغذية الخزانات.
ولدينا أول كوفيرسليبس المعايرة ملفقة لقياسات الارتفاع استخدام الهياكل مقاوم الضوء للهندسة المعروفة. ونحن قد ثم تصويرها الخلايا العصبية المتزايدة مجاناً، ولكن أيضا شكلياً مقيدة من الخلايا العصبية إلى ميكروباتيرنس للالتصاق.
Protocol
أجريت الدراسة وفقا للمبادئ التوجيهية "الجماعة الأوروبية" في رعاية واستخدام الحيوانات المختبرية: 86/609/EEC. كما يرد في المشروع "المرفق اركادج الأخلاقية" التشيللو، الذي أقره ويستعرض بانتظام أرسيا الغرض البحث والبروتوكول. ترخيص معهد كوري تلقي مرفق الحيوانية #C75-05-18, 24/04/2012، تقديم التقارير إلى لجنة الأخلاق أون د مجال 'expérimentation أنيمالي"مركز باريس" et سود (رقم التسجيل الوطني: #59).
1-تلفيق العفن
ملاحظة: يتضمن القالب الدوائر المركزية والمتوسطة متصلة مدخل ومنفذ، بالإضافة إلى اثنين الخزانات (ومداخل) تقع على كلا الجانبين من الدائرة المركزية.
- استخدام الملقط مسطحة للتلاعب برقائق السليكون قطرها 51 مم ونقلها من مكان إلى آخر.
- قالب السليكون الدائرة المركزية
- ملء ماصة بلاستيكية 2 مل مع مقاوم الضوء الإيجابية. ضع ماصة في مركز رقاقة سيليكون قطرها 51 ملم ثم اضغط على في الخزان حتى تغطي حوالي 75% السطح ويفر مع مقاوم الضوء. زيادة ونقصان-معطف 3000 لفة في الدقيقة لمدة 30 ثانية.
- نقل يفر من زيادة ونقصان-المغطى إلى هوتبلت، مع درجة حرارة سطحية من 100 درجة مئوية، لمدة 50 ثانية.
- نقل يفر من هوتبلت إلى حامل الركيزة (تشاك) راصفة القناع. كشف عن طريق "قناع DRIE" (انظر ملفات تكميلية "masks_neuron_volume_chips.tiff" و "masks_neuron_volume_chips.dxf").
- إزالة يفر من تشاك ثم الغوص في زجاجة 100 مل بلورة طبق يحتوي على المطور (1:4 إضعاف في المياه). الإصدار يفر والحفاظ عليه لمدة 1 دقيقة مع التحريك باستمرار لطف الطبق المتبلور.
ملاحظة: لحفظ المواد الكاشفة، ملء الطبق المتبلور إلى 1 سم في الطول كحد أقصى. - تتخذ مرة أخرى يفر من المطور وتغرق إلى 100 مل طبق المتبلور مليئة بالمياه لحوالي 10 s.Then مكان يفر على ورقة ماصة والجافة مع النيتروجين المضغوط باستخدام بندقية ضربة جوية.
- ضع يفر 50 s في هوتبلت مع درجة حرارة سطح 115 درجة مئوية.
- القيام برد الفعل العميق النقش أيون (DRIE) مع المعلمات التالية (مزيد من المعلومات حول تقنية DRIE يمكن الاطلاع على المراجع 14 و 15)؛ الخطوة التخميل: sccm 50 من C4F8، أنه دعم تدفق 10 sccm، الضغط CP 10 ث، والحث يقترن البلازما (ICP) 1500 ث من مجموع 24 [مبر]، درجة حرارة 18 درجة مئوية؛ الخطوة النقش: sccm 100 من SF6، أنه دعم تدفق 10 sccm، الضغط CP 11 ث، وبرنامج المقارنات الدولية 1500 ث من مجموع 24 [مبر]، درجة حرارة 18 درجة مئوية؛ التخميل الوقت: 4 s; النقش الوقت: 7 s; مجموع مدة العملية: عادة 5 دقيقة لحوالي 10 ميكرون المحفور بعمق.
- حل مقاوم الضوء بواسطة الغوص الركيزة في طبق المتبلور مليئة بالأسيتون.
- غمر الرقاقة في حل البيرانا (2/3 ح2س2 (30 في المائة) و 1/3 ح2هكذا4 (95 %)) لمدة 5 دقائق.
إضافة تنبيه: دائماً ح2س2 أولاً وثم ح2حتى4 والشطف على الأقل 3 مرات في منزوع الماء بعد التنظيف.
- اختﻻق قوالب المقابلة للدوائر المتوسطة عن طريق تنفيذ الخطوات 1.2.1 إلى 1.2.11 بعد المعلمات المسرودة في الجداول 1-3.
ملاحظة: كل جدول يتوافق مع جهاز معين يتسم بارتفاع معين من غرفة المراقبة المركزية.
ملاحظة: تنفيذ العملية برمتها استخدام متزايد مرتفعات مقاومات الضوء (الأقنعة الواقية من 1 إلى 3 لكل جهاز، انظر ملفات تكميلية "masks_neuron_volume_chips.tiff" و "masks_neuron_volume_chips.dxf").- ضع رقاقة السيليكون محفوراً على حامل الركيزة تدور المغطى.
- تحقق من أن تدور-المغطى تعمل بشكل صحيح قبل التحقق من أن تطلع الركيزة الفعالة (ينبغي أن تدور الركيزة والبقاء في مكان من خلال سرعة الدوران الاسمية).
- يزيد اللزوجة من سو-8 مع ارتفاع النطاق سمك المستهدفة. دائماً استخدم زجاجات 20-30 مل لتخزين سو-8 مقاومات الضوء، ومن أجل ذلك على الرقاقة قبل طلاء تدور (سو-8 قد تكون لزجة جداً التلاعب بها مع ماصة بلاستيكية).
- صب السلبية من نوع الإيبوكسي مقاوم الضوء سو-8 في مركز الركيزة حتى تغطي حوالي 75% رقاقة السيليكون، ثم أشارت إلى معطف تدور باستخدام المعلمات في صف "سبينكواتينج" للجداول.
- وأشارت إلى مكان يفر المغلفة في هوتبلت للمدة ودرجة الحرارة في صف "خبز لينة".
- جبل يفر محفوراً وكافية "قناع سو-8" على راصفة القناع.
- محاذاة يفر محفوراً مع قناع باستخدام الصلبان محاذاة مخصصة (الحجم النمطي لهذه الصلبان: 50 ميكرون × 150 ميكرومتر) المصممة على كل قناع.
ملاحظة: الصلبان اثنين على كل جانب من الجهاز هي كافية (واحد في الجانب الأيسر السفلي)، وواحدة في أعلى اليمين. - كشف استخدام أنا-خط راصفة قناع (الطول الموجي 365 نانومتر) مع جرعة الأشعة فوق البنفسجية ملائمة، كما هو مبين في صف "التعرض للطاقة".
ملاحظة: وقت التعرض حسابها بقسمة الطاقة ه التعرض المحددة لكل مقاوم الضوء بقوة فعالة لمصباح الأشعة فوق البنفسجية، عن طريق امتصاص القناع التضمين: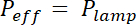 x (1- استيعابقناع). يتم امتصاص حوالي 20% لأقنعة مرنة ولا يعتد بها لقناع الصلب الكروم.
x (1- استيعابقناع). يتم امتصاص حوالي 20% لأقنعة مرنة ولا يعتد بها لقناع الصلب الكروم. - مكان يفر المغلفة في هوتبلت للمدة ودرجة الحرارة المشار إليها في صف "وظيفة خبز".
- إعداد اثنين 100 مل بلورة زجاج الأطباق، واحدة تحتوي على المطور، فارغة أخرى. وأشارت إلى الغوص يفر في المطور للمدة في صف "التنمية". تحرض بلطف الطبق المتبلور على امتداد التنمية
- يرش يفر مع الايزوبروبانول أعلاه الطبق المتبلور فارغة لحوالي 5 s. وأخيراً، المكان يفر على ورقة ماصة والجافة مع النيتروجين المضغوط باستخدام بندقية ضربة جوية.
- مكان يفر المغلفة في هوتبلت للمدة ودرجة الحرارة المشار إليها في صف "خبز الثابت" (اختياري).
ملاحظة: هذه الخطوة مفيدة لتجنب الشقوق في مقاوم الضوء وتوفير سطح مستو متجانسة للخطوات المقبلة. - كرر الخطوات 1.3.1-1.3.10 لإكمال العمليات المدرجة في الجدول 1-3.
- بعد الخطوة الأخيرة من الطباعة التصويرية، العفن سيلانيزي سيد النهائية تتكون من 3 طبقات من المواد السلبية بإيفاد اثنين 100 ميليلتر قطرات من silane Trichloro(1H,1H,2H,2H-perfluoro-octyl) على كل جانب من السيد في طبق بتري 100 ملم. ختم القرص بيتري مع فيلم بارافين بلاستيك واحتضان 20 دقيقة في درجة حرارة الغرفة (RT).
ملاحظة: القالب الرئيسي جاهزة ويمكن استخدامها عدة مرات.
- ضع رقاقة السيليكون محفوراً على حامل الركيزة تدور المغطى.
2-تصنيع الرقائق PDMS
- صب غ 90 من البوليمرات العضوية على أساس السيليكون (بولي دايمثيل سيلوكسان: PDMS) في كوب بلاستيك 100 مل. إضافة 10 جرام وكيلها علاج (01:10 في الوزن). يقلب الخليط باستخدام ماصة بلاستيكية لمدة 2-3 دقائق.
ملاحظة: مزيج ز 90 من PDMS مع 10 جرام من علاج عامل لتصنيع الرقائق 6. - قم بوضع الخليط داخل فراغ مجففة ومضخة لمدة حوالي 30 دقيقة لإزالة فقاعات الهواء في شرك في PDMS.
- ضع القالب الرئيسي في طبق بتري P100 وصب 15 مل المزيج على القالب باستخدام المحاقن.
ملاحظة: 15 مل يؤدي إلى ارتفاع إجمالي شريحة من 1.5 مم. - ضع الهيكل PDMS-العفن داخل فراغ مجففة ومضخة حتى هناك لا فقاعات الهواء أكثر تتضاعف على السطح من PDMS.
ملاحظة: هذه الخطوة تستغرق حوالي 30 دقيقة. - دفع يفر في الجزء السفلي من صحن بيتري استخدام تلميح مخروط لتجنب حجم PDMS الميت أدناه يفر. وضع الجهاز PDMS--القالب في الفرن في 70 درجة مئوية على الأقل ح 2.
- ديمولد كتلة PDMS تحت غطاء كيميائية باستخدام ملعقة مسطحة فولاذ المقاوم للصدأ، وسكب الكحول على الرقاقة. وضعه على مقاعد البدلاء الفولاذ المقاوم للصدأ من غطاء محرك السيارة.
- قص حول رقاقة السيليكون وديمولد النسخة المتماثلة PDMS استخدام مشرط.
- قص حول (هامش الإجازة 2 ملم) على شريحة باستخدام مشرط أو شفرة حلاقة.
- لكمه مداخل بالضغط التثقيب قطرها 1.5 مم بحزم وتحفيز لقطع ونحت حفرة المدخل. تفعل الشيء نفسه في أربع مناطق مخصصة للرقاقة حيث سيتم حقن السائل.
- تنظيف الرقاقة الشائكة وتقشير الشريط اللاصق على الجانب ميكروستروكتوريد. يرش الايزوبروبانول على كلا الجانبين. ثم تجف الرقاقة مع النيتروجين المضغوط باستخدام بندقية ضربة جوية.
3-تصنيع كوفيرسليبس منقوشة (24 × 24 مم2)
ملاحظة: التعامل مع كوفيرسليبس مع ملاقط منحنية.
- أنماط بولي-أورنيثيني (منظمة التحرير الفلسطينية)
- تطبيق س2 تنظيف البلازما في كوفيرسليبس الزجاج. معلمات البلازما: ضخ انخفاض الضغط: 0.25 [مبر]؛ O مدة العرض2 : 3 دقيقة؛ تدفق الغاز: sccm 10؛ الحد الأقصى للانحراف: sccm دقة ± 5؛ بلازما المدة: 3 دقيقة؛ تعيين الضغط: 0.36 [مبر]؛ الحد الأقصى للانحراف: ±0.10 [مبر]؛ تعيين السلطة: 50 واط؛ الحد الأقصى للانحراف: 5 في المائة؛ التنفيس المدة: 45 ثانية.
- ميليلتر 484 مزيج من حامض الخليك وميليلتر 56 من 3-ميثاكريلوكسيبروبيل-تريميثوكسيسيلاني، كاملة مع الإيثانول المطلقة للحصول على إجمالي حجم 15 مل.
- استخدام مخروط تلميح 1 مل، وضع قطره 500 ميليلتر لهذا الحل على كل ساترة، انتظر دقيقة 2-3 الجاف باستخدام ممسحة ستوكات تنظيم.
ملاحظة: يمكن تخزين سيلانيزيد الزجاج كوفيرسليبس إلى شهر واحد في درجة حرارة الغرفة داخل صناديق بلاستيكية مختومة مع فيلم بارافين بلاستيك. - ضع كل ساترة على المغطى تدور يقع في بيئة غرفة نظيفة. وضع قطره مقاوم الضوء الإيجابية التي تغطي حوالي 75% من ساترة (حوالي 500 ميليلتر) وتدور-معطف 4000 لفة في الدقيقة لمدة 30 ثانية للوصول إلى نهائي سماكة 0.45 ميكرومتر.
- مكان كوفيرسليبس لمدة 1 دقيقة على هوتبلت مع درجة حرارة سطح 115 درجة مئوية.
- استخدام راصفة قناع، فضح كل ساترة في موجه 435 نانومتر (ز-خط) عن طريق قناع مخصصة وفقا لمعلمات فابريكانت (جرعة الأشعة فوق البنفسجية عن 50-60 mJ.cm–1)
- إعداد الزجاج 2 أطباق المتبلور، واحدة تحتوي على المطور (لا تمييع)، أخرى تحتوي على المياه.
- الغوص واحداً تلو الآخر كل ساترة في المطور لمدة 1 دقيقة مع التحريك باستمرار لطف الطبق المتبلور. ثم تغرق يفر في المياه لحوالي 5 س. المكان يفر على ورقة ماصة والجافة مع النيتروجين المضغوط باستخدام بندقية ضربة جوية.
- تطبيق تنشيط س2 بلازما مع نفس المعلمات كما هو الحال في 3.1.1.
- تحت غطاء محرك السيارة، خلع 170 أربع قطرات ميليلتر من حل 100 ميكروغرام/مل منظمة التحرير الفلسطينية كل طبق بيتري P100. وضع على وجه منقوشة كوفيرسليبس في كل من هذه القطرات. ختم طبق بيتري مع فيلم بارافين بلاستيك لتجنب التجفيف. تبني بين عشية وضحاها في الرايت
ملاحظة: حل منظمة التحرير الفلسطينية يجب أن لا تزال تعلق كوفيرسليبس بالشعرية. - إعداد أربعة من المستفيدين (عادة أطباق بيتري P60)، وملء ثلاثة منهم مع برنامج تلفزيوني والرابعة مع المياه. إعداد اثنين من الأطباق بلورة زجاج الإيثانول النقي.
- تأخذ بها كل ساترة من أطباق بيتري، تغرق في الحمام أول برنامج تلفزيوني ل 10-15 s، إخلاء السائل في أنسجة امتصاص عن طريق وضع ساترة عمودياً على الجانب، أدخله مع مثل الوجه منقوشة حتى داخل الحمام الإيثانول.
ملاحظة: بمجرد اكتمال انحلال مقاوم الضوء، يصبح من الصعب تحديد موقع إلى جانب منقوشة ساترة. ولذلك، من المهم في هذه المرحلة أن تتبع موقعة. - ضع الإيثانول بلورة طبق داخل سونيكاتور حمام الموجات فوق الصوتية (120 ث/35 كيلو هرتز) وترك الواقي الضوئي يمكن حله لمدة 3 دقائق.
ملاحظة: تغيير حمام الإيثانول كل كوفيرسليبس 4 للحد من التخفيف ببرنامج تلفزيوني قد يعكر صفو انحلال مقاوم الضوء. - تأخذ بها ساترة من حمام الإيثانول، ثم يغوص عليه عدة مرات في حمام PBS الثاني. تحقق في الجانب السطحي مرارا وتكرارا حتى سطح دهني مثل أن يختفي نتائج الفيلم السائل المتبقي من الإيثانول.
- تغرق ل s 5-10 ساترة في الحمام برنامج تلفزيوني الثالثة. ثم نقل على الفور إلى حمام المياه. ساترة على ورقة ماصة والجافة مع النيتروجين المضغوط باستخدام بندقية ضربة جوية.
ملاحظة: يتم استخدام الشطف الأخير في المياه لتجنب تكوين بلورات برنامج تلفزيوني خلال الخطوة التجفيف.
- هياكل مقاوم الضوء لمعايرة ارتفاع
- نفذ الخطوات فقط 3.1.4. ل 3.1.8. باستخدام قناع مخصصة (قناع "المشارب مقاوم الضوء"، انظر الملف التكميلي "Mask_Photoresist-stripes.dxf").
4-رقاقة تجميع التنفيذ النهائي
- رقاقة تجميع الأطباق أسفل الزجاج
- وضع رقاقة PDMS والطبق الزجاج الذي سيتم المستعبدين في قاعة البلازما للتنشيط السطحية. المعلمات: ضخ انخفاض الضغط: 0.25 [مبر]؛ O مدة العرض2 : 3 دقيقة؛ تدفق الغاز: sccm 10؛ الحد الأقصى للانحراف: sccm دقة ± 5؛ بلازما المدة: 30 ثانية؛ تعيين الضغط: 0.40 [مبر]؛ الحد الأقصى للانحراف: ±0.10 [مبر]؛ تعيين السلطة: 50 واط؛ الحد الأقصى للانحراف: 5 في المائة؛ التنفيس المدة: 45 ثانية.
- وضع رقاقة PDMS المنشط على اتصال ساترة زجاجية بلطف ودقة تطبيق الضغط على حواف الرقاقة السندات الرقاقة إلى ساترة. لزيادة قوة الربط، ضع الجهاز في الفرن عند 70 درجة مئوية لمدة 5 إلى 10 دقائق.
ملاحظة: لا تضغط على الأجزاء التي تحتوي على أعمدة، وأنها قد تنهار تحت الكثير من الضغوط. - تحت غطاء محرك السيارة (أي في RT) وخلال 30 دقيقة بعد الربط، ضع مخروط تلميح 10 ميليلتر مليئة بحل 100 ميكروغرام/مل منظمة التحرير الفلسطينية في IHs، ثم حقن السائل. ضبط حجم الصوت لتشكل قطره في الجزء العلوي من كل IHs. استخدام مخروط تلميح 1 مل، ثم إضافة برنامج تلفزيوني في طبق بتري جميع أنحاء الرقاقة.
- تتيح الرقاقة في الرايت مع حد أدنى من الوقت حضانة ح 2. للحضانة بين عشية وضحاها، ختم طبق بيتري استخدام فيلم بارافين بلاستيك لتجنب التجفيف.
ملاحظة: لا ينبغي أن تسرب السائل خارج الرقاقة خلاف ذلك يجب تجاهل الرقاقة. - اضغط مخروط تلميح 10 ميليلتر طفيفة في كل IH وتمتص فائض السائل. ثم عصا تماما المخروط تلميح داخل المنفذ ووضع السائل المتبقية.
- استبدال منظمة التحرير الفلسطينية بالتالي laminin التعليمات المعطاة في الخطوات 4.1.5 (تفريغ) و 4.1.3 (التعبئة). تبني على RT ح 1.
- استبدال لامينين بالتالي الثقافة المتوسطة التعليمات المعطاة في الخطوات 4.1.5 (تفريغ) و 4.1.3 (التعبئة). تكوين المتوسطة الثقافة: MEM 81.8 في المائة؛ بيروفات صوديوم 100 ملم 1%؛ جلوتاماكس 200 ملم 1%؛ الحصان المصل 5%؛ B27 الملحق 2%، N2 الملحق 1%، جنتاميسين 0.2 ٪؛ تصفية الحل باستخدام عامل تصفية 220-شمال البحر الأبيض المتوسط. استخدام مخروط تلميح 1 مل، يحل محل أيضا برنامج تلفزيوني المحيطة الرقاقة بهذه الوسيلة.
- وضع الرقاقة الحاضنة وينظم في 37 درجة مئوية و 5% CO2 على الأقل 5 ح (أو بين عشية وضحاها) قبل العصبية البذر.
- رقاقة تجميع باستخدام كوفيرسليبس منقوشة
ملاحظة: إذا كوفيرسليبس منقوشة تتضمن الكائنات إشارة إيجابية مقاوم الضوء، نفذ الخطوات 4.2.1 إلى 4.2.9. خلاف ذلك، نفذ الخطوة فقط 4.2.3، عصا الجهاز PDMS على ساترة على غرار منظمة التحرير الفلسطينية كما هو مبين في 4.1.2، وضع الثقافة المتوسطة داخل وحول الرقاقة ثم انتقل إلى الخطوة 4.2.10.- إيداع قطره ماء على شريحة زجاج مجهر سميكة مستطيلة والتمسك ساترة على الشريحة الزجاجية بالشعرية (الجانب غير منقوشة تواجه الشريحة الزجاجية). تحت مجهر، وضع علامة على موقع المشارب مقاوم الضوء في الجزء خلفي الشريحة الزجاجية باستخدام قلم اللباد.
- ضع ساترة زجاجية منقوشة على حامل راصفة قناع قناع. تعتمد على علامة بقلم شعر لتوسيط الكائنات المرجعية مقاوم الضوء.
- نفذ الخطوة البلازما كما هو موضح في 4.1.1 على رقاقة PDMS.
- وضع رقاقة PDMS على حامل الركيزة المتنقلة (تشاك) راصفة القناع.
ملاحظة: لزيادة التباين الألياف البصرية، وضع رقاقة سيليكون تحت رقاقة PDMS. يجب أن تظل رقاقة السيليكون المرفقة بشدة على تشاك أثناء عملية المحاذاة (استخدام شريط شفاف التمسك بها لتشاك). - رفع تشاك في حد الاتصال الميكانيكية لمحاذاة الرقاقة مع مجموعة المشارب مقاوم الضوء الموجود في ساترة.
- تحقيق الاتصال الميكانيكي بين الرقاقة وساترة قبل الانتهاء من رفع تشاك حتى سطح PDMS الركائز اللمس ساترة زجاجية.
- انخفاض في تشاك. إزالة ساترة الآن الرهينة إلى شرائح من صاحب القناع. ثم ضع الجهاز في طبق بتري 35 ملم، ونقل كل شيء في الفرن (درجة الحرارة: 70 درجة مئوية) لمدة 5 إلى 10 دقيقة لزيادة قوة الربط.
- أداء كما هو الحال في الخطوة 4.1.3.
ملاحظة: إذا استخدام منظمة التحرير الفلسطينية منقوشة كوفيرسليبس، انتقل مباشرة من الخطوة 4.2.7 خطوة 4.2.9. - استبدال منظمة التحرير الفلسطينية بالتالي متوسطة الطلاء الإجراءات الموصوفة في الخطوات 4.1.5 (تفريغ) و 4.1.3 (ملء). استخدام مخروط تلميح 1 مل، يحل محل أيضا برنامج تلفزيوني المحيطة الرقاقة بهذه الوسيلة.
- وضع الرقاقة الحاضنة وينظم في 37 درجة مئوية و 5% CO2 حتى البذر العصبية، مع حد أدنى من الوقت حضانة ح 5.
5-العصبية الثقافة
- تحضير 100 مل من تشريح المتوسطة (المتوسطة سمو) بخلط 10 مل حبس 10 x و 2 مل من حبيس 1 متر و 88 مل من الماء المعقم في قارورة بلاستيك 200 مل.
ملاحظة: يمكن إعداد متوسطة سمو في اليوم السابق الثقافة. - تشريح الحصين من جنين الفئران E18 المستخرجة من أم euthanized بخلع عنق الرحم (C57BL/6J الفئران من الأنهار تشارلز). خطوات التشريح مثل مفصلة في 16.
- ضع الحصين في أنبوب بلاستيك التي تحتوي على التربسين (0.3 مل التربسين 2.5%، ث/س أدتا إلى 2.7 مل من سمو متوسطة) لمدة 10 دقائق في 37 درجة مئوية من أجل الشروع في الانفصال من المواد الكيميائية.
- تجاهل كافة تقريبا السائل واستبدله 5 إلى 10 مل سمو استخدام الماصات البلاستيك القابل للتصرف. يفعل ذلك 3 مرات. لملء آخر، استخدم 1 مل من تصفيح المتوسطة بدلاً من سمو.
- ميكانيكيا ننأى بالانسجة باستخدام تلميح 1 مل-مخروط التي تطمح، وإخراج وحدة التخزين الكاملة عدة مرات، وتجنب جعل فقاعات واستخدام الممرات لا تزيد عن 15-20.
- في أحد المستلمين 500 ميليلتر منفصلة، إعداد حل باستخدام 5 ميليلتر من تعليق خلية مخفف في ميليلتر 45 من برنامج تلفزيوني. 1 ميليلتر لهذا الحل باستخدام ماصة 10 ميليلتر وإدراج تعليق المخفف في عداد خلية مالاسيز. استخدام المؤشرات المقدمة في 17 لتقدير عدد الخلايا.
ملاحظة: قرن آمون واحدة يوفر عادة حوالي 0.5 مليون من الخلايا العصبية. - أجهزة الطرد المركزي في 100 x ز لمدة 6 دقائق في الرايت
- تجاهل المادة طافية والاستعاضة عنها بحجم متوسطة الطلاء اللازمة لتحقيق تركيز للخلايا 10 مليون/مل. خلايا ريسوسبيند اسباير تباعا وإخراج تعليق خلية مع مخروط تلميح 1 مل.
- رسم يصل متوسطة الطلاء في الرقاقة (راجع الخطوة 4.1.5). 2-3 ميليلتر من الحل ريسوسبينديد طازجة باستخدام ماصة 10 ميليلتر من جمع وحقنه في المدخل (الرجوع إلى حقن الإجراء الموضح في الخطوة 4.1.3). كرر نفس العملية عند المخرج فورا.
- حقن حول نفس الحجم من المتوسطة والطلاء في كل خزان (راجع الخطوة 4.1.3).
ملاحظة: الانتباه بسرعة الرقاقة تحت المجهر للتحقق من كثافة الخلايا. يتوافق مع حجم الكثافة المثلى من الخلية إلى حوالي 5-10 خلايا داخل سطح مربع محدد بواسطة أعمدة 4 (عن 0.3 مم2، أي حول الخلايا 15-20 للواحد مم2). - في النهاية كرر الخطوة 5.10 بدلاً من ذلك باستخدام 0.5-1 ميليلتر تعليق خلية للوصول إلى كثافة الخلية المستهدفة.
- ضع رقاقة المبذورة في حاضنة وينظم في 37 درجة مئوية 5% CO2.
6-الأسفار الاستبعاد المراقبة
- استبدال ثقافة المتوسطة بواسطة التصوير.
- إعداد متوسطة التصوير كما هو الحال في 4.1.7 ولكن بدلاً من ذلك استخدم MEM تخلو من الفينول الحمراء وإضافة ديكستران نيون. في هذا الهدف، يؤدي إلى تمييع ديكستران (الوزن الجزيئي 10,000 غ/مول، حل الأسهم مركزة في 10 ملغ/مل في برنامج تلفزيوني) بغية تحقيق تركيز نهائي من 0.5-1 ملغ/مل في الأجلين المتوسط والتصوير.
ملاحظة: استخدام ديكستران يرتبط مع ماكسيما الانبعاثات الاستيعاب/496/524 أو 650/668. تفضل أول صورة 0.45 ميكرومتر مقاوم الضوء الإيجابية ارتفاع هياكل (التخلص من هذه الأسفار السيارات في عرض النطاق الترددي أحمر) والثانية إلى الخلايا العصبية الصورة (أقل سمية). - إفراغ جميع مداخل استخدام ماصة 10 ميليلتر وإعادة ملئها تماما مع التصوير المتوسط (راجع الخطوات 4.1.3 و 4.1.5 لمنهجية دقيقة لاستبدال المتوسطة).
- إعداد متوسطة التصوير كما هو الحال في 4.1.7 ولكن بدلاً من ذلك استخدم MEM تخلو من الفينول الحمراء وإضافة ديكستران نيون. في هذا الهدف، يؤدي إلى تمييع ديكستران (الوزن الجزيئي 10,000 غ/مول، حل الأسهم مركزة في 10 ملغ/مل في برنامج تلفزيوني) بغية تحقيق تركيز نهائي من 0.5-1 ملغ/مل في الأجلين المتوسط والتصوير.
- تصوير
- ضع شرائح تحت مجهر ابيفلوريسسينسي مزودة بدائرة البيئة لتنظيم على 37 درجة مئوية و 5 في المائة من أول أكسيد الكربون2. استخدام الجاف 40 X، الفتحة العددية (غ) 0.8 موضوعية، 30% من كامل الطاقة (كامل الطاقة: 3 ث) و 30 مللي ثانية من وقت التعرض. الحصول على صور خلايا في التركيز (من واحد إلى عدة صور متتالية في حالة تجارب الزمن الفاصل).
- تحليل الصور
- تطبيع الصور باستخدام روتين الحد خلفية تنفذ في برنامج مخصص للحصول على معلومات أساسية متجانسة. انظر 13 للاطلاع على تفاصيل الخطوات المدرجة في هذا البرنامج لمعالجة الصور. صورة الإخراج له. تنسيق الشروط المتفق عليها تبادلياً.
- تحويل. حصيرة من الملف إلى. وضع الصور TIFF 8 بت باستخدام الروتين في المواد التكميلية (conversion_mattotiff.m، الذي يدعو إلى importfilevol.m).
- إجراء الاستيراد > "تسلسل الصور" في إيماجيج بناء فيديو من. صور TIFF.
- يتم حساب متوسط كثافة ف منطقة مربعة في وسط دعامة (مرجع كائن) وكثافة يعني ب مساحة الدائرة خالية من الخلايا (الخلفية، أي الطول صفر) مترجمة. انظر 18 على سبيل مثال من منهجية مفصلة لمعالجة الصور.
ملاحظة: بالبعد الأفقي لمجالات مربعة تستخدم كما يجب أن تكون مراجع كثافة حوالي نصف قطرها دعامة للحصول على عدد كاف من بكسل مع تجنب التلوث الضوئي من حواف الدعامة. - استخدام القيم ف وب بإنشاء قانون تحويل خطي من كثافة أنا إلى ارتفاع h:
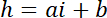
مع حج ذروة المعروفة للدائرة،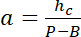 و
و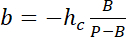
ملاحظة: يعرض PDMS أوتوفلوريسسينسي لا يمكن كشفها. - حدد منطقة حول المنطقة للفائدة، ودمج كثافة استخدام إيماجيج (انظر 19 لمزيد من التفاصيل)، وتطبيق قانون التحويل التي تم الحصول عليها في 6.3.5 لقياس حجم حجرة الخلية.
ملاحظة: منطقة الاهتمام قد تحديد استناداً إلى الأسفار العناصر الخلوية الفرعية مثل الأقماع أكتين، مثلاً، للاختيار النمو في التجارة والنقل-ليفيكت الخلايا العصبية، حدد منطقة الاهتمام في قناة الانبعاثات التجارة والنقل، واحفظ الكفاف من هذا المنطقة باستخدام أداة إدارة العائد على الاستثمار، ثم قياس حجم الخلية المغلقة داخل المنطقة نفسها في قناة الانبعاثات من ديكستران (باللون الأحمر).
النتائج
ويتضح نتيجة لعملية التصنيع المذكورة في البندين 1 و 2 من الصور الشكل 1A-1B ومنحني الشكل 1. جدول رقم 1 يعرض قيم خشونة مختلفة الممثل مجالين رقاقة PDMS، أي في الوسط والدائرة الوسيطة التالية عالية 20 ميكرومتر. قد حصل انخفاض في خشونة بمقدار حوالي 7 باستخدام محفوراً ويفر سي بدلاً من سو-8 مقاوم الضوء. ثم طبق FXm أولاً على مجموعة شريطية مقاوم الضوء الهندسة المعروفة (الشكل 2A) داخل دائرة عالية 10 ميكرون. بعد معالجة الصورة وكثافة لتحويل الارتفاع (انظر الرسم البياني رقم2 باء)، الملامح FXm المنجز في المقاطع العرضية على طول هذا الشريط (الشكل 2) توفر لمحات الارتفاع المطلوب (الشكل 2D). ويبين الشكل 2D المقارنة بين ملفات التعريف التي تم الحصول عليها باستخدام بروفيلوميتري الميكانيكية وأساليب FXm. ملفات التعريف هذه، بما في ذلك قيمة الحافة والهضبة، متشابهة جداً، التحقق من صحة الأسلوب. ملاحظة أن بعثرة البيانات FXm لا يمثل الحل النهائي للأسلوب، تقييم كما في الشكل 3 و رقم 4، ولكن استخدمت النتائج من كثافة منخفضة لتجنب التأثيرات ممكنة لضعيف جداً السيارات-الأسفار من مقاوم الضوء في قناة التجارة والنقل.
بعد ذلك، لاحظنا نيوريتيس في 3 ميكرومتر و 10 ميكرون عالية الدوائر (الشكل 3). هو الانحراف المعياري للضوضاء الخلفية حوالي 18 شمال البحر الأبيض المتوسط بعد كثافة لتصحيح التحويل وخلفية الارتفاع. هذه القيمة أعلى قليلاً من الخشونة البدنية الأسطح PDMS مسبوك على الأسطح السليكون (12 نانومتر، انظر الجدول رقم 1) ولكن أقل بكثير من خشونة تقاس على PDMS التي تم الحصول عليها من العفن سو-8. وتبرز هذه النتائج القيمة المضافة لحفر الآبار في رقائق السيليكون بدلاً من فتح ثقوب في مقاوم الضوء سو-8 يلقي الركائز. يسمح قيمة منخفضة عالية إشارة إلى نسبة الضوضاء وصور واضحة جداً في الحجم مثل المعروض في الشكل 3 ألف. كمثال للبيانات التي يمكن استردادها من مثل هذه الصور، ونحن يحسب حجم 1.6 ميكرون (أي 10 بكسل) واسعة نورت شريحة (انظر الرسم البياني في الشكل 3). تستخدم في تقدير تقريبي أول نوبة خطية من هذه البيانات يعطي قيمة ارتفاع نورت يعني من حوالي 400 نانومتر، بالمقارنة مع مثل قطر محواري 500 نانومتر وجدت في غضون 10 أيام الجراء القديمة داخل كلثوم الإحضار 5. ونحن أيضا الجمع بين FXm ميكروباتيرنس الانضمام التي تتألف من أبوتيد متسلسل 2 ميكرومتر و 6 ميكرومتر المشارب واسعة من 30 ميكرومتر في الطول. وكان هدفنا لدراسة تأثير عرض نورت في شكله ثلاثي الأبعاد. ويظهر الشكل 3 تمثيل ثلاثي الأبعاد في اللون كاذبة لصورة كاملة من الخلايا العصبية التي تم الحصول عليها في دائرة عالية 10 ميكرون. تنتشر نيوريتيس 2 ميكرومتر و 6 ميكرومتر المشارب على نطاق واسع، في حين سوما يقع في الطرف الجنوبي الشريط أكبر. ورسمت ملامح الارتفاع في ثلاثة أقسام مختلفة من الصليب. في اتساق مع الرسم البياني المعروض في الشكل 3 ألف، مدمجة على السطح عبر زيادة المقاطع العرضية مع عرض نورت (الشكل 3D).
ركزنا أيضا على النمو مخروط (GC) هياكل ثلاثية الأبعاد. الشكل 4 ألف-باء يعرض اثنين مختلفة GC التشكيلات الجانبية التي تم الحصول عليها في دائرة عالية 3 ميكرومتر، التي تسلط الضوء على هياكلها الفرعية متفرعة. وبالإضافة إلى ذلك، نحن أجرى تجارب الوقت الفاصل بين اتباع القوى المحركة لحجم الحركة في دائرة عالية 12 ميكرومتر. يعرض الرقم 4 دورة الانكماش وإعادة تنشيط نشرة مصورة عمومية معينة داخل نطاق وقت لبضع عشرات من الدقائق. بفضل استخدام الفئران بروتينات فلورية خضراء-ليفيكت، كانت المترجمة الأقماع النمو في الطول الموجي الانبعاثات التجارة والنقل (510 نيوتن متر) من تركزها أكتين عالية. استخدمت السطح التي حددت في الطول الموجي للاندماج على مدى الطول الموجي الانبعاثات ديكستران في 647 نانومتر لحساب حجم GC. يبين الشكل 4 أخيرا توزيع حجم GC في نقاط زمنية مختلفة، والموقع على ثلاثة من الخلايا العصبية المختلفة، تتمحور حول قيمة حوالي 6 ميكرومتر3.
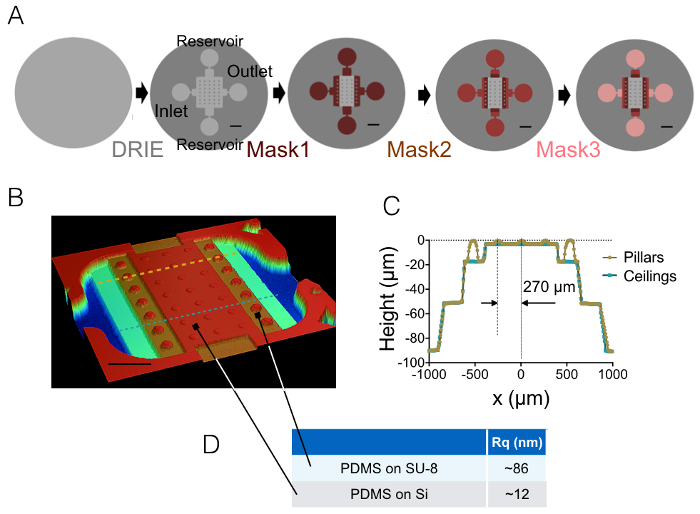
رقم 1: الدوائر FXm PDMS. (أ) مخططات من أربع خطوات رئيسية مختلفة من ميكروفابريكيشن مما أدى إلى القالب النهائي. تتم الإشارة إلى موقع مدخل ومخرج والخزانات. تغيير حجم أشرطة: 1 مم. (ب) صورة الدائرة PDMS FXm التي تم الحصول عليها باستخدام بروفيلوميتير ضوئية. هذه الصورة يبين الدائرة المركزية التي تحتوي على صفوف 3 من 10 ميكرون أعمدة عالية والدوائر المتوسطة من 20 و 50 و 90 ميكرون في الطول. مقياس بار: 500 ميكرومتر. (ج) عرض مستعرضة للرقاقة على طول خطوط متقطعة اثنين في (ب). الأصفر/الذهب: المقطع العرضي على طول أعمدة، الأزرق: المقطع العرضي بين الأعمدة. (د) يعني قياس القيم خشونة PDMS على 50 × 50 ميكرومتر2 مجالات مصبوب على السليكون وقاعة 20 ميكرومتر سو-8 عالية متوسطة (انظر السهام للموقع من هذه المجالات). تم الحصول على قيم المتوسط الحسابي من القياسات لثلاث مناطق مختلفة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
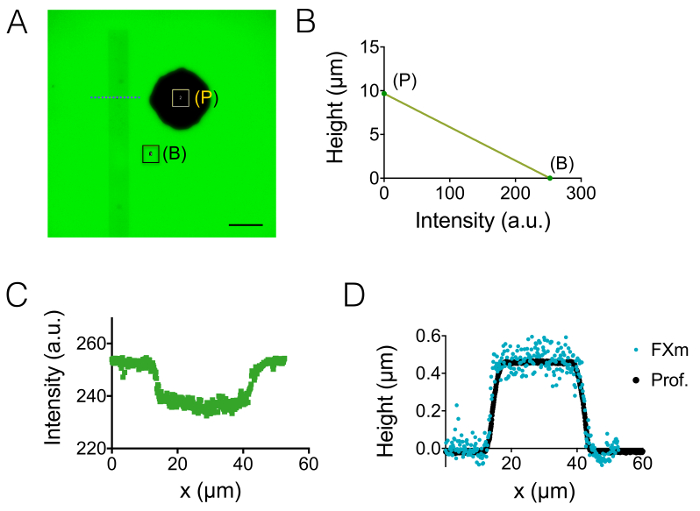
رقم 2: معايرة أسلوب FXm باستخدام مجموعة شريطية مقاوم الضوء كموضع اهتمام- (أ) صورة بروتينات فلورية خضراء-الأسفار في دائرة عالية 10 ميكرون مليئة 10,000 ديكستران ميغاواط تستوعب في 488 نانومتر على 1 ملغ/مل. (ب: الخلفية، دعامة p:). الملاحظة ذات هدف نا X 0.8 40 جافة. شريط الحجم: 50 ميكرومتر. (ب) معايرة خطي القانون الحصول عليها من متوسط كثافة المستطيلات الملونة اثنين المبينة في (أ) (ج) الأسفار كثافة الشخصية التي تم الحصول عليها على مستوى خط متقطع الأزرق المعروضة في (أ)، عبور مقاوم الضوء شريطية (0.45 ميكرومتر عالية الإيجابية مقاوم الضوء). (د) مقارنة بين التشكيلات الجانبية حصل من بروفيلوميتير الميكانيكية (النقاط السوداء) و FXm بعد شدة ارتفاع تحويل البيانات من (ب) (تكون هذه النقاط زرقاء). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
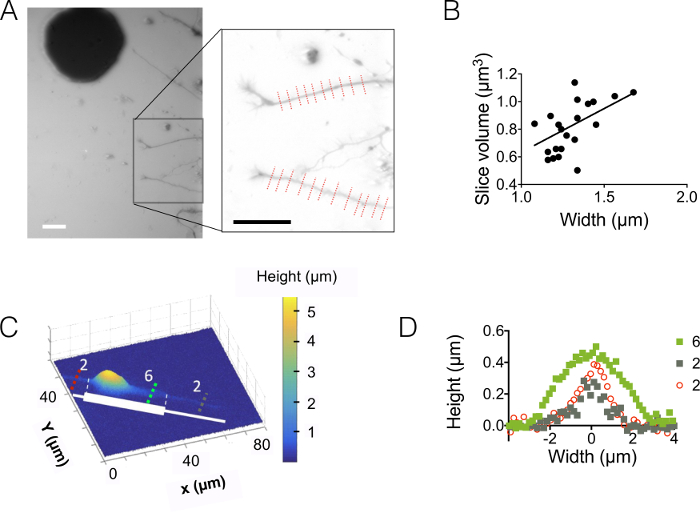
الشكل 3: تصوير حجم نورت. (أ) نورت تمتد في دائرة عالية وسط 3 ميكرومتر من سوما يقع في الدائرة الوسيطة التالية 15 ميكرون. التصوير باستخدام 10,000 ديكستران ميغاواط تستوعب في 488 نانومتر و 40 س، غ 0.8 الجاف للهدف. الداخلي التي تم الحصول عليها بعد استخدام خلفية الحد من الروتين ويبرز نيوريتيس اثنين واختيارها لرسم الرسم البياني على اليمين. تغيير حجم أشرطة: 30 ميكرون. (ب) الحصول على حجم شريحة نورت كدالة لعرض نورت من التشكيلات الجانبية 22 (في المتوسط على 10 بكسل، أي على مكم 1.6 "نورت شريحة") المبينة في (أ). ويمثل خط متصل نوبة خطي من المنحدر 0.4 ميكرومتر مرورا الأصل. (ج) صورة ملونة زائفة لخلية منقوشة على شريطية لاصقة مصنوعة من المتتالية 2 ميكرومتر وجذوعها واسعة 6 ميكرومتر (ممثلة باللون الأبيض). أجريت قياسات في دائرة عالية 10 ميكرون مليئة 10,000 ديكستران ميغاواط تستوعب في 647 نانومتر واستخدام غ 40 x 0.8 الجاف للهدف. (د) لون ملامح الارتفاع المقابل لخطوط متقطعة ملونة المبين في (ج) والاحتفاظ بنفس التعليمات البرمجية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
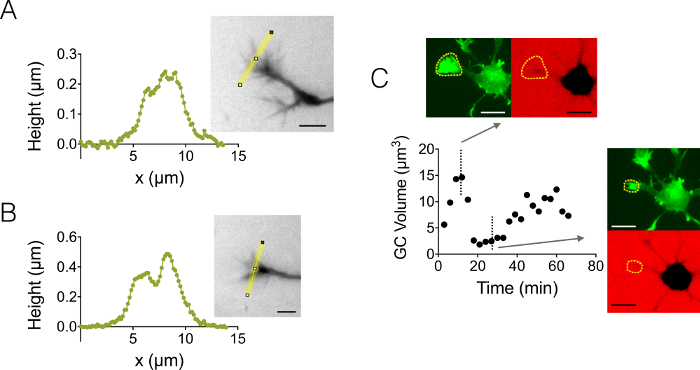
الشكل 4: النمو والدينامية مخروط التصوير- (أ-ب) نمو التشكيلات الجانبية ارتفاع مخروط الحصول عليها في دائرة عالية 3 ميكرومتر بعد كثافة لتحويل الارتفاع على غرار الصفراء المعروضة في الصور المرتبطة بها. مراقبة تنفيذ استخدام تعبئة مع 10,000 ديكستران ميغاواط تستوعب في 488 نانومتر و 40 س، غ 0.8 الجاف للهدف. (ج) تصوير العصبية كلها في دائرة عالية 12 ميكرومتر مليئة 10,000 ديكستران ميغاواط تستوعب في 647 شمال البحر الأبيض المتوسط. الملاحظات قد بذلت في قناتين الفلورسنت: التجارة والنقل للتعريب مخروط النمو (الخطوط المتقطعة الصفراء)، و CY5 لحساب حجم GC من استبعاد الأسفار. واستخدمت لحساب حجم GC السطح المدرجة بخطوط صفراء متقطعة. الرسم البياني يبين اختلاف حجم GC على مر الزمن، والمرتبطة مورفولوجيس في قنوات التجارة والنقل و CY5 في نقاط زمنية مختلفة الممثل اثنين. تم الحصول على بيانات جميع غ 40 x باستخدام الجاف 0.8 هدف لكل أشرطة مقياس الحد الأدنى 3: 10 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
| الخطوة | قناع طبقة ميكرومتر 1:8 | قناع 02:30 ميكرون طبقة | قناع 03:40 ميكرون طبقة |
| نوع سو-8 | 2007 | عام 2025 | عام 2050 |
| سبينكواتينج | 30 s @ 2000 لفة في الدقيقة | 30 s @ 3050 لفة في الدقيقة | 30 s @ 3250 دورة في الدقيقة |
| خبز لينة | 3 دقيقة @ 95 ° C | 2 دقيقة @ 65 ° C + 6 دقيقة @ 95 ° C | 3 دقيقة @ 65 ° C + 7 دقيقة @ 95 ° C |
| التعرض للطاقة | 110 مللي جول/سم2 | 155 مللي جول/سم2 | 170 مللي جول/سم2 |
| خبز بعد التعرض | 4 دقيقة @ 95 ° C | 1 دقيقة @ 65 ° C + 6 دقيقة @ 95 ° C | 2 دقيقة @ 65 ° C + 7 دقيقة @ 95 ° C |
| التنمية | 2 دقيقة 30 ثانية | 5 دقيقة | 6 دقيقة |
| خبز الثابت (اختياري) | 3-5 دقيقة @ 200 درجة مئوية | 3-5 دقيقة @ 200 درجة مئوية | 3-5 دقيقة @ 200 درجة مئوية |
الجدول 1: تنفيذ الخطوات التصويرية لبناء جهاز يحتوي على دائرة مركزية من 12 ميكرومتر في الطول. مرتفعات دوائر وسيطة: 20 و 50 و 90 ميكرون.
| الخطوة | قناع 01:10 ميكرون طبقة | قناع 02:30 ميكرون طبقة | قناع 03:40 ميكرون طبقة |
| نوع سو-8 | 2007 | عام 2025 | عام 2050 |
| سبينكواتينج | 30 s @ 1500 لفة في الدقيقة | 30 s @ 3050 لفة في الدقيقة | 30 s @ 3250 دورة في الدقيقة |
| خبز لينة | 3 دقيقة @ 95 ° C | 2 دقيقة @ 65 ° C + 6 دقيقة @ 95 ° C | 3 دقيقة @ 65 ° C + 7 دقيقة @ 95 ° C |
| التعرض للطاقة | 125 مللي جول/سم2 | 155 مللي جول/سم2 | 170 مللي جول/سم2 |
| خبز بعد التعرض | 4 دقيقة @ 95 ° C | 1 دقيقة @ 65 ° C + 6 دقيقة @ 95 ° C | 2 دقيقة @ 65 ° C + 7 دقيقة @ 95 ° C |
| التنمية | 2 دقيقة 30 ثانية | 5 دقيقة | 6 دقيقة |
| خبز الثابت (اختياري) | 3-5 دقيقة @ 200 درجة مئوية | 3-5 دقيقة @ 200 درجة مئوية | 3-5 دقيقة @ 200 درجة مئوية |
الجدول 2: إجراء خطوات الطباعة الحجرية التصويرية لبناء جهاز يحتوي على دائرة مركزية من 10 ميكرومتر في الطول. مرتفعات دوائر وسيطة: 20 و 50 و 90 ميكرون.
| الخطوة | قناع 01:12 ميكرون طبقة | قناع 02:32 ميكرون طبقة | قناع 03:40 ميكرون طبقة |
| نوع سو-8 | عام 2015 | عام 2025 | عام 2050 |
| سبينكواتينج | 30 s @ 3250 دورة في الدقيقة | 30 s @ 2500 لفة في الدقيقة | 30 s @ 3250 دورة في الدقيقة |
| خبز لينة | 3 دقيقة @ 95 ° C | 2 دقيقة @ 65 ° C + 5 دقيقة @ 95 ° C | 3 دقيقة @ 65 ° C + 7 دقيقة @ 95 ° C |
| زمن التعرض للضوء | 140 مللي جول/سم2 | 157 مللي جول/سم2 | 170 مللي جول/سم2 |
| خبز بعد التعرض | 4 دقيقة @ 95 ° C | 1 دقيقة @ 65 ° C + 5 دقيقة @ 95 ° C | 2 دقيقة @ 65 ° C + 7 دقيقة @ 95 ° C |
| التنمية | 3 دقيقة | 5 دقيقة | 6 دقيقة |
| خبز الثابت (اختياري) | 3-5 دقيقة @ 200 درجة مئوية | 3-5 دقيقة @ 200 درجة مئوية | 3-5 دقيقة @ 200 درجة مئوية |
الجدول 3: تنفيذ الخطوات التصويرية لبناء جهاز يحتوي على دائرة مركزية من 3 ميكرومتر في الطول. مرتفعات الدوائر المتوسطة: 18 و 50 و 90 ميكرون.
بيانات تكميلية 1: masks_neuron_volume_chips.tiff. عرض التخطيطي من الأقنعة المستخدمة لاختلاق الجهاز PDMS (DRIE قناع وأقنعة 1-3). اضغط هنا لتحميل هذا الملف.
بيانات تكميلية 2: ملف "masks_neuron_volume_chips.dxf". ملفات إلكترونية مما يسمح لاختلاق DRIE قناع وأقنعة 1-3. اضغط هنا لتحميل هذا الملف.
البيانات التكميلية 3: "Mask_Photoresist-stripes.dxf". ملفات إلكترونية مما يسمح لاختلاق القناع يستخدم للطباعة التصويرية للمشارب مقاوم الضوء. اضغط هنا لتحميل هذا الملف.
البيانات التكميلية 4: ملف conversion_mattotiff.m اضغط هنا لتحميل هذا الملف.
بيانات تكميلية 5: ملف importfilevol.m اضغط هنا لتحميل هذا الملف.
Discussion
تصوير حجم الخلايا العصبية يشكل تحديا لتقنية FXm بسبب امتدادات طويلة ورقيقة من هذه الخلايا. ويصف هذا البروتوكول المتغيرات من نفس نوع الجهاز موائع جزيئية مكرسة لتصوير الخلايا العصبية.
بجانب من جوانب تصميم موائع جزيئية، اختيار الهدف أساسي لتصوير استبعاد الأسفار ويعني مفاضلة بين القرار الأفقي ووضوح الصورة. وقد ثبت في 13 أن نا عالية مما يؤدي إلى عمق التركيز أصغر من ارتفاع الدائرة ليست ضارة لدقة قياس حجم إذا تم إجراء تصوير في التركيز وإذا ترك هامش كاف بين كفاف الكائن الأول الفوائد وحدود السطح التكامل. ومع ذلك، استخدام دائرة أعلى بكثير من عمق التركيز يضعف وضوح الصورة بسبب نشر فوتون، الذي ينعم حواف الكائنات ذات الاهتمام. تصنيع دائرة عالية 3 ميكرومتر تخفيض هذا التمويه الأفقي وقدمت صور الاستبعاد الفلورسنت محددة جيدا بشكل استثنائي حتى باستخدام نا عالية أهداف 40 (0.8) X لتصور فروع العصبية مع عالية الدقة الأفقي.
رقاقة تجميع خطوة حاسمة، وبخاصة في حالة 3 ميكرومتر الدوائر عالية، ولكن التلاعب بعناية كما هو موضح في 4.1.2 تجنب انهيار السقف. السطح ارتفاع نسبة التخزين المرتبطة بهذه الدوائر رقيقة آثار أيضا مسألة استقرار تركيز ديكستران على مر الزمن. لدينا محدداً أن امتصاص ديكستران السطح بعد ليلة واحدة من الحضانة كان لا يذكر: بعد استبدال ديكستران ببرنامج تلفزيوني، كان اختلاف الكثافة بين الدعامة والخلفية حوالي 1 لكل 1000 تباين كثافة الأولية بين هاتين المنطقتين حضور ديكستران. علما أن الخلايا العصبية قد يتقيد كل ساترة السفلي وعلى السطح PDMS. يختفي هذا التأثير عند استخدام منقوشة كوفيرسليبس (أي عندما لا يمكننا احتضان جزيئات لاصقة داخل قاعة PDMS)، كالطلاء لذلك مترجمة صارما على الجزء السفلي من الدائرة.
وبصرف النظر عن مورفولوجيا على التحدي، الخلايا العصبية مناسبة بدلاً من ذلك إلى FXm يرجع ذلك إلى حقيقة أن واحدة من القيد الرئيسي الأسلوب، أي ديكستران الالتقام، محدودة جداً في هذه الخلايا. علينا أن نختار من 10 تتراوح صياغة كاتشين لقمع في الطويلة (ساعات) أي الظواهر الالتقام مرئية.
وفي الختام، متوازنة بساطة FXm المفاهيمي بمجموعة من القضايا التجريبية التي حلت بهذا البروتوكول، مثل النانومترية PDMS خشونة وارتفاع دائرة مكرمترك، أو تصحيح الخلفية لتصحيح لتفاوت الحد الأقصى PDMS بين الأعمدة. ومع ذلك، غلة استخدام الدائرة موائع جزيئية الوثيق حصر المتوسطة الفلورسنت بعض القيود المحددة مثل الحاجة إلى ركائز الدعم، مما يقلل من سطح الفعالة المتاحة لالتصاق الخلايا، أو ضرورة استبعاد سوما من وسط دائرة مراقبة ملحقات الخلايا العصبية بوضوح أعلى، مما يحد من مناطق الخلية موجوداً للمراقبة عالية الدقة. وسيكون واحد التطور المحتمل لهذا الأسلوب للتخلص من هذا الحبس المادي، لتحل محلها أحد ضوئية. التنمية الجديدة للورقة الخفيفة الميكروسكوب يمكن أن يقترن مفيد FXm في المستقبل.
Disclosures
الكتاب يعلن لا تضارب في المصالح.
Acknowledgements
الكتاب تريد أن نعترف ChiLab والمواد والمختبر Microsystems-معهد البوليتكنيك في تورينو-ديسات، ممثلة في شخص الأستاذ ج و بيري والدكتور م كوكوزا والدكتور ماراسو L S، لدعمها الثمين في عملية تطوير وتصنيع الجهاز. ونحن نشكر فيكتور رأسين من كوانتاسيل للمناقشة والدعم في معالجة الصور. نحن ممتنون غرانجان إيزابيل وشارتييه مانون من "مرفق الحيوان" فارغاس بابلو ومعهد كوري لدعمهم للفئران، وأنا-ماريا لينون (معهد كوري) لتزويدنا بالفئران "ليفيكت التجارة والنقل". نحن ممتنون "أوليفييه توفينين" من معهد لانجفان وكلوتيلد قدرة وفينكوبا لاريسا Piel ماتيو من معهد كوري-144 قاسم أغا، لمساعدتهم في فهم الاستبعاد Fluorescence الأسلوب. وأخيراً، نشكر البرنامج التكنولوجي لمعهد بيار-جيل دي جين (يزار مس 3750) لدعمهم في ميكروفابريكيشن. أيد هذا العمل جزئيا الأوروبية بحوث المجلس متقدمة المنحة رقم 321107 "التشيللو،" جامعة البولندي (مشروع سويثنيوروترايلس)، ANR Investissement دعفينير، وإيبج لابيكس واكويبيكس.
Materials
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Plasmalab System 100 | Oxford Instruments | To perform DRIE | |
| MJB4 mask aligner | SUSS MicroTec | SU-8 photolithography | |
| NXQ 4006 Mask aligner | Neutronix Quintel | Photolithography associated to DRIE | |
| Plasma cleaner | Diener Electronic | Pico PCCE | |
| Cell culture hood | ADS Laminaire | Optimale 12 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Multifuge X1R | |
| Incubator 37 °C 5% CO2 | Panasonic | MCO-170AICUVH-PE IncuSafe CO2 Incubator | |
| Epifluorescence microscope | Leica | DMi8 | |
| PDMS Oven between 65 and 80 °C | Memmert | ||
| Mechanical profilometer | Veeco | Dektak 6M Stylus Profiler | |
| Optical profilometer | Veeco | Wyko NT9100 | |
| Vacuum desiccator | Verrerie Villeurbanaise (Kartel Labware) | 230KAR | Diameter 200 mm |
| Ultrasonic bath sonicator | Labo Moderne | SHE1000 | Volume of the bath: 0.8 liter |
| Hotplate | Stuart SD162 | SD162 | |
| Masks | |||
| DRIE | Supplementary data | ||
| Su8 Mask 1 | Supplementary data | ||
| Su8 Mask 2 | Supplementary data | ||
| Su8 Mask 3 | Supplementary data | ||
| S1805 calibration stripes | Supplementary data | ||
| Small laboratory equipment | |||
| 1.5 mm hole puncher | Sigma-Aldrich | 29002519 (US reference) | |
| Scalpel or razor blade | |||
| 9" Stainless Steel Flat Spatula with Spoon | VWR International | 82027-532 | To demold PDMS |
| Top Lip Wafer Handling | VWR International | 63042-096 | |
| Curved tweezer | FST | Dumont #7 Forceps - Standard / Dumoxel | To manipulate glass coverslips |
| Substrates | |||
| Silicon wafer | Prolog Semicor Ltd | ||
| 24x24 mm glass coverslips | VWR | 631-0127 | |
| Photoresists and developpers | |||
| AZ 1518 positive photoresist | Microchemicals GmbH | Before DRIE process, thicknes 1.8 µm | |
| AZ 351B developer | Microchemicals GmbH | To develop positive AZ 1518 photoresist | |
| SU-8 2007 | MicroChem | ||
| SU-8 2025 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| PGMA developer | Technic | To develop SU-8 negative photoresist | |
| Microposit S1805 resist | Chimie Tech Services | Positive photoresist used to obtain 0.5µm high structures | |
| MF 26A developer | Chimie Tech Services | To develop positive S1805 photoresist | |
| Laboratory consumables | |||
| Disposable plastic pipette 3 mL | LifeTechnologies - ThermoFisher | ||
| P100 Petri dishes | TPP | 93100 | |
| 20 mL syringe | Terumo | SS+20ES1 | |
| Transparent scotch tape | |||
| Square wipes | VWR | 115-2148 | |
| Parafilm | DUTSCHER | 90260 | Plastic paraffin film |
| Chemicals | |||
| (3-Methacryloxypropyl)trichlorosilane | abcr | AB 109004 | |
| PDMS and curing agent Sylgard 184 | Sigma-Aldrich | 761036 | |
| isopropanol | W292907 | ||
| poly-ornithine | Sigma-Aldrich | P4957 - 50 mL | |
| Ethanol absolute | Sigma-aldrich | 02865 | 99.8% |
| 3-methacryloxypropyl-trimethoxysilane | Sigma-aldrich | M6514-25ML | (C4H5O2)-(CH2)3- Si(OCH3)3 |
| acetic acid | Sigma-aldrich | 71251-5ML-F | |
| Dextran 10kW conjugated with Alexa488 | LifeTechnologies - ThermoFisher | D22910 | Absoprtion at 488 nm |
| Dextran 10kW conjugated with Alexa647 | LifeTechnologies - ThermoFisher | D22914 | Absoprtion at 647 nm |
| Culture medium | |||
| MEM | LifeTechnologies - ThermoFisher | 21090-022 | |
| Horse Serum | LifeTechnologies - ThermoFisher | 26050088 | |
| B27 | LifeTechnologies - ThermoFisher | 12587-010 | |
| Glutamax 200 mM | LifeTechnologies - ThermoFisher | 35050-061 | |
| Sodium Pyruvate GIBCO 100 mM | LifeTechnologies - ThermoFisher | 11360-070 | |
| Gentamicin | LifeTechnologies - ThermoFisher | 15710-049 | |
| PBS | Sigma-Aldrich | D8537-500ML | |
| HBSS 10x | LifeTechnologies - ThermoFisher | 14180-046 | |
| Hepes 1M | LifeTechnologies - ThermoFisher | 15630-056 | |
| trypsin-EDTA | Sigma-Aldrich | 59418C-100ML | |
| Neurobasal | LifeTechnologies - ThermoFisher | 21103-049 | |
| Neurobasal without phenol red | LifeTechnologies - ThermoFisher | 12348-017 | |
| Softwares | |||
| Routine in Matlab for background normalization | Quantacell | Contact Victor Racine: victor.racine@quantacell.com | |
| ImageJ | To select specific ROI for image analysis | ||
| Routine | ImageJ | Supplementary data | |
| Routine | Matlab | Supplementary data |
References
- Jun, S., Taheri-Araghi, S. Cell-size maintenance: universal strategy revealed. Trends Microbiol. 23 (1), 4-6 (2015).
- Zlotek-Zlotkiewicz, E., Monnier, S., Cappello, G., Le Berre, M., Piel, M. Optical volume and mass measurements show that mammalian cells swell during mitosis. J. Cell Biol. 211 (4), 765-774 (2015).
- Kim, G. H., Kosterin, P., Obaid, A. L., Salzberg, B. M. A mechanical spike accompanies the action potential in Mammalian nerve terminals. Biophys J. 92 (9), 3122-3129 (2007).
- Iacono, D., et al. Neuronal Hypertrophy in Asymptomatic Alzheimer Disease. J Neuropathol Exp Neurol. 67 (6), 578-589 (2008).
- Cheli, V. T., et al. Conditional Deletion of the L-Type Calcium Channel Cav1. 2 in Oligodendrocyte Progenitor Cells Affects Postnatal Myelination in Mice. J Neurosci. 36 (42), 10853-10869 (2016).
- Kneynsberg, A., Collier, T. J., Manfredsson, F. P., Kanaan, N. M. Quantitative and semi-quantitative measurements of axonal degeneration in tissue and primary neuron cultures. J Neurosci Methods. 266, 32-41 (2016).
- Fouquet, C., et al. Improving axial resolution in confocal microscopy with new high refractive index mounting media. PloS one. 10 (3), (2015).
- Aguet, F., et al. Membrane dynamics of dividing cells imaged by lattice light-sheet microscopy. Mol Biol Cell. 27 (22), 3418-3435 (2016).
- Roland, A. B., et al. Cannabinoid-induced actomyosin contractility shapes neuronal morphology and growth. eLife. 3, (2014).
- Lu, Y. B., et al. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci USA. 103 (47), 17759-17764 (2006).
- Chen, J., Xue, C., Zhao, Y., Chen, D., Wu, M. H., Wang, J. Microfluidic impedance flow cytometry enabling high-throughput single-cell electrical property characterization. Int J Mol Sci. 16 (5), 9804-9830 (2015).
- Bottier, C., et al. Dynamic measurement of the height and volume of migrating cells by a novel fluorescence microscopy technique. Lab Chip. 11, 3855-3863 (2011).
- Cadart, C., et al. Fluorescence eXclusion Measurement of volume in live cells. Methods Cell Biol. 139, 103-120 (2017).
- Marasso, S. L., et al. A novel graphene based nanocomposite for application in 3D flexible micro-supercapacitors. Materials Research Express. 3 (6), 065001(2016).
- Welch, C. C., Goodyear, A. L., Wahlbrink, T., Lemme, M. C., Mollenhauer, T. Silicon etch process options for micro-and nanotechnology using inductively coupled plasmas. Microelectronic Engineering. 83 (4), 1170-1173 (2006).
- Fath, T., Ke, Y. D., Gunning, P., Götz, J., Ittner, L. M. Primary support cultures of hippocampal and substantia nigra neurons. Nat. Protoc. 4 (1), 78-85 (2008).
- abcam. Counting cells using a hemocytometer. , Available from: http://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2017).
- ImageJ. Getting intensity values from single ROI. Image Intensity Processing. , Available from: https://imagej.net/Image_Intensity_Processing (2017).
- ImageJ. 19. Tools. ImageJ User Guide. , Available from: https://imagej.nih.gov/ij/docs/guide/146-19.html (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved