Method Article
Высоким разрешением объем изображений из нейронов путем использования флуоресценции исключения метод и посвятил Microfluidic приборы
В этой статье
Резюме
Объем является важным параметром относительно характеристик физиологических и патологических клеток. Мы описываем флуоресцентный исключения метод, позволяющий полный поле измерения объема в vitro нейронов с югу Микрометрический осевой резолюции, необходимые для анализа невритов и динамические структуры, подразумевается в нейрональных роста.
Аннотация
Объем является важным параметром относительно характеристик физиологических и патологических нейронов в различных масштабах времени. Нейроны являются довольно уникальный клетки относительно их расширенной разветвленной морфологии и следовательно поднять ряд методологических проблем для измерения объема. В конкретном случае в vitro нейрональных роста выбранной методологии должен включать югу Микрометрический осевой резолюции, в сочетании с полный поле наблюдения на временных масштабах от минут до часов или дней. В отличие от других методов, как клетки форму реконструкция с использованием конфокальная томография, электрически на основе измерения или атомной силовой микроскопии недавно разработанный метод исключения флуоресцирования (FXm) имеет потенциал для выполнения этих задач. Однако хотя простые в своем принципе, осуществление разрешением FXm для нейронов требует несколько корректировок и посвященный методологии. Мы представляем здесь метод, основанный на сочетании флуоресценции отчуждения, низкой шероховатости несколькими отсеков microfluidic приборы и, наконец, micropatterning для достижения в vitro измерения объема местных нейронов. Высоким разрешением, предоставляемых устройством позволили нам измерить объем местных нейрональные процессы (невритов) и объем некоторых конкретных структур, участвующих в нейрональных роста, такие как конусы роста (ГСК).
Введение
Точное знание клеточного объема привлекла повышенное внимание в последние годы, движимый выпуск гомеостаза размер ячейки в одноклеточных микроорганизмов 1 и в целом в митотическая клетки 2. Однако вопрос о объема клетки уместно также для пост митотическая ячеек, для которых нейроны представляют собой парадигматический пример.
Объем является действительно важным подпись физиологические и патологические события в различных масштабах и моменты времени в нейрональных жизни, от переходных аксональное деформации, связанные с электрической активности (шкала миллисекунды) 3 к необратимым нейронов, отеки, происходящих во время бессимптомной фазы нейродегенеративных заболеваний (годами в организме человека) 4. Однако большой объем изменений происходит в промежуточные сроки дней или недель (в зависимости от рассматриваемых организма) во время роста нейронов. Расширенный и сложных морфологией нейронов поднимает вопросы кратные, среди которых регулирование размера ячейки. Аксональное Длина и диаметр являются действительно жестко регулируется в естественных условиях, с конкретных значений для каждого типа нейронов 5,6.
Эти вопросы, сложные решения в естественных условиях, могут также рассматриваться в упрощенном виде в пробирке. В этой цели метод, посвященный измерение объема быстро достаточно, чтобы следить за динамикой роста (т.е. в масштабе времени минут) и совместимы с наблюдения за несколько часов или дней не требуется. Несколько методов были разработаны с годами для обеспечения прямого или косвенного доступа к сотовой тома в пробирке. Реконструкция ячейки от конфокальная томография является одним из них, но этот метод подразумевает маркировки и повторные воздействия света, показывая ограниченной осевой разрешением около 500 Нм 7. Обратите внимание, что эти два последних недостатки частично преодолеть, более сложные и последние метод с именем решетка свет лист микроскопии 8. Атомная силовая микроскопия был используется 9 , но этот способ является по своей сути, медленно и утомительно. Кроме того физический контакт, который требует с ячейки могут помешать с измерением, учитывая крайняя мягкость нейронов 10. Косвенный метод, с помощью импеданс или резонанс использовались для различных клеточных типов 11, но распространяются недостаточно для клея клетки как нейронов.
Один из наиболее перспективных методов основан на меру исключенного объема клетки в тесной камере, заполнены с флуоресцентной краской. Метод исключения флуоресцирования (FXm) прост в своем принципе как требует не маркировки и подходит для быстрого, долгосрочные оптических изображений клеточных популяций с потенциально югу оптического осевого резолюции. Более точно в резолюции в z зависит от интенсивности максимум флюоресценции в камере культуры (т.е. в регионе лишенный клетки) делится на динамический диапазон камеры, хотя несколько источников шума ограничить это окончательное урегулирование. Этот метод был очень мощный следовать объем миграции адэрентных клеток 12 или для изучения изменение объема при митозе клеток млекопитающих, как подробно описано в 13. Однако нейроны представляют методологической проблемой для компании FXm, учитывая их обширные ветвления в югу Микрометрический процессы.
Мы представляем здесь метод, ведущих к изготовления гладких FXm камер для доступа с высокой точностью объем и высота ветвей нейронов и динамических структур, участвующих в нейрональных роста как конусы роста.
Камеры должны иметь аналогичные высот, чем объект для измерения с целью оптимизации осевой резолюции. Таким образом мы разработали различные устройства компании FXm характеризуется палат Центральной измерения трех различных высот. Тонкий (3 мкм в высоту) предназначен для измерения neurite: это низкая высота исключает сома, которые остаются в ближайшем высокой Промежуточная камера 15 мкм. Толстые Центральная камер (10 и 12 мкм) являются недостаточно высокими для того, чтобы следовать за весь клеточный рост. Устройство также включает в себя два водохранилища, расположенные по обе стороны центральной камеры. Четыре отверстия впрыска (IH) таким образом реализованы и обозначаются следующим образом: на входе и выходе служат ввести клеточных суспензий в чип, тогда как два других канала водохранилищ.
У нас есть первый сфабрикованные калибровки coverslips для измерения высоты, с использованием структуры фоторезиста известных геометрии. Мы затем образ свободный рост нейронов, но также морфологически ограничением нейронов в micropatterns сцепления.
протокол
Исследование проводилось в соответствии с директивами Европейского сообщества по вопросам ухода и использования лабораторных животных: 86/609/ЕЕС. Цели исследования и протокол описаны в проекте этические приложение ERCadg виолончели, который был одобрен и регулярно пересматривается по ERCEA. Institut Curie животных Фонд получил лицензия #C75-05-18, 24/04/2012, представление докладов в Комитет по этике en matière d' исследования animale Париже центр et Sud (национальный регистрационный номер: #59).
1. Изготовление прессформы
Примечание: Форма включает в себя Центральной и промежуточных камер, подключенных к входе и выход, плюс два водохранилища (и бухт) расположен по обе стороны центральной камеры.
- Используйте плоский пинцет для обработки пластин кремния диаметром 51 мм и передавать их из одного места в другое.
- Центральная Камера кремний плесень
- Пластиковые пипетки 2-мл заполняют позитивный фоторезист. Поместите дозатор в центре пластины кремния диаметром 51 мм и нажмите на его водохранилища до охватывающих около 75% поверхности пластин с фоторезиста. Спин пальто на 3000 об/мин за 30 s.
- Передавать пластины из спин coater плитой, с температурой поверхности 100 ° c, 50 s.
- Передать пластины с плитой субстрат держателя (Чак) маска каппу. Через «DRIE маска» (см. Дополнительные файлы «masks_neuron_volume_chips.tiff» и «masks_neuron_volume_chips.dxf»).
- Удалить пластины из патрона, затем погружение в 100-мл стакан кристаллизующийся блюдо, содержащие разработчик (разбавления 1:4 в деионизированной воде). Отпустите пластины и поддерживать его на 1 мин, помешивая непрерывно и плавно кристаллизации блюдо.
Примечание: Чтобы сохранить реагентов, заполните кристаллизации блюдо до 1 см в высоту на максимум. - Забрать пластины от разработчика и погружаться в 100-мл кристаллизации блюдо с дейонизированной водой около 10 s.Then место на фильтровальную бумагу вафельные и высушить сжатым азотом, используя воздух удара пистолет.
- Поместите пластины для 50 s на плитой с температурой поверхности 115 ° c.
- Выполняют глубоко реактивного ионного травления (DRIE) со следующими параметрами (более подробную информацию о методе DRIE можно найти ссылки на 14 и 15); Пассивирование шаг: 50 sccm C4F8, он бэк потока 10 sccm, CP 10 Вт, индуктивно сочетании плазмы (ICP) 1500 Вт, общее давление 24 мбар, температура 18 ° C; Травление шаг: 100 sccm SF6, он бэк потока 10 sccm, CP 11 W, ICP 1500 Вт, общее давление 24 мбар, температура 18 ° C; Пассивирование время: 4 s; Травления время: 7 s; Общая продолжительность процесса: обычно 5 мин для около 10 мкм травленная глубины.
- Растворите фоторезиста, ныряя субстрата в кристаллизации блюдо заполнены с помощью ацетона.
- Опускайте пластин в растворе Пиранья (2/3 H2O2 (30%) и 1/3 H2т4 (95 %)) за 5 мин.
Предупреждение: Всегда сначала добавить H2O2 и затем H2,4 и полоскания по крайней мере 3 раза в деионизированной воде после очистки.
- Изготовление пресс-форм, соответствующих промежуточных камер, выполнив шаги 1.2.1 для 1.2.11 следующие параметры, перечисленные в таблицах 1-3.
Примечание: Каждая таблица соответствует данное устройство характеризуется определенную высоту центрального наблюдения камеры.
Примечание: Выполните весь процесс, с помощью увеличения высоты фоторезистов (масок 1-3 для каждого устройства, см. Дополнительные файлы «masks_neuron_volume_chips.tiff» и «masks_neuron_volume_chips.dxf»).- Место запечатлелись кремниевой пластины на держателе спин coater субстрата.
- Проверьте, что спин coater работает должным образом, убедившись, что стремление субстрата является эффективным (субстрат должен спина и оставаться на месте во время Номинальная частота вращения).
- Вязкость Су-8 увеличивается с высотой целевых толщина. Всегда использовать 20-30 мл бутылки для хранения Су-8 фоторезисты и вылить ее на пластины перед спин покрытием (Су-8 может быть слишком вязкой манипулировать с Пластиковые пипетки).
- Налить негативные эпоксидно тип фоторезиста Су-8 в центре субстрата до охватывающих около 75% кремниевой пластины, а затем спин пальто с использованием параметров, указанных в строке «Spincoating» таблиц.
- Место с покрытием пластин на конфорку, продолжительность и температура указывается в строку «мягкой выпекать».
- Прикрепите травления пластин и адекватные «Су-8 маска» маска каппу.
- Совместите травления пластин с маской, используя выделенный выравнивание кресты (типичный размер этих крестов: 50 мкм × 150 мкм) на каждую маску.
Примечание: Два креста на каждой стороне устройства являются достаточно (один слева внизу) и один в правом верхнем углу. - Разоблачения, используя я линии маска выравниватель (волны 365 Нм) с соответствующей дозой УФ, как указано в строке «Воздействия энергии».
Примечание: Время экспозиции рассчитывается путем деления энергии E экспозиции, специфичных для каждого фоторезиста эффективную мощность УФ-лампы, модулированные абсорбциой маски: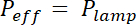 x (1 - поглощениеМаска). Абсорбция составляет около 20% для гибких маски и незначительным для хрома трудно маски.
x (1 - поглощениеМаска). Абсорбция составляет около 20% для гибких маски и незначительным для хрома трудно маски. - Место покрытием пластин на плитой для продолжительности и температуры, указанные в строке «пост выпекать».
- Готовить блюда кристаллизации стекла два 100-мл, одна из которых разработчик, другой пустой. Погружение вафельные в разработчик на срок, указанные в строке «Развития». Агитировать нежно кристаллизации блюдо вдоль развития
- Посыпать вафельные изопропанолом выше пустой кристаллизации блюдо около 5 s. Наконец Поместите пластины на абсорбирующий бумаги и высушить сжатым азотом, используя воздух удара пистолет.
- Места, покрытые вафельной на конфорку, продолжительность и температура указано в строке «жесткий выпекать» (необязательно).
Примечание: Этот шаг является полезным избежать трещин в фоторезиста и предоставляют однородную плоскую поверхность для последующих шагов. - Повторите шаги 1.3.1 - 1.3.10 завершить процессы, перечисленные в таблице 1-3.
- После последнего шага фотолитографии, silanize окончательный мастер формы состоит из 3 слоев негативных фоторезистов, направив двух 100 мкл капельки Trichloro(1H,1H,2H,2H-perfluoro-octyl) силан на каждой стороне мастера в чашке Петри 100-мм. Петри диск с пластиковой парафин пленкой и инкубировать 20 мин при комнатной температуре (RT).
Примечание: Мастер плесень готов и может быть использован несколько раз.
- Место запечатлелись кремниевой пластины на держателе спин coater субстрата.
2. Изготовление чип PDMS
- Налейте 90 g на основе кремния органического полимера (полидиметилсилоксан: PDMS) в 100 мл пластиковых стаканчиков. Добавьте 10 g его отвердителя (1:10 в весе). Перемешайте смесь с использованием пластиковых дозаторов для 2-3 мин.
Примечание: Смеси 90 g PDMS с 10 g Вулканизирующий агент для изготовления 6 фишек. - Поместите смесь в пределах вакуумного эксикатора и насос для около 30 мин для удаления воздушных пузырей в ловушке в PDMS.
- Место главной формы в P100 Петри блюдо и залить 15 мл смеси на плесень, с помощью шприца.
Примечание: 15 мл приводит к общей чип высотой 1,5 мм. - Место PDMS-плесень структуры в рамках вакуумного эксикатора и насос до тех пор, пока есть нет больше пузырьков воздуха, разрывая на поверхности PDMS.
Примечание: Этот шаг занимает около 30 минут. - Нажмите пластин в нижней части Петри, используя кончик конуса, чтобы избежать мертвых PDMS объем ниже пластины. Поместите устройство PDMS-плесень в сушильном при 70 ° C по меньшей мере 2 h.
- Demold блок PDMS под химические вытяжки с помощью шпателя из нержавеющей стали плоская и лить изопропиловый спирт на чипе. Поместите его на скамейке из нержавеющей стали капот.
- Обвести кремниевой пластины и demold PDMS реплики с помощью скальпеля.
- Вырежьте (оставить 2-мм маржа) чип с помощью скальпелем или лезвием бритвы.
- Punch отверстия нажав панчер диаметром 1,5 мм твердо и нажать его вырезать и вырезать отверстие впуска. Сделайте то же самое на четырех специальных зон чипа где будут вводиться жидкость.
- Очистите чип наклеивания и пилинг клейкой ленты на microstructured стороне. Посыпьте изопропанола с обеих сторон. Затем высушите чип азотом под давлением, с использованием пневматический пистолет удар.
3. Изготовление рисунком coverslips (24 × 24 мм2)
Примечание: Управлять coverslips с Изогнутый пинцет.
- Поли орнитина (ООП) шаблоны
- Примените O2 , очистки плазмы на стекло coverslips. Параметров плазмы: насосные вниз давление: 0,25 мбар; O2 питания, длительность: 3 мин; газовый поток: 10 sccm; Максимальное отклонение: ±5 sccm; плазмы продолжительность: 3 мин; установить давление: 0.36 мбар; Максимальное отклонение: ±0.10 мбар; Установленная мощность: 50 Вт; Максимальное отклонение: 5%; продувки продолжительность: 45 s.
- Mix 484 мкл уксусной кислоты и 56 мкл 3-methacryloxypropyl-trimethoxysilane, в комплекте с абсолютного этанола получить общим объемом 15 мл.
- С помощью 1 мл кончик конуса, капнуть каплю 500 мкл этого решения на каждом coverslip, ждать 2-3 мин высушите стеклоочистителя микрофибры чистых помещений.
Примечание: Coverslips Silanized стекло может храниться до 1 месяца при комнатной температуре в течение пластиковые коробки, герметичный пластиковый парафин пленкой. - Место каждого coverslip на спин coater, расположенная в среде чистой комнаты. Капнуть каплю позитивного фоторезиста, охватывающих около 75% coverslip (около 500 мкл) и спин пальто на 4000 rpm для 30 s, чтобы достичь окончательного толщиной 0,45 мкм.
- Место coverslips за 1 мин на плитой с температурой поверхности 115 ° c.
- С помощью маски каппу, подвергать каждого coverslip на длине волны 435 Нм (G-линия) через посвященный маску по параметрам фабрикантши (доза УФ о 50-60 mJ.cm–1)
- Готовить 2 стекла кристаллизации блюда, одна из которых разработчик (неразбавленный), содержащие другие обессоленной воды.
- Погружение по одному каждый coverslip в разработчик за 1 мин, помешивая непрерывно и плавно кристаллизации блюдо. Затем погружать вафельные в дейонизированной воде около 5 s. место пластины на абсорбирующий бумаги и высушить сжатым азотом, используя воздух удара пистолет.
- Применение плазмы2 активации O с теми же параметрами, как 3.1.1.
- Под капотом, низложить четыре 170 мкл капли раствора 100 мкг/мл ООП за P100 Петри блюдо. Положите узорной лицом coverslips на каждом из этих капель. Уплотнение Петри с пластиковой парафин пленкой во избежание высыхания. Инкубируйте на ночь на RT.
Примечание: Решение ООП должна оставаться прикрепленной к coverslips, капиллярности. - Подготовить четыре получателей (обычно P60 Петри), заполнить три из них с PBS и четвертый деионизированной водой. Подготовьте два стекла кристаллизации блюда из чистого этанола.
- Вывезти каждый coverslip от чашки Петри, погружать его в первой ванной PBS для 10-15 s, эвакуировать жидкость поглощает ткань, поставив coverslip вертикально на стороне, вставить его с например узорной лицом вверх внутри Ванна этанола.
Примечание: По завершении роспуск фоторезиста, она становится трудно найти узорной стороне coverslip. Поэтому важно на этом этапе, чтобы отслеживать его местоположение. - Место этанола, кристаллизующийся блюдо в ультразвуковой ванне sonicator (120 Вт / 35 кГц) и пусть фоторезиста распускаться на 3 мин.
Примечание: Измените этанола ванну каждые 4 coverslips ограничить разрежения, PBS, которые могли бы нанести ущерб распада фоторезиста. - Возьмите coverslip от этанола Ванна, затем погружение он несколько раз во втором баня PBS. Проверка поверхности аспект неоднократно до поверхности жирной как, что результаты от оставшихся жидкой пленки этанола исчезает.
- Погружаться на 5-10 s coverslip в третьем ванне PBS. Затем немедленно передать его в дейонизированной воде ванны. Место coverslip на абсорбирующий бумаги и высушить сжатым азотом, используя воздух удара пистолет.
Примечание: Чтобы избежать образование кристаллов PBS на этапе сушки используется последнего полоскания в деионизированной воде.
- Фоторезист структуры для калибровки высота
- Выполните только 3.1.4. для 3.1.8. Использование выделенного маски (маски «Фоторезиста полосы», см. дополнительный файл «Mask_Photoresist-stripes.dxf»).
4. чип монтажных и окончательное осуществление
- Чип-монтаж стекла дно блюда
- Вставьте плазмы палаты для активации поверхности PDMS чип и стеклянную посуду, на котором он будет связан. Параметры: насосные вниз давление: 0,25 мбар; O2 питания, длительность: 3 мин; газовый поток: 10 sccm; Максимальное отклонение: ±5 sccm; плазмы продолжительность: 30 s; установить давление: 0,40 мбар; Максимальное отклонение: ±0.10 мбар; Установленная мощность: 50 Вт; Максимальное отклонение: 5%; продувки продолжительность: 45 s.
- Аккуратно положил активированные PDMS чип при контакте с coverslip стекла и деликатно применить давление на краях чип для склеивания стружки к coverslip. Чтобы увеличить прочность сцепления, поместите устройство в духовке при 70 ° C за 5-10 мин.
Примечание: Не нажимайте на части, содержащие столбов, они могут рухнуть под слишком много давления. - Под капотом (т.е. на RT) и в течение 30 мин после склеивания, поместите кончик конуса 10-мкл заполнены раствором 100 мкг/мл ООП в IHs, а затем придать жидкости. Отрегулируйте громкость для формирования капли в верхней части каждого IHs. Затем используя 1 мл кончик конуса, добавьте PBS в Петри все вокруг чипа.
- Пусть чип на RT с минимум 2 h время инкубации. Для ночи инкубации уплотнение Петри с помощью пластиковых парафин фильм во избежание высыхания.
Примечание: Жидкость не утечки вне иначе чип, чип должно быть отброшено. - Слегка надавите кончик конуса 10-мкл каждого IH и поглощать избыток жидкости. Затем полностью придерживаться кончик конуса внутри розетки и разработать оставшуюся жидкость.
- Замените ООП Ламинин следуя инструкциям, приведенным в шагах 4.1.5 (опорожнение) и 4.1.3 (наполнение). Инкубируйте на RT 1 ч.
- Замените Ламинин питательной среды следующим инструкциям, приведенным в шагах 4.1.5 (опорожнение) и 4.1.3 (наполнение). Состав питательной среды: MEM 81.8%; Пируват натрия 1% 100 мм; Glutamax 200 мм 1%; Верховая сыворотки 5%; B27 дополнение 2%, N2 дополнение 1%, гентамицин 0,2%; Фильтр решения с помощью 220-Нм фильтра. С помощью 1 мл кончик конуса, замените также PBS, вокруг чип в этой среде.
- Поставьте чип в инкубатор, регулируется при 37 ° C и 5% CO2 для по крайней мере 5 h (или ночь) перед нейрон посева.
- Чип, монтаж с использованием рисунком coverslips
Примечание: Если рисунком coverslips позитивный фоторезист ссылаться на объекты, выполните шаги 4.2.1 до 4.2.9. В противном случае выполните только шаг 4.2.3, палка, заданные PDMS устройства на coverslip ООП узорной как указано в 4.1.2, питательной среды внутри и вокруг чип, затем перейдите к шагу 4.2.10.- Депозит в капле воды на прямоугольной толстые микроскопа стекла и палку coverslip на стеклянное скольжение по капиллярность (-узорные стороной стеклянное скольжение). Под микроскопом пометьте расположение полосы фоторезиста на задней части стекла слайда с помощью фломастер.
- Место coverslip узорчатого стекла на держателе маска маска каппу. Полагаться на марки, сделанные с фломастер по центру фоторезиста ссылок объектов.
- Выполните шаг плазмы, как описано в 4.1.1 на чипе PDMS.
- Место PDMS чип на держателе мобильных субстрата (Чак) маска каппу.
Примечание: Чтобы увеличить контраст оптических, место кремниевой пластины под PDMS чип. Кремниевой пластины должна оставаться твердо прикрепленной на патроне во время процесса выравнивания (Используйте прозрачную ленту придерживаться патрона). - Поднимите зажим на пределе механический контакт для выравнивания чип с массивом фоторезиста полос, расположенных на coverslip.
- Достичь механического контакта между чипом и coverslip заканчивают Снятие патрона до тех пор, пока на поверхности PDMS столбы сенсорный coverslip стекла.
- Опустите зажим. Удаление coverslip, теперь тычковой чип от держателя маски. Затем поместите устройство в 35-мм Петри блюдо и перевести все в духовке (температура: 70 ° C) для 5 до 10 минут для увеличения прочности склеивания.
- Выполните как шаг 4.1.3.
Примечание: Если использование ООП узорной coverslips, перейти непосредственно из шага 4.2.7 шаг 4.2.9. - Замените ООП, обшивка среднего следующие процедуры описано в шагах 4.1.5 (опорожнение) и 4.1.3 (заполнение). С помощью 1 мл кончик конуса, замените также PBS, вокруг чип в этой среде.
- Поставьте чип в инкубатор, регулируется при 37 ° C и 5% CO2 до посева нейрон, с минимум 5 h время инкубации.
5. нейрон культура
- Подготовка 100 мл рассечение среды (HH средний) путем смешивания 10 мл HBSS 10 x, 2 мл Hepes 1 М и 88 мл стерильной воды в пластиковый флакон 200 мл.
Примечание: HH среднего можно готовить в день до культуры. - Вскрыть гиппокамп из E18 мышей эмбриона извлекается от матери умерщвлены шейки матки дислокации (мышей C57BL/6J от реки Чарльз). Шаги рассечение, например подробно в 16.
- Место гиппокампа в пластиковые тубы трипсина (0,3 мл 2,5% трипсина, ЭДТА в 2,7 мл среды HH) 10 минут при 37 ° C для того, чтобы инициировать химических диссоциации.
- Отменить почти все жидкости и заменить его с 5 до 10 мл HH, используя одноразовые пластиковые пипетки. Сделайте это в 3 раза. Для последнего заполнения используйте 1 мл покрытия средних вместо HH.
- Механически отделить тканей с помощью кончика конус 1 мл, стремящихся и извлечь полный объем несколько раз, избегая делать пузыри и использование не более 15-20 ходов.
- В отдельный получатель 500 мкл Подготовьте решение с использованием 5 мкл суспензии клеток, разбавленных в 45 мкл PBS. Взять 1 мкл этого решения, с помощью пипетки 10 мкл и вставьте счетчик клеток Malassez разреженных подвеска. Использование показателей, представленных в 17 оценить количество клеток.
Примечание: Один гиппокампа обычно обеспечивает около 0,5 миллионов нейронов. - Центрифуга на 100 x g 6 мин на RT.
- Отменить супернатант и заменить его объем покрытия среды, необходимых для достижения концентрации 10 миллионов клеток/мл. Ресуспензируйте клетки, последовательно стремимся и извлечь суспензию клеток с 1 мл кончик конуса.
- Составить обшивка среднего в чип (обратитесь к шагу 4.1.5). Сбор 2-3 мкл свеже ресуспензированы решения с помощью пипетки 10-мкл и вставляют его на входе (обратитесь к инъекции процедурой, описанной в шаге 4.1.3). Немедленно Повторите ту же операцию на выходе.
- Придать о том же обшивка среды в каждом резервуаре (обратитесь к шагу 4.1.3).
Примечание: Быстро наблюдать чип под микроскопом, чтобы проверить плотность клеток. Порядок величины плотности оптимального клеток соответствует примерно 5-10 клеток в пределах площади поверхности, разделенные 4 столпа (примерно 0,3 мм2, т.е. о 15-20 клеток / мм2). - В конечном итоге повторите шаг 5.10, используя вместо 0,5-1 мкл суспензии клеток достичь плотности целевой ячейки.
- Место в сеяный чип в инкубаторе регулируется при 37 ° C 5% CO2.
6. флуоресценции исключения наблюдения
- Замена культуры среды средство визуализации.
- Подготовка изображений среднего как 4.1.7, но вместо этого использовать MEM лишенный фенола красного и добавить флуоресцентные декстрана. В этой цели, разбавить декстрана (молекулярный вес 10000 г/моль, раствор концентрируется на 10 мг/мл в PBS) для достижения конечной концентрации 0,5-1 мг/мл в средстве визуализации.
Примечание: Использование декстрана конъюгатов с максимумами поглощения/выбросов 496/524 или 650/668. Предпочитаю первых изображений 0,45 мкм высокий позитивный фоторезист структур (чтобы избавиться от их авто флуоресценции в красной полосы пропускания), а второй — изображение нейронов (менее токсичен). - Очистить все отверстия с помощью пипетки 10-мкл и заново заполнить их полностью с изображений среднего (см. шаги 4.1.3 и 4.1.5 для точной методологии средних замены).
- Подготовка изображений среднего как 4.1.7, но вместо этого использовать MEM лишенный фенола красного и добавить флуоресцентные декстрана. В этой цели, разбавить декстрана (молекулярный вес 10000 г/моль, раствор концентрируется на 10 мг/мл в PBS) для достижения конечной концентрации 0,5-1 мг/мл в средстве визуализации.
- Обработка изображений
- Установите фишку под эпифлуоресцентного микроскопа, оборудованные экологической палаты, регулируется при 37 ° C и 5% CO2. Использование сухой 40 X, числовая апертура (NA) 0,8 объективной, 30% от полной мощности (полная мощность: 3 Вт) и 30 мс времени экспозиции. Получение изображений клеток в фокус (с одного на несколько последовательных изображений в случае промежуток времени эксперименты).
- Анализ изображений
- Нормализовать изображения с помощью процедуры сокращения фон в специализированное программное обеспечение для получения однородной фона. Смотрите 13 подробные шаги, включенные в это программное обеспечение обработки изображений. Полученное изображение имеет. МАТ формат.
- Конвертировать. МАТ в файл. 8 бит TIFF изображений с помощью обычной положить в дополнительные материалы (conversion_mattotiff.m, который призывает к importfilevol.m).
- Выполните импорт > последовательность изображений на ImageJ для создания видео из. Изображения в формате TIFF.
- Вычислите среднее интенсивности P площади локализованы в центре столба (объект reference) и средней интенсивности B площади камеры лишенный клетки (фон, то есть высота ноль). Смотрите 18 в качестве примера подробная методология обработки изображений.
Примечание: Боковые измерение площади районов, используются как интенсивность ссылки должны быть около половины диаметра столба получить достаточное количество пикселей избегая световое загрязнение от столба краев. - Используйте значения P и B учредить линейного преобразования закон от интенсивности, я высота h:
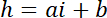
с hc известные высоты камеры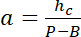 и
и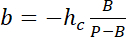
Примечание: PDMS отображает не поддаются обнаружению аутофлюоресценция. - Выберите область вокруг зоны интереса, интегрировать с помощью ImageJ интенсивности (см. 19 для получения более подробной информации) и применять закон преобразования полученных в 6.3.5 измерить объем ячейки отсека.
Примечание: В зоне интереса может быть выбрана флуоресценции югу клеточных элементов на основе как актина, например, для отбора роста конусов в GFP-LifeAct нейронов, выберите зоны интереса в канале выбросов GFP, сохранить контур этого зоны с помощью диспетчера ROI, то мера объема клетки заключены в пределах той же зоны в канале выбросов декстрана (в красном).
Результаты
Результатом процесса изготовления, описанные в разделах 1 и 2 иллюстрируется изображения на рисунке 1A-1В и кривой Рисунок 1 c. Таблица 1 рисунок d отображает значения шероховатости двух различных областей представитель PDMS чип, т.е. в Центральной и 20 мкм высокой следующий промежуточный камеры. Уменьшение шероховатости коэффициент около 7 был получен с помощью травления Si пластин вместо фоторезиста Су-8. Затем FXm был впервые применен на фоторезиста полосой известных геометрии (рисунок 2A) в камере высокой 10 мкм. После обработки изображений и интенсивности высота преобразования (см. диаграмму рис. 2B), FXm профили выполнены на разрезы вдоль этой полосы (рис. 2 c) обеспечивают желаемую высоту профили (Рисунок 2D). 2D рисунок показывает сравнение между профили, полученные с помощью механических profilometry и FXm методы. Эти профили, включая края и плато значение, очень похожи, проверка метода. Обратите внимание, что разброс данных FXm не является представителем окончательное урегулирование этого метода, как дополнительную оценку на рисунке 3 и рис. 4, но результаты от низкой интенсивности занятых чтобы избежать возможного эффекта очень слабых Авто флуоресценции фоторезиста на канале GFP.
Затем мы наблюдали невритов 3 мкм и 10 мкм высокие камеры (рис. 3). Стандартное отклонение фонового шума составляет около 18 Нм после интенсивности преобразования и фон коррекции высоты. Это значение является немного выше, чем физические шероховатости поверхности PDMS литье на поверхности кремния (12 Нм, см. таблицу 1 рисунок d) но гораздо ниже, чем шероховатости, измеренная на PDMS полученные от Су-8 формы. Эти результаты подчеркивают ценность бурения скважин в кремниевых пластин, а не открытие отверстия в Су-8 фоторезиста бросить столбов. Такое низкое значение позволяет высокий сигнал шум и очень четкие изображения в объеме таких отображены на рисунке 3A. В качестве примера данных, которые могут быть получены из таких изображений, мы вычислить объем 1.6 мкм (т.е. 10 пикселей) широкий neurite фрагмент (см. график на рисунке 3B). В первом приближении с помощью линейной fit этих данных дает значение высоты средней neurite около 400 Нм, в сравнении с например аксональное диаметр 500-Нм нашли в течение 10 дней старый детенышей в пределах мозолистого тела 5. Мы также соединили FXm с micropatterns сцепления, состоящий из последовательно упирается 2 мкм и 6 мкм широкие полосы 30 мкм в длину. Нашей целью было изучить влияние ширины neurite на его 3D формы. Рисунок 3 c показывает 3D представление в ложный цвет всей нейрон изображения, полученные в камере высокой 10 мкм. Невритов распространяются на 2 мкм и 6 мкм широкие полосы, тогда как soma расположен на оконечности крупнейших полосой. Высота профиля были нарисованы в трех различных сечений. В согласованности с диаграммой, отображаются на рисунке 3Aповерхность интегрированы над увеличением сечения с (Рисунок 3D) Ширина neurite.
Мы также сосредоточены на трехмерных структур роста конуса (GC). Рисунок 4 A-B отображает два различных GC профили полученные в 3 мкм высокой камере, подчеркивающие их разветвленной вложенные структуры. Кроме того мы провели покадровый эксперименты следовать динамика объема ВЗК в камере высокой 12 мкм. Рисунок 4 c отображает цикл сокращается и возобновления данного GC в сроки от нескольких десятков минут. Благодаря использованию GFP-lifeact мышей, конусы роста были локализованы в длина волны излучения GFP (510 нм) от их актина высокой концентрации. Поверхности, выявленных на длине волны была использована для интеграции через длина волны излучения декстрана в 647 Нм для вычисления объема GC. Рисунок 4 d наконец показывает распределение объема GC в разное время и место на трех различных нейронов, сосредоточены на значение около 6 мкм3.
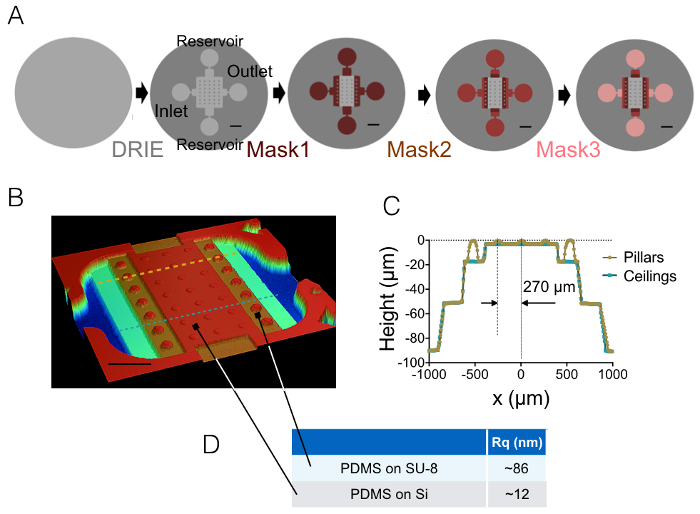
Рисунок 1: камеры FXm PDMS. (A) схемы четырех различных основные этапы микротехнологий, ведущих к окончательной формы. Указывается расположение входе, выходе и водохранилищ. Масштаб бары: 1 мм. (B) изображения камеры PDMS FXm, полученные с помощью оптический профилометр. Это изображение показывает Центральный камеру, содержащую 3 строки 10 мкм высоких столбов и промежуточных камер 20, 50 и 90 мкм в высоту. Линейки: 500 мкм. вид поперечного сечения чипа вдоль двух пунктирные линии, нарисованные в (B) (C) . Желтый/Золотой: сечение вдоль колонны, синий: сечение между столбами. (D) означает, что значения шероховатости PDMS измеряется на 50 × 50 мкм2 областей формованных на силиконовой и на 20 мкм высокой Су-8 промежуточных камеры (см. стрелки для расположения этих областей). Средние значения были получены из измерения трех различных областях. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
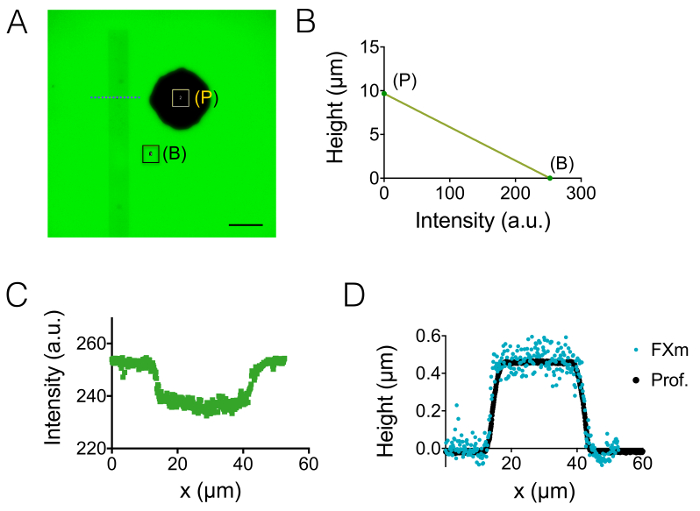
Рисунок 2: Калибровка FXm метода с использованием фоторезиста полосой как объект интереса. (A) GFP-флуоресценции изображения в камере высокой 10 мкм заполнены с 10 000 МВт декстрана, поглощая в 488 Нм при 1 мг/мл. (B: фон, P: столба). Наблюдение с сухой 40 X NA 0,8 цели. Линейки: 50 µm. (B) Калибровка линейная закон получил от средней интенсивности двух цветных прямоугольников в профиле интенсивности флуоресценции A. (C) , полученные на уровне синяя пунктирная линия в (A), пересекающих фоторезист полоса (0,45 мкм высокой позитивного фоторезиста). (D) Сравнение профилей, полученных из механических профилометра (черных точек) и FXm после интенсивности высота преобразования данных (B) (синие точки). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
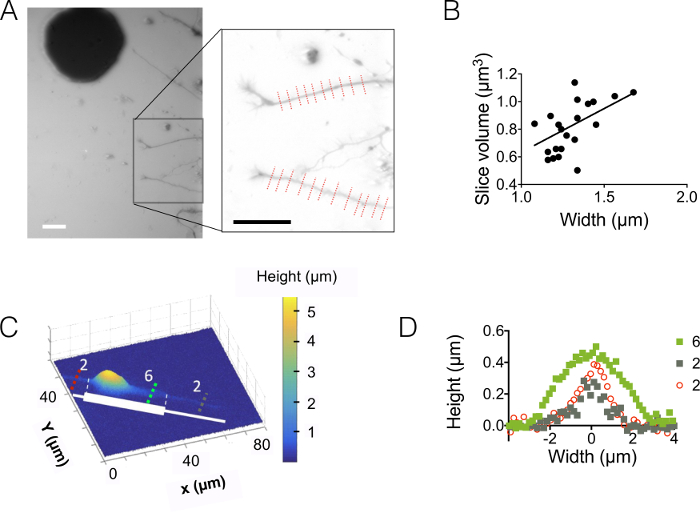
Рисунок 3: Визуализация тома Neurite. (A) Neurite расширения в центральной высокой камеру 3 мкм из сома, расположенный в промежуточной камере следующие 15 мкм. Обработка изображений с помощью 10 000 МВт декстрана поглощающих в 488 нм и 40 X, NA 0,8 сухой цели. Врезные, полученных после использования процедуры сокращения фон подчеркивает два невритов и выбран график справа. Масштаб бары: 30 мкм. (B) Neurite фрагмента тома как функция neurite ширины, полученные из 22 профилей (в среднем на 10 пикселей, т.е. на 1,6 мкм «neurite срез») показано на (A). Сплошная линия представляет линейной fit склона 0,4 мкм, проходящей через начало координат. (C) ложный цвет изображения узорной нейрона на клейкой полосой из последовательных 2 мкм и 6 мкм широкий пни (представлен в белом). Измерения были сделаны в камере высокой 10 мкм, заполнены с 10 000 МВт декстрана, поглощая в 647 Нм и с помощью NA 40 x 0,8 сухой цели. (D) высота профили, соответствующие цветные пунктирные линии показано на (C), сохраняя тот же код цвета. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
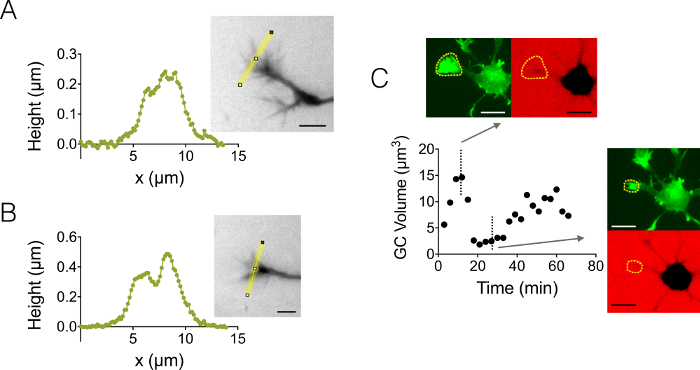
Рисунок 4: статический и динамический рост конуса томографии. (A-B) Рост конуса высота профили, полученные после интенсивности преобразования высоты вдоль желтой линии, отображаются в связанных изображений в камере высокой 3 мкм. Наблюдения с помощью заливки с 10 000 МВт декстрана, поглощая в 488 нм и 40 X, NA 0,8 сухой цели. (C) весь нейрон imaging в камере высокой 12 мкм заполнены с 10 000 МВт декстрана, поглощая в 647 Нм. Замечания были сделаны в двух люминесцентных каналы: GFP для локализации конус роста (пунктирной желтой линии) и CY5 вычислить объем GC изоляции флуоресценции. Поверхности, включаемые пунктирной желтой линии была использована для вычисления объема GC. График показывает вариации GC тома со временем и связанные морфологии GFP и CY5 каналах в двух точках представитель разное время. Все данные были приобретены с помощью NA 40 x 0,8 сухой цели каждые 3 мин шкалы баров: 10 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Шаг | Маска слоя 1:8 µm | Маска 2:30 мкм слоя | Маска 3:40 мкм слоя |
| Типа Су-8 | 2007 года | 2025 | 2050 |
| Spincoating | 30 s @ 2000 об/мин | 30 s @ 3050 об/мин | 30 s @ 3250 об/мин |
| Мягкие выпекать | 3 мин @ 95 ° C | 2 мин @ 65 ° C + 6 мин @ 95 ° C | 3 мин @ 65 ° C + 7 мин @ 95 ° C |
| Энергии воздействия | 110 МДж/см2 | 155 МДж/см2 | 170 МДж/см2 |
| Выпекать постконтактная | 4 мин @ 95 ° C | 1 мин @ 65 ° C + 6 мин @ 95 ° C | 2 мин @ 65 ° C + 7 мин @ 95 ° C |
| Развития | 2 мин 30 s | 5 мин | 6 мин |
| Жесткий выпекать (опционально) | 3-5 мин @ 200 ° C | 3-5 мин @ 200 ° C | 3-5 мин @ 200 ° C |
Таблица 1: фотолитографии действия построить устройство, содержащее Центральный палаты 12 мкм в высоту. Высоты промежуточных камер: 20, 50 и 90 мкм.
| Шаг | Маска 1:10 мкм слоя | Маска 2:30 мкм слоя | Маска 3:40 мкм слоя |
| Типа Су-8 | 2007 года | 2025 | 2050 |
| Spincoating | 30 s @ 1500 об/мин | 30 s @ 3050 об/мин | 30 s @ 3250 об/мин |
| Мягкие выпекать | 3 мин @ 95 ° C | 2 мин @ 65 ° C + 6 мин @ 95 ° C | 3 мин @ 65 ° C + 7 мин @ 95 ° C |
| Энергии воздействия | 125 МДж/см2 | 155 МДж/см2 | 170 МДж/см2 |
| Выпекать постконтактная | 4 мин @ 95 ° C | 1 мин @ 65 ° C + 6 мин @ 95 ° C | 2 мин @ 65 ° C + 7 мин @ 95 ° C |
| Развития | 2 мин 30 s | 5 мин | 6 мин |
| Жесткий выпекать (опционально) | 3-5 мин @ 200 ° C | 3-5 мин @ 200 ° C | 3-5 мин @ 200 ° C |
Таблица 2: фотолитографии действия построить устройство, содержащее Центральный палаты 10 мкм в высоту. Высоты промежуточных камер: 20, 50 и 90 мкм.
| Шаг | 1:12 маска слоя, мкм | Маска 2:32 мкм слоя | Маска 3:40 мкм слоя |
| Типа Су-8 | к 2015 году | 2025 | 2050 |
| Spincoating | 30 s @ 3250 об/мин | 30 s @ 2500 об/мин | 30 s @ 3250 об/мин |
| Мягкие выпекать | 3 мин @ 95 ° C | 2 мин @ 65 ° C + 5 мин @ 95 ° C | 3 мин @ 65 ° C + 7 мин @ 95 ° C |
| Время экспозиции | 140 МДж/см2 | 157 МДж/см2 | 170 МДж/см2 |
| Выпекать постконтактная | 4 мин @ 95 ° C | 1 мин @ 65 ° C + 5 мин @ 95 ° C | 2 мин @ 65 ° C + 7 мин @ 95 ° C |
| Развития | 3 мин | 5 мин | 6 мин |
| Жесткий выпекать (опционально) | 3-5 мин @ 200 ° C | 3-5 мин @ 200 ° C | 3-5 мин @ 200 ° C |
Таблица 3: фотолитографии действия построить устройство, содержащее Центральный палаты 3 мкм в высоту. Высоты промежуточных камер: 18, 50 и 90 мкм.
Дополнительные данные 1: masks_neuron_volume_chips.tiff. Схематическое изображение маски, используемые для изготовления PDMS устройства (DRIE маски и маски 1-3). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные данные 2: файл «masks_neuron_volume_chips.dxf». Электронные файлы, позволяя изготовить DRIE маски и маски 1-3. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные данные 3: «Mask_Photoresist-stripes.dxf». Электронные файлы, позволяя изготовить маска, используемая для фотолитографии фоторезиста полосы. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные данные 4: файла conversion_mattotiff.m пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные данные 5: файла importfilevol.m пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Объем изображений нейронов представляет собой проблему для компании FXm технику из-за длинные и тонкие расширения этих клеток. Этот протокол описывает варианты того же типа microfluidic устройства, посвященный нейрон imaging.
Рядом аспектов microfluidic дизайн выбор цели является основополагающим для флуоресценции исключения воображения и предполагает компромисс между латеральное разрешение и четкость изображения. В 13 показано, что высокая NA, ведущих к глубине фокус меньше, чем высота камеры не наносит ущерб для точности измерения объема, если изображений была исполнена на фокус и если осталось достаточно разницы между контур объекта я выигравшим и границы поверхности интеграции. Однако использование камеры гораздо выше, чем Глубина фокуса ухудшает четкость изображения благодаря Фотон диффузии, которая сглаживает края объектов, представляющих интерес. Изготовление высокой палаты 3 мкм сократить этот боковой размытие и предоставляется исключительно четко флуоресцентные исключения изображения даже с помощью высоких NA (0.8) 40 X цели визуализировать нейрональных отраслей с высоким боковыми резолюции.
Чип сборка является важным шагом, в частности в случае 3 мкм высокие камеры, но тщательного манипуляции, как описано в 4.1.2 избегает распада крыши. Поверхности высокое соотношение объема, связанные с эти тонкие камеры также поднял вопрос о стабильности декстрана концентрации со временем. Мы проверили, что поверхности поглощения декстрана после одной ночи инкубации был незначительным: после замены декстрана, PBS, разность интенсивности между опорой и фон был приблизительно 1 на 1000 первоначального интенсивности контраст между Эти два региона в присутствии декстрана. Обратите внимание, что нейроны могут осаждаться и на нижнем coverslip на крыше PDMS. Этот эффект исчезает при использовании узорной coverslips (т.е. когда мы не инкубировать адгезивные молекулы в зале PDMS), как покрытие поэтому строго локализуется в нижней части камеры.
Помимо их сложной морфологией нейронов скорее подходит для компании FXm с тем, что одним из основных ограничений метода, т.е. декстрана эндоцитоза, является весьма ограниченным в этих клетках. Мы выбираем 10 кДа формулировка для подавления в долгосрочной перспективе диапазон (в часах) каких-либо видимых эндоцитоза явлений.
В заключение концептуальной простоты FXm уравновешивается набор экспериментальных вопросов, которые были решены настоящего Протокола, такие как нанометрические PDMS шероховатости и высота Микрометрический камеры или фоновая поправка для устранения неравномерности потолок PDMS между столбами. Однако использование тесном microfluidic палаты ограничиться флуоресцентные среднего дает несколько конкретных ограничений как необходимость поддержки столбов, который понижает эффективной поверхности, доступные для клеточной адгезии, или необходимость исключить сома из Центральной камеры для наблюдения нейрональных расширений с высокой ясностью, который ограничивает регионах ячейки доступными для наблюдения высокого разрешения. Одной возможной эволюции этого метода будет избавиться от этой физической изоляции, должны быть заменены одним оптическим. Новая разработка легких лист микроскопии могут быть объединены выгодно с компанией FXm в будущем.
Раскрытие информации
Авторы заявляют никакого конфликта интересов.
Благодарности
Авторы хотят признавать ChiLab, материалы и лабораторные Microsystems - Политехнического ди Торино - DISAT, в лице профессора C F Pirri, д-р M Cocuzza и д-р S L Marasso, за их ценные поддержку в процесс разработки и изготовления устройств. Мы благодарим Виктора Racine от Quantacell для обсуждения и поддержку в обработке изображений. Мы благодарны Isabelle Гранджин и Манон Шартье животных фонда Institut Curie для их поддержки для мышей и Пабло Варгас и Ана-Мария Леннон (Institut Кюри) за предоставление нам GFP LifeAct мышей. Мы благодарны Оливье Thouvenin от Institut Langevin и Клотильда Cadart, Лариса Venkova и Matthieu Piel от Institut Кюри - UMR 144, за их помощь в понимании флуоресценции исключения метод. Наконец мы благодарим технологической платформы Institut Пьер-Жиль де жен (CNRS UMS 3750) за их поддержку в микротехнологий. Эта работа частично поддержали европейских исследований Совета дополнительно грант № 321107 «Виолончель,» Université PSL (проект SwithNeuroTrails), практический НРУ будущее и ИНГГ Labex и Equipex.
Материалы
| Name | Company | Catalog Number | Comments |
| Equipments | |||
| Plasmalab System 100 | Oxford Instruments | To perform DRIE | |
| MJB4 mask aligner | SUSS MicroTec | SU-8 photolithography | |
| NXQ 4006 Mask aligner | Neutronix Quintel | Photolithography associated to DRIE | |
| Plasma cleaner | Diener Electronic | Pico PCCE | |
| Cell culture hood | ADS Laminaire | Optimale 12 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Multifuge X1R | |
| Incubator 37 °C 5% CO2 | Panasonic | MCO-170AICUVH-PE IncuSafe CO2 Incubator | |
| Epifluorescence microscope | Leica | DMi8 | |
| PDMS Oven between 65 and 80 °C | Memmert | ||
| Mechanical profilometer | Veeco | Dektak 6M Stylus Profiler | |
| Optical profilometer | Veeco | Wyko NT9100 | |
| Vacuum desiccator | Verrerie Villeurbanaise (Kartel Labware) | 230KAR | Diameter 200 mm |
| Ultrasonic bath sonicator | Labo Moderne | SHE1000 | Volume of the bath: 0.8 liter |
| Hotplate | Stuart SD162 | SD162 | |
| Masks | |||
| DRIE | Supplementary data | ||
| Su8 Mask 1 | Supplementary data | ||
| Su8 Mask 2 | Supplementary data | ||
| Su8 Mask 3 | Supplementary data | ||
| S1805 calibration stripes | Supplementary data | ||
| Small laboratory equipment | |||
| 1.5 mm hole puncher | Sigma-Aldrich | 29002519 (US reference) | |
| Scalpel or razor blade | |||
| 9" Stainless Steel Flat Spatula with Spoon | VWR International | 82027-532 | To demold PDMS |
| Top Lip Wafer Handling | VWR International | 63042-096 | |
| Curved tweezer | FST | Dumont #7 Forceps - Standard / Dumoxel | To manipulate glass coverslips |
| Substrates | |||
| Silicon wafer | Prolog Semicor Ltd | ||
| 24x24 mm glass coverslips | VWR | 631-0127 | |
| Photoresists and developpers | |||
| AZ 1518 positive photoresist | Microchemicals GmbH | Before DRIE process, thicknes 1.8 µm | |
| AZ 351B developer | Microchemicals GmbH | To develop positive AZ 1518 photoresist | |
| SU-8 2007 | MicroChem | ||
| SU-8 2025 | MicroChem | ||
| SU-8 2050 | MicroChem | ||
| PGMA developer | Technic | To develop SU-8 negative photoresist | |
| Microposit S1805 resist | Chimie Tech Services | Positive photoresist used to obtain 0.5µm high structures | |
| MF 26A developer | Chimie Tech Services | To develop positive S1805 photoresist | |
| Laboratory consumables | |||
| Disposable plastic pipette 3 mL | LifeTechnologies - ThermoFisher | ||
| P100 Petri dishes | TPP | 93100 | |
| 20 mL syringe | Terumo | SS+20ES1 | |
| Transparent scotch tape | |||
| Square wipes | VWR | 115-2148 | |
| Parafilm | DUTSCHER | 90260 | Plastic paraffin film |
| Chemicals | |||
| (3-Methacryloxypropyl)trichlorosilane | abcr | AB 109004 | |
| PDMS and curing agent Sylgard 184 | Sigma-Aldrich | 761036 | |
| isopropanol | W292907 | ||
| poly-ornithine | Sigma-Aldrich | P4957 - 50 mL | |
| Ethanol absolute | Sigma-aldrich | 02865 | 99.8% |
| 3-methacryloxypropyl-trimethoxysilane | Sigma-aldrich | M6514-25ML | (C4H5O2)-(CH2)3- Si(OCH3)3 |
| acetic acid | Sigma-aldrich | 71251-5ML-F | |
| Dextran 10kW conjugated with Alexa488 | LifeTechnologies - ThermoFisher | D22910 | Absoprtion at 488 nm |
| Dextran 10kW conjugated with Alexa647 | LifeTechnologies - ThermoFisher | D22914 | Absoprtion at 647 nm |
| Culture medium | |||
| MEM | LifeTechnologies - ThermoFisher | 21090-022 | |
| Horse Serum | LifeTechnologies - ThermoFisher | 26050088 | |
| B27 | LifeTechnologies - ThermoFisher | 12587-010 | |
| Glutamax 200 mM | LifeTechnologies - ThermoFisher | 35050-061 | |
| Sodium Pyruvate GIBCO 100 mM | LifeTechnologies - ThermoFisher | 11360-070 | |
| Gentamicin | LifeTechnologies - ThermoFisher | 15710-049 | |
| PBS | Sigma-Aldrich | D8537-500ML | |
| HBSS 10x | LifeTechnologies - ThermoFisher | 14180-046 | |
| Hepes 1M | LifeTechnologies - ThermoFisher | 15630-056 | |
| trypsin-EDTA | Sigma-Aldrich | 59418C-100ML | |
| Neurobasal | LifeTechnologies - ThermoFisher | 21103-049 | |
| Neurobasal without phenol red | LifeTechnologies - ThermoFisher | 12348-017 | |
| Softwares | |||
| Routine in Matlab for background normalization | Quantacell | Contact Victor Racine: victor.racine@quantacell.com | |
| ImageJ | To select specific ROI for image analysis | ||
| Routine | ImageJ | Supplementary data | |
| Routine | Matlab | Supplementary data |
Ссылки
- Jun, S., Taheri-Araghi, S. Cell-size maintenance: universal strategy revealed. Trends Microbiol. 23 (1), 4-6 (2015).
- Zlotek-Zlotkiewicz, E., Monnier, S., Cappello, G., Le Berre, M., Piel, M. Optical volume and mass measurements show that mammalian cells swell during mitosis. J. Cell Biol. 211 (4), 765-774 (2015).
- Kim, G. H., Kosterin, P., Obaid, A. L., Salzberg, B. M. A mechanical spike accompanies the action potential in Mammalian nerve terminals. Biophys J. 92 (9), 3122-3129 (2007).
- Iacono, D., et al. Neuronal Hypertrophy in Asymptomatic Alzheimer Disease. J Neuropathol Exp Neurol. 67 (6), 578-589 (2008).
- Cheli, V. T., et al. Conditional Deletion of the L-Type Calcium Channel Cav1. 2 in Oligodendrocyte Progenitor Cells Affects Postnatal Myelination in Mice. J Neurosci. 36 (42), 10853-10869 (2016).
- Kneynsberg, A., Collier, T. J., Manfredsson, F. P., Kanaan, N. M. Quantitative and semi-quantitative measurements of axonal degeneration in tissue and primary neuron cultures. J Neurosci Methods. 266, 32-41 (2016).
- Fouquet, C., et al. Improving axial resolution in confocal microscopy with new high refractive index mounting media. PloS one. 10 (3), (2015).
- Aguet, F., et al. Membrane dynamics of dividing cells imaged by lattice light-sheet microscopy. Mol Biol Cell. 27 (22), 3418-3435 (2016).
- Roland, A. B., et al. Cannabinoid-induced actomyosin contractility shapes neuronal morphology and growth. eLife. 3, (2014).
- Lu, Y. B., et al. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc Natl Acad Sci USA. 103 (47), 17759-17764 (2006).
- Chen, J., Xue, C., Zhao, Y., Chen, D., Wu, M. H., Wang, J. Microfluidic impedance flow cytometry enabling high-throughput single-cell electrical property characterization. Int J Mol Sci. 16 (5), 9804-9830 (2015).
- Bottier, C., et al. Dynamic measurement of the height and volume of migrating cells by a novel fluorescence microscopy technique. Lab Chip. 11, 3855-3863 (2011).
- Cadart, C., et al. Fluorescence eXclusion Measurement of volume in live cells. Methods Cell Biol. 139, 103-120 (2017).
- Marasso, S. L., et al. A novel graphene based nanocomposite for application in 3D flexible micro-supercapacitors. Materials Research Express. 3 (6), 065001(2016).
- Welch, C. C., Goodyear, A. L., Wahlbrink, T., Lemme, M. C., Mollenhauer, T. Silicon etch process options for micro-and nanotechnology using inductively coupled plasmas. Microelectronic Engineering. 83 (4), 1170-1173 (2006).
- Fath, T., Ke, Y. D., Gunning, P., Götz, J., Ittner, L. M. Primary support cultures of hippocampal and substantia nigra neurons. Nat. Protoc. 4 (1), 78-85 (2008).
- abcam. Counting cells using a hemocytometer. , Available from: http://www.abcam.com/protocols/counting-cells-using-a-haemocytometer (2017).
- ImageJ. Getting intensity values from single ROI. Image Intensity Processing. , Available from: https://imagej.net/Image_Intensity_Processing (2017).
- ImageJ. 19. Tools. ImageJ User Guide. , Available from: https://imagej.nih.gov/ij/docs/guide/146-19.html (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены